Method Article
Анализ дифференцировки клеток, морфогенеза и паттернинга во время эмбриогенеза курицы с использованием анализа промокшей из бусин
В этой статье
Резюме
Анализ на вымоченные шарики включает в себя целевую доставку тестового реагента в любой момент развития для изучения регуляции дифференцировки и морфогенеза клеток. Представлен подробный протокол, применимый к любой экспериментальной модели на животных, для приготовления трех различных типов размоченных шариков и их имплантации в интердигит куриного эмбриона.
Аннотация
Во время эмбрионального развития активируется множество генетических программ, которые организуют дифференцировку клеток для создания поразительного разнообразия соматических клеток, тканей и органов. Точная активация этих генетических программ регулируется морфогенами, диффузными молекулами, которые направляют судьбу клеток при разных порогах. Понимание того, как генетическая активация координирует морфогенез, требует изучения локальных взаимодействий, вызванных морфогенами во время развития. Использование шариков, пропитанных белками, или лекарств, имплантированных в отдельные области эмбриона, позволяет изучить роль специфических молекул в установлении пальцев и других процессах развития. Этот экспериментальный метод предоставляет информацию о контроле индукции клеток, судьбе клеток и формировании паттернов. Таким образом, этот анализ на вымощенные бусины является чрезвычайно мощным и ценным экспериментальным инструментом, применимым к другим эмбриональным моделям.
Введение
Прорывы в молекулярных механизмах, которые контролируют экспрессию генов во время эмбрионального развития, позволили нам понять, как определяется судьба клеток. Приверженность различным клеточным линиям происходит, как только клетки начинают молекулярную экспрессию факторов транскрипции1. Этот паттерн экспрессии хорошо скоординирован в пространстве и времени и, таким образом, направляет формирование, позиционирование и паттерн клеток, тканей и органов 1,2,3,4,5. Эмбриональная индукция - это процесс, посредством которого клетки посвящаются определенным линиям путем установления иерархий, которые ограничивают потенциал клеток, которые даже включают в себя генерацию основного плана тела, как это происходит с организатором Spemann 6,7. Бластопорная дорсальная губа индуцирует вторую эмбриональную ось у эмбриона-хозяина 8,9. Сегодня с помощью прививки и других классических экспериментов в сочетании с молекулярными подходами известно, что различные факторы транскрипции и факторы роста функционируют для прямой эмбриональной индукции в органайзере Spemann10. Таким образом, экспериментальная манипуляция является важным инструментом для понимания клеточной дифференцировки, морфогенеза и паттерновых процессов во время эмбриогенеза.
Интересно, что в эмбриональных системах, где трансплантация тканей затруднена или когда индукторы уже хорошо известны, носители используются для доставки молекул (например, белков, химических веществ, токсинов и т. Д.) Для регулирования дифференцировки клеток, морфогенеза и даже паттернов. Одна из таких систем носителей включает имплантацию шариков, пропитанных определенной молекулой, в любой экспериментальный модельный организм в любой момент времени развития для определения эффекта указанного реагента или направления дифференцировки указанной модели. Например, путем имплантации шариков, пропитанных ретиноевой кислотой (РА), в почку конечности куриного крыла, Шерил Тикл и др. (1985) продемонстрировали, что РА индуцирует экспрессию звукового ежа в зоне поляризационной активности (ZPA)11,12. Та же экспериментальная стратегия была использована, чтобы обнаружить, что РА контролирует асимметрию сомитов и гибель клеток в почке конечности во время развития пальцев и в других эмбриональных областях конечностей 13,14,15. Другие факторы, в основном белки (например, факторы роста фибробластов [FGF], трансформирующий фактор роста-бета [TGF-ß]) использовались для индуцирования конечностей в боках ранних эмбрионов и новых пальцев в межпальцевой области, соответственно 16,17,18,19,20,21 . Эти эксперименты свидетельствуют о силе и полезности этого метода для определения стадии приверженности или компетентности тканей или групп клеток, подвергающихся воздействию молекул.
В этом протоколе конечность цыпленка на стадии образования пальцев служила экспериментальной моделью для представления пошаговых способов подготовки и имплантации пропитанных шариков. Тем не менее, этот экспериментальный инструмент не ограничивается этим применением, но может быть использован в любой экспериментальной модели на животных и в любой точке времени in vitro и in vivo для изучения индукции, дифференцировки, гибели клеток и паттерна.
протокол
Это исследование было рассмотрено и одобрено Институциональным наблюдательным советом по уходу за лабораторными животными и их использованию Института биомедических исследований Национального автономного университета Мексики (УНАМ, Мехико, Мексика).
1. Инкубация яйцеклеток и постановка эмбриона
ПРИМЕЧАНИЕ: Оплодотворенные куриные яйца можно получить на местных фермах. Чаще всего используются оплодотворенные куриные яйца White Leghorn. Храните свежеоплодотворенные куриные яйца при температуре 15 °C в течение 1 недели до инкубации.
- Инкубируйте оплодотворенные куриные яйца вертикально заостренной стороной вниз в увлажненном инкубаторе при 38 °C и относительной влажности 70%, пока они не достигнут стадии 28 HH (примерно 5,5 дней по данным Hamilton and Hamburger, 1951)22. Вращайте яйца во время инкубации, чтобы эмбрион не прилип к мембране скорлупы.
ПРИМЕЧАНИЕ: Выбор стадии развития определяется экспериментальными целями. В этом случае стадия 28 HH является оптимальной для имплантации междигитной бусины, чтобы вызвать эктопическую цифру или способствовать гибели клеток. - Извлеките яйца из инкубатора, смажьте их 70% этанолом и дайте им высохнуть на воздухе. Продезинфицируйте рабочую зону, микроскопы и инструменты 70% этанолом.
- Подсвечивайте яйцеклетку, чтобы определить кровеносные сосуды и найти эмбрион. Выбросьте яйца, у которых нет эмбриона.
- Используя конец незубчатых щипцов, откройте окно примерно в пять яиц, постукивая тупым концом яйца, и удалите щипцами участок скорлупыразмером 1 см2 .
- Переложите яйцо в картонную коробку или пластиковый держатель и поместите под стереомикроскоп. Удалите воздушную мембрану, проколов и вытащив ее тонкими хирургическими щипцами. Удалите любой маленький кусочек яичной скорлупы, который может контактировать с эмбрионом.
ПРИМЕЧАНИЕ: Воздушная мембрана представляет собой белую, непрозрачную мембрану, наблюдаемую сразу после окна яйца. - Наблюдают под микроскопом, слегка открывая амниотический мешок, разрывая его с помощью тонких хирургических щипцов. Будьте осторожны, чтобы не повредить сосудистую систему хориоаллантоической оболочки.
ПРИМЕЧАНИЕ: Амнион представляет собой прозрачную мембрану, тесно окружающую эмбрион, которая инкапсулирует его в околоплодные воды. - Поместите эмбрионы в яйцеклетку , чтобы определить, находятся ли они в желаемой стадии. Эмбрионы на более ранних стадиях могут быть возвращены в инкубатор после запечатывания окна яичной скорлупы скотчем.
2. Подготовка бисера
ПРИМЕЧАНИЕ: В зависимости от экспериментальной цели и рассматриваемого лечения, альтернативные типы бусин (например, Affi-Gel, AG1-X2, гепарин) могут быть более подходящими. Бусины Affi-Gel оптимальны для белков (например, TGF-ß1), в то время как гепариновые шарики идеально подходят для факторов роста (например, FGF, WNT) и бусины AG1-X2 для химических веществ, солюбилизируемых в органических растворителях (например, DMSO).
- Подготовка аффи-геля и гепарина
- Вырежьте квадрат парапленки, чтобы поместиться в 45-миллиметровую чашку Петри. Поместите парапленку на дно чашки Петри, чтобы покрыть ее, и закрепите ее на дне чашки Петри, толкая каждую вершину, используя конец незубчатых щипцов. Откладывать.
- С помощью пипетки или шпателя переложите шарики в микроцентрифужную трубку и дважды промыть их в 1x PBS путем отстаивания и пипетки.
- Переложите ~40-50 бусин с микропипеткой в центр парафилизированной чашки Петри с шага 1.
- С помощью микроскопа выберите ~30 аффи-гелевых или гепариновых шариков диаметром ~100 мкм для использования. Используйте сетку окуляра микроскопа для определения размера бусин или используйте третий интердигит эмбриона HH 28 в качестве эталона; шарик должен быть меньше интердигита.
- Осторожно удалите как можно больше излишков PBS, окружающих шарики, и замочите их в 2-5 мкл лечебного раствора. Убедитесь, что раствор полностью покрывает бусины.
- Параллельно готовят контрольные шарики путем замачивания в растворе, который содержит такое же количество носителя, как и в экспериментальном лечебном растворе.
ПРИМЕЧАНИЕ: Концентрации должны быть рассчитаны для каждой обработки в соответствии с экспериментом. Используйте соответствующие средства индивидуальной защиты при обращении с потенциально вредными реагентами. - Высиживать шарики в растворе в течение 30 мин при комнатной температуре. Чтобы шарики не высохли во время инкубации, выпейте несколько капель 1x PBS или полейте вокруг бусин, чтобы увлажнить местную атмосферу и накройте блюдо парапленкой для замедления испарения.
- Положите чашку Петри на лед и имплантируйте бусины в течение того же дня.
- Ag 1-X2 подготовка бусин
- Вырежьте квадрат парапленки, чтобы поместиться в 45-миллиметровую чашку Петри. Накройте дно чашки Петри парапленкой и прикрепите, проталкивая каждую вершину концом незубчатых щипцов. Откладывать.
- Используйте шпатель для переноса шариков AG 1-X2 в микроцентрифужную трубку. Добавьте 30-50 мкл лечебного раствора в желаемой конечной концентрации.
- Параллельно инкубируют контрольные шарики в растворе только с носителем, приготовленным без экспериментального химического вещества или белка, представляющего интерес.
- Высиживать шарики в течение 20 мин, медленно встряхивая при комнатной температуре. Оберните микроцентрифужные трубки фольгой для защиты от света во время всей инкубации, учитывая, что многие из этих молекул светочувствительны
- Удалить как можно больше раствора с помощью пипетки и окрашивать 2% фенол-красным растворенным в воде комнатной температуры в течение 2 мин с легким перемешиванием в вихре.
ПРИМЕЧАНИЕ: Окрашивание прозрачных бусин AG 1-X2 облегчает их имплантацию в эмбрион. - Удалите 2% фенольного красного цвета и дважды вымойте шарики в 1x PBS, чтобы удалить излишки красителя.
- С помощью наконечника микропипетки переложите ~40-50 AG 1-X2 шариков в центр покрытой парапленкой чашки Петри, приготовленной на этапе 1, и замочите их в 5 мкл 1x PBS. Под микроскопом выберите около 30 бусин диаметром ~ 100 мкм. Выбросьте неиспользованные бусины.
- Бусины готовы к имплантации. Убедитесь, что шарики погружены в PBS на протяжении всей имплантации, пипетируя несколько капель 1x PBS или воды вокруг шариков, чтобы увлажнить местную атмосферу и / или накрыть тарелку парапленкой для замедления испарения.
3. Манипуляции с эмбрионами и интердигитная имплантация
- Прежде чем манипулировать эмбрионами, расположите два стереомикроскопа рядом друг с другом на столешнице. Один из них предназначен для манипуляций с эмбрионами и имплантации бисера, а другой - для поддержания обработанных бусин готовыми к имплантации в эмбрион.
- Используя незубые щипцы, создайте окно в оставшихся яйцах, как описано в разделе инкубации яйцеклеток и стадии эмбриона.
- Под микроскопом открывают амниотический мешок, разрывая амниотическую мембрану тонкими хирургическими щипцами вблизи правого заднего конечного сгиба только на количество, необходимое для выполнения процедуры (т.е. как можно меньше).
- Используя тонкие щипцы, держите эмбрион за амниотическую мембрану, чтобы обнажить правую заднюю конечность. Используя тонкую вольфрамовую иглу, сделайте отверстие, центрированное в самой дистальной части третьего интердигита задней конечности.
- Не выпуская эмбрион и обнаженную заднюю конечность, возьмите одну обработанную бусину из другого микроскопа, используя один из кончиков щипцов. Щипцы должны находиться в открытом положении, чтобы одна бусина прилипла к кончику щипцов.
- Перенесите шарик в зародыш цыпленка рядом с задней конечностью и расположите его поверх отверстия для задней части.
- Закройте щипцы, чтобы надавить на бусину, пока она не войдет в отверстие.
- Отпустите эмбрион и запечатайте окно яичной скорлупы скотчем.
- Верните яйца в инкубатор до тех пор, пока они не достигнут необходимой стадии. Повторяйте процедуру до тех пор, пока не будет достигнуто необходимое количество манипулируемых эмбрионов. Крайне важно следить за тем, чтобы бусины не высыхали в любой момент.
ПРИМЕЧАНИЕ: Чтобы наблюдать полный эктопический палец, инкубируйте в течение ~ 72 ч после имплантации бусины. Напротив, гены ранней дифференцировки (например, Sox9) экспрессируются ~ через 30 мин после имплантации шарика, пропитанного TGF-ß1.
Результаты
Использование пропитанных шариков для оценки поведения клеток в эмбриональной конечности цыпленка
Чтобы обеспечить эффективность этого анализа, шарик должен быть размещен последовательно и точно в правильном месте; в данном случае дистальный - самый третий интердигит под апикальным эктодермальным гребнем АЭР (рисунок 1А). Такое позиционирование позволяет рассматриваемой молекуле равномерно распространяться по всей межпальцевой ткани. Кроме того, зона под AER содержит недифференцированные клетки, которые легко реагируют на лечение. Чтобы оценить влияние на дифференцировку клеток, эмбрионы могут быть окрашены алциановым синим и красным ализарином, чтобы свидетельствовать о формировании скелетных элементов (рисунок 1B). Анализ на вымощенные шарики также хорошо подходит для оценки гибели клеток с нейтральным красным цветом (рисунок 1C) и регуляции генов путем гибридизации in situ (рисунок 1D). Шкала установлена на уровне 250 мкм.
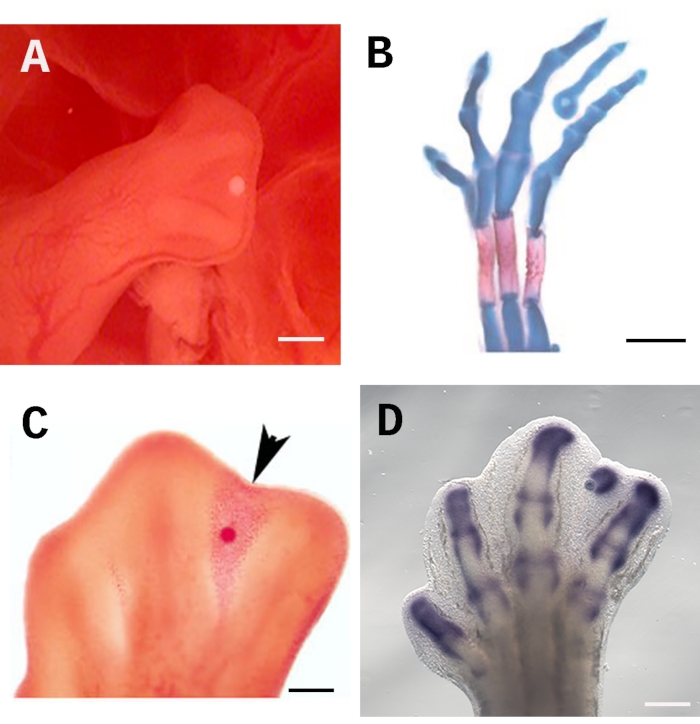
Рисунок 1: Имплантация бусины в межпальцевую ткань конечности цыпленка.( A) Правильное расположение для пропитанной бусины под AER в задней конечности 28 HH. (B) Альциановое синее и ализариновое красное скелетное окрашивание свидетельствуют о формировании эктопического пальца, вызванного через 4 дня после имплантации бусины, пропитанной TGF-ß1. (C) Нейтральное красное окрашивание отмечает индукцию гибели клеток (наконечник стрелы) через 24 ч после имплантации пропитанной РА бусины в межпальцевую ткань на стадии 28 HH. (D) Гибридизация Sox9 in situ через 4 ч после имплантации пропитанного TGF-ß1 шарика. Шкала установлена на уровне 250 мкм. Изображения, показанные в B и C, были взяты из Диас-Эрнандеса и др.23,24. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Основным преимуществом экспериментального инструмента, подробно описанного в этом протоколе, является возможность контролировать время и место воздействия шариков, пропитанных данной экспериментальной молекулой. Сочетание правильного позиционирования с точным временем развития дает огромные возможности для изучения процессов дифференцировки клеток. Проведение этих экспериментов в недифференцированной ткани позволяет исследовать первые важные события в клеточной линии. Например, размещение пропитанной TGFß бусины в межпальцевой ткани эмбриональных конечностей 28 HH приводит к образованию эктопической цифры, в которой запускается молекулярный каскад, индуцирующий генетическую экспрессию главного поколения Sox925. Примечательно, что индуцированная хрящевая ткань также организуется в цифру с образованием фаланги.
Интересно, что РА вызывает гибель клеток в той же межпальцевой области, регулируя экспрессию генов костных морфогенетических белков, которые направляют судьбу клеток недифференцированных клеток к гибели клеток10. Следовательно, дифференцировка клеток, гибель клеток, морфогенез и паттернирование могут быть одновременно исследованы в одной и той же области эмбриона и адаптированы к любой области и генетическому пути, представляющему интерес 8,9.
Элементы, имеющие решающее значение для успеха этого протокола, включают в себя никогда не позволять высохшим размоченным бусинам (т. Е. Они всегда должны оставаться влажными). Кроме того, выбор соответствующих бусин имеет важное значение: аффи-гель и гепариновые шарики предназначены для белков, тогда как AG1-X2 предназначены для химических веществ, растворенных в органических растворителях. Другим критическим моментом является концентрация молекулы, содержащейся в растворе, используемом для замачивания шариков, которая обычно в 1000 раз более концентрирована, чем была бы использована для исследований in vitro . Тем не менее, неудобство этого метода заключается в том, что конечная концентрация молекул, высвобождаемых из пропитанных шариков, неизвестна, как и скорость высвобождения. В протоколе упоминается, что бусины диаметром 100 мкм более удобны в использовании. Учитывайте это, когда конечностями манипулируют. Самое главное, диаметр бусин должен подбираться в соответствии с зоной имплантации и последовательно поддерживаться в каждом эмбрионе. Тем не менее, небольшое изменение размера бусины между экспериментами вряд ли повлияет на результаты.
В заключение, потенциал анализа промокшей бусины, изложенного здесь, зависит только от воображения исследователя. Этот протокол может быть применен к любому экспериментальному животному, клеточной культуре или органотипической модели культуры, включая органоиды. Кроме того, этот протокол является полезным, простым образовательным инструментом для обучения студентов основным концепциям биологии развития и техническим навыкам, практикуя эту экспериментальную манипуляцию на уроках биологии развития.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Генеральным обществом ассоциаций личной академии (DGAPA)-Национальным автономным университетом Мексики [номера грантов IN211117 и IN213314] и Национальным советом по вопросам науки и техники (CONACyT) [грант No 1887 CONACyT-Fronteras de la Ciencia], присужденный JC-M. JC M-L получил постдокторскую стипендию от Национального совета науки и техники (CONACyT-Fronteras de la Ciencia-1887). Авторы высоко ценят помощь Lic. Лючия Брито из Института биомедицинских исследований УНАМ в подготовке ссылок на эту рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| Affi-Gel Blue Gel beads | Bio-Rad | 153-7302 | |
| AG1-X2 beads | Bio-Rad | 1400123 | |
| Egg incubator | Incumatic de Mexico | Incumatic 1000 | |
| Fine surgical forceps | Fine Science Tools | 9115-10 | |
| Heparine Sepharose beads | Abcam | ab193268 | |
| Petri dish | Nest | 705001 | |
| Stereomicroscope | Zeiss | Stemi DV4 | |
| Tape | NA | NA | |
| Tungsten needle | GoodFellow | E74-15096/01 |
Ссылки
- Stapornwongkul, K. S., Vincent, J. P. Generation of extracellular morphogen gradients: the case for diffusion. Nature Reviews Genetics. 22 (6), 393-411 (2021).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Irizarry, J., Stathopoulos, A. Dynamic patterning by morphogens illuminated by cis-regulatory studies. Development. 148 (2), 196113 (2021).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), (2019).
- Marín-Llera, J. C., Garciadiego-Cázares, D., Chimal-Monroy, J. Understanding the cellular and molecular mechanisms that control early cell fate decisions during appendicular skeletogenesis. Frontiers in Genetics. 10, 977 (2019).
- Gurdon, J. B. Embryonic induction--molecular prospects. Development. 99 (3), 285-306 (1987).
- Bouwmeester, T. The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. International Journal of Developmental Biology. 45 (1), 251-258 (2001).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86 (4), 589-598 (1996).
- Cho, K. W., Blumberg, B., Steinbeisser, H., De Robertis, E. M. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell. 67 (6), 1111-1120 (1991).
- Thisse, B., Thisse, C. Formation of the vertebrate embryo: Moving beyond the Spemann organizer. Seminars in Cell & Development Biology. 42, 94-102 (2015).
- Eichele, G., Tickle, C., Alberts, B. M. Microcontrolled release of biologically active compounds in chick embryos: beads of 200-microns diameter for the local release of retinoids. Analytical Biochemistry. 142 (2), 542-555 (1984).
- Tickle, C., Lee, J., Eichele, G. A quantitative analysis of the effect of all-trans-retinoic acid on the pattern of chick wing development. Developmental Biology. 109 (1), 82-95 (1985).
- Vermot, J., Pourquié, O. Retinoic acid coordinates somitogenesis and left-right patterning in vertebrate embryos. Nature. 435 (7039), 215-220 (2005).
- Rodriguez-Leon, J., et al. Retinoic acid regulates programmed cell death through BMP signalling. Nature Cell Biology. 1 (2), 125-126 (1999).
- Rodriguez-Guzman, M., et al. Tendon-muscle crosstalk controls muscle bellies morphogenesis, which is mediated by cell death and retinoic acid signaling. Developmental Biology. 302 (1), 267-280 (2007).
- Cohn, M. J., Izpisúa-Belmonte, J. C., Abud, H., Heath, J. K., Tickle, C. Fibroblast growth factors induce additional limb development from the flank of chick embryos. Cell. 80 (5), 739-746 (1995).
- Ohuchi, H., et al. An additional limb can be induced from the flank of the chick embryo by FGF4. Biochemical and Biophysical Research Communications. 209 (3), 809-816 (1995).
- Abu-Elmagd, M., Goljanek Whysall, K., Wheeler, G., Münsterberg, A. Sprouty2 mediated tuning of signalling is essential for somite myogenesis. BMC Medical Genomics. 8, 8 (2015).
- Gañan, Y., Macias, D., Duterque-Coquillaud, M., Ros, M. A., Hurle, J. M. Role of TGF beta s and BMPs as signals controlling the position of the digits and the areas of interdigital cell death in the developing chick limb autopod. Development. 122 (8), 2349-2357 (1996).
- Merino, R., et al. Morphogenesis of digits in the avian limb is controlled by FGFs, TGFbetas, and noggin through BMP signaling. Developmental Biology. 200 (1), 35-45 (1998).
- Montero, J. A., Lorda-Diez, C. I., Gañan, Y., Macias, D., Hurle, J. M. Activin/TGFbeta and BMP crosstalk determines digit chondrogenesis. Developmental Biology. 321 (2), 343-356 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Díaz-Hernández, M. E., Bustamante, M., Galván-Hernández, C. I., Chimal-Monroy, J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One. 8 (3), 58549 (2013).
- Díaz-Hernández, M. E., Rios-Flores, A. J., Abarca-Buis, R. F., Bustamante, M., Chimal-Monroy, J. Molecular control of interdigital cell death and cell differentiation by retinoic acid during digit development. Journal of Developmental Biology. 2 (2), 138-157 (2014).
- Chimal-Monroy, J., et al. Analysis of the molecular cascade responsible for mesodermal limb chondrogenesis: Sox genes and BMP signaling. Developmental Biology. 257 (2), 292-301 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены