Method Article
Análise da diferenciação celular, morfogênese e padronização durante a embriogênese de frango usando o ensaio de contas encharcadas
Neste Artigo
Resumo
O ensaio de contas encharcada envolve a entrega direcionada de reagente de teste em qualquer ponto de desenvolvimento para estudar a regulação da diferenciação celular e morfogênese. Um protocolo detalhado, aplicável a qualquer modelo animal experimental, para preparar três tipos diferentes de contas encharcadas e implantá-las no interdigit de um embrião de frango é apresentado.
Resumo
Uma infinidade de programas genéticos é ativada durante o desenvolvimento embrionário que orquestra a diferenciação celular para gerar uma diversidade surpreendente de células, tecidos e órgãos somáticos. A ativação precisa desses programas genéticos é regulada por morfogens, moléculas difusíveis que direcionam o destino celular em diferentes limiares. Entender como a ativação genética coordena a morfogênese requer o estudo das interações locais desencadeadas por morfogênicos durante o desenvolvimento. O uso de contas embebidas em proteínas ou drogas implantadas em regiões distintas do embrião permite estudar o papel de moléculas específicas no estabelecimento de dígitos e outros processos de desenvolvimento. Esta técnica experimental fornece informações sobre o controle da indução celular, destino celular e formação de padrões. Assim, este ensaio de contas encharcada é uma ferramenta experimental extremamente poderosa e valiosa aplicável a outros modelos embrionários.
Introdução
Avanços nos mecanismos moleculares que controlam a expressão genética durante o desenvolvimento embrionário nos permitiram entender como o destino celular é determinado. O compromisso com diferentes linhagens celulares ocorre uma vez que as células iniciam a expressão molecular dos fatores de transcrição1. Esse padrão de expressão é altamente coordenado no espaço e no tempo e, assim, direciona a formação, posicionamento e padronização de células, tecidos e órgãos 1,2,3,4,5. A indução embrionária é o processo pelo qual as células estão comprometidas com linhagens específicas, estabelecendo hierarquias que restringem a potencialidade das células, que incluem até mesmo a geração do plano básico do corpo, como ocorre com o organizador spemann 6,7. O lábio dorsal blastopore induz um segundo eixo embrionário em um embrião hospedeiro 8,9. Hoje, com o auxílio do enxerto e outros experimentos clássicos combinados com abordagens moleculares, sabe-se que diferentes fatores de transcrição e fatores de crescimento funcionam para direcionar a indução embrionária no organizadorSpemann 10. Assim, a manipulação experimental é uma ferramenta importante para entender os processos de diferenciação celular, morfogênese e padronização durante a embriogênese.
Curiosamente, em sistemas embrionários onde o transplante de tecido é difícil ou quando os indutores já são bem conhecidos, os portadores são usados para fornecer moléculas (por exemplo, proteínas, produtos químicos, toxinas, etc.) para regular a diferenciação celular, morfogênese e até mesmo a padronização. Um desses sistemas portadores envolve a implantação de contas embebidas em uma molécula específica em qualquer organismo modelo experimental em qualquer ponto de desenvolvimento para determinar o efeito do referido reagente ou direcionar a diferenciação do referido modelo. Por exemplo, ao implantar contas de ácido retinóico (RA) embebidas no broto do membro da asa de frango, Cheryl Tickle et al. (1985) demonstraram que a RA induz a expressão de ouriço sônico na zona de atividade polarizadora (ZPA)11,12. A mesma estratégia experimental foi usada para descobrir que a RA controla a assimetria de somites e morte celular no broto do membro durante o desenvolvimento de dígitos e em outras regiões embrionárias do membro 13,14,15. Outros fatores, principalmente proteínas (por exemplo, fatores de crescimento do fibroblasto [FGF], transformando fator de crescimento-beta [TGF-ß]) têm sido usados para induzir membros nos flancos dos embriões precoces e novos dígitos na região interdigital, respectivamente 16,17,18,19,20,21 . Esses experimentos evidenciam o poder e a utilidade dessa técnica para determinar o estágio de comprometimento ou competência de tecidos ou grupos de células expostas às moléculas.
Neste protocolo, o membro pintinho na fase de formação de dígitos serviu como modelo experimental para apresentar passo a passo como preparar e implantar as contas encharcadas. No entanto, esta ferramenta experimental não se limita a esta aplicação, mas pode ser explorada em qualquer modelo animal experimental e em qualquer ponto de tempo in vitro e in vivo para estudar indução, diferenciação, morte celular e padronização.
Protocolo
Esta pesquisa foi revisada e aprovada pelo Conselho de Revisão Institucional para o Cuidado e Uso de Animais laboratoriais do Instituto de Investigaciones Biomédicas da Universidad Nacional Autónoma de México (UNAM, Cidade do México, México).
1. Incubação de ovos e estadiamento de embriões
NOTA: Ovos de galinha fertilizados podem ser obtidos em fazendas locais. Ovos de galinha Leghorn Branco Fertilizado são mais comumente usados. Armazene os ovos de galinha recém-fertilizados a 15 °C por até 1 semana antes da incubação.
- Incubar os ovos de galinha fertilizados verticalmente com o lado pontial ícquico para baixo em uma incubadora umidificada a 38 °C e 70% de umidade relativa até atingir o estágio de 28 HH (aproximadamente 5,5 dias segundo Hamilton e Hamburger, 1951)22. Gire os ovos durante a incubação para evitar que o embrião aduste à membrana da casca.
NOTA: A escolha da etapa de desenvolvimento é informada pelos objetivos experimentais. Neste caso, o estágio de 28 HH é ideal para a implantação de contas interdigita para induzir um dígito ectópico ou promover a morte celular. - Retire os ovos da incubadora, cotone-os com 70% de etanol e deixe-os secar. Desinfetar a área de trabalho, microscópios e instrumentos com 70% de etanol.
- Vire o ovo para identificar vasos sanguíneos e localizar o embrião. Descarte ovos que não tenham um embrião.
- Usando a extremidade de fórceps não dentes, abra uma janela em cerca de cinco ovos batendo na extremidade contundente de um ovo, e remova uma seção de 1 cm2 da casca com os fórceps.
- Transfira o ovo para uma caixa ou suporte plástico e coloque-o sob o estereóscópio. Remova a membrana de ar perfurando-a e puxando-a para fora com fórceps cirúrgicos finos. Remova qualquer pequeno pedaço de casca de ovo que possa entrar em contato com o embrião.
NOTA: A membrana de ar é a membrana branca e opaca observada imediatamente após a janela do ovo. - Observe sob o microscópio enquanto abre ligeiramente o saco amniótico, rasgando-o usando os fórceps cirúrgicos finos. Tenha cuidado para não danificar a vasculatura da membrana corioallantónica.
NOTA: O amnion é a membrana transparente ao redor do embrião que o encapsula em fluido amniótico. - Encenou os embriões em ovo para determinar se estão na fase desejada. Embriões em estágios anteriores podem ser devolvidos à incubadora após selar a janela da casca de ovo com fita adesiva.
2. Preparação de contas
NOTA: Dependendo do objetivo experimental e do tratamento em questão, os tipos alternativos de contas (por exemplo, Affi-Gel, AG1-X2, heparina) podem ser mais adequados. As contas de Affi-Gel são ótimas para proteínas (por exemplo, TGF-ß1), enquanto as contas de heparina são ideais para fatores de crescimento (por exemplo, FGFs, WNT) e contas AG1-X2 para produtos químicos solubilizados em solventes orgânicos (por exemplo, DMSO).
- Affi-Gel e heparina preparação
- Corte um quadrado de parafilm para caber uma placa de Petri de 45 mm. Coloque o parafilm através da parte inferior da placa de petri para cobri-lo e fixá-lo no fundo da placa de Petri empurrando cada vértice usando a extremidade de fórceps não dentes. Reservar.
- Usando uma pipeta ou espátula, transfira as contas para um tubo de microcentrifuuagem e lave-as duas vezes em 1x PBS, assentando e pipetando.
- Transfira ~40-50 contas com uma micropipette para o centro da placa de Petri parafilmada a partir do passo 1.
- Usando o microscópio, selecione ~30 contas Affi-Gel ou heparina ~100 μm de diâmetro para uso. Use um tique-taque de microscópio para dimensionar as contas ou usar o terceiro interdigit de um embrião HH 28 como referência; a conta deve ser menor que o interdigit.
- Remova cuidadosamente o máximo possível do excesso de PBS em torno das contas e mergulhe-as em 2-5 μL da solução de tratamento. Assegure-se de que a solução abrange completamente as contas.
- Em paralelo, prepare as contas de controle, imerso em uma solução que contenha a mesma quantidade de veículo usada na solução experimental de tratamento.
NOTA: As concentrações precisam ser calculadas para cada tratamento de acordo com o experimento. Use os equipamentos de proteção individual adequados ao manusear reagentes potencialmente prejudiciais. - Incubar as contas na solução por 30 minutos à temperatura ambiente. Para evitar que as contas sequem durante a incubação, pipeta algumas gotas de 1x PBS ou água ao redor das contas para umidificar a atmosfera local e cobrir o prato com parafilme para retardar a evaporação.
- Coloque a placa de Petri no gelo e implante as contas no mesmo dia.
- Preparação de contas AG 1-X2
- Corte um quadrado de parafilm para caber uma placa de Petri de 45 mm. Cubra a parte inferior da placa de Petri com parafilme e afixe empurrando cada vértice usando a extremidade de fórceps não dentes. Reservar.
- Use uma espátula para transferir as contas AG 1-X2 para um tubo de microcentrífuga. Adicione 30-50 μL da solução de tratamento na concentração final desejada.
- Paralelamente, incubar as contas de controle em uma solução apenas com o veículo, preparada sem o produto químico experimental ou proteína de interesse.
- Incubar as contas por 20 minutos enquanto treme lentamente à temperatura ambiente. Enrole os tubos de microcentrifuuge com papel alumínio para proteger da luz durante toda a incubação, dado que muitas dessas moléculas são sensíveis à luz
- Remova o máximo possível da solução usando uma pipeta e uma mancha com 2% de fenol vermelho dissolvido em água em temperatura ambiente por 2 minutos com leve agitação em um vórtice.
NOTA: Tingir as contas transparentes AG 1-X2 facilita sua implantação no embrião. - Retire o 2% de fenol vermelho e lave as contas duas vezes em 1x PBS para remover qualquer corante em excesso.
- Com uma dica de micropipette, transfira ~40-50 contas AG 1-X2 para o centro da placa Petri coberta de parafilm preparada na etapa 1 e mergulhe-as em 5 μL de 1x PBS. Sob o microscópio, selecione cerca de 30 contas com ~100 μm de diâmetro. Descarte as contas não reutilizadas.
- Contas estão prontas para implantar. Certifique-se de que as contas estão submersas no PBS durante toda a implantação, tubulando algumas gotas de PBS 1x ou água ao redor das contas para umidificar a atmosfera local e/ou cobrir o prato com parafilme para retardar a evaporação.
3. Manipulação de embriões e implantação de interdigit
- Antes de manipular os embriões, organize dois estereómicos ao lado um do outro em um banco. Uma é para manipulação de embriões e implantação de contas, e a outra é para manter as contas tratadas prontas para implantar no embrião.
- Usando fórceps não dentes, crie uma janela nos ovos restantes, conforme descrito na seção de incubação de ovos e estadiamento de embriões.
- Sob o microscópio, abra o saco amniótico rasgando a membrana amniótica com fórceps cirúrgicos finos perto da liminar direita apenas pela quantidade necessária para realizar o procedimento (ou seja, o mínimo possível).
- Usando fórceps finos, segure o embrião pela membrana amniótica para expor a divisa direita. Usando uma agulha de tungstênio fina, faça um orifício centrado na maioria distal do terceiro interdigit da retalho traseira.
- Sem liberar o embrião e o hindlimb exposto, pegue uma conta tratada do outro microscópio usando uma das pontas dos fórceps. Os fórceps devem estar em posição aberta para uma conta aderir à ponta fórceps.
- Transfira a conta para o embrião de filhote perto da linha traseira e posicione-a em cima do buraco interdigit.
- Feche os fórceps para aplicar pressão na conta até que ela entre no buraco.
- Solte o embrião e sele a janela da casca de ovo com fita adesiva.
- Devolva os ovos à incubadora até que cheguem ao estágio necessário. Repita o procedimento até que o número necessário de embriões manipulados seja atingido. É imperativo garantir que as contas não sequem em nenhum momento.
NOTA: Para observar um dedo ectópico completo, incubar por ~72 h após a implantação das contas. Em contraste, os genes de diferenciação precoce (por exemplo, Sox9) são expressos ~30 min após a implantação de uma conta encharcada de TGF-ß1.
Resultados
Usando contas encharcadas para avaliar o comportamento celular no membro do pintinho embrionário
Para assegurar a eficácia deste ensaio, a conta deve ser colocada de forma consistente e precisa no local correto; neste caso, a maioria distal do terceiro interdigit sob a est cume ectodérmica apical AER (Figura 1A). Este posicionamento permite que a molécula em questão se espalhe igualmente por todo o tecido interdigital. Além disso, a zona abaixo do AER contém células indiferenciadas que são prontamente responsivas ao tratamento. Para avaliar os efeitos sobre a diferenciação celular, os embriões podem ser manchados com azul alciano e vermelho Alizarin para evidenciar a formação de elementos esqueléticos (Figura 1B). O ensaio de contas encharcadas também é adequado para avaliar a morte celular com vermelho neutro (Figura 1C) e regulação genética por hibridização in situ (Figura 1D). A barra de escala é fixada em 250 μm.
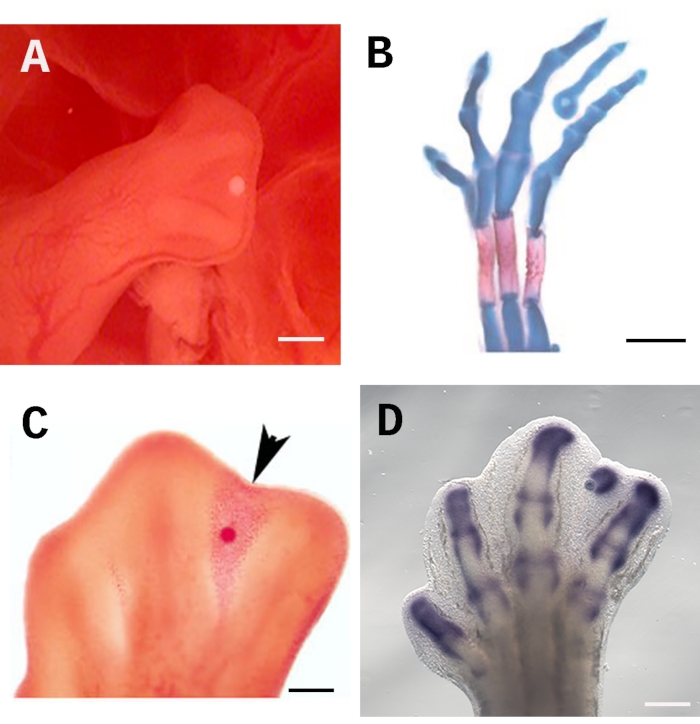
Figura 1: Implantação de contas no tecido interdigital do membro pintinho.( A)O local correto para a conta encharcada abaixo do AER em um retrocesso de 28 HH. (B) A mancha esquelética azul alciana e alizarina evidencia a formação de um dígito ectópico induzido 4 dias após a implantação de uma conta encharcada de TGF-ß1. (C) A coloração vermelha neutra marca a indução da morte celular (ponta de flecha) 24 h depois de implantar uma conta encharcada de RA no tecido interdigital no estágio de 28 HH. (D) Sox9 in situ hibridização 4 h depois que uma conta encharcada de TGF-ß1 foi implantada. A barra de escala é fixada em 250 μm. As imagens mostradas em B e C foram tiradas de Díaz-Hernández et al.23,24. Clique aqui para ver uma versão maior desta figura.
Discussão
A principal vantagem da ferramenta experimental detalhada neste protocolo é ser capaz de controlar a hora e a localização da exposição a contas encharcadas em uma determinada molécula experimental. Combinar o posicionamento correto com o timing preciso do desenvolvimento oferece enormes possibilidades de estudar processos de diferenciação celular. Realizar esses experimentos em tecidos indiferenciados permite investigar os primeiros eventos cruciais na linhagem celular. Por exemplo, colocar uma conta encharcada de TGFß no tecido interdigital dos membros embrionários 28 HH resulta na formação de um dígito ectópico no qual uma cascata molecular é acionada que induz a expressão genética do mestre gen Sox925. Notavelmente, o tecido de cartilagem induzido também se organiza em um dígito com formação de falange.
Curiosamente, a RA desencadeia a morte celular na mesma região interdigital regulando a expressão genética de proteínas morfogenéticas ósseas que direcionam o destino celular de células indiferenciadas para a mortecelular 10. Assim, a diferenciação celular, morte celular, morfogênese e padronização podem ser simultaneamente investigadas na mesma região de um embrião e adaptadas a qualquer região e via genética de interesse 8,9.
Os elementos cruciais para o sucesso deste protocolo incluem nunca deixar as contas encharcadas secarem (ou seja, elas devem sempre permanecer molhadas). Além disso, selecionar as contas apropriadas é essencial: as contas de Affi-Gel e heparina são para proteínas, enquanto AG1-X2 são para produtos químicos dissolvidos em solventes orgânicos. Outro ponto crítico é a concentração da molécula contida na solução usada para absorver as contas, que geralmente é 1000 vezes mais concentrada do que seria usada para estudos in vitro . No entanto, um inconveniente deste método é que a concentração final de moléculas liberadas das contas encharcadas é desconhecida, bem como a velocidade de liberação. No protocolo é mencionado que as contas-100 μm de diâmetro são mais convenientes para uso. Considere isso quando os membros são manipulados. Mais importante, o diâmetro das contas deve ser selecionado de acordo com a zona de implantação e mantido consistentemente em cada embrião. No entanto, uma pequena variação no tamanho das contas entre os experimentos não deve afetar os resultados.
Em conclusão, o potencial do ensaio de contas encharcadas aqui descrito depende apenas da imaginação do pesquisador. Este protocolo pode ser aplicado a qualquer modelo experimental de cultura animal, celular ou organotípica, incluindo organoides. Além disso, este protocolo é uma ferramenta educacional útil e direta para ensinar aos alunos conceitos básicos de biologia do desenvolvimento e habilidades técnicas praticando essa manipulação experimental nas aulas de biologia do desenvolvimento.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela Dirección General de Asuntos del Personal Académico (DGAPA)-Universidad Nacional Autónoma de México [números de subvenção IN211117 e IN213314] e Consejo Nacional de Ciencia y Tecnología (CONACyT) [concessão número 1887 CONACyT-Fronteras de la Ciencia] concedida ao JC-M. JC M-L recebeu uma bolsa de pós-doutorado do Consejo Nacional de Ciencia y Tecnología (CONACyT-Fronteras de la Ciencia-1887). Os autores agradecem a ajuda de Lic. Lucia Brito, do Instituto de Investigaciones Biomédicas, UNAM, nas referências de preparação deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Affi-Gel Blue Gel beads | Bio-Rad | 153-7302 | |
| AG1-X2 beads | Bio-Rad | 1400123 | |
| Egg incubator | Incumatic de Mexico | Incumatic 1000 | |
| Fine surgical forceps | Fine Science Tools | 9115-10 | |
| Heparine Sepharose beads | Abcam | ab193268 | |
| Petri dish | Nest | 705001 | |
| Stereomicroscope | Zeiss | Stemi DV4 | |
| Tape | NA | NA | |
| Tungsten needle | GoodFellow | E74-15096/01 |
Referências
- Stapornwongkul, K. S., Vincent, J. P. Generation of extracellular morphogen gradients: the case for diffusion. Nature Reviews Genetics. 22 (6), 393-411 (2021).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Irizarry, J., Stathopoulos, A. Dynamic patterning by morphogens illuminated by cis-regulatory studies. Development. 148 (2), 196113 (2021).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), (2019).
- Marín-Llera, J. C., Garciadiego-Cázares, D., Chimal-Monroy, J. Understanding the cellular and molecular mechanisms that control early cell fate decisions during appendicular skeletogenesis. Frontiers in Genetics. 10, 977 (2019).
- Gurdon, J. B. Embryonic induction--molecular prospects. Development. 99 (3), 285-306 (1987).
- Bouwmeester, T. The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. International Journal of Developmental Biology. 45 (1), 251-258 (2001).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86 (4), 589-598 (1996).
- Cho, K. W., Blumberg, B., Steinbeisser, H., De Robertis, E. M. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell. 67 (6), 1111-1120 (1991).
- Thisse, B., Thisse, C. Formation of the vertebrate embryo: Moving beyond the Spemann organizer. Seminars in Cell & Development Biology. 42, 94-102 (2015).
- Eichele, G., Tickle, C., Alberts, B. M. Microcontrolled release of biologically active compounds in chick embryos: beads of 200-microns diameter for the local release of retinoids. Analytical Biochemistry. 142 (2), 542-555 (1984).
- Tickle, C., Lee, J., Eichele, G. A quantitative analysis of the effect of all-trans-retinoic acid on the pattern of chick wing development. Developmental Biology. 109 (1), 82-95 (1985).
- Vermot, J., Pourquié, O. Retinoic acid coordinates somitogenesis and left-right patterning in vertebrate embryos. Nature. 435 (7039), 215-220 (2005).
- Rodriguez-Leon, J., et al. Retinoic acid regulates programmed cell death through BMP signalling. Nature Cell Biology. 1 (2), 125-126 (1999).
- Rodriguez-Guzman, M., et al. Tendon-muscle crosstalk controls muscle bellies morphogenesis, which is mediated by cell death and retinoic acid signaling. Developmental Biology. 302 (1), 267-280 (2007).
- Cohn, M. J., Izpisúa-Belmonte, J. C., Abud, H., Heath, J. K., Tickle, C. Fibroblast growth factors induce additional limb development from the flank of chick embryos. Cell. 80 (5), 739-746 (1995).
- Ohuchi, H., et al. An additional limb can be induced from the flank of the chick embryo by FGF4. Biochemical and Biophysical Research Communications. 209 (3), 809-816 (1995).
- Abu-Elmagd, M., Goljanek Whysall, K., Wheeler, G., Münsterberg, A. Sprouty2 mediated tuning of signalling is essential for somite myogenesis. BMC Medical Genomics. 8, 8 (2015).
- Gañan, Y., Macias, D., Duterque-Coquillaud, M., Ros, M. A., Hurle, J. M. Role of TGF beta s and BMPs as signals controlling the position of the digits and the areas of interdigital cell death in the developing chick limb autopod. Development. 122 (8), 2349-2357 (1996).
- Merino, R., et al. Morphogenesis of digits in the avian limb is controlled by FGFs, TGFbetas, and noggin through BMP signaling. Developmental Biology. 200 (1), 35-45 (1998).
- Montero, J. A., Lorda-Diez, C. I., Gañan, Y., Macias, D., Hurle, J. M. Activin/TGFbeta and BMP crosstalk determines digit chondrogenesis. Developmental Biology. 321 (2), 343-356 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Díaz-Hernández, M. E., Bustamante, M., Galván-Hernández, C. I., Chimal-Monroy, J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One. 8 (3), 58549 (2013).
- Díaz-Hernández, M. E., Rios-Flores, A. J., Abarca-Buis, R. F., Bustamante, M., Chimal-Monroy, J. Molecular control of interdigital cell death and cell differentiation by retinoic acid during digit development. Journal of Developmental Biology. 2 (2), 138-157 (2014).
- Chimal-Monroy, J., et al. Analysis of the molecular cascade responsible for mesodermal limb chondrogenesis: Sox genes and BMP signaling. Developmental Biology. 257 (2), 292-301 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados