Method Article
تحليل تمايز الخلايا ، والتشكل ، والتنميط أثناء التكوين الجنيني للدجاج باستخدام فحص الخرز المنقوع
In This Article
Summary
تتضمن مقايسة الخرزة المنقوعة التسليم المستهدف لكاشف الاختبار في أي نقطة زمنية تنموية لدراسة تنظيم تمايز الخلايا وتكوين المورفوجينيا. يتم تقديم بروتوكول مفصل ، ينطبق على أي نموذج حيواني تجريبي ، لإعداد ثلاثة أنواع مختلفة من الخرز المنقوع وزرعها في الأرقام الداخلية لجنين الدجاج.
Abstract
يتم تنشيط العديد من البرامج الجينية أثناء التطور الجنيني الذي ينسق تمايز الخلايا لتوليد تنوع مذهل من الخلايا الجسدية والأنسجة والأعضاء. يتم تنظيم التنشيط الدقيق لهذه البرامج الجينية بواسطة مورفوجينات ، وهي جزيئات قابلة للانتشار توجه مصير الخلية عند عتبات مختلفة. يتطلب فهم كيفية تنسيق التنشيط الجيني للمورفوجينيا دراسة التفاعلات المحلية التي تسببها المورفوجينات أثناء التطور. يتيح استخدام الخرز المنقوع في البروتينات أو الأدوية المزروعة في مناطق متميزة من الجنين دراسة دور جزيئات معينة في إنشاء الأرقام والعمليات التنموية الأخرى. توفر هذه التقنية التجريبية معلومات عن التحكم في تحريض الخلايا ومصير الخلية وتكوين الأنماط. وبالتالي ، فإن اختبار الخرز المنقوع هذا هو أداة تجريبية قوية وقيمة للغاية تنطبق على النماذج الجنينية الأخرى.
Introduction
سمحت لنا الاختراقات في الآليات الجزيئية التي تتحكم في التعبير الجيني أثناء التطور الجنيني بفهم كيفية تحديد مصير الخلية. يحدث الالتزام بسلالات الخلايا المختلفة بمجرد أن تبدأ الخلايا التعبير الجزيئي لعوامل النسخ1. يتم تنسيق نمط التعبير هذا بشكل كبير في المكان والزمان ، وبالتالي يوجه تشكيل وتحديد المواقع ونمط الخلايا والأنسجة والأعضاء1،2،3،4،5. الحث الجنيني هو العملية التي تلتزم بها الخلايا بسلالات محددة من خلال إنشاء تسلسلات هرمية تقيد إمكانات الخلايا ، والتي تشمل حتى توليد خطة الجسم الأساسية كما يحدث مع منظم سبيمان 6,7. تحفز الشفة الظهرية البلاستوبور محورا جنينيا ثانيا في الجنين المضيف 8,9. اليوم ، بمساعدة التطعيم والتجارب الكلاسيكية الأخرى جنبا إلى جنب مع النهج الجزيئية ، من المعروف أن عوامل النسخ المختلفة وعوامل النمو تعمل على توجيه الحث الجنيني في منظم سبيمان10. وبالتالي ، فإن التلاعب التجريبي هو أداة مهمة لفهم تمايز الخلايا ، وتكوين التشكل ، وعمليات النقش أثناء تكوين الجنين.
ومن المثير للاهتمام ، في الأنظمة الجنينية حيث يكون زرع الأنسجة صعبا أو عندما تكون المحفزات معروفة بالفعل ، يتم استخدام الناقلات لتوصيل الجزيئات (على سبيل المثال ، البروتينات والمواد الكيميائية والسموم ، وما إلى ذلك) لتنظيم تمايز الخلايا ، والتشكل ، وحتى النقش. يتضمن أحد هذه الأنظمة الحاملة زرع حبات غارقة في جزيء معين في أي كائن حي تجريبي في أي نقطة زمنية للتطور لتحديد تأثير الكاشف المذكور أو توجيه تمايز النموذج المذكور. على سبيل المثال ، من خلال زرع حبات منقوعة بحمض الريتينويك (RA) في برعم أطراف جناح الدجاج ، أثبتت Cheryl Tickle et al. (1985) أن RA يحفز التعبير عن القنفذ الصوتي في منطقة نشاط الاستقطاب (ZPA) 11,12. تم استخدام نفس الاستراتيجية التجريبية لاكتشاف أن التهاب المفاصل الروماتويدي يتحكم في عدم تناسق السوميت وموت الخلايا في برعم الأطراف أثناء تطور الأرقام وفي مناطق الأطراف الجنينية الأخرى13،14،15. تم استخدام عوامل أخرى ، وخاصة البروتينات (على سبيل المثال ، عوامل نمو الخلايا الليفية [FGF] ، وتحويل عامل النمو بيتا [TGF-ß]) لتحفيز الأطراف في أجنحة الأجنة المبكرة والأرقام الجديدة في المنطقة بين الرقمية ، على التوالي16،17،18،19،20،21 . تثبت هذه التجارب قوة وفائدة هذه التقنية في تحديد مرحلة التزام أو كفاءة الأنسجة أو مجموعات الخلايا المعرضة للجزيئات.
في هذا البروتوكول ، كان طرف الفرخ في مرحلة تكوين الأرقام بمثابة النموذج التجريبي لتقديم خطوة بخطوة كيفية تحضير وزرع الخرز المنقوع. ومع ذلك ، فإن هذه الأداة التجريبية لا تقتصر على هذا التطبيق ولكن يمكن استغلالها في أي نموذج حيواني تجريبي وفي أي نقطة زمنية في المختبر وفي الجسم الحي لدراسة الحث والتمايز وموت الخلايا والنمط.
Protocol
تمت مراجعة هذا البحث والموافقة عليه من قبل مجلس المراجعة المؤسسية لرعاية واستخدام المختبر التابع لمعهد التحقيقات الطبية الحيوية ، الجامعة الوطنية المستقلة في المكسيك (UNAM ، مكسيكو سيتي ، المكسيك).
1. حضانة البيض وتدريج الأجنة
ملاحظة: يمكن الحصول على بيض الدجاج المخصب من المزارع المحلية. يتم استخدام بيض الدجاج الأبيض المخصب Leghorn الأكثر استخداما. تخزين بيض الدجاج المخصب الطازج في 15 درجة مئوية لمدة تصل إلى أسبوع واحد قبل الحضانة.
- احتضن بيض الدجاج المخصب عموديا مع الجانب المدبب لأسفل في حاضنة رطبة عند 38 درجة مئوية ورطوبة نسبية 70٪ حتى تصل إلى مرحلة 28 HH (حوالي 5.5 أيام وفقا لهاميلتون وهامبورغر ، 1951)22. قم بتدوير البيض أثناء الحضانة لمنع الجنين من الالتصاق بغشاء القشرة.
ملاحظة: يتم اختيار المرحلة التنموية من خلال الأهداف التجريبية. في هذه الحالة ، تكون مرحلة 28 HH مثالية لزرع الخرز بين الأرقام للحث على رقم خارج الرحم أو تعزيز موت الخلايا. - قم بإزالة البيض من الحاضنة ، ومسحه بالإيثانول بنسبة 70٪ ، واتركه ليجف في الهواء. تطهير منطقة العمل والمجاهر والأدوات بنسبة 70٪ من الإيثانول.
- شمعة البويضة لتحديد الأوعية الدموية وتحديد موقع الجنين. تخلص من البيض الذي ليس لديه جنين.
- باستخدام نهاية الملقط غير المسنن ، افتح نافذة في حوالي خمس بيضات عن طريق النقر على الطرف الحاد للبيضة ، وقم بإزالة قسم1-cm 2 من القشرة باستخدام الملقط.
- انقل البيضة إلى حامل كرتوني أو بلاستيكي وضعها تحت المجهر المجسم. قم بإزالة غشاء الهواء عن طريق ثقبه وسحبه للخارج باستخدام ملقط جراحي دقيق. قم بإزالة أي قطعة صغيرة من قشر البيض يمكن أن تتصل بالجنين.
ملاحظة: غشاء الهواء هو الغشاء الأبيض غير الشفاف الذي لوحظ مباشرة بعد نافذة البيضة. - راقب تحت المجهر أثناء فتح الكيس الأمنيوسي قليلا ، وتمزيقه باستخدام الملقط الجراحي الدقيق. احرص على عدم إتلاف الأوعية الدموية للغشاء المشيمي.
ملاحظة: السلى هو الغشاء الشفاف المحيط بالجنين عن كثب والذي يغلفه في السائل الأمنيوسي. - مرحلة الأجنة في البيضة لتحديد ما إذا كانت في المرحلة المطلوبة. يمكن إعادة الأجنة في المراحل المبكرة إلى الحاضنة بعد إغلاق نافذة قشر البيض بشريط.
2. إعداد الخرز
ملاحظة: اعتمادا على الهدف التجريبي والعلاج المعني ، قد تكون أنواع الخرز البديلة (على سبيل المثال ، Affi-Gel ، AG1-X2 ، الهيبارين) أكثر ملاءمة. تعتبر حبات Affi-Gel مثالية للبروتينات (على سبيل المثال ، TGF-ß1) ، في حين أن حبات الهيبارين مثالية لعوامل النمو (على سبيل المثال ، FGFs ، WNT) وخرز AG1-X2 للمواد الكيميائية القابلة للذوبان في المذيبات العضوية (على سبيل المثال ، DMSO).
- تحضير حبة Affi-Gel والهيبارين
- قطع مربع من parafilm لتناسب طبق بتري 45 ملم. ضع البارافيلم عبر الجزء السفلي من طبق بتري لتغطيته وتثبيته في الجزء السفلي من طبق بتري عن طريق دفع كل قمة باستخدام نهاية ملقط غير مسننة. جانبا.
- باستخدام ماصة أو ملعقة ، انقل الخرز إلى أنبوب طرد مركزي دقيق واغسلها مرتين في 1x PBS عن طريق الاستقرار والسحب.
- انقل ~ 40-50 حبة مع ماصة دقيقة إلى وسط طبق بتري المظلي من الخطوة 1.
- باستخدام المجهر ، حدد ~ 30 Affi-Gel أو حبات الهيبارين ~ 100 ميكرومتر في القطر للاستخدام. استخدام شبكة عدسة المجهر لتحديد حجم الخرز أو استخدام الرقم البيني الثالث لجنين HH 28 كمرجع ؛ يجب أن تكون الخرزة أصغر من الأرقام البينية.
- قم بإزالة أكبر قدر ممكن من PBS الزائد المحيط بالخرز بعناية وانقعه في 2-5 ميكرولتر من محلول العلاج. تأكد من أن الحل يغطي الخرز بالكامل.
- في موازاة ذلك ، قم بإعداد حبات التحكم عن طريق النقع في محلول يحتوي على نفس كمية السيارة المستخدمة في محلول المعالجة التجريبية.
ملاحظة: يجب حساب التركيزات لكل علاج وفقا للتجربة. استخدم معدات الحماية الشخصية المناسبة عند التعامل مع الكواشف التي يحتمل أن تكون ضارة. - احتضان الخرز في المحلول لمدة 30 دقيقة في درجة حرارة الغرفة. لمنع الخرز من الجفاف أثناء الحضانة ، ماصة بضع قطرات من 1x PBS أو الماء حول الخرز لترطيب الجو المحلي وتغطية الطبق بالبارافيلم لإبطاء التبخر.
- ضع طبق البتري على الثلج وازرع الخرز في نفس اليوم.
- AG 1-X2 إعداد حبة
- قطع مربع من parafilm لتناسب طبق بتري 45 ملم. قم بتغطية الجزء السفلي من طبق بتري بالبارافيلم واللصق عن طريق دفع كل قمة باستخدام نهاية ملقط غير مسننة. جانبا.
- استخدم ملعقة لنقل حبات AG 1-X2 إلى أنبوب جهاز طرد مركزي صغير. أضف 30-50 ميكرولتر من محلول المعالجة عند التركيز النهائي المطلوب.
- في موازاة ذلك ، احتضن حبات التحكم في محلول مع السيارة وحدها ، محضرة بدون المادة الكيميائية التجريبية أو البروتين ذي الاهتمام.
- احتضن الخرز لمدة 20 دقيقة بينما تهتز ببطء في درجة حرارة الغرفة. لف أنابيب أجهزة الطرد المركزي الدقيقة بورق القصدير للحماية من الضوء أثناء كل فترة حضانة ، نظرا لأن العديد من هذه الجزيئات حساسة للضوء
- قم بإزالة أكبر قدر ممكن من المحلول باستخدام ماصة ووصمة عار مع 2٪ من الفينول الأحمر المذاب في الماء في درجة حرارة الغرفة لمدة دقيقتين مع إثارة خفيفة في دوامة.
ملاحظة: صباغة حبات AG 1-X2 الشفافة تسهل زرعها في الجنين. - إزالة 2٪ الفينول الأحمر وغسل الخرز مرتين في 1x PBS لإزالة أي صبغة زائدة.
- باستخدام طرف ماصة دقيقة ، انقل حبات 40-50 AG 1-X2 إلى وسط طبق Petri المغطى بالبارافيلم المحضر في الخطوة 1 وانقعها في 5 ميكرولتر من 1x PBS. تحت المجهر ، حدد حوالي 30 خرزة قطرها ~ 100 ميكرومتر في الحجم. تخلص من الخرز غير المستخدم.
- الخرز جاهز للزرع. تأكد من غمر الخرز في PBS طوال عملية الزرع عن طريق سحب بضع قطرات من 1x PBS أو الماء حول الخرز لترطيب الجو المحلي و / أو تغطية الطبق بالبارافيلم لإبطاء التبخر.
3. التلاعب بالأجنة وزرع بين الأرقام
- قبل التلاعب بالأجنة ، رتب مجهرين ستيريويين بجوار بعضهما البعض على سطح الطاولة. أحدهما للتلاعب بالجنين وزرع الخرز ، والآخر هو للحفاظ على الخرز المعالج جاهزا للزرع في الجنين.
- باستخدام ملقط غير مسنن ، قم بإنشاء نافذة في البيض المتبقي كما هو موضح في قسم حضانة البيض وتدريج الجنين.
- تحت المجهر ، افتح الكيس الأمنيوسي عن طريق تمزيق الغشاء الأمنيوسي بملقط جراحي دقيق بالقرب من الطرف الخلفي الأيمن فقط بالكمية اللازمة لإنجاز الإجراء (أي بأقل قدر ممكن).
- باستخدام ملقط ناعم ، أمسك الجنين بالغشاء الأمنيوسي لفضح الطرف الخلفي الأيمن. باستخدام إبرة التنغستن الدقيقة ، قم بعمل ثقب يتمركز في أقصى الحدود من الرقم الثالث من الطرف الخلفي.
- دون إطلاق الجنين والطرف الخلفي المكشوف ، خذ حبة معالجة واحدة من المجهر الآخر باستخدام أحد أطراف الملقط. يجب أن يكون الملقط في وضع مفتوح حتى تلتصق حبة واحدة بطرف الملقط.
- انقل الخرزة إلى جنين الفرخ بالقرب من الطرف الخلفي وضعها فوق الثقب بين الأرقام.
- أغلق الملقط للضغط على الخرزة حتى تدخل الحفرة.
- حرر الجنين وأغلق نافذة قشر البيض بشريط.
- أعد البيض إلى الحاضنة حتى يصل إلى المرحلة المطلوبة. كرر الإجراء حتى يتم الوصول إلى العدد المطلوب من الأجنة التي تم التلاعب بها. من الضروري التأكد من أن الخرز لا يجف في أي وقت.
ملاحظة: لمراقبة إصبع خارج الرحم كامل ، احتضن لمدة ~ 72 ساعة بعد زرع الخرزة. في المقابل ، يتم التعبير عن جينات التمايز المبكر (على سبيل المثال ، Sox9) بعد حوالي 30 دقيقة من زرع حبة غارقة في TGF-ß1.
النتائج
استخدام الخرز المنقوع لتقييم سلوك الخلية في طرف الفرخ الجنيني
لضمان فعالية هذا الفحص ، يجب وضع الخرزة باستمرار وبدقة في الموقع الصحيح ؛ في هذه الحالة ، فإن الجزء البعيد من الرقم البيني الثالث تحت التلال القمية للجلد الخارجي AER (الشكل 1A). يسمح هذا الوضع للجزيء المعني بالانتشار بالتساوي في جميع أنحاء الأنسجة الرقمية. علاوة على ذلك ، تحتوي المنطقة الموجودة أسفل AER على خلايا غير متمايزة تستجيب بسهولة للعلاج. لتقييم التأثيرات على تمايز الخلايا ، يمكن تلطيخ الأجنة باللون الأزرق الألسياني والأحمر أليزارين لإثبات تكوين عناصر الهيكل العظمي (الشكل 1 ب). كما أن مقايسة الخرز المنقوع مناسبة تماما لتقييم موت الخلايا باللون الأحمر المحايد (الشكل 1C) وتنظيم الجينات عن طريق التهجين في الموقع (الشكل 1D). يتم تعيين شريط المقياس عند 250 ميكرومتر.
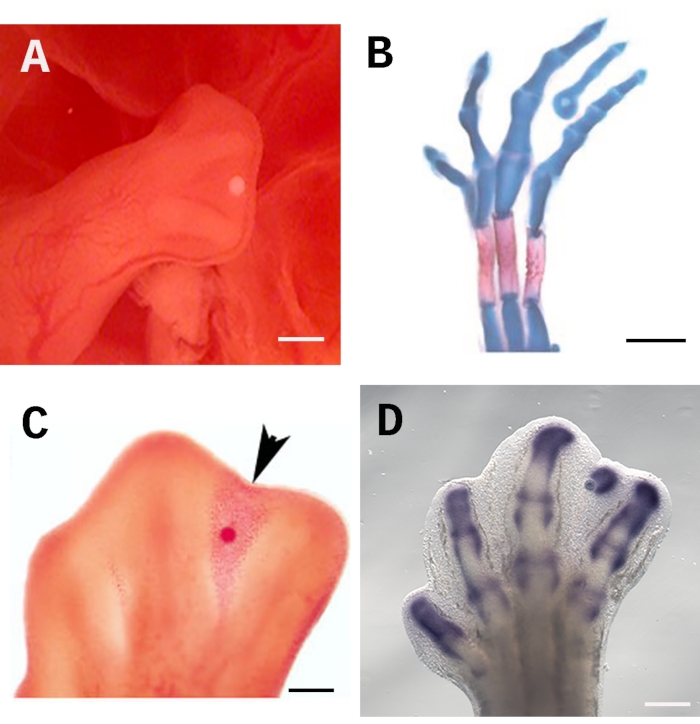
الشكل 1: زرع الخرزة في الأنسجة الرقمية لطرف الفرخ. أ )الموقع الصحيح للخرزة المنقوعة تحت AER في طرف خلفي 28 HH. (ب) الأزرق السياني والأحمر أليزارين تلطيخ الهيكل العظمي دليل على تشكيل رقم خارج الرحم الناجم عن 4 أيام بعد زرع حبة غارقة TGF-ß1. (ج) علامات تلطيخ حمراء محايدة تحريض موت الخلايا (رأس السهم) 24 ساعة بعد زرع حبة غارقة في RA في الأنسجة الرقمية في مرحلة 28 HH. (د) التهجين Sox9 في الموقع 4 ساعات بعد زرع حبة غارقة TGF-ß1. يتم تعيين شريط المقياس عند 250 ميكرومتر. الصور المعروضة في B و C مأخوذة من Díaz-Hernández et al.23,24. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الميزة الرئيسية للأداة التجريبية المفصلة في هذا البروتوكول هي القدرة على التحكم في وقت وموقع التعرض للخرز المنقوع في جزيء تجريبي معين. يوفر الجمع بين تحديد المواقع الصحيح والتوقيت التنموي الدقيق إمكانيات هائلة لدراسة عمليات تمايز الخلايا. يتيح إجراء هذه التجارب في الأنسجة غير المتمايزة التحقيق في الأحداث الحاسمة الأولى في النسب الخلوي. على سبيل المثال ، يؤدي وضع حبة غارقة في TGFß في الأنسجة الرقمية للأطراف الجنينية 28 HH إلى تكوين رقم خارج الرحم يتم فيه تشغيل شلال جزيئي يحفز التعبير الجيني للجيل الرئيسي Sox925. ومن اللافت للنظر أن أنسجة الغضروف المستحثة تنظم أيضا في رقم مع تشكيل الكتائب.
ومن المثير للاهتمام أن التهاب المفاصل الروماتويدي يؤدي إلى موت الخلايا في نفس المنطقة بين الرقمية من خلال تنظيم التعبير الجيني للبروتينات المورفوجينية العظمية التي توجه مصير الخلايا غير المتمايزة نحو موت الخلية10. وبالتالي ، يمكن التحقيق في تمايز الخلايا ، وموت الخلايا ، والتشكل ، والأنماط في وقت واحد في نفس المنطقة من الجنين وتكييفها مع أي منطقة ومسار وراثي ذي أهمية 8,9.
تشمل العناصر الحاسمة لنجاح هذا البروتوكول عدم السماح أبدا للخرز المنقوع بالجفاف (أي أنه يجب أن يظل رطبا دائما). أيضا ، يعد اختيار الخرز المناسب أمرا ضروريا: Affi-Gel وخرز الهيبارين مخصصان للبروتينات ، في حين أن AG1-X2 مخصصان للمواد الكيميائية الذائبة في المذيبات العضوية. نقطة حرجة أخرى هي تركيز الجزيء الموجود في المحلول المستخدم لنقع الخرز ، والذي عادة ما يكون أكثر تركيزا بمقدار 1000 مرة مما يمكن استخدامه في الدراسات المخبرية . ومع ذلك ، فإن إزعاج هذه الطريقة هو أن التركيز النهائي للجزيئات المنبعثة من الخرز المنقوع غير معروف ، وكذلك سرعة الإطلاق. في البروتوكول يذكر أن قطر الخرز 100 ميكرومتر أكثر ملاءمة للاستخدام. ضع في اعتبارك هذا عندما يتم التلاعب بالأطراف. الأهم من ذلك ، يجب اختيار قطر الخرز وفقا لمنطقة الزرع والحفاظ عليه باستمرار في كل جنين. ومع ذلك ، من غير المحتمل أن يؤثر الاختلاف الطفيف في حجم الخرزة بين التجارب على النتائج.
في الختام ، تعتمد إمكانات فحص الخرز المنقوع الموضح هنا فقط على خيال الباحث. يمكن تطبيق هذا البروتوكول على أي تجريبي أو مزرعة خلايا أو نموذج ثقافة عضوي ، بما في ذلك المواد العضوية. علاوة على ذلك ، يعد هذا البروتوكول أداة تعليمية مفيدة ومباشرة لتعليم الطلاب مفاهيم البيولوجيا التنموية الأساسية والمهارات التقنية من خلال ممارسة هذا التلاعب التجريبي في فصول البيولوجيا التنموية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل المديرية العامة للأكاديمية الشخصية (DGAPA) - الجامعة الوطنية المستقلة في المكسيك [أرقام المنح IN211117 و IN213314] والمجلس الوطني للعلوم والتكنولوجيا (CONACyT) [رقم المنحة 1887 CONACyT-Fronteras de la Ciencia] الممنوحة ل JC-M. حصل JC M-L على زمالة ما بعد الدكتوراه من المجلس الوطني للعلوم والتكنولوجيا (CONACyT-Fronteras de la Ciencia-1887). يقدر المؤلفون مساعدة Lic. لوسيا بريتو من معهد التحقيقات الطبية الحيوية، UNAM في إعداد مراجع هذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Affi-Gel Blue Gel beads | Bio-Rad | 153-7302 | |
| AG1-X2 beads | Bio-Rad | 1400123 | |
| Egg incubator | Incumatic de Mexico | Incumatic 1000 | |
| Fine surgical forceps | Fine Science Tools | 9115-10 | |
| Heparine Sepharose beads | Abcam | ab193268 | |
| Petri dish | Nest | 705001 | |
| Stereomicroscope | Zeiss | Stemi DV4 | |
| Tape | NA | NA | |
| Tungsten needle | GoodFellow | E74-15096/01 |
References
- Stapornwongkul, K. S., Vincent, J. P. Generation of extracellular morphogen gradients: the case for diffusion. Nature Reviews Genetics. 22 (6), 393-411 (2021).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Irizarry, J., Stathopoulos, A. Dynamic patterning by morphogens illuminated by cis-regulatory studies. Development. 148 (2), 196113 (2021).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), (2019).
- Marín-Llera, J. C., Garciadiego-Cázares, D., Chimal-Monroy, J. Understanding the cellular and molecular mechanisms that control early cell fate decisions during appendicular skeletogenesis. Frontiers in Genetics. 10, 977 (2019).
- Gurdon, J. B. Embryonic induction--molecular prospects. Development. 99 (3), 285-306 (1987).
- Bouwmeester, T. The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. International Journal of Developmental Biology. 45 (1), 251-258 (2001).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86 (4), 589-598 (1996).
- Cho, K. W., Blumberg, B., Steinbeisser, H., De Robertis, E. M. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell. 67 (6), 1111-1120 (1991).
- Thisse, B., Thisse, C. Formation of the vertebrate embryo: Moving beyond the Spemann organizer. Seminars in Cell & Development Biology. 42, 94-102 (2015).
- Eichele, G., Tickle, C., Alberts, B. M. Microcontrolled release of biologically active compounds in chick embryos: beads of 200-microns diameter for the local release of retinoids. Analytical Biochemistry. 142 (2), 542-555 (1984).
- Tickle, C., Lee, J., Eichele, G. A quantitative analysis of the effect of all-trans-retinoic acid on the pattern of chick wing development. Developmental Biology. 109 (1), 82-95 (1985).
- Vermot, J., Pourquié, O. Retinoic acid coordinates somitogenesis and left-right patterning in vertebrate embryos. Nature. 435 (7039), 215-220 (2005).
- Rodriguez-Leon, J., et al. Retinoic acid regulates programmed cell death through BMP signalling. Nature Cell Biology. 1 (2), 125-126 (1999).
- Rodriguez-Guzman, M., et al. Tendon-muscle crosstalk controls muscle bellies morphogenesis, which is mediated by cell death and retinoic acid signaling. Developmental Biology. 302 (1), 267-280 (2007).
- Cohn, M. J., Izpisúa-Belmonte, J. C., Abud, H., Heath, J. K., Tickle, C. Fibroblast growth factors induce additional limb development from the flank of chick embryos. Cell. 80 (5), 739-746 (1995).
- Ohuchi, H., et al. An additional limb can be induced from the flank of the chick embryo by FGF4. Biochemical and Biophysical Research Communications. 209 (3), 809-816 (1995).
- Abu-Elmagd, M., Goljanek Whysall, K., Wheeler, G., Münsterberg, A. Sprouty2 mediated tuning of signalling is essential for somite myogenesis. BMC Medical Genomics. 8, 8 (2015).
- Gañan, Y., Macias, D., Duterque-Coquillaud, M., Ros, M. A., Hurle, J. M. Role of TGF beta s and BMPs as signals controlling the position of the digits and the areas of interdigital cell death in the developing chick limb autopod. Development. 122 (8), 2349-2357 (1996).
- Merino, R., et al. Morphogenesis of digits in the avian limb is controlled by FGFs, TGFbetas, and noggin through BMP signaling. Developmental Biology. 200 (1), 35-45 (1998).
- Montero, J. A., Lorda-Diez, C. I., Gañan, Y., Macias, D., Hurle, J. M. Activin/TGFbeta and BMP crosstalk determines digit chondrogenesis. Developmental Biology. 321 (2), 343-356 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Díaz-Hernández, M. E., Bustamante, M., Galván-Hernández, C. I., Chimal-Monroy, J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One. 8 (3), 58549 (2013).
- Díaz-Hernández, M. E., Rios-Flores, A. J., Abarca-Buis, R. F., Bustamante, M., Chimal-Monroy, J. Molecular control of interdigital cell death and cell differentiation by retinoic acid during digit development. Journal of Developmental Biology. 2 (2), 138-157 (2014).
- Chimal-Monroy, J., et al. Analysis of the molecular cascade responsible for mesodermal limb chondrogenesis: Sox genes and BMP signaling. Developmental Biology. 257 (2), 292-301 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved