Method Article
Analisi della differenziazione cellulare, della morfogenesi e del pattern durante l'embriogenesi del pollo utilizzando il test Soaked-Bead
In questo articolo
Riepilogo
Il test del tallone imbevuto prevede la consegna mirata del reagente di prova in qualsiasi momento dello sviluppo per studiare la regolazione della differenziazione cellulare e della morfogenesi. Viene presentato un protocollo dettagliato, applicabile a qualsiasi modello animale sperimentale, per preparare tre diversi tipi di perline imbevute e impiantarle nell'interdigit di un embrione di pollo.
Abstract
Una moltitudine di programmi genetici viene attivata durante lo sviluppo embrionale che orchestra la differenziazione cellulare per generare una sorprendente diversità di cellule somatiche, tessuti e organi. L'attivazione precisa di questi programmi genetici è regolata dai morfogeni, molecole diffusibili che dirigono il destino cellulare a diverse soglie. Capire come l'attivazione genetica coordina la morfogenesi richiede lo studio delle interazioni locali innescate dai morfogeni durante lo sviluppo. L'uso di perline imbevute di proteine o farmaci impiantati in regioni distinte dell'embrione consente di studiare il ruolo di molecole specifiche nella creazione di dita e altri processi di sviluppo. Questa tecnica sperimentale fornisce informazioni sul controllo dell'induzione cellulare, del destino cellulare e della formazione del modello. Pertanto, questo test di perline imbevute è uno strumento sperimentale estremamente potente e prezioso applicabile ad altri modelli embrionali.
Introduzione
Le scoperte nei meccanismi molecolari che controllano l'espressione genica durante lo sviluppo embrionale ci hanno permesso di capire come viene determinato il destino cellulare. L'impegno verso diverse linee cellulari si verifica una volta che le cellule iniziano l'espressione molecolare dei fattori di trascrizione1. Questo modello di espressione è altamente coordinato nello spazio e nel tempo e quindi dirige la modellazione, il posizionamento e il pattern di cellule, tessuti e organi 1,2,3,4,5. L'induzione embrionale è il processo attraverso il quale le cellule sono impegnate in lignaggi specifici stabilendo gerarchie che limitano le potenzialità delle cellule, che includono anche la generazione del piano corporeo di base come avviene con l'organizzatore spemann 6,7. Il labbro dorsale blastopore induce un secondo asse embrionale in un embrione ospite 8,9. Oggi, con l'aiuto dell'innesto e di altri esperimenti classici combinati con approcci molecolari, è noto che diversi fattori di trascrizione e fattori di crescita funzionano per dirigere l'induzione embrionale nell'organizzatore di Spemann10. Pertanto, la manipolazione sperimentale è uno strumento importante per comprendere la differenziazione cellulare, la morfogenesi e i processi di patterning durante l'embriogenesi.
È interessante notare che, nei sistemi embrionali in cui il trapianto di tessuto è difficile o quando gli induttori sono già ben noti, i vettori vengono utilizzati per fornire molecole (ad esempio, proteine, sostanze chimiche, tossine, ecc.) per regolare la differenziazione cellulare, la morfogenesi e persino il patterning. Uno di questi sistemi di trasporto prevede l'impianto di perline imbevute di una molecola specifica in qualsiasi organismo modello sperimentale in qualsiasi momento di sviluppo per determinare l'effetto di detto reagente o dirigere la differenziazione di detto modello. Ad esempio, impiantando perline imbevute di acido retinoico (RA) nel bocciolo dell'arto dell'ala di pollo, Cheryl Tickle et al. (1985) hanno dimostrato che RA induce l'espressione del riccio sonico nella zona di attività polarizzante (ZPA)11,12. La stessa strategia sperimentale è stata utilizzata per scoprire che l'AR controlla l'asimmetria dei somiti e la morte cellulare nella gemma dell'arto durante lo sviluppo delle dita e in altre regioni embrionali degli arti 13,14,15. Altri fattori, principalmente proteine (ad esempio, fattori di crescita dei fibroblasti [FGF], fattore di crescita trasformante-beta [TGF-ß]) sono stati utilizzati per indurre arti nei fianchi degli embrioni precoci e nuove cifre nella regione interdigitale, rispettivamente 16,17,18,19,20,21 . Questi esperimenti dimostrano il potere e l'utilità di questa tecnica per determinare lo stadio di impegno o competenza dei tessuti o dei gruppi di cellule esposte alle molecole.
In questo protocollo, l'arto del pulcino nella fase di formazione delle dita è servito come modello sperimentale per presentare passo dopo passo come preparare e impiantare le perline imbevute. Tuttavia, questo strumento sperimentale non si limita a questa applicazione, ma può essere sfruttato in qualsiasi modello animale sperimentale e in qualsiasi punto temporale in vitro e in vivo per studiare l'induzione, la differenziazione, la morte cellulare e il patterning.
Protocollo
Questa ricerca è stata esaminata e approvata dall'Institutional Review Board for the Care and Use of Laboratory Animals dell'Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México (UNAM, Città del Messico, Messico).
1. Incubazione dell'uovo e stadiazione dell'embrione
NOTA: Le uova di gallina fecondate possono essere ottenute da allevamenti locali. Le uova di gallina Livorno bianca fecondate sono più comunemente usate. Conservare le uova di gallina appena fecondate a 15 °C per un massimo di 1 settimana prima dell'incubazione.
- Incubare le uova di gallina fecondate verticalmente con il lato appuntito verso il basso in un incubatore umidificato a 38 ° C e 70% di umidità relativa fino a raggiungere lo stadio 28 HH (circa 5,5 giorni secondo Hamilton e Hamburger, 1951) 22. Ruotare le uova durante l'incubazione per evitare che l'embrione aderisca alla membrana del guscio.
NOTA: La scelta dello stadio di sviluppo è informata dagli obiettivi sperimentali. In questo caso, lo stadio 28 HH è ottimale per l'impianto di perline interdigit per indurre una cifra ectopica o promuovere la morte cellulare. - Rimuovere le uova dall'incubatrice, tamponarle con etanolo al 70% e lasciarle asciugare all'aria. Disinfettare l'area di lavoro, i microscopi e gli strumenti con il 70% di etanolo.
- Candela l'uovo per identificare i vasi sanguigni e localizzare l'embrione. Scartare le uova che non hanno un embrione.
- Usando l'estremità della pinza non dentata, apri una finestra in circa cinque uova toccando l'estremità smussata di un uovo e rimuovi una sezione di 1 cm2 del guscio con la pinza.
- Trasferire l'uovo in un cartone o in un supporto di plastica e posizionarlo sotto lo stereomicroscopio. Rimuovere la membrana dell'aria perforandola ed estraendola con una pinza chirurgica fine. Rimuovere qualsiasi piccolo pezzo di guscio d'uovo che potrebbe contattare l'embrione.
NOTA: La membrana dell'aria è la membrana bianca e opaca osservata immediatamente dopo la finestra dell'uovo. - Osservare al microscopio mentre si apre leggermente il sacco amniotico, strappandolo usando la pinza chirurgica fine. Fare attenzione a non danneggiare la vascolarizzazione della membrana corioallantoica.
NOTA: L'amnione è la membrana trasparente che circonda strettamente l'embrione che lo incapsula nel liquido amniotico. - Metti in scena gli embrioni in ovo per determinare se sono nella fase desiderata. Gli embrioni nelle fasi precedenti possono essere restituiti all'incubatrice dopo aver sigillato la finestra del guscio d'uovo con del nastro.
2. Preparazione delle perline
NOTA: A seconda dello scopo sperimentale e del trattamento in questione, i tipi di perline alternative (ad esempio, Affi-Gel, AG1-X2, eparina) possono essere più adatti. Le perle Affi-Gel sono ottimali per le proteine (ad esempio, TGF-ß1), mentre le perle di eparina sono ideali per i fattori di crescita (ad esempio, FGF, WNT) e le perle AG1-X2 per sostanze chimiche solubilizzate in solventi organici (ad esempio, DMSO).
- Preparazione di Affi-Gel ed eparina
- Taglia un quadrato di parafilm per adattarlo a una piastra di Petri da 45 mm. Posizionare il parafilm sul fondo della capsula di Petri per coprirlo e fissarlo al fondo della capsula di Petri spingendo ogni vertice usando l'estremità della pinza non dentata. Accantonare.
- Utilizzando una pipetta o una spatola, trasferire le perline in un tubo microcentrifuga e lavarle due volte in 1x PBS mediante sedimentazione e pipettaggio.
- Trasferire ~ 40-50 perline con una micropipetta al centro della piastra di Petri parafilmata dal passaggio 1.
- Utilizzando il microscopio, selezionare ~ 30 Affi-Gel o perline di eparina ~ 100 μm di diametro per l'uso. Utilizzare un reticolo oculare per microscopio per dimensionare le perline o utilizzare la terza interdigit di un embrione HH 28 come riferimento; il tallone deve essere più piccolo dell'interdigit.
- Rimuovere con attenzione il più possibile il PBS in eccesso che circonda le perline e immergerle in 2-5 μL della soluzione di trattamento. Assicurarsi che la soluzione copra completamente le perline.
- In parallelo, preparare le perle di controllo immergendole in una soluzione che contiene la stessa quantità di veicolo utilizzata nella soluzione di trattamento sperimentale.
NOTA: le concentrazioni devono essere calcolate per ogni trattamento in base all'esperimento. Utilizzare i dispositivi di protezione individuale appropriati quando si maneggiano reagenti potenzialmente dannosi. - Incubare le perline nella soluzione per 30 minuti a temperatura ambiente. Per evitare che le perline si secchino durante l'incubazione, pipettare alcune gocce di 1x PBS o acqua intorno alle perline per umidificare l'atmosfera locale e coprire il piatto con parafilm per rallentare l'evaporazione.
- Posizionare la capsula di Petri sul ghiaccio e impiantare le perline entro lo stesso giorno.
- Preparazione per perline AG 1-X2
- Taglia un quadrato di parafilm per adattarlo a una piastra di Petri da 45 mm. Coprire il fondo della capsula di Petri con parafilm e apporre spingendo ogni vertice usando l'estremità della pinza non dentata. Accantonare.
- Utilizzare una spatola per trasferire le perle AG 1-X2 in un tubo microcentrifuga. Aggiungere 30-50 μL della soluzione di trattamento alla concentrazione finale desiderata.
- In parallelo, incubare le perle di controllo in una soluzione con il solo veicolo, preparato senza la sostanza chimica sperimentale o la proteina di interesse.
- Incubare le perline per 20 minuti agitando lentamente a temperatura ambiente. Avvolgere i tubi microcentrifuga con un foglio per proteggerli dalla luce durante tutta l'incubazione, dato che molte di queste molecole sono sensibili alla luce
- Rimuovere il più possibile la soluzione utilizzando una pipetta e macchiare con il 2% di rosso fenolo disciolto in acqua a temperatura ambiente per 2 minuti con lieve agitazione in un vortice.
NOTA: La tintura delle perle trasparenti AG 1-X2 facilita il loro impianto nell'embrione. - Rimuovere il rosso fenolo al 2% e lavare le perline due volte in 1x PBS per rimuovere qualsiasi colorante in eccesso.
- Con una punta a micropipetta, trasferire ~ 40-50 AG 1-X2 perline al centro della capsula di Petri ricoperta di parafilm preparata nel passaggio 1 e immergerle in 5 μL di 1x PBS. Al microscopio, selezionare circa 30 perline di dimensioni ~ 100 μm. Scartare le perline inutilizzate.
- Le perline sono pronte per l'impianto. Assicurarsi che le perline siano immerse nel PBS durante l'impianto pipettando alcune gocce di 1x PBS o acqua intorno alle perline per umidificare l'atmosfera locale e / o coprire il piatto con parafilm per rallentare l'evaporazione.
3. Manipolazione embrionale e impianto interdigit
- Prima di manipolare gli embrioni, disporre due stereomicroscopi uno accanto all'altro su un banco. Uno è per la manipolazione dell'embrione e l'impianto di perline, e l'altro è per mantenere le perle trattate pronte per l'impianto nell'embrione.
- Usando una pinza non dentata, crea una finestra nelle uova rimanenti come descritto nella sezione di incubazione dell'uovo e stadiazione dell'embrione.
- Al microscopio, aprire il sacco amniotico strappando la membrana amniotica con una pinza chirurgica fine vicino all'arto posteriore destro solo per la quantità necessaria per eseguire la procedura (cioè, il meno possibile).
- Usando una pinza fine, tenere l'embrione per la membrana amniotica per esporre l'arto posteriore destro. Usando un ago di tungsteno fine, fai un buco centrato nella parte distale della terza interdigit del retrobra.
- Senza rilasciare l'embrione e l'arto posteriore esposto, prendi una perla trattata dall'altro microscopio usando una delle punte della pinza. La pinza deve essere in posizione aperta affinché una perla aderisca alla punta della pinza.
- Trasferire il tallone nell'embrione di pulcino vicino all'arto posteriore e posizionarlo sopra il foro dell'interdigit.
- Chiudere la pinza per esercitare pressione sul tallone fino a quando non entra nel foro.
- Rilasciare l'embrione e sigillare la finestra del guscio d'uovo con del nastro adesivo.
- Restituire le uova all'incubatrice fino a quando non hanno raggiunto lo stadio richiesto. Ripetere la procedura fino a raggiungere il numero richiesto di embrioni manipolati. È imperativo assicurarsi che le perline non si asciughino in nessun punto.
NOTA: Per osservare un dito ectopico completo, incubare per ~ 72 ore dopo l'impianto del tallone. Al contrario, i geni di differenziazione precoce (ad esempio, Sox9) sono espressi ~ 30 minuti dopo l'impianto di una perla imbevuta di TGF-ß1.
Risultati
Utilizzo di perline imbevute per valutare il comportamento cellulare nell'arto embrionale del pulcino
Per garantire l'efficacia di questo test, il tallone deve essere posizionato in modo coerente e preciso nella posizione corretta; in questo caso, la maggior parte distale della terza interdigit sotto la cresta ectodermica apicale AER (Figura 1A). Questo posizionamento permette alla molecola in questione di diffondersi equamente in tutto il tessuto interdigitale. Inoltre, la zona sotto l'AER contiene cellule indifferenziate che rispondono prontamente al trattamento. Per valutare gli effetti sulla differenziazione cellulare, gli embrioni possono essere colorati con blu alciano e rosso alizarina per evidenziare la formazione di elementi scheletrici (Figura 1B). Il test del tallone imbevuto è anche adatto per valutare la morte cellulare con rosso neutro (Figura 1C) e la regolazione genica mediante ibridazione in situ (Figura 1D). La barra della scala è impostata a 250 μm.
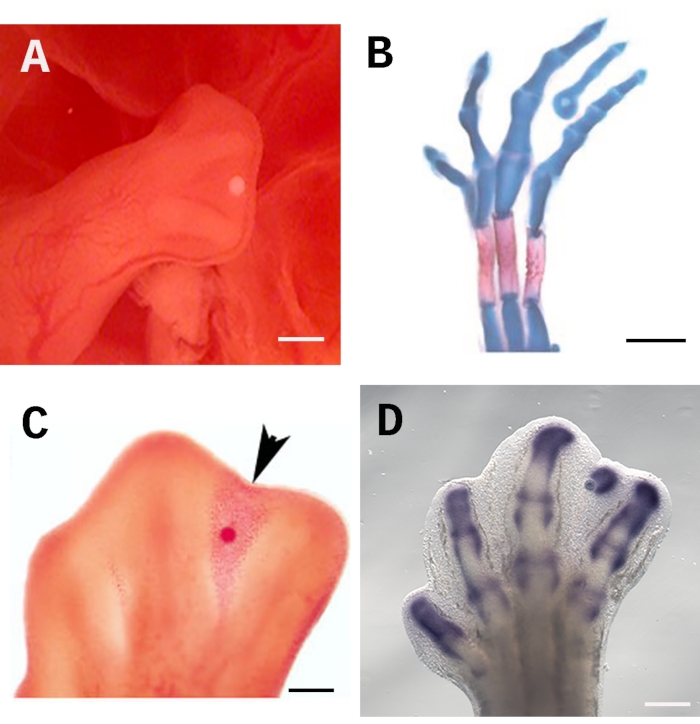
Figura 1: Impianto di perline nel tessuto interdigitale dell'arto del pulcino.( A) La posizione corretta per il tallone imbevuto sotto l'AER in un arto posteriore di 28 HH. (B) La colorazione scheletrica blu di Alcian e rosso di Alizarina evidenzia la formazione di una cifra ectopica indotta 4 giorni dopo l'impianto di una perla imbevuta di TGF-ß1. (C) La colorazione rossa neutra segna l'induzione della morte cellulare (punta di freccia) 24 ore dopo aver impiantato una perla imbevuta di RA nel tessuto interdigitale allo stadio 28 HH. (D) Ibridazione in situ di Sox9 4 ore dopo l'impianto di una perla imbevuta di TGF-ß1. La barra della scala è impostata a 250 μm. Le immagini mostrate in B e C sono state prese da Díaz-Hernández et al.23,24. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il vantaggio principale dello strumento sperimentale dettagliato in questo protocollo è quello di poter controllare il tempo e la posizione dell'esposizione alle perline imbevute di una determinata molecola sperimentale. La combinazione del corretto posizionamento con tempi di sviluppo precisi offre enormi possibilità per studiare i processi di differenziazione cellulare. L'esecuzione di questi esperimenti nel tessuto indifferenziato consente di indagare i primi eventi cruciali nel lignaggio cellulare. Ad esempio, posizionando una perla imbevuta di TGFß nel tessuto interdigitale degli arti embrionali 28 HH si ottiene la formazione di una cifra ectopica in cui viene attivata una cascata molecolare che induce l'espressione genetica della master gen Sox925. Sorprendentemente, il tessuto cartilagineo indotto si organizza anche in una cifra con formazione di falange.
È interessante notare che l'AR innesca la morte cellulare nella stessa regione interdigitale regolando l'espressione genica delle proteine morfogenetiche ossee che dirigono il destino cellulare delle cellule indifferenziate verso la morte cellulare10. Quindi, la differenziazione cellulare, la morte cellulare, la morfogenesi e il pattern possono essere contemporaneamente studiati nella stessa regione di un embrione e adattati a qualsiasi regione e percorso genetico di interesse 8,9.
Gli elementi cruciali per il successo di questo protocollo includono non lasciare mai asciugare le perline imbevute (cioè, devono sempre rimanere bagnate). Inoltre, la selezione delle perline appropriate è essenziale: Affi-Gel e eparina sono per le proteine, mentre AG1-X2 sono per le sostanze chimiche disciolte in solventi organici. Un altro punto critico è la concentrazione della molecola contenuta nella soluzione utilizzata per immergere le perline, che di solito è 1000 volte più concentrata di quella che verrebbe utilizzata per gli studi in vitro . Tuttavia, un inconveniente di questo metodo è che la concentrazione finale di molecole rilasciate dalle perle imbevute è sconosciuta, così come la velocità di rilascio. Nel protocollo è menzionato che il diametro di perline-100 μm è più conveniente per l'uso. Considera questo quando gli arti sono manipolati. Ancora più importante, il diametro delle perline deve essere selezionato in base alla zona di impianto e mantenuto in modo coerente in ciascun embrione. Tuttavia, una leggera variazione delle dimensioni del tallone tra gli esperimenti non è probabile che influenzi i risultati.
In conclusione, il potenziale del saggio di perline imbevute qui delineato dipende solo dall'immaginazione del ricercatore. Questo protocollo può essere applicato a qualsiasi animale da esperimento, coltura cellulare o modello di coltura organotipica, inclusi gli organoidi. Inoltre, questo protocollo è uno strumento educativo utile e diretto per insegnare agli studenti concetti di biologia dello sviluppo di base e abilità tecniche praticando questa manipolazione sperimentale nelle lezioni di biologia dello sviluppo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Dirección General de Asuntos del Personal Académico (DGAPA)-Universidad Nacional Autónoma de México [numeri di sovvenzione IN211117 e IN213314] e dal Consejo Nacional de Ciencia y Tecnología (CONACyT) [numero di sovvenzione 1887 CONACyT-Fronteras de la Ciencia] assegnato a JC-M. JC M-L ha ricevuto una borsa di studio post-dottorato dal Consejo Nacional de Ciencia y Tecnología (CONACyT-Fronteras de la Ciencia-1887). Gli autori apprezzano l'aiuto di Lic. Lucia Brito dell'Instituto de Investigaciones Biomédicas, UNAM nella preparazione dei riferimenti di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Affi-Gel Blue Gel beads | Bio-Rad | 153-7302 | |
| AG1-X2 beads | Bio-Rad | 1400123 | |
| Egg incubator | Incumatic de Mexico | Incumatic 1000 | |
| Fine surgical forceps | Fine Science Tools | 9115-10 | |
| Heparine Sepharose beads | Abcam | ab193268 | |
| Petri dish | Nest | 705001 | |
| Stereomicroscope | Zeiss | Stemi DV4 | |
| Tape | NA | NA | |
| Tungsten needle | GoodFellow | E74-15096/01 |
Riferimenti
- Stapornwongkul, K. S., Vincent, J. P. Generation of extracellular morphogen gradients: the case for diffusion. Nature Reviews Genetics. 22 (6), 393-411 (2021).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Irizarry, J., Stathopoulos, A. Dynamic patterning by morphogens illuminated by cis-regulatory studies. Development. 148 (2), 196113 (2021).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), (2019).
- Marín-Llera, J. C., Garciadiego-Cázares, D., Chimal-Monroy, J. Understanding the cellular and molecular mechanisms that control early cell fate decisions during appendicular skeletogenesis. Frontiers in Genetics. 10, 977 (2019).
- Gurdon, J. B. Embryonic induction--molecular prospects. Development. 99 (3), 285-306 (1987).
- Bouwmeester, T. The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. International Journal of Developmental Biology. 45 (1), 251-258 (2001).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86 (4), 589-598 (1996).
- Cho, K. W., Blumberg, B., Steinbeisser, H., De Robertis, E. M. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell. 67 (6), 1111-1120 (1991).
- Thisse, B., Thisse, C. Formation of the vertebrate embryo: Moving beyond the Spemann organizer. Seminars in Cell & Development Biology. 42, 94-102 (2015).
- Eichele, G., Tickle, C., Alberts, B. M. Microcontrolled release of biologically active compounds in chick embryos: beads of 200-microns diameter for the local release of retinoids. Analytical Biochemistry. 142 (2), 542-555 (1984).
- Tickle, C., Lee, J., Eichele, G. A quantitative analysis of the effect of all-trans-retinoic acid on the pattern of chick wing development. Developmental Biology. 109 (1), 82-95 (1985).
- Vermot, J., Pourquié, O. Retinoic acid coordinates somitogenesis and left-right patterning in vertebrate embryos. Nature. 435 (7039), 215-220 (2005).
- Rodriguez-Leon, J., et al. Retinoic acid regulates programmed cell death through BMP signalling. Nature Cell Biology. 1 (2), 125-126 (1999).
- Rodriguez-Guzman, M., et al. Tendon-muscle crosstalk controls muscle bellies morphogenesis, which is mediated by cell death and retinoic acid signaling. Developmental Biology. 302 (1), 267-280 (2007).
- Cohn, M. J., Izpisúa-Belmonte, J. C., Abud, H., Heath, J. K., Tickle, C. Fibroblast growth factors induce additional limb development from the flank of chick embryos. Cell. 80 (5), 739-746 (1995).
- Ohuchi, H., et al. An additional limb can be induced from the flank of the chick embryo by FGF4. Biochemical and Biophysical Research Communications. 209 (3), 809-816 (1995).
- Abu-Elmagd, M., Goljanek Whysall, K., Wheeler, G., Münsterberg, A. Sprouty2 mediated tuning of signalling is essential for somite myogenesis. BMC Medical Genomics. 8, 8 (2015).
- Gañan, Y., Macias, D., Duterque-Coquillaud, M., Ros, M. A., Hurle, J. M. Role of TGF beta s and BMPs as signals controlling the position of the digits and the areas of interdigital cell death in the developing chick limb autopod. Development. 122 (8), 2349-2357 (1996).
- Merino, R., et al. Morphogenesis of digits in the avian limb is controlled by FGFs, TGFbetas, and noggin through BMP signaling. Developmental Biology. 200 (1), 35-45 (1998).
- Montero, J. A., Lorda-Diez, C. I., Gañan, Y., Macias, D., Hurle, J. M. Activin/TGFbeta and BMP crosstalk determines digit chondrogenesis. Developmental Biology. 321 (2), 343-356 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Díaz-Hernández, M. E., Bustamante, M., Galván-Hernández, C. I., Chimal-Monroy, J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One. 8 (3), 58549 (2013).
- Díaz-Hernández, M. E., Rios-Flores, A. J., Abarca-Buis, R. F., Bustamante, M., Chimal-Monroy, J. Molecular control of interdigital cell death and cell differentiation by retinoic acid during digit development. Journal of Developmental Biology. 2 (2), 138-157 (2014).
- Chimal-Monroy, J., et al. Analysis of the molecular cascade responsible for mesodermal limb chondrogenesis: Sox genes and BMP signaling. Developmental Biology. 257 (2), 292-301 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon