Method Article
Analyse de la différenciation cellulaire, de la morphogenèse et de la modelation au cours de l’embryogenèse du poulet à l’aide du test des perles trempées
Dans cet article
Résumé
Le test des billes trempées implique l’administration ciblée de réactif de test à n’importe quel moment du développement pour étudier la régulation de la différenciation cellulaire et de la morphogenèse. Un protocole détaillé, applicable à tout modèle animal expérimental, pour préparer trois types différents de perles trempées et les implanter dans l’interdigit d’un embryon de poulet est présenté.
Résumé
Une multitude de programmes génétiques sont activés au cours du développement embryonnaire qui orchestre la différenciation cellulaire pour générer une diversité étonnante de cellules somatiques, de tissus et d’organes. L’activation précise de ces programmes génétiques est régulée par des morphogènes, des molécules diffusibles qui dirigent le destin cellulaire à différents seuils. Comprendre comment l’activation génétique coordonne la morphogenèse nécessite l’étude des interactions locales déclenchées par les morphogènes au cours du développement. L’utilisation de perles imbibées de protéines ou de médicaments implantés dans des régions distinctes de l’embryon permet d’étudier le rôle de molécules spécifiques dans l’établissement des doigts et d’autres processus de développement. Cette technique expérimentale fournit des informations sur le contrôle de l’induction cellulaire, du devenir cellulaire et de la formation de motifs. Ainsi, ce test de perles trempées est un outil expérimental extrêmement puissant et précieux applicable à d’autres modèles embryonnaires.
Introduction
Les percées dans les mécanismes moléculaires qui contrôlent l’expression des gènes au cours du développement embryonnaire nous ont permis de comprendre comment le devenir cellulaire est déterminé. L’engagement envers différentes lignées cellulaires se produit une fois que les cellules commencent l’expression moléculaire des facteurs de transcription1. Ce modèle d’expression est hautement coordonné dans l’espace et le temps et dirige ainsi la mise en forme, le positionnement et le modelage des cellules, des tissus et des organes 1,2,3,4,5. L’induction embryonnaire est le processus par lequel les cellules sont engagées dans des lignées spécifiques en établissant des hiérarchies qui limitent la potentialité des cellules, qui incluent même la génération du plan corporel de base comme cela se produit avec l’organisateur spemann 6,7. La lèvre dorsale blastopore induit un deuxième axe embryonnaire chez un embryon hôte 8,9. Aujourd’hui, à l’aide de greffes et d’autres expériences classiques combinées à des approches moléculaires, on sait que différents facteurs de transcription et facteurs de croissance fonctionnent pour diriger l’induction embryonnaire dans l’organisateur spemann10. Ainsi, la manipulation expérimentale est un outil important pour comprendre la différenciation cellulaire, la morphogenèse et les processus de modelage au cours de l’embryogenèse.
Fait intéressant, dans les systèmes embryonnaires où la transplantation de tissus est difficile ou lorsque les inducteurs sont déjà bien connus, les porteurs sont utilisés pour délivrer des molécules (par exemple, protéines, produits chimiques, toxines, etc.) pour réguler la différenciation cellulaire, la morphogenèse et même le modelage. L’un de ces systèmes porteurs consiste à implanter des billes imbibées dans une molécule spécifique dans tout organisme modèle expérimental à n’importe quel moment de développement pour déterminer l’effet dudit réactif ou diriger la différenciation dudit modèle. Par exemple, en implantant des perles imbibées d’acide rétinoïque (PR) dans le bourgeon du membre de l’aile de poulet, Cheryl Tickle et coll. (1985) ont démontré que la PR induit l’expression du hérisson sonique dans la zone d’activité polarisante (ZPA)11,12. La même stratégie expérimentale a été utilisée pour découvrir que la PR contrôle l’asymétrie des somites et la mort cellulaire dans le bourgeon du membre pendant le développement des doigts et dans d’autres régions embryonnaires des membres 13,14,15. D’autres facteurs, principalement des protéines (par exemple, les facteurs de croissance des fibroblastes [FGF], le facteur de croissance transformant bêta [TGF-ß]) ont été utilisés pour induire des membres dans les flancs des embryons précoces et de nouveaux chiffres dans la région interdigitale, respectivement 16,17,18,19,20,21 . Ces expériences démontrent la puissance et l’utilité de cette technique pour déterminer le stade d’engagement ou de compétence des tissus ou groupes de cellules exposés aux molécules.
Dans ce protocole, le membre du poussin au stade de la formation des doigts a servi de modèle expérimental pour présenter étape par étape comment préparer et implanter les perles trempées. Cependant, cet outil expérimental ne se limite pas à cette application, mais peut être exploité dans n’importe quel modèle animal expérimental et n’importe quel point temporel in vitro et in vivo pour étudier l’induction, la différenciation, la mort cellulaire et le modelage.
Protocole
Cette recherche a été examinée et approuvée par le Comité d’examen institutionnel pour le soin et l’utilisation des animaux de laboratoire de l’Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México (UNAM, Mexico, Mexique).
1. Incubation d’ovules et stadification embryonnaire
REMARQUE: Les œufs de poule fécondés peuvent être obtenus dans les fermes locales. Les œufs de poule fertilisés à Livourne blanche sont les plus couramment utilisés. Conservez les œufs de poule fraîchement fécondés à 15 °C jusqu’à 1 semaine avant l’incubation.
- Incuber les œufs de poule fécondés verticalement avec le côté pointu vers le bas dans un incubateur humidifié à 38 °C et 70 % d’humidité relative jusqu’à ce qu’ils atteignent le stade de 28 HH (environ 5,5 jours selon Hamilton et Hamburger, 1951)22. Faites pivoter les œufs pendant l’incubation pour empêcher l’embryon d’adhérer à la membrane de la coquille.
NOTE: Le choix du stade de développement est éclairé par les objectifs expérimentaux. Dans ce cas, le stade 28 HH est optimal pour l’implantation de billes interdigites afin d’induire un chiffre ectopique ou de favoriser la mort cellulaire. - Retirez les œufs de l’incubateur, écouvillonnez-les avec de l’éthanol à 70% et laissez-les sécher à l’air. Désinfectez la zone de travail, les microscopes et les instruments avec de l’éthanol à 70%.
- Bougie l’œuf pour identifier les vaisseaux sanguins et localiser l’embryon. Jetez les œufs qui n’ont pas d’embryon.
- À l’aide de l’extrémité d’une pince non dentée, ouvrez une fenêtre dans environ cinq œufs en tapotant l’extrémité émoussée d’un œuf et retirez une section de 1 cm2 de la coquille avec la pince.
- Transférer l’œuf dans un support en carton ou en plastique et le placer sous le stéréomicroscope. Retirez la membrane d’air en perforant et en la tirant avec une pince chirurgicale fine. Retirez tout petit morceau de coquille d’œuf qui pourrait entrer en contact avec l’embryon.
REMARQUE: La membrane d’air est la membrane blanche et opaque observée immédiatement après le fenêtrage de l’œuf. - Observez au microscope tout en ouvrant légèrement le sac amniotique, en le déchirant à l’aide de la pince chirurgicale fine. Veillez à ne pas endommager le système vasculaire de la membrane chorioallantoïque.
REMARQUE: L’amnion est la membrane transparente entourant étroitement l’embryon qui l’encapsule dans le liquide amniotique. - Mettez les embryons en scène pour déterminer s’ils sont au stade souhaité. Les embryons à un stade précoce peuvent être renvoyés à l’incubateur après avoir scellé la fenêtre de la coquille d’œuf avec du ruban adhésif.
2. Préparation des perles
REMARQUE: Selon le but expérimental et le traitement en question, d’autres types de billes (par exemple, Affi-Gel, AG1-X2, héparine) peuvent être plus appropriés. Les billes Affi-Gel sont optimales pour les protéines (par exemple, TGF-ß1), tandis que les perles d’héparine sont idéales pour les facteurs de croissance (par exemple, les FGF, WNT) et les billes AG1-X2 pour les produits chimiques solubilisés dans des solvants organiques (par exemple, DMSO).
- Affi-Gel et préparation de perles d’héparine
- Coupez un carré de parafilm pour l’adapter à une boîte de Petri de 45 mm. Placez le parafilm au fond de la boîte de Pétri pour le couvrir et fixez-le au fond de la boîte de Pétri en poussant chaque sommet à l’aide de l’extrémité d’une pince non dentée. Réserver.
- À l’aide d’une pipette ou d’une spatule, transférer les billes dans un tube de microcentrifugation et les laver deux fois dans 1x PBS en les déposant et en les pipetant.
- Transférer ~ 40-50 perles avec une micropipette au centre de la boîte de Petri parafilmée à partir de l’étape 1.
- À l’aide du microscope, sélectionnez ~30 Affi-Gel ou perles d’héparine ~100 μm de diamètre pour l’utilisation. Utilisez un réticule oculaire de microscope pour dimensionner les perles ou utilisez le troisième interdigit d’un embryon HH 28 comme référence; la perle doit être plus petite que l’interdigit.
- Retirez soigneusement autant que possible l’excès de PBS entourant les billes et faites-les tremper dans 2 à 5 μL de la solution de traitement. Assurez-vous que la solution couvre complètement les perles.
- En parallèle, préparez les billes de contrôle en les trempant dans une solution qui contient la même quantité de véhicule que celle utilisée dans la solution de traitement expérimentale.
REMARQUE: Les concentrations doivent être calculées pour chaque traitement en fonction de l’expérience. Utilisez l’équipement de protection individuelle approprié lorsque vous manipulez des réactifs potentiellement nocifs. - Incuber les billes dans la solution pendant 30 min à température ambiante. Pour éviter que les perles ne se dessèchent pendant l’incubation, pipettez quelques gouttes de 1x PBS ou d’eau autour des perles pour humidifier l’atmosphère locale et recouvrir le plat de parafilm pour ralentir l’évaporation.
- Placez la boîte de Petri sur de la glace et implantez les perles dans la même journée.
- AG 1-X2 préparation de billes
- Coupez un carré de parafilm pour l’adapter à une boîte de Petri de 45 mm. Couvrir le fond de la boîte de Petri avec un parafilm et apposer en poussant chaque sommet à l’aide de l’extrémité d’une pince non dentée. Réserver.
- Utilisez une spatule pour transférer les billes AG 1-X2 dans un tube de microcentrifugation. Ajouter 30-50 μL de la solution de traitement à la concentration finale souhaitée.
- En parallèle, incuber les billes de contrôle dans une solution avec le véhicule seul, préparée sans le produit chimique expérimental ou la protéine d’intérêt.
- Incuber les perles pendant 20 min tout en secouant lentement à température ambiante. Enveloppez les tubes de microcentrifugation avec une feuille pour les protéger de la lumière pendant toute l’incubation, étant donné que beaucoup de ces molécules sont sensibles à la lumière
- Retirer autant de solution que possible à l’aide d’une pipette et tacher avec 2% de rouge phénol dissous dans de l’eau à température ambiante pendant 2 min avec une légère agitation dans un vortex.
REMARQUE: La teinture des perles transparentes AG 1-X2 facilite leur implantation dans l’embryon. - Retirez le rouge phénol à 2% et lavez les billes deux fois dans 1x PBS pour éliminer tout excès de colorant.
- À l’aide d’une pointe de micropipette, transférez ~40-50 perles AG 1-X2 au centre de la boîte de Petri recouverte de parafilm préparée à l’étape 1 et faites-les tremper dans 5 μL de 1x PBS. Sous le microscope, sélectionnez environ 30 perles d’une taille d’environ 100 μm. Jetez les perles inutilisées.
- Les perles sont prêtes à être implantées. Assurez-vous que les billes sont immergées dans le PBS tout au long de l’implantation en pipetant quelques gouttes de PBS 1x ou d’eau autour des perles pour humidifier l’atmosphère locale et / ou couvrir le plat avec un parafilm pour ralentir l’évaporation.
3. Manipulation d’embryons et implantation interdigit
- Avant de manipuler les embryons, disposez deux stéréomicroscopes l’un à côté de l’autre sur une paillasse. L’un est destiné à la manipulation d’embryons et à l’implantation de perles, et l’autre au maintien des perles traitées prêtes à être implantées dans l’embryon.
- À l’aide de pinces non dentées, créez une fenêtre dans les œufs restants comme décrit dans la section incubation des œufs et stadification embryonnaire.
- Au microscope, ouvrez le sac amniotique en déchirant la membrane amniotique avec une pince chirurgicale fine près du membre postérieur droit uniquement par la quantité nécessaire pour accomplir la procédure (c.-à-d. le moins possible).
- À l’aide de pinces fines, maintenez l’embryon par la membrane amniotique pour exposer le membre postérieur droit. À l’aide d’une fine aiguille en tungstène, faites un trou centré dans la plus distale du troisième interdigit du membre postérieur.
- Sans libérer l’embryon et le membre postérieur exposé, prenez une perle traitée de l’autre microscope à l’aide de l’une des pointes de la pince. Les pinces doivent être en position ouverte pour qu’une perle adhère à la pointe de la pince.
- Transférez la perle dans l’embryon de poussin près du membre postérieur et positionnez-la sur le trou interdigit.
- Fermez les pinces pour appliquer une pression sur la perle jusqu’à ce qu’elle pénètre dans le trou.
- Relâchez l’embryon et scellez la fenêtre de la coquille d’œuf avec du ruban adhésif.
- Retournez les œufs à l’incubateur jusqu’à ce qu’ils aient atteint le stade requis. Répétez la procédure jusqu’à ce que le nombre requis d’embryons manipulés soit atteint. Il est impératif de s’assurer que les perles ne se dessèchent à aucun moment.
REMARQUE: Pour observer un doigt ectopique complet, incuber pendant environ 72 h après l’implantation de la perle. En revanche, les gènes de différenciation précoce (par exemple, Sox9) sont exprimés environ 30 minutes après l’implantation d’une perle imbibée de TGF-ß1.
Résultats
Utilisation de perles trempées pour évaluer le comportement cellulaire dans le membre embryonnaire du poussin
Pour assurer l’efficacité de ce test, la perle doit être placée de manière cohérente et précise au bon endroit; dans ce cas, la plus grande partie distale du troisième interdigit sous la crête ectodermique apicale AER (Figure 1A). Ce positionnement permet à la molécule en question de se propager également dans tout le tissu interdigital. De plus, la zone sous l’ARE contient des cellules indifférenciées qui répondent facilement au traitement. Pour évaluer les effets sur la différenciation cellulaire, les embryons peuvent être colorés avec du bleu Alcian et du rouge Alizarine pour prouver la formation d’éléments squelettiques (Figure 1B). Le test des billes trempées est également bien adapté à l’évaluation de la mort cellulaire avec du rouge neutre (Figure 1C) et de la régulation des gènes par hybridation in situ (Figure 1D). La barre d’échelle est fixée à 250 μm.
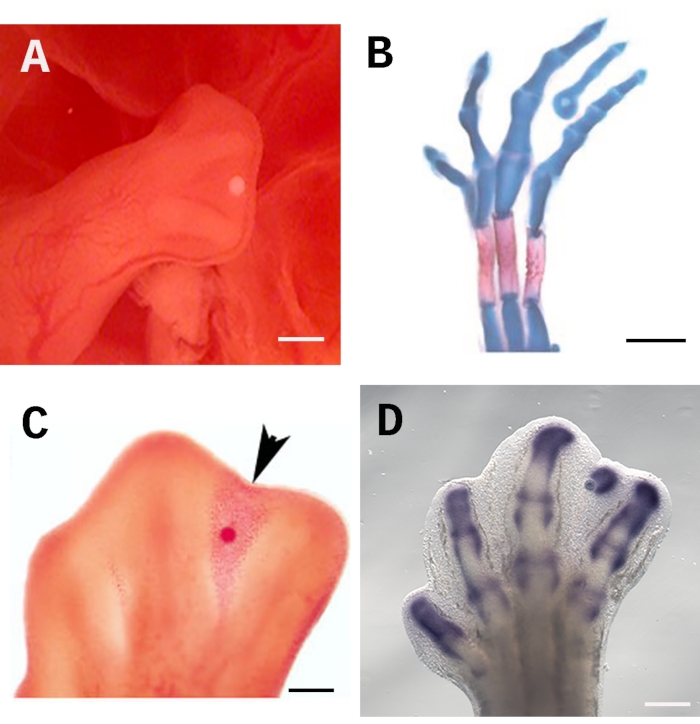
Figure 1 : Implantation de perles dans le tissu interdigital du membre du poussin. A) L’emplacement correct de la perle trempée sous l’AER dans un membre postérieur de 28 HH. (B) La coloration squelettique bleu Alcian et rouge Alizarine met en évidence la formation d’un doigt ectopique induit 4 jours après l’implantation d’une perle imbibée de TGF-ß1. (C) Une coloration rouge neutre marque l’induction de la mort cellulaire (pointe de flèche) 24 h après l’implantation d’une bille imbibée de PR dans le tissu internumérique au stade 28 HH. (D) Hybridation in situ Sox9 4 h après l’implantation d’une bille imbibée de TGF-ß1. La barre d’échelle est fixée à 250 μm. Les images montrées en B et C ont été prises de Díaz-Hernández et al.23,24. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le principal avantage de l’outil expérimental détaillé dans ce protocole est de pouvoir contrôler le temps et le lieu de l’exposition aux perles imbibées d’une molécule expérimentale donnée. La combinaison du positionnement correct avec un calendrier de développement précis offre d’énormes possibilités pour étudier les processus de différenciation cellulaire. La réalisation de ces expériences dans des tissus indifférenciés permet d’étudier les premiers événements cruciaux de la lignée cellulaire. Par exemple, placer une perle imbibée de TGFß dans le tissu internumérique des membres embryonnaires 28 HH entraîne la formation d’un chiffre ectopique dans lequel une cascade moléculaire est déclenchée qui induit l’expression génétique du maître gen Sox925. Remarquablement, le tissu cartilagineux induit s’organise également en un chiffre avec la formation de phalange.
Fait intéressant, la PR déclenche la mort cellulaire dans la même région interdigitale en régulant l’expression génique des protéines morphogénétiques osseuses qui dirigent le destin cellulaire des cellules indifférenciées vers la mort cellulaire10. Par conséquent, la différenciation cellulaire, la mort cellulaire, la morphogenèse et le modelage peuvent être étudiés simultanément dans la même région d’un embryon et adaptés à n’importe quelle région et voie génétique d’intérêt 8,9.
Les éléments cruciaux pour le succès de ce protocole comprennent le fait de ne jamais laisser les perles trempées sécher (c.-à-d. qu’elles doivent toujours rester humides). En outre, la sélection des perles appropriées est essentielle: Affi-Gel et les perles d’héparine sont pour les protéines, tandis que AG1-X2 sont pour les produits chimiques dissous dans les solvants organiques. Un autre point critique est la concentration de la molécule contenue dans la solution utilisée pour faire tremper les billes, qui est généralement 1000 fois plus concentrée que ce qui serait utilisé pour les études in vitro . Néanmoins, un inconvénient de cette méthode est que la concentration finale des molécules libérées par les billes trempées est inconnue, ainsi que la vitesse de libération. Dans le protocole, il est mentionné que les perles de 100 μm de diamètre sont plus pratiques à utiliser. Considérez cela lorsque les membres sont manipulés. Plus important encore, le diamètre des perles doit être sélectionné en fonction de la zone d’implantation et maintenu de manière cohérente dans chaque embryon. Cependant, une légère variation de la taille des perles entre les expériences n’est pas susceptible d’affecter les résultats.
En conclusion, le potentiel du test de perles trempées décrit ici ne dépend que de l’imagination du chercheur. Ce protocole peut être appliqué à tout animal expérimental, culture cellulaire ou modèle de culture organotypique, y compris les organoïdes. En outre, ce protocole est un outil éducatif utile et simple pour enseigner aux étudiants les concepts de base de la biologie du développement et les compétences techniques en pratiquant cette manipulation expérimentale dans les cours de biologie du développement.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Dirección General de Asuntos del Personal Académico (DGAPA)-Universidad Nacional Autónoma de México [numéros de subvention IN211117 et IN213314] et le Consejo Nacional de Ciencia y Tecnología (CONACyT) [numéro de subvention 1887 CONACyT-Fronteras de la Ciencia] attribué à JC-M. JC M-L a reçu une bourse postdoctorale du Consejo Nacional de Ciencia y Tecnología (CONACyT-Fronteras de la Ciencia-1887). Les auteurs apprécient l’aide de Lic. Lucia Brito de l’Instituto de Investigaciones Biomédicas, UNAM dans la préparation des références de ce manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Affi-Gel Blue Gel beads | Bio-Rad | 153-7302 | |
| AG1-X2 beads | Bio-Rad | 1400123 | |
| Egg incubator | Incumatic de Mexico | Incumatic 1000 | |
| Fine surgical forceps | Fine Science Tools | 9115-10 | |
| Heparine Sepharose beads | Abcam | ab193268 | |
| Petri dish | Nest | 705001 | |
| Stereomicroscope | Zeiss | Stemi DV4 | |
| Tape | NA | NA | |
| Tungsten needle | GoodFellow | E74-15096/01 |
Références
- Stapornwongkul, K. S., Vincent, J. P. Generation of extracellular morphogen gradients: the case for diffusion. Nature Reviews Genetics. 22 (6), 393-411 (2021).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Irizarry, J., Stathopoulos, A. Dynamic patterning by morphogens illuminated by cis-regulatory studies. Development. 148 (2), 196113(2021).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), (2019).
- Marín-Llera, J. C., Garciadiego-Cázares, D., Chimal-Monroy, J. Understanding the cellular and molecular mechanisms that control early cell fate decisions during appendicular skeletogenesis. Frontiers in Genetics. 10, 977(2019).
- Gurdon, J. B. Embryonic induction--molecular prospects. Development. 99 (3), 285-306 (1987).
- Bouwmeester, T. The Spemann-Mangold organizer: the control of fate specification and morphogenetic rearrangements during gastrulation in Xenopus. International Journal of Developmental Biology. 45 (1), 251-258 (2001).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86 (4), 589-598 (1996).
- Cho, K. W., Blumberg, B., Steinbeisser, H., De Robertis, E. M. Molecular nature of Spemann's organizer: the role of the Xenopus homeobox gene goosecoid. Cell. 67 (6), 1111-1120 (1991).
- Thisse, B., Thisse, C. Formation of the vertebrate embryo: Moving beyond the Spemann organizer. Seminars in Cell & Development Biology. 42, 94-102 (2015).
- Eichele, G., Tickle, C., Alberts, B. M. Microcontrolled release of biologically active compounds in chick embryos: beads of 200-microns diameter for the local release of retinoids. Analytical Biochemistry. 142 (2), 542-555 (1984).
- Tickle, C., Lee, J., Eichele, G. A quantitative analysis of the effect of all-trans-retinoic acid on the pattern of chick wing development. Developmental Biology. 109 (1), 82-95 (1985).
- Vermot, J., Pourquié, O. Retinoic acid coordinates somitogenesis and left-right patterning in vertebrate embryos. Nature. 435 (7039), 215-220 (2005).
- Rodriguez-Leon, J., et al. Retinoic acid regulates programmed cell death through BMP signalling. Nature Cell Biology. 1 (2), 125-126 (1999).
- Rodriguez-Guzman, M., et al. Tendon-muscle crosstalk controls muscle bellies morphogenesis, which is mediated by cell death and retinoic acid signaling. Developmental Biology. 302 (1), 267-280 (2007).
- Cohn, M. J., Izpisúa-Belmonte, J. C., Abud, H., Heath, J. K., Tickle, C. Fibroblast growth factors induce additional limb development from the flank of chick embryos. Cell. 80 (5), 739-746 (1995).
- Ohuchi, H., et al. An additional limb can be induced from the flank of the chick embryo by FGF4. Biochemical and Biophysical Research Communications. 209 (3), 809-816 (1995).
- Abu-Elmagd, M., Goljanek Whysall, K., Wheeler, G., Münsterberg, A. Sprouty2 mediated tuning of signalling is essential for somite myogenesis. BMC Medical Genomics. 8, Suppl 1 8(2015).
- Gañan, Y., Macias, D., Duterque-Coquillaud, M., Ros, M. A., Hurle, J. M. Role of TGF beta s and BMPs as signals controlling the position of the digits and the areas of interdigital cell death in the developing chick limb autopod. Development. 122 (8), 2349-2357 (1996).
- Merino, R., et al. Morphogenesis of digits in the avian limb is controlled by FGFs, TGFbetas, and noggin through BMP signaling. Developmental Biology. 200 (1), 35-45 (1998).
- Montero, J. A., Lorda-Diez, C. I., Gañan, Y., Macias, D., Hurle, J. M. Activin/TGFbeta and BMP crosstalk determines digit chondrogenesis. Developmental Biology. 321 (2), 343-356 (2008).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Díaz-Hernández, M. E., Bustamante, M., Galván-Hernández, C. I., Chimal-Monroy, J. Irx1 and Irx2 are coordinately expressed and regulated by retinoic acid, TGFβ and FGF signaling during chick hindlimb development. PLoS One. 8 (3), 58549(2013).
- Díaz-Hernández, M. E., Rios-Flores, A. J., Abarca-Buis, R. F., Bustamante, M., Chimal-Monroy, J. Molecular control of interdigital cell death and cell differentiation by retinoic acid during digit development. Journal of Developmental Biology. 2 (2), 138-157 (2014).
- Chimal-Monroy, J., et al. Analysis of the molecular cascade responsible for mesodermal limb chondrogenesis: Sox genes and BMP signaling. Developmental Biology. 257 (2), 292-301 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.
