Method Article
Кристаллизация на кристалле и крупномасштабная последовательная дифракция при комнатной температуре
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом вкладе описывается, как настроить кристаллизацию белка на кристаллических устройствах и как выполнять автоматизированный последовательный сбор данных при комнатной температуре с использованием платформы кристаллизации на кристалле.
Аннотация
Биохимические реакции и биологические процессы можно лучше всего понять, продемонстрировав, как белки переходят между своими функциональными состояниями. Поскольку криогенные температуры не являются физиологическими и могут предотвращать, сдерживать или даже изменять структурную динамику белка, очень желателен надежный метод для обычных экспериментов по дифракции рентгеновских лучей при комнатной температуре. Устройство «кристалл на кристалле» и сопутствующее аппаратное и программное обеспечение, используемое в этом протоколе, предназначены для обеспечения рентгеновской дифракции in situ при комнатной температуре кристаллов белка различных размеров без каких-либо манипуляций с образцами. Здесь мы представляем протоколы для ключевых этапов от сборки устройства, кристаллизации на кристалле, оптического сканирования, распознавания кристаллов до планирования рентгеновского снимка и автоматизированного сбора данных. Поскольку эта платформа не требует сбора кристаллов или каких-либо других манипуляций с образцами, от сотен до тысяч кристаллов белка, выращенных на чипе, могут быть введены в рентгеновский луч программируемым и высокопроизводительным способом.
Введение
Из-за ионизирующего воздействия рентгеновского излучения кристаллография белка в значительной степени была ограничена криогенными условиями в последние три десятилетия. Таким образом, современные знания о движениях белка во время его функционирования в значительной степени возникают из сравнений статических структур, наблюдаемых в различных состояниях в криогенных условиях. Однако криогенные температуры неизбежно препятствуют прогрессированию биохимической реакции или взаимоконверсии между различными конформационными состояниями во время работы белковых молекул. Для непосредственного наблюдения структурной динамики белка при атомном разрешении с помощью кристаллографии необходимы надежные и рутинные методы проведения дифракционных экспериментов при комнатной температуре, что требует технических инноваций в доставке образцов, сборе данных и анализе задних данных. С этой целью последние достижения в области серийной кристаллографии предложили новые возможности для захвата молекулярных изображений промежуточных продуктов и короткоживущих структурных видов при комнатной температуре 1,2,3. В отличие от стратегии «один кристалл — один набор данных», широко используемой в обычной криокристаллографии, серийная кристаллография использует стратегию сбора данных, аналогичную стратегии криоэлектронной микроскопии с одной частицей. В частности, экспериментальные данные в серийной кристаллографии собираются в небольших фракциях из большого количества отдельных образцов с последующей интенсивной обработкой данных, в которой фракции данных оцениваются и объединяются в полный набор данных для определения 3D-структуры4. Эта стратегия «один кристалл — один выстрел» эффективно облегчает рентгеновское радиационное повреждение кристаллов белка при комнатной температуре посредством дифракции перед стратегией разрушения5.
Поскольку серийная кристаллография требует большого количества кристаллов белка для завершения набора данных, она создает серьезные технические проблемы для многих биологических систем, где образцы белка ограничены и / или связана деликатная обработка кристаллов. Другим важным соображением является то, как наилучшим образом сохранить целостность кристаллов в экспериментах по серийной дифракции. Методы дифракции in situ решают эти проблемы, позволяя кристаллам белка дифрагировать непосредственно из того места, где они растут, не нарушая уплотнения камеры кристаллизации 6,7,8,9. Эти методы без обработки естественным образом совместимы с крупномасштабной последовательной дифракцией. Недавно мы сообщили о разработке и реализации кристаллизационного устройства для дифракции in situ на основе концепции кристалл-на-кристалле - белковых кристаллов, выращенных непосредственно на монокристаллическом кварце11. Это устройство «кристалл на кристалле» предлагает несколько преимуществ. Во-первых, он имеет рентгеновское и светлое прозрачное окно, сделанное из монокристаллической кварцевой подложки, которая производит небольшое фоновое рассеяние, что приводит к отличным соотношениям сигнал/шум на дифракционных изображениях из кристаллов белка. Во-вторых, монокристаллический кварц является отличной пароизоляцией, эквивалентной стеклу, тем самым обеспечивая стабильную среду для кристаллизации белка. Напротив, другие кристаллизационные устройства, использующие подложки на полимерной основе, склонны к высыханию из-за паропроницаемости, если полимерный материал не имеет существенной толщины, что, следовательно, способствует высокому фоновому рассеянию10. В-третьих, это устройство позволяет доставлять большое количество кристаллов белка в рентгеновский луч без какой-либо формы манипуляции с кристаллами или сбора, что имеет решающее значение для сохранения целостности кристаллов11.
Для оптимизации последовательных экспериментов по дифракции рентгеновских лучей с использованием кристаллических устройств мы разработали прототип дифрактометра, облегчающий легкое переключение между режимами12 оптического сканирования и дифракции рентгеновских лучей. Этот дифрактометр имеет небольшую площадь и используется для последовательного сбора данных на двух линиях луча усовершенствованного источника фотонов (APS) в Аргоннской национальной лаборатории. В частности, мы использовали BioCARS 14-ID-B для дифракции Лауэ и LS-CAT 21-ID-D для монохроматических колебаний. Это дифрактометрическое оборудование не требуется, если синхротронная или рентгеновская лазерная линия свободных электронов оснащена двумя ключевыми возможностями: (1) моторизованное позиционирование образца с диапазоном перемещения ±12 мм вокруг рентгеновского пучка во всех направлениях; и (2) осевая цифровая камера для просмотра кристаллов при световом освещении, безопасная для исследуемых кристаллов белка. Монокристаллическое кварцевое устройство вместе с портативным дифрактометром и управляющим программным обеспечением для оптического сканирования, распознавания кристаллов и автоматизированного сбора данных in situ в совокупности составляют платформу inSituX для серийной кристаллографии. Хотя эта разработка в первую очередь мотивирована ее динамическими кристаллографическими приложениями с использованием полихроматического источника рентгеновского излучения, мы продемонстрировали потенциал этой технологии для поддержки методов монохроматических колебаний10,12. Благодаря автоматизации эта платформа предлагает высокопроизводительный метод последовательного сбора данных при комнатной температуре с доступным потреблением белка.
В этом материале мы подробно описываем, как настроить кристаллизацию на кристалле в влажной лаборатории и как выполнять последовательный сбор рентгеновских данных на линии синхротронного пучка с помощью платформы inSituX.
Пакетный метод используется для установки кристаллизации на чипе в условиях, аналогичных условиям метода диффузии паров, полученного для того же образца белка (таблица 1). В качестве отправной точки мы рекомендуем использовать осадок в концентрации 1,2-1,5x от таковой для метода диффузии паров. При необходимости состояние кристаллизации партии может быть дополнительно оптимизировано с помощью тонкого сетчатого просеивания. Кварцевые пластины не нужны для оптимизационных испытаний; вместо этого можно использовать стеклянные крышки (см. ниже). Частично загруженные кристаллизационные устройства рекомендуются для проведения оптимизационных испытаний в меньших масштабах. Ряд белковых образцов был успешно кристаллизован на таких устройствах с использованием периодического метода10 (таблица 1).
Само устройство состоит из следующих частей: 1) наружного кольца; 2) две кварцевые пластины; 3) одна шайбообразная прокладка из пластика или нержавеющей стали; 4) стопорное кольцо; 5) микроскоп погружное масло в качестве герметика (рисунок 1). Общий объем кристаллизационного раствора, загруженного на один чип, зависит от цели эксперимента. Емкость камеры кристаллизации можно регулировать, выбирая прокладку различной толщины и/или внутреннего диаметра. Мы регулярно устанавливаем кристаллизационные устройства емкостью 10-20 мкл с использованием прокладок толщиной 50-100 мкм. Типичное устройство может производить от десятков до тысяч кристаллов белка, достаточных для последовательного сбора данных (рисунок 2).
В случае успеха кристаллизация на чипе будет производить десятки, сотни или даже тысячи кристаллов белка на каждом кварцевом устройстве, готовых к рентгеновской дифракции. На синхротронной лучевой линии такое устройство монтируется на трехосевой ступени трансляции дифрактометра с помощью кинематического механизма. Окно кристаллизации навесного устройства оптически сканируется и визуализируется на десятках-сотнях микроснимков. Эти микроснимки затем сшиваются в монтаж с высоким разрешением. Для светочувствительных кристаллов оптическое сканирование может быть выполнено под инфракрасным (ИК) светом, чтобы избежать непреднамеренной фотоактивации. Было разработано программное обеспечение для компьютерного зрения для идентификации и определения местоположения кристаллов белка, случайным образом распределенных на устройстве. Затем эти кристаллы ранжируются в соответствии с их размером, формой и положением, чтобы информировать или направлять стратегию сбора данных в серийной кристаллографии. Например, один или несколько выстрелов могут быть расположены на каждом целевом кристалле. Пользователи могли планировать один проход или несколько маршрутов через целевые кристаллы. Мы внедрили программное обеспечение для вычисления различных маршрутов путешествий. Например, кратчайший маршрут вычисляется с использованием алгоритмов, которые решают задачу13 коммивояжера. Для динамических кристаллографических применений насос-зонд можно выбрать время и продолжительность лазерных (накачки) и рентгеновских (зондовых) снимков. Автоматизированный последовательный сбор данных запрограммирован на перемещение каждого целевого кристалла в рентгеновский пучок один за другим.
К ключевым компонентам дифрактометра insituX относятся: 1) держатель прибора; 2) трехосевой этап трансляции; 3) источник света для оптического сканирования; 4) остановка рентгеновского пучка; 5) накачивать лазеры, если изучаются светочувствительные белки; 6) Микрокомпьютер Raspberry Pi, оснащенный ИК-чувствительной камерой; 7) программное обеспечение управления для синхронизации двигателей, камеры, источников света, накачки лазера и взаимодействия с элементами управления линией луча.
протокол
1. Предварительная сборка устройства
- Маркировка наружного кольца (диаметр 30 мм) для идентификации образца. При необходимости укажите название проекта, номер устройства, условие кристаллизации и дату (рисунок 1A). Поместите наружное кольцо вверх ногами на чистую поверхность (рисунок 1B) и аккуратно поместите одну кварцевую пластину внутрь кольца (рисунок 1C). Эта первая кварцевая пластина служит входным окном для падающих рентгеновских лучей.
- Налейте небольшое количество погружного масла микроскопа (вязкость 150 сСт) в чашку Петри. Окуните прокладку в масло и убедитесь, что обе стороны прокладки правильно смазаны маслом (рисунок 1D). Удалите излишки масла, нанеся прокладку на чистую поверхность.
- Поместите промасленную прокладку поверх первой кварцевой пластины (рисунок 1Е).
ПРИМЕЧАНИЕ: Иммерсионное масло является отличным герметиком, который защищает камеру кристаллизации от потенциальной потери пара. Правильно собранные чипсы обычно служат неделями без видимого высыхания. Этот этап предварительной сборки выполняется при освещении помещения. Для светочувствительных образцов все последующие этапы, включая загрузку образцов, хранение устройства и наблюдение, должны проводиться при безопасном свете.
2. Загрузка образца и сборка устройства
- Используйте пипетку, чтобы тщательно смешать белковый раствор и буфер кристаллизации на первой кварцевой пластине. Объемное соотношение между образцом белка и буфером обычно колеблется от 2:1 до 1:2 (рисунок 1F). Убедитесь, что общий объем кристаллизационного раствора не превышает максимальную емкость кристаллизационной камеры, определяемую размером и толщиной прокладки. Избегайте пузырьков воздуха во время перемешивания.
ПРИМЕЧАНИЕ: Состав буфера кристаллизации варьируется от одного эксперимента к другому. Условия кристаллизации приведены в таблице 1 . - Поместите вторую кварцевую пластину поверх смешанного раствора, когда раствор начнет растекаться (рисунок 1G). Эта вторая кварцевая пластина служит выходным окном дифрагированных рентгеновских лучей.
- Слегка нажмите на вторую кварцевую пластину по краю, чтобы помочь намазать масло, выталкивая воздух. Закрепите устройство, вкрутив стопорное кольцо во внешнее кольцо (рисунок 1H). При необходимости используйте инструмент для затяжки (рисунок 1I). Имейте в виду, что чрезмерное затягивание может привести к деформации или даже растрескиванию тонких кварцевых пластин.
3. Оптимизация хранения и кристаллизации устройства
- Храните собранные устройства (рисунок 1J) в коробке при комнатной температуре или внутри инкубатора с контролем температуры.
ПРИМЕЧАНИЕ: Кристаллы белка могут появиться через несколько часов или дней после сборки кристаллизационного устройства. Типичные результаты кристаллизации на чипе показаны для нескольких репрезентативных образцов белка (рисунок 2). - Контролируйте рост кристаллов, наблюдая за кристаллизационным устройством под микроскопом. При необходимости оптимизируют условия кристаллизации итерациями секций 1-3.
4. Калибровка
ПРИМЕЧАНИЕ: Программы и команды, упомянутые в разделах ниже, выполняются в программном обеспечении inSituX.
- Установите тонкий кристалл легированного иттриевого алюминиевого граната на держатель чипа (рисунок 3). Установите упор балки. Сделайте рентгеновские флуоресцентные снимки прямого луча, запустив программу:
burnmark.py <устройство>.param
где <устройство> — выбранное пользователем имя устройства кристаллизации. .param — это имя файла, содержащее параметры управления для конкретного устройства. Значения по умолчанию будут постепенно заменяться определенными значениями по протоколу. Пример файла .param приведен в дополнительном файле 1. - Найдите точное положение прямого рентгеновского пучка, запустив программу установки профиля пучка:
beam.py <обожженное изображение> -d <устройство>
где <снежное изображение> — имя файла рентгеновского флуоресцентного изображения (рисунок 4).
ПРИМЕЧАНИЕ: Эта программа вычисляет точное положение прямого луча, а также размер луча. Положение луча обозначает место назначения перемещения для всех кристаллов одного и того же устройства. Размер луча также используется для планирования цели.
5. Оптическое сканирование
- Поместите кристаллизационное устройство в держатель чипа и закрепите устройство с помощью винта большого пальца (рисунок 3A).
- Установите держатель микросхемы на ступень трансляции дифрактометра с помощью кинематического механизма (рисунок 3B).
- Установите правильный источник света для съемки микрофотографий из оптического окна устройства. Белый свет, ИК-свет или другой свет по выбору могут быть использованы в зависимости от светочувствительности образца белка, а также цели эксперимента.
- Запустите программу сканирования:
scan.py <устройство>.param
Эта программа захватывает набор микроснимков, которые автоматически передаются на указанные компьютеры пользователей. - Запустите программу разметки на компьютере пользователя:
tile.py <устройство> -x -y
где и — начальные значения смещений столбцов и строк микрофотографий соответственно. Эта программа сшивает все микроснимки в монтаж с разрешением 1-3 мкм/пиксель (рисунок 5).
ПРИМЕЧАНИЕ: Шаги 5.4 и 5.5 обычно занимают несколько минут. Общее количество микроснимков колеблется от нескольких десятков до сотен в зависимости от области сканирования и увеличения. - Запустите программу поиска кристаллов:
findX.py <монтаж> -c <длительность> <ширина> -w -x размер < луча>
где <монтаж> — это изразцовое изображение. Эта программа выполняет распознавание кристаллов и планирование выстрелов. < длиной> и шириной <> указывают размер кристалла, который необходимо найти. Если пользователь хочет избежать меньших кристаллов, <широту> можно использовать в качестве отсечки, установив число, превышающее размеры нежелательных мелких кристаллов. <кровка> — угловое значение, задающее допуск для кристаллов неправильной формы. <размер луча> относится к размеру прямого луча, полученного в результате установки профиля выше (этап 4.2; Рисунок 4). Кроме того, номинальное значение может быть установлено пользователями для дальнейшего освобождения от целевых выстрелов. Эти ключевые параметры позволяют выбирать кристаллы и планировать цели (рисунок 6).
6. Рентгеновская дифракция
- Извлеките источник света и установите упор луча. Установите соответствующее расстояние детектора. Следуйте протоколу безопасности лучевой линии для поиска рентгеновского домика. Откройте рентгеновский затвор и лазерный затвор, если это применимо.
- Запустите программу сбора данных для последовательной дифракции:
collect.py <устройство>.param -l <световая длительность>
Эта команда запускает сбор данных, при котором все запланированные снимки посещаются один за другим в соответствии с заранее запрограммированной последовательностью. Каждый целевой кристалл перемещается в положение пучка (шаг 4.2). На каждой остановке рентгеновское облучение снимается с лазерной подсветкой или без нее с запланированной временной задержкой. На ролике 1 показана автоматизированная последовательность сбора данных, работающая на частоте 1 Гц. Обычно от десятков до сотен дифракционных изображений собираются с устройства монокристаллизации (фильм 2).
ПРИМЕЧАНИЕ: Калибровка секции 4 и оптическое сканирование секции 5 являются автономными в платформе inSituX, поэтому полностью переносятся на другую линию луча. Секция 6 Дифракция рентгеновских лучей должна включать некоторые детали в работу линии луча.
Результаты
За последние несколько лет было опубликовано несколько репрезентативных наборов данных10,12 вместе с кристаллографическими результатами и научными выводами из разнообразного спектра белков, включая фоторецепторные белки и ферменты, например, растительный фоторецептор UV-B UVR8, светоремонтную фотолиазу PHrB10, новый белок, чувствительный к дальнему красному свету из многодоменной сенсорной гистидинкиназы14 , лигандные/световые домены с двумя датчиками и фотосенсорный основной модуль бактериофитохрома12. В качестве репрезентативных результатов мы перечисляем условия кристаллизации этих белков в таблице 1 и непосредственно сравниваем их с условиями, используемыми для метода диффузии паров. Здесь мы показываем четыре дополнительных тематических исследования кристаллизации на чипе (рисунок 2) и коллекцию дифракционных паттернов in situ в фильме (фильм 2). Репрезентативные наборы данных in situ, собранные с использованием этого протокола, кратко изложены в таблице 2.
В репрезентативном случае криокристаллография привела к плохой дифракции для фоторецепторного белка, чувствительного к дальнему красному свету, вероятно, из-за светочувствительности и высокого содержания растворителя (~ 80%) этих кристаллов14. Электронные плотности, полученные из данных криокристаллографии, были слишком размыты, чтобы разрешить конформацию хромофора, которая находится в центре нашего научного вопроса. Используя протокол in situ, мы смогли избежать непреднамеренной активации света перед дифракцией и получили темный набор данных при комнатной температуре из более чем 800 кристаллов. Этот темный набор данных из последовательной дифракции Лауэ in situ привел к лучшей разрешенной электронной плотности, что позволило уверенно построить модель билинового хромофора, который демонстрирует до сих пор неизвестную конформацию all-Z,syn (рисунок 7A)12,14. Наши эксперименты по динамической кристаллографии также выявили вызванные светом изменения в этом дальнекрасном фоторецепторном белке, сравнив данные 4 352 кристаллов в темноте и 8 287 кристаллов после освещения света (рисунок 7). Предварительный анализ карт различий, индуцированных светом, выявил согласованные движения в центральном β листе, что свидетельствует о важности π-π укладки между пиррольными кольцами хромофора и несколькими ароматическими остатками (рисунок 7B, C). Углубленный анализ и научные выводы будут представлены в другом месте.

Рисунок 1: Сборка кристаллизационного устройства. Каждая сборка оценивается в 30 долларов США с двумя монокристаллическими кварцевыми пластинами или 10 долларов США с двумя стеклянными крышками. Аппаратные компоненты, кроме прокладки, можно использовать повторно. (A) Плоская сторона наружного кольца маркирована для целей идентификации. (B) Наружное кольцо помещается вверх ногами на чистую поверхность. (C) Кварцевая пластина диаметром 1 дюйм аккуратно помещается внутрь. Стеклянный чип также может быть использован во время испытаний кристаллизации, но не совместим с рентгеновской дифрацией. (D) Обе стороны прокладки смазаны маслом. (E) Промасленная прокладка помещается на первый кварцевый чип. (F) Белковые и кристаллизационные растворы пипетируются в центр чипа и смешиваются. (G) Второй кварцевый или стеклянный чип покрывает каплю так, чтобы она равномерно распределялась по чипу. (H) Удерживающее кольцо навинчивается на вторую кварцевую пластину. (I) Для осторожного затягивания стопорного кольца используется затягивающий инструмент. J) полностью собранное устройство. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
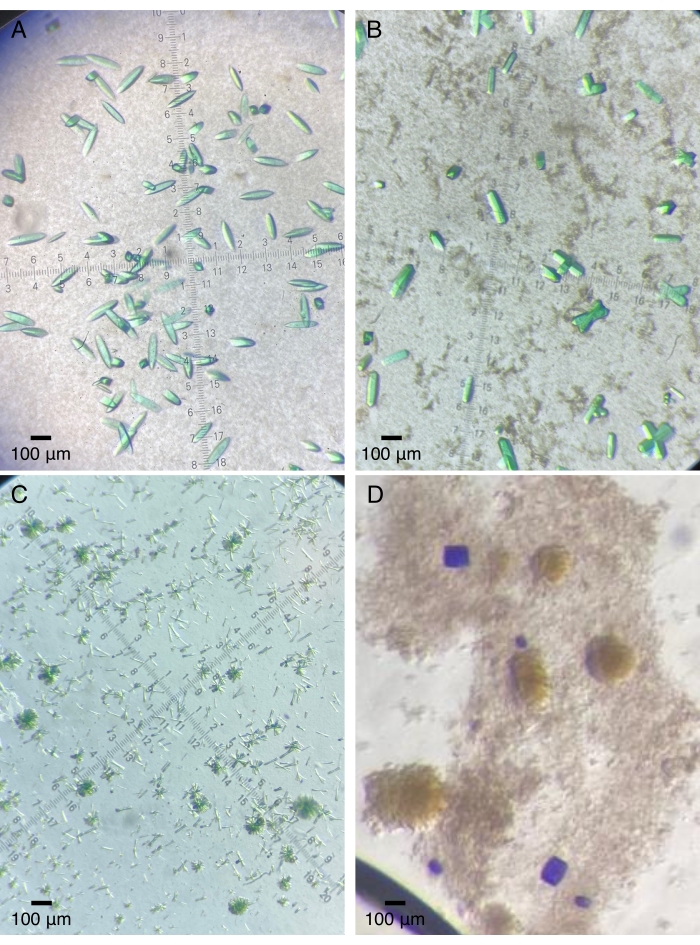
Рисунок 2: Репрезентативные кристаллы белка, выращенные на кварцевых устройствах. (А) Фотосенсорный модуль ядра бактериофитохрома (Pa497 в таблице 1). (В,С) Различные конструкции третьего домена GAF от многодоменной сенсорной гистидинкиназы (2551g3 и 2551g3Δα1 в таблице 1). (D) Тандемные сенсорные домены из гистидинкиназы с двумя датчиками (RECGAF в таблице 1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: дифрактометр inSituX. (A) В держателе микросхемы установлено кристаллизационное устройство. Хотя устройство монтируется вертикально, кристаллы, выращенные на чипе, не собираются падать, в первую очередь потому, что слой жидкости в собранном устройстве очень тонкий, а кристаллы при росте закрепляются к их ядрам. (B) Для оптического сканирования устанавливается ИК-источник света. Камера захватывает встроенный вид кристаллов белка вдоль рентгеновского луча через призматическое зеркало (не видно на снимке). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Прямой монтаж профиля балки. Красный, зеленый и синий каналы рентгеновского флуоресцентного изображения используются для соответствия двумерной функции Гаусса. В левом столбце отображается необработанное изображение красного, зеленого и синего каналов. Средняя колонна - это результат подгонки с точным положением и размером луча. В правом столбце отображаются остатки фитинга. Если амплитуда фитинговых остатков охватывает небольшую часть необработанного изображения, то подгонка профиля прямого луча проходит успешно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
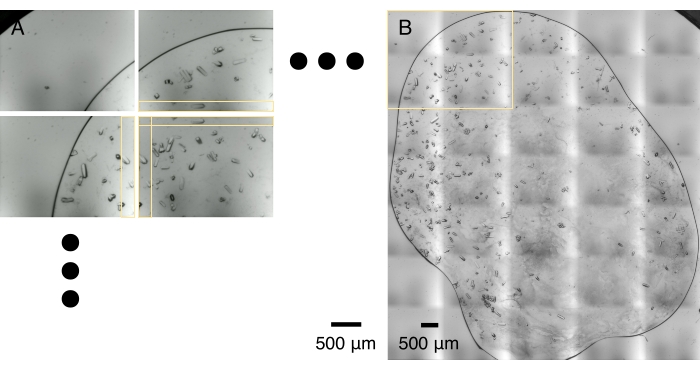
Рисунок 5: Мозаика изображений. (A) Массив кристаллических микроснимков захватывается во время оптического сканирования. Оптическое сканирование и передача данных обычно занимают 1-2 мин. Соседние микроснимки разделяют полосу перекрывающейся области, горизонтально и вертикально, отмеченную желтыми полями. (B) Микроснимки сшиваются вместе, чтобы сделать монтаж с высоким разрешением на основе оптимальной корреляции в перекрывающихся областях. Этот процесс обычно занимает минуту на портативном компьютере. Желтая рамка очерчивает область, захваченную 2 x 2 микроснимками, показанными в (A). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Распознавание кристаллов и планирование выстрелов. Каждый розовый круг отмечает первичный снимок кристалла. Желтые круги отмечают дополнительные снимки, если кристалл достаточно длинный, чтобы расположить эти снимки. Розовые линии обозначают маршрут как решение проблемы коммивояжера. Кластеризованные кристаллы и более мелкие кристаллы в значительной степени избегаются. Агрессивность нахождения кристаллов может быть скорректирована как вариант findX.py (шаг 5.6). Стратегия «перебора» грубой силы не оставит кристалл без выстрела, но может создать много дифракционных изображений, но не обрабатываемых12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
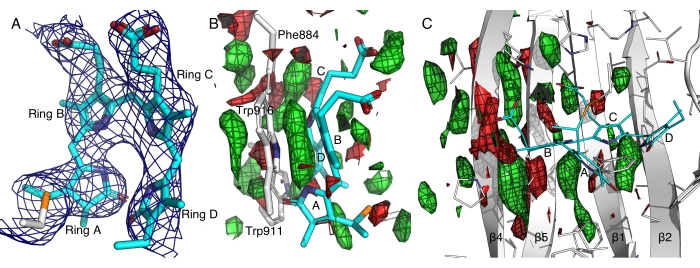
Рисунок 7: Карты электронной плотности домена, зондирующего дальний красный свет гистидинкиназы. (A) Карта 2Fo-Fc, контурная на расстоянии 2,5σ показывает плотность электронов, связанную с билиновым хромофором в конформации all-Z,syn 14. Отмечены пирроловые кольца от A до D. (B и C) Карты различий между светом и темной, очерченные на ±2,5σ зеленым и красным цветом, соответственно, подчеркивают усиление и потерю электронной плотности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Сравнение условий кристаллизации между диффузией пара и пакетным методом на кристалле. Пародиффузионный и пакетный методы кристаллизации сильно коррелированы 10,14,15,16,17,18,19. Начиная с состояния диффузии пара, аналогичное состояние может быть оптимизировано для кристаллизации на чипе. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Сводка наборов данных in situ , собранных непосредственно с кварцевых устройств. Тысячи дифракционных паттернов Лауэ могут быть собраны из нескольких кристаллизующих устройств. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Фильм 1: Имитация сбора данных. Целевые кристаллы перемещаются в рентгеновский пучок, отмеченный красным кругом. Последовательность целевых кристаллов в этом фильме не следует решению проблемы коммивояжера. Лазерное и рентгеновское облучение срабатывает на каждой остановке с запрограммированной задержкой. Собираются дифракционные изображения. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 2: Дифракционные изображения. Сотни дифракционных изображений могут быть собраны с устройства монокристаллизации. Для создания полного и сильно избыточного набора данных достаточно нескольких устройств (таблица 2). Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный файл 1: Пример файла <устройства>.param. Небольшой текстовый файл собирает некоторые параметры управления, специфичные для каждого устройства кристаллизации. Эти параметры начинаются со значений по умолчанию и будут соответствующим образом изменяться в разделах 4, 5 и 6 по мере прохождения протокола. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Кристаллография белка в первые годы, проводимая при комнатной температуре, испытывала огромные трудности в борьбе с повреждением рентгеновским излучением. Таким образом, он был заменен более надежным методом криокристаллографии, поскольку синхротронные рентгеновские источники стали легкодоступными20. С появлением рентгеновских лазеров на свободных электронах в последние годы была возрождена кристаллография белка комнатной температуры, со многими новыми разработками, обусловленными желанием наблюдать структурную динамику белка при физиологически значимой температуре 2,21. Разработка платформы inSituX на основе кристаллических устройств была мотивирована теми же амбициями, то есть создание рутинных и надежных методов сбора данных для динамических кристаллографических исследований при комнатной температуре. Этот автоматизированный метод последовательной рентгеновской дифракции также применим для определения статической структуры кристаллов белка, не поддающихся замораживанию14. В этом протоколе мы представляем ключевые технические соображения, а также критические шаги, необходимые для сбора данных о комнатной температуре с использованием этой платформы. Этот метод особенно подходит для хрупких кристаллов белка, которые чувствительны к механическому обращению, повреждению рентгеновским излучением или воздействию воздуха.
Прототип платформы был тщательно протестирован на двух линиях кристаллографии белка в Advanced Photon Source (APS) Аргоннской национальной лаборатории. Хотя настроить кристаллизацию на кристалле в соответствии с этим протоколом довольно просто, этап сбора данных включает в себя несколько пользовательских аппаратных и программных компонентов. В результате его применение и реализация стратегий сбора данных по конкретным проектам может потребовать тесного сотрудничества между пользователями и учеными, занимающимися лучевой линией. Другими словами, эта технология в ее нынешнем виде ограничена теми пользователями, которые имеют адекватный доступ к синхротронам, таким как APS. Тем не менее, общий рабочий процесс и ключевые шаги, описанные в этом протоколе, будут служить справочным материалом или руководством для любой исследовательской группы, заинтересованной в кристаллографии белка при комнатной температуре.
Наиболее значительным преимуществом этой платформы является то, что не требуется никаких манипуляций с кристаллами, таких как монтаж или замораживание, так что деликатные кристаллы белка дифрагируются в нетронутых условиях. Другим важным преимуществом является то, что использование монокристаллической кварцевой подложки приводит к очень небольшому фоновому рассеянию на изображениях дифракции белка, предлагая стабильные среды для кристаллизации белка в течение длительного времени (от недель до месяцев). Однако эта платформа не подходит для разрежиссного кристаллического экранирования, так как предназначена для крупномасштабного производства кристаллов. Таким образом, предварительное знание условий кристаллизации требуется для организации первоначальных испытаний кристаллизации на чипе для данного образца белка.
На практике мы обнаруживаем, что некоторые этапы сборки устройства, такие как смазывание прокладки (шаг 1.2) и как запечатать устройство (шаг 2.3), какими бы тривиальными они ни казались, часто напрямую влияют на результаты кристаллизации. Устройство может быстро высохнуть, если смазка не выполнена должным образом. Кроме того, чрезмерная затяжка устройства на заключительном этапе сборки может деформировать кварцевые пластины, в то время как недостаточная затяжка приводит к потенциальным утечкам и/или неконтролируемому испарению из устройства. Другим важным шагом является планирование рентгеновских снимков. Необходимо тщательно обращаться с кластеризованными или переполненными кристаллами, чтобы избежать перекрывающихся дифракционных паттернов, которые часто трудно обрабатывать. Эта проблема может быть облегчена с помощью микрофокусирующего рентгеновского пучка. Потенциально полный набор данных может быть трудно получить, если морфология кристалла представляет собой большую тонкую пластину, так что большинство пластин параллельны кварцевым окнам. Кроме того, монокристаллические кварцевые чипы могут быть переработаны и повторно использованы после процедуры очистки с использованием мыла и органических растворителей, которые удаляют масляный и белковый мусор. Обычно около 80-90% этих деликатных чипсов можно очистить без повреждений для следующих экспериментов. В случае небольших кристаллов на микросфокусированной линии луча, когда должна быть достигнута лучшая точность в позиционировании кристаллов, могут быть модернизированы некоторые аппаратные компоненты, такие как более тонкие двигатели, лучшая камера и оптика, большее увеличение и т. Д. Однако ни один из них не близок к современным ограничениям. Поэтому много места доступно для улучшения без особого труда.
Раскрытие информации
ZR является изобретателем кристаллических чипов на кристалле в патенте США 9632042 выдан Renz Research, Inc.
Благодарности
Использование Advanced Photon Source, пользовательского объекта Управления науки, управляемого для Министерства энергетики США Аргоннской национальной лабораторией, было поддержано контрактом DE-AC02-06CH11357. Использование BioCARS было поддержано Национальным институтом общих медицинских наук Национальных институтов здравоохранения под номером гранта R24GM111072. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения. Использование LS-CAT Sector 21 было поддержано Мичиганской корпорацией экономического развития и грантом Michigan Technology Tri-Corridor 085P1000817. Эта работа поддерживается грантами Университета Иллинойса в Чикаго, Национальных институтов здравоохранения (R01EY024363) и Национального научного фонда (MCB 2017274) для XY.
Материалы
| Name | Company | Catalog Number | Comments |
| Analysis software | In-house developed | ||
| Cerium doped yttrium aluminum garnet | MSE Supplies | Ce:Y3Al5O12, YAG single crystal substrates | |
| Chip holder | In-house developed | ||
| Control software | In-house developed | ||
| Immersion oil | Cargille Laboratories | 16482 | Type A low viscosity 150 cSt |
| inSituX platform | In-house developed | ||
| IR light source | Thorlabs Incorporated | LED1085L | LED with a Glass Lens, 1085 nm, 5 mW, TO-18 |
| Microscope | Zeiss | SteREO Discovery V8 | |
| Outer ring | In-house developed | ||
| Petri dish | Fisher Scietific | FB0875713 | |
| Pipette | Pipetman | F167380 | P10 |
| Pump lasers | Thorlabs Incorporated | LD785-SE400 | 785 nm, 400 mW, Ø9 mm, E Pin Code, Laser Diode |
| Raspberry Pi | Raspberry Pi Fundation | ||
| Retaining ring | Thorlabs Incorporated | SM1RR | SM1 retaining ring for Ø1" lens tubes and mounts |
| Seedless quartz crystal | University Wafers, Inc. | U01-W2-L-190514 | 25.4 mm diameter Z-cut 0.05 mm thickness double side polish 8 mm on -X |
| Shim | In-house developed | ||
| X-ray beam stop | In-house developed |
Ссылки
- Brändén, G., Neutze, R. Advances and challenges in time-resolved macromolecular crystallography. Science. 373, (2021).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, (2021).
- Schaffer, J. E., Kukshal, V., Miller, J. J., Kitainda, V., Jez, J. M. Beyond X-rays: an overview of emerging structural biology methods. Emerging Topics in Life Sciences. 5 (2), 221-230 (2021).
- Nogales, E., Scheres, S. H. W. Cryo-EM: A unique tool for the visualization of macromolecular complexity. Molecular Cell. 58, 677-689 (2015).
- Chapman, H. N., Caleman, C., Timneanu, N. Diffraction before destruction. Philosophical Transactions of the Royal Society B Biological Sciences. 369, 20130313 (2014).
- Kisselman, G., et al. X-CHIP: an integrated platform for high-throughput protein crystallization and on-the-chip X-ray diffraction data collection. Acta Crystallographica Section D Biological Crystallography. 67 (6), 533-539 (2011).
- Liang, M., et al. Novel combined crystallization plate for high-throughput crystal screening and in situ data collection at a crystallography beamline. Acta Crystallographica Section F Structural Biology Communications. 77, 319-327 (2021).
- le Maire, A., et al. In-plate protein crystallization, in situ ligand soaking and X-ray diffraction. Acta Crystallographica Section D Biological Crystallography. 67, 747-755 (2011).
- Perry, S. L., et al. In situ serial Laue diffraction on a microfluidic crystallization device. Journal of Applied Crystallography. 47, 1975-1982 (2014).
- Ren, Z., et al. Crystal-on-crystal chips for in situ serial diffraction at room temperature. Lab on a Chip. 18, 2246-2256 (2018).
- Ren, Z. Single crystal quartz chips for protein crystallization and X-ray diffraction data collection and related methods. US patent. , (2017).
- Ren, Z., et al. An automated platform for in situ serial crystallography at room temperature. IUCrJ. 7, 1009-1018 (2020).
- Croes, G. A. A method for solving traveling salesman problems. Operations Research. 6, 791-812 (1958).
- Bandara, S., et al. Crystal structure of a far-red-sensing cyanobacteriochrome reveals an atypical bilin conformation and spectral tuning mechanism. Proceedings of the National Academy of Sciences of the United States of America. 118, 2025094118 (2021).
- Shin, H., Ren, Z., Zeng, X., Bandara, S., Yang, X. Structural basis of molecular logic OR in a dual-sensor histidine kinase. Proceedings of the National Academy of Sciences of the United States of America. 116, 19973-19982 (2019).
- Yang, X., Ren, Z., Kuk, J., Moffat, K. Temperature-scan cryocrystallography reveals reaction intermediates in bacteriophytochrome. Nature. 479, 428-432 (2011).
- Zhang, F., Scheerer, P., Oberpichler, I., Lamparter, T., Krauss, N. Crystal structure of a prokaryotic (6-4) photolyase with an Fe-S cluster and a 6,7-dimethyl-8-ribityllumazine antenna chromophore. Proceedings of the National Academy of Sciences of the United States of America. 110, 7217-7222 (2013).
- Zeng, X., et al. Dynamic crystallography reveals early signaling events in ultraviolet photoreceptor UVR8. Nature Plants. 1, 14006 (2015).
- Wang, M., et al. Insights into base selectivity from the 1.8 Å resolution structure of an RB69 DNA polymerase ternary complex. Biochemistry. 50, 581-590 (2011).
- Rodgrs, D. W. Cryocrystallography. Structure. 2, 1135-1140 (1994).
- Zhao, F. -. Z., et al. A guide to sample delivery systems for serial crystallography. TheFEBS Journal. 286, 4402-4417 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены