Method Article
On-Chip-Kristallisation und großflächige serielle Beugung bei Raumtemperatur
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Beitrag beschreibt, wie man die Proteinkristallisation auf Crystal-on-Crystal-Geräten einrichtet und wie man eine automatisierte serielle Datenerfassung bei Raumtemperatur mit der On-Chip-Kristallisationsplattform durchführt.
Zusammenfassung
Biochemische Reaktionen und biologische Prozesse können am besten verstanden werden, indem gezeigt wird, wie Proteine zwischen ihren funktionellen Zuständen übergehen. Da kryogene Temperaturen unphysiologisch sind und die Proteinstrukturdynamik verhindern, abschrecken oder sogar verändern können, ist eine robuste Methode für routinemäßige Röntgenbeugungsexperimente bei Raumtemperatur sehr wünschenswert. Das Crystal-on-Crystal-Gerät und die dazugehörige Hard- und Software, die in diesem Protokoll verwendet werden, sind so konzipiert, dass sie eine In-situ-Röntgenbeugung bei Raumtemperatur für Proteinkristalle unterschiedlicher Größe ohne Probenmanipulation ermöglichen. Hier stellen wir die Protokolle für die wichtigsten Schritte von der Gerätemontage, On-Chip-Kristallisation, optischem Scannen, Kristallerkennung bis hin zur Röntgenaufnahmeplanung und automatisierten Datenerfassung vor. Da diese Plattform keine Kristallgewinnung oder andere Probenmanipulation erfordert, können Hunderte bis Tausende von Proteinkristallen, die auf Chip gezüchtet werden, programmierbar und mit hohem Durchsatz in einen Röntgenstrahl eingebracht werden.
Einleitung
Aufgrund der ionisierenden Wirkung von Röntgenstrahlung war die Proteinkristallographie in den letzten drei Jahrzehnten weitgehend auf kryogene Bedingungen beschränkt. Daher ergibt sich das aktuelle Wissen über Proteinbewegungen während seiner Funktion weitgehend aus Vergleichen zwischen statischen Strukturen, die in verschiedenen Zuständen unter kryogenen Bedingungen beobachtet wurden. Kryogene Temperaturen behindern jedoch unweigerlich das Fortschreiten einer biochemischen Reaktion oder Interkonversion zwischen verschiedenen Konformationszuständen, während Proteinmoleküle arbeiten. Um die Proteinstrukturdynamik mit atomarer Auflösung direkt durch Kristallographie zu beobachten, sind robuste und routinemäßige Methoden zur Durchführung von Beugungsexperimenten bei Raumtemperatur erforderlich, was technische Innovationen in der Probenabgabe, Datenerfassung und posterioren Datenanalyse erfordert. Zu diesem Zweck haben die jüngsten Fortschritte in der seriellen Kristallographie neue Wege eröffnet, um die molekularen Bilder von Zwischenprodukten und kurzlebigen Strukturspezies bei Raumtemperatur 1,2,3 aufzunehmen. Im Gegensatz zu der in der konventionellen Kryokristallographie weit verbreiteten "Ein-Kristall-ein-Datensatz"-Strategie verfolgt die serielle Kristallographie eine Datenerfassungsstrategie, die der Einzelpartikel-Kryo-Elektronenmikroskopie ähnelt. Konkret werden die experimentellen Daten in der seriellen Kristallographie in kleinen Fraktionen aus einer großen Anzahl von Einzelproben gesammelt, gefolgt von einer intensiven Datenverarbeitung, bei der Datenfraktionen ausgewertet und zu einem vollständigen Datensatz zur 3D-Strukturbestimmung zusammengeführt werden4. Diese "One-Crystal-One-Shot"-Strategie mildert effektiv die Röntgenstrahlungsschädigung von Proteinkristallen bei Raumtemperatur durch eine Beugung vor der Zerstörungsstrategie5.
Da die serielle Kristallographie eine große Anzahl von Proteinkristallen benötigt, um einen Datensatz zu vervollständigen, stellt sie viele biologische Systeme, in denen Proteinproben begrenzt sind und/oder eine empfindliche Kristallhandhabung erforderlich ist, vor große technische Herausforderungen. Eine weitere wichtige Überlegung ist, wie die Kristallintegrität in seriellen Beugungsexperimenten am besten erhalten werden kann. Die In-situ-Beugungsmethoden adressieren diese Bedenken, indem sie es Proteinkristallen ermöglichen, direkt von dort zu beugen, wo sie wachsen, ohne die Versiegelung der Kristallisationskammer 6,7,8,9 zu brechen. Diese handhabungsfreien Verfahren sind selbstverständlich kompatibel mit großflächiger serieller Beugung. Wir haben kürzlich über das Design und die Implementierung einer Kristallisationsvorrichtung für die In-situ-Beugung berichtet, die auf einem Crystal-on-Crystal-Konzept basiert - Proteinkristalle, die direkt auf monokristallinem Quarz11 gezüchtet werden. Dieses "Kristall-auf-Kristall"-Gerät bietet mehrere Vorteile. Erstens verfügt es über ein röntgen- und lichttransparentes Fenster aus einem monokristallinen Quarzsubstrat, das wenig Hintergrundstreuung erzeugt, was zu hervorragenden Signal-Rausch-Verhältnissen in Beugungsbildern von Proteinkristallen führt. Zweitens ist der einkristalline Quarz eine ausgezeichnete Dampfsperre, die Glas entspricht und somit eine stabile Umgebung für die Proteinkristallisation bietet. Im Gegensatz dazu neigen andere Kristallisationsvorrichtungen, die polymerbasierte Substrate verwenden, aufgrund der Dampfdurchlässigkeit zum Austrocknen, es sei denn, das Polymermaterial weist eine erhebliche Dicke auf, was folglich zu einer hohen Hintergrundstreuung beiträgt10. Drittens ermöglicht dieses Gerät die Abgabe einer großen Anzahl von Proteinkristallen an den Röntgenstrahl ohne jegliche Form von Kristallmanipulation oder -ernte, was für die Erhaltung der Kristallintegrität entscheidend ist11.
Um serielle Röntgenbeugungsexperimente mit den Crystal-on-Crystal-Geräten zu rationalisieren, haben wir einen Diffraktometer-Prototyp entwickelt, der ein einfaches Umschalten zwischen den optischen Scanning- und Röntgenbeugungsmodi12 erleichtert. Dieses Diffraktometer hat einen geringen Platzbedarf und wurde für die serielle Datenerfassung an zwei Beamlines der Advanced Photon Source (APS) am Argonne National Laboratory verwendet. Konkret haben wir BioCARS 14-ID-B für die Laue-Beugung und LS-CAT 21-ID-D für die monochromatische Oszillation verwendet. Diese Diffraktometer-Hardware ist nicht erforderlich, wenn eine Synchrotron- oder Röntgen-Freie-Elektronen-Laser-Beamline mit zwei Schlüsselfunktionen ausgestattet ist: (1) motorisierte Probenpositionierung mit einem Verfahrbereich von ±12 mm um den Röntgenstrahl in alle Richtungen; und (2) eine On-Axis-Digitalkamera für die Kristallbetrachtung unter Lichtbeleuchtung, die für untersuchte Proteinkristalle sicher ist. Das monokristalline Quarzgerät bildet zusammen mit einem tragbaren Diffraktometer und der Steuerungssoftware für optisches Scannen, Kristallerkennung und automatisierte In-situ-Datenerfassung die inSituX-Plattform für die serielle Kristallographie. Obwohl diese Entwicklung in erster Linie durch ihre dynamischen Kristallographie-Anwendungen mit einer polychromatischen Röntgenquelle motiviert ist, haben wir das Potenzial dieser Technologie zur Unterstützung monochromatischer Oszillationsmethoden10,12 demonstriert. Mit Automatisierung bietet diese Plattform eine serielle Datenerfassungsmethode mit hohem Durchsatz bei Raumtemperatur mit erschwinglichem Proteinverbrauch.
In diesem Beitrag beschreiben wir im Detail, wie man die On-Chip-Kristallisation in einem Nasslabor aufbaut und wie man serielle Röntgendatenerfassung an einer Synchrotron-Beamline mit der inSituX-Plattform durchführt.
Die Batch-Methode wird verwendet, um eine On-Chip-Kristallisation unter einer ähnlichen Bedingung wie die Dampfdiffusionsmethode für dieselbe Proteinprobe einzurichten (Tabelle 1). Als Ausgangspunkt empfehlen wir, Fällungsmittel in einer 1,2-1,5-fachen Konzentration für die Dampfdiffusionsmethode zu verwenden. Bei Bedarf kann die Chargenkristallisation durch Feingittersiebung weiter optimiert werden. Quarzwafer sind für Optimierungsversuche nicht notwendig; Stattdessen können Glasdeckgläser verwendet werden (siehe unten). Teilweise beladene Kristallisationsgeräte werden empfohlen, um Optimierungsversuche in kleinerem Maßstab durchzuführen. Eine Reihe von Proteinproben wurde erfolgreich auf solchen Geräten unter Verwendung der Batch-Methode10 kristallisiert (Tabelle 1).
Das Gerät selbst besteht aus folgenden Teilen: 1) einem äußeren Ring; 2) zwei Quarzwafer; 3) eine scheibenartige Unterlegscheibe aus Kunststoff oder Edelstahl; 4) einen Sicherungsring; 5) Mikroskop-Tauchöl als Dichtmittel (Abbildung 1). Das Gesamtvolumen der Kristallisationslösung, die auf einen Chip geladen wird, hängt vom Zweck des Experiments ab. Die Kapazität der Kristallisationskammer kann durch Auswahl einer Unterlegscheibe unterschiedlicher Dicke und/oder Innendurchmesser eingestellt werden. Wir richten routinemäßig Kristallisationsgeräte mit einer Kapazität von 10-20 μL mit Scheiben von 50-100 μm Dicke ein. Ein typisches Gerät kann Zehntausende bis Tausende von Proteinkristallen produzieren, die für die serielle Datenerfassung geeignet sind (Abbildung 2).
Wenn die On-Chip-Kristallisation erfolgreich ist, werden Dutzende bis Hunderte oder sogar Tausende von Proteinkristallen auf jedem Quarzgerät erzeugt, die für die Röntgenbeugung bereit sind. An einer Synchrotron-Beamline wird eine solche Vorrichtung mittels eines kinematischen Mechanismus auf einem dreiachsigen Translationstisch des Diffraktometers montiert. Das Kristallisationsfenster eines montierten Gerätes wird optisch gescannt und in Dutzenden bis Hunderten von Mikroaufnahmen abgebildet. Diese Mikroaufnahmen werden dann zu einer hochauflösenden Montage zusammengefügt. Bei lichtempfindlichen Kristallen kann das optische Scannen unter Infrarotlicht (IR) durchgeführt werden, um eine unbeabsichtigte Photoaktivierung zu vermeiden. Eine Computer-Vision-Software wurde entwickelt, um zufällig auf dem Gerät verteilte Proteinkristalle zu identifizieren und zu lokalisieren. Diese Kristalle werden dann nach ihrer Größe, Form und Position eingestuft, um die Datenerfassungsstrategie in der seriellen Kristallographie zu informieren oder zu leiten. Zum Beispiel können einzelne oder mehrere Schüsse auf jedem Zielkristall lokalisiert werden. Benutzer konnten einen einzelnen Durchgang oder mehrere Routen durch gezielte Kristalle planen. Wir haben Software implementiert, um verschiedene Reiserouten zu berechnen. Zum Beispiel wird die kürzeste Route mit Algorithmen berechnet, die das Problem des Handlungsreisenden13 angehen. Für dynamische kristallographische Pump-Probe-Anwendungen können Zeitpunkt und Dauer von Laser- (Pump) und Röntgenaufnahmen (Sonde) gewählt werden. Eine automatisierte serielle Datenerfassung ist so programmiert, dass sie jeden Zielkristall nacheinander in den Röntgenstrahl transloziert.
Zu den wichtigsten Komponenten des insituX-Diffraktometers gehören: 1) ein Gerätehalter; 2) eine dreiachsige Übersetzungsstufe; 3) eine Lichtquelle für optisches Scannen; 4) ein Röntgenstrahlstopp; 5) Pumplaser, wenn lichtempfindliche Proteine untersucht werden; 6) Raspberry Pi Mikrocomputer mit einer IR-empfindlichen Kamera; 7) Steuerungssoftware zur Synchronisierung von Motoren, Kameras, Lichtquellen, Pumplaser und zur Schnittstelle mit Beamline-Steuerungen.
Protokoll
1. Gerätevormontage
- Beschriften Sie den Außenring (30 mm Durchmesser) zur Probenidentifikation. Geben Sie ggf. den Projektnamen, die Gerätenummer, die Kristallisationsbedingung und das Datum an (Abbildung 1A). Legen Sie den äußeren Ring kopfüber auf eine saubere Oberfläche (Abbildung 1B), und legen Sie vorsichtig einen Quarzwafer in den Ring (Abbildung 1C). Dieser erste Quarzwafer dient als Eingangsfenster für die einfallenden Röntgenstrahlen.
- Gießen Sie eine kleine Menge Mikroskop-Tauchöl (Viskosität von 150 cSt) in eine Petrischale. Tauchen Sie eine Unterlegscheibe in das Öl, und stellen Sie sicher, dass beide Seiten der Unterlegscheibe ordnungsgemäß geölt sind (Abbildung 1D). Entfernen Sie das überschüssige Öl, indem Sie die Unterlegscheibe auf eine saubere Oberfläche tupfen.
- Legen Sie die geölte Unterlegscheibe auf den ersten Quarzwafer (Abbildung 1E).
HINWEIS: Tauchöl ist ein ausgezeichnetes Dichtmittel, das die Kristallisationskammer vor potenziellem Dampfverlust schützt. Richtig montierte Späne halten in der Regel wochenlang ohne sichtbare Trocknung. Dieser Vormontageschritt erfolgt unter Raumlicht. Bei lichtempfindlichen Proben müssen alle nachfolgenden Schritte, einschließlich Probenbeladung, Gerätelagerung und Beobachtung, unter Sicherheitslicht durchgeführt werden.
2. Probenbeladung und Gerätemontage
- Verwenden Sie eine Pipette, um die Proteinlösung und den Kristallisationspuffer auf dem ersten Quarzwafer gründlich zu mischen. Das Volumenverhältnis zwischen Proteinprobe und Puffer liegt typischerweise zwischen 2:1 und 1:2 (Abbildung 1F). Stellen Sie sicher, dass das Gesamtvolumen der Kristallisationslösung die maximale Kapazität der Kristallisationskammer, die durch die Größe und Dicke der Unterlegscheibe bestimmt wird, nicht überschreitet. Vermeiden Sie Luftblasen während des Mischens.
HINWEIS: Die Zusammensetzung eines Kristallisationspuffers variiert von Experiment zu Experiment. Die Kristallisationsbedingungen finden Sie in Tabelle 1 . - Platzieren Sie den zweiten Quarzwafer über der Mischlösung, wenn sich die Lösung auszubreiten beginnt (Abbildung 1G). Dieser zweite Quarzwafer dient als Austrittsfenster der gebeugten Röntgenstrahlen.
- Klopfen Sie den zweiten Quarzwafer leicht auf den Rand, um das Öl zu verteilen und gleichzeitig Luft herauszudrücken. Sichern Sie das Gerät, indem Sie einen Sicherungsring in den Außenring schrauben (Abbildung 1H). Verwenden Sie bei Bedarf ein Anzugswerkzeug (Abbildung 1I). Beachten Sie, dass eine übermäßige Straffung dazu führen kann, dass sich empfindliche Quarzwafer verformen oder sogar reißen.
3. Gerätespeicherung und Kristallisationsoptimierung
- Lagern Sie die montierten Geräte (Abbildung 1J) in einer Box bei Raumtemperatur oder in einem Inkubator mit Temperaturregelung.
HINWEIS: Proteinkristalle können in wenigen Stunden bis Tagen nach dem Zusammenbau einer Kristallisationsvorrichtung auftreten. Typische Ergebnisse der On-Chip-Kristallisation sind für mehrere repräsentative Proteinproben dargestellt (Abbildung 2). - Überwachen Sie das Kristallwachstum, indem Sie die Kristallisationsvorrichtung unter einem Mikroskop beobachten. Falls erforderlich, optimieren Sie die Kristallisationsbedingungen durch Iterationen der Abschnitte 1-3.
4. Kalibrierung
HINWEIS: Die in den folgenden Abschnitten genannten Programme und Befehle werden in der inSituX-Software ausgeführt.
- Installieren Sie einen dünnen Kristall aus dotiertem Yttrium-Aluminium-Granat auf dem Chiphalter (Abbildung 3). Installieren Sie den Strahlanschlag. Machen Sie Röntgenfluoreszenzbilder des direkten Strahls, indem Sie das Programm ausführen:
burnmark.py .param
Dabei ist ein vom Benutzer ausgewählter Name für das Kristallisationsgerät. .param ist ein Dateiname, der gerätespezifische Steuerungsparameter enthält. Die Standardwerte werden schrittweise durch spezifische Werte entlang des Protokolls ersetzt. Eine Beispieldatei .param wird in Zusatzdatei 1 gezeigt. - Finden Sie die genaue Position des direkten Röntgenstrahls, indem Sie das Strahlprofilanpassungsprogramm ausführen:
beam.py-d
wobei der Dateiname des Röntgenfluoreszenzbildes ist (Abbildung 4).
HINWEIS: Dieses Programm berechnet die genauen direkten Strahlpositionen sowie die Strahlgröße. Die Strahlposition markiert das Translokationsziel für alle Kristalle desselben Geräts. Die Strahlgröße wird auch für die Zielplanung verwendet.
5. Optisches Scannen
- Setzen Sie eine Kristallisationsvorrichtung in den Chiphalter ein, und sichern Sie das Gerät mit einer Rändelschraube (Abbildung 3A).
- Montieren Sie den Chiphalter über einen kinematischen Mechanismus auf dem Translationstisch des Diffraktometers (Abbildung 3B).
- Installieren Sie eine geeignete Lichtquelle für die Aufnahme von Mikroaufnahmen aus dem optischen Fenster des Geräts. Weißlicht, IR-Licht oder anderes Licht der Wahl kann abhängig von der Lichtempfindlichkeit der Proteinprobe sowie dem Zweck des Experiments verwendet werden.
- Führen Sie das Scanprogramm aus:
scan.py .param
Dieses Programm erfasst eine Reihe von Mikroaufnahmen, die automatisch auf bestimmte Benutzercomputer übertragen werden. - Führen Sie das Kachelprogramm auf einem Benutzercomputer aus:
tile.py -x -y
wobei < x > und die Anfangswerte für Spalten- bzw. Zeilenverschiebungen von Mikrobildern sind. Dieses Programm fügt alle Mikroaufnahmen zu einer Montage von 1-3 μm/Pixel Auflösung zusammen (Abbildung 5).
HINWEIS: Die Schritte 5.4 und 5.5 dauern in der Regel einige Minuten. Die Gesamtzahl der Mikroaufnahmen reicht von einigen zehn bis zu hunderten, abhängig von der Scanfläche und der Vergrößerung. - Führen Sie das Kristallfindungsprogramm aus:
findX.py -c -w -x
wobei das gekachelte Bild ist. Dieses Programm führt Kristallerkennung und Schussplanung durch. > und geben die zu findende Kristallgröße an. Wenn der Benutzer kleinere Kristalle vermeiden möchte, kann als Cutoff verwendet werden, indem eine Zahl eingestellt wird, die größer ist als die Größe unerwünschter kleiner Kristalle. ist ein Winkelwert, der die Toleranz für Kristalle mit unregelmäßiger Form festlegt. bezieht sich auf die direkte Strahlgröße, die sich aus der obigen Profilverschraubung ergibt (Schritt 4.2; Abbildung 4). Außerdem kann ein Sollwert von Benutzern festgelegt werden, um gezielte Aufnahmen weiter zu verteilen. Diese Schlüsselparameter ermöglichen eine spezifische Kristallauswahl und Zielplanung (Abbildung 6).
6. Röntgenbeugung
- Entfernen Sie die Lichtquelle und installieren Sie den Strahlstopp. Stellen Sie einen geeigneten Detektorabstand ein. Folgen Sie dem Sicherheitsprotokoll der Beamline, um den Röntgenstall zu durchsuchen. Öffnen Sie den Röntgenverschluss und ggf. den Laserverschluss.
- Führen Sie das Datenerfassungsprogramm für die serielle Beugung aus:
collect.py .param -l
Dieser Befehl löst eine Datenerfassung aus, bei der alle geplanten Aufnahmen nacheinander nach einer vorprogrammierten Reihenfolge besucht werden. Jeder Zielkristall wird in die Strahlposition transloziert (Schritt 4.2). Bei jedem Stopp erfolgt die Röntgenbelichtung mit oder ohne Laserbeleuchtung in einer geplanten Zeitverzögerung. Film 1 zeigt eine automatisierte Datenerfassungssequenz , die mit einer Frequenz von 1 Hz betrieben wird. Routinemäßig werden Dutzende bis Hunderte von Beugungsbildern von einer einzigen Kristallisationsvorrichtung gesammelt (Film 2).
HINWEIS: Abschnitt 4 Kalibrierung und Abschnitt 5 optischer Scan sind in der inSituX-Plattform enthalten und daher vollständig auf eine andere Beamline übertragbar. Abschnitt 6 Röntgenbeugung muss einige Details im Betrieb der Strahllinie beinhalten.
Ergebnisse
Mehrere repräsentative Datensätze wurden in den letzten Jahren veröffentlicht 10,12 zusammen mit den kristallographischen Ergebnissen und wissenschaftlichen Erkenntnissen aus einer Vielzahl von Proteinproben, einschließlich Photorezeptorproteinen und Enzymen, zum Beispiel einem pflanzlichen UV-B-Photorezeptor UVR8, einer lichtgetriebenen DNA-Reparaturphotolyase PhrB10, einem neuartigen Fern-Rotlicht-Sensorprotein aus einer multidomänensensorischen Histidinkinase 14 , Ligand/Licht-Dual-Sensor-Domänen und das photosensorische Kernmodul eines Bakteriophytochroms12. Als repräsentative Ergebnisse listen wir die On-Chip-Kristallisationsbedingungen dieser Proteine in Tabelle 1 auf und vergleichen sie direkt mit den Bedingungen, die für die Dampfdiffusionsmethode verwendet werden. Hier zeigen wir vier weitere Fallstudien zur On-Chip-Kristallisation (Abbildung 2) und eine Sammlung von In-situ-Beugungsmustern in einem Film (Film 2). Repräsentative In-situ-Datensätze, die mit diesem Protokoll gesammelt wurden, sind in Tabelle 2 zusammengefasst.
In einem repräsentativen Fall führte die Kryokristallographie zu einer schlechten Beugung für ein fernrotlichtempfindliches Photorezeptorprotein, wahrscheinlich aufgrund der Lichtempfindlichkeit und des hohen Lösungsmittelgehalts (~ 80%) dieser Kristalle14. Die Elektronendichten, die aus den kryokristallographischen Daten gewonnen wurden, waren zu verschmiert, um die Chromophorkonformation aufzulösen, die im Zentrum unserer wissenschaftlichen Frage steht. Mit dem In-situ-Protokoll konnten wir eine unbeabsichtigte Lichtaktivierung vor der Beugung vermeiden und einen dunklen Datensatz bei Raumtemperatur aus mehr als 800 Kristallen erhalten. Dieser dunkle Datensatz aus der in situ seriellen Laue-Beugung führte zu besser aufgelösten Elektronendichten, was eine zuverlässige Modellbildung eines Bilin-Chromophors ermöglichte, das eine bisher unbekannte All-Z,syn-Konformation aufweist (Abbildung 7A)12,14. Unsere dynamischen Kristallographie-Experimente haben außerdem lichtinduzierte Veränderungen in diesem tiefroten Photorezeptorprotein aufgedeckt, indem sie Daten von 4.352 Kristallen in Dunkelheit und 8.287 Kristallen nach Lichtbeleuchtung verglichen haben (Abbildung 7). Eine vorläufige Analyse der lichtinduzierten Differenzkarten ergab konzertierte Bewegungen im zentralen β Blatt, was auf die Bedeutung der π-π-Stapelung zwischen den Pyrrolringen des Chromophors und mehreren aromatischen Resten hindeutet (Abbildung 7B,C). Eine vertiefte Analyse und wissenschaftliche Erkenntnisse werden an anderer Stelle vorgestellt.

Abbildung 1: Kristallisationsvorrichtung. Jede Baugruppe kostet schätzungsweise 30 US-Dollar mit zwei monokristallinen Quarzwafern oder 10 US-Dollar mit zwei Glasdeckgläsern. Hardwarekomponenten mit Ausnahme des Shim sind wiederverwendbar. (A) Die flache Seite des äußeren Rings ist zu Identifizierungszwecken beschriftet. (B) Der äußere Ring wird kopfüber auf eine saubere Oberfläche gelegt. (C) Ein Quarzwafer von 1 Zoll Durchmesser wird sorgfältig im Inneren platziert. Ein Glaschip könnte stattdessen auch während Kristallisationsversuchen verwendet werden, ist aber nicht mit Röntgenbeugung kompatibel. (D) Beide Seiten der Unterlegscheibe sind geölt. (E) Die geölte Unterlegscheibe wird auf den ersten Quarzchip gelegt. (F) Protein- und Kristallisationslösungen werden in die Mitte des Chips pipettiert und gemischt. (G) Ein zweiter Quarz- oder Glassplitter bedeckt den Tropfen, so dass er sich gleichmäßig über den Chip verteilt. (H) Über den zweiten Quarzwafer wird ein Sicherungsring geschraubt. (I) Ein Anzugswerkzeug wird verwendet, um den Sicherungsring vorsichtig festzuziehen. (J) Ein vollständig montiertes Gerät. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
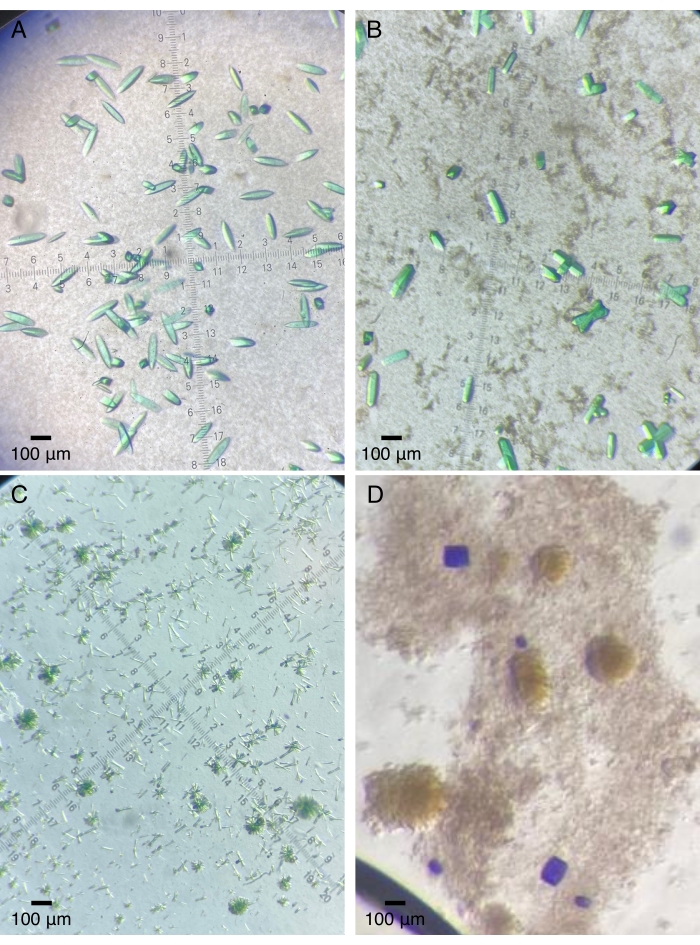
Abbildung 2: Repräsentative Proteinkristalle, die auf Quarzgeräten gezüchtet wurden. (A) Das photosensorische Kernmodul eines Bakteriophytochroms (Pa497 in Tabelle 1). (B,C) Verschiedene Konstrukte der dritten GAF-Domäne aus einer multidomänensensorischen Histidinkinase (2551g3 und 2551g3Δα1 in Tabelle 1). (D) Die sensorischen Tandemdomänen einer Dualsensor-Histidinkinase (RECGAF in Tabelle 1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: inSituX-Diffraktometer . (A) Im Chiphalter ist eine Kristallisationsvorrichtung montiert. Obwohl das Gerät vertikal montiert ist, werden Kristalle, die auf Chip gezüchtet werden, nicht fallen, vor allem, weil die Flüssigkeitsschicht in einem zusammengebauten Gerät sehr dünn ist und Kristalle beim Wachstum an ihren Kernen verankert werden. (B) Für den optischen Scan ist eine IR-Lichtquelle installiert. Die Kamera erfasst die Inline-Ansicht der Proteinkristalle entlang des Röntgenstrahls durch einen Prismenspiegel (im Bild nicht sichtbar). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Direkte Trägerprofilanpassung. Die roten, grünen und blauen Kanäle des Röntgenfluoreszenzbildes werden verwendet, um eine zweidimensionale Gaußfunktion anzupassen. Die linke Spalte zeigt das Rohbild der roten, grünen und blauen Kanäle. Die mittlere Säule ist das passende Ergebnis mit der genauen Strahlposition und -größe. In der rechten Spalte werden die Fitting-Residuen angezeigt. Wenn die Amplitude der Fitting-Residuen einen kleinen Bruchteil des Rohbildes überspannt, ist die Profilanpassung des Direktstrahls erfolgreich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
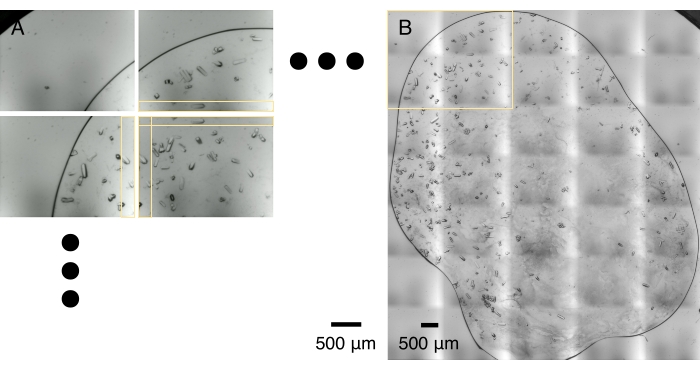
Abbildung 5: Bildkachelung . (A) Während eines optischen Scans wird eine Reihe kristallmikroskopischer Aufnahmen aufgenommen. Der optische Scan und die Datenübertragung dauern in der Regel 1-2 min. Benachbarte Mikroaufnahmen teilen sich einen Streifen überlappender Fläche, horizontal und vertikal, wie durch gelbe Kästchen gekennzeichnet. (B) Mikroaufnahmen werden zusammengefügt, um eine hochauflösende Montage zu erstellen, die auf der optimalen Korrelation in den überlappenden Bereichen basiert. Dieser Vorgang dauert normalerweise eine Minute auf einem Laptop-Computer. Der gelbe Kasten umreißt den Bereich, der von 2 x 2 Mikroaufnahmen erfasst wird, die in (A) gezeigt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Kristallerkennung und Aufnahmeplanung. Jeder rosa Kreis markiert die primäre Aufnahme eines Kristalls. Die gelben Kreise markieren zusätzliche Aufnahmen, wenn ein Kristall lang genug ist, um diese Aufnahmen zu positionieren. Die rosa Linien markieren eine Route als Lösung für das Problem des Handlungsreisenden. Clusterkristalle und kleinere Kristalle werden weitgehend vermieden. Die Aggressivität der Kristallsuche kann optional an findX.py angepasst werden (Schritt 5.6). Eine Brute-Force-"Overkill"-Strategie würde keinen Kristall ungedreht lassen, könnte aber viele Beugungsbilder erzeugen, aber nicht verarbeitbar12. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
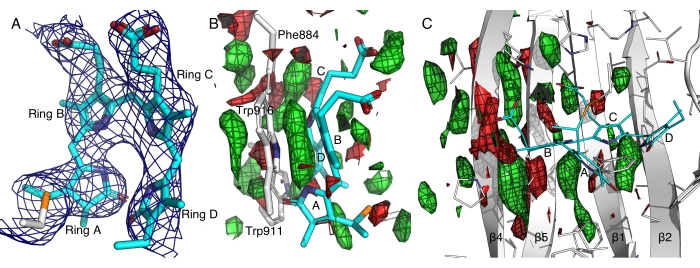
Abbildung 7: Elektronendichtekarten der Fernrotlicht-Sensordomäne einer Histidinkinase . (A) Die bei 2,5σ konturierte 2Fo-Fc-Karte zeigt die Elektronendichten, die mit dem Bilin-Chromophor in einer All-Z,syn-Konformation assoziiert sind 14. Die Pyrrolringe A bis D sind markiert. (B und C) Hell-Dunkel-Differenzabbildungen, die bei ±2,5σ in Grün bzw. Rot konturiert sind, heben die Verstärkung und den Verlust von Elektronendichten hervor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Vergleich der Kristallisationsbedingungen zwischen Dampfdiffusion und On-Chip-Batch-Methode. Dampfdiffusion und Batch-Kristallisationsmethoden sind stark korreliert 10,14,15,16,17,18,19. Ausgehend von einer Dampfdiffusionsbedingung kann eine ähnliche Bedingung für die On-Chip-Kristallisation optimiert werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Zusammenfassung der In-situ-Datensätze , die direkt von Quarzgeräten gesammelt wurden. Tausende von Laue-Beugungsmustern können von mehreren Kristallisationsgeräten gesammelt werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Film 1: Eine simulierte Datensammlung. Zielkristalle werden in den Röntgenstrahl transloziert, der durch einen roten Kreis markiert ist. Die Reihenfolge der anvisierten Kristalle in diesem Film folgt nicht einer Lösung für das Problem des Handlungsreisenden. Laser- und Röntgenaufnahmen werden an jedem Stopp mit einer programmierten Verzögerung abgefeuert. Beugungsbilder werden gesammelt. Bitte klicken Sie hier, um diesen Film herunterzuladen.
Film 2: Beugungsbilder. Hunderte von Beugungsbildern können von einem einzigen Kristallisationsgerät gesammelt werden. Mehrere Geräte reichen aus, um einen vollständigen und hochredundanten Datensatz zu erzeugen (Tabelle 2). Bitte klicken Sie hier, um diesen Film herunterzuladen.
Ergänzende Datei 1: Beispieldatei .param. Eine kleine Textdatei sammelt einige Steuerparameter, die für jedes Kristallisationsgerät spezifisch sind. Diese Parameter beginnen mit ihren Standardwerten und werden im weiteren Verlauf des Protokolls in den Abschnitten 4, 5 und 6 entsprechend geändert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Proteinkristallographie in den frühen Jahren, die bei Raumtemperatur durchgeführt wurde, hatte enorme Schwierigkeiten, Röntgenstrahlenschäden zu bekämpfen. Daher wurde es durch die robustere Kryokristallographie-Methode ersetzt, da Synchrotron-Röntgenquellen leicht verfügbar wurden20. Mit dem Aufkommen von Freie-Elektronen-Röntgenlasern wurde die Proteinkristallographie bei Raumtemperatur in den letzten Jahren wiederbelebt, wobei viele neue Entwicklungen von dem Wunsch angetrieben wurden, die Proteinstrukturdynamik bei einer physiologisch relevanten Temperatur 2,21 zu beobachten. Die Entwicklung der inSituX-Plattform, die auf den Crystal-on-Crystal-Geräten basiert, wurde von dem gleichen Ziel motiviert, nämlich routinemäßige und robuste Datenerfassungsmethoden für dynamische Kristallographiestudien bei Raumtemperatur zu etablieren. Diese automatisierte serielle Röntgenbeugungsmethode ist auch auf die statische Strukturbestimmung für Proteinkristalle anwendbar, die nicht eingefroren werdenkönnen 14. In diesem Protokoll stellen wir wichtige technische Überlegungen sowie kritische Schritte vor, die für die Datenerfassung bei Raumtemperatur mit dieser Plattform erforderlich sind. Diese Methode eignet sich besonders für zerbrechliche Proteinkristalle, die empfindlich auf mechanische Handhabung, Röntgenstrahlenschäden oder Lufteinwirkung reagieren.
Der Plattformprototyp wurde an zwei Proteinkristallographie-Beamlines an der Advanced Photon Source (APS) des Argonne National Laboratory ausgiebig getestet. Während es ziemlich einfach ist, die On-Chip-Kristallisation nach diesem Protokoll einzurichten, umfasst der Schritt der Datenerfassung mehrere maßgeschneiderte Hardware- und Softwarekomponenten. Daher kann die Anwendung und Implementierung projektspezifischer Datenerhebungsstrategien eine enge Zusammenarbeit zwischen Nutzern und Beamline-Wissenschaftlern erfordern. Mit anderen Worten, diese Technologie in ihrer derzeitigen Form ist auf diejenigen Benutzer beschränkt, die einen ausreichenden Zugang zu Synchrotrons wie APS haben. Nichtsdestotrotz würden der gesamte Arbeitsablauf und die wichtigsten Schritte, die in diesem Protokoll beschrieben werden, als Referenz oder Leitfaden für jede Forschungsgruppe dienen, die sich für die Proteinkristallographie bei Raumtemperatur interessiert.
Der wichtigste Vorteil dieser Plattform besteht darin, dass keine Kristallmanipulation wie Montieren oder Einfrieren erforderlich ist, so dass empfindliche Proteinkristalle unter unberührten Bedingungen gebeugt werden. Ein weiterer großer Vorteil ist, dass die Verwendung des monokristallinen Quarzsubstrats zu einer sehr geringen Hintergrundstreuung von Proteinbeugungsbildern führt und gleichzeitig stabile Umgebungen für die Proteinkristallisation über einen langen Zeitraum (Wochen bis Monate) bietet. Diese Plattform eignet sich jedoch nicht für das Screening von Kristallen mit spärlicher Matrix, da sie für die Kristallproduktion in großem Maßstab vorgesehen ist. Daher sind Vorkenntnisse der Kristallisationsbedingungen erforderlich, um erste On-Chip-Kristallisationsversuche für eine bestimmte Proteinprobe durchzuführen.
In der Praxis stellen wir fest, dass einige Bauelementmontageschritte, wie z. B. das Ölen einer Unterlegscheibe (Schritt 1.2) und das Versiegeln eines Geräts (Schritt 2.3), so trivial sie auch scheinen, oft direkt die Ergebnisse der Kristallisation beeinflussen. Ein Gerät kann schnell austrocknen, wenn es nicht richtig geölt wird. Darüber hinaus kann eine übermäßige Anspannung des Geräts im letzten Schritt der Montage die Quarzwafer verformen, während eine Unterspannung zu potenziellen Leckagen und / oder unkontrollierter Verdunstung aus dem Gerät führt. Ein weiterer kritischer Schritt ist die Planung von Röntgenaufnahmen. Man muss sorgfältig mit geclusterten oder überfüllten Kristallen umgehen, um überlappende Beugungsmuster zu vermeiden, die oft schwer zu verarbeiten sind. Dieses Problem kann durch den Einsatz eines mikrofokussierenden Röntgenstrahls gelindert werden. Möglicherweise könnte es schwierig sein, einen vollständigen Datensatz zu erhalten, wenn die Kristallmorphologie eine große dünne Platte ist, so dass die meisten Platten parallel zu den Quarzfenstern verlaufen. Darüber hinaus können die einkristallinen Quarzchips recycelt und nach einem Reinigungsverfahren mit Seife und organischen Lösungsmitteln, die Öl- und Proteinreste entfernen, wiederverwendet werden. In der Regel können etwa 80-90% dieser empfindlichen Späne für die nächsten Experimente ohne Beschädigung gereinigt werden. Im Falle kleiner Kristalle auf einer mikrofokussierten Beamline, wenn eine bessere Präzision bei der Kristallpositionierung erreicht werden muss, könnten mehrere Hardwarekomponenten aufgerüstet werden, z. B. feinere Motoren, bessere Kamera und Optik, größere Vergrößerung usw. Keines davon entspricht jedoch den Beschränkungen des Stands der Technik. Daher ist viel Raum für Verbesserungen ohne große Schwierigkeiten.
Offenlegungen
ZR ist der Erfinder der Crystal-on-Crystal-Chips auf dem US-Patent, das Renz Research, Inc. erteilt 9632042.
Danksagungen
Die Nutzung von Advanced Photon Source, einer Office of Science User Facility, die vom Argonne National Laboratory für das US-Energieministerium betrieben wird, wurde durch den Vertrag DE-AC02-06CH11357 unterstützt. Der Einsatz von BioCARS wurde vom National Institute of General Medical Sciences der National Institutes of Health unter der Fördernummer R24GM111072 unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und stellt nicht unbedingt die offiziellen Ansichten der National Institutes of Health dar. Die Nutzung von LS-CAT Sector 21 wurde von der Michigan Economic Development Corporation und dem Michigan Technology Tri-Corridor Grant 085P1000817 unterstützt. Diese Arbeit wird durch Zuschüsse der University of Illinois in Chicago, der National Institutes of Health (R01EY024363) und der National Science Foundation (MCB 2017274) an XY unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Analysis software | In-house developed | ||
| Cerium doped yttrium aluminum garnet | MSE Supplies | Ce:Y3Al5O12, YAG single crystal substrates | |
| Chip holder | In-house developed | ||
| Control software | In-house developed | ||
| Immersion oil | Cargille Laboratories | 16482 | Type A low viscosity 150 cSt |
| inSituX platform | In-house developed | ||
| IR light source | Thorlabs Incorporated | LED1085L | LED with a Glass Lens, 1085 nm, 5 mW, TO-18 |
| Microscope | Zeiss | SteREO Discovery V8 | |
| Outer ring | In-house developed | ||
| Petri dish | Fisher Scietific | FB0875713 | |
| Pipette | Pipetman | F167380 | P10 |
| Pump lasers | Thorlabs Incorporated | LD785-SE400 | 785 nm, 400 mW, Ø9 mm, E Pin Code, Laser Diode |
| Raspberry Pi | Raspberry Pi Fundation | ||
| Retaining ring | Thorlabs Incorporated | SM1RR | SM1 retaining ring for Ø1" lens tubes and mounts |
| Seedless quartz crystal | University Wafers, Inc. | U01-W2-L-190514 | 25.4 mm diameter Z-cut 0.05 mm thickness double side polish 8 mm on -X |
| Shim | In-house developed | ||
| X-ray beam stop | In-house developed |
Referenzen
- Brändén, G., Neutze, R. Advances and challenges in time-resolved macromolecular crystallography. Science. 373, (2021).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, (2021).
- Schaffer, J. E., Kukshal, V., Miller, J. J., Kitainda, V., Jez, J. M. Beyond X-rays: an overview of emerging structural biology methods. Emerging Topics in Life Sciences. 5 (2), 221-230 (2021).
- Nogales, E., Scheres, S. H. W. Cryo-EM: A unique tool for the visualization of macromolecular complexity. Molecular Cell. 58, 677-689 (2015).
- Chapman, H. N., Caleman, C., Timneanu, N. Diffraction before destruction. Philosophical Transactions of the Royal Society B Biological Sciences. 369, 20130313(2014).
- Kisselman, G., et al. X-CHIP: an integrated platform for high-throughput protein crystallization and on-the-chip X-ray diffraction data collection. Acta Crystallographica Section D Biological Crystallography. 67 (6), 533-539 (2011).
- Liang, M., et al. Novel combined crystallization plate for high-throughput crystal screening and in situ data collection at a crystallography beamline. Acta Crystallographica Section F Structural Biology Communications. 77, 319-327 (2021).
- le Maire, A., et al. In-plate protein crystallization, in situ ligand soaking and X-ray diffraction. Acta Crystallographica Section D Biological Crystallography. 67, 747-755 (2011).
- Perry, S. L., et al. In situ serial Laue diffraction on a microfluidic crystallization device. Journal of Applied Crystallography. 47, 1975-1982 (2014).
- Ren, Z., et al. Crystal-on-crystal chips for in situ serial diffraction at room temperature. Lab on a Chip. 18, 2246-2256 (2018).
- Ren, Z. Single crystal quartz chips for protein crystallization and X-ray diffraction data collection and related methods. US patent. , 9632042 (2017).
- Ren, Z., et al. An automated platform for in situ serial crystallography at room temperature. IUCrJ. 7, 1009-1018 (2020).
- Croes, G. A. A method for solving traveling salesman problems. Operations Research. 6, 791-812 (1958).
- Bandara, S., et al. Crystal structure of a far-red-sensing cyanobacteriochrome reveals an atypical bilin conformation and spectral tuning mechanism. Proceedings of the National Academy of Sciences of the United States of America. 118, 2025094118(2021).
- Shin, H., Ren, Z., Zeng, X., Bandara, S., Yang, X. Structural basis of molecular logic OR in a dual-sensor histidine kinase. Proceedings of the National Academy of Sciences of the United States of America. 116, 19973-19982 (2019).
- Yang, X., Ren, Z., Kuk, J., Moffat, K. Temperature-scan cryocrystallography reveals reaction intermediates in bacteriophytochrome. Nature. 479, 428-432 (2011).
- Zhang, F., Scheerer, P., Oberpichler, I., Lamparter, T., Krauss, N. Crystal structure of a prokaryotic (6-4) photolyase with an Fe-S cluster and a 6,7-dimethyl-8-ribityllumazine antenna chromophore. Proceedings of the National Academy of Sciences of the United States of America. 110, 7217-7222 (2013).
- Zeng, X., et al. Dynamic crystallography reveals early signaling events in ultraviolet photoreceptor UVR8. Nature Plants. 1, 14006(2015).
- Wang, M., et al. Insights into base selectivity from the 1.8 Å resolution structure of an RB69 DNA polymerase ternary complex. Biochemistry. 50, 581-590 (2011).
- Rodgrs, D. W. Cryocrystallography. Structure. 2, 1135-1140 (1994).
- Zhao, F. -Z., et al. A guide to sample delivery systems for serial crystallography. TheFEBS Journal. 286, 4402-4417 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten