Method Article
Cristalização no chip e difração serial em larga escala à temperatura ambiente
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Esta contribuição descreve como configurar a cristalização de proteínas em dispositivos cristal sobre cristal e como executar a coleta automatizada de dados seriais à temperatura ambiente usando a plataforma de cristalização no chip.
Resumo
Reações bioquímicas e processos biológicos podem ser melhor compreendidos demonstrando como as proteínas transitam entre seus estados funcionais. Como as temperaturas criogênicas não são fisiológicas e podem prevenir, dissuadir ou mesmo alterar a dinâmica estrutural das proteínas, um método robusto para experimentos rotineiros de difração de raios X à temperatura ambiente é altamente desejável. O dispositivo cristal sobre cristal e seu hardware e software que o acompanham usados neste protocolo são projetados para permitir a difração de raios-X in situ à temperatura ambiente para cristais de proteína de diferentes tamanhos sem qualquer manipulação de amostra. Aqui apresentamos os protocolos para as principais etapas desde a montagem do dispositivo, cristalização no chip, digitalização óptica, reconhecimento de cristais até o planejamento de disparos de raios-X e coleta automatizada de dados. Uma vez que esta plataforma não requer colheita de cristais nem qualquer outra manipulação de amostras, centenas a milhares de cristais de proteína cultivados em chip podem ser introduzidos em um feixe de raios-X de maneira programável e de alto rendimento.
Introdução
Devido aos efeitos ionizantes da radiação de raios-X, a cristalografia de proteínas, em grande medida, tem sido limitada a condições criogênicas nas últimas três décadas. Portanto, o conhecimento atual dos movimentos das proteínas durante sua função decorre em grande parte de comparações entre estruturas estáticas observadas em diferentes estados sob condições criogênicas. No entanto, as temperaturas criogênicas inevitavelmente dificultam a progressão de uma reação bioquímica ou interconversão entre diferentes estados conformacionais enquanto as moléculas de proteína estão em ação. Para observar diretamente a dinâmica estrutural de proteínas em resolução atômica por cristalografia, métodos robustos e rotineiros são necessários para a realização de experimentos de difração à temperatura ambiente, o que exige inovações técnicas na entrega de amostras, coleta de dados e análise posterior de dados. Para tanto, avanços recentes na cristalografia seriada têm oferecido novos caminhos para a captura de imagens moleculares de intermediários e espécies estruturais de curta duração à temperatura ambiente 1,2,3. Em contraste com a estratégia "um-cristal-um-conjunto de dados" amplamente utilizada na criocristalografia convencional, a cristalografia seriada adota uma estratégia de coleta de dados semelhante à da microscopia crio-eletrônica de partícula única. Especificamente, os dados experimentais em cristalografia seriada são coletados em pequenas frações de um grande número de amostras individuais, seguidos por um processamento intensivo de dados no qual as frações de dados são avaliadas e combinadas em um conjunto de dados completo para determinação da estrutura 3D4. Essa estratégia de "um cristal-um-tiro" efetivamente alivia os danos da radiação de raios-X aos cristais de proteína à temperatura ambiente por meio de uma difração antes da estratégia de destruição5.
Como a cristalografia em série requer um grande número de cristais de proteína para completar um conjunto de dados, ela representa grandes desafios técnicos para muitos sistemas biológicos onde as amostras de proteína são limitadas e / ou o manuseio delicado de cristais está envolvido. Outra consideração importante é a melhor forma de preservar a integridade do cristal em experimentos de difração serial. Os métodos de difração in situ abordam essas preocupações, permitindo que os cristais de proteína difratem diretamente de onde crescem sem quebrar o selo da câmara de cristalização 6,7,8,9. Esses métodos livres de manuseio são naturalmente compatíveis com difração serial em larga escala. Recentemente, relatamos o projeto e a implementação de um dispositivo de cristalização para difração in situ baseado em um conceito cristal-em-cristal - cristais de proteína cultivados diretamente em quartzo monocristalino11. Este dispositivo "cristal sobre cristal" oferece várias vantagens. Primeiro, possui uma janela transparente de raios-X e luz feita de um substrato de quartzo monocristalino, que produz pouca dispersão de fundo, resultando em excelentes relações sinal-ruído em imagens de difração de cristais de proteína. Em segundo lugar, o quartzo de cristal único é uma excelente barreira de vapor equivalente ao vidro, proporcionando assim um ambiente estável para a cristalização de proteínas. Em contraste, outros dispositivos de cristalização que utilizam substratos à base de polímeros são propensos à secagem devido à permeabilidade ao vapor, a menos que o material polimérico tenha uma espessura substancial, o que, consequentemente, contribui para o alto espalhamento de fundo10. Em terceiro lugar, esse dispositivo permite a entrega de um grande número de cristais de proteína ao feixe de raios-X sem qualquer forma de manipulação ou colheita de cristais, o que é fundamental para preservar a integridade do cristal11.
Para agilizar os experimentos seriais de difração de raios X usando os dispositivos cristal sobre cristal, desenvolvemos um protótipo de difratômetro para facilitar a comutação entre os modos de varredura óptica e difração de raios X12. Este difratômetro tem uma pegada pequena e tem sido usado para coleta de dados em série em duas linhas de luz da Fonte Avançada de Fótons (APS) no Argonne National Laboratory. Especificamente, utilizamos BioCARS 14-ID-B para difração de Laue e LS-CAT 21-ID-D para oscilação monocromática. Este hardware de difratômetro não é necessário se uma linha de luz de laser de elétrons livres de síncrotron ou raios-X estiver equipada com duas capacidades principais: (1) posicionamento motorizado da amostra com uma faixa de curso de ±12 mm ao redor do feixe de raios-X em todas as direções; e (2) uma câmera digital no eixo para visualização de cristais sob iluminação luminosa que seja segura para cristais de proteína em estudo. O dispositivo de quartzo monocristalino, juntamente com um difratômetro portátil e o software de controle para varredura óptica, reconhecimento de cristais e coleta automatizada de dados in situ, constituem coletivamente a plataforma inSituX para cristalografia serial. Embora esse desenvolvimento seja motivado principalmente por suas aplicações de cristalografia dinâmica utilizando uma fonte policromática de raios-X, demonstramos o potencial dessa tecnologia para suportar métodos de oscilação monocromática10,12. Com a automação, essa plataforma oferece um método de coleta de dados seriais de alto rendimento à temperatura ambiente com consumo de proteína acessível.
Nesta contribuição, descrevemos em detalhes como configurar a cristalização no chip em um laboratório úmido e como realizar a coleta de dados de raios-X em série em uma linha de luz síncrotron usando a plataforma inSituX.
O método do lote é utilizado para configurar a cristalização em cavaco sob uma condição semelhante à do método de difusão de vapor obtido para a mesma amostra de proteína (Tabela 1). Como ponto de partida, recomendamos o uso de precipitante na concentração de 1,2-1,5x para o método de difusão de vapor. Se necessário, a condição de cristalização em lote pode ser otimizada por meio da triagem de grade fina. As bolachas de quartzo não são necessárias para ensaios de otimização; em vez disso, podem ser usadas coberturas de vidro (veja abaixo). Dispositivos de cristalização parcialmente carregados são recomendados para manter os testes de otimização em menor escala. Várias amostras de proteína foram cristalizadas com sucesso nesses dispositivos usando o método de lote10 (Tabela 1).
O dispositivo em si consiste nas seguintes partes: 1) um anel externo; 2) duas bolachas de quartzo; 3) um calço tipo arruela de plástico ou aço inoxidável; 4) um anel de retenção; 5) óleo de imersão do microscópio como selante (Figura 1). O volume total da solução de cristalização carregada em um chip depende do propósito do experimento. A capacidade da câmara de cristalização pode ser ajustada escolhendo um calço de diferentes espessuras e/ou diâmetro interno. Rotineiramente configuramos dispositivos de cristalização de 10-20 μL de capacidade usando calços de 50-100 μm de espessura. Um dispositivo típico pode produzir dezenas a milhares de cristais de proteína adequados para a coleta de dados seriados (Figura 2).
Quando bem-sucedida, a cristalização no chip produzirá dezenas a centenas ou mesmo milhares de cristais de proteína em cada dispositivo de quartzo pronto para difração de raios-X. Em uma linha de luz síncrotron, esse dispositivo é montado em um estágio de translação de três eixos do difratômetro usando um mecanismo cinemático. A janela de cristalização de um dispositivo montado é digitalizada opticamente e fotografada em dezenas a centenas de micrografias. Essas micrografias são então costuradas em uma montagem de alta resolução. Para cristais fotossensíveis, a varredura óptica pode ser realizada sob luz infravermelha (IR) para evitar fotoativação não intencional. Um software de visão computacional foi desenvolvido para identificar e localizar cristais de proteína distribuídos aleatoriamente no dispositivo. Esses cristais são então classificados de acordo com seu tamanho, forma e posição para informar ou orientar a estratégia de coleta de dados em cristalografia seriada. Por exemplo, tiros únicos ou múltiplos podem ser localizados em cada cristal alvo. Os usuários podiam planejar uma única passagem ou várias rotas através de cristais direcionados. Implementamos um software para calcular várias rotas de viagem. Por exemplo, a rota mais curta é calculada usando algoritmos que abordam o problema do caixeiro viajante13. Para aplicações cristalográficas dinâmicas bomba-sonda, o tempo e a duração dos disparos de laser (bomba) e raios-X (sonda) podem ser escolhidos. Uma coleta de dados serial automatizada é programada para translocar cada cristal alvo no feixe de raios-X, um após o outro.
Os principais componentes do difratômetro insituX incluem: 1) um suporte de dispositivo; 2) uma etapa de tradução de três eixos; 3) uma fonte de luz para varredura óptica; 4) uma parada de feixe de raios-X; 5) lasers de bomba se forem estudadas proteínas sensíveis à luz; 6) Microcomputador Raspberry Pi equipado com uma câmera sensível ao IR; 7) software de controle para sincronizar motores, câmera, fontes de luz, bomba de laser, e para interface com os controles da linha de luz.
Protocolo
1. Pré-montagem do dispositivo
- Rotule o anel exterior (30 mm de diâmetro) para identificação da amostra. Se necessário, inclua o nome do projeto, o número do dispositivo, a condição de cristalização e a data (Figura 1A). Coloque o anel externo de cabeça para baixo em uma superfície limpa (Figura 1B) e coloque cuidadosamente uma bolacha de quartzo dentro do anel (Figura 1C). Esta primeira bolacha de quartzo serve como uma janela de entrada para os raios-X incidentes.
- Despeje uma pequena quantidade de óleo de imersão do microscópio (viscosidade de 150 cSt) em uma placa de Petri. Mergulhe um calço no óleo e certifique-se de que ambos os lados do calço estejam devidamente lubrificados (Figura 1D). Remova o excesso de óleo esfregando o calço em uma superfície limpa.
- Coloque o calço oleado em cima da primeira bolacha de quartzo (Figura 1E).
NOTA: O óleo de imersão é um excelente selante que protege a câmara de cristalização da potencial perda de vapor. Os cavacos devidamente montados geralmente duram semanas sem secagem visível. Esta etapa de pré-montagem é realizada sob luz ambiente. Para amostras sensíveis à luz, todas as etapas subsequentes, incluindo o carregamento da amostra, o armazenamento do dispositivo e a observação, devem ser realizadas sob luz de segurança.
2. Carregamento da amostra e montagem do dispositivo
- Use uma pipeta para misturar completamente a solução de proteína e o tampão de cristalização na primeira bolacha de quartzo. A razão de volume entre a amostra de proteína e o tampão normalmente varia de 2:1 a 1:2 (Figura 1F). Certifique-se de que o volume total da solução de cristalização não exceda a capacidade máxima da câmara de cristalização determinada pelo tamanho e espessura do calço. Evite bolhas de ar durante a mistura.
NOTA: A composição de um buffer de cristalização varia de um experimento para outro. Consulte a Tabela 1 para obter informações sobre as condições de cristalização. - Coloque a segunda bolacha de quartzo sobre a solução mista à medida que a solução começa a se espalhar (Figura 1G). Esta segunda bolacha de quartzo serve como a janela de saída dos raios-X difratados.
- Bata levemente na segunda bolacha de quartzo na borda para ajudar a espalhar o óleo enquanto empurra o ar para fora. Prenda o dispositivo parafusando um anel de retenção no anel externo (Figura 1H). Use uma ferramenta de aperto, se necessário (Figura 1I). Esteja ciente de que o aperto excessivo pode fazer com que bolachas de quartzo delicadas se deformem ou até mesmo rachem.
3. Otimização de armazenamento e cristalização de dispositivos
- Armazenar os dispositivos montados (Figura 1J) em uma caixa à temperatura ambiente ou dentro de uma incubadora com controle de temperatura.
NOTA: Os cristais de proteína podem aparecer em algumas horas a dias após a montagem de um dispositivo de cristalização. Os resultados típicos da cristalização em chip são mostrados para várias amostras de proteínas representativas (Figura 2). - Monitore o crescimento do cristal observando o dispositivo de cristalização sob um microscópio. Se necessário, otimize as condições de cristalização por iterações das seções 1-3.
4. Calibração
NOTA: Os programas e comandos mencionados nas seções abaixo são executados no software inSituX.
- Instale um cristal fino de granada de alumínio de ítrio dopado no suporte do chip (Figura 3). Instale a parada do feixe. Tire imagens de fluorescência de raios X do feixe direto executando o programa:
burnmark.py .param
onde é um nome selecionado pelo usuário para o dispositivo de cristalização. .param é um nome de arquivo que contém parâmetros de controle específicos do dispositivo. Os valores padrão serão gradualmente substituídos por valores específicos ao longo do protocolo. Um arquivo .param de exemplo é mostrado no arquivo suplementar 1. - Encontre a posição precisa do feixe de raios X direto executando o programa de encaixe do perfil do feixe:
beam.py -d
onde é o nome do arquivo da imagem de fluorescência de raios X (Figura 4).
NOTA: Este programa calcula as posições precisas do feixe direto, bem como o tamanho do feixe. A posição do feixe marca o destino de translocação para todos os cristais do mesmo dispositivo. O tamanho do feixe também é usado para o planejamento do alvo.
5. Varredura óptica
- Coloque um dispositivo de cristalização no suporte do chip e prenda o dispositivo usando um parafuso manual (Figura 3A).
- Monte o suporte do chip no estágio de translação do difratômetro através de um mecanismo cinemático (Figura 3B).
- Instale uma fonte de luz adequada para tirar micrografias da janela óptica do dispositivo. A luz branca, a luz infravermelha ou outra luz de escolha podem ser usadas dependendo da sensibilidade à luz da amostra de proteína, bem como do objetivo do experimento.
- Execute o programa de varredura:
scan.py .param
Este programa captura um conjunto de micrografias que são automaticamente transferidas para computadores de usuário especificados. - Execute o programa de mosaico em um computador de usuário:
tile.py -x -y
onde < x > e são os valores iniciais para deslocamentos de coluna e linha de micrografias, respectivamente. Este programa costura todas as micrografias em uma montagem de 1-3 μm/pixel de resolução (Figura 5).
NOTA: Os passos 5.4 e 5.5 geralmente demoram alguns minutos. O número total de micrografias varia de várias dezenas a centenas, dependendo da área de digitalização e ampliação. - Execute o programa de localização de cristal:
findX.py -c -w -x tamanho do feixe de <>
onde é a imagem lado a lado. Este programa realiza reconhecimento de cristais e planejamento de tiros. e largura <> indicam o tamanho do cristal a ser encontrado. Se o usuário deseja evitar cristais menores, pode ser usado como um ponto de corte, definindo um número maior do que os tamanhos de pequenos cristais indesejados. é um valor angular que define a tolerância para cristais de forma irregular. feixe> refere-se ao tamanho do feixe direto obtido a partir do perfil montado acima (etapa 4.2; Figura 4). Além disso, um valor nominal pode ser definido pelos usuários para espaçar ainda mais os tiros direcionados. Esses parâmetros-chave permitem a seleção específica de cristais e o planejamento de destino (Figura 6).
6. Difração de raios X
- Remova a fonte de luz e instale a parada de feixe. Defina uma distância de detector apropriada. Siga o protocolo de segurança da linha de luz para procurar a cabana de raios-X. Abra o obturador de raios-X e o obturador a laser, se aplicável.
- Execute o programa de coleta de dados para difração serial:
collect.py .param -l
Este comando aciona a coleta de dados na qual todas as tomadas planejadas são visitadas uma após a outra de acordo com uma sequência pré-programada. Cada cristal alvo é translocado para a posição do feixe (passo 4.2). Em cada parada, a exposição a raios-X é tomada com ou sem uma iluminação a laser em um atraso de tempo programado. O Filme 1 mostra uma sequência automatizada de coleta de dados operada a uma frequência de 1 Hz. Rotineiramente, dezenas a centenas de imagens de difração são coletadas de um único dispositivo de cristalização (Filme 2).
NOTA: A calibração da seção 4 e a varredura óptica da seção 5 são independentes na plataforma inSituX, portanto, completamente transferíveis para outra linha de luz. Seção 6 A difração de raios X deve envolver algum detalhe na operação da linha de luz.
Resultados
Vários conjuntos de dados representativos foram publicados nos últimos anos 10,12, juntamente com os resultados cristalográficos e descobertas científicas de uma gama diversificada de amostras de proteínas, incluindo proteínas e enzimas fotorreceptoras, por exemplo, um fotorreceptor UV-B UVR8 vegetal, uma fotoliase de reparo de DNA orientada à luz PhrB10, uma nova proteína de detecção de luz vermelha distante de uma histidina quinase sensorial de múltiplos domínios14 , domínios de duplo sensor ligante/luz e o módulo do núcleo fotossensorial de um bacteriofitocromo12. Como resultados representativos, listamos as condições de cristalização on-chip dessas proteínas na Tabela 1 e as comparamos diretamente com as condições utilizadas para o método de difusão de vapor. Aqui mostramos quatro estudos de caso adicionais de cristalização on-chip (Figura 2) e uma coleção de padrões de difração in situ em um filme (Filme 2). Os conjuntos de dados in situ representativos coletados por meio desse protocolo estão resumidos na Tabela 2.
Em um caso representativo, a criocristalografia deu origem a uma fraca difração para uma proteína fotorreceptora de detecção de luz vermelha distante, provavelmente devido à sensibilidade à luz e ao alto teor de solvente (~80%) desses cristais14. As densidades eletrônicas obtidas a partir dos dados da criocristalografia foram muito manchadas para resolver a conformação cromofora, que está no centro de nossa questão científica. Usando o protocolo in situ, fomos capazes de evitar a ativação não intencional da luz antes da difração e obtivemos um conjunto de dados escuros à temperatura ambiente de mais de 800 cristais. Esse conjunto de dados escuros da difração de Laue serial in situ resultou em densidades eletrônicas melhor resolvidas, permitindo a construção de um modelo confiante de um cromóforo bilino que exibe uma conformação all-Z,syn até então desconhecida (Figura 7A)12,14. Nossos experimentos de cristalografia dinâmica revelaram ainda mudanças induzidas pela luz nesta proteína fotorreceptora de vermelho distante, comparando dados de 4.352 cristais no escuro e 8.287 cristais após a iluminação da luz (Figura 7). Uma análise preliminar dos mapas de diferenças induzidas pela luz revelou movimentos concertados na folha central β, sugerindo a importância do empilhamento π-π entre os anéis de pirrol do cromóforo e vários resíduos aromáticos (Figura 7B,C). Uma análise aprofundada e descobertas científicas serão apresentadas em outro lugar.

Figura 1: Montagem do dispositivo de cristalização. Estima-se que cada montagem custe US$ 30 com duas bolachas de quartzo monocristalino ou US$ 10 com duas tampas de vidro. Os componentes de hardware, exceto o calço, são reutilizáveis. (A) O lado plano do anel exterior é rotulado para fins de identificação. (B) O anel externo é colocado de cabeça para baixo em uma superfície limpa. (C) Uma bolacha de quartzo de 1 polegada de diâmetro é cuidadosamente colocada no interior. Um chip de vidro também pode ser usado durante os ensaios de cristalização, mas não é compatível com a difração de raios-X. (D) Ambos os lados do calço são oleados. (E) O calço oleado é colocado no primeiro chip de quartzo. (F) As soluções de proteína e cristalização são pipetadas para o centro do cavaco e misturadas. (G) Um segundo chip de quartzo ou vidro cobre a gota de modo que ela se espalhe uniformemente sobre o chip. (H) Um anel de retenção é parafusado sobre a segunda bolacha de quartzo. (I) Uma ferramenta de aperto é usada para apertar suavemente o anel de retenção. (J) Um dispositivo totalmente montado. Por favor, clique aqui para ver uma versão maior desta figura.
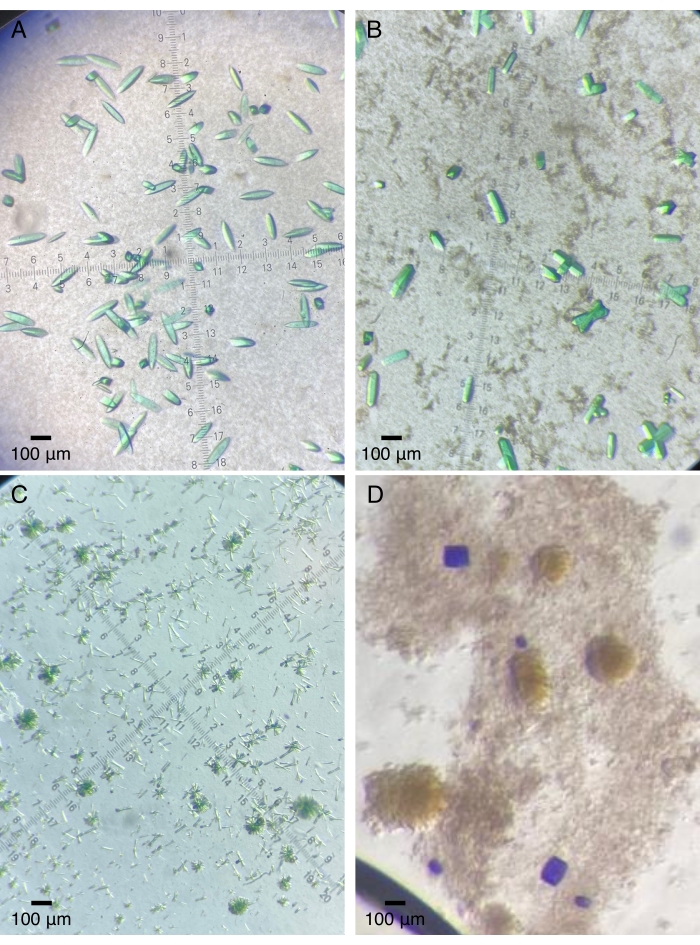
Figura 2: Cristais proteicos representativos cultivados em dispositivos de quartzo. (A) O módulo do núcleo fotossensorial de um bacteriofitocromo (Pa497 na Tabela 1). (B,C) Diferentes construtos do terceiro domínio GAF de uma histidina quinase sensorial multidomínio (2551g3 e 2551g3Δα1 na Tabela 1). (D) Os domínios sensoriais em tandem de uma histidina quinase de sensor duplo (RECGAF na Tabela 1). Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Difratômetro inSituX . (A) Um dispositivo de cristalização é montado no suporte do chip. Embora o dispositivo seja montado verticalmente, os cristais cultivados em chip não vão cair, principalmente porque a camada líquida em um dispositivo montado é muito fina e os cristais são ancorados aos seus núcleos ao crescer. (B) Uma fonte de luz IR é instalada para a varredura óptica. A câmera captura a visão em linha dos cristais de proteína ao longo do feixe de raios-X através de um espelho de prisma (não visível na imagem). Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4: Encaixe do perfil do feixe direto. Os canais vermelho, verde e azul da imagem de fluorescência de raios X são usados para se ajustar a uma função gaussiana bidimensional. A coluna da esquerda mostra a imagem bruta dos canais vermelho, verde e azul. A coluna do meio é o resultado do ajuste com a posição e o tamanho precisos do feixe. A coluna da direita exibe os resíduos de ajuste. Se a amplitude dos resíduos de encaixe abranger uma pequena fração da imagem bruta, o ajuste do perfil do feixe direto é bem-sucedido. Por favor, clique aqui para ver uma versão maior desta figura.
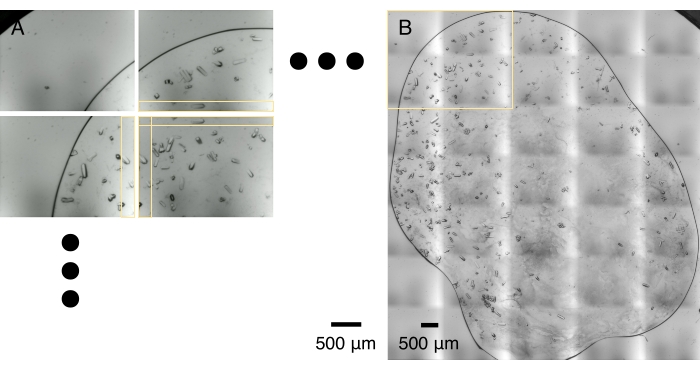
Figura 5: Mosaico da imagem . (A) Uma matriz de micrografias de cristal é capturada durante uma varredura óptica. A varredura óptica e a transferência de dados geralmente levam de 1 a 2 minutos. As micrografias adjacentes compartilham uma faixa de área sobreposta, horizontal e verticalmente, marcadas por caixas amarelas. (B) As micrografias são costuradas para fazer uma montagem de alta resolução com base na correlação ideal nas áreas sobrepostas. Esse processo geralmente leva um minuto em um laptop. A caixa amarela descreve a área capturada por 2 x 2 micrografias mostradas em (A). Por favor, clique aqui para ver uma versão maior desta figura.

Figura 6: Reconhecimento de cristais e planejamento de disparos. Cada círculo rosa marca a foto primária de um cristal. Os círculos amarelos marcam tiros adicionais se um cristal for longo o suficiente para posicionar esses tiros. As linhas cor-de-rosa marcam uma rota como uma solução para o problema do caixeiro-viajante. Cristais agrupados e cristais menores são amplamente evitados. A agressividade do achado cristal pode ser ajustada como uma opção para findX.py (etapa 5.6). Uma estratégia de "exagero" de força bruta não deixaria nenhum cristal sem disparo, mas poderia produzir muitas imagens de difração, mas não processáveis12. Por favor, clique aqui para ver uma versão maior desta figura.
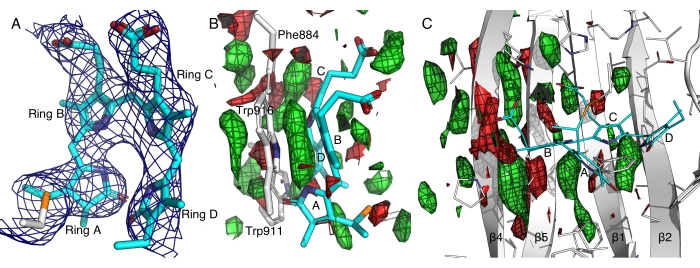
Figura 7: Mapas de densidade eletrônica do domínio de detecção de luz vermelha distante de uma histidina quinase . (A) O mapa 2Fo-Fc contornado a 2,5σ mostra as densidades de elétrons associadas ao cromóforo bilina em uma conformação all-Z,syn 14. Os anéis de pirrola de A a D são marcados. (B e C) Mapas de diferença claro-escuro contornados a ±2,5σ em verde e vermelho, respectivamente, destacam o ganho e a perda de densidades eletrônicas. Por favor, clique aqui para ver uma versão maior desta figura.
Tabela 1: Comparação das condições de cristalização entre a difusão de vapor e o método de lote on-chip. Os métodos de difusão de vapor e de cristalização em batelada estão altamente correlacionados 10,14,15,16,17,18,19. A partir de uma condição de difusão de vapor, uma condição semelhante pode ser otimizada para cristalização no chip. Por favor, clique aqui para baixar esta Tabela.
Tabela 2: Resumo dos conjuntos de dados in situ coletados diretamente de dispositivos de quartzo. Milhares de padrões de difração Laue podem ser coletados de vários dispositivos de cristalização. Por favor, clique aqui para baixar esta Tabela.
Filme 1: Uma coleta de dados simulada. Os cristais direcionados são translocados para o feixe de raios-X, marcado por um círculo vermelho. A sequência dos cristais-alvo neste filme não segue uma solução para o problema do caixeiro-viajante. Exposições a laser e raios-X são disparadas em cada parada com um atraso programado. Imagens de difração são coletadas. Por favor, clique aqui para baixar este filme.
Filme 2: Imagens de difração. Centenas de imagens de difração podem ser coletadas de um único dispositivo de cristalização. Vários dispositivos são suficientes para produzir um conjunto de dados completo e altamente redundante (Tabela 2). Por favor, clique aqui para baixar este filme.
Arquivo Suplementar 1: Exemplo de arquivo .param. Um pequeno arquivo de texto coleta alguns parâmetros de controle específicos para cada dispositivo de cristalização. Esses parâmetros começam com seus valores padrão e serão modificados de acordo com as seções 4, 5 e 6 à medida que o protocolo prossegue. Clique aqui para baixar este arquivo.
Discussão
A cristalografia de proteínas nos primeiros anos conduzida à temperatura ambiente experimentou uma tremenda dificuldade em combater os danos da radiação de raios-X. Assim, foi substituído pelo método de criocristalografia mais robusto, à medida que as fontes de raios-X síncrotron se tornaram prontamente disponíveis20. Com o advento dos lasers de elétrons livres de raios-X, a cristalografia de proteínas em temperatura ambiente foi revivida nos últimos anos, com muitos novos desenvolvimentos impulsionados pelo desejo de observar a dinâmica estrutural das proteínas a uma temperatura fisiologicamente relevante 2,21. O desenvolvimento da plataforma inSituX baseada nos dispositivos cristal-a-cristal tem sido motivado pela mesma ambição, ou seja, estabelecer métodos de recolha de dados rotineiros e robustos para estudos de cristalografia dinâmica à temperatura ambiente. Este método automatizado de difração seriada de raios-X também é aplicável à determinação de estruturas estáticas para cristais de proteína inpassíveis de congelamento14. Neste protocolo, apresentamos as principais considerações técnicas, juntamente com as etapas críticas necessárias para fornecer a coleta de dados em temperatura ambiente usando essa plataforma. Este método é particularmente adequado para cristais de proteína frágeis que são sensíveis ao manuseio mecânico, danos por radiação de raios-X ou exposição ao ar.
O protótipo da plataforma foi extensivamente testado em duas linhas de luz de cristalografia de proteínas na Fonte Avançada de Fótons (APS) do Laboratório Nacional de Argonne. Embora seja bastante simples configurar a cristalização no chip de acordo com esse protocolo, a etapa de coleta de dados envolve vários componentes de hardware e software personalizados. Como resultado, sua aplicação e implementação de estratégias de coleta de dados específicas do projeto podem exigir uma estreita colaboração entre os usuários e os cientistas da linha de luz. Em outras palavras, essa tecnologia em sua forma atual é limitada aos usuários que têm acesso adequado a síncrotrons, como o APS. No entanto, o fluxo de trabalho geral e as principais etapas descritas neste protocolo serviriam de referência ou guia para qualquer grupo de pesquisa interessado em cristalografia de proteínas à temperatura ambiente.
A vantagem mais significativa desta plataforma é que nenhuma manipulação de cristal, como montagem ou congelamento, é necessária, de modo que cristais de proteína delicados sejam difratados em condições intocadas. Outra grande vantagem é que o uso do substrato de quartzo monocristalino dá origem a muito pouca dispersão de fundo para imagens de difração de proteínas, oferecendo ambientes estáveis para cristalização de proteínas por um longo período de tempo (semanas a meses). No entanto, esta plataforma não é adequada para a triagem de cristais de matriz esparsa, pois destina-se à produção de cristais em larga escala. Como tal, o conhecimento prévio das condições de cristalização é necessário para configurar ensaios iniciais de cristalização em chip para uma determinada amostra de proteína.
Na prática, descobrimos que algumas etapas de montagem do dispositivo, como lubrificar um calço (etapa 1.2) e como selar um dispositivo (etapa 2.3), por mais triviais que pareçam, muitas vezes afetam diretamente os resultados da cristalização. Um dispositivo pode secar rapidamente se a lubrificação não for feita corretamente. Além disso, o aperto excessivo do dispositivo na etapa final de montagem pode deformar as bolachas de quartzo, enquanto o subaperto leva a possíveis vazamentos e/ou evaporação descontrolada do dispositivo. Outro passo crítico é o planejamento de fotos de raios-X. Deve-se lidar cuidadosamente com cristais agrupados ou lotados para evitar a sobreposição de padrões de difração que muitas vezes são difíceis de processar. Este problema pode ser aliviado pelo uso de um feixe de raios-X de micro-foco. Potencialmente, um conjunto de dados completo pode ser difícil de obter se a morfologia do cristal for uma grande placa fina, de modo que a maioria das placas seja paralela às janelas de quartzo. Além disso, os chips de quartzo de cristal único podem ser reciclados e reutilizados após um procedimento de limpeza envolvendo sabão e solventes orgânicos que removem detritos de óleo e proteína. Normalmente, cerca de 80-90% desses chips delicados podem ser limpos sem danos para os próximos experimentos. No caso de pequenos cristais em uma linha de luz microfocada, quando uma melhor precisão deve ser alcançada no posicionamento do cristal, vários componentes de hardware podem ser atualizados, como motores mais finos, melhor câmera e óptica, maior ampliação, etc. No entanto, nenhum deles está perto das limitações de última geração. Portanto, há muito espaço disponível para melhorias sem muita dificuldade.
Divulgações
ZR é o inventor dos chips cristal-em-cristal na patente dos EUA 9632042 concedida à Renz Research, Inc.
Agradecimentos
O uso da Advanced Photon Source, uma instalação de usuário do Office of Science operada para o Departamento de Energia dos EUA pelo Argonne National Laboratory, foi apoiada pelo contrato DE-AC02-06CH11357. O uso do BioCARS foi apoiado pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde sob o número de concessão R24GM111072. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde. O uso do LS-CAT Sector 21 foi apoiado pela Michigan Economic Development Corporation e pela Michigan Technology Tri-Corridor grant 085P1000817. Este trabalho é apoiado por doações da Universidade de Illinois em Chicago, Institutos Nacionais de Saúde (R01EY024363) e National Science Foundation (MCB 2017274) para XY.
Materiais
| Name | Company | Catalog Number | Comments |
| Analysis software | In-house developed | ||
| Cerium doped yttrium aluminum garnet | MSE Supplies | Ce:Y3Al5O12, YAG single crystal substrates | |
| Chip holder | In-house developed | ||
| Control software | In-house developed | ||
| Immersion oil | Cargille Laboratories | 16482 | Type A low viscosity 150 cSt |
| inSituX platform | In-house developed | ||
| IR light source | Thorlabs Incorporated | LED1085L | LED with a Glass Lens, 1085 nm, 5 mW, TO-18 |
| Microscope | Zeiss | SteREO Discovery V8 | |
| Outer ring | In-house developed | ||
| Petri dish | Fisher Scietific | FB0875713 | |
| Pipette | Pipetman | F167380 | P10 |
| Pump lasers | Thorlabs Incorporated | LD785-SE400 | 785 nm, 400 mW, Ø9 mm, E Pin Code, Laser Diode |
| Raspberry Pi | Raspberry Pi Fundation | ||
| Retaining ring | Thorlabs Incorporated | SM1RR | SM1 retaining ring for Ø1" lens tubes and mounts |
| Seedless quartz crystal | University Wafers, Inc. | U01-W2-L-190514 | 25.4 mm diameter Z-cut 0.05 mm thickness double side polish 8 mm on -X |
| Shim | In-house developed | ||
| X-ray beam stop | In-house developed |
Referências
- Brändén, G., Neutze, R. Advances and challenges in time-resolved macromolecular crystallography. Science. 373, (2021).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, (2021).
- Schaffer, J. E., Kukshal, V., Miller, J. J., Kitainda, V., Jez, J. M. Beyond X-rays: an overview of emerging structural biology methods. Emerging Topics in Life Sciences. 5 (2), 221-230 (2021).
- Nogales, E., Scheres, S. H. W. Cryo-EM: A unique tool for the visualization of macromolecular complexity. Molecular Cell. 58, 677-689 (2015).
- Chapman, H. N., Caleman, C., Timneanu, N. Diffraction before destruction. Philosophical Transactions of the Royal Society B Biological Sciences. 369, 20130313 (2014).
- Kisselman, G., et al. X-CHIP: an integrated platform for high-throughput protein crystallization and on-the-chip X-ray diffraction data collection. Acta Crystallographica Section D Biological Crystallography. 67 (6), 533-539 (2011).
- Liang, M., et al. Novel combined crystallization plate for high-throughput crystal screening and in situ data collection at a crystallography beamline. Acta Crystallographica Section F Structural Biology Communications. 77, 319-327 (2021).
- le Maire, A., et al. In-plate protein crystallization, in situ ligand soaking and X-ray diffraction. Acta Crystallographica Section D Biological Crystallography. 67, 747-755 (2011).
- Perry, S. L., et al. In situ serial Laue diffraction on a microfluidic crystallization device. Journal of Applied Crystallography. 47, 1975-1982 (2014).
- Ren, Z., et al. Crystal-on-crystal chips for in situ serial diffraction at room temperature. Lab on a Chip. 18, 2246-2256 (2018).
- Ren, Z. Single crystal quartz chips for protein crystallization and X-ray diffraction data collection and related methods. US patent. , (2017).
- Ren, Z., et al. An automated platform for in situ serial crystallography at room temperature. IUCrJ. 7, 1009-1018 (2020).
- Croes, G. A. A method for solving traveling salesman problems. Operations Research. 6, 791-812 (1958).
- Bandara, S., et al. Crystal structure of a far-red-sensing cyanobacteriochrome reveals an atypical bilin conformation and spectral tuning mechanism. Proceedings of the National Academy of Sciences of the United States of America. 118, 2025094118 (2021).
- Shin, H., Ren, Z., Zeng, X., Bandara, S., Yang, X. Structural basis of molecular logic OR in a dual-sensor histidine kinase. Proceedings of the National Academy of Sciences of the United States of America. 116, 19973-19982 (2019).
- Yang, X., Ren, Z., Kuk, J., Moffat, K. Temperature-scan cryocrystallography reveals reaction intermediates in bacteriophytochrome. Nature. 479, 428-432 (2011).
- Zhang, F., Scheerer, P., Oberpichler, I., Lamparter, T., Krauss, N. Crystal structure of a prokaryotic (6-4) photolyase with an Fe-S cluster and a 6,7-dimethyl-8-ribityllumazine antenna chromophore. Proceedings of the National Academy of Sciences of the United States of America. 110, 7217-7222 (2013).
- Zeng, X., et al. Dynamic crystallography reveals early signaling events in ultraviolet photoreceptor UVR8. Nature Plants. 1, 14006 (2015).
- Wang, M., et al. Insights into base selectivity from the 1.8 Å resolution structure of an RB69 DNA polymerase ternary complex. Biochemistry. 50, 581-590 (2011).
- Rodgrs, D. W. Cryocrystallography. Structure. 2, 1135-1140 (1994).
- Zhao, F. -. Z., et al. A guide to sample delivery systems for serial crystallography. TheFEBS Journal. 286, 4402-4417 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados