Method Article
Cristallisation sur puce et diffraction série à grande échelle à température ambiante
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette contribution décrit comment configurer la cristallisation des protéines sur des dispositifs cristaux sur cristaux et comment effectuer une collecte automatisée de données série à température ambiante à l’aide de la plate-forme de cristallisation sur puce.
Résumé
Les réactions biochimiques et les processus biologiques peuvent être mieux compris en démontrant comment les protéines font la transition entre leurs états fonctionnels. Étant donné que les températures cryogéniques ne sont pas physiologiques et peuvent prévenir, dissuader ou même modifier la dynamique structurelle des protéines, une méthode robuste pour les expériences de diffraction des rayons X de routine à température ambiante est hautement souhaitable. Le dispositif cristal sur cristal et le matériel et les logiciels qui l’accompagnent utilisés dans ce protocole sont conçus pour permettre la diffraction in situ des rayons X à température ambiante pour les cristaux de protéines de différentes tailles sans aucune manipulation d’échantillon. Nous présentons ici les protocoles pour les étapes clés de l’assemblage de l’appareil, de la cristallisation sur puce, du balayage optique, de la reconnaissance des cristaux à la planification des tirs aux rayons X et à la collecte automatisée des données. Étant donné que cette plate-forme ne nécessite aucune récolte de cristaux ni aucune autre manipulation d’échantillons, des centaines, voire des milliers de cristaux de protéines cultivés sur puce peuvent être introduits dans un faisceau de rayons X de manière programmable et à haut débit.
Introduction
En raison des effets ionisants des rayons X, la cristallographie des protéines, dans une large mesure, a été limitée aux conditions cryogéniques au cours des trois dernières décennies. Par conséquent, les connaissances actuelles sur les mouvements des protéines au cours de leur fonction découlent en grande partie de comparaisons entre des structures statiques observées dans différents états dans des conditions cryogéniques. Cependant, les températures cryogéniques entravent inévitablement la progression d’une réaction biochimique ou d’une interconversion entre différents états conformationnels pendant que les molécules de protéines sont à l’œuvre. Pour observer directement la dynamique structurale des protéines à la résolution atomique par cristallographie, des méthodes robustes et de routine sont nécessaires pour mener des expériences de diffraction à température ambiante, ce qui nécessite des innovations techniques dans la livraison d’échantillons, la collecte de données et l’analyse de données postérieures. À cette fin, les progrès récents de la cristallographie en série ont ouvert de nouvelles voies pour capturer les images moléculaires d’espèces intermédiaires et structurales à vie courte à température ambiante 1,2,3. Contrairement à la stratégie « un cristal, un ensemble de données » largement utilisée en cryocristallographie conventionnelle, la cristallographie en série adopte une stratégie de collecte de données similaire à celle de la cryo-microscopie électronique à une particule. Plus précisément, les données expérimentales en cristallographie en série sont collectées en petites fractions à partir d’un grand nombre d’échantillons individuels, suivies d’un traitement intensif des données dans lequel les fractions de données sont évaluées et combinées en un ensemble de données complet pour la détermination de la structure 3D4. Cette stratégie « un cristal, un coup » atténue efficacement les dommages causés par les rayons X aux cristaux de protéines à température ambiante via une stratégie de diffraction avant destruction5.
Étant donné que la cristallographie en série nécessite un grand nombre de cristaux de protéines pour compléter un ensemble de données, elle pose des défis techniques majeurs pour de nombreux systèmes biologiques où les échantillons de protéines sont limités et / ou la manipulation délicate des cristaux est impliquée. Une autre considération importante est la meilleure façon de préserver l’intégrité des cristaux dans les expériences de diffraction en série. Les méthodes de diffraction in situ répondent à ces préoccupations en permettant aux cristaux de protéines de se diffracter directement de l’endroit où ils se développent sans briser le sceau de la chambre de cristallisation 6,7,8,9. Ces méthodes sans manipulation sont naturellement compatibles avec la diffraction série à grande échelle. Nous avons récemment annoncé la conception et la mise en œuvre d’un dispositif de cristallisation pour la diffraction in situ basé sur un concept cristal sur cristal - cristaux de protéines cultivés directement sur quartz monocristallin11. Cet appareil « cristal sur cristal » offre plusieurs avantages. Tout d’abord, il dispose d’une fenêtre transparente aux rayons X et à la lumière faite d’un substrat de quartz monocristallin, qui produit peu de diffusion de fond, ce qui se traduit par d’excellents rapports signal sur bruit dans les images de diffraction à partir de cristaux de protéines. Deuxièmement, le quartz monocristallin est un excellent pare-vapeur équivalent au verre, fournissant ainsi un environnement stable pour la cristallisation des protéines. En revanche, d’autres dispositifs de cristallisation utilisant des substrats à base de polymères sont sujets au séchage en raison de la perméabilité à la vapeur, sauf si le matériau polymère a une épaisseur substantielle, ce qui contribue par conséquent à une diffusion de fond élevée10. Troisièmement, ce dispositif permet l’administration d’un grand nombre de cristaux de protéines au faisceau de rayons X sans aucune forme de manipulation ou de récolte des cristaux, ce qui est essentiel pour préserver l’intégrité des cristaux11.
Pour rationaliser les expériences de diffraction des rayons X en série à l’aide des dispositifs cristal sur cristal, nous avons développé un prototype de diffractomètre pour faciliter la commutation entre les modes de balayage optique et de diffraction des rayons X12. Ce diffractomètre a un faible encombrement et a été utilisé pour la collecte de données en série sur deux lignes de faisceau de la source avancée de photons (APS) au laboratoire national d’Argonne. Plus précisément, nous avons utilisé BioCARS 14-ID-B pour la diffraction Laue et LS-CAT 21-ID-D pour l’oscillation monochromatique. Ce diffractomètre n’est pas nécessaire si un synchrotron ou une ligne de faisceau laser à rayons X à électrons libres est équipé de deux capacités clés : (1) positionnement d’échantillon motorisé avec une plage de course de ±12 mm autour du faisceau de rayons X dans toutes les directions; et (2) un appareil photo numérique sur axe pour l’observation des cristaux sous éclairage lumineux qui est sans danger pour les cristaux de protéines à l’étude. Le dispositif à quartz monocristallin ainsi qu’un diffractomètre portable et le logiciel de contrôle pour le balayage optique, la reconnaissance cristalline et la collecte automatisée de données in situ constituent collectivement la plate-forme inSituX pour la cristallographie en série. Bien que ce développement soit principalement motivé par ses applications de cristallographie dynamique utilisant une source de rayons X polychromatique, nous avons démontré le potentiel de cette technologie pour soutenir les méthodes d’oscillation monochromatique10,12. Grâce à l’automatisation, cette plate-forme offre une méthode de collecte de données en série à haut débit à température ambiante avec une consommation de protéines abordable.
Dans cette contribution, nous décrivons en détail comment mettre en place la cristallisation sur puce dans un laboratoire humide et comment effectuer la collecte de données de rayons X en série sur une ligne de faisceau synchrotron à l’aide de la plate-forme inSituX.
La méthode par lots est utilisée pour mettre en place la cristallisation sur puce dans des conditions similaires à celles de la méthode de diffusion de vapeur obtenue pour le même échantillon de protéines (tableau 1). Comme point de départ, nous recommandons d’utiliser un précipitant à une concentration de 1,2 à 1,5 fois celle de la méthode de diffusion de vapeur. Si nécessaire, les conditions de cristallisation des lots peuvent être optimisées davantage grâce à un criblage fin par grille. Les plaquettes de quartz ne sont pas nécessaires pour les essais d’optimisation; Les lamelles de couverture en verre peuvent être utilisées à la place (voir ci-dessous). Les dispositifs de cristallisation partiellement chargés sont recommandés pour conserver les essais d’optimisation à plus petite échelle. Un certain nombre d’échantillons de protéines ont été cristallisés avec succès sur de tels dispositifs en utilisant la méthode par lots10 (tableau 1).
Le dispositif lui-même se compose des parties suivantes: 1) une bague extérieure; 2) deux plaquettes de quartz; 3) une cale en forme de rondelle en plastique ou en acier inoxydable; 4) un anneau de retenue; 5) l’huile d’immersion pour microscope comme scellant (figure 1). Le volume total de la solution de cristallisation chargée sur une puce dépend du but de l’expérience. La capacité de la chambre de cristallisation peut être ajustée en choisissant une cale de différentes épaisseurs et/ou diamètres intérieurs. Nous mettons régulièrement en place des dispositifs de cristallisation d’une capacité de 10 à 20 μL à l’aide de cales de 50 à 100 μm d’épaisseur. Un dispositif typique peut produire des dizaines à des milliers de cristaux de protéines adéquats pour la collecte de données en série (Figure 2).
En cas de succès, la cristallisation sur puce produira des dizaines, voire des centaines, voire des milliers de cristaux de protéines sur chaque dispositif à quartz prêt pour la diffraction des rayons X. Sur une ligne de faisceau synchrotron, un tel dispositif est monté sur un étage de translation à trois axes du diffractomètre à l’aide d’un mécanisme cinématique. La fenêtre de cristallisation d’un dispositif monté est balayée optiquement et imagée dans des dizaines à des centaines de micrographies. Ces micrographies sont ensuite assemblées dans un montage haute résolution. Pour les cristaux photosensibles, le balayage optique peut être effectué sous lumière infrarouge (IR) pour éviter une photoactivation involontaire. Un logiciel de vision par ordinateur a été développé pour identifier et localiser les cristaux de protéines distribués au hasard sur l’appareil. Ces cristaux sont ensuite classés en fonction de leur taille, de leur forme et de leur position pour informer ou guider la stratégie de collecte de données en cristallographie sérielle. Par exemple, des tirs uniques ou multiples peuvent être localisés sur chaque cristal ciblé. Les utilisateurs pouvaient planifier un seul passage ou plusieurs itinéraires à travers des cristaux ciblés. Nous avons mis en place un logiciel pour calculer différents itinéraires de voyage. Par exemple, l’itinéraire le plus court est calculé à l’aide d’algorithmes qui résolvent le problème du vendeur itinérant13. Pour les applications cristallographiques dynamiques pompe-sonde, le moment et la durée des tirs laser (pompe) et à rayons X (sonde) peuvent être choisis. Une collecte automatisée de données en série est programmée pour transférer chaque cristal ciblé dans le faisceau de rayons X l’un après l’autre.
Les composants clés du diffractomètre insituX comprennent: 1) un support de dispositif; 2) une étape de traduction à trois axes; 3) une source lumineuse pour le balayage optique; 4) un arrêt de faisceau de rayons X; 5) pomper des lasers si des protéines photosensibles sont étudiées; 6) Micro-ordinateur Raspberry Pi équipé d’une caméra sensible aux infrarouges; 7) Logiciel de contrôle pour synchroniser les moteurs, la caméra, les sources lumineuses, le laser de la pompe et pour l’interface avec les commandes de ligne de faisceau.
Protocole
1. Pré-assemblage de l’appareil
- Étiqueter la bague extérieure (30 mm de diamètre) pour l’identification de l’échantillon. Si nécessaire, indiquez le nom du projet, le numéro de l’appareil, l’état de cristallisation et la date (figure 1A). Placez la bague extérieure à l’envers sur une surface propre (Figure 1B) et placez délicatement une plaquette de quartz à l’intérieur de la bague (Figure 1C). Cette première plaquette de quartz sert de fenêtre d’entrée pour les rayons X incidents.
- Versez une petite quantité d’huile d’immersion pour microscope (viscosité de 150 cSt) dans une boîte de Pétri. Trempez une cale dans l’huile et assurez-vous que les deux côtés de la cale sont correctement huilés (figure 1D). Retirez l’excès d’huile en tamponnant la cale sur une surface propre.
- Placer la cale huilée sur la première plaquette de quartz (figure 1E).
REMARQUE: L’huile d’immersion est un excellent scellant qui protège la chambre de cristallisation contre les pertes de vapeur potentielles. Les copeaux correctement assemblés durent généralement des semaines sans séchage visible. Cette étape de pré-assemblage est réalisée sous la lumière de la pièce. Pour les échantillons photosensibles, toutes les étapes suivantes, y compris le chargement des échantillons, le stockage de l’appareil et l’observation, doivent être effectuées sous une lumière de sécurité.
2. Chargement de l’échantillon et assemblage de l’appareil
- Utilisez une pipette pour bien mélanger la solution protéique et le tampon de cristallisation sur la première plaquette de quartz. Le rapport volumique entre l’échantillon de protéines et le tampon varie généralement de 2:1 à 1:2 (Figure 1F). Assurez-vous que le volume total de la solution de cristallisation ne dépasse pas la capacité maximale de la chambre de cristallisation déterminée par la taille et l’épaisseur de la cale. Évitez les bulles d’air pendant le mélange.
NOTE: La composition d’un tampon de cristallisation varie d’une expérience à l’autre. Voir le tableau 1 pour connaître les conditions de cristallisation. - Placez la deuxième plaquette de quartz sur la solution mélangée lorsque la solution commence à s’étaler (Figure 1G). Cette deuxième plaquette de quartz sert de fenêtre de sortie aux rayons X diffractés.
- Tapotez légèrement la deuxième tranche de quartz sur le bord pour aider à répandre l’huile tout en poussant l’air vers l’extérieur. Fixez le dispositif en vissant une bague de retenue dans la bague extérieure (Figure 1H). Utilisez un outil de serrage si nécessaire (figure 1I). N’oubliez pas qu’un serrage excessif peut provoquer la déformation ou même la fissuration de plaquettes de quartz délicates.
3. Stockage des appareils et optimisation de la cristallisation
- Rangez les appareils assemblés (Figure 1J) dans une boîte à température ambiante ou à l’intérieur d’un incubateur avec contrôle de la température.
REMARQUE: Les cristaux de protéines peuvent apparaître quelques heures à quelques jours après l’assemblage d’un dispositif de cristallisation. Les résultats typiques de la cristallisation sur puce sont présentés pour plusieurs échantillons de protéines représentatifs (Figure 2). - Surveillez la croissance des cristaux en observant le dispositif de cristallisation au microscope. Si nécessaire, optimiser les conditions de cristallisation par itérations des sections 1 à 3.
4. Étalonnage
REMARQUE: Les programmes et commandes mentionnés dans les sections ci-dessous sont exécutés dans le logiciel inSituX.
- Installez un mince cristal de grenat d’yttrium et d’aluminium dopé sur le porte-puce (Figure 3). Installez la butée du faisceau. Prenez des images de fluorescence X du faisceau direct en exécutant le programme :
burnmark.py .param
où est un nom sélectionné par l’utilisateur pour le dispositif de cristallisation. .param est un nom de fichier qui contient des paramètres de contrôle spécifiques au périphérique. Les valeurs par défaut seront progressivement remplacées par des valeurs spécifiques le long du protocole. Un exemple de fichier .param est présenté dans le fichier supplémentaire 1. - Trouvez la position précise du faisceau de rayons X direct en exécutant le programme d’ajustement du profil de faisceau :
beam.py -d
où < graver l’image > est le nom de fichier de l’image de fluorescence X (Figure 4).
REMARQUE: Ce programme calcule les positions précises du faisceau direct ainsi que la taille du faisceau. La position du faisceau marque la destination de translocation pour tous les cristaux du même dispositif. La taille du faisceau est également utilisée pour la planification des cibles.
5. Balayage optique
- Placez un dispositif de cristallisation dans le porte-puce et fixez-le à l’aide d’une vis à molette (Figure 3A).
- Montez le porte-puce sur l’étage de translation du diffractomètre à l’aide d’un mécanisme cinématique (Figure 3B).
- Installez une source de lumière appropriée pour prendre des micrographies à partir de la fenêtre optique de l’appareil. La lumière blanche, la lumière IR ou toute autre lumière de choix peuvent être utilisées en fonction de la sensibilité à la lumière de l’échantillon de protéines ainsi que du but de l’expérience.
- Exécutez le programme d’analyse :
scan.py .param
Ce programme capture un ensemble de micrographies qui sont automatiquement transférées vers des ordinateurs utilisateur spécifiés. - Exécutez le programme de mosaïque sur un ordinateur utilisateur :
tile.py -x -y
où < x > et sont les valeurs initiales pour les déplacements de colonnes et de lignes des micrographies, respectivement. Ce programme assemble toutes les micrographies dans un montage d’une résolution de 1 à 3 μm/pixel (Figure 5).
REMARQUE: Les étapes 5.4 et 5.5 prennent généralement quelques minutes. Le nombre total de micrographies varie de plusieurs dizaines à des centaines selon la zone de balayage et le grossissement. - Exécutez le programme de recherche de cristaux :
findX.py -c -w -x
où est l’image en mosaïque. Ce programme effectue la reconnaissance des cristaux et la planification des tirs. et indiquent la taille du cristal à trouver. Si l’utilisateur souhaite éviter les cristaux plus petits, peut être utilisé comme coupure en définissant un nombre plus grand que les tailles des petits cristaux indésirables. est une valeur angulaire qui définit la tolérance pour les cristaux de forme irrégulière. faisceau> désigne la taille directe du faisceau obtenue à partir du raccord du profil ci-dessus (étape 4.2; Graphique 4). En outre, une valeur nominale peut être définie par les utilisateurs pour espacer davantage les prises de vue ciblées. Ces paramètres clés permettent une sélection cristalline spécifique et une planification des cibles (Figure 6).
6. Diffraction des rayons X
- Retirez la source lumineuse et installez la butée du faisceau. Définissez une distance de détection appropriée. Suivez le protocole de sécurité de la ligne de faisceau pour fouiller le clapier à rayons X. Ouvrez l’obturateur à rayons X et l’obturateur laser, le cas échéant.
- Exécutez le programme de collecte de données pour la diffraction série:
collect.py .param -l
Cette commande déclenche la collecte de données dans laquelle tous les plans planifiés sont visités les uns après les autres selon une séquence préprogrammée. Chaque cristal ciblé est transloqué vers la position du faisceau (étape 4.2). À chaque arrêt, l’exposition aux rayons X est prise avec ou sans éclairage laser à un délai prévu. Le film 1 montre une séquence de collecte de données automatisée fonctionnant à une fréquence de 1 Hz. Régulièrement, des dizaines à des centaines d’images de diffraction sont collectées à partir d’un seul dispositif de cristallisation (film 2).
NOTE: L’étalonnage de la section 4 et le balayage optique de la section 5 sont autonomes dans la plate-forme inSituX, donc complètement transférables à une autre ligne de faisceau. Section 6 La diffraction des rayons X doit impliquer certains détails dans le fonctionnement de la ligne de faisceau.
Résultats
Plusieurs ensembles de données représentatifs ont été publiés au cours des dernières années 10,12 ainsi que les résultats cristallographiques et les découvertes scientifiques d’un large éventail d’échantillons de protéines, y compris des protéines photoréceptrices et des enzymes, par exemple, un photorécepteur UV-B UVR8 végétal, une photolyase de réparation de l’ADN pilotée par la lumière PhrB10, une nouvelle protéine de détection de la lumière rouge lointaine d’une histidine kinase sensorielle multi-domaines 14 , les domaines ligand/lumière à double capteur, et le module central photosensoriel d’un bactériophytochrome12. Comme résultats représentatifs, nous énumérons les conditions de cristallisation sur puce de ces protéines dans le tableau 1 et les comparons directement avec les conditions utilisées pour la méthode de diffusion de vapeur. Nous montrons ici quatre études de cas supplémentaires de cristallisation sur puce (Figure 2) et une collection de modèles de diffraction in situ dans un film (Film 2). Les ensembles de données in situ représentatifs recueillis à l’aide de ce protocole sont résumés dans le tableau 2.
Dans un cas représentatif, la cryocristallographie a donné lieu à une mauvaise diffraction d’une protéine photoréceptrice de détection de la lumière rouge lointaine probablement en raison de la sensibilité à la lumière et de la teneur élevée en solvant (~80%) de ces cristaux14. Les densités électroniques obtenues à partir des données de cryocristallographie étaient trop étalées pour résoudre la conformation chromophore, qui est au centre de notre question scientifique. En utilisant le protocole in situ, nous avons pu éviter l’activation involontaire de la lumière avant la diffraction et avons obtenu un ensemble de données sombres à température ambiante à partir de plus de 800 cristaux. Cet ensemble de données sombres provenant de la diffraction de Laue en série in situ a permis d’obtenir des densités électroniques mieux résolues, permettant la construction de modèles fiables d’un chromophore bilin présentant une conformation tout-Z,syn jusqu’alors inconnue (Figure 7A)12,14. Nos expériences de cristallographie dynamique ont en outre révélé des changements induits par la lumière dans cette protéine photoréceptrice rouge lointain en comparant les données de 4 352 cristaux dans l’obscurité et de 8 287 cristaux après éclairage lumineux (Figure 7). Une analyse préliminaire des cartes des différences induites par la lumière a révélé des mouvements concertés dans la feuille de β centrale, suggérant l’importance de l’empilement de π-π entre les cycles pyrrole du chromophore et plusieurs résidus aromatiques (Figure 7B,C). Une analyse approfondie et des résultats scientifiques seront présentés ailleurs.

Figure 1 : Ensemble dispositif de cristallisation. Le coût de chaque assemblage est estimé à 30 $ US avec deux plaquettes de quartz monocristallin ou à 10 $ US avec deux lamelles de couvercle en verre. Les composants matériels, à l’exception de la cale, sont réutilisables. (A) Le côté plat de la bague extérieure est étiqueté à des fins d’identification. (B) L’anneau extérieur est placé à l’envers sur une surface propre. (C) Une plaquette de quartz de 1 pouce de diamètre est soigneusement placée à l’intérieur. Un éclat de verre pourrait également être utilisé à la place lors d’essais de cristallisation, mais n’est pas compatible avec la diffraction des rayons X. (D) Les deux côtés de la cale sont huilés. (E) La cale huilée est placée sur la première copeaux de quartz. (F) Les solutions protéiques et de cristallisation sont pipetées au centre de la puce et mélangées. (G) Un deuxième éclat de quartz ou de verre recouvre la goutte de manière à ce qu’elle se répartisse uniformément sur la puce. (H) Une bague de retenue est vissée sur la deuxième tranche de quartz. (I) Un outil de serrage est utilisé pour serrer doucement l’anneau de retenue. (J) Un dispositif entièrement assemblé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
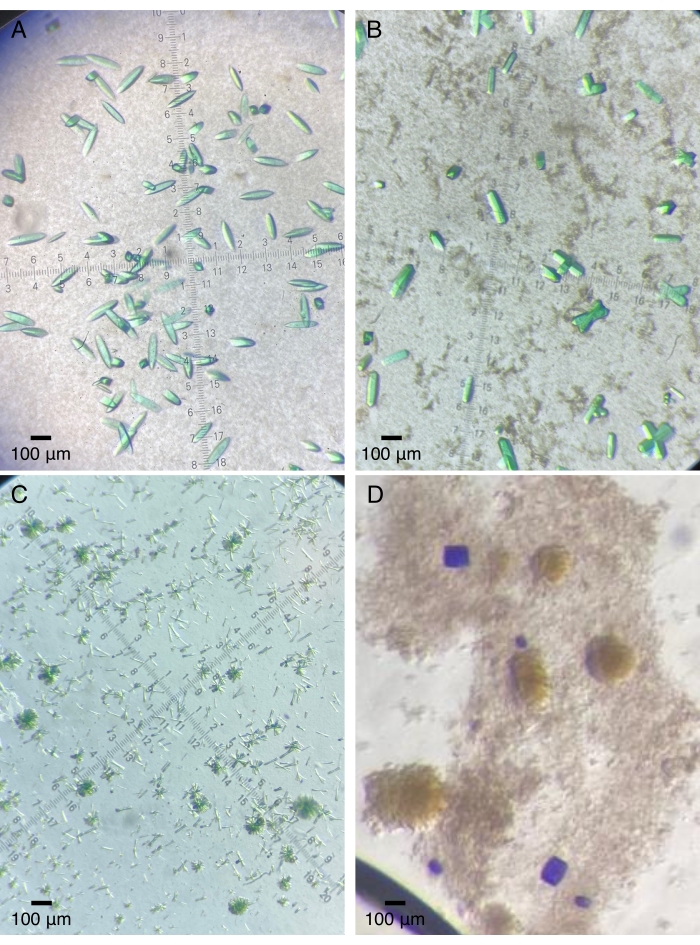
Figure 2 : Cristaux protéiques représentatifs cultivés sur des dispositifs à quartz. (A) Le module central photosensoriel d’un bactériophytochrome (Pa497 dans le tableau 1). (B,C) Différentes constructions du troisième domaine GAF à partir d’une histidine kinase sensorielle multi-domaines (2551g3 et 2551g3Δα1 dans le tableau 1). (D) Les domaines sensoriels en tandem d’une histidine kinase à double capteur (RECGAF dans le tableau 1). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : diffractomètre inSituX. (A) Un dispositif de cristallisation est monté dans le porte-puce. Bien que le dispositif soit monté verticalement, les cristaux cultivés sur puce ne vont pas tomber, principalement parce que la couche liquide dans un dispositif assemblé est très mince et que les cristaux sont ancrés à leur noyau lors de la croissance. (B) Une source lumineuse IR est installée pour le balayage optique. La caméra capture la vue en ligne des cristaux de protéines le long du faisceau de rayons X à travers un miroir à prisme (non visible sur l’image). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Ajustement du profil de faisceau direct. Les canaux rouge, vert et bleu de l’image de fluorescence X sont utilisés pour ajuster une fonction gaussienne bidimensionnelle. La colonne de gauche affiche l’image brute des canaux rouge, vert et bleu. La colonne du milieu est le résultat de l’ajustement avec la position et la taille précises de la poutre. La colonne de droite affiche les résidus de raccord. Si l’amplitude des résidus de raccord couvre une petite fraction de l’image brute, l’ajustement du profil du faisceau direct est réussi. Veuillez cliquer ici pour voir une version agrandie de cette figure.
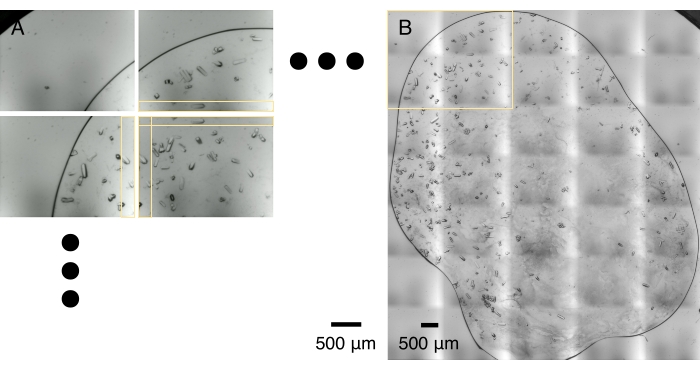
Figure 5 : mosaïque d’image. (A) Un réseau de micrographies cristallines est capturé lors d’un balayage optique. Le balayage optique et le transfert de données prennent généralement 1-2 min. Les micrographies adjacentes partagent une bande de zone qui se chevauche, horizontalement et verticalement, marquée par des cases jaunes. (B) Les micrographies sont assemblées pour faire un montage haute résolution basé sur la corrélation optimale dans les zones de chevauchement. Ce processus prend généralement une minute sur un ordinateur portable. La case jaune délimite la zone capturée par 2 x 2 micrographies illustrées en (A). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Reconnaissance des cristaux et planification des prises de vue. Chaque cercle rose marque le tir principal d’un cristal. Les cercles jaunes marquent des prises de vue supplémentaires si un cristal est assez long pour positionner ces tirs. Les lignes roses marquent un itinéraire comme solution au problème du vendeur itinérant. Les cristaux groupés et les cristaux plus petits sont largement évités. L’agressivité de la recherche de cristaux peut être ajustée en option pour findX.py (étape 5.6). Une stratégie de « surenchère » par force brute ne laisserait aucun cristal sans tir, mais pourrait produire beaucoup d’images de diffraction, mais pas traitables12. Veuillez cliquer ici pour voir une version agrandie de cette figure.
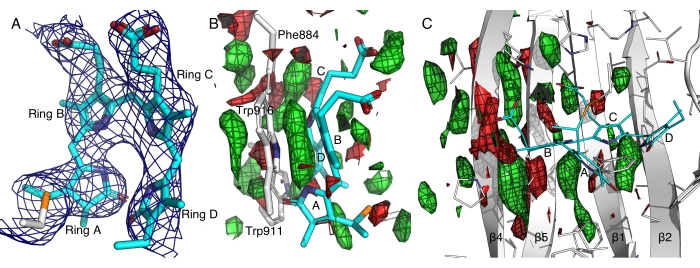
Figure 7 : Cartes de densité électronique du domaine de détection de la lumière rouge lointaine d’une histidine kinase. (A) La carte 2Fo-Fc profilée à 2,5σ montre les densités électroniques associées au chromophore bilin dans une conformation14 tout Z,syn. Les anneaux Pyrrole A à D sont marqués. (B et C) Les cartes de différence clair-obscur profilées à ±2,5σ en vert et en rouge, respectivement, mettent en évidence le gain et la perte de densité électronique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Comparaison des conditions de cristallisation entre la diffusion de vapeur et la méthode par lots sur puce. La diffusion de vapeur et les méthodes de cristallisation par lots sont fortement corrélées 10,14,15,16,17,18,19. À partir d’une condition de diffusion de vapeur, une condition similaire peut être optimisée pour la cristallisation sur puce. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Résumé des ensembles de données in situ recueillis directement à partir de dispositifs à quartz. Des milliers de motifs de diffraction Laue peuvent être collectés à partir de plusieurs dispositifs de cristallisation. Veuillez cliquer ici pour télécharger ce tableau.
Film 1 : Une fausse collecte de données. Les cristaux ciblés sont transloqués dans le faisceau de rayons X marqué par un cercle rouge. La séquence des cristaux ciblés dans ce film ne suit pas une solution au problème du vendeur itinérant. Les expositions au laser et aux rayons X sont déclenchées à chaque arrêt avec un délai programmé. Des images de diffraction sont collectées. Veuillez cliquer ici pour télécharger ce film.
Film 2: Images de diffraction. Des centaines d’images de diffraction peuvent être collectées à partir d’un seul dispositif de cristallisation. Plusieurs dispositifs suffisent pour produire un ensemble de données complet et hautement redondant (tableau 2). Veuillez cliquer ici pour télécharger ce film.
Fichier supplémentaire 1 : Exemple de fichier .param. Un petit fichier texte collecte certains paramètres de contrôle spécifiques à chaque dispositif de cristallisation. Ces paramètres commencent par leurs valeurs par défaut et seront modifiés en conséquence dans les sections 4, 5 et 6 au fur et à mesure que le protocole avance. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans les premières années, la cristallographie des protéines réalisée à température ambiante a eu énormément de difficulté à lutter contre les dommages causés par les rayons X. Ainsi, il a été remplacé par la méthode de cryocristallographie plus robuste à mesure que les sources de rayons X synchrotron devenaient facilement disponibles20. Avec l’avènement des lasers à rayons X à électrons libres, la cristallographie des protéines à température ambiante a été relancée ces dernières années, avec de nombreux nouveaux développements motivés par le désir d’observer la dynamique structurelle des protéines à une température physiologiquement pertinente 2,21. Le développement de la plateforme inSituX basée sur les dispositifs cristal sur cristal a été motivé par la même ambition, à savoir établir des méthodes de collecte de données de routine et robustes pour les études de cristallographie dynamique à température ambiante. Cette méthode automatisée de diffraction des rayons X en série est également applicable à la détermination de la structure statique des cristaux de protéines ne se prêtant pas à la congélation14. Dans ce protocole, nous présentons les principales considérations techniques ainsi que les étapes critiques nécessaires pour fournir une collecte de données à température ambiante à l’aide de cette plate-forme. Cette méthode est particulièrement adaptée aux cristaux de protéines fragiles sensibles à la manipulation mécanique, aux dommages causés par les rayons X ou à l’exposition à l’air.
Le prototype de la plate-forme a été largement testé sur deux lignes de faisceau de cristallographie de protéines à la source de photons avancée (APS) du laboratoire national d’Argonne. Bien qu’il soit assez simple de mettre en place la cristallisation sur puce selon ce protocole, l’étape de collecte de données implique plusieurs composants matériels et logiciels sur mesure. Par conséquent, son application et sa mise en œuvre de stratégies de collecte de données propres au projet peuvent nécessiter une collaboration étroite entre les utilisateurs et les scientifiques des lignes de faisceau. En d’autres termes, cette technologie dans sa forme actuelle est limitée aux utilisateurs qui ont un accès adéquat aux synchrotrons tels que l’APS. Néanmoins, le flux de travail global et les étapes clés décrites dans ce protocole serviraient de référence ou de guide pour tout groupe de recherche intéressé par la cristallographie des protéines à température ambiante.
L’avantage le plus important de cette plate-forme est qu’aucune manipulation de cristaux telle que le montage ou la congélation n’est nécessaire, de sorte que les cristaux de protéines délicats sont diffractés dans des conditions vierges. Un autre avantage majeur est que l’utilisation du substrat de quartz monocristallin donne lieu à très peu de diffusion de fond vers les images de diffraction des protéines tout en offrant des environnements stables pour la cristallisation des protéines sur une longue période (semaines à mois). Cependant, cette plate-forme n’est pas adaptée au criblage cristallin à matrice clairsemée car elle est destinée à la production de cristaux à grande échelle. En tant que tel, une connaissance préalable des conditions de cristallisation est nécessaire pour mettre en place des essais initiaux de cristallisation sur puce pour un échantillon de protéine donné.
En pratique, nous constatons que certaines étapes d’assemblage du dispositif, telles que la façon d’huiler une cale (étape 1.2) et la façon de sceller un dispositif (étape 2.3), aussi triviales qu’elles puissent paraître, affectent souvent directement les résultats de la cristallisation. Un appareil peut sécher rapidement si l’huilage n’est pas effectué correctement. En outre, un serrage excessif de l’appareil lors de la dernière étape de l’assemblage peut déformer les plaquettes de quartz, tandis qu’un sous-serrage entraîne des fuites potentielles et / ou une évaporation incontrôlée de l’appareil. Une autre étape critique est la planification des radiographies. Il faut traiter soigneusement les cristaux groupés ou encombrés pour éviter les motifs de diffraction qui se chevauchent et qui sont souvent difficiles à traiter. Ce problème peut être atténué par l’utilisation d’un faisceau de rayons X à micro-focalisation. Potentiellement, un ensemble de données complet pourrait être difficile à obtenir si la morphologie cristalline est une grande plaque mince de sorte que la plupart des plaques sont parallèles aux fenêtres de quartz. De plus, les copeaux de quartz monocristallin peuvent être recyclés et réutilisés après une procédure de nettoyage impliquant du savon et des solvants organiques qui éliminent les débris d’huile et de protéines. Habituellement, environ 80 à 90% de ces copeaux délicats peuvent être nettoyés sans dommage pour les prochaines expériences. Dans le cas de petits cristaux sur une ligne de faisceau micro-focalisée, lorsqu’une meilleure précision doit être obtenue dans le positionnement des cristaux, plusieurs composants matériels pourraient être améliorés, tels que des moteurs plus fins, une meilleure caméra et optique, un plus grand grossissement, etc. Cependant, aucun d’entre eux n’est proche des limitations de l’état de l’art. Par conséquent, beaucoup de place est disponible pour l’amélioration sans trop de difficulté.
Déclarations de divulgation
ZR est l’inventeur des puces cristal sur cristal sur le brevet américain 9632042 accordé à Renz Research, Inc.
Remerciements
L’utilisation d’Advanced Photon Source, une installation utilisateur de l’Office of Science exploitée pour le département de l’Énergie des États-Unis par Argonne National Laboratory, a été soutenue par le contrat DE-AC02-06CH11357. L’utilisation de BioCARS a été soutenue par le National Institute of General Medical Sciences des National Institutes of Health sous le numéro de subvention R24GM111072. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health. L’utilisation du secteur 21 du LS-CAT a été soutenue par la Michigan Economic Development Corporation et la subvention Michigan Technology Tri-Corridor 085P1000817. Ce travail est soutenu par des subventions de l’Université de l’Illinois à Chicago, des National Institutes of Health (R01EY024363) et de la National Science Foundation (MCB 2017274) à XY.
matériels
| Name | Company | Catalog Number | Comments |
| Analysis software | In-house developed | ||
| Cerium doped yttrium aluminum garnet | MSE Supplies | Ce:Y3Al5O12, YAG single crystal substrates | |
| Chip holder | In-house developed | ||
| Control software | In-house developed | ||
| Immersion oil | Cargille Laboratories | 16482 | Type A low viscosity 150 cSt |
| inSituX platform | In-house developed | ||
| IR light source | Thorlabs Incorporated | LED1085L | LED with a Glass Lens, 1085 nm, 5 mW, TO-18 |
| Microscope | Zeiss | SteREO Discovery V8 | |
| Outer ring | In-house developed | ||
| Petri dish | Fisher Scietific | FB0875713 | |
| Pipette | Pipetman | F167380 | P10 |
| Pump lasers | Thorlabs Incorporated | LD785-SE400 | 785 nm, 400 mW, Ø9 mm, E Pin Code, Laser Diode |
| Raspberry Pi | Raspberry Pi Fundation | ||
| Retaining ring | Thorlabs Incorporated | SM1RR | SM1 retaining ring for Ø1" lens tubes and mounts |
| Seedless quartz crystal | University Wafers, Inc. | U01-W2-L-190514 | 25.4 mm diameter Z-cut 0.05 mm thickness double side polish 8 mm on -X |
| Shim | In-house developed | ||
| X-ray beam stop | In-house developed |
Références
- Brändén, G., Neutze, R. Advances and challenges in time-resolved macromolecular crystallography. Science. 373, (2021).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, (2021).
- Schaffer, J. E., Kukshal, V., Miller, J. J., Kitainda, V., Jez, J. M. Beyond X-rays: an overview of emerging structural biology methods. Emerging Topics in Life Sciences. 5 (2), 221-230 (2021).
- Nogales, E., Scheres, S. H. W. Cryo-EM: A unique tool for the visualization of macromolecular complexity. Molecular Cell. 58, 677-689 (2015).
- Chapman, H. N., Caleman, C., Timneanu, N. Diffraction before destruction. Philosophical Transactions of the Royal Society B Biological Sciences. 369, 20130313 (2014).
- Kisselman, G., et al. X-CHIP: an integrated platform for high-throughput protein crystallization and on-the-chip X-ray diffraction data collection. Acta Crystallographica Section D Biological Crystallography. 67 (6), 533-539 (2011).
- Liang, M., et al. Novel combined crystallization plate for high-throughput crystal screening and in situ data collection at a crystallography beamline. Acta Crystallographica Section F Structural Biology Communications. 77, 319-327 (2021).
- le Maire, A., et al. In-plate protein crystallization, in situ ligand soaking and X-ray diffraction. Acta Crystallographica Section D Biological Crystallography. 67, 747-755 (2011).
- Perry, S. L., et al. In situ serial Laue diffraction on a microfluidic crystallization device. Journal of Applied Crystallography. 47, 1975-1982 (2014).
- Ren, Z., et al. Crystal-on-crystal chips for in situ serial diffraction at room temperature. Lab on a Chip. 18, 2246-2256 (2018).
- Ren, Z. Single crystal quartz chips for protein crystallization and X-ray diffraction data collection and related methods. US patent. , (2017).
- Ren, Z., et al. An automated platform for in situ serial crystallography at room temperature. IUCrJ. 7, 1009-1018 (2020).
- Croes, G. A. A method for solving traveling salesman problems. Operations Research. 6, 791-812 (1958).
- Bandara, S., et al. Crystal structure of a far-red-sensing cyanobacteriochrome reveals an atypical bilin conformation and spectral tuning mechanism. Proceedings of the National Academy of Sciences of the United States of America. 118, 2025094118 (2021).
- Shin, H., Ren, Z., Zeng, X., Bandara, S., Yang, X. Structural basis of molecular logic OR in a dual-sensor histidine kinase. Proceedings of the National Academy of Sciences of the United States of America. 116, 19973-19982 (2019).
- Yang, X., Ren, Z., Kuk, J., Moffat, K. Temperature-scan cryocrystallography reveals reaction intermediates in bacteriophytochrome. Nature. 479, 428-432 (2011).
- Zhang, F., Scheerer, P., Oberpichler, I., Lamparter, T., Krauss, N. Crystal structure of a prokaryotic (6-4) photolyase with an Fe-S cluster and a 6,7-dimethyl-8-ribityllumazine antenna chromophore. Proceedings of the National Academy of Sciences of the United States of America. 110, 7217-7222 (2013).
- Zeng, X., et al. Dynamic crystallography reveals early signaling events in ultraviolet photoreceptor UVR8. Nature Plants. 1, 14006 (2015).
- Wang, M., et al. Insights into base selectivity from the 1.8 Å resolution structure of an RB69 DNA polymerase ternary complex. Biochemistry. 50, 581-590 (2011).
- Rodgrs, D. W. Cryocrystallography. Structure. 2, 1135-1140 (1994).
- Zhao, F. -. Z., et al. A guide to sample delivery systems for serial crystallography. TheFEBS Journal. 286, 4402-4417 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon