Method Article
Резонансные анализы переноса энергии Фёрстера с временным разрешением для измерения эндогенных фосфорилированных белков STAT в клетках человека
В этой статье
Резюме
Описаны протоколы клеточного анализа резонансного переноса энергии Фёрстера с временным разрешением для простой, специфической, чувствительной и надежной количественной оценки эндогенного фосфорилированного преобразователя сигнала и активатора транскрипции (STAT) 1/3/4/5/6 белков в клеточных лизатах в формате 384 лунки.
Аннотация
Сигнальный путь Janus kinase (JAK)/сигнальный преобразователь и активатор транскрипции (STAT) играет решающую роль в опосредовании клеточных реакций на цитокины и факторы роста. Белки STAT активируются фосфорилированием тирозина, опосредованным главным образом JAK. Аномальная активация сигнальных путей STAT связана со многими заболеваниями человека, особенно раком и иммунными состояниями. Поэтому возможность мониторинга фосфорилирования белка STAT в нативной клеточной сигнальной среде важна как для академических исследований, так и для исследований по открытию лекарств. Традиционные форматы анализа, доступные для количественной оценки фосфорилированных белков STAT, включают вестерн-блоттинг и иммуноферментный анализ (ИФА). Эти гетерогенные методы являются трудоемкими, малопроизводительными и часто ненадежными (специфическими) в случае западного блоттинга. Однородные (без стирки) методы доступны, но остаются дорогими.
Здесь представлены подробные протоколы для чувствительного, надежного и экономически эффективного измерения в формате 384 скважин эндогенных уровней фосфорилированных STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) и STAT6 (Y641) в лизатах клеток из адгезивных или суспензионных ячеек с использованием новой платформы резонансного переноса энергии Förster (TR-FRET) с временным разрешением THUNDER. Рабочий процесс для анализа сотовой связи прост, быстр и предназначен для высокопроизводительного скрининга (HTS). Протокол анализа является гибким, использует малообъемный образец (15 мкл), требует только одного этапа добавления реагента и может быть адаптирован к приложениям с низкой и высокой пропускной способностью. Каждый фосфо-STAT сэндвич иммуноанализ проверяется в оптимизированных условиях с известными агонистами и ингибиторами и генерирует ожидаемые значения фармакологии и Z'-фактора. Поскольку анализы TR-FRET являются ратиометрическими и не требуют этапов промывки, они обеспечивают гораздо лучшую воспроизводимость, чем традиционные подходы. Вместе этот набор анализов предоставляет новые экономически эффективные инструменты для более полного анализа специфических фосфорилированных белков STAT после обработки клеток, а также скрининга и характеристики специфических и селективных модуляторов сигнального пути JAK / STAT.
Введение
Сигнальный путь JAK/STAT играет ключевую роль в опосредовании клеточных реакций на различные цитокины, интерфероны, факторы роста и связанные с ними молекулы1,2. Связывание этих лигандов со специфическими рецепторами клеточной поверхности приводит к активации JAK, которые, в свою очередь, активируют белки STAT путем фосфорилирования специфических остатков тирозина. Фосфорилирование STAT приводит к их димеризации и транслокации в ядро, где они оказывают свое влияние на транскрипцию регулируемых генов-мишеней. Семейство STAT состоит из семи членов: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b и STAT6. Члены играют сложную и существенную роль в регуляции физиологических клеточных процессов, включая пролиферацию, дифференцировку, апоптоз, ангиогенез и регуляцию иммунной системы. Аномальная активация сигнальных путей STAT связана со многими заболеваниями человека, особенно раком и иммунными состояниями3,4. Таким образом, способность оценивать фосфорилирование белка STAT в нативной клеточной сигнальной среде важна как для академических исследований, так и для исследований по открытию лекарств.
На сегодняшний день традиционные методы, используемые для измерения внутриклеточных уровней фосфорилированного белка, включая STATs, основаны на антителах и включают вестерн-блоттинг, ИФА и цитометрию фосфопотока. Эти гетерогенные методы являются трудоемкими, трудоемкими, трудоемкими, подверженными ошибкам, с низкой пропускной способностью и часто ненадежными (например, вопросы специфичности) в случае западного блоттинга5. Напротив, однородные анализы требуют меньшего количества экспериментальных этапов, используют меньшие объемы образцов и поддаются HTS. Существует пять коммерчески доступных платформ иммуноанализа на основе однородных клеток, которые можно использовать для количественного мониторинга JAK-зависимого фосфорилирования STATs в клеточных лизатах: SureFire, HTRF, LANCE, LanthaScreen и Lumit. Каждая из этих платформ имеет свои преимущества и недостатки.
SureFire основан на люминесцентной технологии канала кислорода, которая использует донорские и акцепторные шарики, покрытые специальным захватом пары антител, одно из которых является биотинилированным. В присутствии фосфорилированного белка два антитела приближают донорские и акцепторные шарики, что позволяет генерировать хемилюминесцентный сигнал6. Несмотря на универсальность и чувствительность, эта технология является дорогостоящей, подвержена влиянию биотина в питательной среде, очень чувствительна к температуре окружающей среды и свету и требует специального считывателя для обнаружения. HTRF и LANCE основаны на технологии TR-FRET, которая использует люминесцентные ионные комплексы лантаноидов с длительным сроком службы (хелаты европия или тербия, или криптат европия) в качестве донорских молекул и дальние красные флуорофоры в качестве молекул-акцепторов7. Когда два белково-специфических антитела, меченные донорскими или акцепторными молекулами, находятся в непосредственной близости, происходит FRET, вызывая увеличение акцепторной флуоресценции и снижение донорской флуоресценции. Эти долгоживущие флуоресцентные сигналы могут быть измерены с временным разрешением и ратиометрическим способом, чтобы уменьшить помехи анализа и повысить качество данных. Другие преимущества TR-FRET заключаются в том, что он не светочувствительн, позволяет повторять показания и демонстрирует длительную стабильность сигнала. В то время как TR-FRET широко применяется в HTS из-за его универсальности, чувствительности и высокой надежности, все коммерческие платформы анализа на основе TR-FRET являются дорогостоящими, что исключает его широкое внедрение в академических и небольших промышленных лабораториях. Анализ LanthaScreen также использует считывание на основе TR-FRET, но зависит от инженерной клеточной линии U2OS, которая стабильно экспрессирует зеленый флуоресцентный белок (GFP)-STAT1 в сочетании с меченым тербием фосфо-специфическим антителом STAT18. Помимо того, что этот метод ограничен с точки зрения выбора сигнальных белков, он требует покупки дорогостоящих трансфектированных клеточных линий, снижения его применимости и увеличения возможности экспериментальных артефактов. Lumit - это универсальная платформа для биолюминесцентного иммуноанализа, которая использует вторичные антитела (против мышей и кроликов), химически меченые малыми и большими субъединицами NanoBit Люциферазы NanoLuc9. Связывание двух первичных антител с целевым белком приводит вторичные антитела в близость, образуя активный фермент, который генерирует сигнал люминесценции. В то время как люминесценция, как правило, является чувствительным и надежным считыванием, потребность в первичных антителах, выращенных у двух разных видов, ограничивает выбор конструкции анализа. Кроме того, использование вторичных антител в сложных матрицах образцов может быть склонно к анализу интерференции.
Таким образом, по-прежнему существует потребность в надежной, быстрой, но доступной клеточной аналитической платформе для измерения отдельных фосфорилированных и общих белков STAT способом, совместимым с HTS. Для удовлетворения этой потребности была разработана новая высокопроизводительная клеточная иммунологическая платформа, основанная на усовершенствованной технологии TR-FRET (THUNDER) и предназначенная для обеспечения простого, чувствительного, надежного и экономически эффективного измерения эндогенно экспрессированных внутриклеточных белков (фосфорилированных или общих) в клеточных лизатах. Преимущества этой технологии связаны с комбинацией пары донор/акцептор FRET, демонстрирующей исключительную спектральную совместимость и сигнал TR-FRET, строго проверенные антитела и оптимизированные буферы лизиса. Эти анализы форматируются как сэндвич-иммуноанализы и используют простой трехэтапный рабочий процесс (рисунок 1). Клетки сначала обрабатывают для модуляции фосфорилирования белка, а затем лизируют специфическим буфером лизиса, предусмотренным в наборе. Целевой фосфорилированный или общий белок STAT в клеточном лизате обнаруживается на стадии добавления и инкубации реагента с парой флуорофор-меченых антител, которые распознают различные эпитопы на белке-мишени (рисунок 2). Одно антитело маркируется донором хелата европия (Eu-Ab1), в то время как второе антитело маркируется дальним красным акцепторным флуорофором (FR-Ab2). Два меченых антитела связываются с белком в растворе, в результате чего две метки находятся в непосредственной близости. Возбуждение донорского хелата европия при 320 или 340 нм запускает FRET к акцептору, который излучает долгоживущий сигнал TR-FRET на 665 нм, пропорциональный концентрации белка-мишени (фосфорилированного или общего) в клеточном лизате.

Рисунок 1: Рабочий процесс анализа TR-FRET. Рабочий процесс состоит из трех этапов: обработка клеток, лизис клеток и обнаружение белка с использованием TR-FRET. В протоколе двухпластинчатого анализа лизаты переносятся на белую 384-луночную детектирующую пластину, тогда как в протоколе с одной пластиной все этапы проводятся в одной и той же белой 384-луночной детектирующей пластине (протокол «все в одной скважине»). Независимо от используемого протокола анализа, обнаружение белка выполняется в одном и том же общем объеме (20 мкл на лунку). Аббревиатура: TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Принцип иммунологического анализа сэндвича TR-FRET. Одно антитело маркируется донором хелата европия (Eu-Ab1), а второе — дальнокрасым малым флуорофорным акцептором (FR-Ab2). Два меченых антитела связываются специфически с различными эпитопами на белке-мишени (фосфорилированном или общем) в клеточном лизате, в результате чего два флуорофора находятся в непосредственной близости. Возбуждение донора хелата европия при 320 или 340 нм запускает FRET от донора к молекулам-акцепторам, которые в свою очередь излучают сигнал на 665 нм. Этот сигнал пропорционален концентрации белка в клеточном лизате. При отсутствии специфического белка-мишени донорский и акцепторный флуорофоры находятся слишком далеко друг от друга для возникновения FRET. Сокращения: FRET = резонансный перенос энергии Фёрстера; TR-FRET = фрет с временным разрешением; Ab = антитело; FR = дальний красный; Eu - хелат европия; P = фосфорилирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Здесь представлены подробные протоколы для измерения в формате 384 лунки внутриклеточных уровней фосфорилированных STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) и STAT6 (Y641) вместе с общим количеством STAT1, STAT3, STAT5 и STAT6 в лизатах клеток из адгезивных или суспензионных ячеек с использованием платформы THUNDER TR-FRET. Эти протоколы определяют этапы обработки клеток, лизиса и обнаружения целевого белка на основе TR-FRET с использованием либо протокола передачи двух пластин, либо протокола «все в одной скважине». Эти клеточные анализы применяются для определения фармакологического профиля известных активаторов и ингибиторов пути JAK/STAT. Продемонстрирована надежность и пригодность выбранных анализов для ХТШ. Наконец, обсуждаются ключевые эксперименты по оптимизации анализа, а также рекомендации по устранению неполадок анализа.
протокол
1. Клеточная культура
- Поддерживайте клетки в увлажненном инкубаторе и культуре CO2 с температурой 37 ° C / 5% с помощью DMEM, дополненного 10% фетальной бычьей сывороткой (FBS) (клетки HeLa и A431), либо RPMI, дополненной 15% FBS (клетки U266B1). Культивируйте клетки до тех пор, пока они не достигнут 70-80% слияния, затем попробуйте их и пройдите или используйте для анализов.
ПРИМЕЧАНИЕ: Питательные среды содержали фенол красный. До проведения анализов не проводилось сывороточного голодания для какой-либо клеточной линии.
2. Титрование стимулятора или ингибитора с использованием протокола двухпластинного анализа с адгезивными клетками
ПРИМЕЧАНИЕ: В этой процедуре описывается, как определить потенции стимулятора или ингибитора путем создания кривой концентрация-реакция из серии разбавления исследуемого соединения.
- Посев клеток
- Дозировать 50 мкл клеток с предварительно оптимизированной плотностью (40 000 клеток HeLa/лунка как для STAT3, так и для STAT6; 75 000 клеток A431/лунка для STAT5) в 96-луночную пластину, обработанную культурой тканей, в соответствующей культуральной среде. Инкубировать в течение ночи при 37 °C/5% CO2.
ПРИМЕЧАНИЕ: Необходимо определить оптимальную плотность клеток и время инкубации культуры.
- Дозировать 50 мкл клеток с предварительно оптимизированной плотностью (40 000 клеток HeLa/лунка как для STAT3, так и для STAT6; 75 000 клеток A431/лунка для STAT5) в 96-луночную пластину, обработанную культурой тканей, в соответствующей культуральной среде. Инкубировать в течение ночи при 37 °C/5% CO2.
- Разбавления исследуемых соединений
- Получение промежуточной 2-кратной серии разбавления испытательного соединения (соединений) путем последовательного разбавления соединения (соединений) (полулогарифмических интервальных разбавлений) через 12 скважин полипропиленовой 96-луночной пластины в среду, свободную от сыворотки.
ПРИМЕЧАНИЕ: Для точной оценки EC50 или IC50 рекомендуется проводить 12-точечную кривую концентрации-отклика с половинным интервалом по меньшей мере в двух экземплярах. - Альтернативно, для гидрофобных, растворимых в диметилсульфоксиде (ДМСО) испытательных соединений, выполняют начальные разведения в 100% ДМСО, а затем разбавляют серию разбавления соединения в безсывороточную среду.
ПРИМЕЧАНИЕ: Допуск анализа на ДМСО должен быть установлен до проведения испытательного титрования соединений в транспортном средстве ДМСО. Важно поддерживать равные концентрации растворителей между обработанными и необработанными клетками. Кроме того, при испытании серийных разбавлений соединений концентрации растворителей всегда должны оставаться постоянными во всех рядах разбавления.
- Получение промежуточной 2-кратной серии разбавления испытательного соединения (соединений) путем последовательного разбавления соединения (соединений) (полулогарифмических интервальных разбавлений) через 12 скважин полипропиленовой 96-луночной пластины в среду, свободную от сыворотки.
- Лечение клеток
- Для стимуляции клеток добавьте 50 мкл свободной от сыворотки среды (необработанные клетки) или содержащей стимулятор (2x).
- Инкубировать в течение предварительно оптимизированного времени при комнатной температуре (RT) или 37 °C (интерферон (IFN) α2b/20 мин при RT для STAT3; эпидермальный фактор роста (EGF)/10 мин при RT для STAT5; интерлейкин (IL)-4/20 мин при RT для STAT6). Затем перейдите к разделу 2.4.
ПРИМЕЧАНИЕ: Необходимо определить оптимальную температуру инкубации. - Для ингибирования клеток добавьте 25 мкл свободной от сыворотки среды (необработанные клетки) или содержащей ингибитор (4x).
- Инкубировать в течение предварительно оптимизированного времени при RT или 37 °C (ингибитор JAK 1/30 мин при RT для STAT3 и STAT6; Эрлотиниб/15 мин при РТ для STAT5).
- Добавьте 25 мкл свободной от сыворотки среды (необработанные клетки) или содержащей стимулятор (4x) в его EC80.
- Инкубировать в течение предварительно оптимизированного времени при RT или 37 °C (те же условия, что и на этапе 2.3.2).
- Лизис клеток
- Подготовьте специальный 1x дополненный лизисный буфер комплекта в соответствии с указаниями производителя.
ПРИМЕЧАНИЕ: Обязательным является дополнение 1x Lysis Buffer 100x Phosphatase Inhibitor Cocktail, разбавленным до конечной концентрации 1x. 1x дополненный лизисный буфер содержит 1 мМ фторида натрия, 2 мМ ортованадата натрия и 2 мМ бета-глицерофосфата. Другие ингибиторы фосфатазы не требуются и их следует избегать. Буферы лизиса и ингибиторы фосфатазы, отличные от тех, которые включены в набор, не рекомендуются, поскольку они могут содержать ингредиенты, которые могут помешать измерению. - Осторожно удалите и выбросьте питательную среду клеток, аспирируя супернатант.
- Немедленно добавьте 50 мкл 1x дополненного буфера лизиса.
ПРИМЕЧАНИЕ: Объем буфера лизиса (25-50 мкл) может быть оптимизирован. - Инкубировать в течение 30 мин при РТ при встряхивании (орбитальный пластинчатый шейкер устанавливают при 400 об/мин; умеренное перемешивание).
ПРИМЕЧАНИЕ: Время инкубации лизиса (30-60 мин) может быть оптимизировано. Лизаты могут быть немедленно использованы для обнаружения целевого белка или заморожены при -80 °C.
- Подготовьте специальный 1x дополненный лизисный буфер комплекта в соответствии с указаниями производителя.
- Обнаружение TR-FRET
- Подготовьте 4x Antibody Detection Mix в 1x Detection Buffer в соответствии с указаниями производителя.
- На этом этапе переноса аккуратно пипетку 15 мкл клеточного лизата из 96-луночной культуральной пластины в скважину из белой микропластины небольшого объема из 384 лунок.
- Добавьте 15 мкл положительного контрольного лизата и 15 мкл 1x лизисного буфера (отрицательный контроль) в отдельные пробирные скважины.
- Добавьте 5 мкл 4-кратной смеси для обнаружения антител (либо Eu-Ab1/FR-Ab2 для обнаружения фосфо-белка, либо Eu-Ab3/FR-Ab4 для обнаружения общего белка) в каждую из пробирных ядер.
- Накройте пластину пластинчатым герметизатором и инкубируйте в течение 1 ч до ночи на РТ, в зависимости от анализа (см. соответствующий Технический паспорт).
ПРИМЕЧАНИЕ: Оптимальное время считывания должно быть оптимизировано для каждого анализа и клеточной линии. Пластину можно считывать несколько раз без негативного влияния на производительность анализа. - Снимите герметик клейкой пластины и считайте пластину на считывателе микропластин, совместимом с TR-FRET.
ПРИМЕЧАНИЕ: Рекомендуются флуорометры на основе фильтров, хотя можно использовать некоторые монохроматорные приборы. Убедитесь, что установлен соответствующий оптический модуль (фильтры и зеркало) для TR-FRET. Используйте длину волны возбуждения 320 или 340 нм для возбуждения хелата европия. Считывание анализов при 615 нм (или 620 нм) и 665 нм для обнаружения излучения как донора европия, так и акцепторного флуорофора соответственно. Настройки прибора будут зависеть от конкретного считывателя. Данные, представленные здесь, были получены с использованием возбуждения на основе лампы, задержки 90 мкс, времени интеграции 300 мкс и 100 вспышек на лунку. Анализ фосфо-STAT4, однако, был прочитан с использованием лазерного возбуждения для генерации более высоких соотношений сигнал-фон (S / B).
3. Титрование стимулятора или ингибитора с использованием протокола двухпластинного анализа с суспензионными клетками
- Разбавление исследуемых соединений
- Подготовьте промежуточную серию 2-кратного разбавления испытательного соединения (веществ), как описано на этапах 2.2.1 и 2.2.2.
- Посев и обработка клеток
- Дозируйте 20 мкл клеток с предварительно оптимизированной плотностью (200 000 клеток U266B1 / лунка для STAT1; 400 000 клеток U266B1 / лунка для STAT4) в 96-луночную пластину, обработанную культурой ткани, в соответствующей питательной среде. Непосредственно приступают к клеточной обработке или инкубируют 2-4 ч при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: Этот шаг должен быть оптимизирован для различных типов клеток. - Для стимуляции клеток добавьте 20 мкл свободной от сыворотки среды (необработанные клетки) или содержащей стимулятор (2x).
- Инкубировать в течение предварительно оптимизированного времени при RT или 37 °C (IFNα2b/15 мин при RT для STAT1; IFNα2b/25 мин при 37 °C для STAT4). Затем перейдите к разделу 3.3.
ПРИМЕЧАНИЕ: Необходимо определить оптимальную температуру инкубации. - Для ингибирования клеток добавьте 10 мкл свободной от сыворотки среды (необработанные клетки) или содержащей ингибитор (4x).
- Инкубировать в течение предварительно оптимизированного времени при RT или 37 °C (ингибитор JAK 1/30 мин при RT для STAT1 и STAT4).
- Добавьте 10 мкл свободной от сыворотки среды (необработанные клетки) или содержащей стимулятор (4x) в его EC80.
- Инкубировать в течение предварительно оптимизированного времени при RT или 37 °C (те же условия, что и на этапе 3.2.3).
- Дозируйте 20 мкл клеток с предварительно оптимизированной плотностью (200 000 клеток U266B1 / лунка для STAT1; 400 000 клеток U266B1 / лунка для STAT4) в 96-луночную пластину, обработанную культурой ткани, в соответствующей питательной среде. Непосредственно приступают к клеточной обработке или инкубируют 2-4 ч при 37 °C, 5% CO2.
- Лизис клеток
- Подготовьте специальный 5-кратный дополнительный буфер лизиса в комплекте, как указано производителем.
ПРИМЕЧАНИЕ: Обязательно дополнить 5-кратный буфер лизиса 100-кратным коктейлем ингибитора фосфатазы, разбавленным до конечной концентрации 5 раз. 5x дополненный лизисный буфер содержит 5 мМ фторида натрия, 10 мМ ортованадата натрия и 10 мМ бета-глицерофосфата. Другие ингибиторы фосфатазы не требуются и их следует избегать. - Добавьте 10 мкл 5-кратного дополненного буфера лизиса.
- Инкубировать в течение 30 мин при РТ при встряхивании (орбитальный пластинчатый шейкер устанавливают при 400 об/мин; умеренное перемешивание).
ПРИМЕЧАНИЕ: Время инкубации лизиса (30-60 мин) может быть оптимизировано. Лизаты могут быть немедленно использованы для обнаружения целевого белка или заморожены при -80 °C.
- Подготовьте специальный 5-кратный дополнительный буфер лизиса в комплекте, как указано производителем.
- Обнаружение TR-FRET
- После лизиса клеток проводят стадию обнаружения TR-FRET, как описано в разделе 2.5 для протокола анализа с 2 пластинами для адгезивных клеток.
4. Титрование стимулятора с использованием протокола однопластинного анализа с адгезивными или суспензионными клетками
- Разбавление исследуемых соединений
- Подготовка промежуточной серии разбавления исследуемого соединения (соединений) при 3x путем последовательного разбавления соединения (соединений) (полулогарифмических интервальных разбавлений) в 12 скважинах полипропиленовой 96-луночной пластины в среду, свободную от сыворотки.
- Посев и обработка клеток
- Дозировать 8 мкл клеток при предварительно оптимизированной плотности (160 000 клеток U266B1 / лунка для STAT4; 80 000 клеток HeLa / лунка для STAT6), в соответствующей культуральной среде без сыворотки, в белую, малообъемную 384-язую пробирную пластину. Непосредственно приступают к клеточной обработке или инкубируют 2-4 ч при 37 °C, 5% CO2.
ПРИМЕЧАНИЕ: Потребность в инкубационном периоде клеточной культуры перед обработкой должна быть определена для различных типов клеток. - Для стимуляции клеток добавьте 4 мкл свободной от сыворотки среды (необработанные клетки) или содержащей стимулятор (3x).
- Инкубировать в течение предварительно оптимизированного времени при комнатной температуре или 37 °C (IFNα2b/25 мин при 37°C для STAT4; IL-4/20 мин при 37°C для STAT6). Затем перейдите к разделу 4.3.
- Дозировать 8 мкл клеток при предварительно оптимизированной плотности (160 000 клеток U266B1 / лунка для STAT4; 80 000 клеток HeLa / лунка для STAT6), в соответствующей культуральной среде без сыворотки, в белую, малообъемную 384-язую пробирную пластину. Непосредственно приступают к клеточной обработке или инкубируют 2-4 ч при 37 °C, 5% CO2.
- Лизис клеток
- Подготовьте специальный 5-кратный дополнительный буфер лизиса в комплекте, как указано производителем.
ПРИМЕЧАНИЕ: Обязательно дополнить 5-кратный буфер лизиса 100-кратным коктейлем ингибитора фосфатазы, разбавленным до конечной концентрации 5 раз. - Добавьте 3 мкл 5x дополненного буфера лизиса.
- Инкубировать в течение 30 мин при РТ при встряхивании (орбитальный пластинчатый шейкер при 400 об/мин).
ПРИМЕЧАНИЕ: Время инкубации лизиса (30-60 мин) может быть оптимизировано. Лизаты можно использовать немедленно или заморозить при 80 °C.
- Подготовьте специальный 5-кратный дополнительный буфер лизиса в комплекте, как указано производителем.
- Обнаружение TR-FRET
- Добавьте 15 мкл положительного контрольного лизата (неразбавленного) и 15 мкл 1x дополненного лизисного буфера (отрицательный контроль) в отдельные пробирные скважины.
- Добавьте 5 мкл 4-кратной смеси для обнаружения антител (либо Eu-Ab1/FR-Ab2 для фосфо-белка, либо Eu-Ab3-/FR-Ab4 для общего белка), приготовленной в 1x детекторном буфере, в каждую из пробирных лунок.
- Накройте пластину пластинчатым герметиком и инкубируйте в течение 1 ч до ночи на РТ, в зависимости от анализа.
ПРИМЕЧАНИЕ: Оптимальное время считывания должно быть оптимизировано для каждого анализа и клеточной линии. Пластину можно считывать несколько раз без негативного влияния на производительность анализа. - Снимите клейкую пластину герметика. Считывание пластины на TR-FRET-совместимом микропластине считывателе.
5. Анализ данных
- Рассчитайте коэффициент TR-FRET для каждой скважины, используя следующую формулу (1):
 (1)
(1)
ПРИМЕЧАНИЕ: Поскольку сигнал TR-FRET считывается в режиме с временным разрешением, вычитание фона обычно не требуется. Если проводится фоновое вычитание, используйте бесклеточные скважины, содержащие 1x дополненный буфер лизиса (отрицательный контроль) для фонового вычитания. Определите среднее соотношение TR-FRET из бесклеточных скважин, а затем вычтите это значение из отношения TR-FRET каждой скважины. - Для кривых концентрация-отклик анализируйте данные в соответствии с нелинейной регрессией, используя логистическое уравнение с 4 параметрами (сигмоидальная кривая доза-реакция с переменным наклоном) и взвешивание данных 1/Y2 для получения значений EC50 или IC50 .
- Для эксперимента с Z-фактором проанализируйте данные по следующей формуле (2)10
 (2)
(2)
Где μ и σ являются средними значениями и стандартными отклонениями для положительного контроля (p; стимулированные клетки) и отрицательного контроля (n; необработанные клетки) соответственно.
Результаты
Каждый анализ THUNDER TR-FRET был фармакологически подтвержден путем лечения адгезивных (HeLa или A431) или суспензионных клеток (U266B1) активаторами или ингибиторами, специфичными для пути JAK / STAT, а затем измерением уровней конкретных фосфорилированных и общих STATs, когда это применимо. Анализы проводились в формате 384 скважины с использованием протокола передачи двух пластин и предварительно оптимизированных условий анализа. Рисунок 3, Рисунок 4, Рисунок 5, Рисунок 6 и Рисунок 7 обобщают репрезентативные кривые концентрации-отклика, полученные для всех анализов STAT. В целом, все кривые концентрации-ответа стимулятора и ингибитора для анализов фосфо-STAT показали надежные сигналы TR-FRET, широкие динамические диапазоны, низкий коэффициент вариации между скважинами (обычно ≤5%) и приемлемые соотношения S/B. Значения EC50 и IC50 , представленные здесь, находятся в диапазоне ожидаемых значений.
Обработка клеток активаторами JAK IFNα2b (фосфо-STAT1, фосфо-STAT3 и фосфо-STAT4), IL-4 (фосфо-STAT6) и EGF (фосфо-STAT5) показала ожидаемое концентрационно-зависимое увеличение фосфорилирования STAT при определенных остатках тирозина, в то время как соответствующие общие белки STAT (STAT1, STAT3, STAT5 и STAT6) оставались стабильными (Рисунок 3, Рисунок 4, Рисунок 5, Рисунок 6 и Рисунок 7 , Группа А). Снижение сигнала (менее 20%), наблюдаемое для общего STAT5 с увеличением фосфорилирования STAT5, ожидается и обусловлено стерическим препятствием, когда фосфорилирование STAT5 препятствует связыванию одного из двух анти-суммарных антител STAT5 с соответствующим антигеном. Значения EC50 находились в субномолярном диапазоне для IFNα2b и IL-4 (от 0,083 до 0,47 нМ) и в низком наномолярном диапазоне для EGF (12 нМ). Эти значения согласуются с опубликованными данными6,11.
Чтобы подтвердить, что сигнал, индуцированный активаторами, был опосредован активацией эндогенных рецепторов, клетки предварительно обрабатывали повышением концентрации либо ингибитора JAK 1 (пан-ингибитор JAK), либо Эрлотиниба (ингибитор тирозинкиназы EGFR) перед субмаксимальной стимуляцией (EC80) активаторами STAT. Как и ожидалось, как ингибитор JAK 1, так и эрлотиниб ингибировали соответствующие уровни фосфо-STAT в зависимости от концентрации, причем значения IC50 варьировались между низким наномолярным и высоким наномолярным диапазоном для ингибитора JAK 1 (29-759 нМ) и в низком наномолярном диапазоне для эрлотиниба (10 нМ) (рисунок 3, рисунок 4, рисунок 5, рисунок 6 и рисунок 7, Группа B). Значения IC50 согласуются с опубликованными данными11,12,13. Как и в случае со стимулирующими экспериментами, уровни соответствующего общего STAT не были затронуты ни одним из методов лечения. Взятые вместе, эти результаты демонстрируют специфичность каждого анализа для его эндогенного целевого белка STAT (фосфорилированного или общего) и их способность профилировать активаторы или ингибиторы, демонстрирующие ряд потенций.
Анализы, в которых весь рабочий процесс (обработка клеток, лизис и обнаружение белка) проводится в одной скважине из 384-луночной пластины без стадии переноса, больше подходят для HTS. Соответственно, анализы фосфо-STAT4 и фосфо-STAT6 проводились с использованием протокола с одной пластинкой. Репрезентативные данные, полученные в оптимизированных условиях, обобщены на рисунках 8 и 9. Стимуляция фосфорилированного STAT4 ifNα2b в клеточной линии суспензии (U266B1; Рисунок 8) или фосфорилированный STAT6 il-4 в адгезивной клеточной линии (HeLa; Рисунок 9) был получен с приемлемыми соотношениями S/B и значениями EC50 , соответствующими тем, которые получены с использованием протокола двух пластин. Эти данные показывают, что анализы фосфо-STAT могут быть успешно адаптированы от протокола передачи двух пластин к протоколу «все в одной скважине» с одной пластиной.
Z'-фактор обычно используется в сообществе HTS для оценки пригодности и надежности анализа для HTS10. Для дальнейшей проверки анализов фосфо-STAT были проведены предварительные исследования Z'-фактора вручную с использованием протокола с двумя пластинами. Чтобы оценить стабильность анализа, пластины считывали как после 4-часовой инкубации, так и после ночной инкубации. Результаты, полученные для анализов фосфо-СТАТ1 и фосфо-СТАТ3 с использованием клеточной линии суспензии (U266B1) или адгезивной клеточной линии (HeLa), соответственно, обобщены на фиг.10. Расчетные значения Z'-фактора составили 0,85 для фосфо-СТАТ1 и 0,79 для фосфо-СТАТ3. После ночной инкубации значения Z'-фактора оставались стабильными (0,83 для фосфо-СТАТ1 и 0,78 для фосфо-СТАТ3). Аналогичные значения Z'-фактора были получены для других анализов фосфо-СТАТ (STAT4: 0,79; СТАТ5: 0,78; СТАТ6: 0,63). Клеточный анализ с Z'-фактором ≥ 0,40 считается подходящим для HTS15. Соответственно, эти результаты демонстрируют надежность этих анализов фосфо-STAT для применения HTS.

Рисунок 3: Обнаружение модуляции фосфо-STAT1 (Y701) в клетках U266B1. Клетки (200 000 клеток/лунка), посеянные в 96-луночной культуральной пластине, обрабатывали повышением концентрации либо (A) IFNα2b в течение 15 мин при RT, либо (B) ингибитора JAK 1 в течение 30 мин при RT, затем 1 нМ (EC80) IFNα2b в течение 15 мин при RT. После лизиса лизаты переносили в малообъемную 384-луночную белую пластину с последующим добавлением смеси для обнаружения антител. Пластину инкубировали в течение 4 ч на RT, а затем считывали на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IFN = интерферон; RT = комнатная температура; JAK = Янус киназа; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Обнаружение фосфо-STAT3 (Y705) и общей модуляции STAT3 в клетках HeLa. Клетки (40 000 клеток/лунка), культивируемые в течение ночи в 96-луночной культуральной пластине, обрабатывали повышением концентрации либо (A) IFNα2b в течение 20 мин на RT, либо (B) ингибитора JAK 1 в течение 30 мин при RT, а затем 1,5 нМ IFNα2b в течение 20 мин при RT. После удаления среды и лизиса лизаты переносили в белую пластину с малым объемом 384 лунки, с последующим добавлением смеси для обнаружения антител. Пластину инкубировали в течение 4 ч на RT, а затем считывали на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IFN = интерферон; RT = комнатная температура; JAK = Янус киназа; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Обнаружение модуляции фосфо-STAT4 (Y693) в клетках U266B1. Клетки (400 000 клеток/лунка), посеянные в 96-луночной культуральной пластине, обрабатывали повышением концентрации либо (A) IFNα2b в течение 25 мин при 37 °C, либо (B) ингибитора JAK 1 в течение 30 мин при RT, затем 1 нМ IFNα2b в течение 25 мин при 37 °C. После удаления среды и лизиса лизаты переносили в белую пластину с малым объемом 384 лунки, с последующим добавлением смеси для обнаружения антител. Пластина инкубировалась в течение ночи в RT, а затем считывалась на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IFN = интерферон; RT = комнатная температура; JAK = Янус киназа; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Обнаружение фосфо-STAT5 (Y694/Y699) и общей модуляции STAT5 в ячейках A431. Клетки (75 000 клеток/лунка), культивируемые в течение ночи в 96-луночной культуральной пластине, обрабатывали повышением концентрации либо (А) EGF в течение 10 мин при RT, либо (B) Эрлотиниба в течение 15 мин при RT, затем 73 нМ EGF в течение 10 мин при RT. После удаления среды и лизиса лизаты переносили в белую пластину с малым объемом 384 лунки, с последующим добавлением смеси для обнаружения антител. Пластина инкубировалась в течение ночи в RT, а затем считывалась на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; EGF = эпидермальный фактор роста; RT = комнатная температура; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
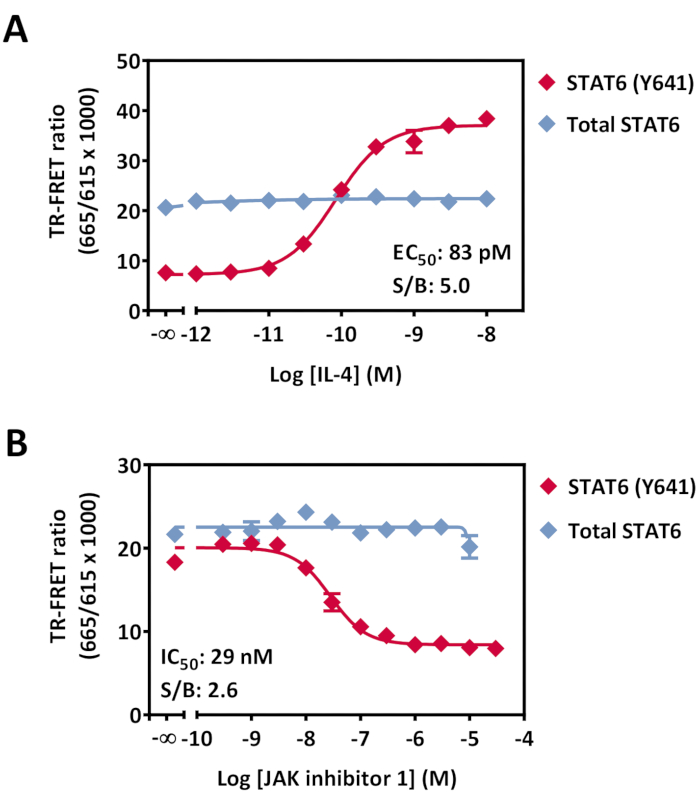
Рисунок 7: Обнаружение фосфо-STAT6 (Y641) и общей модуляции STAT6 в клетках HeLa. Клетки (40 000 клеток/лунка), культивируемые в течение ночи в 96-луночной культуральной пластине, обрабатывали повышением концентрации либо (А) IL-4 в течение 20 мин при RT, либо (B) ингибитора JAK 1 в течение 30 мин при RT, затем 0,5 нМ IL4 в течение 20 мин при RT. После удаления среды и лизиса лизаты переносили в белую пластину с малым объемом 384 лунки, с последующим добавлением смеси для обнаружения антител. Пластину инкубировали в течение 4 ч на RT, а затем считывали на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IL = интерлейкин; JAK = Янус киназа; RT = комнатная температура; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Обнаружение стимуляции фосфо-STAT4 (Y693) в клетках U266B1 по протоколу с одной пластинкой. Клетки (160 000 клеток/лунка), посеянные в малообъемную 384-луночную белую пластину, немедленно обрабатывали повышением концентрации IFNα2b в течение 25 мин при 37 °C. После лизиса смесь для обнаружения антител добавлялась непосредственно к лизату. Пластину инкубировали в течение ночи в RT, а затем считывали на TR-FRET-совместимом считывателе с помощью лампы вспышки или лазерного возбуждения. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IFN = интерферон; RT = комнатная температура; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9: Обнаружение стимуляции фосфо-STAT6 (Y641) в клетках HeLa по протоколу одной пластинки. Клетки (80 000 клеток/лунка), посеянные в малообъемную белую пластину с 384 лунками, немедленно обрабатывали повышением концентрации IL-4 в течение 20 мин при RT. После лизиса смесь для обнаружения антител добавлялась непосредственно к лизату. Пластину инкубировали 4 ч на RT, а затем считывали на TR-FRET-совместимом считывателе. Данные показаны как среднее значение тройных скважин на точку анализа. Полосы ошибок указывают на стандартное отклонение. Некоторые полосы ошибок меньше размера символа. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IL = интерлейкин; RT = комнатная температура; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10: Исследование внутрипластичной вариабельности анализа фосфо-STAT1 (Y701) и фосфо-STAT3 (Y705). (A) Анализ фосфо-STAT1: клетки суспензии (200 000 клеток U266B1 / лунка) обрабатывали либо 10 нМ IFNα2b в течение 15 мин, либо только безсывороточной средой (низкие контрольные группы). (B) Анализ фосфо-STAT3: адгезивные клетки (20 000 клеток HeLa/лунка) обрабатывали либо 5 нМ IFNα2b в течение 20 мин, либо только безывороточной средой. Для обоих анализов сигнал TR-FRET считывался после 4 ч инкубации. Сокращения: STAT = преобразователь сигнала и активатор транскрипции; IFN = интерферон; TR-FRET = резонансный перенос энергии Фёрстера с временным разрешением; S/B = отношение сигнал/фон; CV = коэффициент вариации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
По сравнению с традиционными методами анализа фосфопротеинов, такими как западное блоттинг и методы на основе ИФА, рабочий процесс для клеточного анализа THUNDER TR-FRET прост и быстр, использует образец малого объема (15 мкл), предназначен для HTS в формате 384 скважины и очень поддается автоматизации. Протокол анализа является гибким и может быть легко адаптирован как для приложений со средней, так и с высокой пропускной способностью. Анализы могут быть выполнены с использованием либо протокола передачи двух пластин, либо протокола одной-384-луночной пластины. В протоколе переноса двух пластин клетки засевают, обрабатывают и лизируют в одной пластине культуры клеток, а лизаты впоследствии переносят на отдельную белую детектируемую пластину (пластину половинной площади 96 или 384 лунки) для анализа. В протоколе пластины с одной скважиной 384 скважины весь рабочий процесс проводится в одной скважине, что устраняет необходимость в этапе переноса жидкости. Анализы могут быть легко адаптированы к формату 1536 скважин за счет пропорционального уменьшения объема. Независимо от протокола анализа, есть только три раствора реагентов для приготовления и нет этапов промывки, и анализы могут быть выполнены в соответствии с протоколом «только для добавления», требующим минимального практического времени.
Критическим шагом в выполнении любого клеточного анализа является оптимизация клеточной культуры и условий обработки16. Как количество клеток, так и условия лечения требуют тщательной оптимизации перед проведением анализа, поскольку эти ключевые параметры часто варьируются для каждой клеточной линии и каждого фосфопротеина. Оптимизация этих параметров позволяет максимизировать окно анализа, получить оптимальную производительность с высоким коэффициентом S/B и низким межскважинным коэффициентом вариации, а также обеспечить надежность и воспроизводимость результатов. Количество клеток, сывороточное голодание (при необходимости) и время стимуляции или ингибирования (при комнатной температуре или 37 °C) должны быть оптимизированы для каждой клеточной линии и целевого белка. Слишком высокое или слишком низкое количество клеток может негативно влиять на модуляцию внутриклеточных сигнальных путей. Плотность посева клеток 40 000-80 000 клеток / лунка для адгезивных клеток или 100 000-200 000 клеток / лунка для клеток суспензии обычно приемлема для большинства клеточных линий. Следует отметить, что оптимальная продолжительность времени для стимуляции и ингибирования может широко варьироваться между клеточными линиями и целевыми белками, от нескольких минут до нескольких часов. Таким образом, исследование времени настоятельно рекомендуется для определения оптимального времени инкубации стимуляции и ингибирования, в идеале как при комнатной температуре, так и при 37 ° C, поскольку температура инкубации влияет на кинетику стимуляции целевого белка.
Устранение неполадок клеточного анализа может быть сложным и трудоемким из-за многих этапов, связанных с рабочим процессом (клеточная культура, обработка клеток, лизис и обнаружение белка). Эти наборы для анализа включают положительный контрольный лизат. Рекомендуется использовать эти положительные контрольные лизаты и отрицательный контроль (1x дополненный Lysis Buffer в одиночку) в каждом эксперименте. Использование надлежащих средств управления облегчает устранение неполадок, поскольку проблемы могут быть быстро отнесены либо к этапу обнаружения (неправильная подготовка реагента и/или выполнение анализа), либо к качеству лизатов, используемых в эксперименте. Последнее, как правило, связано с использованием субоптимальных клеточных состояний.
Дополнительным преимуществом этой платформы является наличие набора оптимизированных буферов лизиса с различными строками. Это позволяет генерировать более или менее гетерогенные лизаты из частичного субклеточного фракционирования. Это полезно, потому что сигнальные белки расположены в различных внутриклеточных компартментах, а некоторые, такие как белки STAT, перемещаются между компартментами (например, между цитоплазмой и ядром). Следует отметить, что фосфорилированные и общие STAT1 используют буфер лизиса 1, поскольку они не могут быть хорошо обнаружены с помощью лизисного буфера 2, используемого для других белков STAT. Напротив, другие однородные методы полагаются на единый «универсальный» буфер лизиса, который генерирует более сложный образец, который может создавать неспецифические взаимодействия с антителами. Однако использование различных буферов лизиса может препятствовать анализу нескольких сигнальных белков из одного образца лизата. Тем не менее, все еще можно тестировать лизаты, генерируемые различными буферами лизиса одновременно на одной пластине для анализа параллельных путей.
В заключение, методы, представленные здесь на основе этой однородной платформы клеточного иммуноанализа TR-FRET, предлагают высокопроизводительную альтернативу для мониторинга передачи сигналов JAK/STAT посредством обнаружения и количественной оценки эндогенных фосфорилированных белков STAT1/3/4/5/6 вместе с общим количеством STAT1/3/5/6 в клеточных лизатах. Эти анализы предоставляют новые инструменты для более всестороннего анализа специфических белков STAT после обработки клеток, а также скрининга и характеристики специфических и селективных модуляторов сигнальных путей JAK / STAT. Учитывая ее простоту, специфичность, чувствительность, воспроизводимость и экономическую эффективность, эта новая платформа для анализа представляет собой привлекательную альтернативу традиционным иммуноанализам, как в академических условиях, так и в промышленных лабораториях для применения HTS.
Раскрытие информации
Конкурирующие интересы: Хайме Падрос, Мирей Карон и Женевьева Шатель являются сотрудниками BioAuxilium Research, которая производит наборы для анализа THUNDER TR-FRET, используемые в этом исследовании. Кроме того, Хайме Падрос и Мирей Карон являются акционерами BioAuxilium Research. Это не меняет соблюдения авторами всех политик JoVE в отношении обмена данными и материалами.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Ссылки
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392(2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94(2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al. HTS assay validation. Assay Guidance Manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены