Method Article
时间分辨Förster共振能量转移测定法,用于测量人细胞中的内源性磷酸化STAT蛋白
摘要
描述了基于时间分辨Förster共振能量转移细胞的测定方案,用于以384孔格式对细胞裂解物中内源性磷酸化信号转导和转录激活子(STAT)1/3/4/5/6蛋白的有效定量进行简单,特异性,灵敏和稳健的定量。
摘要
Janus激酶(JAK)/信号转导器和转录激活子(STAT)信号通路在介导细胞对细胞因子和生长因子的反应中起着至关重要的作用。STAT蛋白被主要由JAKs介导的酪氨酸磷酸化激活。STAT信号通路的异常激活与许多人类疾病有关,特别是癌症和免疫相关疾病。因此,在天然细胞信号传导环境中监测STAT蛋白磷酸化的能力对于学术和药物发现研究都很重要。可用于定量磷酸化STAT蛋白的传统测定形式包括蛋白质印迹和酶联免疫吸附测定(ELISA)。这些异构方法是劳动密集型的,低通量,并且在蛋白质印迹的情况下通常不可靠(特异性)。均质(无洗涤)方法可用,但仍然昂贵。
在这里,提供了详细的实验方案,以384孔的形式对使用新型THUNDER时间分辨Förster共振能量转移(TR-FRET)平台的细胞裂解物中的磷酸化STAT1(Y701),STAT3(Y705),STAT4(Y693),STAT5(Y694 / Y699)和STAT6(Y641)的内源性水平进行测量。细胞检测的工作流程简单、快速,专为高通量筛选 (HTS) 而设计。该测定方案非常灵活,使用低容量样品(15 μL),只需要一个试剂添加步骤,并且可以适应低通量和高通量应用。每个磷酸化-STAT三明治免疫测定均在优化条件下使用已知的激动剂和抑制剂进行验证,并产生预期的药理学和Z'因子值。由于TR-FRET测定是成比例的,不需要洗涤步骤,因此与传统方法相比,它们具有更好的再现性。总之,这套检测方法为细胞处理后对特定的磷酸化STAT蛋白进行更全面的分析以及JAK / STAT信号通路的特异性和选择性调节剂的筛选和表征提供了新的经济高效的工具。
引言
JAK/STAT信号通路在介导细胞对各种细胞因子、干扰素、生长因子和相关分子的反应方面起着关键作用1,2。这些配体与特定细胞表面受体的结合导致JAKs的激活,而JAKs又通过特定酪氨酸残基的磷酸化来激活STAT蛋白。STAT磷酸化导致它们二聚化和易位到细胞核中,在那里它们对受调控靶基因的转录产生影响。STAT 系列由七个成员组成:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b 和 STAT6。这些成员在生理细胞过程的调节中起着复杂而重要的作用,包括增殖,分化,凋亡,血管生成和免疫系统调节。STAT信号通路的异常激活与许多人类疾病有关,特别是癌症和免疫相关疾病3,4。因此,在天然细胞信号传导环境中评估STAT蛋白磷酸化的能力对于学术和药物发现研究都很重要。
迄今为止,用于测量细胞内磷酸化蛋白水平(包括STAT)的常规方法是基于抗体的,包括蛋白质印迹,ELISA和磷流细胞术。这些异构方法劳动密集型、耗时、容易出错、通量低,并且在免疫印迹的情况下通常不可靠(例如,特异性问题)5。相反,均质测定需要较少的实验步骤,使用较小的样品体积,并且适合HTS。市售的基于细胞的五种均质免疫测定平台可用于定量监测细胞裂解物中STAT的JAK依赖性磷酸化:SureFire,HTRF,LANCE,LanthaScreen和Lumit。这些平台中的每一个都有其优点和缺点。
SureFire基于发光氧通道技术,该技术利用包被的供体和受体珠来特异性捕获一对抗体,其中一种是生物素化的。在磷酸化蛋白存在下,两种抗体使供体和受体珠近距离接触,从而产生化学发光信号6。虽然该技术用途广泛且灵敏,但价格昂贵,受培养基中生物素的影响,对环境温度和光线非常敏感,并且需要特殊的读数仪进行检测。HTRF和LANCE均基于TR-FRET技术,该技术利用长寿命发光镧系元素离子络合物(铕或铽螯合物,或铕隐酸盐)作为供体分子,利用远红色荧光团作为受体分子7。当用供体或受体分子标记的两种蛋白质特异性抗体被近距离接触时,发生FRET,导致受体荧光增加和供体荧光降低。这些长寿命荧光信号可以以时间分辨和比例方式进行测量,以减少测定干扰并提高数据质量。TR-FRET的其他优点是它不感光,允许重复读数,并表现出长信号稳定性。虽然TR-FRET由于其多功能性,灵敏度和高鲁棒性而在HTS中广泛实施,但所有基于TR-FRET的商用分析平台都很昂贵,因此无法将其广泛用于学术和小型工业实验室。LanthaScreen测定也使用基于TR-FRET的读数,但依赖于工程化的U2OS细胞系,该细胞系稳定地表达绿色荧光蛋白(GFP)-STAT1融合蛋白与铽标记的磷酸特异性STAT1抗体8。除了在信号蛋白的选择方面受到限制外,这种方法还需要购买昂贵的转染细胞系,从而降低了其适用性并增加了实验伪影的可能性。Lumit是一种通用的生物发光免疫测定平台,利用二抗(抗小鼠和抗兔)化学标记的NanoLuc荧光素酶9的小型和大型NanoBit亚基。两种一抗与靶蛋白的结合使二抗接近,形成产生发光信号的活性酶。虽然发光通常是一种灵敏而可靠的读数,但对两种不同物种中产生的一抗的要求限制了测定设计的选择。此外,在复杂样品基质中使用二抗可能容易受到测定干扰。
因此,仍然需要一种可靠、快速且经济实惠的基于细胞的测定平台,以与HTS兼容的方式测量单个磷酸化和总STAT蛋白。为了满足这一需求,基于增强型TR-FRET技术(THUNDER)开发了一种新的高通量基于细胞的免疫测定平台,旨在能够对细胞裂解物中内源性表达的细胞内蛋白(磷酸化或总)进行简单,灵敏,稳健且经济高效的测量。该技术的优势源于供体/受体FRET对的组合,具有出色的光谱相容性和TR-FRET信号,严格验证的抗体和优化的裂解缓冲液。这些测定被格式化为三明治免疫测定,并使用简单的三步工作流程(图1)。首先处理细胞以调节蛋白质磷酸化,然后用试剂盒中提供的特异性裂解缓冲液裂解。在单个试剂添加和孵育步骤中检测细胞裂解物中的靶磷酸化或总STAT蛋白,并使用一对荧光团标记的抗体检测靶标磷酸化或总STAT蛋白,这些抗体可识别靶蛋白上的不同表位(图2)。一种抗体用铕螯合供体(Eu-Ab1)标记,而第二种抗体用远红色受体荧光团(FR-Ab2)标记。两种标记的抗体与溶液中的蛋白质结合,使两种标记非常接近。在320或340nm处激发供体铕螯合物触发FRET到受体,其在665nm处发出长寿命TR-FRET信号,与细胞裂解物中靶蛋白(磷酸化或总)的浓度成比例。

图1:TR-FRET测定工作流程。 工作流程包括三个步骤:细胞处理、细胞裂解和使用 TR-FRET 进行蛋白质检测。在双板检测方案中,裂解物被转移到白色384孔检测板中,而在单板方案中,所有步骤都在同一个白色384孔检测板(一体式检测方案)中进行。无论使用何种检测方案,蛋白质检测均以相同的总体积(每孔20μL)进行。缩写:TR-FRET = 时间分辨的 Förster 共振能量转移。 请点击此处查看此图的放大版本。

图2:TR-FRET三明治免疫测定原理。 一种抗体用铕螯合物供体(Eu-Ab1)标记,第二种抗体用远红色的小荧光团受体(FR-Ab2)标记。两种标记的抗体特异性地结合细胞裂解物中靶蛋白(磷酸化或总)上的不同表位,使两个荧光团非常接近。在320或340nm处激发供体铕螯合物触发从供体到受体分子的FRET,其反过来在665nm处发射信号。该信号与细胞裂解物中蛋白质的浓度成正比。在没有特异性靶蛋白的情况下,供体和受体荧光团彼此相距太远,无法发生FRET。缩写:FRET = Förster 共振能量转移;TR-FRET = 时间分辨 FRET;抗体=抗体;FR = 远红;Eu - 铕螯合物;P = 磷酸化。 请点击此处查看此图的放大版本。
在这里,提供了详细的方案,用于以384孔格式测量磷酸化STAT1(Y701),STAT3(Y705),STAT4(Y693),STAT5(Y694 / Y699)和STAT6(Y641)的细胞内水平,以及使用THUNDER TR-FRET平台的贴壁或悬浮细胞的细胞裂解物中的总STAT1,STAT3,STAT5和STAT6。这些方案定义了使用双板转移方案或单板一体孔方案进行细胞处理、裂解和基于TR-FRET的靶蛋白检测的步骤。这些基于细胞的测定用于确定JAK / STAT途径的已知激活剂和抑制剂的药理学谱。证明了所选HTS检测的稳健性和适用性。最后,讨论了分析优化的关键实验,以及分析故障排除的建议。
研究方案
1. 细胞培养
- 将细胞维持在加湿的37°C / 5%CO 2 培养箱中,并用补充10%胎牛血清(FBS)(HeLa和A431细胞)或补充15%FBS(U266B1细胞)的DMEM培养。培养细胞直到它们达到70-80%汇合,然后胰蛋白酶消化并传代或用于测定。
注:培养基含有酚红。在进行测定之前,未对任何细胞系进行血清饥饿。
2. 使用贴壁细胞的两板测定方案进行刺激剂或抑制剂滴定
注意:该过程描述了如何通过从测试化合物的稀释系列生成浓度 - 响应曲线来确定刺激剂或抑制剂效力。
- 细胞接种
- 将50μL细胞以预先优化的密度(STAT3和STAT6为40,000个HeLa细胞/孔;STAT5为75,000个A431细胞/孔)分配到适当培养基中的96孔组织培养处理板中。在37°C / 5%CO 2下孵育过夜。
注意:需要确定最佳细胞密度和培养时间。
- 将50μL细胞以预先优化的密度(STAT3和STAT6为40,000个HeLa细胞/孔;STAT5为75,000个A431细胞/孔)分配到适当培养基中的96孔组织培养处理板中。在37°C / 5%CO 2下孵育过夜。
- 测试化合物的稀释
- 通过将聚丙烯96孔板的12孔连续稀释化合物(半对数间隔稀释)到无血清培养基中,制备中间的2x稀释系列测试化合物。
注意:建议进行至少重复的12点半对数区间浓度 - 响应曲线,以准确估计EC50 或IC50。 - 或者,对于疏水性二甲基亚砜(DMSO)可溶性测试化合物,在100%DMSO中进行初始稀释,然后将化合物稀释系列稀释到无血清培养基中。
注:在DMSO载体中进行测试化合物滴定之前,必须建立对DMSO的分析耐受性。重要的是在处理和未处理的细胞之间保持相等的溶剂浓度。此外,在测试化合物的连续稀释时,溶剂浓度应始终在整个稀释系列中保持恒定。
- 通过将聚丙烯96孔板的12孔连续稀释化合物(半对数间隔稀释)到无血清培养基中,制备中间的2x稀释系列测试化合物。
- 细胞处理
- 对于细胞刺激,单独加入50μL无血清培养基(未处理的细胞)或含有刺激剂(2x)。
- 在室温(RT)或37°C(STAT3的室温下干扰素(IFN)α2b / 20分钟;STAT5的表皮生长因子(EGF)/ 10分钟的室温下孵育预优化时间;STAT6的室温下白细胞介素(IL)-4/20分钟)。然后继续执行第 2.4 节。
注:需要确定最佳孵育温度。 - 对于细胞抑制,单独加入25μL无血清培养基(未处理的细胞)或含有抑制剂(4x)。
- 在室温或37°C下孵育预优化时间(STAT3和STAT6在室温下JAK抑制剂1/30分钟;厄洛替尼/15分钟在室温下用于STAT5)。
- 单独加入25μL无血清培养基(未处理的细胞)或含有刺激剂(4x)的EC80。
- 在室温或37°C下孵育预优化时间(与步骤2.3.2相同的条件)。
- 细胞裂解
- 按照制造商的指示准备试剂盒的特定1x补充裂解缓冲液。
注意:必须用稀释至1x终浓度为1x的100x磷酸酶抑制剂鸡尾酒补充1x裂解缓冲液。1x补充裂解缓冲液含有1mM氟化钠,2mM正钒酸钠和2mMβ-甘油磷酸盐。其他磷酸酶抑制剂不是必需的,应避免使用。不建议使用试剂盒中未包含的裂解缓冲液和磷酸酶抑制剂,因为它们可能含有可能干扰测量的成分。 - 通过吸出上清液小心地取出并丢弃细胞培养基。
- 立即加入50μL1x补充裂解缓冲液。
注:裂解缓冲液体积(25-50 μL)可以优化。 - 在室温下振荡孵育30分钟(轨道板振荡器设置为400rpm;适度搅拌)。
注意:裂解孵育时间(30-60分钟)可以优化。裂解物可立即用于靶蛋白检测或在-80°C下冷冻。
- 按照制造商的指示准备试剂盒的特定1x补充裂解缓冲液。
- TR-FRET 检测
- 按照制造商的指示,在1x检测缓冲液中准备4x抗体检测混合物。
- 在该转移步骤中,小心地将15μL细胞裂解物从96孔培养板移液到白色,低容量384孔微孔板的孔中。
- 加入15μL阳性对照裂解物和15μL1x裂解缓冲液(阴性对照)以分离测定孔。
- 将5μL4x抗体检测混合物(Eu-Ab1 / FR-Ab2用于检测磷酸化蛋白或Eu-Ab3 / FR-Ab4用于检测总蛋白)加入每个测定孔中。
- 用板封口剂盖住板,并在室温下孵育1小时至过夜,具体取决于测定(参见相应的技术数据表)。
注意:需要针对每种检测方法和细胞系优化最佳读取时间。板可以多次读取,而不会对测定性能产生负面影响。 - 取出粘合板封口机,并在TR-FRET兼容的酶标仪上读取板。
注:建议使用基于滤光片的荧光计,但也可以使用一些单色仪仪器。验证是否安装了用于TR-FRET的相应光学模块(滤波器和反射镜)。使用320或340nm的激发波长来激发铕螯合物。读取615 nm(或620 nm)和665 nm的测定,以分别检测供体铕和受体荧光团的发射。仪器设置将取决于特定的读取器。此处提供的数据是使用基于灯的激励、90 μs 延迟、300 μs 积分时间和每孔 100 次闪光获得的。然而,使用激光激发读取磷酸化-STAT4测定,以产生更高的信底比(S / B)。
3. 使用双板测定方案与悬浮细胞进行刺激剂或抑制剂滴定
- 测试化合物的稀释
- 按照步骤2.2.1和2.2.2中所述制备中间的2x稀释系列测试化合物。
- 细胞接种和处理
- 将20μL细胞以预先优化的密度(200,000 U266B1细胞/孔用于STAT1;400,000 U266B1细胞/孔用于STAT4)分配到适当培养基中的96孔组织培养处理板中。直接进行细胞处理或在37°C,5%CO 2下孵育2-4小时。
注意:此步骤需要针对不同的单元格类型进行优化。 - 对于细胞刺激,单独加入20μL无血清培养基(未处理的细胞)或含有刺激物(2x)。
- 在室温或37°C下孵育预优化时间(STAT1在室温下IFNα2b / 15分钟;IFNα2b / 25分钟在37°C下用于STAT4)。然后继续执行第 3.3 节。
注:需要确定最佳孵育温度。 - 对于细胞抑制,单独加入10μL无血清培养基(未处理的细胞)或含有抑制剂(4x)。
- 在室温或37°C下孵育预优化时间(STAT1和STAT4在室温下JAK抑制剂1/30分钟)。
- 在其EC80中单独加入10μL无血清培养基(未处理的细胞)或含有刺激剂(4x)。
- 在室温或37°C下孵育预优化时间(与步骤3.2.3的条件相同)。
- 将20μL细胞以预先优化的密度(200,000 U266B1细胞/孔用于STAT1;400,000 U266B1细胞/孔用于STAT4)分配到适当培养基中的96孔组织培养处理板中。直接进行细胞处理或在37°C,5%CO 2下孵育2-4小时。
- 细胞裂解
- 按照制造商的指示准备试剂盒的特定5x补充裂解缓冲液。
注意:必须用稀释至5x终浓度的100x磷酸酶抑制剂鸡尾酒补充5x裂解缓冲液。5x补充裂解缓冲液含有5mM氟化钠,10mM正钒酸钠和10mMβ-甘油磷酸盐。其他磷酸酶抑制剂不是必需的,应避免使用。 - 加入10μL5x补充裂解缓冲液。
- 在室温下振荡孵育30分钟(轨道板振荡器设置为400rpm;适度搅拌)。
注意:裂解孵育时间(30-60分钟)可以优化。裂解物可立即用于靶蛋白检测或在-80°C下冷冻。
- 按照制造商的指示准备试剂盒的特定5x补充裂解缓冲液。
- TR-FRET 检测
- 细胞裂解后,对贴壁细胞的2-板测定方案进行TR-FRET检测步骤,如第2.5节所述。
4. 使用单板测定方案对贴壁或悬浮细胞进行刺激滴定
- 测试化合物的稀释
- 通过将聚丙烯96孔板的12孔连续稀释化合物(半对数间隔稀释)到无血清培养基中,以3倍的速度制备中间稀释系列测试化合物。
- 细胞接种和处理
- 在适当的无血清培养基中以预先优化的密度(STAT4为160,000 U266B1细胞/孔;STAT6为80,000个HeLa细胞/孔)分配8μL细胞,放入白色,低容量384well测定板中。直接进行细胞处理或在37°C,5%CO 2下孵育2-4小时。
注意:需要针对不同的细胞类型确定处理前细胞培养孵育期的要求。 - 对于细胞刺激,单独加入4μL无血清培养基(未处理的细胞)或含有刺激物(3x)。
- 在室温或37°C下孵育预优化时间(STAT4在37°C下为IFNα2b / 25分钟;IL-4/20分钟在37°C下用于STAT6)。然后继续执行第 4.3 节。
- 在适当的无血清培养基中以预先优化的密度(STAT4为160,000 U266B1细胞/孔;STAT6为80,000个HeLa细胞/孔)分配8μL细胞,放入白色,低容量384well测定板中。直接进行细胞处理或在37°C,5%CO 2下孵育2-4小时。
- 细胞裂解
- 按照制造商的指示准备试剂盒的特定5x补充裂解缓冲液。
注意:必须用稀释至5x终浓度的100x磷酸酶抑制剂鸡尾酒补充5x裂解缓冲液。 - 加入3μL5x补充裂解缓冲液。
- 在室温下振荡(轨道板振荡器以400rpm)孵育30分钟。
注意:裂解孵育时间(30-60分钟)可以优化。裂解物可以立即使用或在80°C下冷冻。
- 按照制造商的指示准备试剂盒的特定5x补充裂解缓冲液。
- TR-FRET 检测
- 加入15μL阳性对照裂解物(未稀释)和15μL1x补充裂解缓冲液(阴性对照)以分离测定孔。
- 将5μL在1x检测缓冲液中制备的4x抗体检测混合物(Eu-Ab1 / FR-Ab2用于磷酸蛋白或Eu-Ab3-/ FR-Ab4用于总蛋白)加入每个测定孔中。
- 用板封口剂盖住板,并在室温下孵育1小时至过夜,具体取决于测定结果。
注意:需要针对每种检测方法和细胞系优化最佳读取时间。板可以多次读取,而不会对测定性能产生负面影响。 - 取下粘合板密封剂。在TR-FRET兼容的酶标仪上读取板。
5. 数据分析
- 使用以下公式(1)计算每口井的TR-FRET比率:
 (1)
(1)
注意:由于TR-FRET信号是在时间分辨模式下读取的,因此通常不需要背景减法。如果进行背景减法,使用含有1x补充裂解缓冲液(阴对照)的无细胞孔进行背景减法。从无细胞孔中确定平均TR-FRET比值,然后从每个孔的TR-FRET比率中减去该值。 - 对于浓度-响应曲线,使用 4 参数逻辑方程(具有可变斜率的西格莫剂量-响应曲线)和 1/Y2 数据加权,根据非线性回归分析数据,以生成 EC50 或 IC50 值。
- 对于 Z' 因子实验,请根据以下公式 (2)10 分析数据
 (二)
(二)
其中μ和σ分别是阳性对照(p;刺激细胞)和阴性对照(n;未处理细胞)的平均值和标准偏差。
结果
每个THUNDER TR-FRET测定都通过用JAK / STAT途径特异性激活剂或抑制剂处理贴壁细胞(HeLa或A431)或悬浮细胞(U266B1),然后在适用的情况下测量特异性磷酸化和总STAT的水平进行药理学验证。使用双板转移方案和预优化的测定条件以384孔格式进行测定。 图3, 图4, 图5, 图6和 图7 总结了所有STAT测定获得的代表性浓度 - 响应曲线。总体而言,磷酸-STAT测定的所有刺激器和抑制剂浓度-响应曲线均显示出鲁棒的TR-FRET信号、宽动态范围、低孔间变异系数(通常为≤5%)和可接受的S/B比。此处报告的 EC50 和 IC50 值在预期值范围内。
使用JAK激活剂IFNα2b(磷酸-STAT1,磷酸-STAT3和磷酸-STAT4),IL-4(磷酸-STAT6)和EGF(磷酸-STAT5)处理细胞显示,在特定的酪氨酸残基处,STAT磷酸化的预期浓度依赖性增加,而相应的总STAT蛋白(STAT1,STAT3,STAT5和STAT6)保持稳定(图3,图4,图5,图6和图7,面板 A)。随着STAT5磷酸化的增加,总STAT5观察到的信号降低(小于20%)是预期的,并且是由于空间位阻,其中STAT5的磷酸化阻碍了两种抗总STAT5抗体之一与其各自抗原的结合。IFNα2b和IL-4的EC50值在亚纳摩尔范围内(0.083至0.47 nM),EGF(12 nM)的低纳摩尔范围。这些值与已发布的数据一致6,11。
为了确认由激活剂诱导的信号是由内源性受体的激活介导的,在使用STAT激活剂进行亚最大刺激(EC80)之前,用增加浓度的JAK抑制剂1(泛JAK抑制剂)或厄洛替尼(EGFR酪氨酸激酶抑制剂)对细胞进行预处理。正如预期的那样,JAK抑制剂1和厄洛替尼都以浓度依赖性的方式抑制了相应的磷酸-STAT水平,IC50 值介于JAK抑制剂1的低纳摩尔和高纳摩尔范围(29-759 nM)以及厄洛替尼的低纳摩尔范围(10 nM)之间(图3, 图4, 图5, 图6和 图7, 小组B)。IC50 值与公布的数据一致11,12,13。与刺激实验的情况一样,相应的总STAT水平不受任何一种治疗的影响。综上所述,这些结果证明了每种测定对其内源性靶标STAT蛋白(磷酸化或总)的特异性,以及它们分析表现出一系列效力的激活剂或抑制剂的能力。
在没有转移步骤的384孔板的单孔中进行整个工作流程(细胞处理,裂解和蛋白质检测)的测定更适合HTS。因此,使用单板方案进行磷酸-STAT4和磷酸-STAT6测定。 图8 和 图9总结了在优化条件下获得的代表性数据。通过悬浮细胞系中的IFNα2b刺激任一磷酸化的STAT4(U266B1; 图 8)或通过IL-4在贴壁细胞系(HeLa; 图 9)以可接受的S / B比和EC50值获得与使用两板方案获得的S / B比和EC50 值一致。这些数据表明,磷酸化-STAT测定可以成功地从双板转移方案调整为单板多孔方案。
Z'因子在 HTS 社区中通常用于评估 HTS10 检测的适用性和稳健性。为了进一步验证磷酸-STAT测定,使用双板方案手动进行了初步的Z'因子研究。为了评估测定稳定性,在4小时孵育和过夜孵育后读取板。分别使用悬浮细胞系(U266B1)或贴壁细胞系(HeLa)的磷酸化-STAT1和磷酸-STAT3测定获得的结果总结在 图10中。磷酸化-STAT1的计算Z′因子值为0.85,磷酸化-STAT3为0.79。在过夜孵育后,Z'因子值保持稳定(磷酸-STAT1为0.83,磷酸化-STAT3为0.78)。其他磷酸-STAT测定获得了相似的Z'因子值(STAT4:0.79;统计5: 0.78;统计6:0.63)。Z'因子≥0.40的基于细胞的测定被认为适用于HTS15。因此,这些结果表明了这些磷酸-STAT测定在HTS应用中的稳健性。

图3:U266B1电池中磷酸化STAT1(Y701)调制的检测。 接种在96孔培养板中的细胞(200,000个细胞/孔)在室温下用增加浓度的(A)IFNα2b处理15分钟或(B)JAK抑制剂1在室温下处理30分钟,然后在室温下用1nM(EC80)IFNα2b处理15分钟。裂解后,将裂解物转移到低容量的384孔白板中,然后加入抗体检测混合物。将板在室温下孵育4小时,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IFN = 干扰素;室温 = 室温;JAK = Janus 激酶;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图4:HeLa细胞中磷酸-STAT3(Y705)和总STAT3调制的检测。 在96孔培养板中培养过夜的细胞(40,000个细胞/孔)在室温下用增加浓度的(A)IFNα2b处理20分钟或(B)JAK抑制剂1在室温下30分钟,然后在室温下用1.5nM的IFNα2b处理20分钟。在培养基去除和裂解之后,将裂解物转移到低容量的384孔白板中,然后加入抗体检测混合物。将板在室温下孵育4小时,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IFN = 干扰素;室温 = 室温;JAK = Janus 激酶;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图5:U266B1电池中磷酸-STAT4(Y693)调制的检测。 在96孔培养板中接种的细胞(400,000个细胞/孔)在37°C下用增加浓度的(A)IFNα2b处理25分钟或(B)JAK抑制剂1在室温下30分钟,然后在37°C下用1nM的IFNα2b处理25分钟。 在培养基去除和裂解之后,将裂解物转移到低容量的384孔白板中,然后加入抗体检测混合物。将板在室温下孵育过夜,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IFN = 干扰素;室温 = 室温;JAK = Janus 激酶;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图6:A431电池中磷酸化STAT5(Y694 / Y699)和总STAT5调制的检测。 在96孔培养板中培养过夜的细胞(75,000个细胞/孔)在室温下用增加浓度的(A)EGF处理10分钟或(B)埃罗替尼在室温下处理15分钟,然后在室温下用73nM的EGF处理10分钟。在培养基去除和裂解之后,将裂解物转移到低容量的384孔白板中,然后加入抗体检测混合物。将板在室温下孵育过夜,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;EGF =表皮生长因子;室温 = 室温;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。
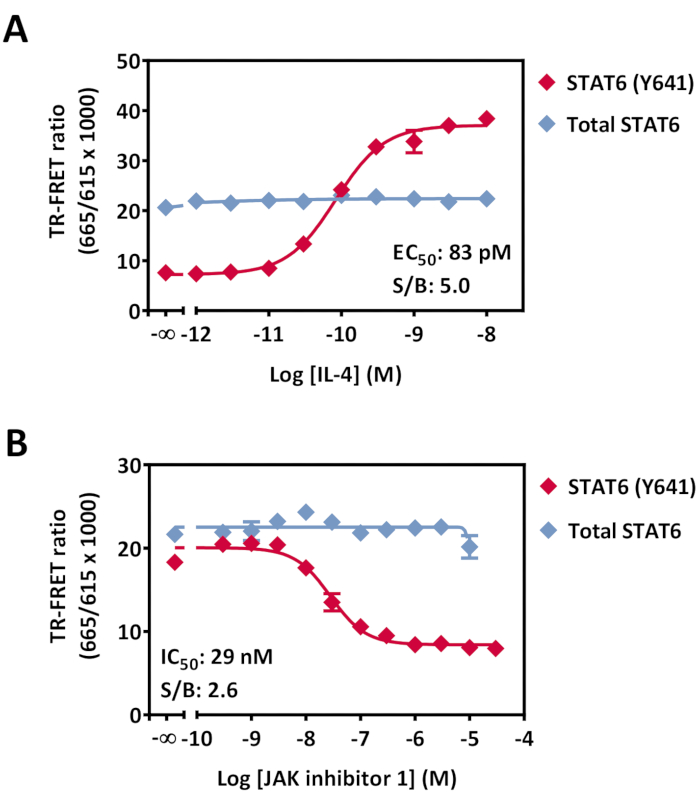
图7:HeLa细胞中磷酸化-STAT6(Y641)和总STAT6调制的检测。 在96孔培养板中培养过夜的细胞(40,000个细胞/孔)在室温下用增加浓度的(A)IL-4处理20分钟或(B)JAK抑制剂1在室温下30分钟,然后在室温下用0.5nM的IL4处理20分钟。在培养基去除和裂解之后,将裂解物转移到低容量的384孔白板中,然后加入抗体检测混合物。将板在室温下孵育4小时,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IL = 白细胞介素;JAK = Janus 激酶;室温 = 室温;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图8:使用单板方案检测U266B1细胞中的磷酸-STAT4(Y693)刺激。 在低容量384孔白板中接种的细胞(160,000个细胞/孔)立即在37°C下用增加浓度的IFNα2b处理25分钟。 裂解后,将抗体检测混合物直接添加到裂解物中。将板在室温下孵育过夜,然后使用闪光灯或激光激发在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IFN = 干扰素;室温 = 室温;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图9:使用单板方案检测HeLa细胞中的磷酸-STAT6(Y641)刺激。 在低容量384孔白板中接种的细胞(80,000个细胞/孔)立即在室温下用增加浓度的IL-4处理20分钟。裂解后,将抗体检测混合物直接添加到裂解物中。将板在室温下孵育4小时,然后在TR-FRET兼容的阅读器上读取。数据显示为每个测定点一式三份的孔的平均值。误差线表示标准偏差。某些误差线小于符号大小。缩写:STAT = 转录的信号传感器和激活器;IL = 白细胞介素;室温 = 室温;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/B = 信号/背景比。 请点击此处查看此图的放大版本。

图10:磷酸化STAT1(Y701)和磷酸-STAT3(Y705)测定的板内变异性研究。 (A)磷酸化-STAT1测定:悬浮细胞(200,000 U266B1细胞/孔)用10nM IFNα2b处理15分钟或仅无血清培养基(低对照)。(B)磷酸化-STAT3测定:贴壁细胞(20,000个HeLa细胞/孔)用5nM的IFNα2b处理20分钟或单独使用无血清培养基。对于两种测定,在孵育4小时后读取TR-FRET信号。缩写:STAT = 转录的信号传感器和激活器;IFN = 干扰素;TR-FRET = 时间分辨弗尔斯特共振能量转移;S/ B = 信号/背景比;CV = 变异系数。 请点击此处查看此图的放大版本。
讨论
与传统的磷酸蛋白分析方法(如蛋白质印迹和基于ELISA的方法)相比,THUNDER TR-FRET细胞测定的工作流程简单快捷,使用低容量样品(15μL),专为384孔格式的HTS而设计,并且非常适合自动化。检测方案非常灵活,可轻松适应中通量和高通量应用。可以使用双板转移方案或单-384孔板方案进行测定。在双板转移方案中,将细胞接种,处理和裂解到一个细胞培养板中,然后将裂解物转移到单独的白色检测板(半区域96孔或384孔板)进行分析。在一-384孔板方案中,整个工作流程在同一孔中进行,无需液体转移步骤。通过按比例减小体积,检测可以很容易地适应1536孔格式。无论检测方案如何,只需制备三种试剂溶液,无需洗涤步骤,并且检测可以按照"仅添加"方案运行,需要最少的手动操作时间。
执行任何基于细胞的测定的关键步骤是优化细胞培养和处理条件16。在运行测定之前,细胞数量和处理条件都需要仔细优化,因为这些关键参数通常因每个细胞系和每个磷酸蛋白而异。这些参数的优化允许最大化分析窗口,获得具有高S / B比和低孔间变异系数的最佳性能,并确保结果的稳健性和重现性。应针对每种细胞系和靶蛋白优化细胞数量、血清饥饿(适当时)以及刺激或抑制时间(室温或 37 °C)。太高或太低的细胞数会对细胞内信号通路的调节产生负面影响。对于大多数细胞系,贴壁细胞的细胞接种密度为40,000-80,000个细胞/孔,悬浮细胞的细胞接种密度为100,000-200,000个细胞/孔通常是可以接受的。值得注意的是,刺激和抑制的最佳时间长度在细胞系和靶蛋白之间可能差异很大,从几分钟到几小时不等。因此,强烈建议进行时间过程研究以确定最佳刺激和抑制孵育时间,理想情况下在室温和37°C下,因为孵育温度会影响目标蛋白刺激的动力学。
对基于细胞的检测进行故障排除可能既困难又耗时,因为工作流程中涉及许多步骤(细胞培养、细胞处理、裂解和蛋白质检测)。这些测定试剂盒包括阳性对照裂解物。建议在每次实验中使用这些阳性对照裂解物和阴性对照(单独补充1x裂解缓冲液)。使用适当的对照有助于故障排除,因为问题可以快速归因于检测步骤(不正确的试剂制备和/或测定执行)或实验中使用的裂解物的质量。后者通常是由于使用次优的细胞条件。
该平台的另一个优点是可以使用一套具有不同强度的优化裂解缓冲液。这允许从部分亚细胞分馏中产生或多或少的异质性裂解物。这是有用的,因为信号蛋白位于各种细胞内区室中,并且有些,如STAT蛋白,在区室之间穿梭(例如,在细胞质和细胞核之间)。值得注意的是,磷酸化和总STAT1使用裂解缓冲液1,因为它们不能用用于其他STAT蛋白的裂解缓冲液2很好地检测。相比之下,其他均相方法依赖于单个"通用"裂解缓冲液,该缓冲液产生更复杂的样品,可以与抗体产生非特异性相互作用。然而,使用不同的裂解缓冲液可能排除从单个裂解物样品中分析多种信号蛋白。尽管如此,仍然可以在单个板上同时测试使用不同裂解缓冲液生成的裂解物,以进行平行通路分析。
总之,这里介绍的基于这种均质TR-FRET细胞免疫测定平台的方法为通过检测和定量细胞裂解物中的内源性磷酸化STAT1/3/4/5/6蛋白以及总STAT1/3/5/6来监测JAK/STAT信号传导提供了一种高通量替代方案。这些测定为在细胞处理后对特定STAT蛋白进行更全面的分析以及JAK / STAT信号通路的特异性和选择性调节剂的筛选和表征提供了新的工具。鉴于其简单性、特异性、灵敏度、可重复性和成本效益,这种新的检测平台代表了传统免疫检测的有吸引力的替代方案,无论是在学术环境中还是在HTS应用的工业实验室中。
披露声明
竞争利益:Jaime Padros,Mireille Caron和Geneviève Chatel是BioAuxilium Research的员工,该公司生产本研究中使用的THUNDER TR-FRET检测试剂盒。此外,Jaime Padros和Mireille Caron是BioAuxilium Research的股东。这不会改变作者对JoVE共享数据和材料的所有政策的遵守情况。
致谢
没有。
材料
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
参考文献
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392(2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94(2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al. HTS assay validation. Assay Guidance Manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029(2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。