Method Article
Zeitaufgelöste Förster-Resonanz-Energietransfer-Assays zur Messung von endogenen phosphorylierten STAT-Proteinen in menschlichen Zellen
In diesem Artikel
Zusammenfassung
Zeitaufgelöste Förster-Resonanzenergietransfer-Zell-basierte Assay-Protokolle werden für die einfache, spezifische, sensitive und robuste Quantifizierung von endogenen phosphorylierten Signalwandlern und Aktivatoren der Transkription (STAT) 1/3/4/5/6-Proteinen in Zelllysaten im 384-Well-Format beschrieben.
Zusammenfassung
Der Signalweg Januskinase (JAK)/Signalwandler und Aktivator der Transkription (STAT) spielt eine entscheidende Rolle bei der Vermittlung zellulärer Reaktionen auf Zytokine und Wachstumsfaktoren. STAT-Proteine werden durch Tyrosinphosphorylierung aktiviert, die hauptsächlich durch JAKs vermittelt wird. Die abnormale Aktivierung von STAT-Signalwegen ist an vielen menschlichen Krankheiten beteiligt, insbesondere an Krebs und immunbedingten Erkrankungen. Daher ist die Fähigkeit, die Phosphorylierung von STAT-Proteinen innerhalb der nativen Zellsignalumgebung zu überwachen, sowohl für die akademische als auch für die Arzneimittelforschung wichtig. Zu den traditionellen Assay-Formaten, die zur Quantifizierung phosphorylierter STAT-Proteine zur Verfügung stehen, gehören Western Blotting und der Enzyme-linked Immunosorbent Assay (ELISA). Diese heterogenen Methoden sind arbeitsintensiv, mit geringem Durchsatz und im Falle von Western Blotting oft nicht zuverlässig (spezifisch). Homogene (no-wash) Methoden sind verfügbar, bleiben aber teuer.
Hier werden detaillierte Protokolle für die sensitive, robuste und kostengünstige Messung in einem 384-Well-Format von endogenen Konzentrationen von phosphoryliertem STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) und STAT6 (Y641) in Zelllysaten aus adhärenten oder Suspensionszellen unter Verwendung der neuartigen THUNDER zeitaufgelösten Förster-Resonanzenergietransferplattform (TR-FRET) bereitgestellt. Der Workflow für den zellulären Assay ist einfach, schnell und für das Hochdurchsatz-Screening (HTS) ausgelegt. Das Assay-Protokoll ist flexibel, verwendet eine Probe mit geringem Volumen (15 μL), erfordert nur einen Reagenzzugabeschritt und kann an Anwendungen mit niedrigem Durchsatz und hohem Durchsatz angepasst werden. Jeder Phospho-STAT-Sandwich-Immunoassay wird unter optimierten Bedingungen mit bekannten Agonisten und Inhibitoren validiert und generiert die erwarteten pharmakologischen und Z'-Faktor-Werte. Da TR-FRET-Assays ratiometrisch sind und keine Waschschritte erfordern, bieten sie eine viel bessere Reproduzierbarkeit als herkömmliche Ansätze. Zusammen bietet diese Suite von Assays neue kostengünstige Werkzeuge für eine umfassendere Analyse spezifischer phosphorylierter STAT-Proteine nach der Zellbehandlung und das Screening und die Charakterisierung spezifischer und selektiver Modulatoren des JAK/STAT-Signalwegs.
Einleitung
Der JAK/STAT-Signalweg spielt eine Schlüsselrolle bei der Vermittlung zellulärer Reaktionen auf verschiedene Zytokine, Interferone, Wachstumsfaktoren und verwandte Moleküle1,2. Die Bindung dieser Liganden an spezifische Zelloberflächenrezeptoren führt zur Aktivierung von JAKs, die wiederum STAT-Proteine durch Phosphorylierung spezifischer Tyrosinreste aktivieren. Die STAT-Phosphorylierung führt zu ihrer Dimerisierung und Translokation in den Zellkern, wo sie ihre Wirkung auf die Transkription regulierter Zielgene ausüben. Die STAT-Familie besteht aus sieben Mitgliedern: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b und STAT6. Die Mitglieder spielen eine komplexe und wesentliche Rolle bei der Regulation physiologischer Zellprozesse, einschließlich Proliferation, Differenzierung, Apoptose, Angiogenese und Regulation des Immunsystems. Die abnormale Aktivierung von STAT-Signalwegen ist an vielen menschlichen Krankheiten beteiligt, insbesondere an Krebs und immunbedingten Erkrankungen3,4. Daher ist die Fähigkeit, die Phosphorylierung von STAT-Proteinen in der nativen Zellsignalumgebung zu bewerten, sowohl für die akademische als auch für die Wirkstoffforschung wichtig.
Bis heute sind die konventionellen Methoden zur Messung des intrazellulären phosphorylierten Proteinspiegels, einschließlich STATs, Antikörper-basiert und umfassen Western Blotting, ELISA und Phosphoflow-Zytometrie. Diese heterogenen Methoden sind arbeitsintensiv, zeitaufwendig, fehleranfällig, mit geringem Durchsatz und im Falle von Western Blotting oft unzuverlässig (z. B. Spezifitätsprobleme). Im Gegensatz dazu erfordern homogene Assays weniger experimentelle Schritte, verwenden kleinere Probenvolumina und sind für HTS zugänglich. Es gibt fünf homogene zellbasierte Immunoassay-Plattformen, die kommerziell verfügbar sind und zur quantitativen Überwachung der JAK-abhängigen Phosphorylierung von STATs in Zelllysaten verwendet werden können: SureFire, HTRF, LANCE, LanthaScreen und Lumit. Jede dieser Plattformen hat ihre Vor- und Nachteile.
SureFire basiert auf der lumineszierenden Sauerstoffkanalisierungstechnologie, die Spender- und Akzeptorperlen verwendet, die beschichtet sind, um speziell ein Paar Antikörper einzufangen, von denen einer biotinyliert ist. In Gegenwart von phosphoryliertem Protein bringen die beiden Antikörper die Spender- und Akzeptorkügelchen in die Nähe und ermöglichen so die Erzeugung eines chemilumineszenten Signals6. Obwohl vielseitig und empfindlich, ist diese Technologie teuer, wird von Biotin im Kulturmedium beeinflusst, ist sehr empfindlich gegenüber Umgebungstemperatur und Licht und erfordert ein spezielles Lesegerät zur Detektion. HTRF und LANCE basieren beide auf der TR-FRET-Technologie, die langlebige lumineszierende Lanthanid-Ionenkomplexe (Europium- oder Terbiumchelate oder Europium-Kryptonat) als Donormoleküle und fernrote Fluorophore als Akzeptormoleküle verwendet7. Wenn zwei proteinspezifische Antikörper, die entweder mit Spender- oder Akzeptormolekülen markiert sind, in die Nähe gebracht werden, findet FRET statt, was zu einer Erhöhung der Akzeptorfluoreszenz und einer Abnahme der Spenderfluoreszenz führt. Diese langlebigen fluoreszierenden Signale können zeitaufgelöst und ratiometrisch gemessen werden, um Assay-Interferenzen zu reduzieren und die Datenqualität zu erhöhen. Weitere Vorteile von TR-FRET sind, dass es nicht lichtempfindlich ist, wiederholte Messwerte ermöglicht und eine lange Signalstabilität aufweist. Während TR-FRET aufgrund seiner Vielseitigkeit, Empfindlichkeit und hohen Robustheit in HTS weit verbreitet ist, sind alle kommerziellen TR-FRET-basierten Assay-Plattformen teuer, wodurch eine breite Akzeptanz in akademischen und kleinen Industrielabors ausgeschlossen wird. Der LanthaScreen-Assay verwendet ebenfalls eine TR-FRET-basierte Auslesung, ist jedoch auf eine entwickelte U2OS-Zelllinie angewiesen, die stabil grün fluoreszierendes Protein (GFP)-STAT1 in Kombination mit einem terbiummarkierten Phospho-spezifischen STAT1-Antikörper exprimiert8. Diese Methode ist nicht nur in Bezug auf die Auswahl an Signalproteinen begrenzt, sondern erfordert auch den Kauf teurer transfizierter Zelllinien, wodurch ihre Anwendbarkeit verringert und die Möglichkeit experimenteller Artefakte erhöht wird. Lumit ist eine generische biolumineszente Immunoassay-Plattform, die sekundäre Antikörper (Anti-Maus und Anti-Kaninchen) verwendet, die chemisch mit den kleinen und großen NanoBit-Untereinheiten von NanoLuc Luciferase9 markiert sind. Die Bindung von zwei primären Antikörpern an das Zielprotein bringt die sekundären Antikörper in die Nähe, um ein aktives Enzym zu bilden, das ein Lumineszenzsignal erzeugt. Während die Lumineszenz im Allgemeinen eine empfindliche und robuste Anzeige ist, schränkt der Bedarf an primären Antikörpern, die in zwei verschiedenen Spezies erhoben werden, die Auswahl für das Assay-Design ein. Darüber hinaus kann die Verwendung von Sekundärantikörpern in komplexen Probenmatrizen anfällig für Assay-Interferenzen sein.
Daher besteht nach wie vor ein Bedarf an einer zuverlässigen, schnellen und dennoch erschwinglichen zellbasierten Assay-Plattform zur Messung einzelner phosphorylierter und totaler STAT-Proteine in einer mit HTS kompatiblen Weise. Um diesem Bedarf gerecht zu werden, wurde eine neue zellbasierte Hochdurchsatz-Immunoassay-Plattform entwickelt, die auf einer verbesserten TR-FRET-Technologie (THUNDER) basiert und eine einfache, empfindliche, robuste und kostengünstige Messung von endogen exprimierten intrazellulären Proteinen (phosphoryliert oder vollständig) in Zelllysaten ermöglicht. Die Vorteile dieser Technologie ergeben sich aus der Kombination eines Donor/Akzeptor-FRET-Paares mit außergewöhnlicher spektraler Kompatibilität und TR-FRET-Signal, streng validierten Antikörpern und optimierten Lysepuffern. Diese Assays sind als Sandwich-Immunoassays formatiert und verwenden einen einfachen, dreistufigen Workflow (Abbildung 1). Die Zellen werden zuerst behandelt, um die Proteinphosphorylierung zu modulieren, und dann mit dem spezifischen Lysepuffer, der im Kit bereitgestellt wird, lysiert. Das phosphorylierte oder gesamte STAT-Protein im Zelllysat wird in einem einzelnen Reagenzzugabe- und Inkubationsschritt mit einem Paar fluorophormarkierter Antikörper nachgewiesen, die unterschiedliche Epitope auf dem Zielprotein erkennen (Abbildung 2). Ein Antikörper ist mit einem Europium-Chelat-Donor (Eu-Ab1) markiert, während der zweite Antikörper mit einem weit roten Akzeptorfluorophor (FR-Ab2) markiert ist. Die beiden markierten Antikörper binden an das Protein in Lösung und bringen die beiden Markierungen in die Nähe. Die Anregung des Spenders Europiumchelat bei 320 oder 340 nm löst einen FRET zum Akzeptor aus, der bei 665 nm ein langlebiges TR-FRET-Signal aussendet, das proportional zur Konzentration des Zielproteins (phosphoryliert oder vollständig) im Zelllysat ist.

Abbildung 1: TR-FRET-Assay-Workflow. Der Workflow besteht aus drei Schritten: Zellbehandlung, Zelllyse und Proteindetektion mit TR-FRET. Beim Zwei-Platten-Assay-Protokoll werden Lysate auf eine weiße 384-Well-Detektionsplatte übertragen, während im One-Plate-Protokoll alle Schritte in derselben weißen 384-Well-Detektionsplatte (All-in-One-Well-Protokoll) durchgeführt werden. Unabhängig vom verwendeten Assay-Protokoll wird der Proteinnachweis im gleichen Gesamtvolumen (20 μL pro Well) durchgeführt. Abkürzung: TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: TR-FRET-Sandwich-Immunoassay-Prinzip. Ein Antikörper ist mit dem Europium-Chelat-Donor (Eu-Ab1) und der zweite mit dem tiefroten kleinen Fluorophor-Akzeptor (FR-Ab2) markiert. Die beiden markierten Antikörper binden spezifisch an unterschiedliche Epitope auf dem Zielprotein (phosphoryliert oder vollständig) im Zelllysat, wodurch die beiden Fluorophore nahe beieinander liegen. Die Anregung des Spender-Europiumchelats bei 320 oder 340 nm löst einen FRET vom Donor zu den Akzeptormolekülen aus, die wiederum ein Signal bei 665 nm aussenden. Dieses Signal ist proportional zur Proteinkonzentration im Zelllysat. In Ermangelung des spezifischen Zielproteins sind die Spender- und Akzeptorfluorophore zu weit voneinander entfernt, als dass FRET auftreten könnte. Abkürzungen: FRET = Förster-Resonanzenergieübertragung; TR-FRET = zeitaufgelöster FRET; Ab = Antikörper; FR = far-red; EU - Europiumchelat; P = Phosphorylierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Hier werden detaillierte Protokolle bereitgestellt, um in einem 384-Well-Format die intrazellulären Spiegel von phosphoryliertem STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) und STAT6 (Y641) zusammen mit Gesamt-STAT1, STAT3, STAT5 und STAT6 in Zelllysaten aus adhärenten oder Suspensionszellen mit der THUNDER TR-FRET-Plattform zu messen. Diese Protokolle definieren Schritte für die Zellbehandlung, Lyse und TR-FRET-basierte Zielproteindetektion unter Verwendung eines Zwei-Platten-Transferprotokolls oder eines Ein-Platten-All-in-One-Well-Protokolls. Diese zellbasierten Assays werden zur Bestimmung des pharmakologischen Profils bekannter Aktivatoren und Inhibitoren des JAK/STAT-Signalwegs eingesetzt. Die Robustheit und Eignung ausgewählter Assays für HTS wird nachgewiesen. Schließlich werden Schlüsselexperimente zur Assay-Optimierung sowie Empfehlungen für die Assay-Fehlerbehebung diskutiert.
Protokoll
1. Zellkultur
- Pflegen Sie die Zellen in einem befeuchteten 37 °C / 5% CO2-Inkubator und in Kultur mit DMEM, das entweder mit 10% fetalem Rinderserum (FBS) (HeLa- und A431-Zellen) oder RPMI mit 15% FBS (U266B1-Zellen) ergänzt wird. Kultivieren Sie die Zellen, bis sie 70-80% Konfluenz erreichen, dann versuchen Sie, sie zu versuchen und zu passieren oder verwenden Sie sie für die Assays.
HINWEIS: Kulturmedien enthielten Phenolrot. Vor der Durchführung der Assays wurde für keine Zelllinie ein Serumhunger durchgeführt.
2. Stimulator- oder Inhibitortitration unter Verwendung des Zwei-Platten-Assay-Protokolls mit adhärenten Zellen
HINWEIS: In diesem Verfahren wird beschrieben, wie die Potenz von Stimulatoren oder Inhibitoren durch Erzeugen einer Konzentrations-Wirkungs-Kurve aus einer Verdünnungsreihe der Testverbindung bestimmt wird.
- Zellaussaat
- Geben Sie 50 μL Zellen in der voroptimierten Dichte (40.000 HeLa-Zellen/Well für STAT3 und STAT6; 75.000 A431-Zellen/Well für STAT5) in eine 96-Well-Gewebekultur-behandelte Platte im entsprechenden Kulturmedium ab. Inkubieren über Nacht bei 37 °C/5% CO2.
HINWEIS: Die optimale Zelldichte und die Inkubationszeit der Kulturen müssen bestimmt werden.
- Geben Sie 50 μL Zellen in der voroptimierten Dichte (40.000 HeLa-Zellen/Well für STAT3 und STAT6; 75.000 A431-Zellen/Well für STAT5) in eine 96-Well-Gewebekultur-behandelte Platte im entsprechenden Kulturmedium ab. Inkubieren über Nacht bei 37 °C/5% CO2.
- Verdünnungen von Prüfpräparaten
- Bereiten Sie eine 2-fache Verdünnungsreihe von Testverbindung(en) vor, indem Sie die Verbindung(en) (Halbprotokollintervallverdünnungen) über 12 Vertiefungen einer Polypropylen-96-Well-Platte in serumfreies Medium verdünnen.
HINWEIS: Es wird empfohlen, eine 12-Punkt-Konzentrations-Wirkungs-Kurve mit halblogigem Intervall in mindestens doppelter Ausführung durchzuführen, um eine genaue Schätzung des EC50 oder IC50 zu ermöglichen. - Alternativ können Sie für hydrophobe, dimethylsulfoxid (DMSO)-lösliche Testverbindungen die anfänglichen Verdünnungen in 100% DMSO durchführen und dann die Verbindungsverdünnungsreihe in serumfreies Medium verdünnen.
HINWEIS: Die Assay-Toleranz gegenüber DMSO muss vor der Durchführung einer Testcompound-Titration im DMSO-Fahrzeug festgelegt werden. Es ist wichtig, die gleichen Lösungsmittelkonzentrationen zwischen behandelten und unbehandelten Zellen beizubehalten. Darüber hinaus sollten bei der Prüfung serieller Verdünnungen von Verbindungen die Lösungsmittelkonzentrationen über die Verdünnungsreihe hinweg immer konstant bleiben.
- Bereiten Sie eine 2-fache Verdünnungsreihe von Testverbindung(en) vor, indem Sie die Verbindung(en) (Halbprotokollintervallverdünnungen) über 12 Vertiefungen einer Polypropylen-96-Well-Platte in serumfreies Medium verdünnen.
- Zellbehandlung
- Zur Zellstimulation 50 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Stimulator (2x) hinzufügen.
- Inkubieren für die voroptimierte Zeit entweder bei Raumtemperatur (RT) oder 37 °C (Interferon (IFN) α2b/20 min bei RT für STAT3; epidermaler Wachstumsfaktor (EGF)/10 min bei RT für STAT5; Interleukin (IL)-4/20 min bei RT für STAT6). Fahren Sie dann mit Abschnitt 2.4 fort.
HINWEIS: Die optimale Inkubationstemperatur muss bestimmt werden. - Zur Zellhemmung 25 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Inhibitor (4x) hinzufügen.
- Inkubieren für die voroptimierte Zeit entweder bei RT oder 37 °C (JAK-Inhibitor 1/30 min bei RT für STAT3 und STAT6; Erlotinib/15 min bei RT für STAT5).
- 25 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Stimulator (4x) an seinem EC80 hinzufügen.
- Inkubieren für die voroptimierte Zeit entweder bei RT oder 37 °C (gleiche Bedingungen wie bei Schritt 2.3.2).
- Zelllyse
- Bereiten Sie den spezifischen 1x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
HINWEIS: Es ist zwingend erforderlich, den 1x Lysis Buffer mit dem 100x Phosphatase Inhibitor Cocktail zu ergänzen, der auf eine Endkonzentration von 1x verdünnt ist. Der 1x Supplemented Lysis Buffer enthält 1 mM Natriumfluorid, 2 mM Natriumorthovanadat und 2 mM Beta-Glycerophosphat. Andere Phosphatase-Hemmer sind nicht erforderlich und sollten vermieden werden. Andere Lysepuffer und Phosphatasehemmer als die im Kit enthaltenen werden nicht empfohlen, da sie Inhaltsstoffe enthalten können, die die Messung beeinträchtigen könnten. - Entfernen und verwerfen Sie das Zellkulturmedium vorsichtig durch Absaugen des Überstands.
- Fügen Sie sofort 50 μL 1x Supplemented Lysis Buffer hinzu.
HINWEIS: Das Lysepuffervolumen (25-50 μL) kann optimiert werden. - Inkubation für 30 min bei RT unter Schütteln (Orbitalplattenschüttler auf 400 U / min eingestellt; mäßiges Rühren).
HINWEIS: Die Lyse-Inkubationszeit (30-60 min) kann optimiert werden. Lysate können sofort für den Zielproteinnachweis verwendet oder bei -80 °C eingefroren werden.
- Bereiten Sie den spezifischen 1x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
- TR-FRET-Erkennung
- Bereiten Sie den 4x Antikörper-Detektionsmix in 1x Detection Buffer vor, wie vom Hersteller angegeben.
- In diesem Transferschritt pipettieren Sie vorsichtig 15 μL Zelllysat von der 96-Well-Kulturplatte in eine Vertiefung einer weißen, 384-Well-Mikroplatte mit geringem Volumen.
- Fügen Sie 15 μL des Positivkontrolllysats und 15 μL 1x Lysepuffer (Negativkontrolle) hinzu, um die Assay-Bohrlöcher zu trennen.
- 5 μL 4x Antikörper-Detektionsmix (entweder Eu-Ab1/FR-Ab2 zum Nachweis des Phospho-Proteins oder Eu-Ab3/FR-Ab4 zum Nachweis des Gesamtproteins) zu jeder der Assay-Vertiefungen hinzufügen.
- Decken Sie die Platte mit einem Plattenversiegeler ab und inkubieren Sie sie je nach Assay für 1 h bis über Nacht bei RT (siehe entsprechendes technisches Datenblatt).
HINWEIS: Die optimale Lesezeit muss für jeden Assay und jede Zelllinie optimiert werden. Die Platte kann mehrfach abgelesen werden, ohne dass sich dies negativ auf die Assay-Leistung auswirkt. - Entfernen Sie den selbstklebenden Plattenversiegeler und lesen Sie die Platte auf einem TR-FRET-kompatiblen Mikroplattenleser.
HINWEIS: Filterbasierte Fluorometer werden empfohlen, obwohl einige Monochromator-Instrumente verwendet werden können. Stellen Sie sicher, dass das entsprechende optische Modul (Filter und Spiegel) für TR-FRET installiert ist. Verwenden Sie eine Anregungswellenlänge von 320 oder 340 nm, um das Europiumchelat anzuregen. Lesen Sie Assays sowohl bei 615 nm (oder 620 nm) als auch bei 665 nm, um sowohl die Emission des Spender-Europiums als auch des Akzeptor-Fluorophors nachzuweisen. Die Geräteeinstellungen hängen vom jeweiligen Lesegerät ab. Die hier vorgestellten Daten wurden unter Verwendung einer lampenbasierten Anregung, einer Verzögerung von 90 μs, einer Integrationszeit von 300 μs und 100 Blitzen pro Vertiefung erhalten. Der Phospho-STAT4-Assay wurde jedoch mittels Laseranregung abgelesen, um höhere Signal-Hintergrund-Verhältnisse (S/B) zu erzeugen.
3. Stimulator- oder Inhibitortitration unter Verwendung des Zwei-Platten-Assay-Protokolls mit Suspensionszellen
- Verdünnung von Prüfpräparaten
- Es werden eine 2-fache Verdünnungsreihe von Prüflingsverbindungen hergestellt, wie in den Schritten 2.2.1 und 2.2.2 beschrieben.
- Zellaussaat und -behandlung
- Geben Sie 20 μL Zellen in der voroptimierten Dichte (200.000 U266B1-Zellen/Well für STAT1; 400.000 U266B1-Zellen/Well für STAT4) in eine 96-Well-Gewebekultur-behandelte Platte im entsprechenden Kulturmedium ab. Fahren Sie direkt mit der Zellbehandlung fort oder inkubieren Sie 2-4 h bei 37 °C, 5% CO2.
HINWEIS: Dieser Schritt muss für verschiedene Zelltypen optimiert werden. - Zur Zellstimulation 20 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Stimulator (2x) hinzufügen.
- Inkubation für die voroptimierte Zeit bei RT oder 37 °C (IFNα2b/15 min bei RT für STAT1; IFNα2b/25 min bei 37 °C für STAT4). Fahren Sie dann mit Abschnitt 3.3 fort.
HINWEIS: Die optimale Inkubationstemperatur muss bestimmt werden. - Zur Zellhemmung 10 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Inhibitor (4x) hinzufügen.
- Inkubieren Sie für die voroptimierte Zeit entweder bei RT oder 37 °C (JAK-Inhibitor 1/30 min bei RT für STAT1 und STAT4).
- 10 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Stimulator (4x) an seinem EC80 hinzufügen.
- Inkubieren für die voroptimierte Zeit entweder bei RT oder 37 °C (gleiche Bedingungen wie für Schritt 3.2.3).
- Geben Sie 20 μL Zellen in der voroptimierten Dichte (200.000 U266B1-Zellen/Well für STAT1; 400.000 U266B1-Zellen/Well für STAT4) in eine 96-Well-Gewebekultur-behandelte Platte im entsprechenden Kulturmedium ab. Fahren Sie direkt mit der Zellbehandlung fort oder inkubieren Sie 2-4 h bei 37 °C, 5% CO2.
- Zelllyse
- Bereiten Sie den spezifischen 5x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
HINWEIS: Es ist zwingend erforderlich, den 5x Lysis Buffer mit dem 100x Phosphatase Inhibitor Cocktail zu ergänzen, der auf eine Endkonzentration von 5x verdünnt ist. Der 5x Supplemented Lysis Buffer enthält 5 mM Natriumfluorid, 10 mM Natriumorthovanadat und 10 mM Beta-Glycerophosphat. Andere Phosphatase-Hemmer sind nicht erforderlich und sollten vermieden werden. - Fügen Sie 10 μL 5x ergänzten Lysepuffer hinzu.
- Inkubation für 30 min bei RT unter Schütteln (Orbitalplattenschüttler auf 400 U / min eingestellt; mäßiges Rühren).
HINWEIS: Die Lyse-Inkubationszeit (30-60 min) kann optimiert werden. Lysate können sofort für den Zielproteinnachweis verwendet oder bei -80 °C eingefroren werden.
- Bereiten Sie den spezifischen 5x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
- TR-FRET-Erkennung
- Nach der Zelllyse ist der TR-FRET-Detektionsschritt wie in Abschnitt 2.5 für das 2-Platten-Assay-Protokoll für adhärente Zellen beschrieben durchzuführen.
4. Stimulatortitration unter Verwendung des Ein-Platten-Assay-Protokolls mit adhärenten oder Suspensionszellen
- Verdünnung von Prüfpräparaten
- Bereiten Sie eine Zwischenverdünnungsreihe von Testverbindungen bei 3x vor, indem Sie die Verbindung (n) (Halbprotokollintervallverdünnungen) über 12 Vertiefungen einer Polypropylen-96-Well-Platte in serumfreies Medium verdünnen.
- Zellaussaat und -behandlung
- Geben Sie 8 μL Zellen in der voroptimierten Dichte (160.000 U266B1-Zellen/Well für STAT4; 80.000 HeLa-Zellen/Well für STAT6) im entsprechenden serumfreien Kulturmedium in eine weiße, kostengünstige 384well-Assay-Platte ab. Fahren Sie direkt mit der Zellbehandlung fort oder inkubieren Sie 2-4 h bei 37 °C, 5% CO2.
HINWEIS: Die Notwendigkeit einer Zellkulturinkubationszeit vor der Behandlung muss für verschiedene Zelltypen bestimmt werden. - Zur Zellstimulation 4 μL serumfreies Medium allein (unbehandelte Zellen) oder mit dem Stimulator (3x) hinzufügen.
- Inkubation für die voroptimierte Zeit entweder bei Raumtemperatur oder 37 °C (IFNα2b/25 min bei 37°C für STAT4; IL-4/20 min bei 37°C für STAT6). Fahren Sie dann mit Abschnitt 4.3 fort.
- Geben Sie 8 μL Zellen in der voroptimierten Dichte (160.000 U266B1-Zellen/Well für STAT4; 80.000 HeLa-Zellen/Well für STAT6) im entsprechenden serumfreien Kulturmedium in eine weiße, kostengünstige 384well-Assay-Platte ab. Fahren Sie direkt mit der Zellbehandlung fort oder inkubieren Sie 2-4 h bei 37 °C, 5% CO2.
- Zelllyse
- Bereiten Sie den spezifischen 5x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
HINWEIS: Es ist zwingend erforderlich, den 5x Lysis Buffer mit dem 100x Phosphatase Inhibitor Cocktail zu ergänzen, der auf eine Endkonzentration von 5x verdünnt ist. - Fügen Sie 3 μL 5x ergänzten Lysepuffer hinzu.
- Inkubation für 30 min bei RT unter Schütteln (Orbitalplattenschüttler bei 400 U / min).
HINWEIS: Die Lyse-Inkubationszeit (30-60 min) kann optimiert werden. Lysate können sofort verwendet oder bei 80 °C eingefroren werden.
- Bereiten Sie den spezifischen 5x Supplemented Lysis Buffer des Kits vor, wie vom Hersteller angegeben.
- TR-FRET-Erkennung
- Fügen Sie 15 μL Positivkontrolllysat (unverdünnt) und 15 μL 1x Supplemented Lysis Buffer (Negative Control) hinzu, um die Assay-Bohrungen zu trennen.
- 5 μL 4x Antikörper-Detektionsmix (entweder Eu-Ab1/FR-Ab2 für das Phospho-Protein oder Eu-Ab3-/FR-Ab4 für das Gesamtprotein) in 1x Detektionspuffer zu jeder der Assay-Bohrungen geben.
- Decken Sie die Platte mit einem Plattenversiegeler ab und inkubieren Sie sie je nach Assay für 1 h bis über Nacht bei RT.
HINWEIS: Die optimale Lesezeit muss für jeden Assay und jede Zelllinie optimiert werden. Die Platte kann mehrfach abgelesen werden, ohne dass sich dies negativ auf die Assay-Leistung auswirkt. - Entfernen Sie die selbstklebende Plattenversiegelung. Lesen Sie die Platte auf einem TR-FRET-kompatiblen Mikroplattenleser.
5. Datenanalyse
- Berechnen Sie das TR-FRET-Verhältnis für jedes Bohrloch mit der folgenden Formel (1):
 (1)
(1)
HINWEIS: Da das TR-FRET-Signal in einem zeitaufgelösten Modus gelesen wird, ist eine Hintergrundsubtraktion normalerweise nicht erforderlich. Wenn eine Hintergrundsubtraktion durchgeführt wird, verwenden Sie die zellfreien Vertiefungen mit dem 1x Supplemented Lysis Buffer (Negativkontrolle) für die Hintergrundsubtraktion. Bestimmen Sie das durchschnittliche TR-FRET-Verhältnis aus den zellfreien Wells und subtrahieren Sie diesen Wert dann vom TR-FRET-Verhältnis jedes Wells. - Für Konzentrations-Wirkungs-Kurven analysieren Sie die Daten gemäß einer nichtlinearen Regression unter Verwendung der logistischen Gleichung mit 4 Parametern (sigmoidale Dosis-Wirkungs-Kurve mit variabler Steigung) und einer 1/Y2-Datengewichtung, um EC50- oder IC50-Werte zu generieren.
- Für das Z'-Faktor-Experiment analysieren Sie die Daten gemäß der folgenden Formel (2)10
 (2)
(2)
Dabei sind μ und σ die Mittelwerte und Standardabweichungen für die Positivkontrolle (p; stimulierte Zellen) bzw. die Negativkontrolle (n; unbehandelte Zellen).
Ergebnisse
Jeder THUNDER TR-FRET-Assay wurde pharmakologisch validiert, indem adhärente (HeLa oder A431) oder Suspensionszellen (U266B1) mit JAK/STAT-Signalweg-spezifischen Aktivatoren oder Inhibitoren behandelt und dann gegebenenfalls die Konzentrationen spezifischer phosphorylierter und Gesamt-STATs gemessen wurden. Die Assays wurden im 384-Well-Format unter Verwendung des Zwei-Platten-Transferprotokolls und voroptimierter Assay-Bedingungen durchgeführt. Abbildung 3, Abbildung 4, Abbildung 5, Abbildung 6 und Abbildung 7 fassen repräsentative Konzentrations-Wirkungs-Kurven zusammen, die für alle STAT-Assays erhalten wurden. Insgesamt zeigten alle Stimulator- und Inhibitor-Konzentrations-Wirkungs-Kurven für die Phospho-STAT-Assays robuste TR-FRET-Signale, große Dynamikbereiche, einen niedrigen Variationskoeffizienten zwischen den Vertiefungen (typischerweise ≤5 %) und akzeptable S / B-Verhältnisse. Die hier gemeldeten EC50- und IC50-Werte liegen im Bereich der Erwartungswerte.
Die Behandlung von Zellen mit den JAK-Aktivatoren IFNα2b (Phospho-STAT1, Phospho-STAT3 und Phospho-STAT4), IL-4 (Phospho-STAT6) und EGF (Phospho-STAT5) zeigte den erwarteten konzentrationsabhängigen Anstieg der STAT-Phosphorylierung an spezifischen Tyrosinresten, während die entsprechenden Gesamt-STAT-Proteine (STAT1, STAT3, STAT5 und STAT6) stabil blieben (Abbildung 3, Abbildung 4, Abbildung 5, Abbildung 6 und Abbildung 7 , Panel A). Die Signalabnahme (weniger als 20%), die für Gesamt-STAT5 mit zunehmender STAT5-Phosphorylierung beobachtet wurde, wird erwartet und ist auf die sterische Behinderung zurückzuführen, bei der die Phosphorylierung von STAT5 die Bindung eines der beiden Anti-total-STAT5-Antikörper an sein jeweiliges Antigen behindert. Die EC50-Werte lagen im sub-nanomolaren Bereich für IFNα2b und IL-4 (0,083 bis 0,47 nM) und im niedrigen nanomolaren Bereich für EGF (12 nM). Diese Werte stimmen mit den veröffentlichten Daten überein6,11.
Um zu bestätigen, dass das von den Aktivatoren induzierte Signal durch die Aktivierung endogener Rezeptoren vermittelt wurde, wurden die Zellen vor der submaximalen Stimulation (EC80) mit den STAT-Aktivatoren mit steigenden Konzentrationen von entweder JAK-Inhibitor 1 (einem Pan-JAK-Inhibitor) oder Erlotinib (einem EGFR-Tyrosinkinase-Inhibitor) vorbehandelt. Wie erwartet, hemmten sowohl JAK-Inhibitor 1 als auch Erlotinib die entsprechenden Phospho-STAT-Spiegel in konzentrationsabhängiger Weise, wobei die IC50-Werte zwischen dem niedrigen nanomolaren und dem hohen nanomolaren Bereich für JAK-Inhibitor 1 (29-759 nM) und im niedrigen nanomolaren Bereich für Erlotinib (10 nM) lagen (Abbildung 3, Abbildung 4, Abbildung 5, Abbildung 6 und Abbildung 7, Panel B). Die IC50-Werte stimmen mit den veröffentlichten Daten überein11,12,13. Wie bei Stimulationsexperimenten wurden die Spiegel der entsprechenden Gesamt-STAT von keiner der beiden Behandlungen beeinflusst. Zusammengenommen zeigen diese Ergebnisse die Spezifität jedes Assays für sein endogenes Ziel-STAT-Protein (phosphoryliert oder vollständig) und seine Fähigkeit, Aktivatoren oder Inhibitoren mit einer Reihe von Potenzen zu profilieren.
Assays, bei denen der gesamte Arbeitsablauf (Zellbehandlung, Lyse und Proteinnachweis) in einem einzigen Well einer 384-Well-Platte ohne Transferschritt durchgeführt wird, eignen sich besser für HTS. Dementsprechend wurden die Phospho-STAT4- und Phospho-STAT6-Assays unter Verwendung des One-Plate-Protokolls durchgeführt. Repräsentative Daten, die unter optimierten Bedingungen gewonnen werden, sind in Abbildung 8 und Abbildung 9 zusammengefasst. Stimulation von entweder phosphoryliertem STAT4 durch IFNα2b in einer Suspensionszelllinie (U266B1; Abbildung 8) oder phosphoryliertes STAT6 durch IL-4 in einer adhärenten Zelllinie (HeLa; Abbildung 9) wurde mit akzeptablen S / B-Verhältnissen und EC50-Werten erhalten, die mit denen übereinstimmen, die mit dem Zwei-Platten-Protokoll erhalten wurden. Diese Daten zeigen, dass die Phospho-STAT-Assays erfolgreich von einem Zwei-Platten-Übertragungsprotokoll auf ein Ein-Platten-All-in-One-Well-Protokoll angepasst werden können.
Der Z'-Faktor wird in der HTS-Community häufig zur Bewertung der Eignung und Robustheit eines Assays für HTS10 verwendet. Zur weiteren Validierung der Phospho-STAT-Assays wurden vorläufige Z'-Faktor-Studien manuell unter Verwendung des Zwei-Platten-Protokolls durchgeführt. Um die Assay-Stabilität zu beurteilen, wurden die Platten sowohl nach einer 4-stündigen Inkubation als auch nach einer Inkubation über Nacht gelesen. Die Ergebnisse für die Phospho-STAT1- und Phospho-STAT3-Assays unter Verwendung einer Suspensionszelllinie (U266B1) bzw. einer adhärenten Zelllinie (HeLa) sind in Abbildung 10 zusammengefasst. Die berechneten Z′-Faktorwerte betrugen 0,85 für Phospho-STAT1 und 0,79 für Phospho-STAT3. Nach der Inkubation über Nacht blieben die Z'-Faktor-Werte stabil (0,83 für Phospho-STAT1 und 0,78 für Phospho-STAT3). Ähnliche Z'-Faktor-Werte wurden für die anderen Phospho-STAT-Assays erhalten (STAT4: 0,79; STAT5: 0,78; STAT6: 0,63). Ein zellbasierter Assay mit einem Z'-Faktor ≥ 0,40 gilt als geeignet für HTS15. Dementsprechend zeigen diese Ergebnisse die Robustheit dieser Phospho-STAT-Assays für HTS-Anwendungen.

Abbildung 3: Nachweis der Phospho-STAT1 (Y701)-Modulation in U266B1-Zellen. Zellen (200.000 Zellen/Well), die in einer 96-Well-Kulturplatte ausgesät waren, wurden mit steigenden Konzentrationen von entweder (A) IFNα2b für 15 min bei RT oder (B) JAK-Inhibitor 1 für 30 min bei RT, dann mit 1 nM (EC80) IFNα2b für 15 min bei RT behandelt. Nach der Lyse wurden Lysate auf eine 384-Well-Weißplatte mit geringem Volumen übertragen, gefolgt von der Zugabe des Antikörper-Detektionsmixes. Die Platte wurde bei RT 4 h lang inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IFN = Interferon; RT = Raumtemperatur; JAK = Januskinase; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Nachweis von Phospho-STAT3 (Y705) und Gesamtmodulation von STAT3 in HeLa-Zellen. Zellen (40.000 Zellen/Well), die über Nacht in einer 96-Well-Kulturplatte kultiviert wurden, wurden mit steigenden Konzentrationen von entweder (A) IFNα2b für 20 min bei RT oder (B) JAK-Inhibitor 1 für 30 min bei RT und dann mit 1,5 nM IFNα2b für 20 min bei RT behandelt. Nach der Medienentfernung und Lyse wurden Lysate auf eine 384-Well-Weißplatte mit geringem Volumen übertragen, gefolgt von der Zugabe des Antikörper-Detektionsmixes. Die Platte wurde bei RT 4 h lang inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IFN = Interferon; RT = Raumtemperatur; JAK = Januskinase; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Nachweis der Phospho-STAT4 (Y693)-Modulation in U266B1-Zellen. Zellen (400.000 Zellen/Well), die in einer 96-Well-Kulturplatte ausgesät waren, wurden mit steigenden Konzentrationen von entweder (A) IFNα2b für 25 min bei 37 °C oder (B) JAK-Inhibitor 1 für 30 min bei RT, dann mit 1 nM IFNα2b für 25 min bei 37 °C behandelt. Nach der Medienentfernung und Lyse wurden Lysate auf eine 384-Well-Weißplatte mit geringem Volumen übertragen, gefolgt von der Zugabe des Antikörper-Detektionsmixes. Die Platte wurde über Nacht bei RT inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IFN = Interferon; RT = Raumtemperatur; JAK = Januskinase; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Nachweis von Phospho-STAT5 (Y694/Y699) und Gesamtmodulation von STAT5 in A431-Zellen. Zellen (75.000 Zellen/Well), die über Nacht in einer 96-Well-Kulturplatte kultiviert wurden, wurden mit steigenden Konzentrationen von entweder (A) EGF für 10 min bei RT oder (B) Erlotinib für 15 min bei RT, dann mit 73 nM EGF für 10 min bei RT behandelt. Nach der Medienentfernung und Lyse wurden Lysate auf eine 384-Well-Weißplatte mit geringem Volumen übertragen, gefolgt von der Zugabe des Antikörper-Detektionsmixes. Die Platte wurde über Nacht bei RT inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; EGF = epidermaler Wachstumsfaktor; RT = Raumtemperatur; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
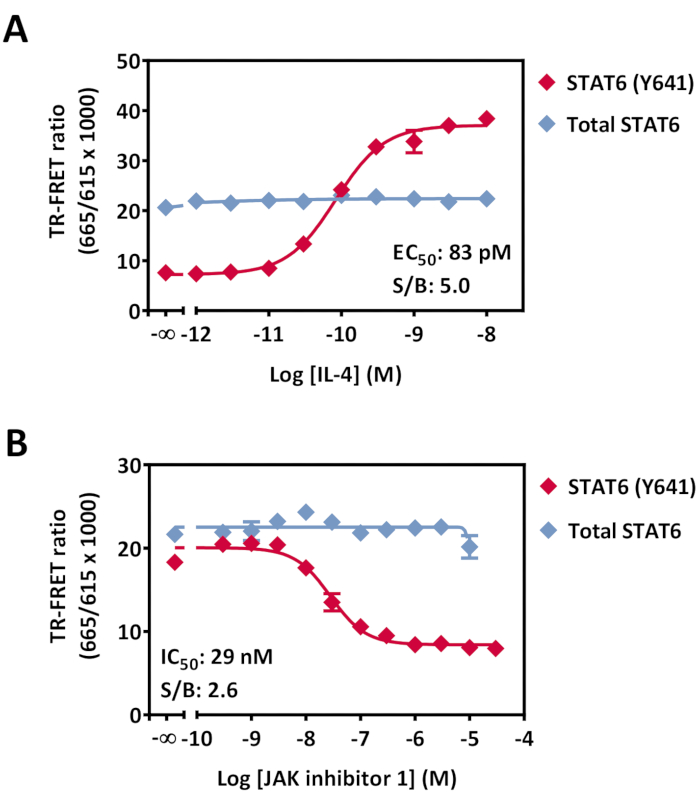
Abbildung 7: Nachweis von Phospho-STAT6 (Y641) und Gesamtmodulation von STAT6 in HeLa-Zellen. Zellen (40.000 Zellen/Well), die über Nacht in einer 96-Well-Kulturplatte kultiviert wurden, wurden mit steigenden Konzentrationen von entweder (A) IL-4 für 20 min bei RT oder (B) JAK-Inhibitor 1 für 30 min bei RT, dann mit 0,5 nM IL4 für 20 min bei RT behandelt. Nach der Medienentfernung und Lyse wurden Lysate auf eine 384-Well-Weißplatte mit geringem Volumen übertragen, gefolgt von der Zugabe des Antikörper-Detektionsmixes. Die Platte wurde bei RT 4 h lang inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IL = Interleukin; JAK = Januskinase; RT = Raumtemperatur; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 8: Nachweis der Phospho-STAT4 (Y693) Stimulation in U266B1-Zellen mit dem Ein-Platten-Protokoll. Zellen (160.000 Zellen/Well), die in einer 384-Well-White-Platte mit geringem Volumen ausgesät waren, wurden sofort mit steigenden Konzentrationen von IFNα2b für 25 min bei 37 °C behandelt. Nach der Lyse wurde der Antikörper-Detektionsmix direkt in das Lysat gegeben. Die Platte wurde über Nacht bei RT inkubiert und dann mit einer Blitzlampe oder Laseranregung auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IFN = Interferon; RT = Raumtemperatur; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 9: Nachweis der Phospho-STAT6 (Y641)-Stimulation in HeLa-Zellen mit dem Ein-Platten-Protokoll. Zellen (80.000 Zellen/Well), die in einer 384-Well-White-Plate mit geringem Volumen ausgesät waren, wurden sofort mit steigenden Konzentrationen von IL-4 für 20 min bei RT behandelt. Nach der Lyse wurde der Antikörper-Detektionsmix direkt in das Lysat gegeben. Die Platte wurde 4 h bei RT inkubiert und dann auf einem TR-FRET-kompatiblen Lesegerät gelesen. Die Daten werden als Mittelwert der dreifachen Vertiefungen pro Analysepunkt dargestellt. Fehlerindikatoren zeigen die Standardabweichung an. Einige Fehlerindikatoren sind kleiner als die Symbolgröße. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IL = Interleukin; RT = Raumtemperatur; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 10: Intraplatten-Variabilitätsstudie der Phospho-STAT1 (Y701) und Phospho-STAT3 (Y705) Assays. (A) Phospho-STAT1-Assay: Suspensionszellen (200.000 U266B1-Zellen/Well) wurden entweder mit 10 nM IFNα2b für 15 min oder serumfreiem Medium allein (niedrige Kontrollen) behandelt. (B) Phospho-STAT3-Assay: adhärente Zellen (20.000 HeLa-Zellen/Well) wurden entweder mit 5 nM IFNα2b für 20 min oder mit serumfreiem Medium allein behandelt. Bei beiden Assays wurde das TR-FRET-Signal nach 4 h Inkubation abgelesen. Abkürzungen: STAT = Signalwandler und Aktivator der Transkription; IFN = Interferon; TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung; S/B = Signal/Hintergrund-Verhältnis; CV = Variationskoeffizient. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Im Vergleich zu herkömmlichen Methoden zur Phosphoproteinanalyse wie Western Blotting und ELISA-basierten Methoden ist der Workflow für einen zellulären THUNDER TR-FRET-Assay einfach und schnell, verwendet eine Probe mit geringem Volumen (15 μL), ist für HTS in einem 384-Well-Format konzipiert und sehr automatisierungsfähig. Das Assay-Protokoll ist flexibel und kann sowohl an Anwendungen mit mittlerem als auch an Anwendungen mit hohem Durchsatz angepasst werden. Assays können entweder mit einem Zwei-Platten-Übertragungsprotokoll oder einem Ein-384-Well-Plattenprotokoll ausgeführt werden. Im Zwei-Platten-Transferprotokoll werden Zellen in einer Zellkulturplatte ausgesät, behandelt und lysiert, und Lysate werden anschließend zur Analyse auf eine separate weiße Detektionsplatte (Halbflächen-96-Well- oder 384-Well-Platte) übertragen. In einem Ein-384-Well-Plattenprotokoll wird der gesamte Workflow im selben Bohrloch durchgeführt, sodass kein Flüssigkeitstransferschritt erforderlich ist. Die Assays konnten leicht an das 1536-Well-Format angepasst werden, indem das Volumen proportional reduziert wurde. Unabhängig vom Assay-Protokoll gibt es nur drei Reagenzienlösungen zur Vorbereitung und keine Waschschritte, und die Assays können nach einem "Addition-only"-Protokoll ausgeführt werden, was minimale praktische Zeit erfordert.
Ein kritischer Schritt bei der Durchführung eines zellbasierten Assays ist die Optimierung der Zellkultur- und Behandlungsbedingungen16. Sowohl die Zellzahl als auch die Behandlungsbedingungen erfordern eine sorgfältige Optimierung, bevor ein Assay durchgeführt wird, da diese Schlüsselparameter oft für jede Zelllinie und jedes Phosphoprotein variieren. Die Optimierung dieser Parameter ermöglicht es, das Assay-Fenster zu maximieren, eine optimale Leistung mit einem hohen S/B-Verhältnis und einem niedrigen Inter-Well-Variationskoeffizienten zu erzielen und die Robustheit und Reproduzierbarkeit der Ergebnisse sicherzustellen. Die Zellzahl, der Serumhunger (falls zutreffend) und die Stimulations- oder Hemmzeit (entweder bei Raumtemperatur oder 37 °C) sollten für jede Zelllinie und jedes Zielprotein optimiert werden. Zu hohe oder zu niedrige Zellzahlen können die Modulation intrazellulärer Signalwege negativ beeinflussen. Zellaussaatdichten von 40.000-80.000 Zellen / Well für adhärente Zellen oder 100.000-200.000 Zellen / Well für Suspensionszellen sind im Allgemeinen für die meisten Zelllinien akzeptabel. Bemerkenswert ist, dass die optimale Zeitspanne für Stimulation und Hemmung zwischen Zelllinien und Zielproteinen stark variieren kann, von wenigen Minuten bis zu mehreren Stunden. Daher wird dringend empfohlen, eine Zeitkursstudie durchzuführen, um die optimalen Stimulations- und Hemmungsinkubationszeiten zu bestimmen, idealerweise sowohl bei Raumtemperatur als auch bei 37 °C, da die Inkubationstemperatur die Kinetik der Zielproteinstimulation beeinflusst.
Die Fehlerbehebung bei einem zellbasierten Assay kann aufgrund der vielen Schritte im Workflow (Zellkultur, Zellbehandlung, Lyse und Proteinnachweis) schwierig und zeitaufwändig sein. Diese Assay-Kits enthalten ein Positivkontrolllysat. Es wird empfohlen, diese Positivkontrolllysate und Negativkontrolle (1x ergänzter Lysepuffer allein) in jedem Experiment zu verwenden. Die Verwendung geeigneter Kontrollen erleichtert die Fehlerbehebung, da Probleme dann schnell entweder dem Nachweisschritt (falsche Reagenzienvorbereitung und/oder Assay-Ausführung) oder der Qualität der im Experiment verwendeten Lysate zugeschrieben werden können. Letzteres ist im Allgemeinen auf die Verwendung suboptimaler zellulärer Bedingungen zurückzuführen.
Ein weiterer Vorteil dieser Plattform ist die Verfügbarkeit einer Suite optimierter Lysepuffer mit unterschiedlichen Stringenzen. Dies ermöglicht die Erzeugung von mehr oder weniger heterogenen Lysaten aus partieller subzellulärer Fraktionierung. Dies ist nützlich, da sich Signalproteine in verschiedenen intrazellulären Kompartimenten befinden und einige, wie STAT-Proteine, zwischen Kompartimenten pendeln (z. B. zwischen dem Zytoplasma und dem Zellkern). Bemerkenswert ist, dass phosphorylierte und totale STAT1 Lysepuffer 1 verwenden, da sie mit dem Lysepuffer 2, der für die anderen STAT-Proteine verwendet wird, nicht gut nachgewiesen werden können. Im Gegensatz dazu basieren andere homogene Methoden auf einem einzigen "universellen" Lysepuffer, der eine komplexere Probe erzeugt, die unspezifische Wechselwirkungen mit den Antikörpern erzeugen kann. Die Verwendung verschiedener Lysepuffer kann jedoch die Analyse mehrerer Signalproteine aus einer einzigen Lysatprobe ausschließen. Dennoch kann man Lysate, die mit verschiedenen Lysepuffern gleichzeitig auf einer einzigen Platte erzeugt wurden, für die parallele Signalweganalyse testen.
Zusammenfassend lässt sich sagen, dass die hier vorgestellten Methoden, die auf dieser homogenen TR-FRET zellulären Immunoassay-Plattform basieren, eine Hochdurchsatzalternative für die Überwachung der JAK/STAT-Signalgebung durch den Nachweis und die Quantifizierung von endogenen phosphorylierten STAT1/3/4/5/6-Proteinen zusammen mit Gesamt-STAT1/3/5/6 in Zelllysaten bieten. Diese Assays bieten neue Werkzeuge für eine umfassendere Analyse spezifischer STAT-Proteine nach der Zellbehandlung und das Screening und die Charakterisierung spezifischer und selektiver Modulatoren der JAK/STAT-Signalwege. Aufgrund ihrer Einfachheit, Spezifität, Sensitivität, Reproduzierbarkeit und Kosteneffizienz stellt diese neue Assay-Plattform eine attraktive Alternative zu herkömmlichen Immunoassays dar, sowohl in einem akademischen Umfeld als auch in Industrielabors für HTS-Anwendungen.
Offenlegungen
Konkurrierende Interessen: Jaime Padros, Mireille Caron und Geneviève Chatel sind Mitarbeiter von BioAuxilium Research, das die in dieser Studie verwendeten THUNDER TR-FRET Assay-Kits herstellt. Darüber hinaus sind Jaime Padros und Mireille Caron Gesellschafter von BioAuxilium Research. Dies ändert nichts an der Einhaltung aller JoVE-Richtlinien zum Teilen von Daten und Materialien durch die Autoren.
Danksagungen
Nichts.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Referenzen
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392(2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94(2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al. HTS assay validation. Assay Guidance Manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029(2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten