Method Article
ヒト細胞中の内因性リン酸化STATタンパク質の測定のための時間分解フェルスター共鳴エネルギー移動アッセイ
要約
時間分解フェルスター共鳴エネルギー移動細胞ベースのアッセイプロトコルは、384ウェルフォーマットの細胞溶解物中の内因性リン酸化シグナルトランスデューサおよび転写活性化剤(STAT)1/3/4/5/6タンパク質の単純、特異的、高感度、および堅牢な定量のために記載されています。
要約
ヤヌスキナーゼ(JAK)/シグナルトランスデューサーおよび転写の活性化因子(STAT)シグナル伝達経路は、サイトカインおよび成長因子に対する細胞応答を媒介する上で重要な役割を果たしている。STATタンパク質は、主にJAKによって媒介されるチロシンリン酸化によって活性化される。STATシグナル伝達経路の異常な活性化は、多くのヒト疾患、特に癌および免疫関連状態に関与している。したがって、天然細胞シグナル伝達環境内でのSTATタンパク質のリン酸化をモニターする能力は、学術的および創薬的研究の両方にとって重要である。リン酸化STATタンパク質を定量するために利用可能な従来のアッセイ形式には、ウェスタンブロッティングおよび酵素結合免疫吸着アッセイ(ELISA)が含まれる。これらの異種の方法は、労働集約的でスループットが低く、ウェスタンブロッティングの場合、信頼性が低い(特異的な)ことがよくあります。均質な(洗浄なしの)方法が利用可能であるが、依然として高価である。
ここでは、新規サンダー時間分解フェルスター共鳴エネルギー移動(TR-FRET)プラットフォームを使用して、接着細胞または浮遊細胞からの細胞溶解物中のリン酸化STAT1(Y701)、STAT3(Y705)、STAT4(Y693)、STAT5(Y694/Y699)、およびSTAT6(Y641)の内因性レベルの384ウェルフォーマットで、高感度で堅牢で費用対効果の高い測定のための詳細なプロトコルが提供されています。細胞アッセイのワークフローはシンプルで高速で、ハイスループットスクリーニング(HTS)用に設計されています。アッセイプロトコルは柔軟で、少量サンプル(15 μL)を使用し、1つの試薬添加ステップのみを必要とし、低スループットおよびハイスループットのアプリケーションに適合させることができます。各ホスホ-STATサンドイッチイムノアッセイは、既知のアゴニストおよび阻害剤を用いて最適化された条件下で検証され、予想される薬理学およびZ'因子値を生成する。TR-FRETアッセイはレシオメトリックであり、洗浄ステップを必要としないため、従来のアプローチよりもはるかに優れた再現性を提供します。この一連のアッセイは、細胞処理後の特異的リン酸化STATタンパク質のより包括的な分析、およびJAK/STATシグナル伝達経路の特異的および選択的モジュレーターのスクリーニングおよび特性評価のための新しい費用対効果の高いツールを提供します。
概要
JAK/STATシグナル伝達経路は、多様なサイトカイン、インターフェロン、成長因子、および関連分子に対する細胞応答を媒介する上で重要な役割を果たしています1,2。これらのリガンドの特異的細胞表面受容体への結合はJAKの活性化をもたらし、JAKは特定のチロシン残基のリン酸化によってSTATタンパク質を活性化する。STATリン酸化は、それらの二量体化および核への転座をもたらし、そこで調節された標的遺伝子の転写にその効果を発揮する。STAT ファミリは、STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、および STAT6 の 7 つのメンバーで構成されています。メンバーは、増殖、分化、アポトーシス、血管新生、および免疫系調節を含む生理学的細胞プロセスの調節において複雑かつ不可欠な役割を果たす。STATシグナル伝達経路の異常な活性化は、多くのヒト疾患、特に癌および免疫関連状態に関与している3,4。したがって、天然細胞シグナル伝達環境におけるSTATタンパク質のリン酸化を評価する能力は、学術的および創薬的研究の両方にとって重要である。
今日まで、STATを含む細胞内リン酸化タンパク質レベルを測定するために使用される従来の方法は、抗体ベースであり、ウェスタンブロッティング、ELISA、およびホスホフローサイトメトリーを含む。これらの異種の方法は、労力がかかり、時間がかかり、エラーが発生しやすく、スループットが低く、ウェスタンブロッティングの場合、しばしば信頼性が低い(特異性の問題など)5。対照的に、均質アッセイは、より少ない実験ステップを必要とし、より少ないサンプル量を使用し、HTSに従順である。細胞溶解物中のSTATのJAK依存性リン酸化を定量的にモニタリングするために使用できる5つの均質な細胞ベースの免疫アッセイプラットフォームが市販されている:SureFire、HTRF、LANCE、LanthaScreen、およびLumit。これらのプラットフォームにはそれぞれ長所と短所があります。
SureFireは発光酸素チャネリング技術に基づいており、ドナービーズとアクセプタービーズを使用して、一対の抗体を特異的に捕捉し、そのうちの1つはビオチン化されています。リン酸化タンパク質の存在下で、2つの抗体はドナービーズとアクセプタービーズを近接させ、化学発光シグナルの生成を可能にします6。汎用性と感度は高いものの、この技術は高価であり、培養液中のビオチンの影響を受け、周囲温度や光に非常に敏感であり、検出には特別なリーダーが必要です。HTRFとLANCEはどちらもTR-FRET技術に基づいており、ドナー分子として長寿命発光ランタノイドイオン錯体(ユウロピウムまたはテルビウムキレート、またはユウロピウムクリプテート)を使用し、アクセプター分子として遠赤色蛍光団7。ドナー分子またはアクセプター分子のいずれかで標識された2つのタンパク質特異的抗体が近接すると、FRETが発生し、アクセプター蛍光の増加およびドナー蛍光の減少を引き起こす。これらの長寿命蛍光シグナルは、時間分解およびレシオメトリック方式で測定できるため、アッセイ干渉を低減し、データ品質を向上させることができます。TR-FRETの他の利点は、光に敏感ではなく、繰り返し読み取りが可能で、長い信号安定性を示すことです。TR-FRETは、その汎用性、感度、および高い堅牢性のためにHTSに広く実装されていますが、すべての市販のTR-FRETベースのアッセイプラットフォームは高価であるため、学術的および小規模な産業研究所での幅広い採用を妨げています。LanthaScreenアッセイもTR-FRETベースの読み出しを使用しますが、緑色蛍光タンパク質(GFP)-STAT1融合タンパク質とテルビウム標識ホスホ特異的STAT1抗体を組み合わせた安定発現する操作されたU2OS細胞株に依存しています8。シグナル伝達タンパク質の選択が限られていることに加えて、この方法は高価なトランスフェクト細胞株を購入し、その適用性を低下させ、実験的アーチファクトの可能性を高める必要がある。Lumitは、NanoLuc Luciferase9の大小のNanoBitサブユニットで化学的に標識された二次抗体(抗マウスおよび抗ウサギ)を利用する一般的な生物発光免疫測定プラットフォームです。2つの一次抗体の標的タンパク質への結合は、二次抗体を近接させ、発光シグナルを生成する活性酵素を形成する。発光は一般に高感度で堅牢な読み出しですが、2つの異なる種で産生される一次抗体の要件により、アッセイ設計の選択肢が制限されます。さらに、複雑なサンプルマトリックスに二次抗体を使用すると、アッセイ干渉を受けやすくなる可能性があります。
したがって、HTSと互換性のある方法で個々のリン酸化タンパク質および総STATタンパク質を測定するための、信頼性が高く、迅速で、かつ手頃な価格の細胞ベースのアッセイプラットフォームの必要性が依然として存在する。このニーズに対応するために、強化されたTR-FRET技術(THUNDER)に基づいて新しいハイスループット細胞ベースのイムノアッセイプラットフォームが開発され、細胞ライセート中の内因的に発現された細胞内タンパク質(リン酸化または合計)のシンプルで高感度、堅牢で費用対効果の高い測定を可能にするように設計されています。この技術の利点は、優れたスペクトル適合性とTR-FRETシグナルを示すドナー/アクセプターFRETペア、厳密に検証された抗体、および最適化された溶解バッファーの組み合わせに由来します。これらのアッセイはサンドイッチイムノアッセイとしてフォーマットされ、簡単な3段階のワークフローを使用します(図1)。細胞は、まずタンパク質リン酸化を調節するように処理され、次いでキットに提供される特定の溶解緩衝液で溶解される。細胞溶解物中の標的リン酸化または総STATタンパク質は、標的タンパク質上の別個のエピトープを認識する一対のフルオロフォア標識抗体との単一の試薬添加およびインキュベーション工程で検出される(図2)。1つの抗体はユウロピウムキレートドナー(Eu-Ab1)で標識され、2番目の抗体は遠赤色アクセプターフルオロフォア(FR-Ab2)で標識されています。2つの標識抗体は溶液中のタンパク質に結合し、2つの標識を近接させる。ドナーのユウロピウムキレートを320または340nmで励起すると、アクセプターにFRETがトリガーされ、細胞溶解物中の標的タンパク質(リン酸化または合計)の濃度に比例した665nmで長寿命のTR-FRETシグナルを放出する。

図1:TR-FRETアッセイワークフロー ワークフローは、細胞処理、細胞溶解、TR-FRETを使用したタンパク質検出の3つのステップで構成されています。2プレートアッセイプロトコルでは、溶解液は白色384ウェル検出プレートに移されますが、1プレートプロトコルでは、すべてのステップが同じ白色384ウェル検出プレート(オールインワンウェルプロトコル)で行われます。使用されるアッセイプロトコルにかかわらず、タンパク質検出は同じ総容量(ウェルあたり20 μL)で行われます。略語: TR-FRET = 時間分解フェルスター共鳴エネルギー移動。 この図の拡大版を表示するには、ここをクリックしてください。

図2:TR-FRETサンドイッチ免疫測定法原理。 1つの抗体はユウロピウムキレートドナー(Eu-Ab1)で標識され、もう1つは遠赤色の小蛍光色素受容体(FR-Ab2)で標識されています。2つの標識抗体は、細胞ライセート中の標的タンパク質(リン酸化または全)上の異なるエピトープに特異的に結合し、2つの蛍光色素を近接させます。320または340nmでのドナーユーロピウムキレートの励起は、ドナーからアクセプター分子へのFRETを誘発し、次いで665nmでシグナルを放出する。このシグナルは、細胞溶解物中のタンパク質の濃度に比例する。特定の標的タンパク質がない場合、ドナーとアクセプターの蛍光色素は互いに離れすぎているため、FRETは発生しません。略語: FRET = フェルスター共鳴エネルギー移動;TR-FRET = 時間分解フレット;Ab = 抗体;FR = 極赤色。Eu - ユウロピウムキレート;P = リン酸化。 この図の拡大版を表示するには、ここをクリックしてください。
ここでは、THUNDER TR-FRETプラットフォームを使用する付着細胞または浮遊細胞からの細胞溶解物中のリン酸化STAT1(Y701)、STAT3(Y705)、STAT4(Y693)、STAT5(Y694/Y699)、およびSTAT6(Y641)の細胞内レベルを、合計STAT1、STAT3、STAT5、およびSTAT6とともに測定するための詳細なプロトコルが、384ウェルフォーマットで提供されています。これらのプロトコルは、2 プレート転写プロトコルまたは 1 プレートオールインワンウェルプロトコルのいずれかを使用した細胞処理、溶解、および TR-FRET ベースの標的タンパク質検出の手順を定義します。これらの細胞ベースのアッセイは、JAK/STAT経路の既知の活性化剤および阻害剤の薬理学的プロファイルを決定するために適用される。HTSのための選択されたアッセイの堅牢性と適合性が実証されています。最後に、アッセイ最適化のための主要な実験と、アッセイのトラブルシューティングに関する推奨事項について説明します。
プロトコル
1. 細胞培養
- 加湿した37°C/5%CO2 インキュベーター内で細胞を維持し、10%ウシ胎児血清(FBS)を添加したDMEM(HeLaおよびA431細胞)または15%FBSを添加したRPMI(U266B1細胞)のいずれかで培養する。70〜80%のコンフルエントに達するまで細胞を培養し、次いでそれらをトリプシン処理して継代するか、アッセイに使用する。
注:培地にはフェノールレッドが含まれていました。アッセイを実施する前に、どの細胞株についても血清飢餓は実施されなかった。
2. 接着細胞を用いた2プレートアッセイプロトコルを用いた刺激剤または阻害剤滴定
注:この手順では、試験化合物の希釈系列から濃度 - 応答曲線を生成することによって、刺激剤または阻害剤の効力を決定する方法について説明します。
- 細胞播種
- 事前に最適化された密度で 50 μL の細胞 (STAT3 と STAT6 の両方で 40,000 HeLa 細胞/ウェル、STAT5 で 75,000 A431 細胞/ウェル) を適切な培養液中の 96 ウェル組織培養処理プレートに分注します。37°C/5%CO2で一晩インキュベートする。
注:最適な細胞密度と培養インキュベーション時間を決定する必要があります。
- 事前に最適化された密度で 50 μL の細胞 (STAT3 と STAT6 の両方で 40,000 HeLa 細胞/ウェル、STAT5 で 75,000 A431 細胞/ウェル) を適切な培養液中の 96 ウェル組織培養処理プレートに分注します。37°C/5%CO2で一晩インキュベートする。
- 試験化合物の希釈
- ポリプロピレン製96ウェルプレートの12ウェルにわたって化合物を連続希釈(半対数間隔希釈)して、試験化合物の中間2x希釈シリーズを無血清培地に調製する。
メモ:EC50またはIC50を正確に推定するために、12ポイント、ハーフログ間隔の濃度-応答曲線を少なくとも重複して実行することをお勧めします。 - あるいは、疎水性の場合、ジメチルスルホキシド(DMSO)可溶性試験化合物は、100%DMSOで初期希釈を行い、次いで化合物希釈シリーズを無血清培地に希釈する。
注:DMSOに対するアッセイ耐性は、DMSOビヒクル中で試験化合物滴定を実施する前に確立されなければならない。処理された細胞と未処理の細胞の間で等しい溶媒濃度を保つことが重要です。さらに、化合物の段階希釈をテストする場合、溶媒濃度は希釈シリーズ全体で常に一定に保たれるべきです。
- ポリプロピレン製96ウェルプレートの12ウェルにわたって化合物を連続希釈(半対数間隔希釈)して、試験化合物の中間2x希釈シリーズを無血清培地に調製する。
- 細胞処理
- 細胞刺激のために、50 μLの無血清培地(未処理細胞)または刺激剤を含む(2x)を添加する。
- 室温(RT)または37°Cのいずれかで予め最適化された時間(インターフェロン(IFN)α2b/STAT3についてはRTで20分;STAT5については上皮成長因子(EGF)/RTで10分;STAT6についてはRTでインターロイキン(IL)-4/20分)の間インキュベートする。その後、セクション 2.4 に進みます。
注:最適なインキュベーション温度を決定する必要があります。 - 細胞阻害のために、25μLの無血清培地を単独で(未処理細胞)または阻害剤を含む(4x)加える。
- RTまたは37°Cのいずれかで予め最適化された時間の間インキュベートする(JAK阻害剤は、STAT3およびSTAT6についてRTで1/30分;エルロチニブ/RTで15分(STAT5用)。
- EC80に無血清培地を単独で(未処理細胞)または刺激剤を含む25 μL(4x)加える。
- RTまたは37°Cのいずれかで事前に最適化された時間(ステップ2.3.2と同じ条件)でインキュベートします。
- 細胞溶解
- キット固有の1x補充溶解バッファーを、製造元の指示に従って準備します。
注:1x溶解バッファーに、最終濃度1xに希釈した100xホスファターゼ阻害剤カクテルを補充することが必須です。1x 補充溶解バッファーには、1 mM フッ化ナトリウム、2 mM オルトバナジン酸ナトリウム、および 2 mM β-グリセロリン酸が含まれています。他のホスファターゼ阻害剤は必須ではなく、避けるべきである。キットに含まれるもの以外の溶解バッファーおよびホスファターゼ阻害剤は、測定を妨げる可能性のある成分を含む可能性があるため、推奨されません。 - 上清を吸引して細胞培養培地を慎重に取り出して廃棄する。
- 直ちに50 μLの1x添加溶解バッファーを加える。
注:溶解バッファー容量(25-50 μL)は最適化できます。 - 振とう下でRTで30分間インキュベートする(400rpmに設定したオービタルプレートシェーカー;適度な攪拌)。
注:溶解インキュベーション時間(30〜60分)を最適化してもよい。溶解物は、標的タンパク質検出のために直ちに使用することも、-80°Cで凍結することもできます。
- キット固有の1x補充溶解バッファーを、製造元の指示に従って準備します。
- TR-フレット検出
- 製造元の指示に従って、4x 抗体検出ミックスを 1x 検出バッファーに準備します。
- この移入ステップでは、96ウェル培養プレートから白色の低容量384ウェルマイクロプレートのウェルに細胞溶解液15 μLを慎重にピペットでピペットします。
- 15 μL のポジティブコントロール溶解液と 15 μL の 1x 溶解バッファー (陰性対照) をアッセイウェルに分離して加えます。
- 5 μL の 4x 抗体検出ミックス (リンタンパク質の検出には Eu-Ab1/FR-Ab2、総タンパク質を検出する場合は Eu-Ab3/FR-Ab4) を各アッセイウェルに加えます。
- プレートシーラーでプレートを覆い、アッセイに応じてRTで1時間~一晩インキュベートします(対応する技術データシートを参照)。
注: 最適な読み取り時間は、アッセイおよび細胞株ごとに最適化する必要があります。プレートは、アッセイ性能に悪影響を及ぼすことなく複数回読み取ることができます。 - 接着プレートシーラーを取り外し、TR-FRET互換マイクロプレートリーダーでプレートを読み取ります。
メモ:フィルターベースの蛍光光度計を推奨しますが、一部のモノクロメーター機器を使用することもできます。TR-FRET用の適切な光モジュール(フィルタとミラー)が取り付けられていることを確認します。励起波長 320 または 340 nm を使用して、ユウロピウム キレートを励起します。615 nm(または620 nm)と665 nmの両方で読み取りアッセイを行い、ドナーのユウロピウムとアクセプター蛍光色素分子の両方からの発光をそれぞれ検出しました。計測器の設定は、特定のリーダによって異なります。ここで示したデータは、ランプベースの励起、90μsの遅延、300μsの積分時間、およびウェルあたり100回の点滅を使用して得られたものです。しかし、ホスホ-STAT4アッセイは、より高いシグナル対バックグラウンド(S/B)比を生成するためにレーザー励起を使用して読み取られました。
浮遊細胞を用いた2プレートアッセイプロトコルを用いた刺激剤または阻害剤滴定
- 試験化合物の希釈
- ステップ2.2.1および2.2.2に説明されているように、試験化合物の中間体2x希釈シリーズを調製する。
- 細胞播種および処理
- 事前に最適化された密度で 20 μL の細胞 (STAT1 の場合は 200,000 U266B1 細胞/ウェル、STAT4 の場合は 400,000 U266B1 細胞/ウェル) を、適切な培養液中の 96 ウェル組織培養処理プレートに分注します。直接細胞処理に進むか、37°C、5%CO2で2〜4時間インキュベートします。
メモ: この手順は、さまざまなセルタイプに合わせて最適化する必要があります。 - 細胞刺激のために、20μLの無血清培地を単独で(未処理細胞)または刺激剤を含む(2x)加える。
- RTまたは37°Cのいずれかで事前に最適化された時間(STAT1についてはRTでIFNα2b/15分;IFNα2b/STAT4の場合、37°Cで25分間)。その後、セクション 3.3 に進みます。
注:最適なインキュベーション温度を決定する必要があります。 - 細胞阻害のために、10 μLの無血清培地を単独で(未処理細胞)または阻害剤を含む(4x)加える。
- RTまたは37°Cのいずれかで予め最適化された時間(JAK阻害剤、STAT1およびSTAT4についてはRTで1/30分)インキュベートします。
- EC80に無血清培地を単独で(未処理細胞)または刺激剤を含む10 μL(4x)加える。
- RTまたは37°Cのいずれかで予め最適化された時間(ステップ3.2.3と同じ条件)でインキュベートする。
- 事前に最適化された密度で 20 μL の細胞 (STAT1 の場合は 200,000 U266B1 細胞/ウェル、STAT4 の場合は 400,000 U266B1 細胞/ウェル) を、適切な培養液中の 96 ウェル組織培養処理プレートに分注します。直接細胞処理に進むか、37°C、5%CO2で2〜4時間インキュベートします。
- 細胞溶解
- キット固有の5x補足溶解バッファーを、製造元の指示に従って準備します。
注:5x溶解バッファーに、最終濃度5xに希釈した100xホスファターゼインヒビターカクテルを補充することが必須です。5x 補充溶解バッファーには、5 mM フッ化ナトリウム、10 mM オルトバナジン酸ナトリウム、および 10 mM β-グリセロリン酸が含まれています。他のホスファターゼ阻害剤は必須ではなく、避けるべきである。 - 10 μL の 5 倍添加溶解バッファーを追加します。
- 振とう下でRTで30分間インキュベートする(400rpmに設定したオービタルプレートシェーカー;適度な攪拌)。
注:溶解インキュベーション時間(30〜60分)を最適化してもよい。溶解物は、標的タンパク質検出のために直ちに使用することも、-80°Cで凍結することもできます。
- キット固有の5x補足溶解バッファーを、製造元の指示に従って準備します。
- TR-フレット検出
- 細胞溶解に続いて、接着細胞の2プレートアッセイプロトコルのセクション2.5に記載されているようにTR-FRET検出ステップを実施します。
4. 付着細胞または浮遊細胞を用いた1プレートアッセイプロトコルを用いた刺激剤滴定
- 試験化合物の希釈
- ポリプロピレン製96ウェルプレートの12ウェルにわたって化合物を連続希釈(半対数間隔希釈)して、無血清培地に段階的に希釈することにより、試験化合物の中間希釈シリーズを3倍で調製する。
- 細胞播種および処理
- 事前に最適化された密度で 8 μL の細胞 (STAT4 の場合は 160,000 U266B1 細胞/ウェル、STAT6 の場合は 80,000 HeLa 細胞/ウェル) を、適切な無血清培養培地で白色の少量 384well アッセイプレートに分注します。直接細胞処理に進むか、37°C、5%CO2で2〜4時間インキュベートします。
注:治療前の細胞培養潜伏期間の要件は、異なる細胞タイプについて決定する必要があります。 - 細胞刺激のために、4μLの無血清培地を単独で(未処理細胞)または刺激剤を含む(3x)加える。
- 室温または37°Cのいずれかで事前に最適化された時間(STAT4の場合はIFNα2b/37°Cで25分;IL-4/20分、STAT6の場合、37°Cで)。その後、セクション 4.3 に進みます。
- 事前に最適化された密度で 8 μL の細胞 (STAT4 の場合は 160,000 U266B1 細胞/ウェル、STAT6 の場合は 80,000 HeLa 細胞/ウェル) を、適切な無血清培養培地で白色の少量 384well アッセイプレートに分注します。直接細胞処理に進むか、37°C、5%CO2で2〜4時間インキュベートします。
- 細胞溶解
- キット固有の5x補足溶解バッファーを、製造元の指示に従って準備します。
注:5x溶解バッファーに、最終濃度5xに希釈した100xホスファターゼインヒビターカクテルを補充することが必須です。 - 3 μL の 5 倍添加溶解バッファーを追加します。
- 振とう下でRTで30分間インキュベートする(400rpmのオービタルプレートシェーカー)。
注:溶解インキュベーション時間(30〜60分)を最適化してもよい。溶解液は、直ちに又は80°Cで凍結して使用することができる。
- キット固有の5x補足溶解バッファーを、製造元の指示に従って準備します。
- TR-フレット検出
- 15 μL のポジティブコントロール溶解液 (希釈なし) と 15 μL の 1x 補充溶解バッファー (陰性コントロール) をアッセイウェルに分離します。
- 1x 検出バッファーで調製した 5 μL の 4x 抗体検出ミックス (リンタンパク質の場合は Eu-Ab1/FR-Ab2 または全タンパク質の場合は Eu-Ab3-/FR-Ab4) を各アッセイウェルに加えます。
- プレートシーラーでプレートを覆い、アッセイに応じてRTで1時間から一晩インキュベートします。
注: 最適な読み取り時間は、アッセイおよび細胞株ごとに最適化する必要があります。プレートは、アッセイ性能に悪影響を及ぼすことなく複数回読み取ることができます。 - 粘着板シーラーを取り外します。TR-FRET 互換マイクロプレートリーダーでプレートを読み取ります。
5. データ解析
- 以下の式(1)を用いて各ウェルのTR-FRET比を計算する:
 (1)
(1)
メモ: TR-FRET信号は時間分解モードで読み取られるため、通常はバックグラウンド減算は必要ありません。バックグラウンド減算を行う場合は、バックグラウンド減算に 1x 補充溶解バッファー (ネガティブ コントロール) を含む無細胞ウェルを使用します。無細胞ウェルから平均TR-FRET比を決定し、次に各ウェルのTR-FRET比からこの値を差し引く。 - 濃度反応曲線の場合、4パラメータロジスティック式(可変傾きを持つシグモイド線量反応曲線)と1/Y2 データ重み付けを使用して非線形回帰に従ってデータを分析してEC50 またはIC50 値を生成します。
- Z'因子実験では、下記式(2)に従ってデータを解析する10
 (2)
(2)
ここで、μおよびσは、それぞれ陽性対照(p;刺激細胞)および陰性対照(n;未処理細胞)の平均値および標準偏差である。
結果
各 THUNDER TR-FRET アッセイは、付着細胞 (HeLa または A431) または浮遊細胞 (U266B1) を JAK/STAT経路特異的アクチベーターまたはインヒビターで処理し、該当する場合は特定のリン酸化 STAT および総 STAT のレベルを測定することによって薬理学的に検証されました。アッセイは、2プレート転写プロトコルおよび事前に最適化されたアッセイ条件を使用して、384ウェルフォーマットで実施しました。図3、図4、図5、図6、および図7は、すべてのSTATアッセイについて得られた代表的な濃度反応曲線を要約する。 全体として、ホスホ-STATアッセイのすべての刺激剤および阻害剤濃度-応答曲線は、堅牢なTR-FRETシグナル、広いダイナミックレンジ、低いウェル間変動係数(典型的には≤5%)、および許容可能なS/B比を示した。ここで報告されるEC50およびIC50の値は、期待値の範囲内にあります。
JAK活性化剤IFNα2b(ホスホ-STAT1、ホスホ-STAT3、およびホスホ-STAT4)、IL-4(ホスホ-STAT6)、およびEGF(ホスホ-STAT5)による細胞の処理は、特定のチロシン残基におけるSTATリン酸化の予想される濃度依存的な増加を示したが、対応する総STATタンパク質(STAT1、STAT3、STAT5、およびSTAT6)は安定なままであった(図3、図4、図5、図6、および図7) 、パネルA)。STAT5リン酸化の増加に伴う全STAT5について観察されるシグナル減少(20%未満)は、STAT5のリン酸化が2つの抗総STAT5抗体のうちの1つのそれぞれの抗原への結合を妨げる立体障害によるものである。EC50値は、IFNα2bおよびIL-4についてはサブナノモル範囲(0.083~0.47nM)にあり、EGFについては低ナノモル範囲(12nM)であった。これらの値は、公開されたデータと一致しています6,11。
活性化剤によって誘導されるシグナルが内因性受容体の活性化によって媒介されることを確認するために、細胞を、STAT活性化剤による最大下刺激(EC80)の前に、JAK阻害剤1(パンJAK阻害剤)またはエルロチニブ(EGFRチロシンキナーゼ阻害剤)のいずれかの濃度の増加で前処理した。予想されたように、JAK阻害剤1およびエルロチニブの両方が、JAK阻害剤1の低ナノモルおよび高ナノモル範囲(29〜759nM)およびエルロチニブの低ナノモル範囲(10nM)の範囲のIC50値(図3、図4、図5、図6、および図7において、濃度依存的に対応するホスホ−STATレベルを阻害した。 パネルB)。IC50の値は、公開されたデータ11、12、13と一致しています。刺激実験の場合と同様に、対応する総STATのレベルは、いずれの治療によっても影響を受けなかった。まとめると、これらの結果は、その内因性標的STATタンパク質(リン酸化または全)に対する各アッセイの特異性、およびさまざまな効力を示す活性化剤または阻害剤をプロファイルする能力を実証する。
ワークフロー全体(細胞処理、溶解、およびタンパク質検出)を転写ステップなしで384ウェルプレートの単一ウェルで実施するアッセイは、HTSに適しています。したがって、ホスホ−STAT4およびホスホ−STAT6アッセイを、ワンプレートプロトコールを用いて実施した。最適化された条件下で得られた代表的なデータを 図8 および 図9に要約する。浮遊細胞株におけるIFNα2bによるリン酸化STAT4のいずれかの刺激(U266B1; 図8)または付着細胞株中のIL-4によってリン酸化されたSTAT6(HeLa; 図9)は、2プレートプロトコルを使用して得られたものと一致する許容可能なS/B比およびEC50 値で得られた。これらのデータは、phospho-STATアッセイが2プレート転写プロトコルから1プレートオールインワンウェルプロトコルにうまく適応できることを示しています。
Z'因子は、HTS10のアッセイの適合性と堅牢性を評価するためにHTSコミュニティで一般的に使用されています。ホスホ-STATアッセイをさらに検証するために、予備的なZ'因子研究を2プレートプロトコールを使用して手動で実施した。アッセイ安定性を評価するために、4時間インキュベーションおよび一晩インキュベーションの両方に続いてプレートを読み取った。浮遊細胞株(U266B1)または付着細胞株(HeLa)を用いたホスホ−STAT1およびホスホ−STAT3アッセイについて得られた結果を、 図10に要約する。計算されたZ'因子値は、ホスホ-STAT1で0.85、ホスホ-STAT3で0.79であった。一晩のインキュベーション後、Z'因子値は安定したままであった(ホスホ-STAT1では0.83、ホスホ-STAT3では0.78)。他のホスホ-STATアッセイについても同様のZ'因子値が得られた(STAT4:0.統計 5: 0.78;統計6: 0.63)。Z'因子≥0.40の細胞ベースのアッセイは、HTS15に適していると考えられています。したがって、これらの結果は、HTSアプリケーションに対するこれらのホスホ-STATアッセイの堅牢性を実証する。

図3:U266B1細胞におけるホスホ-STAT1(Y701)変調の検出 96ウェル培養プレートに播種した細胞(200,000細胞/ウェル)を、RTで15分間(A)IFNα2bまたは(B)JAK阻害剤1のいずれかの濃度をRTで30分間処理し、次いで1nM(EC80)のIFNα2bでRTで15分間処理した。溶解後、溶解液を少容量の384ウェル白色プレートに移し、続いて抗体検出ミックスを添加した。プレートをRTで4時間インキュベートし、次いでTR-FRE互換リーダで読み取りを行った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IFN = インターフェロン;RT = 室温;JAK = ヤヌスキナーゼ;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図4:HeLa細胞におけるホスホ-STAT3(Y705)および総STAT3変調の検出。 96ウェル培養プレートで一晩培養した細胞(40,000細胞/ウェル)を、(A)IFNα2bをRTで20分間、または(B)JAK阻害剤1をRTで30分間、次いで1.5nMのIFNα2bでRTで20分間、濃度を上昇させて処理した。培地の除去および溶解に続いて、溶解液を少容量の384ウェル白色プレートに移し、続いて抗体検出ミックスを添加した。プレートをRTで4時間インキュベートし、次いでTR-FRE互換リーダで読み取りを行った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IFN = インターフェロン;RT = 室温;JAK = ヤヌスキナーゼ;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図5:U266B1細胞におけるホスホ-STAT4(Y693)変調の検出 96ウェル培養プレートに播種した細胞(400,000細胞/ウェル)を、(A)IFNα2bを37°Cで25分間、または(B)JAK阻害剤1をRTで30分間、次いで1nMのIFNα2bで37°Cで25分間、増加濃度で処理した。 培地の除去および溶解に続いて、溶解液を少容量の384ウェル白色プレートに移し、続いて抗体検出ミックスを添加した。プレートをRTで一晩インキュベートし、次いでTR-FRE互換リーダで読み取った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IFN = インターフェロン;RT = 室温;JAK = ヤヌスキナーゼ;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図6:A431細胞におけるホスホ-STAT5(Y694/Y699)および総STAT5変調の検出。 96ウェル培養プレートで一晩培養した細胞(75,000細胞/ウェル)を、RTで10分間、(A)EGFまたは(B)RTで15分間エルロチニブのいずれかの濃度を増加させ、次いでRTで10分間、73nMのEGFで処理した。培地の除去および溶解に続いて、溶解液を少容量の384ウェル白色プレートに移し、続いて抗体検出ミックスを添加した。プレートをRTで一晩インキュベートし、次いでTR-FRE互換リーダで読み取った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;EGF = 上皮成長因子;RT = 室温;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。
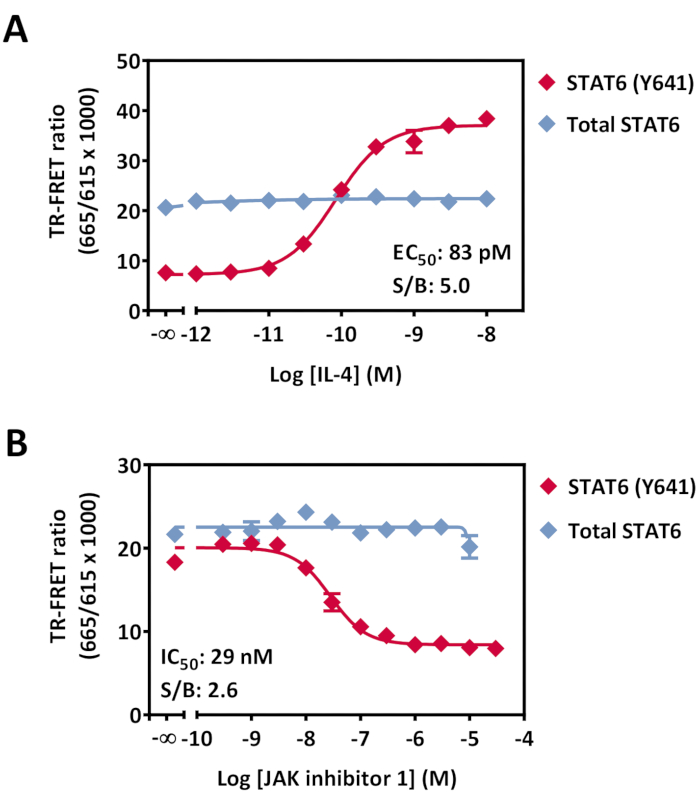
図7:HeLa細胞におけるホスホ-STAT6(Y641)および総STAT6変調の検出。 96ウェル培養プレートで一晩培養した細胞(40,000細胞/ウェル)を、RTで20分間、(A)IL-4または(B)JAK阻害剤1のいずれかの濃度をRTで30分間、次いでRTで20分間0.5nMのIL4で処理した。培地の除去および溶解に続いて、溶解液を少容量の384ウェル白色プレートに移し、続いて抗体検出ミックスを添加した。プレートをRTで4時間インキュベートし、次いでTR-FRE互換リーダで読み取りを行った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IL = インターロイキン;JAK = ヤヌスキナーゼ;RT = 室温;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図8:ワンプレートプロトコルによるU266B1細胞におけるホスホ-STAT4(Y693)刺激の検出。 少容量の384ウェル白色プレートに播種した細胞(160,000細胞/ウェル)を、直ちに37°Cで25分間、増加する濃度のIFNα2bで処理した。 溶解後、抗体検出ミックスを溶解液に直接添加した。プレートをRTで一晩インキュベートし、フラッシュランプまたはレーザー励起を使用してTR-FRE互換リーダーで読み取りました。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IFN = インターフェロン;RT = 室温;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図9:1プレートプロトコールによるHeLa細胞におけるホスホ-STAT6(Y641)刺激の検出。 少容量の384ウェル白色プレートに播種した細胞(80,000細胞/ウェル)を、RTで20分間、増加する濃度のIL-4で直ちに処理した。溶解後、抗体検出ミックスを溶解液に直接添加した。プレートをRTで4時間インキュベートし、次いでTR-FRE互換リーダで読み取りを行った。データは、アッセイポイント当たりの3連ウェルの平均として示されている。エラーバーは標準偏差を示す。一部のエラーバーはシンボルサイズよりも小さくなっています。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IL = インターロイキン;RT = 室温;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比。 この図の拡大版を表示するには、ここをクリックしてください。

図10:ホスホ-STAT1(Y701)およびホスホ-STAT3(Y705)アッセイのプレート内変動性試験。 (A)Phospho-STAT1アッセイ:浮遊細胞(200,000 U266B1細胞/ウェル)を、10nMのIFNα2bで15分間処理するか、無血清培地単独(低対照)のいずれかで処理した。(B)Phospho-STAT3アッセイ:接着細胞(20,000 HeLa細胞/ウェル)を5nMのIFNα2bで20分間、または無血清培地のみで処理した。両方のアッセイについて、TR−FRETシグナルを4時間のインキュベーション後に読み取った。略語:STAT =シグナルトランスデューサおよび転写の活性化剤;IFN = インターフェロン;TR-FRET = 時間分解フェルスター共鳴エネルギー移動;S/B = 信号/バックグラウンド比;CV = 変動係数。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ウェスタンブロッティングやELISAベースの方法などの従来のリンタンパク質分析方法と比較して、THUNDER TR-FRET細胞アッセイのワークフローはシンプルで高速で、少量のサンプル(15 μL)を使用し、384ウェルフォーマットのHTS用に設計されており、自動化に非常に適しています。アッセイプロトコルは柔軟性があり、中スループットおよび高スループットの両方のアプリケーションに容易に適合させることができます。アッセイは、2 プレート転送プロトコルまたは 1 384 ウェルプレートプロトコルのいずれかを使用して実行できます。2プレート転写プロトコルでは、細胞を1つの細胞培養プレートに播種、処理、および溶解し、続いて溶解物を別の白色検出プレート(ハーフエリア96ウェルまたは384ウェルプレート)に移して分析します。1-384ウェルプレートプロトコルでは、ワークフロー全体が同じウェルで行われ、液体移送ステップが不要になります。アッセイは、容量を比例的に減らすことで、1536ウェル形式に容易に適合させることができました。アッセイプロトコルに関係なく、調製する試薬溶液は3つしかなく、洗浄ステップはなく、アッセイは「添加のみ」のプロトコルに従って実行でき、最小限のハンズオン時間しか必要としません。
細胞ベースのアッセイを行う際の重要なステップは、細胞培養および処理条件の最適化です16。細胞数と処理条件の両方は、これらの重要なパラメータが細胞株ごとおよびリンタンパク質ごとに異なることが多いため、アッセイを実行する前に慎重な最適化が必要です。これらのパラメータの最適化により、アッセイウィンドウを最大化し、高いS/B比と低いウェル間変動係数で最適な性能を獲得し、結果の堅牢性と再現性を確保できます。細胞数、血清飢餓(適切な場合)、および刺激または阻害時間(室温または37°Cのいずれかで)は、細胞株および標的タンパク質ごとに最適化されるべきである。細胞数が高すぎたり低すぎたりすると、細胞内シグナル伝達経路の調節に悪影響を及ぼす可能性があります。接着細胞では40,000~80,000細胞/ウェル、浮遊細胞では100,000~200,000細胞/ウェルの細胞播種密度が、ほとんどの細胞株で一般的に許容されます。注目すべきは、刺激および阻害の最適な時間の長さは、細胞株および標的タンパク質間で、数分から数時間まで大きく異なる可能性がある。したがって、インキュベーション温度が標的タンパク質刺激の動態に影響を与えるため、最適な刺激および阻害インキュベーション時間を決定するために、理想的には室温および37°Cの両方で、時間経過研究を強く推奨する。
細胞ベースのアッセイのトラブルシューティングは、ワークフロー(細胞培養、細胞処理、溶解、およびタンパク質検出)に多くのステップが関係するため、困難で時間がかかる場合があります。これらのアッセイキットには、陽性対照溶解物が含まれる。これらの陽性対照溶解物および陰性対照(1x添加溶解バッファーのみ)をすべての実験で使用することが推奨される。適切なコントロールを使用すると、検出ステップ(誤った試薬調製および/またはアッセイの実行)または実験で使用された溶解物の品質のいずれかに問題をすばやく起因させることができるため、トラブルシューティングが容易になります。後者は、一般に、最適でない細胞状態の使用によるものである。
このプラットフォームのもう 1 つの利点は、異なるストリンジェンシーを持つ最適化された溶解バッファーのスイートを使用できることです。これにより、部分的細胞内分画から多かれ少なかれ不均一な溶解物を生成することができる。シグナル伝達タンパク質は様々な細胞内コンパートメントに位置し、STATタンパク質のように、コンパートメント間(例えば、細胞質と核の間)を往復するため、これは有用である。注目すべきは、リン酸化および総STAT1は、他のSTATタンパク質に使用される溶解緩衝液2とうまく検出できないため、溶解緩衝液1を使用する。対照的に、他の均質な方法は、単一の「普遍的な」溶解バッファーに依存しており、抗体との非特異的相互作用を作り出すことができるより複雑なサンプルを生成する。しかしながら、異なる溶解緩衝液の使用は、単一の溶解液サンプルからの複数のシグナル伝達タンパク質の分析を妨げる可能性がある。それにもかかわらず、異なる溶解バッファーで生成された溶解液を単一のプレート上で同時に試験して、平行経路分析を行うことができます。
結論として、この均質なTR-FRET細胞免疫測定プラットフォームに基づいてここに提示された方法は、細胞溶解物中の内因性リン酸化STAT1/3/4/5/6タンパク質および総STAT1/3/5/6の検出および定量を介してJAK/STATシグナル伝達をモニタリングするためのハイスループットの代替手段を提供する。これらのアッセイは、細胞処理後の特異的STATタンパク質のより包括的な分析、およびJAK/STATシグナル伝達経路の特異的および選択的モジュレーターのスクリーニングおよび特性評価のための新しいツールを提供します。そのシンプルさ、特異性、感度、再現性、および費用対効果を考えると、この新しいアッセイプラットフォームは、HTSアプリケーションのための学術的環境および産業研究所の両方で、従来のイムノアッセイに代わる魅力的な代替品です。
開示事項
競合する利益:ハイメ・パドロス、ミレイユ・カロン、ジュヌヴィエーヴ・シャテルは、この研究で使用されたサンダーTR-FRETアッセイキットを製造するBioAuxilium Researchの従業員です。さらに、Jaime PadrosとMireille CaronはBioAuxilium Researchの株主です。これは、データと資料の共有に関するすべてのJoVEポリシーに対する著者の遵守を変更するものではありません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
参考文献
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392(2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94(2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al. HTS assay validation. Assay Guidance Manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved