Method Article
בדיקות העברת אנרגיה תהודה Förster נפתר זמן למדידה של חלבונים STAT זרחן אנדוגני בתאים אנושיים
In This Article
Summary
פרוטוקולי בדיקה מבוססי תאים מבוססי-בסיס של Förster, שנפתרו בזמן, מתוארים עבור הכימות הפשוט, הספציפי, הרגיש והחזק של מתמר אותות זרחן אנדוגני ומפעיל של תמלול (STAT) 1/3/4/5/6 חלבונים בתאים ליסטים בפורמט של 384 בארות.
Abstract
מתמר האיתות יאנוס קינאז (JAK)/אותות ומפעיל מסלול איתות שעתוק (STAT) ממלא תפקיד מכריע בתיווך תגובות סלולריות לציטוקינים וגורמי גדילה. חלבונים STAT מופעלים על ידי טירוזין זרחן בתיווך בעיקר על ידי JAKs. ההפעלה החריגה של מסלולי איתות STAT מעורבת במחלות אנושיות רבות, במיוחד סרטן ותנאים הקשורים למערכת החיסון. לכן, היכולת לעקוב אחר זרחן חלבון STAT בתוך סביבת איתות התא המקומי חשובה הן למחקר אקדמי והן למחקר גילוי תרופות. פורמטי הבדיקה המסורתיים הזמינים לכימות חלבונים סטטיסטיים זרחניים כוללים סופג מערבי ובדיקת החיסון המקושרת לאנזימים (ELISA). שיטות הטרוגניות אלה הן עתירות עבודה, תפוקה נמוכה, ולעתים קרובות לא אמינות (ספציפיות) במקרה של סופג מערבי. שיטות הומוגניות (ללא כביסה) זמינות אך נשארות יקרות.
כאן, פרוטוקולים מפורטים מסופקים עבור המדידה הרגישה, החזקה והחסכונית בפורמט של 384 באר של רמות אנדוגניות של STAT1 זרחן (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) ו- STAT6 (Y641) בתאי ליסטאטים מתאי חסיד או השעיה באמצעות פלטפורמת העברת האנרגיה התהודה החדשה של Förster (TR-FRET). זרימת העבודה עבור הבדיקה הסלולרית היא פשוטה, מהירה ומיועדת להקרנה בתפוקה גבוהה (HTS). פרוטוקול הבדיקה גמיש, משתמש במדגם בנפח נמוך (15 μL), דורש רק שלב אחד של תוספת ריאגנט, וניתן להתאים אותו ליישומים בעלי תפוקה נמוכה ותפוקה גבוהה. כל אימונואסאי כריך phospho-STAT מאומת בתנאים אופטימליים עם אגוניסטים ומעכבים ידועים ומייצר את הפרמקולוגיה הצפויה וערכי Z'factor. מכיוון שבדיקות TR-FRET הן יחסיות ואינן דורשות צעדי כביסה, הן מספקות רבייה טובה בהרבה מגישות מסורתיות. יחד, חבילת בדיקות זו מספקת כלים חסכוניים חדשים לניתוח מקיף יותר של חלבוני STAT זרחניים ספציפיים לאחר טיפול בתאים והסינון ואפיון של אפננים ספציפיים וסלקטיביים של מסלול האיתות JAK / STAT.
Introduction
מסלול האיתות JAK/STAT ממלא תפקיד מרכזי בתיווך תגובות תאיות לציטוקינים מגוונים, אינטרפרונים, גורמי גדילה ומולקולות קשורות1,2. הכריכה של ליגנדים אלה לקולטנים ספציפיים של פני התא גורמת להפעלה של JAKs, אשר בתורו להפעיל חלבונים STAT על ידי זרחן של שאריות טירוזין ספציפיות. זרחן STAT גורם לדימריזציה שלהם וטרנסלוקציה לגרעין, שם הם מפעילים את השפעתם על שעתוק של גנים יעד מוסדר. משפחת STAT מורכבת משבעה חברים: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b ו- STAT6. החברים ממלאים תפקיד מורכב וחיוני בוויסות תהליכי התאים הפיזיולוגיים, כולל התפשטות, בידול, אפופטוזיס, אנגיוגנזה ווויסות מערכת החיסון. ההפעלה החריגה של מסלולי איתות STAT מעורבת במחלות אנושיות רבות, במיוחד סרטן ותנאים הקשורים למערכת החיסון3,4. לכן, היכולת להעריך זרחן חלבון STAT בתוך סביבת איתות התאים המקומיים חשובה הן למחקר אקדמי והן למחקר גילוי תרופות.
עד כה, השיטות הקונבנציונליות המשמשות למדידת רמות החלבון הזרחן התאי, כולל STATs, מבוססות נוגדנים וכוללות סופג מערבי, ELISA וציטומטריית זרחן. שיטות הטרוגניות אלה הן עתירות עבודה, גוזלות זמן רב, מועדות לשגיאות, בעלות תפוקה נמוכה ולעתים קרובות אינן אמינות (לדוגמה, בעיות ספציפיות) במקרה של סופג מערבי5. לעומת זאת, בדיקות הומוגניות דורשות פחות צעדים ניסיוניים, משתמשות בנפחי מדגם קטנים יותר, והן מקובלות על HTS. ישנן חמש פלטפורמות אימונואסאי מבוססות תאים הומוגניות הזמינות מסחרית שניתן להשתמש בהן לניטור כמותי של זרחן תלוי JAK של STATs בליסטים של תאים: SureFire, HTRF, LANCE, LanthaScreen ו- Lumit. לכל אחת מהפלטפורמות הללו יש יתרונות וחסרונות.
SureFire מבוסס על טכנולוגיית תקשור חמצן זוהרת, המשתמשת בחרוזי תורם ומקבל מצופים ללכוד באופן ספציפי זוג נוגדנים, שאחד מהם הוא biotinylated. בנוכחות חלבון זרחן, שני הנוגדנים מביאים את התורם ואת חרוזי הקבלה לקרבה, ומאפשרים יצירת אות chemiluminescent6. למרות שהיא רב-תכליתית ורגישה, טכנולוגיה זו יקרה, מושפעת מהביוטין במדיום התרבותי, רגישה מאוד לטמפרטורת הסביבה ולאור, ודורשת קורא מיוחד לגילוי. HTRF ו- LANCE מבוססים שניהם על טכנולוגיית TR-FRET המשתמשת במתחמי יונים לנתניד זוהרים לכל החיים הארוכים (יורופיום או טרביום כלאטים, או קריפטט יורופיום) כמולקולות התורם ופלואורופורים אדומים בהרבה כמולקולות המקבל7. כאשר שני נוגדנים ספציפיים לחלבון המסומנים במולקולות תורמות או קבליות מובאים לקרבה, FRET מתרחש, מה שגורם לעלייה בפלואורסצנטיות של מקבל וירידה בפלואורסצנטיות התורם. אותות פלואורסצנטיים ארוכי טווח אלה ניתנים למדידה באופן שנפתר בזמן וביחס כדי להפחית את הפרעות הבדיקה ולהגדיל את איכות הנתונים. יתרונות אחרים של TR-FRET הם שהוא אינו רגיש לאור, מאפשר קריאות חוזרות ונשנות ומפגין יציבות איתות ארוכה. בעוד ש- TR-FRET מיושם באופן נרחב ב- HTS בשל הרב-תכליתיות, הרגישות והחוסן הגבוה שלו, כל פלטפורמות הבדיקה המסחריות המבוססות על TR-FRET יקרות, ובכך מונעות את אימוצו הרחב במעבדות אקדמיות ותעשייתיות קטנות. בדיקת LanthaScreen משתמשת גם בקריאה מבוססת TR-FRET אך מסתמכת על קו תאים מהונדס של U2OS המבטא ביציבות חלבון פלואורסצנטי ירוק (GFP)-STAT1 חלבון היתוך בשילוב עם נוגדן STAT1 ספציפי לזרחן טרביום. בנוסף להיותו מוגבל במונחים של בחירה של חלבוני איתות, שיטה זו דורשת רכישת קווי תאים transfected יקר, הפחתת הישימות שלה והגדלת האפשרות של ממצאים ניסיוניים. Lumit היא פלטפורמת אימונואסאי ביו-לומינציה גנרית המשתמשת בנוגדנים משניים (אנטי עכבר ואנטי ארנב) המסומנים כימית עם יחידות המשנה הקטנות והגדולות של NanoBit של NanoLuc Luciferase9. קשירת שני נוגדנים עיקריים לחלבון המטרה מביאה את הנוגדנים המשניים לקרבה ליצירת אנזים פעיל המייצר אות זוהר. בעוד זוהר הוא בדרך כלל קריאה רגישה וחזקה, הדרישה לנוגדנים ראשוניים המועלים בשני מינים שונים מגבילה את האפשרויות לתכנון הבדיקה. בנוסף, השימוש בנוגדנים משניים במטריצות מדגם מורכבות עשוי להיות מועד להפרעות בדיקה.
לפיכך, עדיין קיים צורך בפלטפורמת בדיקה אמינה, מהירה אך משתלמת המבוססת על תאים למדידת חלבונים בודדים זרחניים וסה"כ STAT באופן התואם ל- HTS. כדי לענות על צורך זה, פותחה פלטפורמת אימונואסאי חדשה המבוססת על תפוקה גבוהה המבוססת על טכנולוגיית TR-FRET משופרת (THUNDER) ונועדה לאפשר מדידה פשוטה, רגישה, חזקה וחסכונית של חלבונים תאיים אנדוגניים (זרחניים או סה"כ) בליסטים של תאים. היתרונות של טכנולוגיה זו נובעים משילוב של זוג FRET תורם/מקבל המציג תאימות ספקטרלית יוצאת דופן ואות TR-FRET, נוגדנים מאומתים בקפדנות ומאגרי תמוגה ממוטבים. בדיקות אלה מעוצבות כהודעות חיסוניות של כריך ומשתמשות בזרימת עבודה פשוטה בת שלושה שלבים (איור 1). תאים מטופלים תחילה כדי לווסת זרחן חלבון ולאחר מכן lysed עם מאגר תמוגה ספציפי המסופק בערכה. חלבון הסטטיסטיקה הממוקד או הכולל של ה-STAT בליסט התא מזוהה בשלב חיבור ריאגנט ודלילה יחיד עם זוג נוגדנים בעלי תווית פלואורופורית המזהים אפיטופים ברורים בחלבון היעד (איור 2). נוגדן אחד מסומן עם תורם כלאט יורופיום (Eu-Ab1), ואילו הנוגדן השני מתויג עם פלואורופור מקבל אדום בהרבה (FR-Ab2). שני הנוגדנים המסומנים נקשרים לחלבון בתמיסה, ומביאים את שתי התוויות לקרבה. עירור של התורם Europium chelate ב 320 או 340 ננומטר מפעיל FRET למקובל, אשר פולט אות TR-FRET ארוך טווח ב 665 ננומטר פרופורציונלי לריכוז של חלבון היעד (זרחן או סה"כ) בתא lysate.

איור 1: זרימת עבודה של בדיקת TR-FRET. זרימת העבודה מורכבת משלושה שלבים: טיפול בתאים, תמוגה לתאים וזיהוי חלבונים באמצעות TR-FRET. בפרוטוקול הבדיקה של שתי הצלחות, הליסטים מועברים ללוחית זיהוי לבנה של 384 בארות, בעוד שבפרוטוקול של צלחת אחת, כל השלבים מתנהלים באותה לוחית זיהוי לבנה של 384 באר (פרוטוקול All-in-One-well). ללא קשר לפרוטוקול הבדיקה המשמש, זיהוי חלבונים מתבצע באותו נפח כולל (20 μL לבאר). קיצור: TR-FRET = העברת אנרגיית תהודה של פורסטר שנפתרה בזמן. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: עיקרון אימונואסאי כריך TR-FRET. נוגדן אחד מסומן עם תורם כלאט יורופיום (Eu-Ab1) והשני עם מקבל הפלואורופור הקטן והאדום בהרבה (FR-Ab2). שני הנוגדנים המסומנים נקשרים במיוחד לאפיטופים מובחנים על חלבון המטרה (זרחן או סה"כ) בליסט התא, מה שמביא את שני הפלורופורים לקרבה. עירור של התורם Europium chelate ב 320 או 340 ננומטר מפעיל FRET מהתורם למולקולות המקבל, אשר בתורו פולטים אות ב 665 ננומטר. אות זה הוא פרופורציונלי לריכוז החלבון בליסט התא. בהיעדר חלבון היעד הספציפי, פלואורופורים התורם והמקבל רחוקים מדי זה מזה מכדי ש-FRET תתרחש. קיצורים: FRET = העברת אנרגיה תהודה Förster; TR-FRET = FRET שנפתר בזמן; Ab = נוגדן; FR = אדום רחוק; האיחוד האירופי - כלאט יורופיום; P = זרחן. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כאן, פרוטוקולים מפורטים מסופקים למדידה, בפורמט של 384 בארות, את הרמות התאיות של STAT1 זרחן (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) ו STAT6 (Y641), יחד עם סך הכל STAT1, STAT3, STAT5, ו STAT6, בתא lysates מתאי דבק או השעיה באמצעות פלטפורמת רעם TR-FRET. פרוטוקולים אלה מגדירים שלבים לטיפול בתאים, תמוגה וזיהוי חלבון יעד מבוסס TR-FRET באמצעות פרוטוקול העברה של שתי לוחות או פרוטוקול All-in-one-well של צלחת אחת. בדיקות מבוססות תאים אלה מוחלות לקביעת הפרופיל הפרמקולוגי של מפעילים ומעכבים ידועים של מסלול JAK / STAT. החוסן וההתאמה של בדיקות נבחרות עבור HTS מודגמות. לבסוף, ניסויים מרכזיים עבור אופטימיזציה לבדיקה נדונים, יחד עם המלצות לפתרון בעיות בדיקה.
Protocol
1. תרבות התא
- שמור על תאים בחממה ובתרבית לחים של 37 °C /5% CO2 עם 10% סרום בקר עוברי (FBS) (תאי HeLa ו- A431) או RPMI בתוספת 15% FBS (תאי U266B1). תרבית את התאים עד שהם מגיעים 70-80% מפגש, ולאחר מכן trypsinize אותם לעבור או להשתמש בהם עבור בדיקות.
הערה: מדיה תרבותית הכילה אדום פנול. לא נערכה רעב בסרום עבור כל קו תאים לפני ביצוע הבדיקות.
2. גירוי או טיטר מעכב באמצעות פרוטוקול בדיקה שתי צלחת עם תאים דבקים
הערה: הליך זה מתאר כיצד לקבוע את עוצמת הממריץ או המעכב על ידי יצירת עקומת תגובת ריכוז מסדרת דילול של תרכובת הבדיקה.
- זריעת תאים
- חלוקת 50 μL של תאים בצפיפות ממוטבת מראש (40,000 תאי HeLa / טוב עבור STAT3 ו STAT6; 75,000 A431 תאים / טוב עבור STAT5) לתוך צלחת 96-well רקמות שטופלו בתרבית במדיום התרבות המתאים. דגירה לילה ב 37 °C /5% CO2.
הערה: יש לקבוע את צפיפות התאים האופטימלית ואת זמן הדגירה התרבותי.
- חלוקת 50 μL של תאים בצפיפות ממוטבת מראש (40,000 תאי HeLa / טוב עבור STAT3 ו STAT6; 75,000 A431 תאים / טוב עבור STAT5) לתוך צלחת 96-well רקמות שטופלו בתרבית במדיום התרבות המתאים. דגירה לילה ב 37 °C /5% CO2.
- דילול של תרכובות בדיקה
- הכן סדרת דילול ביניים 2x של תרכובות בדיקה(ים) על ידי דילול סדרתי של תרכובות (ים) (דילול מרווח חצי יומן) על פני 12 בארות של צלחת פוליפרופילן 96-well למדיום ללא סרום.
הערה: מומלץ לנהל עקומת ריכוז-תגובה של מרווח של 12 נקודות וחצי יומן לפחות בשכפול להערכה מדויקת של EC50 או IC50. - לחלופין, עבור תרכובות בדיקה הידרופוביות, דימתילסולפוקסיד (DMSO) מסיסות, בצע את הדילול הראשוני ב-100% DMSO ולאחר מכן לדלל את סדרת הדילול המורכבת למדיום נטול סרום.
הערה: יש להקים את עמידות הבדיקה ל- DMSO לפני ביצוע תרכובת בדיקה ברכב DMSO. חשוב לשמור על ריכוזי ממסים שווים בין תאים מטופלים ולא מטופלים. בנוסף, בעת בדיקת דילול סדרתי של תרכובות, ריכוזי הממס תמיד צריך להישאר קבוע על פני סדרת הדילול.
- הכן סדרת דילול ביניים 2x של תרכובות בדיקה(ים) על ידי דילול סדרתי של תרכובות (ים) (דילול מרווח חצי יומן) על פני 12 בארות של צלחת פוליפרופילן 96-well למדיום ללא סרום.
- טיפול בתאים
- לגירוי תאים, להוסיף 50 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכיל את הממריץ (2x).
- דגירה לזמן ממוטב מראש בטמפרטורת החדר (RT) או 37 °C (אינטרפרון (IFN) α2b / 20 דקות ב RT עבור STAT3; גורם גדילה אפידרמלי (EGF)/10 דקות ב RT עבור STAT5; אינטרלוקין (IL)-4/20 דקות ב RT עבור STAT6). המשך לסעיף 2.4.
הערה: יש לקבוע טמפרטורת דגירה אופטימלית. - לעיכוב תאים, הוסיפו 25 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכילים את המעכב (4x).
- דגירה לזמן ממוטב מראש ב RT או 37 °C (מעכב JAK 1/30 דקות ב RT עבור STAT3 ו STAT6; Erlotinib/15 דקות ב RT עבור STAT5).
- הוסף 25 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכיל את הממריץ (4x) ב EC80 שלה.
- דגירה לזמן ממוטב מראש ב RT או 37 °C (אותם תנאים כמו לשלב 2.3.2).
- תמוגת תאים
- הכן את מאגר תמוגה 1x מסוים של הערכה כפי שצוין על-ידי היצרן.
הערה: חובה להשלים את מאגר תמוגה 1x עם קוקטייל מעכבי פוספטאז 100x מדולל לריכוז סופי של 1x. מאגר הליזה המשלים 1x מכיל 1 מ"מ נתרן פלואוריד, 2 מ"מ נתרן אורתוונדאט, ו 2 מ"מ בטא-גליצריפוספט. מעכבי פוספטאז אחרים אינם נדרשים ויש להימנע מהם. מאגרי תמוגה ומעכבי פוספטאז שאינם אלה הכלולים בערכה אינם מומלצים מכיוון שהם עשויים להכיל מרכיבים שעלולים להפריע למדידה. - הסר בזהירות והשלך את מדיום תרבית התאים על ידי שאיפה לסופר-נרטיב.
- מיד להוסיף 50 μL של 1x תוספת תמוגה חוצץ.
הערה: נפח מאגר תמוגה (25-50 μL) עשוי להיות ממוטב. - דגירה במשך 30 דקות ב RT תחת טלטול (שייקר צלחת מסלולית להגדיר ב 400 סל"ד; עצבנות מתונה).
הערה: זמן הדגירה של תמוגה (30-60 דקות) עשוי להיות ממוטב. Lysates יכול לשמש באופן מיידי לגילוי חלבון היעד או קפוא ב -80 °C (80 °F).
- הכן את מאגר תמוגה 1x מסוים של הערכה כפי שצוין על-ידי היצרן.
- זיהוי TR-FRET
- הכן את תערובת זיהוי הנוגדנים 4x במאגר זיהוי 1x כפי שצוין על ידי היצרן.
- בשלב העברה זה, בזהירות pipette 15 μL של ליסט התא מצלחת התרבות 96-well לבאר של לבן, בנפח נמוך 384-well microplate.
- הוסף 15 μL של Lysate בקרה חיובית ו 15 μL של מאגר תמוגה 1x (שליטה שלילית) כדי להפריד בארות בדיקה.
- הוסף 5 μL של תערובת זיהוי נוגדנים 4x (Eu-Ab1 / FR-Ab2 לאיתור חלבון הזרחן או Eu-Ab3 / FR-Ab4 לאיתור החלבון הכולל) לכל אחת מבארות הבדיקה.
- מכסים את הצלחת עם אטם צלחת ודגור במשך 1 שעות עד לילה ב RT, בהתאם לבדיקה (ראה את גיליון הנתונים הטכניים המתאימים).
הערה: יש למטב את זמן הקריאה האופטימלי עבור כל בדיקה וקו תא. הצלחת ניתן לקרוא מספר פעמים ללא השפעה שלילית על ביצועי הבדיקה. - הסר את אטם לוחית ההדבקה וקרא את הצלחת על קורא מיקרו-לוחית תואם TR-FRET.
הערה: פלואורומטרים מבוססי מסנן מומלצים, אם כי ניתן להשתמש בכמה מכשירים מונוכרומטיים. ודא שמודול הראייה המתאים (מסננים ושיקוף) עבור TR-FRET מותקן. השתמש באורך גל עירור של 320 או 340 ננומטר כדי לרגש את כלאט יורופיום. קרא בדיקות הן ב 615 ננומטר (או 620 ננומטר) ו 665 ננומטר כדי לזהות הן את הפליטה מן התורם Europium ואת פלואורופור המקבל, בהתאמה. הגדרות המכשיר יהיו תלויות בקורא המסוים. הנתונים המוצגים כאן הושגו באמצעות עירור מבוסס מנורה, עיכוב של 90 μs, זמן אינטגרציה של 300 μs, ו -100 הבזקים לבאר. בדיקת הפוספו-STAT4, לעומת זאת, נקראה באמצעות עירור לייזר כדי ליצור יחסי אות-לרקע גבוהים יותר (S/B).
3. גירוי או טיטר מעכב באמצעות פרוטוקול בדיקה שתי צלחת עם תאי השעיה
- דילול של תרכובות בדיקה
- הכן סדרות דילול ביניים 2x של תרכובות בדיקה כמתואר בשלבים 2.2.1 ו 2.2.2.2.
- זריעת תאים וטיפול
- חלק 20 μL של תאים בצפיפות ממוטבת מראש (200,000 U266B1 תאים / טוב עבור STAT1; 400,000 U266B1 תאים / טוב עבור STAT4) לתוך צלחת 96-well-well רקמות שטופלו בתרבית רקמות במדיום התרבות המתאים. יש להמשיך ישירות לטיפול בתאים או לדגור 2-4 שעות בטמפרטורה של 37 °C (5°C), 5% CO2.
הערה: שלב זה צריך להיות ממוטב עבור סוגי תאים שונים. - לגירוי תאים, הוסיפו 20 μL של מדיום ללא סרום בלבד (תאים לא מטופלים) או המכילים את הממריץ (2x).
- דגירה לזמן ממוטב מראש ב RT או 37 °C (IFNα2b / 15 דקות ב RT עבור STAT1; IFNα2b/25 דקות ב 37 °C (15 °F) עבור STAT4). המשך לסעיף 3.3.
הערה: יש לקבוע טמפרטורת דגירה אופטימלית. - לעיכוב תאים, להוסיף 10 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכיל את המעכב (4x).
- דגירה לזמן ממוטב מראש ב RT או 37 °C (מעכב JAK 1/30 דקות ב RT עבור STAT1 ו STAT4).
- הוסף 10 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכיל את הממריץ (4x) ב EC80 שלה.
- יש לדגור לזמן הממוטב מראש ב-RT או ב-37°C (אותם תנאים כמו לשלב 3.2.3).
- חלק 20 μL של תאים בצפיפות ממוטבת מראש (200,000 U266B1 תאים / טוב עבור STAT1; 400,000 U266B1 תאים / טוב עבור STAT4) לתוך צלחת 96-well-well רקמות שטופלו בתרבית רקמות במדיום התרבות המתאים. יש להמשיך ישירות לטיפול בתאים או לדגור 2-4 שעות בטמפרטורה של 37 °C (5°C), 5% CO2.
- תמוגת תאים
- הכן את מאגר תמוגה 5x תוספת ספציפי של הערכה כפי שצוין על-ידי היצרן.
הערה: חובה להשלים את מאגר תמוגה 5x עם קוקטייל מעכבי פוספטאז 100x מדולל לריכוז סופי של 5x. מאגר תמוגה 5x בתוספת מכיל 5 מ"מ נתרן פלואוריד, 10 מ"מ נתרן אורתוונדאט, ו 10 מ"מ בטא-גליצריפוספט. מעכבי פוספטאז אחרים אינם נדרשים ויש להימנע מהם. - הוסף 10 μL של 5x בתוספת מאגר תמוגה.
- דגירה במשך 30 דקות ב RT תחת טלטול (שייקר צלחת מסלולית להגדיר ב 400 סל"ד; עצבנות מתונה).
הערה: זמן הדגירה של תמוגה (30-60 דקות) עשוי להיות ממוטב. Lysates יכול לשמש באופן מיידי לגילוי חלבון היעד או קפוא ב -80 °C (80 °F).
- הכן את מאגר תמוגה 5x תוספת ספציפי של הערכה כפי שצוין על-ידי היצרן.
- זיהוי TR-FRET
- בעקבות תמוגת התאים, בצע את שלב הזיהוי של TR-FRET כמתואר בסעיף 2.5 עבור פרוטוקול הבדיקה של 2 לוחות עבור תאים דבקים.
4. טיטרציה ממריץ באמצעות פרוטוקול בדיקה צלחת אחת עם תאים חסידים או השעיה
- דילול של תרכובות בדיקה
- הכן סדרת דילול ביניים של תרכובות בדיקה (ים) ב 3x על ידי דילול סדרתי של תרכובות (ים) (דילול מרווח חצי יומן) על פני 12 בארות של צלחת פוליפרופילן 96-well לתוך מדיום ללא סרום.
- זריעת תאים וטיפול
- חלוקת 8 μL של תאים בצפיפות ממוטבת מראש (160,000 U266B1 תאים / טוב עבור STAT4; 80,000 תאי HeLa / טוב עבור STAT6), במדיום התרבות המתאים ללא סרום, לתוך צלחת בדיקה לבנה, בנפח נמוך 384well. יש להמשיך ישירות לטיפול בתאים או לדגור 2-4 שעות בטמפרטורה של 37 °C (5°C), 5% CO2.
הערה: הדרישה לתקופת דגירה של תרבית תאים לפני הטיפול צריכה להיקבע עבור סוגי תאים שונים. - לגירוי תאים, להוסיף 4 μL של מדיום ללא סרום לבד (תאים לא מטופלים) או המכיל את הממריץ (3x).
- דגירה לזמן ממוטב מראש בטמפרטורת החדר או 37 °C (IFNα2b /25 דקות ב 37°C עבור STAT4; IL-4/20 דקות ב 37°C עבור STAT6). המשך לסעיף 4.3.
- חלוקת 8 μL של תאים בצפיפות ממוטבת מראש (160,000 U266B1 תאים / טוב עבור STAT4; 80,000 תאי HeLa / טוב עבור STAT6), במדיום התרבות המתאים ללא סרום, לתוך צלחת בדיקה לבנה, בנפח נמוך 384well. יש להמשיך ישירות לטיפול בתאים או לדגור 2-4 שעות בטמפרטורה של 37 °C (5°C), 5% CO2.
- תמוגת תאים
- הכן את מאגר תמוגה 5x תוספת ספציפי של הערכה כפי שצוין על-ידי היצרן.
הערה: חובה להשלים את מאגר תמוגה 5x עם קוקטייל מעכבי פוספטאז 100x מדולל לריכוז סופי של 5x. - הוסף 3 μL של מאגר תמוגה 5x בתוספת.
- דגירה במשך 30 דקות ב RT תחת טלטול (שייקר צלחת מסלולית ב 400 סל"ד).
הערה: זמן הדגירה של תמוגה (30-60 דקות) עשוי להיות ממוטב. Lysates ניתן להשתמש באופן מיידי או קפוא ב 80 °C (80 °F).
- הכן את מאגר תמוגה 5x תוספת ספציפי של הערכה כפי שצוין על-ידי היצרן.
- זיהוי TR-FRET
- הוסף 15 μL של שליטה חיובית Lysate (לא מדולל) ו 15 μL של 1x בתוספת מאגר תמוגה (שליטה שלילית) כדי להפריד בארות בדיקה.
- הוסיפו 5 μL של תערובת זיהוי נוגדנים 4x (Eu-Ab1/FR-Ab2 לחלבון הזרחן או Eu-Ab3-/FR-Ab4 עבור החלבון הכולל) שהוכנו במאגר זיהוי 1x לכל אחת מבארות הבדיקה.
- מכסים את הצלחת עם אטם צלחת ודגור במשך 1 שעות עד לילה ב RT, בהתאם לבדיקה.
הערה: יש למטב את זמן הקריאה האופטימלי עבור כל בדיקה וקו תא. הצלחת ניתן לקרוא מספר פעמים ללא השפעה שלילית על ביצועי הבדיקה. - הסר את אטם צלחת דבק. קרא את הלוחית על קורא מיקרופלט תואם TR-FRET.
5. ניתוח נתונים
- חשב את יחס TR-FRET עבור כל באר באמצעות הנוסחה הבאה (1):
 (1)
(1)
הערה: מאחר שאות TR-FRET נקרא במצב שנפתר בזמן, בדרך כלל אין צורך בחיסור רקע. אם מתבצע חיסור ברקע, השתמש בבארות נטולות התאים המכילות את מאגר תמוגה 1x (בקרה שלילית) לחיסור ברקע. קבע את יחס TR-FRET הממוצע מהבארות נטולות התאים ולאחר מכן הפחת ערך זה מיחס TR-FRET של כל באר. - עבור עקומות תגובת ריכוז, לנתח את הנתונים על פי רגרסיה לא ליניארית באמצעות משוואה לוגיסטית 4 פרמטרים (עקומת מינון-תגובה sigmoidal עם שיפוע משתנה) ושקלול נתונים 1/Y2 כדי ליצור ערכי EC50 או IC50 .
- לניסוי גורם Z, נתחו את הנתונים לפי הנוסחה הבאה (2)10
 (2)
(2)
כאשר μ σ הם הערכים הממוצעים וחריגות התקן עבור השליטה החיובית (p; תאים מגורים) ושליטה שלילית (n; תאים לא מטופלים), בהתאמה.
תוצאות
כל בדיקת רעם TR-FRET אומתה מבחינה פרמקולוגית על ידי טיפול בתאי דבק (HeLa או A431) או השעיה (U266B1) עם מפעילים או מעכבים ספציפיים למסלול JAK / STAT ולאחר מכן מדידת רמות של STATs ספציפיים זרחן וסה"כ, כאשר ישים. הבדיקות נערכו בפורמט של 384 בארות באמצעות פרוטוקול ההעברה של שתי הצלחות ותנאי בדיקה ממוטבים מראש. איור 3, איור 4, איור 5, איור 6 ואיור 7 מסכמים עקומות ייצוגיות של תגובת ריכוז שהושגו עבור כל בדיקות הסטטיסטיקה. בסך הכל, כל עקומות תגובת הריכוז הממריצים והמעכבים עבור בדיקות הפוספו-STAT הראו אותות TR-FRET חזקים, טווחים דינמיים רחבים, מקדם בין-טוב נמוך של וריאציה (בדרך כלל ≤5%), ויחסי S/B מקובלים. ערכי EC50 ו- IC50 המדווחים כאן נמצאים בטווח הערכים הצפויים.
הטיפול בתאים עם מפעילי JAK IFNα2b (phospho-STAT1, phospho-STAT3 ו phospho-STAT4), IL-4 (phospho-STAT6) ו- EGF (phospho-STAT5) הראה את העלייה הצפויה תלוית הריכוז בזרחן STAT בשאריות טירוזין ספציפיות, בעוד שחלבוני הסטטיסטיקה הכוללים המתאימים (STAT1, STAT3, STAT5 ו- STAT6) נותרו יציבים (איור 3, איור 4, איור 5, איור 6 ואיור 7 לוח א'). ירידה האות (פחות מ 20%) נצפתה עבור סך STAT5 עם הגדלת STAT5 זרחן צפוי והוא בשל מכשול סטרי, שבו זרחן של STAT5 מעכב את הכריכה של אחד משני נוגדני STAT5 נגד סך הכל STAT5 לאנטיגן שלה. ערכי EC50 היו בטווח תת-ננומולרי עבור IFNα2b ו- IL-4 (0.083 עד 0.47 nM) ובטווח הננו-מולרי הנמוך עבור EGF (12 nM). ערכים אלה עולים בקנה אחד עם נתונים שפורסמו6,11.
כדי לאשר כי האות המושרה על ידי המפעילים היה מתווך על ידי הפעלה של קולטנים אנדוגניים, תאים טופלו מראש עם ריכוזים הולכים וגדלים של מעכב JAK 1 (מעכב JAK פאן) או Erlotinib (מעכב טירוזין קינאז EGFR) לפני גירוי תת-כימי (EC80) עם מפעילי STAT. כצפוי, הן מעכב JAK 1 והן Erlotinib עיכבו את רמות הפוספו-STAT המתאימות באופן תלוי ריכוז, עם ערכי IC50 הנעים בין הננומולאר הנמוך לבין הטווח הננו-מולרי הגבוה עבור מעכב JAK 1 (29-759 ננומטר) ובטווח הננו-מולקולרי הנמוך עבור ארלוטיניב (10 ננומטר) (איור 3, איור 4, איור 5, איור 6 ואיור 7, לוח ב'). ערכי IC50 עקביים עם נתונים שפורסמו11,12,13. כמו במקרה של ניסויי גירוי, רמות הסטטיסטיקה הכוללת המתאימה לא הושפעו מאף אחד מהטיפולים. יחד, תוצאות אלה ממחישות את הספציפיות של כל בדיקה עבור חלבון STAT היעד האנדוגני שלה (זרחן או סה"כ) ואת יכולתם פרופיל מפעילים או מעכבים המציגים מגוון של עוצמות.
בדיקות שבהן כל זרימת העבודה (טיפול בתאים, תמוגה וזיהוי חלבונים) מתבצעת בבאר אחת של צלחת של 384 באר ללא שלב העברה מתאימות יותר ל- HTS. בהתאם לכך, בדיקות הפוספו-STAT4 והפוספו-STAT6 בוצעו באמצעות פרוטוקול צלחת אחת. נתונים מייצגים המתקבלים בתנאים ממוטבים מסוכמים באיור 8 ובאיור 9. גירוי של STAT4 זרחן על ידי IFNα2b בקו תא השעיה (U266B1; איור 8) או STAT6 זרחן על ידי IL-4 בקו תא חסיד (HeLa; איור 9) הושג עם יחסי S/B מקובלים וערכי EC50 התואמים לאלה שהושגו באמצעות פרוטוקול שתי הלוחות. נתונים אלה מראים כי בדיקות phospho-STAT ניתן להתאים בהצלחה מפרוטוקול העברה של שתי צלחת לפרוטוקול All-in-One-well של צלחת אחת.
גורם Z'-factor משמש בדרך כלל בקהילת HTS להערכת ההתאמה והחוסן של בדיקה עבור HTS10. כדי לאמת עוד יותר את בדיקות הפוספו-STAT, מחקרי Z'-factor ראשוניים נערכו באופן ידני באמצעות פרוטוקול שתי הלוחות. כדי להעריך את יציבות הבדיקה, צלחות נקראו בעקבות דגירה של 4 שעות ודגרה לילית. התוצאות שהושגו עבור בדיקות הפוספו-STAT1 והפוספו-STAT3, באמצעות קו תא השעיה (U266B1) או קו תא דבק (HeLa), בהתאמה, מסוכמות באיור 10. ערכי גורם Z מחושבים היו 0.85 עבור זרחן-STAT1 ו 0.79 עבור זרחן-STAT3. לאחר הדגירה הלילית, ערכי ה-Z'-factor נותרו יציבים (0.83 עבור זרחן-STAT1 ו-0.78 עבור זרחן-STAT3). ערכי Z'-factor דומים הושגו עבור בדיקות זרחן-STAT אחרות (STAT4: 0.79; STAT5: 0.78; STAT6: 0.63). בדיקה מבוססת תאים עם גורם Z'factor ≥ 0.40 נחשבת מתאימה ל- HTS15. בהתאם לכך, תוצאות אלה ממחישות את החוסן של בדיקות זרחן-STAT אלה עבור יישומי HTS.

איור 3: זיהוי אפנון זרחן-STAT1 (Y701) בתאי U266B1. תאים (200,000 תאים/טוב) שנזרעו בצלחת תרבית של 96 בארות טופלו בריכוזים הולכים וגדלים של כל אחד (A) IFNα2b במשך 15 דקות ב- RT או (B) מעכב JAK 1 במשך 30 דקות ב- RT, ולאחר מכן עם 1 ננומטר (EC80) של IFNα2b במשך 15 דקות ב RT או (B) מעכב JAK 1 במשך 30 דקות ב RT, ולאחר מכן עם 1 nm (EC80) של IFNα2b במשך 15 דקות ב RT. בעקבות תמוגה, lysates הועברו צלחת לבנה בנפח נמוך 384-well, ואחריו תוספת של תערובת זיהוי נוגדנים. הצלחת דוגרה במשך 4 שעות ב- RT ולאחר מכן נקראה על קורא תואם TR- FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IFN = אינטרפרון; RT = טמפרטורת החדר; JAK = יאנוס קינאז; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: זיהוי זרחן-STAT3 (Y705) ואפנון STAT3 כולל בתאי HeLa. תאים (40,000 תאים/טוב) בתרבית לילה בצלחת תרבית של 96 באר טופלו בריכוזים הולכים וגדלים של (A) IFNα2b במשך 20 דקות ב- RT או (B) מעכב JAK 1 במשך 30 דקות ב- RT ואז עם 1.5 ננומטר של IFNα2b למשך 20 דקות ב- RT. לאחר הסרת מדיה lysis, lysates הועברו צלחת לבנה בנפח נמוך 384-well, ואחריו תוספת של תערובת זיהוי נוגדנים. הצלחת דוגרה במשך 4 שעות ב- RT ולאחר מכן נקראה על קורא תואם TR- FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IFN = אינטרפרון; RT = טמפרטורת החדר; JAK = יאנוס קינאז; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: זיהוי אפנון פוספו-STAT4 (Y693) בתאי U266B1. תאים (400,000 תאים/טוב) שנזרעו בלוח תרבית של 96 בארות טופלו בריכוזים הולכים וגדלים של (A) IFNα2b במשך 25 דקות ב 37 °C (37 °C או (B) מעכב JAK 1 במשך 30 דקות ב RT, ולאחר מכן עם 1 ננומטר של IFNα2b במשך 25 דקות ב 37 °C (37 °C). לאחר הסרת מדיה lysis, lysates הועברו צלחת לבנה בנפח נמוך 384-well, ואחריו תוספת של תערובת זיהוי נוגדנים. הצלחת דוגרה בן לילה ב- RT ולאחר מכן נקראה על קורא תואם TR-FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IFN = אינטרפרון; RT = טמפרטורת החדר; JAK = יאנוס קינאז; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: זיהוי פוספו-STAT5 (Y694/Y699) ואפנון STAT5 כולל בתאי A431. תאים (75,000 תאים /טוב) בתרבית לילה בצלחת תרבית של 96 באר טופלו בריכוזים הולכים וגדלים של או (A) EGF במשך 10 דקות ב RT או (B) Erlotinib במשך 15 דקות ב RT, ולאחר מכן עם 73 nM של EGF במשך 10 דקות ב RT. לאחר הסרת מדיה lysis, lysates הועברו צלחת לבנה בנפח נמוך 384-well, ואחריו תוספת של תערובת זיהוי נוגדנים. הצלחת דוגרה בן לילה ב- RT ולאחר מכן נקראה על קורא תואם TR-FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; EGF = גורם גדילה אפידרמיס; RT = טמפרטורת החדר; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
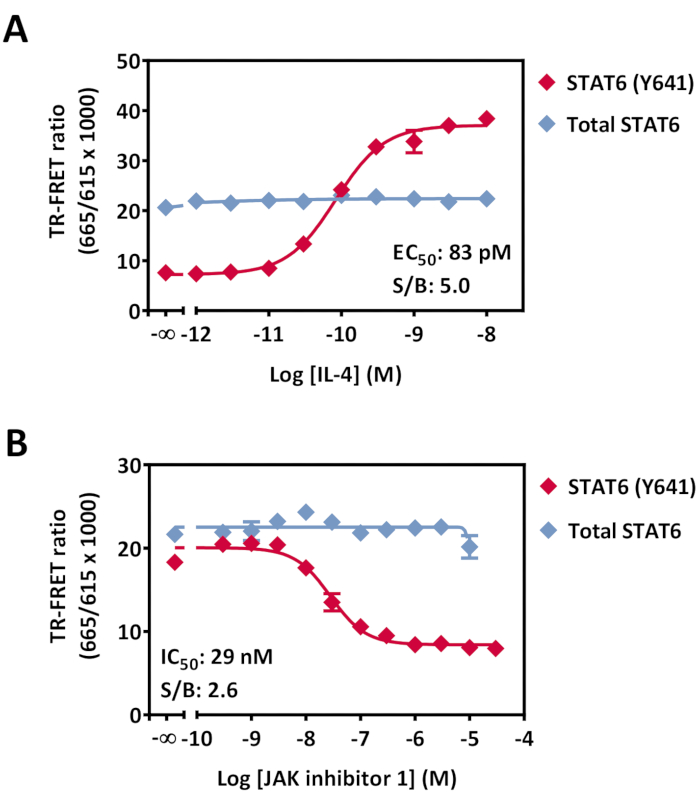
איור 7: זיהוי זרחן-STAT6 (Y641) ואפנון STAT6 כולל בתאי HeLa. תאים (40,000 תאים/טוב) בתרבית לילה בצלחת תרבית של 96 בארות טופלו בריכוזים הולכים וגדלים של (A) IL-4 למשך 20 דקות ב- RT או (B) מעכב JAK 1 למשך 30 דקות ב- RT, ולאחר מכן עם 0.5 ננומטר של IL4 למשך 20 דקות ב- RT. לאחר הסרת מדיה lysis, lysates הועברו צלחת לבנה בנפח נמוך 384-well, ואחריו תוספת של תערובת זיהוי נוגדנים. הצלחת דוגרה במשך 4 שעות ב- RT ולאחר מכן נקראה על קורא תואם TR- FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IL = אינטרלוקין; JAK = יאנוס קינאז; RT = טמפרטורת החדר; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 8: זיהוי גירוי זרחן-STAT4 (Y693) בתאי U266B1 באמצעות פרוטוקול צלחת אחת. תאים (160,000 תאים/טוב) שנזרעו בצלחת לבנה בנפח נמוך של 384-well טופלו מיד בריכוזים הולכים וגדלים של IFNα2b במשך 25 דקות בטמפרטורה של 37 °C (37 °F). בעקבות תמוגה, תערובת זיהוי הנוגדנים נוספה ישירות לליסט. הלוח היה דגירה לילה ב RT ולאחר מכן לקרוא על קורא תואם TR-FRET באמצעות מנורת פלאש או עירור לייזר. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IFN = אינטרפרון; RT = טמפרטורת החדר; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 9: זיהוי גירוי זרחן-STAT6 (Y641) בתאי HeLa באמצעות פרוטוקול צלחת אחת. תאים (80,000 תאים/טוב) שנזרעו בצלחת לבנה בנפח נמוך של 384-well טופלו מיד בריכוזים הולכים וגדלים של IL-4 למשך 20 דקות ב- RT. בעקבות תמוגה, תערובת זיהוי הנוגדנים נוספה ישירות לליסט. הצלחת דוגרה 4 שעות ב- RT ולאחר מכן נקראה על קורא תואם TR- FRET. הנתונים מוצגים כממוצע של בארות משולשות לכל נקודת בדיקה. קווי שגיאה מציינים סטיית תקן. קווי שגיאה מסוימים קטנים מגודל הסמל. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IL = אינטרלוקין; RT = טמפרטורת החדר; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 10: מחקר שונות תוך-פלטתית של פוספו-STAT1 (Y701) ופוספו-STAT3 (Y705) בדיקות. (A) בדיקת Phospho-STAT1: תאי ההשעיה (200,000 תאי U266B1/well) טופלו ב-10 ננומטר של IFNα2b למשך 15 דקות או בינוני ללא סרום בלבד (בקרות נמוכות). (B) בדיקת Phospho-STAT3: תאים דבקים (20,000 תאי HeLa / טוב) טופלו או עם 5 ננומטר של IFNα2b במשך 20 דקות או עם מדיום ללא סרום בלבד. עבור שתי הבדיקות, האות TR-FRET נקרא לאחר 4 שעות של דגירה. קיצורים: STAT = מתמר אותות ומפעיל של תמלול; IFN = אינטרפרון; TR-FRET = העברת אנרגיית תהודה Förster נפתרה בזמן; S/B = יחס אות/רקע; קורות חיים = מקדם וריאציה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
בהשוואה לשיטות קונבנציונליות לניתוח פוספופרוטאין כגון סופג מערבי ושיטות מבוססות ELISA, זרימת העבודה עבור בדיקת סלולר THUNDER TR-FRET היא פשוטה ומהירה, משתמשת במדגם בנפח נמוך (15 μL), מיועדת ל- HTS בפורמט של 384 בארות, והיא נוחה מאוד לאוטומציה. פרוטוקול הבדיקה גמיש וניתן להתאים אותו בקלות הן ליישומים בעלי תפוקה בינונית והן לתפוקה גבוהה. ניתן להפעיל בדיקות באמצעות פרוטוקול העברה של שתי לוחות או פרוטוקול לוחית רישוי אחת-384 באר. בפרוטוקול ההעברה של שתי הלוחות, התאים נזרעים, מטופלים ומודבקים בלוח תרבית תא אחד, וlysates מועברים לאחר מכן ללוח זיהוי לבן נפרד (חצי שטח 96-well או צלחת 384-well) לניתוח. בפרוטוקול לוחית אחת-384-well, זרימת העבודה כולה מתנהלת באותה באר, ומבטלת את הצורך בשלב העברה נוזלית. ניתן להתאים את הבדיקות בקלות לפורמט 1536-well על ידי הפחתת עוצמת הקול באופן פרופורציונלי. ללא קשר לפרוטוקול הבדיקה, ישנם רק שלושה פתרונות ריאגנטים להכנה וללא צעדי כביסה, וניתן להפעיל את הבדיקות בהתאם לפרוטוקול "תוספת בלבד", הדורש זמן מעשי מינימלי.
צעד קריטי בביצוע כל בדיקה מבוססת תאים הוא אופטימיזציה של תרביות תאים ותנאי טיפול16. הן מספר התא והן תנאי הטיפול דורשים אופטימיזציה זהירה לפני הפעלת בדיקה, כמו פרמטרים מרכזיים אלה משתנים לעתים קרובות עבור כל קו תא וכל phosphoprotein. האופטימיזציה של פרמטרים אלה מאפשרת למקסם את חלון הבדיקה, להשיג ביצועים אופטימליים עם יחס S/B גבוה ומקדם בין-באר נמוך של וריאציה, ולהבטיח את החוסן והשחזור של התוצאות. מספר תא, רעב בסרום (בעת הצורך), וזמן גירוי או עיכוב (בטמפרטורת החדר או 37 °C (37 °F) צריך להיות ממוטב עבור כל קו תא חלבון היעד. מספרי תאים גבוהים מדי או נמוכים מדי יכולים להשפיע לרעה על אפנון מסלולי איתות תאיים. צפיפות זריעת תאים של 40,000-80,000 תאים / טוב עבור תאים דבקים או 100,000-200,000 תאים / טוב עבור תאים מתלים מקובלים בדרך כלל עבור רוב קווי התאים. שימו לב, משך הזמן האופטימלי לגירוי ועיכוב יכול להשתנות במידה רבה בין קווי התא וחלבוני היעד, מכמה דקות עד מספר שעות. ככזה, מחקר קורס זמן מומלץ בחום כדי לקבוע את גירוי אופטימלי ועיכוב זמני הדגירה, באופן אידיאלי הן בטמפרטורת החדר והן 37 °C (50 °F), כמו טמפרטורת הדגירה משפיעה על הקינטיקה של גירוי חלבון היעד.
פתרון בעיות בבדיקה מבוססת תאים עלול להיות קשה וגוזל זמן רב בשל השלבים הרבים הכרוכים בזרימת העבודה (תרבית תאים, טיפול בתאים, תמוגה וזיהוי חלבונים). ערכות בדיקה אלה כוללות lysate שליטה חיובית. מומלץ להשתמש אלה lysates שליטה חיובית ושליטה שלילית (1x בתוספת מאגר תמוגה לבד) בכל ניסוי. השימוש בפקדים מתאימים מקל על פתרון בעיות, שכן לאחר מכן ניתן לייחס בעיות במהירות לשלב הזיהוי (הכנה ריאגנט שגויה ו/או ביצוע בדיקה) או לאיכות הליסטים המשמשים בניסוי. זה האחרון הוא בדרך כלל בשל השימוש בתנאים תאיים תת-אופטימליים.
יתרון נוסף של פלטפורמה זו הוא הזמינות של חבילה של מאגרי תמוגה ממוטבים עם מחרוזות שונות. זה מאפשר יצירת ליסטים הטרוגניים פחות או יותר מהפרדה תת-תאית חלקית. זה שימושי כי חלבוני איתות ממוקמים בתאים תאיים שונים, וכמה, כמו חלבונים STAT, הסעות בין תאים (למשל, בין הציטופלסמה לגרעין). הערה, זרחן וסך הכל STAT1 להשתמש מאגר תמוגה 1 כי הם לא יכולים להיות מזוהים היטב עם מאגר תמוגה 2 המשמש חלבונים STAT אחרים. לעומת זאת, שיטות הומוגניות אחרות מסתמכות על מאגר תמוגה "אוניברסלי" יחיד, המייצר מדגם מורכב יותר שיכול ליצור אינטראקציות לא ספציפיות עם הנוגדנים. עם זאת, השימוש במאגרי תמוגה שונים עשוי למנוע ניתוח של חלבוני איתות מרובים מדגם ליסט יחיד. עם זאת, אפשר עדיין לבדוק lysates שנוצר עם מאגרי תמוגה שונים בו זמנית על צלחת אחת לניתוח מסלול מקבילי.
לסיכום, השיטות המוצגות כאן המבוססות על פלטפורמת אימונואסאי תאית הומוגנית זו של TR-FRET מציעות חלופה בעלת תפוקה גבוהה לניטור איתות JAK/ STAT באמצעות זיהוי וכימות של חלבונים STAT1/3/3/3/4/5/6 אנדוגניים, יחד עם סך הכל STAT1/3/5/6, בליסטים של תאים. בדיקות אלה מספקות כלים חדשים לניתוח מקיף יותר של חלבוני STAT ספציפיים לאחר טיפול בתאים והקרנה ואפיון של אפננים ספציפיים וסלקטיביים של מסלולי איתות JAK / STAT. בהתחשב בפשטותה, בייחודיותה, ברגישותה, בשחזורה ובעלויות האפקטיביות שלה, פלטפורמת בדיקה חדשה זו מהווה חלופה אטרקטיבית לחיסון מסורתי, הן בסביבה אקדמית והן במעבדות תעשייתיות ליישומי HTS.
Disclosures
תחומי עניין מתחרים: חיימה פדרוס, מירי קארון וז'נבייב שאטל הם עובדי BioAuxilium Research, המייצרת את ערכות הבדיקה THUNDER TR-FRET המשמשות במחקר זה. בנוסף, חיימה פדרוס ומיריל קארון הם בעלי המניות של BioAuxilium Research. זה לא משנה את דבקות המחברים בכל מדיניות JoVE על שיתוף נתונים וחומרים.
Acknowledgements
ללא.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392(2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94(2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al. HTS assay validation. Assay Guidance Manual. Markossian, S., et al. , Eli Lilly & Company and the National Center for Advancing Translational Sciences. Bethesda (MD). (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved