Method Article
Получение многофункциональных микрокапсул на основе шелка, загруженных ДНК-плазмидами, кодирующими РНК-аптамеры и рибопереключатели
В этой статье
Резюме
Протокол описывает формирование надежных и биосовместимых микрокапсул, нагруженных ДНК, в виде мультиплексированных биосенсоров in vitro , способных отслеживать несколько лигандов.
Аннотация
Мы представляем протокол для получения микрокапсул волокоина шелка, нагруженных ДНК, с помощью метода послойной сборки (LbL) на жертвенных сферических ядрах. После адсорбции первичного слоя и плазмид ДНК образованию прочных микрокапсул способствовала индуцирование β-листов во вторичной структуре шелка при остром обезвоживании одного слоя шелка. Следовательно, наслоение происходило за счет множественных водородных связей и гидрофобных взаимодействий. После адсорбции многослойных оболочек структуры ядро-оболочка могут быть дополнительно функционализированы наночастицами золота (AuNP) и/или антителами (IgG) для использования для дистанционного зондирования и/или адресной доставки. Корректировка нескольких ключевых параметров во время последовательного осаждения ключевых макромолекул на ядрах кремнезема, таких как присутствие полимерного праймера, концентрация ДНК и белка шелка, а также ряд адсорбированных слоев, привела к созданию биосовместимых, нагруженных ДНК микрокапсул с переменной проницаемостью и нагрузкой ДНК. При растворении ядер кремнезема протокол продемонстрировал образование полых и прочных микрокапсул с плазмидами ДНК, иммобилизованными на внутреннюю поверхность мембраны капсулы. Создание селективно проницаемой биосовместимой мембраны между плазмидами ДНК и внешней средой сохранило ДНК при длительном хранении и сыграло важную роль в улучшении выходного ответа от пространственно ограниченных плазмид. Активность матриц ДНК и их доступность проверяли в ходе реакций транскрипции и трансляции in vitro (бесклеточные системы). ДНК-плазмиды, кодирующие светящиеся аптамеры РНК и рибопереключатели, были успешно активированы соответствующими аналитами, что было визуализировано при локализации флуоресцентно меченных транскриптов РНК или белка GFPa1 в мембранах оболочки.
Введение
Область синтетической биологии предлагает уникальные возможности для развития сенсорных возможностей путем использования естественных механизмов, эволюционирующих микроорганизмами, для мониторинга окружающей среды и потенциальных угроз. Важно отметить, что эти сенсорные механизмы, как правило, связаны с реакцией, которая защищает эти микроорганизмы от вредного воздействия, регулируя экспрессию генов для смягчения негативных эффектов или предотвращения поступления токсичных материалов. Были предприняты значительные усилия по созданию этих микроорганизмов для создания цельноклеточных сенсоров, использующих преимущества этих естественных реакций, но перенаправляющих их на распознавание новых мишеней и/или на получение измеримого сигнала, который можно измерить для целей количественного определения (обычно флуоресценции)1,2. В настоящее время опасения по поводу использования генетически модифицированных микроорганизмов (ГМО), особенно при высвобождении в окружающую среду или организм человека, из-за утечки целых клеток или части их генетического материала, даже если они инкапсулированы в полимерную матрицу, предполагают, что необходимы альтернативные способы использования этих сенсорных подходов3.
Мощным подходом к использованию преимуществ зондирования на основе микроорганизмов без заботы о внедрении ГМО является использование систем транскрипции/трансляции in vitro (IVTT). С практической точки зрения, системы IVTT состоят из смеси, содержащей большинство клеточных компонентов в активном состоянии, которая была «извлечена» из клеток различными способами, включая обработку ультразвуком, биение шариков или другие4. Конечным продуктом этого процесса является биохимическая реакционная смесь, уже оптимизированная для выполнения транскрипции и трансляции, которая может быть использована для тестирования различных датчиков в формате «открытого сосуда» без ограничений, связанных с использованием целых клеток (мембранная диффузия, эффективность трансформации, клеточная токсичность и т. д.). Важно отметить, что различные компоненты датчика могут быть количественно добавлены, и их влияние изучается различными оптическими и спектрометрическими методами, как мы продемонстрировали5. Было замечено, что производительность систем IVTT может быть непостоянной; Тем не менее, недавние исследования показали подходы к стандартизации их подготовки и определения характеристик, что очень помогает при изучении их характеристик в конструкциидатчика 6. В последнее время было продемонстрировано множество примеров использования систем IVTT для создания бумажных анализов путем лиофилизации их компонентов в бумажных матрицах, включая обнаружение ионов тяжелых металлов, лекарств, чувствительных элементов кворума и др. 7,8,9. Интересным пространством применения датчиков на основе IVTT является их использование в сенсорных приложениях в различных типах сред, включая почву, воду и человеческое тело. Чтобы развернуть эти системы IVTT в этих сложных средах, необходимо реализовать подход к инкапсуляции, чтобы содержать компоненты IVTT и защищать их от деградации.
Наиболее распространенные подходы к инкапсуляции для систем IVTT включают использование липидных капсул, мицелл, полимерсом и других плотно закрытых микроконтейнеров10,11,12. Одним из недостатков этого подхода является необходимость включения либо пассивных, либо активных механизмов для транспортировки материалов в контейнеры и из них, чтобы обеспечить связь с внешней средой и обеспечить возможности зондирования. Чтобы преодолеть некоторые из этих проблем, в исследовании сообщается о методе, который обеспечивает простой, но эффективный подход к инкапсуляции кодирующих материалов для различных конструкций датчиков, которые будут выражаться в системах IVTT. Этот подход основан на использовании послойного (LbL) осаждения биополимера в присутствии интересующих плазмид для создания полых микрокапсул с высокой пористостью, что позволяет защищенному генетическому материалу взаимодействовать с различными компонентами IVTT по выбору. Исследование показало, что инкапсулированные плазмиды могут направлять транскрипцию и трансляцию при активации в этой полимерной матрице, как показано в ответе кодируемого плазмидой аптамера и рибопереключателя на соответствующие мишени. Кроме того, это покрытие LbL защищает плазмиды в течение нескольких месяцев без каких-либо специальных условий хранения.
протокол
1. Построение плазмидного вектора.
- Построение плазмидного вектора (pSALv-RS-GFPa1, 3,4 кб) путем амплификации кодирующей последовательности теофиллинового рибопереключателя (ThyRS) в сочетании с GFPa1 из вектора pJ201:23976-RS-GFPa1 (разработанного и созданного DNA2.0) и вставки в вектор экспрессии E. coli , pSAL13. Используйте прямой (5'-CGTGGTACCGGTGATACCAGCATCGTCTTGATG-3') и обратный (5'-CGTGCTCAGCTTAAGCCAGCTCGTAG-3') праймеры для амплификации кодирующей последовательности ThyRS в сочетании с GFPa1 и проводят реакцию ПЦР в объеме 50 мкл с использованием ДНК-полимеразы в соответствии с протоколомпроизводителя 14.
- Приготовьте 1% агарозный гель из 0,5 г агарозы, 50 мл буфера TAE (40 мМ трис-ацетата, 1 мМ ЭДТА, pH 8,0) и 3 мкл ДНК-красителя.
- Смешайте 5 мкл аликвоты продукта, усиленного ПЦР, с 5 мкл воды, не содержащей РНКазы/ДНКазы, и 2 мкл 6-кратного гель-загрузочного красителя и проанализируйте с помощью электрофореза в агарозном геле. Загрузите лестницу ДНК (0,1-10,0 кб) в качестве ссылки. Запускайте гель при напряжении 120 В до тех пор, пока линия красителя почти не достигнет дна геля.
- Визуализируйте фрагменты ДНК с помощью системы визуализации УФ-трансиллюминатора, чтобы проверить правильный размер ДНК15.
- Очистите продукт ПЦР с помощью набора для очистки ПЦР в соответствии с протоколомпроизводителя 16.
- Расщепляют продукт ПЦР и вектор экспрессии pSAL рестрикционными ферментами KpnI и BlpI в реакции 15 мкл, содержащей 10 мкл продукта ПЦР или плазмидного вектора (концентрация 20-50 нг/мкл), 1,5 мкл 10-кратного ферментного буфера, 1 мкл каждого фермента и 1,5 мкл воды, свободной от РНКазы/ДНКазы, при 37 °C в течение 2 часов.
- Добавьте 3 мкл 6-кратного гель-загрузочного красителя в реакционную смесь и разделите расщепленные фрагменты на 1% агарозном геле, как описано на этапах 1.3-1.5.
- Очистите фрагменты ДНК с помощью набора для экстракции геля в соответствии с протоколомпроизводителя 16.
- Переваривают переваренный продукт ПЦР в переваренный линеаризованный плазмидный вектор, pSAL, используя ДНК-лигазу Т4 и дополненный лигазный буфер в реакции 10 мкл, содержащей 3-20 фмоль переваренного вектора, 9-60 фмоль переваренного продукта ПЦР, 2 мкл лигазного буфера, 1 мкл (1 единицу) ДНК-лигазы Т4 и воду, не содержащую ДНКазы/РНКазы. Инкубировать реакцию лигирования при 25 °C в течение 3 ч.
ПРИМЕЧАНИЕ: Убедитесь, что общее содержание ДНК в реакционной смеси составляет 0,01-0,1 мкг. - Трансформируют E. coli DH5α компетентные клетки с помощью 10 нг смеси реакции лигирования согласно протоколупроизводителя 17.
- Выращивайте трансформированные клетки при 37 ° C в течение ночи на планшетах из LB-агара с добавлением ампициллина (100 мкг / мл).
- Выберите 3-4 бактериальные колонии из планшета и асептически перенесите каждую из них в 5 мл среды LB с добавлением ампициллина (100 мкг / мл). Выращивают культуры в течение ночи при 37 °C в встряхивающем инкубаторе при 225 об/мин.
- Гранулируйте ночные культуры центрифугированием при 11 x g в течение 3 мин при комнатной температуре.
- Используйте набор для очистки плазмид в соответствии с протоколомпроизводителя 16.
- Проверьте последовательности очищенных плазмид с помощью секвенирования ДНК. Плазмидная карта и последовательность полученной конструкции (pSALv-RS-GFPa1) показаны на рисунке 1.
2. Масштабная очистка ДНК.
- Трансформируют плазмидный вектор pSALv-RS-GFPa1 (3,4 кб) (кодирующий теофиллиновый рибопереключатель, связанный с геном-репортером GFPa1) или pET28c-F30-2xBroccoli (5,4 кб) (кодирующий аптамер брокколи) в компетентные клетки E. coli DH5α в соответствии с протоколомпроизводителя 17.
- Выращивайте трансформированные клетки при 37 ° C в течение ночи на планшетах из LB-агара с добавлением ампициллина (100 мкг / мл) для клеток, трансформированных pSALv-RS-GFPa1, или канамицина (50 мкг / мл) для клеток, трансформированных брокколи pET28c-F30-2x.
- Выберите 3-4 бактериальные колонии из планшета и асептически перенесите каждую колонию в 5 мл среды LB с добавлением соответствующего антибиотика (100 мкг / мл ампициллина или 50 мкг / мл канамицина). Выращивают культуры в течение ночи при 37 °C в встряхивающем инкубаторе при 225 об/мин.
- Используйте 3 мл ночной культуры для инокуляции в 150 мл LB с добавлением соответствующего антибиотика (100 мкг/мл ампициллина или 50 мкг/мл канамицина) и выращивайте культуры в течение ночи при 37 °C в встряхивающем инкубаторе при 225 об/мин.
- Гранулируют ячейки центрифугированием при ≥3400 x g в течение 10 мин при 4 °C.
- Используйте набор для очистки плазмид в соответствии с протоколомпроизводителя 16.
- Разбавьте ДНК 0,5 мл чистой воды, не содержащей ДНКазы / РНКазы. Измерьте концентрацию ДНК и приготовьте 1 мл исходных растворов ДНК (100 нг/мкл). Храните пробирки с ДНК при температуре 4 °C до дальнейшего использования.
3. Экстракция фиброина шелка и подготовка исходных материалов.
- Приготовьте водный раствор восстановленного белка фиброина шелка (SF) из коконов тутового шелкопряда Bombyx mori в соответствии с процедурой, подробно описанной в другом месте, чтобы составить 10% раствора18 Silk-LiBr.
- Определите конечную концентрацию водного раствора SF. Пипеткой нанесите 0,5 мл шелкового раствора на чашку Петри диаметром 60 мм, дайте ей высохнуть при 60 °C и измерьте вес сухой шелковой пленки. Разделите сухой вес на 0.5 мл, чтобы рассчитать процент веса на объем.
- Разбавьте концентрированный раствор шелка дистиллированной водой, не содержащей ДНКазы / РНКазы, медленно добавляя воду с помощью серологической пипетки, чтобы получить конечную концентрацию 1 мг / мл. Храните раствор при температуре 4 °C для использования в будущем.
- Приготовьте флуоресцентно меченный фиброин шелка, используя набор для маркировки антител. Используйте 1 мл 2 мг / мл раствора фиброина шелка для соединения N-концевых α-аминогрупп белка с производным красителем, активированным эфиром NHS, в соответствии с протоколомпроизводителя 19.
- Приготовьте 50 мл водного раствора полиэтиленимина (ПЭИ) с концентрацией 6 мг/мл, отрегулируйте рН до 4 с помощью HCl (1 М). Раствор фильтруют через стерильную мембрану 0,2 мкм. Хранение возможно при комнатных условиях в течение нескольких месяцев.
- Подготовьте ядра SiO2 . Пипетка 300 мкл частиц SiO 2 в микроцентрифужную пробирку объемом2 мл. Промойте микрочастицы два раза 1 мл воды, не содержащей ДНКазы / РНКазы, центрифугированием в дозе 0,2 x г в течение 1 мин.
4. Выполните послойное осаждение первичного слоя, плазмид ДНК и слоев шелка.
- Чтобы нанести первичный слой PEI на микрочастицы SiO2 , добавьте 1 мл раствора PEI в открученную гранулу с шага 3.6 и перемешивайте смесь в условиях окружающей среды на термомиксере при 800 об/мин в течение 15 минут. Промойте частицы четыре раза 1 мл деионизированной воды, не содержащей ДНКазы / РНКазы, центрифугированием в концентрации 0,2 x g в течение 1 мин.
- Для выполнения осаждения слоя ДНК добавляют 1 мл водного раствора плазмид ДНК со стадии 2.7 к микрочастицам, загрунтованным PEI, и осторожно перемешивают смесь при 4 °C на термомиксере при 800 об/мин в течение 15 мин. Для приготовления микрокапсул с различной нагрузкой ДНК отрегулируйте концентрацию плазмид ДНК в пределах 50-200 нг/мкл с помощью дистиллированной воды, не содержащей ДНКазы/РНКазы, и используйте 1 мл этих растворов для депонирования ДНК. Соберите микрочастицы центрифугированием в дозе 0,2 x g в течение 1 мин.
- Пометьте пробирки для ДНК-плазмид, кодирующих теофиллиновый рибопереключатель в сочетании с GFPa1, как ThyRS-GFPa1, а ДНК-плазмиды, кодирующие аптамер брокколи, как BrocApt.
ПРИМЕЧАНИЕ: Держите микроцентрифужные пробирки с ДНК на льду. - Осторожно удалите надосадочную жидкость и промойте микрочастицы четыре раза 1 мл дистиллированной воды, не содержащей ДНКазы / РНКазы, каждый раз выбрасывая надосадочную жидкость после центрифугирования при 0,2 x g в течение 1 мин. Все эксперименты проводите при комнатной температуре (RT), если не указано иное.
- Для осаждения слоя фиброина шелка добавляют 1 мл восстановленного водного раствора SF со стадии 3.3 к адсорбированным ДНК микрочастицам, осторожно перемешивают и перемешивают смесь при 10 ° C на термосмесителе при 750 об/мин в течение 15 мин. Соберите микрочастицы центрифугированием при 0,2 x г в течение 1 мин при 4 ° C, удалите надосадочную жидкость, а затем промойте их один раз 1 мл дистиллированной воды, не содержащей ДНКазы / РНКазы. Повторите центрифугирование и выбросьте надосадочную жидкость.
ПРИМЕЧАНИЕ: Во время эксперимента держите раствор шелка на льду, чтобы избежать гелеобразования, вызванного температурой. - Постепенно обрабатывайте частицы метанолом, чтобы вызвать образование β листов в белковой структуре шелка. Сначала добавьте 0,5 мл дистиллированной воды ДНКазы / РНКазы, вкрутите микроцентрифужную пробирку, затем добавьте 0,5 мл 100% метанола. Аккуратно встряхните частицы на термомиксере при температуре 10 °C в течение 5 минут. Собирают частицы центрифугированием в дозе 0,2 x g в течение 1 мин. Удалите надосадочную жидкость.
- Обработайте частицы метанолом, чтобы способствовать образованию β-листов и обеспечить сильную физическую адсорбцию слоя шелка. Добавьте 1 мл 100% метанола. Аккуратно встряхните частицы на термомиксере при 750 об/мин в течение 10 минут при 10 °C.
- Соберите частицы центрифугированием при 0,2 x g в течение 1 мин при 4 °C и дважды промойте их 1 мл дистиллированной воды без ДНКазы / РНКазы каждый раз, отбрасывая надосадочную жидкость и осторожно перемешивая перед следующим центрифугированием.
- Повторите шаги 4,5-4,8 20 раз для получения шелковых многослойных структур сердцевина-оболочка. Для последнего этапа осаждения используйте шелк с флуоресцентной меткой из шага 3.4 (Silk-DyLight550, 1 мл).
- Выполните последний этап промывки и храните микрочастицы в 1 мл дистиллированной воды, не содержащей ДНКазы / РНКазы, в условиях окружающей среды.
ПРИМЕЧАНИЕ: Чтобы избежать агрегации частиц во время осаждения слоев шелка, проведите визуальный осмотр суспензии частиц и нанесите ее пипеткой вверх и вниз с помощью наконечника пипетки объемом 1 мл, чтобы способствовать однородному распределению частиц. - Рассчитайте количество копий плазмид ДНК, инкапсулированных в каждую микрокапсулу NДНК , используя уравнение 1:
 (1)
(1)
Где N = 6,769 × 1011 - количество ядер SiO2, используемых для инкапсуляции. Рассчитайте его по стандартной кривой для известных концентраций частиц кремнезема с использованием последовательных разбавлений и поглощения A 320 при λ =320 нм;
С- начальная концентрация ДНК, используемая для адсорбции
V- объем ДНК, используемый для адсорбции
0,8- Эффективность адсорбции ДНК на ядрах
Mw- Молекулярная масса плазмиды ДНК
NA- число Авогадро (6.022 × 1023)
5. Растворение ядер для получения шелковых микрокапсул.
- Приготовьте 8% раствор плавиковой кислоты (HF) с pH 5,5, разбавив исходный раствор (48%) дистиллированной водой. Приобретите центрифужную пробирку объемом 50 мл. Осторожно наберите пипеткой 5 мл HF и добавьте 25 мл дистиллированной воды до получения 8% раствора HF.
ВНИМАНИЕ: HF является высококоррозионной кислотой и может вызвать серьезные ожоги тканей. Следует соблюдать крайнюю осторожность при обращении с HF и его использовании для экспериментов. Придерживайтесь Стандартной операционной процедуры (СОП) для правильного использования и обращения с ВЧ, разработанной организацией, чтобы избежать нежелательных несчастных случаев с утечкой. Не используйте стеклянную тару для разбавления HF-кислоты. Используйте химическую вытяжку для выполнения этого шага протокола. - Растворяют ядра SiO2 , добавляя 1,5 мл 8% раствора HF к гранулированным микрочастицам ядра-оболочки с шага 4.10. Осторожно встряхните и дайте ядрам раствориться в течение ночи при условиях окружающей среды с легким встряхиванием при 450 об/мин.
ПРИМЕЧАНИЕ: Чтобы избежать утечки HF, используйте прививочную ленту для герметизации микроцентрифужной пробирки. Используйте химическую вытяжку для выполнения этого шага протокола. - Подготовьте стеклянный стакан объемом 2 л, наполненный 2 л деионизированной воды. Раствор микрокапсул переносят в диализные аппараты (MWCO 50 кДа) и диализируют их на фоне деионизированной воды с повторной сменой воды каждые 3 ч в течение следующих 3 дней.
ПРИМЕЧАНИЕ: Соберите надосадочную жидкость во время первых трех обменов воды и выбросьте раствор в соответствии с установленным протоколом для опасных отходов. - Используйте пипетку объемом 1 мл для переноса суспензии из диализных устройств в новые микроцентрифужные пробирки объемом 2 мл для сбора микрокапсул.
ПРИМЕЧАНИЕ: Водные растворы микрокапсул хранят в условиях окружающей среды в течение нескольких лет.
6. Визуализация микрокапсул фиброина шелка с помощью конфокального лазерного сканирующего микроскопа (CLSM).
- Выполните окрашивание ДНК с использованием ДНК-красителя.
- Перелейте 300 мкл полых микрокапсул фиброина шелка в свежую микроцентрифужную пробирку объемом 1 мл. Добавьте 500 мкл дистиллированной воды, не содержащей РНКазы / ДНКазы.
- Добавьте 5 мкл красителя для окрашивания ДНК, кратковременно встряхните и инкубируйте при RT в течение 2 ч в защищенном от света месте.
- Выполните четыре этапа промывки центрифугированием при 0,1 x g в течение 20 мин при 4 ° C каждый раз, осторожно удаляя 400 мкл надосадочной жидкости и пополняя ее 400 мкл дистиллированной воды, не содержащей РНКазы / ДНКазы.
- Выполните визуализацию шелковых капсул на инвертированных конфокальных системах, оснащенных тремя основными лазерами (405 нм, 488 нм, 561 нм), используя 100-кратный масляный иммерсионный объектив (NA 1,49). Перенесите 100 мкл образца капсулы в одну лунку стеклянных предметных стекол с 8-луночными камерами, дайте капсулам отложиться в течение 20-30 минут перед визуализацией.
ПРИМЕЧАНИЕ: Красители очень чувствительны к фотообесцвечиванию. Защитите образцы, накрыв предметные стекла алюминиевой фольгой.
7. Оценка проницаемости полых микрокапсул методом молекулярно-массовой отсечки (MWCO).
- Приготовьте по 2 мл помеченных FITC растворов декстран-флуорофора (20 мкМ, диГ 2 О) различных МВт (4 кДа, 20 кДа, 40 кДа, 70 кДа, 150 кДа, 250 кДа, 500 кДа и2МДа).
- Пипетка 100 мкл суспензии капсул в одну лунку камерного предметного стекла. Проанализируйте каждую конструкцию микрокапсулы (концентрацию PEI, количество загрузки плазмид ДНК, концентрацию фиброина шелка и количество слоев) отдельно.
- В каждую лунку добавляют 300 мкл конкретного раствора флуорофора, начиная с самого низкого Mw до самого высокого, чтобы каждая лунка соответствовала конкретному раствору флуорофора. Перемешайте пипеткой вверх и вниз и дайте смеси инкубироваться в течение 1 ч при RT до тех пор, пока диффузия растворов флуорофора не достигнет равновесия.
- Перенесите предметное стекло на конфокальный лазерный сканирующий микроскоп (CLSM) и сфотографируйте каждую скважину с помощью 100-кратного нефтяного погружного объектива при возбуждении λ = 488 нм.
- Определите интересующую область, отрегулировав фокальную плоскость, чтобы убедиться, что капсулы появляются в виде кругов наибольшего диаметра. Обычно это происходит при просмотре образцов ближе ко дну скважины, когда капсулы осаждаются под действием силы тяжести.
- Соберите несколько изображений образцов микрокапсул, перемещая предметное стекло в направлении XY. Сделайте снимки, чтобы учесть до 100-150 капсул для каждого образца.
- Используйте программное обеспечение ImageJ для анализа проницаемости мембраны капсулы в каждом растворе флуорофора Mw путем сравнения интенсивности флуоресценции внутри и снаружи капсул. Для этого нарисуйте интересующую область (ROI) в виде круга, чтобы очертить окружность капсулы, и нажмите «Анализ/Измерить», чтобы измерить интенсивность флуоресценции внутри. Сведите данные в таблицу в электронную таблицу. Выполняйте эту операцию для каждой микрокапсулы, всего 200-300 капсул.
- Оцените интенсивность внешней флуоресценции таким же образом, обрисовав в общих чертах рентабельность инвестиций и измерив интенсивность вдали от капсул. Выполните 3-5 измерений для статистического анализа.
- Для проведения статистического анализа сравните интенсивности флуоресценции внутри и снаружи капсул с помощью парного t-критерия (p < 0,05).
- Используйте таблицу преобразования 2 для оценки проницаемости микрокапсул на основе гидродинамических радиусов для FITC-Dextran с переменной Mw.
8. Активация in vitro синтетического теофиллинового рибопереключателя в микрокапсулах шелка
- Приготовьте 1 мл исходного раствора теофиллина (100 мМ, ДМСО). Подготовьте систему экстракта E. coli S30 для кольцевой ДНК, разморозив компоненты на льду в течение 40 минут.
- Получите микроцентрифужную пробирку без ДНКазы / РНКазы объемом 0,5 мл. Проведите реакцию транскрипции/трансляции in vitro , соедините бесклеточные компоненты с образцом микрокапсул в следующем порядке (общий объем 50 мкл): премикс S30 без аминокислот (20 мкл); Экстракт S30, циркулярный (15 мкл); полная смесь аминокислот (5 мкл); полые микрокапсулы, содержащие плазмиды ThyRS-GFPa1 из стадии 4.10 (9 мкл); и теофиллин, 100 мМ ДМСО (1 мкл).
ПРИМЕЧАНИЕ: После добавления всех компонентов кратковременно поверните пробирку и соберите образец во время кратковременного центрифугирования при 0,2 × г в течение нескольких секунд. - Инкубируйте пробирку при 30 °C в течение 4 ч и проверьте флуоресценцию на планшетном считывателе, используя возбуждение при λ = 488 нм и излучение для фильтра GFP/FITC (510 нм ± 20 нм).
- Изображение капсул в любой системе LCSM с помощью лазеров с длиной волны 488 нм и 561 нм. Получайте изображения наилучшего качества с помощью 100-кратного масляного погружного объектива и 8-луночных камерных слайдов.
9. Активация аптамера брокколи in vitro в микрокапсулах шелка
- Приготовьте 1 мл исходного раствора красителя DFHBI-1T (30 мкМ, diH2O). Приготовьте бесклеточный системный реакционный набор PURE (синтез белка с использованием рекомбинантных элементов), разморозив компоненты на льду в течение 40 минут.
- Получите микроцентрифужную пробирку без ДНКазы / РНКазы объемом 0,5 мл. Проводят реакцию транскрипции in vitro путем объединения бесклеточных компонентов реакции с образцом микрокапсул в следующем порядке (общий объем 50 мкл): раствор А (20 мкл); раствор В (15 мкл); полые микрокапсулы, содержащие плазмиды BrocApt из шага 4.10 (14 мкл); и краситель DFHBI-1T (1 мкл).
ПРИМЕЧАНИЕ: После добавления всех компонентов кратковременно поверните пробирку и соберите образец во время кратковременного центрифугирования при 0,2 × г в течение нескольких секунд. - Инкубируют пробирку при 37 °C в течение 6 ч и проверяют флуоресценцию на планшетном считывателе, используя возбуждение при λex = 470 нм и излучение при λem = 510 нм ± 20 нм.
- Изображение капсул в любой системе LCSM с помощью лазеров с длиной волны 488 нм и 561 нм. Получите изображения наилучшего качества, используя 100-кратный масляный объектив и 8-луночные предметные стекла с камерой.
Результаты
Здесь в исследовании рассматривается функциональность шаблонов ДНК, кодирующих различные конструкции датчиков (два типа РНК-регулируемых элементов транскрипции/трансляции) после инкапсуляции в капсулы шелкового белка. Микрокапсулы были приготовлены с помощью шаблонной послойной (LbL) сборки ключевых компонентов: первичного слоя, плазмид ДНК, кодирующих конструкции датчиков, и биополимера фиброина шелка (рис. 2). Слоистое осаждение макромолекул позволяет контролировать проницаемость мембраны капсулы на основе меж- и внутримолекулярных взаимодействий между поглощенными слоями и толщиной оболочки. Перестраиваемая проницаемость системы дает возможность контролировать диффузию основных молекул при одновременном ограничении диффузии больших нежелательных макромолекул через мембрану20 капсулы.
Однородные по размеру (4,5 мкм) и прочные микрокапсулы волокнистого шелка с толщиной оболочки ~500 нм (20 слоев) в гидратированном состоянии могут быть получены при правильном соблюдении протокола (рис. 3)21. Подход LbL позволил настроить загрузочную способность матриц ДНК на основе исходной концентрации плазмид. Оптимальная загрузка ДНК может быть достигнута путем варьирования начальной концентрации матриц ДНК в пределах 50-200 нг/мкл. В таблице 1 представлено количество копий ДНК, сохраненных в одной микрокапсуле после завершения инкапсуляции LbL, и она была рассчитана для каждой конструкции датчика на основе исходных концентраций ДНК и Mw плазмид ДНК в соответствии с уравнением 1. Оптимальная загрузочная способность ДНК была достигнута с помощью 32 и 20 копий ДНК для конструкций датчиков ThyRS и BrocApt соответственно. Оценка грузоподъемности была важна для точной оценки концентраций инкапсулированной ДНК, чтобы иметь возможность титровать ее во время активации датчиков IVTT путем добавления более концентрированных образцов капсул.
Проницаемость оболочек капсул можно систематически анализировать, следуя методу MWCO. Метод оценивает размер пор мембраны на основе молекулярной массы молекул растворенного вещества, которые не смогли проникнуть через мембрану капсулы. Подвергая микрокапсулы вариабельным молекулам флуорофора Mw и выполняя конфокальную визуализацию в фокальной плоскости, которая соответствует наибольшему диаметру в нескольких капсулах, можно оценить проницаемость мембран оболочки. Анализ ImageJ позволяет оценить интенсивность флуоресценции внутри и снаружи капсул и идентифицировать полностью проницаемые (наружная и внутренняя интенсивности флуорофоров были сопоставимы), частично проницаемые (50-70% капсул имели более низкую флуоресценцию внутри по сравнению с наружной) и непроницаемые (внутренняя интенсивность флуорофора была ниже по сравнению с внешней интенсивностью) мембраны (рис. 4). Преобразование Mw в гидродинамический радиус для каждого флуорофора позволяет оценить размер ячеек мембраны капсулы (табл. 2).
Селективная проницаемость белковых капсул может быть достигнута при систематической оптимизации протокола осаждения LbL с использованием переменных концентраций первичного слоя (от 0-6 мг / мл), концентрации фиброина шелка (от 0,5 до 2 мг / мл) и количества осажденных слоев (от 10 до 25) до достижения оптимальной проницаемости. В этом протоколе оптимальная проницаемость между 25-32 нм была достигнута с 6 мг / мл PEI в качестве первичного слоя и 20 слоями по 1 мг / мл фиброина шелка, осажденного во время сборки LbL (рис. 4). Этот диапазон проницаемости был идеальным для того, чтобы компоненты системы IVTT просачивались через оболочку капсулы. Как правило, крупнейшими молекулярными комплексами любой системы IVTT являются прокариотические рибосомные единицы, 30S и 50S, которые при связывании мРНК в рибосомном комплексе могут достигать ~20 нм в размере22. Структура оболочек разработанных микрокапсул напоминает сильно переплетенную сеть слоев шелковых волокон, которые физически сшиты β-листовыми блоками, образующимися при сборке LbL. Эта мембранная структура является полупроницаемой: высокопроницаемой для малых молекул (например, ионов, аминокислот, пептидов, сахаров и т. д.) и ограниченной крупными молекулами (например, высокомолекулярными белками, гликопротеинами, клетками и т. д.), что позволяет перколятивировать только молекулы с гидродинамическим радиусом менее 25 нм. Следовательно, микрокапсулы фиброина шелка с оптимальной нагрузкой ДНК и проницаемостью мембраны могут быть использованы в качестве носителей биореактора для активации IVTT.
Транскрипционная и трансляционная активность датчиков конструкции ThyRS и BrocApt может быть протестирована с использованием коммерчески доступных систем IVTT. ThyRS требует трансляционной активации репортерного гена в присутствии теофиллинового лиганда. Активация синтетического ThyRS включает в себя несколько этапов для инициации экспрессии генов, включая синтез мРНК, конформационное изменение последовательности мРНК при связывании с анализируемым веществом, высвобождение сайта связывания рибосом и синтез репортерного белка GFPa1. Все эти этапы требуют свободной диффузии компонентов IVTT через мембрану капсулы. Предложенная конструкция микрокапсул фиброина шелка, нагруженных ДНК, улучшила параметры активации РНК-регулируемых сенсорных конструкций: как кинетика экспрессии, так и выход флуоресценции были значительно выше по сравнению со свободной неиммобилизованной ДНК (рис. 5А). Визуализация CLSM также подтвердила успешную активацию гена GFPa1 в капсулах, загруженных ДНК-плазмидами, кодирующими последовательности ThyRS (рис. 5B-D).
В качестве альтернативы, активация конструкции датчика BrocApt проводилась в системе IVTT, которая поддерживает транскрипцию/трансляцию, связанную с промотором T7 E. coli , в присутствии красителя DHFBI-1T. Выход флуоресценции инициировался при связывании флуорогенного красителя с последовательностью мРНК. Важно отметить, что выходной сигнал от микрокапсул шелка был в несколько раз выше по сравнению с неинкапсулированными образцами ДНК эквивалентных концентраций (рис. 6). Следовательно, микрокапсулы фиброина шелка могут сохранять существенную функциональность кодируемых ДНК сенсорных элементов, что может быть важно для разработки новых типов биосенсорных платформ in vitro для быстрого и чувствительного обнаружения интересующих аналитов.

Рисунок 1: Плазмидная карта и последовательность pSALv-RS-GFPa1 . (A) Плазмида содержит последовательность теофиллинового рибопереключателя (ThyRS), расположенную выше по течению от гена, кодирующего GFPa1, под контролем промотора ptac, гена, кодирующего β-лактамазу (bla), ответственного за устойчивость к ампициллину. (B) последовательность промоторов ptac выделена жирным шрифтом и подчеркнута; Последовательность рибопереключателей теофиллина выделена жирным курсивом; Последовательность кодирования GFPa1 выделена жирным шрифтом; Последовательности сайтов ограничений подчеркнуты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Обзор приготовления микрокапсул с использованием послойного подхода. Нетронутые ядра SiO2 сначала функционализировали полимером PEI, а затем последовательно осаждали плазмиды ДНК, кодирующие различные конструкции датчиков, и слои фиброина шелка до тех пор, пока не было адсорбировано желаемое количество слоев белка шелка. Полые нетронутые микрокапсулы, содержащие различные конструкции датчиков ДНК, могут быть получены путем растворения жертвенных ядер. Активация каждой конструкции биосенсора, инкапсулированного в микрокапсулу, может быть достигнута во время реакций IVTT в присутствии соответствующих лигандов. Этот рисунок был перепечатан из Drachuk, I. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
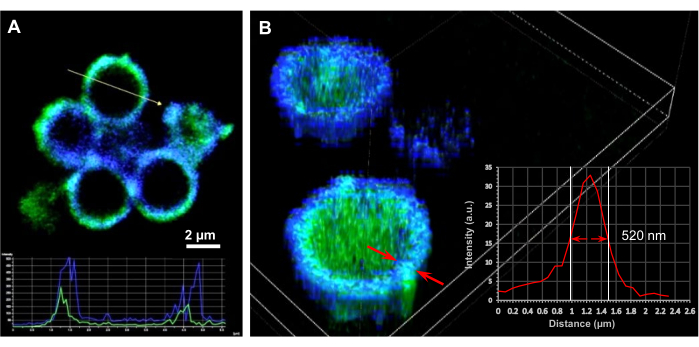
Рисунок 3: Микроскопические исследования микрокапсул, нагруженных ДНК. (A) Поперечное сечение 2D и (B) Визуализированные 3D-изображения конфокальной микроскопии полых (SF) 20 микрокапсул, загруженных плазмидами ДНК, кодирующими ThyRS (32 копии ДНК / капсула) и полученных из 6 мг / мл ядер SiO2 с затравкой PEI. Для выявления локализации плазмид ДНК и оценки толщины мембраны капсулы применяли автофлуоресценцию из фиброиновых капсул шелка (канал DAPI, синий) и окрашенную ДНК (канал FITC, зеленый). Вставка в (A) представляет профили интенсивности для оболочек ДНК и фиброина шелка по всей капсуле. Масштабная линейка: 2 мкм. Вставка в (B) представляет собой профиль интенсивности белка шелка по всей оболочке капсулы. Толщина мембраны измерялась как длина на пике половинной интенсивности. Обработка изображений поперечного сечения и 3D-рендеринг были выполнены с помощью программного обеспечения NIS imaging на системе Nikon C2+ . Этот рисунок был перепечатан из Drachuk, I. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
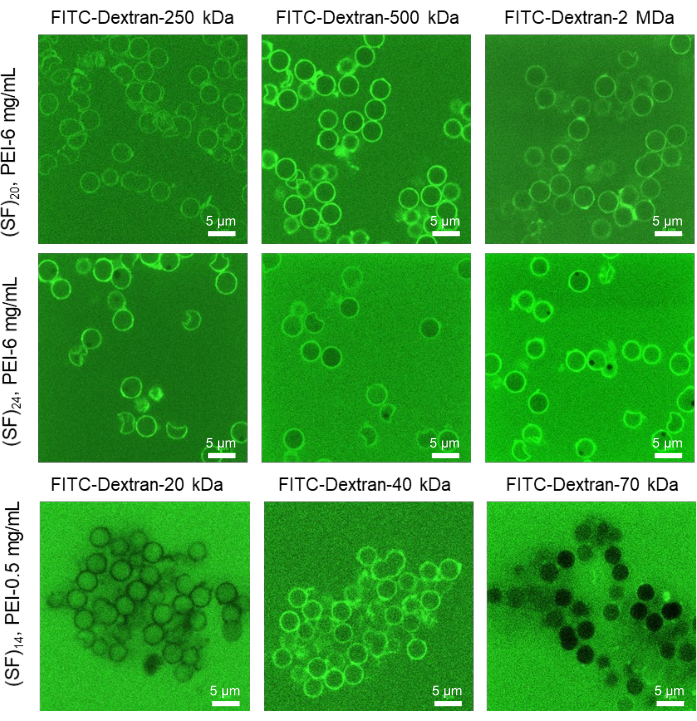
Рисунок 4: Оценка проницаемости мембраны для микрокапсул шелка методом MWCO. Селективные CLSM репрезентативные флуоресцентные изображения полых микрокапсул фиброина шелка, подвергнутых растворам FITC-Dextran различных Mw (20 мкМ, diH2O). Капсулы готовили с разным количеством слоев и концентрацией PEI. Увеличение концентрации первичного слоя приводит к повышению коллоидной стабильности микрокапсул с более проницаемыми оболочками, в то время как устранение первичного слоя вызывает агрегацию капсул с менее проницаемыми мембранами оболочки. Масштабная линейка: 5 мкм. Этот рисунок был перепечатан из Drachuk, I. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Активация конструкции датчика ThyRS в микрокапсулах фиброина шелка. (A) Кинетика экспрессии GFPa1 во время активации ThyRS из плазмид ДНК, загруженных в 20-слойные микрокапсулы SF (линии красного цвета) и контрольной неинкапсулированной ДНК (линии синего цвета). Сверху вниз концентрации ДНК в объеме образца (50 мкл) составляли 6,5 нг/мкл, 4,5 нг/мкл, 2,5 нг/мкл и 0 нг/мкл и соответствуют изменениям интенсивности цвета. (B) CLSM-изображения капсул фиброина шелка, загруженных 32 копиями ДНК на капсулу. Масштабная линейка: 5 мкм. (C) Изображение соответствует профилям интенсивности поперечного сечения, соответствующим изображению (B) на двух капсулах (белая линия в B). Красная линия представляет шелковые капсулы, а зеленая линия представляет GFPa1, выраженную в капсулах. (D) Изображение представляет собой визуализированные 3D-шелковые капсулы, загруженные 32 копиями ДНК после инкубации в системе IVTT. Зеленая флуоресценция соответствует сигналу GFPa1, а красная флуоресценция соответствует флуоресцентно меченным слоям шелка. Масштабная линейка: 2 мкм. Активацию ThyRS проводили теофиллином (2 мМ, ДМСО) во время инкубации микрокапсул в системе IVTT (экстракт S30). Этот рисунок был перепечатан из Drachuk, I. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
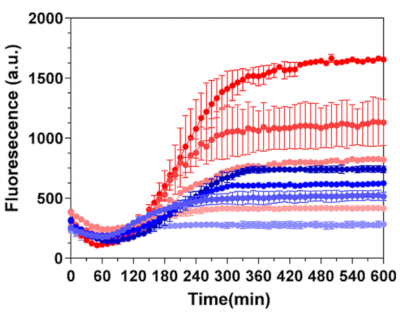
Рисунок 6: Активация BroccApt в микрокапсулах фиброина шелка. Сравнение кинетики транскрипции проводилось для 20-слойных шелковых микрокапсул, загруженных 30 копиями ДНК на капсулу (линии красного цвета) и контрольной неинкапсулированной ДНК (линии синего цвета). Сверху вниз концентрации инкапсулированной ДНК в образце составляли: 3,6 нг/мкл, 2 нг/мкл, 1 нг/мкл и 0 нг/мкл и соответствуют изменениям интенсивности цвета. Концентрации неинкапсулированной ДНК составляли: 20 нг/мкл, 10 нг/мкл, 5 нг/мкл и 0 нг/мкл и соответствуют изменениям интенсивности цвета. Активацию проводили DHBFI-1T (100 мкМ, diH2O) во время инкубации в бесклеточной системе PURE. Этот рисунок был перепечатан из Drachuk, I. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Дизайн датчика ДНК | Начальная концентрация ДНК (нг/мкл) | Количество копий ДНК на капсулу (ДНК/капсула) |
| 50 | 16 | |
| ТиРС | 100 | 32 |
| 150 | 48 | |
| 200 | 64 | |
| 50 | 10 | |
| БрокАпт | 100 | 20 |
| 150 | 30 | |
| 200 | 40 |
Таблица 1: Количество копий ДНК на капсулу для каждого дизайна ДНК. Число копий рассчитывалось в соответствии с уравнением 1 и коррелировало с исходной концентрацией плазмид ДНК, сродством к сохранению последовательностей ДНК в процессе осаждения LbL и длиной плазмид ДНК.
| МВт ФИТК-декстрана (кДа) | Гидродинамический радиус (нм) |
| 4 | 1.4 |
| 20 | 3.3 |
| 40 | 4.5 |
| 70 | 6 |
| 150 | 8.5 |
| 250 | 10 |
| 500 | 14 |
| 2,000 | 18 |
Таблица 2: Физические свойства FITC-dextrans. Гидродинамический радиус для каждого флуорофора был использован для оценки проницаемости микрокапсул полого фиброина шелка.
Обсуждение
Селективно проницаемые гидрогелевые микрокапсулы, загруженные различными типами ДНК-кодируемых сенсорных конструкций, могут быть получены в соответствии с этим протоколом. Одной из отличительных особенностей подхода LbL является возможность адаптировать сложность микрокапсул во время сборки снизу вверх, которая обычно начинается с адсорбции молекулярных частиц на жертвенных шаблонах. Тщательно регулируя концентрации исходных компонентов, условия рН и количество слоев, можно получить микрокапсулы с различными параметрами загрузки ДНК, функциональностью и перестраиваемой проницаемостью23. Чтобы усилить универсальность капсул, может быть достигнута дальнейшая функционализация поверхности оболочки с помощью AuNP и IgG для реализации биосовместимых сенсорных носителей для диагностики in vivo . Оба этих альтернативных пути основаны на уникальной молекулярной структуре фиброина шелка. Восстановление ионов Au3+ in situ может быть достигнуто благодаря наличию остатков тирозина (5,3% мол.), способных восстанавливать ионы металлов в присутствии оптимального восстановительного буфера. Конъюгация специфических антител с поверхностью AuNPs-функционализированных белковых микрокапсул может быть осуществлена путем реализации химии активации карбодиимида. Оба этих шага требуют тщательной разработки и оптимизации протокола для достижения надлежащей функциональности биосенсорных капсул для будущих применений. Например, чтобы использовать эти микрокапсулы в качестве «умных» систем доставки, в которых молекулярный груз доставляется по определенным стимулам (таким как pH или химические сигналы), необходимо охарактеризовать и настроить конкретные свойства этих капсул, включая эффективность доставки, время удержания, путь введения и лечение модели заболевания.
Микрокапсулы, нагруженные ДНК, были охарактеризованы методом CLSM и измерениями флуоресценции. Однако другие методы характеризации, такие как атомно-силовая микроскопия (АСМ), криогенная электронная томография (CEM) и прямая стохастическая реконструктивная микроскопия сверхвысокого разрешения (dSTORM), могут применяться для дифференциации специфических структур микрокапсул, включая отдельные волокна, нанодомены и локализацию плазмид ДНК24,25,26.
В разработанном протоколе подчеркивается использование биополимера фиброина шелка в качестве биосовместимого сетевого материала, сохраняющего третичную структуру нагруженных плазмид ДНК. Стабильность иммобилизованных последовательностей ДНК в сети фиброина шелка достигается за счет гидрофобных взаимодействий и/или водородных связей, которые обеспечивают защитное микроокружение от инактивации pH, окисления или гидролиза27. Кроме того, β-кристаллические домены фиброина шелка обеспечивают уникальный механический барьер, ограничивая движение захваченных макромолекул и предотвращая деградацию плазмид ДНК при хранении в водных растворах.
Полупроницаемая природа микрокапсул фиброина шелка, загруженных матрицами ДНК, создала уникальные пространственные и физико-химические условия для реакций IVTT. Транскрипционно и трансляционно активированная РНК аптамер и рибопереключатель, иммобилизованные в микрокапсулах фиброина шелка, смогли получить выходной сигнал, который был, по крайней мере, в три раза выше по сравнению со свободными неиммобилизованными датчиками. Кроме того, иммобилизация матриц ДНК в микрокапсулах может значительно повысить активность инкапсулированных сенсоров за пределами предела обнаружения неинкапсулированных. В то время как неинкапсулированные датчики имели минимальную реакцию при низких концентрациях ДНК, инкапсулированные датчики имели очень отчетливую выходную реакцию, которую можно легко титровать, чтобы отразить тонкие изменения концентраций ДНК. Улучшенный сигнал ответа инкапсулированных репортеров, вероятно, был связан с неограниченной диффузией компонентов оборудования IVTT и снижением подвижности плазмид ДНК. В нескольких исследованиях было признано, что выход синтеза белка в бесклеточных реакциях зависит от макромолекулярной среды28,29. Иммобилизация плазмид ДНК в шелковую сеть обеспечила эффективную замкнутую среду, ограничивающую движение олигонуклеотидов и ускоряющую реакции механизма транскрипции/трансляции даже из нескольких копий ДНК21.
В то время как метод LbL обеспечивает очень универсальный подход к созданию многофункциональных сборок контролируемым образом, процедура изготовления занимает относительно много времени и, как правило, требует корректировки обработки для увеличения выхода микрокапсул. Еще одним соображением при создании микрокапсул на основе биомолекул является совместимость любой данной системы с требованиями к растворению ядра после завершения осаждения LbL. До сих пор для получения однородных по размеру и прочных полых микрокапсул на основе ДНК на основе шелка оболочки осаждались на шаблонах сердцевины жертвенного кремнезема (SiO2), что требовало последующего удаления с помощью травления плавиковой (HF) кислотой. Ни обработка HF, ни травление не считаются биосовместимыми процессами, что ограничивает их широкое использование в практических приложениях. Являясь альтернативой неорганическим коллоидным матрицамSiO2 , карбонатные ядра обычно инертны при образовании комплексов с полимерными слоями и могут растворяться в мягких условиях с использованием этилендиаминтетрауксусной кислоты (ЭДТА). Однако корректировка жертвенных ядер может повлиять на свойства осаждения многослойных слоев и целостность структуры оболочки, что требует дальнейшей оптимизации протокола.
Таким образом, текущий протокол позволяет готовить микрокапсулы на основе ДНК на основе шелка с различными конструкциями датчиков. Сочетание замкнутого микроокружения, обеспечиваемого методом LbL, и использования фиброина шелка в качестве биосовместимого материала улучшило сенсорные свойства инкапсулированной ДНК. С быстрым развитием технологии флуорогенных РНК-аптамеров потенциальное использование микрокапсул шелка, нагруженных ДНК, может быть расширено до мультиплексной диагностики in vitro. В последнее время появилось несколько вариаций флуоресцентных аптамеров на основе РНК в качестве мощной фоновой технологии для визуализации РНК в живых клетках с высокой чувствительностью отношения сигнал/шум30,31. Применяя нанотехнологию синтетической РНК для разработки искусственных РНК-аптамеров, флуорогенные свойства аптамеров могут быть использованы для обнаружения специфических лигандов, представляющих интерес. Эта технология будет особенно ценна для мониторинга биомаркеров, представляющих интерес, в различных форматах, включая бумажные датчики в точках использования, пластыри на основе гидрогеля для пота или интерстициальной жидкости и имплантируемые материалы.
Раскрытие информации
Взгляды и мнения, представленные в настоящем документе, принадлежат авторам и не обязательно отражают точку зрения МО или его компонентов
Благодарности
Эта работа была поддержана грантом LRIR 16RH3003J от Управления научных исследований ВВС, а также программой «Синтетическая биология для военной среды: прикладные исследования для продвижения приоритетов науки и техники» (ARAP) Управления заместителя министра обороны США по исследованиям и разработкам.
Последовательность плазмидных векторов для ThyRS (pSALv-RS-GFPa1, 3,4 кб) была щедро предоставлена доктором J. Gallivan. Коконы тутового шелкопряда из Bombyx mori были щедро пожертвованы доктором Д.Л. Капланом из Университета Тафтса, штат Массачусетс.
Материалы
| Name | Company | Catalog Number | Comments |
| (Z)-4-(3,5-difluoro-4-hydroxybenzylidene)-2-methyl-1-(2,2,2-trifluoroethyl)-1H-imidazol-5(4 H)-one (DFHBI-1T) | Lucerna | DFHBI-1T | |
| 5x T4 DNA Ligase Buffer | ThermoFisher Scientific | 46300-018 | |
| 6x Blue Gel Loading Dye | New England BioLabs | B7021S | |
| 96-well plates, black circular | Corning | 3601 | |
| Agarose | Sigma-Aldrich | A9539 | BioReagent, for molecular biology, low EEO |
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | powder or crystals, BioReagent, suitable for cell culture |
| BlpI restriction enzymes | New England BioLabs | R0585S | |
| Corning Disposable Vacuum Filter/Storage Systems | FisherScientific | 09-761-1 | |
| Dimethyl sulfoxide, DMSO | Sigma-Aldrich | 472301 | ACS reagent, ≥99.9% |
| DNA Plasmid, pET28c-F30-2x Broccoli (5.4 kb), BrocApt. | Addgene | Plasmid #66788 | |
| DyLightTM550 Antibody Labeling kit (Invitrogen) | ThermoFisher Scientific | 84530 | |
| E. coli S30 extract system for circular DNA | Promega | L1020 | |
| Falcon Conical centrifuge tubes, 15 mL | FisherScientific | 14-959-53A | |
| Falcon Conical centrifuge tubes, 50 mL | 14-432-22 | ||
| Fisherbrand Microcentrifuge tubes, 1.5 mL | FisherScientific | 05-408-129 | |
| Hydrofluoric acid, HF | Sigma-Aldrich | 695068 | ACS reagent, 48% |
| Kanamycin sulfate | Sigma-Aldrich | 60615 | mixture of Kanamycin A (main component) and Kanamycin B and C |
| KpnI restriction enzymes | New England BioLabs | R0142S | |
| LB agar plate supplemented with 100 µg/mL ampicillin | Sigma-Aldrich | L5667 | pre-poured agar plates with 100 µg/mL ampicillin |
| LB agar plate supplemented with 50 µg/mL kanamycin | Sigma-Aldrich | L0543 | pre-poured agar plates with 50 µg/mL kanamycin |
| LB broth (Lennox grade) | Sigma-Aldrich | L3022 | |
| Lithium bromide, LiBr | Sigma-Aldrich | 213225 | ReagentPlus, ≥99% |
| Max Efficiency DH5-α competent E. coli strain | ThermoFisher Scientific | 18258012 | |
| Methanol | MilliporeSigma | 322415 | anhydrous, 99.8% |
| MilliQ-water | EMD MilliPore | Milli-Q Reference Water Purification System | |
| MinElute PCR Purification Kit | Qiagen | 28004 | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride, EDC | Sigma-Aldrich | E1769 | |
| PBS (phosphate buffered saline) | ThermoFisher Scientific | 10010023 | 1x PBS, pH 7.4 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| Polyethylenimine, branched | Sigma-Aldrich | 408727 | average Mw ~25,000 |
| PURExpress In Vitro Protein Synthesis Kit | New England BioLabs | E6800S | |
| QIAEX II Gel Extraction Kit | Qiagen | 20021 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| Quick-Load 2-Log DNA Ladder (0.1-10.0 kb) | New England BioLabs | N0469S | |
| SiO? silica microspheres, 4.0 µm | Polysciences, Inc. | 24331-15 | 10% aqueous solution |
| Slide-A-Lyzer G2 Dialysis Cassettes, 3.5K MWCO, 15 mL | ThermoFisher Scientific | 87724 | |
| Sodium carbonate, Na?CO? | Sigma-Aldrich | 222321 | ACS reagent, anhydrous, ≥99.5%, powder |
| Spectrum Spectra/Por Float-A-Lyzer G2 Dialysis Devices | FisherScientific | 08-607-008 | Spectrum G235058 |
| SYBR Safe DNA gel stain | ThermoFisher Scientific | S33102 | |
| T4 DNA Ligase (5 U/µL) | ThermoFisher Scientific | EL0011 | |
| Theophylline | Sigma-Aldrich | T1633 | anhydrous, ≥99%, powder |
| Tris Acetate-EDTA buffer (TAE buffer) | Sigma-Aldrich | T6025 | Contains 40 mM Tris-acetate and 1 mM EDTA, pH 8.3. |
| UltraPure DNase/RNase-Free Distilled Water | FisherScientific | 10-977-023 | |
| ZymoPURE II Plasmid MaxiPrep kit | ZymoResearch | D4202 |
Ссылки
- Slomovic, S., Pardee, K., Collins, J. J. Synthetic biology devices for in vitro and in vivo diagnostics. Proceedings of the National Academy of Sciences of the United States of America. 112 (47), 14429-14435 (2015).
- Harbaugh, S. V., Goodson, M. S., Dillon, K., Zabarnick, S., Kelley-Loughnane, N. Riboswitch-based reversible dual-color sensor. ACS Synthetic Biology. 6 (5), 766-781 (2017).
- König, H., Frank, D., Heil, R., Coenen, C. Synthetic genomics and synthetic biology applications between hopes and concerns. Current Genomics. 14 (1), 11-24 (2013).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: An expanded repertoire of applications. Nature Reviews Genetics. 21, 151-170 (2020).
- Chushak, Y., et al. Characterization of synthetic riboswitch in cell-free protein expression systems. RNA Biology. , 1-12 (2021).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- Grӓwe, A., et al. A paper-based, cell-free biosensor system for the detection of heavy metals and date rape drugs. PLoS One. 14 (3), 0210940(2019).
- Lin, X., et al. Portable environment-signal detection biosensors with cell-free synthetic biosystems. RSC Advances. 10 (64), 39261-39265 (2020).
- Caschera, F., Lee, J. W., Ho, K. K. Y., Liu, A. P., Jewett, M. C. Cell-free compartmentalized protein synthesis inside double emulsion templated liposomes with in vitro synthesized and assembled ribosomes. Chemical Communications. 52 (31), 5467-5469 (2016).
- Niederholtmeyer, H., Chaggan, C., Devaraj, N. K. Communication and quorum sensing in non-living mimics of eukaryotic cells. Nature Communications. 9, 5027(2018).
- Timin, A. S., Gould, D. J., Sukkhorukov, G. B. Multi-layer microcapsules: Fresh insights and new applications. Expert Opinion on Drug Delivery. 14 (5), 583-587 (2017).
- Bomati, E. K., Haley, J. E., Noel, J. P., Deheyn, D. D. Spectral and structural comparison between bright and dim green fluorescent proteins in Amphioxus. Scientific Reports. 4, 5469(2014).
- Frey, B. Amplification of Genomic DNA by PCR. Molecular Diagnosis of Infectious Diseases. Methods in Molecular Medicine. Reischl, U. 13, Humana Press. Totowa, NJ. 143-156 (1998).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Zhou, Y., et al. Rapid regeneration and reuse of silica columns from PCR purification and gel extraction kits. Scientific Reports. 8, 12870(2018).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5α-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), 0137466(2015).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Drachuk, I., et al. Silk macromolecules with amino acid-Poly(Ethylene Glycol) grafts for controlling layer-by-layer encapsulation and aggregation of recombinant bacterial cells. ACS Nano. 9 (2), 1219-1235 (2015).
- Antipov, A. A., Sukhorukov, G. B. Polyelectrolyte multilayer capsules as vehicles with tunable permeability. Advances in Colloid and Interface Science. 111 (1-2), 49-61 (2004).
- Drachuk, I., Harbaugh, S., Chávez, J. L., Kelley-Loughnane, N. Improving the activity of DNA-encoded sensing elements through confinement in silk microcapsules. ACS Applied Materials & Interfaces. 12 (43), 48329-48339 (2020).
- Melnikov, S., Ben-Shem, A., Garreau de Loubresse, N., Jenner, L., Yusupova, G., Yusupov, M. Structural basis for the inhibition of the eukaryotic ribosome. Nature Structural & Molecular Biology. 19 (6), 560-567 (2012).
- Zhao, S., et al. The future of layer-by-layer assembly: A tribute to ACS Nano associate editor Helmuth Möhwald. ACS Nano. 13 (6), 6151-6169 (2019).
- Main, K. H. S., Provan, J. I., Haynes, P. J., Wells, G., Hartley, J. A., Pyne, A. L. B. Atomic force microscopy-A tool for structural and translational DNA research. APL Bioengineering. 5, 031504(2021).
- Riera, R., Feiner-Gracia, N., Fornaguera, C., Cascante, A., Borrós, S., Albertazzi, L. Tracking the DNA complexation state of pBAE polyplexes in cells with super resolution microscopy. Nanoscale. 11 (38), 17869-17877 (2019).
- Bilokapic, S., Strauss, M., Halic, M. Cryo-EM of nucleosome core particle interactions in trans. Scientific Reports. 8, 7046(2018).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Fritz, B. R., Jamil, O. K., Jewett, M. C. Implications of macromolecular crowding and reducing conditions for in vitro ribosome construction. Nucleic Acids Research. 43 (9), 4774-4784 (2015).
- Ge, X., Luo, D., Xu, J. Cell-free protein expression under macromolecular crowding conditions. PLoS One. 6 (12), 28707(2011).
- Cawte, A. D., Unrau, P. J., Rueda, D. S. Live cell imaging of single RNA molecules with fluorogenic mango II arrays. Nature Communications. 11, 1283(2020).
- Chen, X., et al. Visualizing RNA dynamics in live cells with bright and stable fluorescent RNAs. Nature Biotechnology. 37 (11), 1287-1293 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены