Method Article
تحضير كبسولات دقيقة متعددة الوظائف تعتمد على الحرير محملة ببلازميدات الحمض النووي المشفرة ل RNA Aptamers و Riboswitches
In This Article
Summary
يصف البروتوكول تكوين كبسولات دقيقة قوية ومتوافقة حيويا محملة بالحمض النووي على أنها أجهزة استشعار حيوية متعددة الإرسال في المختبر قادرة على تتبع العديد من الروابط.
Abstract
نقدم بروتوكولا لإعداد كبسولات فيبروين الحريرية المحملة بالحمض النووي عبر طريقة التجميع طبقة تلو الأخرى (LbL) على النوى الكروية القربانية. بعد امتصاص الطبقة الأولية وبلازميدات الحمض النووي ، تم تسهيل تكوين كبسولات دقيقة قوية عن طريق تحفيز صفائح β في بنية ثانوية من الحرير أثناء الجفاف الحاد لطبقة حرير واحدة. ومن ثم ، حدثت الطبقات عن طريق روابط هيدروجينية متعددة وتفاعلات كارهة للماء. عند امتزاز الأصداف متعددة الطبقات ، يمكن زيادة تشغيل هياكل القشرة الأساسية باستخدام جسيمات الذهب النانوية (AuNPs) و / أو الأجسام المضادة (IgG) لاستخدامها في الاستشعار عن بعد و / أو التسليم المستهدف. أدى ضبط العديد من المعلمات الرئيسية أثناء الترسيب المتسلسل للجزيئات الرئيسية على نوى السيليكا مثل وجود برايمر بوليمر ، وتركيز الحمض النووي وبروتين الحرير ، بالإضافة إلى عدد من الطبقات الممتصة إلى كبسولات دقيقة متوافقة حيويا ومحملة بالحمض النووي مع نفاذية متغيرة وتحميل الحمض النووي. عند انحلال نوى السيليكا ، أظهر البروتوكول تكوين كبسولات دقيقة مجوفة وقوية مع بلازميدات الحمض النووي يجمد على السطح الداخلي لغشاء الكبسولة. أدى إنشاء غشاء متوافق حيويا قابل للنفاذ بشكل انتقائي بين بلازميدات الحمض النووي والبيئة الخارجية إلى الحفاظ على الحمض النووي أثناء التخزين طويل الأجل ولعب دورا مهما في تحسين استجابة الإخراج من البلازميدات المحصورة مكانيا. تم اختبار نشاط قوالب الحمض النووي وإمكانية الوصول إليها أثناء تفاعلات النسخ والترجمة في المختبر (الأنظمة الخالية من الخلايا). تم تنشيط بلازميدات الحمض النووي التي تشفر أبتامير إضاءة الحمض النووي الريبي ومفاتيح الريبوسويتشات بنجاح مع التحليلات المقابلة ، كما تم تصوره أثناء توطين نسخ الحمض النووي الريبي المسمى بالفلورسنت أو بروتين GFPa1 في أغشية القشرة.
Introduction
يوفر مجال البيولوجيا التركيبية فرصا فريدة لتطوير قدرات الاستشعار من خلال استغلال الآليات الطبيعية التي تطورها الكائنات الحية الدقيقة لرصد بيئتها والتهديدات المحتملة. الأهم من ذلك ، ترتبط آليات الاستشعار هذه عادة باستجابة تحمي هذه الكائنات الحية الدقيقة من التعرض الضار ، وتنظم التعبير الجيني للتخفيف من الآثار السلبية أو منع تناول المواد السامة. كانت هناك جهود كبيرة لهندسة هذه الكائنات الحية الدقيقة لإنشاء أجهزة استشعار خلية كاملة تستفيد من هذه الاستجابات الطبيعية ولكن إعادة توجيهها للتعرف على أهداف جديدة و / أو لإنتاج إشارة قابلة للقياس يمكن قياسها لأغراض القياس الكمي (عادة مضان)1,2. في الوقت الحالي ، تشير المخاوف المتعلقة باستخدام الكائنات الحية الدقيقة المعدلة وراثيا (GMOs) ، خاصة عند إطلاقها في البيئة أو جسم الإنسان ، بسبب تسرب خلايا كاملة أو بعض موادها الوراثية ، حتى لو كانت مغلفة في مصفوفة بوليمر ، إلى أن هناك حاجة إلى طرق بديلة لاستغلال أساليب الاستشعار هذه3.
نهج قوي لاستغلال فوائد الاستشعار القائم على الكائنات الحية الدقيقة دون القلق بشأن نشر الكائنات المعدلة وراثيا هو استخدام أنظمة النسخ / الترجمة في المختبر (IVTT). من منظور عملي ، تتكون أنظمة IVTT من خليط يحتوي على معظم مكونات الخلية في حالة نشطة تم "استخراجها" من الخلايا بوسائل مختلفة ، بما في ذلك صوتنة ، ضرب حبة ، أو غيرها4. المنتج النهائي لهذه العملية هو خليط تفاعل كيميائي حيوي تم تحسينه بالفعل لإجراء النسخ والترجمة التي يمكن استخدامها لاختبار أجهزة استشعار مختلفة بتنسيق "وعاء مفتوح" ، دون القيود المرتبطة باستخدام خلايا كاملة (انتشار الغشاء ، كفاءة التحويل ، سمية الخلية ، إلخ). الأهم من ذلك ، يمكن إضافة مكونات استشعار مختلفة كميا ، ودراسة تأثيرها بواسطة تقنيات بصرية ومطيفية مختلفة ، كما أوضحنا5. وقد لوحظ أن أداء أنظمة IVTT يمكن أن يكون غير متسق. ومع ذلك ، فقد أظهرت الدراسات الحديثة مناهج لتوحيد إعدادها وتوصيفها ، وهو أمر مفيد للغاية عند دراسة أدائها في تصميم أجهزة الاستشعار6. في الآونة الأخيرة ، تم عرض العديد من الأمثلة على أنظمة IVTT المستخدمة لإنشاء مقايسات ورقية من خلال التجفيد لمكوناتها في مصفوفات الورق ، بما في ذلك الكشف عن أيونات المعادن الثقيلة والأدوية وعناصر استشعار النصاب وغيرها7،8،9. مساحة تطبيق مثيرة لأجهزة الاستشعار المستندة إلى IVTT هي استخدامها في تطبيقات الاستشعار في أنواع مختلفة من البيئات ، بما في ذلك التربة والمياه وجسم الإنسان. من أجل نشر أنظمة IVTT هذه في هذه البيئات الصعبة ، يجب تنفيذ نهج تغليف لاحتواء مكونات IVTT وحمايتها من التدهور.
تشمل طرق التغليف الأكثر شيوعا لأنظمة IVTT استخدام كبسولات الدهون والمذيلات والبوليميرات وغيرها من الحاويات الدقيقة المغلقةبإحكام 10،11،12. ويتمثل أحد عيوب هذا النهج في الحاجة إلى إدماج آليات سلبية أو إيجابية لنقل المواد داخل الحاويات وخارجها للسماح بالاتصال بالبيئة الخارجية وتوفير قدرات الاستشعار. للتغلب على بعض هذه المشكلات ، تشير الدراسة هنا إلى طريقة توفر نهجا بسيطا ولكنه فعال لتغليف مواد التشفير لتصميمات أجهزة الاستشعار المختلفة التي سيتم التعبير عنها في أنظمة IVTT. يعتمد هذا النهج على استخدام ترسب طبقة تلو الأخرى (LbL) للبوليمر الحيوي في وجود البلازميدات ذات الأهمية لإنشاء كبسولات دقيقة مجوفة ذات مسامية عالية ، مما يسمح للمادة الوراثية المحمية بالتفاعل مع المكونات المختلفة ل IVTT المختار. أظهرت الدراسة أن البلازميدات المغلفة يمكن أن توجه النسخ والترجمة عند تنشيطها داخل هذه المصفوفة البوليمرية ، كما هو موضح مع استجابة الأبتامير المشفر بالبلازميد والريبوسويتش إلى أهدافهما المقابلة. بالإضافة إلى ذلك ، يحمي طلاء LbL هذا البلازميدات لعدة أشهر دون أي ظروف تخزين خاصة.
Protocol
1. بناء ناقلات البلازميد.
- بناء متجه بلازميد (pSALv-RS-GFPa1، 3.4 كيلو بايت) عن طريق تضخيم تسلسل الترميز لريبوسويتش الثيوفيلين (ThyRS) مقترنا ب GFPa1 من ناقل pJ201: 23976-RS-GFPa1 (تم تصميمه وإنشاؤه بواسطة DNA2.0) وإدخاله في متجه تعبير الإشريكية القولونية ، pSAL13. استخدم البادئات الأمامية (5'-CGTGGTACCGGTGATACCAGCATCGTCTTGATG-3') والخلفية (5'-CGTGCTCAGCTTAAGCCAGCTCGTAG-3') لتضخيم تسلسل ترميز ThyRS إلى جانب GFPa1 وإجراء تفاعل تفاعل PCR بحجم 50 ميكرولتر باستخدام بوليميراز الحمض النووي وفقا لبروتوكولالشركة المصنعة 14.
- تحضير هلام الأغاروز 1 ٪ من 0.5 غرام من الأغاروز ، 50 مل من العازلة TAE (40 مليمتر تريس خلات ، 1 مللي متر EDTA ، درجة الحموضة 8.0) ، و 3 ميكرولتر من صبغة الحمض النووي.
- امزج 5 ميكرولتر من القسمة من المنتج المضخم PCR مع 5 ميكرولتر من الماء الخالي من RNase / DNase و 2 ميكرولتر من صبغة تحميل هلام 6x وقم بتحليلها بواسطة الرحلان الكهربائي لهلام الأغاروز. قم بتحميل سلم الحمض النووي (0.1-10.0 كيلو بايت) كمرجع. قم بتشغيل الجل عند 120 فولت حتى يصل خط الصبغة تقريبا إلى قاع الجل.
- تصور شظايا الحمض النووي باستخدام نظام تصوير الأشعة فوق البنفسجية للتحقق من الحجم الصحيح للحمض النووي15.
- قم بتنقية منتج PCR باستخدام مجموعة تنقية PCR وفقا لبروتوكول الشركة المصنعة16.
- هضم منتج تفاعل البوليميراز المتسلسل ومتجه تعبير pSAL مع إنزيمات تقييد KpnI و BlpI في تفاعل 15 ميكرولتر ، يحتوي على 10 ميكرولتر من منتج تفاعل البوليميراز المتسلسل أو ناقل البلازميد (تركيز 20-50 نانوغرام / ميكرولتر) ، 1.5 ميكرولتر من محلول إنزيم 10x ، 1 ميكرولتر من كل إنزيم ، و 1.5 ميكرولتر من الماء الخالي من RNase / DNase ، عند 37 درجة مئوية لمدة ساعتين.
- أضف 3 ميكرولتر من صبغة تحميل الجل 6x إلى خليط التفاعل وافصل الأجزاء المهضومة على هلام أغاروز 1٪ كما هو موضح في الخطوات 1.3-1.5.
- قم بتنقية شظايا الحمض النووي باستخدام مجموعة استخراج هلام وفقا لبروتوكول الشركة المصنعة16.
- قم بربط منتج تفاعل البوليميراز المتسلسل المهضوم في ناقل بلازميد خطي مهضوم ، pSAL ، باستخدام T4 DNA ligase ومخزن ligase المكمل في تفاعل 10 ميكرولتر يحتوي على 3-20 fmol من الناقل المهضوم ، 9-60 fmol من منتج تفاعل البوليميراز المتسلسل المهضوم ، 2 ميكرولتر من المخزن المؤقت ligase ، 1 μL (وحدة واحدة) من T4 DNA Ligase ، والماء الخالي من DNase / RNase. احتضان تفاعل الربط عند 25 درجة مئوية لمدة 3 ساعات.
ملاحظة: تأكد من أن إجمالي محتوى الحمض النووي في خليط التفاعل هو 0.01-0.1 ميكروغرام. - تحويل الخلايا المختصة E. coli DH5α مع 10 نانوغرام من خليط تفاعل الربط وفقا لبروتوكول الشركة المصنعة17.
- تنمو الخلايا المحولة عند 37 درجة مئوية طوال الليل على ألواح LB-agar المكملة بالأمبيسلين (100 ميكروغرام / مل).
- اختر 3-4 مستعمرات بكتيرية من اللوحة وانقل كل منها بشكل معقم إلى 5 مل من وسائط LB المكملة بالأمبيسلين (100 ميكروغرام / مل). قم بزراعة الثقافات بين عشية وضحاها عند 37 درجة مئوية في حاضنة اهتزاز عند 225 دورة في الدقيقة.
- بيليه الثقافات بين عشية وضحاها عن طريق الطرد المركزي في 11 × غرام لمدة 3 دقائق في درجة حرارة الغرفة.
- استخدم مجموعة تنقية لتنقية البلازميدات وفقا لبروتوكولالشركة المصنعة 16.
- تحقق من تسلسل البلازميدات المنقاة عن طريق تسلسل الحمض النووي. يظهر الشكل 1 خريطة البلازميد وتسلسل البنية الناتجة (pSALv-RS-GFPa1).
2. تنقية الحمض النووي على نطاق واسع.
- تحويل ناقل البلازميد pSALv-RS-GFPa1 (3.4 كيلو بايت) (ترميز الثيوفيلين ريبوسويتش إلى جانب جين مراسل GFPa1) أو pET28c-F30-2xBroccoli (5.4 كيلو بايت) (ترميز القرنبيط أبتامير) إلى خلايا E. coli DH5α المختصة وفقا لبروتوكولالشركة المصنعة 17.
- تنمو الخلايا المحولة عند 37 درجة مئوية طوال الليل على ألواح LB-agar المكملة بالأمبيسلين (100 ميكروغرام / مل) للخلايا المحولة باستخدام pSALv-RS-GFPa1 أو الكانامايسين (50 ميكروغرام / مل) للخلايا المحولة باستخدام البروكلي pET28c-F30-2x.
- اختر 3-4 مستعمرات بكتيرية من الصفيحة وانقل كل مستعمرة بشكل معقم إلى 5 مل من وسط LB المكمل بمضاد حيوي مناسب (100 ميكروغرام / مل أمبيسيلين أو 50 ميكروغرام / مل كاناميسين). قم بزراعة الثقافات بين عشية وضحاها عند 37 درجة مئوية في حاضنة اهتزاز عند 225 دورة في الدقيقة.
- استخدم 3 مل من المستزرع الليلي للتلقيح في 150 مل من LB المكمل بمضاد حيوي مناسب (100 ميكروغرام / مل أمبيسيلين أو 50 ميكروغرام / مل كاناميسين) وقم بزراعة المزارع طوال الليل عند 37 درجة مئوية في حاضنة اهتزاز عند 225 دورة في الدقيقة.
- قم بإذابة الخلايا عن طريق الطرد المركزي عند ≥3400 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- استخدم مجموعة تنقية لتنقية البلازميدات وفقا لبروتوكولالشركة المصنعة 16.
- تخلص من الحمض النووي ب 0.5 مل من الماء النقي الخالي من DNase / RNase. قم بقياس تركيز الحمض النووي وإعداد 1 مل من محاليل مخزون الحمض النووي (100 نانوغرام / ميكرولتر). قم بتخزين الأنابيب مع الحمض النووي عند 4 درجات مئوية حتى الاستخدام مرة أخرى.
3. استخراج الحرير فيبروين وإعداد المواد الأولية.
- قم بإعداد محلول مائي من بروتين فيبروين الحرير المعاد تشكيله (SF) من شرانق دودة القز Bombyx mori وفقا للإجراء الموضح بالتفصيل في مكان آخر لحساب 10٪ من محلول Silk-LiBr18.
- أوجد التركيز النهائي لمحلول SF المائي. ماصة 0.5 مل من محلول الحرير إلى طبق بتري 60 مم ، اتركه يجف عند 60 درجة مئوية ، وقم بقياس وزن فيلم الحرير الجاف. اقسم الوزن الجاف على 0.5 مل لحساب النسبة المئوية للوزن لكل حجم.
- قم بتخفيف محلول الحرير المركز بالماء المقطر الخالي من DNase / RNase عن طريق إضافة الماء ببطء عبر الماصة المصلية للحصول على تركيز نهائي 1 مجم / مل. قم بتخزين المحلول في درجة حرارة 4 درجات مئوية للاستخدام في المستقبل.
- تحضير فيبروين الحرير المسمى بالفلورسنت باستخدام مجموعة لصق الأجسام المضادة. استخدم 1 مل من محلول فيبروين الحرير 2 مجم / مل لإقران مجموعات N-terminal α-amino من البروتين بصبغة مشتقة منشطة بالإستر NHS وفقا لبروتوكولالشركة المصنعة 19.
- تحضير 50 مل من محلول مائي من البولي إيثيلين (PEI) بتركيز 6 مجم / مل ، اضبط الرقم الهيدروجيني على 4 مع حمض الهيدروكلوريك (1 م). قم بتصفية المحلول من خلال غشاء معقم 0.2 ميكرومتر. التخزين ممكن في الظروف المحيطة لعدة أشهر.
- إعداد SiO2 النوى. ماصة 300 ميكرولتر من جزيئات SiO 2 في أنبوب طرد مركزي دقيق سعة2 مل. اغسل الجسيمات الدقيقة مرتين ب 1 مل من الماء الخالي من DNase / RNase عن طريق الطرد المركزي عند 0.2 × جم لمدة دقيقة واحدة.
4. قم بإجراء ترسب طبقة تلو الأخرى للطبقة الأولية وبلازميدات الحمض النووي وطبقات الحرير.
- لإيداع طبقة PEI الأولية على الجسيمات الدقيقة SiO2 ، أضف 1 مل من محلول PEI إلى الحبيبات المغزولة من الخطوة 3.6 وقم بتحريك الخليط في الظروف المحيطة على خلاط حراري عند 800 دورة في الدقيقة لمدة 15 دقيقة. اغسل الجسيمات أربع مرات باستخدام 1 مل من الماء منزوع الأيونات الخالي من DNase / RNase عن طريق الطرد المركزي عند 0.2 × جم لمدة دقيقة واحدة.
- لإجراء ترسب طبقة الحمض النووي ، أضف 1 مل من المحلول المائي لبلازميدات الحمض النووي من الخطوة 2.7 إلى الجسيمات الدقيقة المحضرة في جزيرة الأمير إدوارد وحرك الخليط برفق عند 4 درجات مئوية على خلاط حراري عند 800 دورة في الدقيقة لمدة 15 دقيقة. لتحضير كبسولات دقيقة بأحمال مختلفة من الحمض النووي ، اضبط تركيز بلازميدات الحمض النووي من 50-200 نانوغرام / ميكرولتر باستخدام الماء المقطر الخالي من DNase / RNase واستخدم 1 مل من هذه المحاليل لإيداع الحمض النووي. جمع الجسيمات الدقيقة عن طريق الطرد المركزي في 0.2 × غرام لمدة 1 دقيقة.
- ضع علامة على الأنابيب الخاصة ببلازميدات الحمض النووي التي تشفر ريبوسويتش الثيوفيلين إلى جانب GFPa1 ك ThyRS-GFPa1 ، وبلازميدات الحمض النووي التي تشفر البروكلي أبتامير ك BrocApt.
ملاحظة: احتفظ بأنابيب الطرد المركزي الدقيقة مع الحمض النووي على الجليد. - قم بإزالة المادة الطافية بعناية واغسل الجسيمات الدقيقة أربع مرات باستخدام 1 مل من الماء المقطر الخالي من DNase / RNase ، في كل مرة تتخلص من المادة الطافية بعد الطرد المركزي عند 0.2 × جم لمدة دقيقة واحدة. قم بإجراء جميع التجارب في درجة حرارة الغرفة (RT) ما لم يتم تحديد خلاف ذلك.
- لإجراء ترسب طبقة الفبروين الحريرية ، أضف 1 مل من محلول SF المائي المعاد تشكيله من الخطوة 3.3 إلى الجسيمات الدقيقة الممتصة بالحمض النووي ، ودوامة بلطف وحرك الخليط عند 10 درجات مئوية على الخلاط الحراري عند 750 دورة في الدقيقة لمدة 15 دقيقة. اجمع الجسيمات الدقيقة عن طريق الطرد المركزي عند 0.2 × جم لمدة دقيقة واحدة عند 4 درجات مئوية ، وقم بإزالة المادة الطافية ، ثم اغسلها مرة واحدة ب 1 مل من الماء المقطر الخالي من DNase / RNase. كرر الطرد المركزي وتخلص من المادة الطافية.
ملاحظة: أثناء التجربة ، احتفظ بمحلول الحرير على الجليد لتجنب الهلام الناجم عن درجة الحرارة. - عالج الجسيمات تدريجيا بالميثانول للحث على تكوين صفائح β في بنية بروتين الحرير. أولا ، أضف 0.5 مل من الماء المقطر DNase / RNase ، دوامة أنبوب الطرد المركزي الدقيق ، ثم أضف 0.5 مل من الميثانول بنسبة 100٪. رج الجسيمات برفق على الخلاط الحراري على حرارة 10 درجات مئوية لمدة 5 دقائق. جمع الجسيمات عن طريق الطرد المركزي في 0.2 × غرام لمدة 1 دقيقة. إزالة الطاف.
- عالج الجسيمات بالميثانول لتعزيز تكوين صفائح β وضمان امتصاص مادي قوي لطبقة الحرير. أضف 1 مل من الميثانول بنسبة 100٪. هز الجسيمات برفق على الخلاط الحراري عند 750 دورة في الدقيقة لمدة 10 دقائق عند 10 درجات مئوية.
- اجمع الجسيمات عن طريق الطرد المركزي عند 0.2 × جم لمدة دقيقة واحدة عند 4 درجات مئوية واغسلها مرتين ب 1 مل من الماء المقطر الخالي من DNase / RNase في كل مرة ، وتخلص من المادة الطافية ودوامة بلطف قبل الطرد المركزي التالي.
- كرر الخطوات 4.5-4.8 20 مرة للحصول على هياكل قشرة أساسية متعددة الطبقات من الحرير. بالنسبة لخطوة الترسيب الأخيرة ، استخدم الحرير المسمى بالفلورسنت من الخطوة 3.4 (Silk-DyLight550 ، 1 مل).
- قم بإجراء خطوة الغسيل الأخيرة واحتفظ بالجسيمات الدقيقة في 1 مل من الماء المقطر الخالي من DNase / RNase في الظروف المحيطة.
ملاحظة: لتجنب تجميع الجسيمات أثناء ترسب طبقات الحرير ، قم بإجراء فحص بصري لتعليق الجسيمات وماصة لأعلى ولأسفل باستخدام طرف ماصة سعة 1 مل لتعزيز توزيع الجسيمات المتجانسة. - احسب عدد نسخ بلازميد الحمض النووي المغلفة في كل كبسولة دقيقة ، NDNA باستخدام المعادلة 1:
 (1)
(1)
حيث N = 6.769 × 1011 - عدد نوى SiO2 المستخدمة في التغليف. احسب ذلك من منحنى قياسي للتركيزات المعروفة لجزيئات السيليكا باستخدام التخفيفات التسلسلية والامتصاص A 320 عند λ =320 نانومتر ؛
ج- التركيز الأولي للحمض النووي المستخدم في الامتزاز
V- حجم الحمض النووي المستخدم في الامتزاز
0.8- كفاءة امتصاص الحمض النووي على النوى
Mw- الوزن الجزيئي لبلازميد الحمض النووي
نأ- رقم أفوجادرو (6.022 × 1023)
5. حل النوى للحصول على كبسولات الحرير الدقيقة.
- تحضير محلول حمض الهيدروفلوريك (HF) بنسبة 8٪ ، درجة الحموضة 5.5 ، عن طريق تخفيف محلول المخزون (48٪) بالماء المقطر. الحصول على أنبوب طرد مركزي سعة 50 مل. ماصة بعناية 5 مل من HF وإضافة 25 مل من الماء المقطر للحصول على 8٪ محلول HF.
تنبيه: HF هو حمض شديد التآكل وقد يسبب حروقا شديدة في الأنسجة. يجب توخي الحذر الشديد أثناء التعامل مع HF واستخدامه في التجارب. الالتزام بإجراءات التشغيل القياسية (SOP) للاستخدام والتعامل السليمين مع HF التي طورتها المنظمة لتجنب حوادث الانسكاب غير المرغوب فيها. لا تستخدم عبوات زجاجية لتخفيف حمض HF. استخدم الغطاء الكيميائي لتنفيذ هذه الخطوة من البروتوكول. - قم بإذابة نوى SiO2 بإضافة 1.5 مل من محلول HF بنسبة 8٪ إلى الجسيمات الدقيقة ذات القشرة الأساسية المحببة من الخطوة 4.10. دوامة بلطف واترك النوى تذوب طوال الليل في الظروف المحيطة مع اهتزاز لطيف عند 450 دورة في الدقيقة.
ملاحظة: لتجنب انسكاب HF ، استخدم شريط التطعيم لإغلاق أنبوب الطرد المركزي الدقيق. استخدم غطاء كيميائيا لتنفيذ هذه الخطوة من البروتوكول. - تحضير دورق زجاجي سعة 2 لتر مملوء ب 2 لتر من الماء منزوع الأيونات. نقل محلول الكبسولات الدقيقة إلى أجهزة غسيل الكلى (50 كيلو دالتون MWCO) وتحليلها ضد الماء منزوع الأيونات مع تغيير متكرر للمياه كل 3 ساعات لمدة 3 أيام قادمة.
ملاحظة: اجمع المادة الطافية خلال عمليات التبادل الثلاثة الأولى للمياه وتخلص من المحلول وفقا للبروتوكول المعمول به لمواد النفايات الخطرة. - استخدم ماصة سعة 1 مل لنقل التعليق من أجهزة غسيل الكلى إلى أنابيب طرد مركزي دقيقة جديدة سعة 2 مل لجمع الكبسولات الدقيقة.
ملاحظة: قم بتخزين المحاليل المائية للكبسولات الدقيقة في الظروف المحيطة لعدة سنوات.
6. تصوير كبسولات فيبروين الحرير الدقيقة باستخدام مجهر المسح بالليزر متحد البؤر (CLSM).
- إجراء تلطيخ الحمض النووي باستخدام صبغة الحمض النووي.
- انقل 300 ميكرولتر من كبسولات فيبروين الحريرية المجوفة إلى أنبوب طرد مركزي جديد سعة 1 مل. أضف 500 ميكرولتر من الماء المقطر الخالي من RNase / DNase.
- أضف 5 ميكرولتر من صبغة تلطيخ الحمض النووي ، دوامة لفترة وجيزة ، واحتضانها في RT لمدة 2 ساعة محمية من الضوء.
- قم بإجراء أربع خطوات غسيل عن طريق الطرد المركزي عند 0.1 × جم لمدة 20 دقيقة عند 4 درجات مئوية في كل مرة ، مع إزالة 400 ميكرولتر بعناية من المادة الطافية وتجديدها ب 400 ميكرولتر من الماء المقطر الخالي من RNase / DNase.
- قم بإجراء تصوير كبسولات الحرير على أنظمة متحدة البؤر مقلوبة مزودة بثلاثة ليزر رئيسية (405 نانومتر ، 488 نانومتر ، 561 نانومتر) باستخدام هدف غمر الزيت 100x (NA 1.49). انقل 100 ميكرولتر من عينة الكبسولة إلى بئر واحد من الشرائح الزجاجية ذات 8 غرف ، والسماح للكبسولات بالترسب لمدة 20-30 دقيقة قبل التصوير.
ملاحظة: الأصباغ حساسة جدا للتبييض الضوئي. حماية العينات من خلال تغطية الشرائح بورق الألمنيوم.
7. تقدير نفاذية الكبسولات الدقيقة المجوفة بطريقة قطع الوزن الجزيئي (MWCO).
- قم بإعداد 2 مل لكل من محاليل فلوروفور ديكستران المسمى FITC (20 ميكرومتر ، diH 2 O) من Mw مختلفة (4 كيلو دالتون ، 20 كيلو دالتون ، 40 كيلو دالتون ، 70 كيلو دالتون ، 150 كيلو دالتون ، 250 كيلو دالتون ، 500 كيلو دالتون ، و2ميجا فولت أمبير).
- ماصة 100 ميكرولتر من تعليق الكبسولات في بئر واحد من شريحة زجاجية حجرة. تحليل كل تصميم كبسولة دقيقة (تركيز جزيرة الأمير إدوارد ، تحميل عدد بلازميدات الحمض النووي ، تركيز فيبروين الحرير ، وعدد الطبقات) بشكل منفصل.
- لكل بئر ، أضف 300 ميكرولتر من محلول الفلوروفور المحدد بدءا من أدنى Mw حتى الأعلى ، بحيث يتوافق كل بئر مع محلول الفلوروفور المحدد. امزج عن طريق السحب لأعلى ولأسفل واترك الخليط يحتضن لمدة 1 ساعة في RT حتى يصل انتشار محاليل الفلوروفور إلى التوازن.
- انقل الشريحة إلى مجهر المسح الضوئي بالليزر متحد البؤر (CLSM) وصور كل بئر باستخدام هدف غمر الزيت 100x عند الإثارة λ = 488 نانومتر.
- حدد مجال الاهتمام عن طريق ضبط المستوى البؤري للتأكد من ظهور الكبسولات على شكل دوائر ذات قطر أكبر. يحدث هذا عادة عند عرض العينات بالقرب من قاع البئر عندما تترسب الكبسولات بسبب الجاذبية.
- اجمع عدة صور لعينات الكبسولات الدقيقة عن طريق تحريك الشريحة في اتجاه XY. التقط صورا لحساب ما يصل إلى 100-150 كبسولة لكل عينة.
- استخدم برنامج ImageJ لتحليل نفاذية غشاء الكبسولة في كل محلول فلوروفور Mw من خلال مقارنة شدة التألق داخل وخارج الكبسولات. لذلك ، ارسم منطقة اهتمام (ROI) في شكل دائرة لتحديد محيط الكبسولة وانقر فوق تحليل / قياس لقياس شدة التألق بالداخل. جدولة البيانات في جدول بيانات. قم بإجراء هذه العملية لكل كبسولة صغيرة لما مجموعه 200-300 كبسولة.
- قم بتقييم شدة التألق الخارجي بنفس الطريقة من خلال تحديد عائد الاستثمار وقياس الشدة بعيدا عن الكبسولات. إجراء 3-5 قياسات للتحليل الإحصائي.
- لإجراء التحليل الإحصائي ، قارن شدة التألق داخل وخارج الكبسولات باستخدام اختبار t المزدوج (p < 0.05).
- استخدم جدول التحويل 2 لتقدير نفاذية الكبسولات الدقيقة بناء على أنصاف الأقطار الهيدروديناميكية ل FITC-Dextran مع المتغير Mw.
8. في المختبر تفعيل ريبوسويتش الثيوفيلين الاصطناعية في كبسولات الحرير الدقيقة
- تحضير 1 مل من محلول مخزون الثيوفيلين (100 مللي مول ، DMSO). قم بإعداد نظام استخراج E. coli S30 للحمض النووي الدائري عن طريق إذابة المكونات على الجليد لمدة 40 دقيقة.
- احصل على أنبوب طرد مركزي خال من DNase / RNase سعة 0.5 مل. إجراء تفاعل النسخ / الترجمة في المختبر ، والجمع بين المكونات الخالية من الخلايا مع عينة من microcapsules بالترتيب التالي (الحجم الإجمالي 50 ميكرولتر): S30 بريمكس بدون أحماض أمينية (20 ميكرولتر) ؛ مستخلص S30 ، دائري (15 ميكرولتر) ؛ خليط كامل من الأحماض الأمينية (5 ميكرولتر) ؛ كبسولات مجوفة تحتوي على بلازميدات ThyRS-GFPa1 من الخطوة 4.10 (9 ميكرولتر) ؛ والثيوفيلين ، 100 mM DMSO (1 ميكرولتر).
ملاحظة: بعد إضافة جميع المكونات ، قم بدوامة الأنبوب لفترة وجيزة وجمع العينة أثناء الطرد المركزي القصير عند 0.2 × جم لبضع ثوان. - احتضان الأنبوب عند 30 درجة مئوية لمدة 4 ساعات وتحقق من التألق على قارئ اللوحة باستخدام الإثارة عند λ = 488 نانومتر والانبعاث لمرشح GFP / FITC (510 نانومتر ± 20 نانومتر).
- صور الكبسولات على أي نظام LCSM باستخدام ليزر 488 نانومتر و 561 نانومتر. احصل على أفضل جودة للصور باستخدام هدف الغمر بالزيت 100x والشرائح ذات 8 غرف جيدا.
9. في المختبر تفعيل البروكلي أبتامير في كبسولات الحرير الدقيقة
- تحضير 1 مل من محلول المخزون من صبغة DFHBI-1T (30 ميكرومتر ، diH2O). قم بإعداد مجموعة تفاعل النظام الخالي من الخلايا PURE (تخليق البروتين باستخدام العناصر المؤتلفة) عن طريق إذابة المكونات على الجليد لمدة 40 دقيقة.
- احصل على أنبوب طرد مركزي خال من DNase / RNase سعة 0.5 مل. إجراء تفاعل النسخ في المختبر عن طريق الجمع بين مكونات التفاعل الخالية من الخلايا مع عينة من الكبسولات الدقيقة بالترتيب التالي (الحجم الإجمالي 50 ميكرولتر): محلول A (20 ميكرولتر) ؛ محلول B (15 ميكرولتر) ؛ كبسولات مجوفة تحتوي على بلازميدات BrocApt من الخطوة 4.10 (14 ميكرولتر) ؛ وصبغة DFHBI-1T (1 ميكرولتر).
ملاحظة: بعد إضافة جميع المكونات ، قم بدوامة الأنبوب لفترة وجيزة وجمع العينة أثناء الطرد المركزي القصير عند 0.2 × جم لبضع ثوان. - احتضان الأنبوب عند 37 درجة مئوية لمدة 6 ساعات وتحقق من التألق على قارئ اللوحة باستخدام الإثارة عند λex = 470 nm والانبعاثات عند λem = 510 نانومتر ± 20 نانومتر.
- صور الكبسولات على أي نظام LCSM باستخدام ليزر 488 نانومتر و 561 نانومتر. احصل على أفضل جودة للصور باستخدام هدف الغمر بالزيت 100x ، والشرائح ذات الحجرة الزجاجية ذات الغطاء 8 آبار.
النتائج
هنا ، تتناول الدراسة وظائف قوالب الحمض النووي التي تشفر تصميمات أجهزة استشعار مختلفة (نوعان من عناصر النسخ / الترجمة التي ينظمها الحمض النووي الريبي) بعد التغليف في كبسولات بروتين الحرير. تم تحضير الكبسولات الدقيقة من خلال تجميع نموذجي طبقة تلو الأخرى (LbL) للمكونات الرئيسية: طبقة أولية ، وتصميمات مستشعر تشفير بلازميدات الحمض النووي ، والبوليمر الحيوي للفيبروين الحريري (الشكل 2). يسمح ترسب الجزيئات الكبيرة بطريقة الطبقات بالتحكم في نفاذية غشاء الكبسولة بناء على التفاعلات بين الجزيئات وداخلها بين الطبقات الممتصة وسمك القشرة. أتاحت نفاذية النظام القابلة للضبط إمكانية التحكم في انتشار الجزيئات الأساسية مع الحد من انتشار الجزيئات الكبيرة غير المرغوب فيها عبر غشاءالكبسولة 20.
متجانسة في الحجم (4.5 ميكرومتر) وكبسولات فيبروين حريرية قوية بسمك قشرة ~ 500 نانومتر (20 طبقة) في حالة رطبة يمكن إنتاجها عند اتباع البروتوكول بشكل صحيح (الشكل 3)21. سمح نهج LbL بضبط قدرة تحميل قوالب الحمض النووي بناء على التركيز الأولي للبلازميدات. يمكن تحقيق التحميل الأمثل للحمض النووي عن طريق تغيير التركيز الأولي لقوالب الحمض النووي من 50-200 نانوغرام / ميكرولتر. يمثل الجدول 1 عدد نسخ الحمض النووي المحتفظ بها في كبسولة دقيقة واحدة عند الانتهاء من تغليف LbL وتم حسابه لكل تصميم مستشعر بناء على تركيزات الحمض النووي الأولية و Mw من بلازميدات الحمض النووي وفقا للمعادلة 1. تم تحقيق القدرة المثلى لتحميل الحمض النووي مع 32 و 20 نسخة من الحمض النووي لتصميمات مستشعر ThyRS و BrocApt ، على التوالي. كان تقييم قدرة التحميل مهما للحصول على تقدير دقيق لتركيزات الحمض النووي المغلفة لتكون قادرة على معايرتها أثناء تنشيط IVTT لأجهزة الاستشعار عن طريق إضافة عينات كبسولة أكثر تركيزا.
يمكن تحليل نفاذية قذائف الكبسولة بشكل منهجي باتباع طريقة MWCO. تقدر الطريقة حجم مسام الغشاء بناء على الوزن الجزيئي لجزيئات المذاب التي لا يمكنها اختراق غشاء الكبسولة. من خلال إخضاع الكبسولات الدقيقة لجزيئات Mw fluorophore المتغيرة وإجراء تصوير متحد البؤر في المستوى البؤري الذي يتوافق مع أكبر قطر عبر كبسولات متعددة ، يمكن تقييم نفاذية أغشية القشرة. يسمح تحليل ImageJ بتقدير شدة التألق داخل وخارج الكبسولات وتحديد الأغشية القابلة للنفاذ بالكامل (كانت شدة الفلوروفور الخارجية والداخلية قابلة للمقارنة) ، ونفاذية جزئيا (50٪ -70٪ من الكبسولات كانت مضان أقل في الداخل مقارنة بالخارج) ، وغير منفذة (كانت كثافة الفلوروفور الداخلية أقل مقارنة بالكثافة الخارجية) أغشية (الشكل 4). يسمح تحويل Mw إلى نصف قطر هيدروديناميكي لكل فلوروفور بتقدير حجم شبكة غشاء الكبسولة (الجدول 2).
يمكن تحقيق النفاذية الانتقائية لكبسولات البروتين أثناء التحسين المنهجي لبروتوكول ترسيب LbL باستخدام تركيزات متغيرة للطبقة الأولية (من 0-6 مجم / مل) ، وتركيز فيبروين الحرير (من 0.5-2 مجم / مل) وعدد الطبقات المترسبة (من 10-25) حتى يتم تحقيق النفاذية المثلى. في هذا البروتوكول ، تم تحقيق النفاذية المثلى بين 25-32 نانومتر مع 6 مجم / مل من PEI كطبقة أولية و 20 طبقة من 1 مجم / مل من فيبروين الحرير المترسب أثناء تجميع LbL (الشكل 4). كان نطاق النفاذية هذا مثاليا لمكونات نظام IVTT للتسرب من خلال غلاف الكبسولة. عادة ما تكون أكبر المجمعات الجزيئية لأي نظام IVTT هي وحدات الريبوسوم بدائية النواة ، 30S و 50S ، والتي ، عند ربطها بواسطة mRNA في مجمع الريبوسوم ، يمكن أن تصل إلى ~ 20 نانومتر في الحجم22. يشبه هيكل قذائف الكبسولات الدقيقة المطورة شبكة متشابكة للغاية من طبقات ألياف الحرير المتشابكة ماديا بواسطة كتل β صفائح يتم إنتاجها أثناء تجميع LbL. هيكل الغشاء هذا شبه منفذ: عالي النفاذية للجزيئات الصغيرة (مثل الأيونات والأحماض الأمينية والببتيدات والسكريات وما إلى ذلك) ويقتصر على الجزيئات الكبيرة (على سبيل المثال ، البروتينات عالية الوزن الجزيئي ، البروتينات السكرية ، الخلايا ، إلخ) التي تسمح فقط بترشيح الجزيئات ذات نصف القطر الهيدروديناميكي أقل من 25 نانومتر. وبالتالي ، يمكن استخدام كبسولات فيبروين الحرير الدقيقة مع التحميل الأمثل للحمض النووي ونفاذية الغشاء كحاملات مفاعل حيوي لتنشيط IVTT.
يمكن اختبار النشاط النسخي والانتقالي لأجهزة استشعار تصميم ThyRS و BrocApt باستخدام أنظمة IVTT المتاحة تجاريا. يتطلب ThyRS تنشيطا متعديا لجين المراسل في وجود ليجند الثيوفيلين. يتضمن تنشيط ThyRS الاصطناعي عدة خطوات لبدء التعبير الجيني ، بما في ذلك تخليق mRNA ، والتغيير التوافقي لتسلسل mRNA عند الارتباط بالمادة المراد تحليلها ، وإطلاق موقع ربط الريبوسوم ، وتوليف بروتين GFPa1 المراسل. كل هذه الخطوات تتطلب الانتشار الحر لمكونات IVTT من خلال غشاء الكبسولة. أدى التصميم المقترح للكبسولات الدقيقة المصنوعة من الفيبروين الحريري المحمل بالحمض النووي إلى تحسين معلمات التنشيط لتصميمات أجهزة الاستشعار المنظمة بواسطة الحمض النووي الريبي: كان كل من حركية التعبير وناتج التألق أعلى بكثير مقارنة بالحمض النووي الحر غير المتجمد (الشكل 5 أ). أكد تصوير CLSM أيضا نجاح تنشيط جين GFPa1 داخل كبسولات محملة ببلازميدات الحمض النووي التي تشفر تسلسلات ThyRS (الشكل 5B-D).
بدلا من ذلك ، تم تنشيط تصميم مستشعر BrocApt في نظام IVTT الذي يدعم النسخ / الترجمة المقترنة بمروج T7 E. coli في وجود صبغة DHFBI-1T. بدأ ناتج التألق عند ربط الصبغة الفلورية بتسلسل mRNA. الأهم من ذلك ، كانت إشارة الخرج من الكبسولات الدقيقة الحريرية أعلى بعدة أضعاف مقارنة بعينات الحمض النووي غير المغلفة ذات التركيزات المكافئة (الشكل 6). وبالتالي ، يمكن أن تحتفظ كبسولات فيبروين الدقيقة الحريرية بالوظائف الأساسية لعناصر الاستشعار المشفرة بالحمض النووي ، والتي يمكن أن تكون مهمة لتصميم أنواع جديدة من منصات الاستشعار الحيوي في المختبر للكشف السريع والحساس عن التحليلات ذات الأهمية.

الشكل 1: خريطة البلازميد وتسلسل pSALv-RS-GFPa1. (أ) يحتوي البلازميد على تسلسل الثيوفيلين ريبوسويتش (ThyRS) الموضوع في المنبع من جين تشفير GFPa1 تحت سيطرة مروج ptac ، جين تشفير β-lactamase (bla) المسؤول عن مقاومة الأمبيسلين. (ب) يظهر تسلسل مروج ptac بالخط العريض وتحته خط ؛ يظهر تسلسل الثيوفيلين ريبوسويتش بخط مائل غامق. يظهر تسلسل ترميز GFPa1 بالخط العريض ؛ يتم وضع خط تحت تسلسلات مواقع التقييد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نظرة عامة على تحضير الكبسولات الدقيقة باستخدام نهج طبقة تلو الأخرى. تم تشغيل نوى SiO2 البكر أولا باستخدام بوليمر PEI ، متبوعا بالترسب المتسلسل لبلازميدات الحمض النووي التي تشفر تصميمات أجهزة استشعار مختلفة وطبقات فيبروين حريرية حتى يتم امتصاص العدد المطلوب من طبقات بروتين الحرير. يمكن إنتاج كبسولات دقيقة مجوفة نقية تحتوي على تصميمات مختلفة لأجهزة استشعار الحمض النووي عن طريق إذابة النوى القربانية. يمكن تحقيق تنشيط كل تصميم مستشعر حيوي مغلف في الكبسولة الدقيقة أثناء تفاعلات IVTT في وجود الروابط المقابلة. أعيد طبع هذا الرقم من Drachuk, I. et al.21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
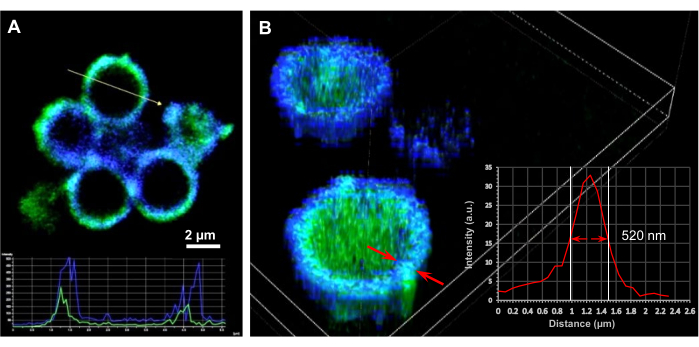
الشكل 3: دراسات الفحص المجهري للكبسولات الدقيقة المحملة بالحمض النووي. (أ) المقطع العرضي 2D و (ب) صور مجهرية متحدة البؤر ثلاثية الأبعاد لكبسولات مجوفة (SF) 20 دقيقة محملة ببلازميدات الحمض النووي التي تشفر ThyRS (32 نسخة / كبسولة من الحمض النووي) ويتم إنتاجها من نوى SiO2 المحضرة ب 6 مجم / مل من PEI. تم تطبيق التألق التلقائي من كبسولات فيبروين الحرير (قناة DAPI ، الأزرق) والحمض النووي الملون (قناة FITC ، الأخضر) لتحديد توطين بلازميدات الحمض النووي وتقدير سمك غشاء الكبسولة. يمثل الجزء الداخلي في (A) ملامح شدة الحمض النووي وأغلفة الفبروين الحريرية عبر الكبسولة. شريط المقياس: 2 ميكرومتر. يمثل الجزء الداخلي في (B) ملف تعريف كثافة بروتين الحرير عبر غلاف الكبسولة. تم قياس سمك الغشاء على أنه الطول عند ذروة نصف الشدة. تم إجراء معالجة الصور المقطعية والعرض ثلاثي الأبعاد باستخدام برنامج تصوير NIS على نظام Nikon C2 +. أعيد طبع هذا الرقم من Drachuk, I. et al.21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
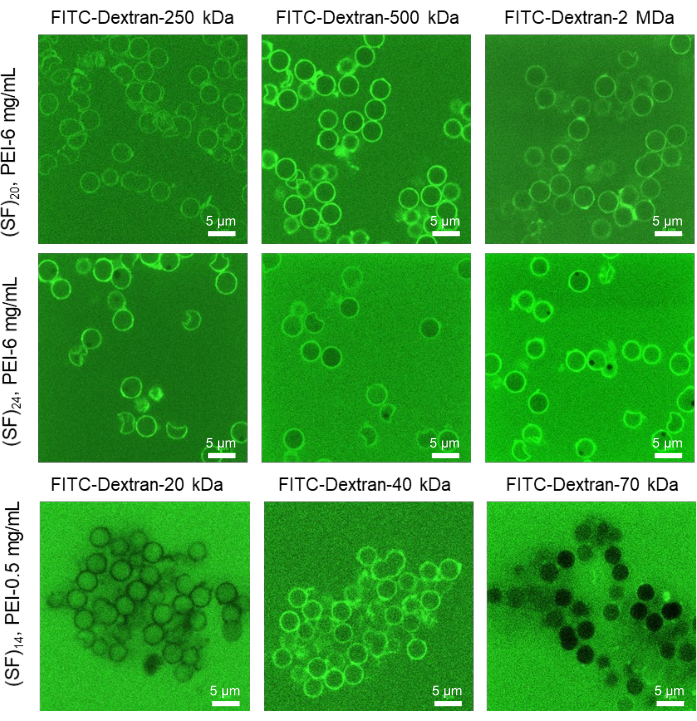
الشكل 4: تقدير نفاذية الغشاء للكبسولات الحريرية الدقيقة باستخدام طريقة MWCO. صور فلورية انتقائية تمثيلية CLSM لكبسولات فيبروين حريرية مجوفة معرضة لمحاليل FITC-Dextran من Mw مختلفة (20 μM ، diH2O). تم تحضير الكبسولات بعدد مختلف من الطبقات وتركيزات جزيرة الأمير إدوارد. تؤدي الزيادة في تركيز الطبقة الأولية إلى زيادة الاستقرار الغروي للكبسولات الدقيقة ذات الأصداف الأكثر نفاذية ، بينما يؤدي التخلص من الطبقة الأولية إلى تجميع الكبسولات ذات أغشية القشرة الأقل نفاذية. شريط المقياس: 5 ميكرومتر. أعيد طبع هذا الرقم من Drachuk, I. et al.21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تنشيط تصميم مستشعر ThyRS في كبسولات فيبروين الحرير. (أ) حركية تعبير GFPa1 أثناء تنشيط ThyRS من بلازميدات الحمض النووي المحملة في كبسولات SF الدقيقة المكونة من 20 طبقة (خطوط حمراء اللون) والتحكم في الحمض النووي غير المغلف (خطوط زرقاء اللون). من أعلى إلى أسفل ، كانت تركيزات الحمض النووي في حجم العينة (50 ميكرولتر) 6.5 نانوغرام / ميكرولتر ، 4.5 نانوغرام / ميكرولتر ، 2.5 نانوغرام / ميكرولتر ، و 0 نانوغرام / ميكرولتر وتتوافق مع التغيرات في شدة اللون. (ب) صور CLSM لكبسولات فيبروين حريرية محملة ب 32 نسخة من الحمض النووي (DNA) لكل كبسولة. شريط المقياس: 5 ميكرومتر. (C) تتوافق الصورة مع ملفات تعريف شدة المقطع العرضي المقابلة للصورة (B) عبر كبسولتين (خط أبيض في B). يمثل الخط الأحمر كبسولات الحرير ، ويمثل الخط الأخضر GFPa1 معبرا عنه في كبسولات. (د) تمثل الصورة كبسولات حرير ثلاثية الأبعاد محملة ب 32 نسخة من الحمض النووي بعد الحضانة في نظام IVTT. يتوافق التألق الأخضر مع إشارة GFPa1 ، ويتوافق التألق الأحمر مع طبقات الحرير ذات العلامات الفلورية. شريط المقياس: 2 ميكرومتر. تم إجراء تنشيط ThyRS باستخدام الثيوفيلين (2 mM ، DMSO) أثناء حضانة الكبسولات الدقيقة في نظام IVTT (مستخلص S30). أعيد طبع هذا الرقم من Drachuk, I. et al.21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
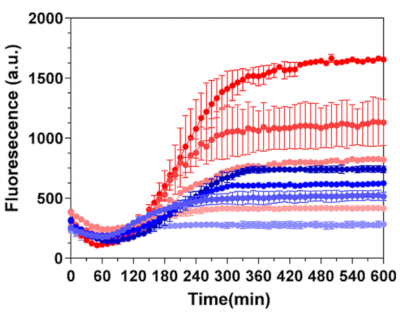
الشكل 6: تنشيط البروكيت في كبسولات فيبروين الحرير. تم إجراء مقارنة بين حركية النسخ للكبسولات الدقيقة الحريرية المكونة من 20 طبقة محملة ب 30 نسخة من الحمض النووي لكل كبسولة (خطوط حمراء اللون) والتحكم في الحمض النووي غير المغلف (خطوط زرقاء اللون). من أعلى إلى أسفل ، كانت تركيزات الحمض النووي المغلف في العينة: 3.6 نانوغرام / ميكرولتر ، 2 نانوغرام / ميكرولتر ، 1 نانوغرام / ميكرولتر و 0 نانوغرام / ميكرولتر وتتوافق مع التغيرات في كثافة اللون. كانت تركيزات الحمض النووي غير المغلف: 20 نانوغرام / ميكرولتر ، 10 نانوغرام / ميكرولتر ، 5 نانوغرام / ميكرولتر و 0 نانوغرام / ميكرولتر وتتوافق مع التغيرات في شدة اللون. تم إجراء التنشيط باستخدام DHBFI-1T (100 ميكرومتر ، diH2O) أثناء الحضانة في نظام PURE الخالي من الخلايا. أعيد طبع هذا الرقم من Drachuk, I. et al.21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| تصميم مستشعر الحمض النووي | تركيز الحمض النووي الأولي (نانوغرام / ميكرولتر) | عدد نسخ الحمض النووي لكل كبسولة (الحمض النووي / الكبسولة) |
| 50 | 16 | |
| ثيرس | 100 | 32 |
| 150 | 48 | |
| 200 | 64 | |
| 50 | 10 | |
| بروك أبت | 100 | 20 |
| 150 | 30 | |
| 200 | 40 |
الجدول 1: عدد نسخ الحمض النووي لكل كبسولة لكل تصميم الحمض النووي. تم حساب رقم النسخة وفقا للمعادلة 1 وكان مرتبطا بالتركيز الأولي لبلازميدات الحمض النووي ، وتقارب الاحتفاظ بتسلسل الحمض النووي أثناء عملية ترسيب LbL ، وطول بلازميدات الحمض النووي.
| ميغاواط من FITC-ديكستران (kDa) | نصف القطر الهيدروديناميكي (نانومتر) |
| 4 | 1.4 |
| 20 | 3.3 |
| 40 | 4.5 |
| 70 | 6 |
| 150 | 8.5 |
| 250 | 10 |
| 500 | 14 |
| 2,000 | 18 |
الجدول 2: الخصائص الفيزيائية ل FITC-dextrans. تم استخدام نصف القطر الهيدروديناميكي لكل فلوروفور لتقدير نفاذية كبسولات فيبروين الحرير المجوفة.
Discussion
يمكن تحضير كبسولات هيدروجيل دقيقة قابلة للنفاذ بشكل انتقائي محملة بأنواع مختلفة من تصميمات أجهزة الاستشعار المشفرة بالحمض النووي باتباع هذا البروتوكول. تتمثل إحدى السمات المميزة لنهج LbL في القدرة على تكييف تعقيد الكبسولات الدقيقة أثناء التجميع من أسفل إلى أعلى ، والذي يبدأ عادة بامتصاص الأنواع الجزيئية على قوالب القرابين. من خلال ضبط تركيزات المكونات الأولية بعناية ، وظروف الأس الهيدروجيني ، وعدد الطبقات ، يمكن تحضير كبسولات دقيقة ذات معلمات تحميل DNA مختلفة ، ووظائف ، ونفاذية قابلة للضبط23. من أجل تضخيم تعدد استخدامات الكبسولات ، يمكن تحقيق مزيد من الأداء الوظيفي لسطح القشرة باستخدام AuNPs و IgG لتنفيذ ناقلات أجهزة استشعار متوافقة حيويا للتشخيصات في الجسم الحي . يعتمد كلا هذين الطريقين البديلين على التركيب الجزيئي الفريد للفيبروين الحريري. يمكن تحقيق الاختزال في الموقع لأيونات Au3+ بسبب وجود بقايا التيروزين (5.3٪ مول) قادرة على تقليل أيونات المعادن في وجود مخزن مؤقت مثالي للاختزال. يمكن إجراء اقتران أجسام مضادة محددة على سطح كبسولات البروتين الدقيقة الوظيفية AuNPs عن طريق تنفيذ كيمياء تنشيط الكربوديميد. تتطلب هاتان الخطوتان تطويرا دقيقا وتحسين البروتوكول من أجل تحقيق الوظائف المناسبة لكبسولات المستشعر الحيوي للتطبيقات المستقبلية. على سبيل المثال ، لاستخدام هذه الكبسولات الدقيقة كأنظمة توصيل "ذكية" ، حيث يتم تسليم شحنة جزيئية بناء على محفزات محددة (مثل الأس الهيدروجيني أو الإشارات الكيميائية) ، يجب تمييز الخصائص المحددة لهذه الكبسولات وضبطها ، بما في ذلك كفاءة التسليم ووقت الاحتفاظ وطريقة الإعطاء وعلاجات نموذج المرض.
تميزت الكبسولات الدقيقة المحملة بالحمض النووي بتقنية CLSM وقياسات مضان. ومع ذلك ، يمكن تطبيق طرق توصيف أخرى مثل مجهر القوة الذرية (AFM) ، والتصوير المقطعي الإلكتروني المبرد (CEM) ، والمجهر فائق الدقة لإعادة البناء العشوائي المباشر (dSTORM) للتمييز بين هياكل محددة من الكبسولات الدقيقة ، بما في ذلك الألياف الفردية ، والمجالات النانوية ، وتوطين بلازميدات الحمض النووي24،25،26.
يسلط البروتوكول المطور الضوء على استخدام البوليمر الحيوي للفيبروين الحريري كمادة شبكة متوافقة حيويا تحافظ على البنية الثلاثية لبلازميدات الحمض النووي المحملة. يحدث استقرار تسلسل الحمض النووي المتجمد داخل شبكة فيبروين الحرير عن طريق التفاعلات الكارهة للماء و / أو الترابط الهيدروجيني ، والتي توفر بيئة دقيقة واقية ضد تعطيل الأس الهيدروجيني أو الأكسدة أو التحلل المائي27. بالإضافة إلى ذلك ، توفر المجالات β البلورية للفيبروين الحريري حاجزا ميكانيكيا فريدا ، مما يقيد حركة الجزيئات الكبيرة المحاصرة ، ويمنع بلازميدات الحمض النووي من التدهور أثناء التخزين في المحاليل المائية.
خلقت الطبيعة شبه المنفذة للكبسولات الدقيقة المصنوعة من فيبروين الحرير المحملة بقوالب الحمض النووي ظروفا مكانية وفيزيائية كيميائية فريدة لتفاعلات IVTT. تمكن أبتامر الحمض النووي الريبي المنشط نسخيا ومتعديا وريبو سويتش المجمدة في كبسولات فيبروين الدقيقة الحريرية من إنتاج إشارة خرج كانت أعلى بثلاثة أضعاف على الأقل مقارنة بأجهزة الاستشعار الحرة غير المجمودة. بالإضافة إلى ذلك ، يمكن أن يؤدي تجميد قوالب الحمض النووي في الكبسولات الدقيقة إلى تعزيز نشاط أجهزة الاستشعار المغلفة بشكل كبير بما يتجاوز حد الكشف عن تلك غير المغلفة. في حين أن المستشعرات غير المغلفة لديها استجابة ضئيلة عند تركيزات منخفضة من الحمض النووي ، فإن المستشعرات المغلفة لها استجابة خرج مميزة للغاية ، والتي يمكن معايرتها بسهولة لتعكس التغيرات الطفيفة في تركيزات الحمض النووي. من المحتمل أن تكون إشارة الاستجابة المحسنة للمراسلين المغلفين بسبب الانتشار غير المقيد لمكونات آلية IVTT وانخفاض حركة بلازميدات الحمض النووي. وقد اعترفت العديد من الدراسات بأن غلة تخليق البروتين في التفاعلات الخالية من الخلايا تعتمد على البيئة الجزيئية28,29. وفر تجميد بلازميدات الحمض النووي في شبكة الحرير بيئة محصورة فعالة تقيد حركة قليل النوكليوتيدات وتسريع تفاعلات آلية النسخ / الترجمة حتى من عدة نسخ من الحمض النووي21.
بينما توفر طريقة LbL نهجا متعدد الاستخدامات للغاية لبناء تجميعات متعددة الوظائف بطريقة يمكن التحكم فيها ، فإن إجراء التصنيع يستغرق وقتا طويلا نسبيا ويتطلب عادة تعديلات معالجة لزيادة إنتاجية الكبسولات الدقيقة. هناك اعتبار آخر في صنع كبسولات دقيقة قائمة على الجزيئات الحيوية وهو توافق أي نظام معين مع متطلبات الذوبان الأساسي بعد اكتمال ترسب LbL. حتى الآن ، لإنتاج كبسولات دقيقة متجانسة الحجم وقوية محملة بالحمض النووي من الحرير المجوف ، تم ترسيب الأصداف على قوالب أساسية من السيليكا القربانية (SiO2) ، والتي تتطلب إزالتها لاحقا عن طريق حفر حمض الهيدروفلوريك (HF). كما أن مناولة الموجات الديكامترية (HF) أو النقش لا تعتبر عمليات متوافقة أحيائيا، مما يحد من استخدامها على نطاق واسع في التطبيقات العملية. البديل للقوالب الغروية غير العضوية SiO2 ، عادة ما تكون نوى الكربونات خاملة في تكوين معقدات بطبقات بوليمر ويمكن إذابتها في ظل ظروف معتدلة باستخدام حمض الإيثيلين ديامينيترايتيك (EDTA). ومع ذلك ، قد يؤثر ضبط النوى القربانية على خصائص ترسيب الطبقات المتعددة وسلامة هيكل القشرة ، الأمر الذي يتطلب مزيدا من التحسين للبروتوكول.
باختصار ، يسمح البروتوكول الحالي بإعداد كبسولات دقيقة محملة بالحمض النووي تعتمد على الحرير بتصميمات أجهزة استشعار مختلفة. أدى الجمع بين البيئة المكروية المحصورة التي توفرها طريقة LbL واستخدام فيبروين الحرير كمادة متوافقة حيويا إلى تحسين خصائص الاستشعار للحمض النووي المغلف. مع التطور السريع لتقنية أبتامر الحمض النووي الريبي الفلورية ، يمكن توسيع الاستخدام المحتمل للكبسولات الدقيقة الحريرية المحملة بالحمض النووي لتشمل التشخيص المختبري المتعدد. في الآونة الأخيرة ، ظهرت العديد من الاختلافات في أبتامير الفلورسنت القائمة على الحمض النووي الريبي كتقنية قوية خالية من الخلفية لتصوير الحمض النووي الريبي في الخلايا الحية ذات حساسية عالية لنسبة الإشارة إلى الضوضاء30,31. من خلال تطبيق تقنية النانو RNA الاصطناعية لتصميم أبتامير الحمض النووي الريبي الاصطناعي ، يمكن تسخير الخصائص الفلورية للأبتامير للكشف عن روابط محددة ذات أهمية. ستكون هذه التقنية ذات قيمة خاصة لمراقبة المؤشرات الحيوية ذات الأهمية بتنسيقات مختلفة ، بما في ذلك أجهزة الاستشعار الورقية في نقاط الاستخدام ، والبقع القائمة على الهيدروجيل للعرق أو السائل الخلالي ، والمواد القابلة للزرع.
Disclosures
الآراء ووجهات النظر الواردة هنا هي آراء المؤلفين ولا تمثل بالضرورة وجهات نظر دائرة الدفاع أو مكوناتها
Acknowledgements
تم دعم هذا العمل من خلال منحة LRIR 16RH3003J من مكتب البحث العلمي التابع للقوات الجوية ، بالإضافة إلى برنامج البيولوجيا التركيبية للبحوث التطبيقية للبيئات العسكرية للنهوض بأولويات العلوم والتكنولوجيا (ARAP) التابع لمكتب وكيل وزارة الدفاع الأمريكي للبحوث والهندسة.
تم توفير تسلسل ناقل البلازميد ل ThyRS (pSALv-RS-GFPa1 ، 3.4 كيلو بايت) بسخاء من قبل الدكتور ج. جاليفان. تم التبرع بشرانق دودة القز من Bombyx mori بسخاء من قبل الدكتور D.L. كابلان من جامعة تافتس ، ماساتشوستس.
Materials
| Name | Company | Catalog Number | Comments |
| (Z)-4-(3,5-difluoro-4-hydroxybenzylidene)-2-methyl-1-(2,2,2-trifluoroethyl)-1H-imidazol-5(4 H)-one (DFHBI-1T) | Lucerna | DFHBI-1T | |
| 5x T4 DNA Ligase Buffer | ThermoFisher Scientific | 46300-018 | |
| 6x Blue Gel Loading Dye | New England BioLabs | B7021S | |
| 96-well plates, black circular | Corning | 3601 | |
| Agarose | Sigma-Aldrich | A9539 | BioReagent, for molecular biology, low EEO |
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | powder or crystals, BioReagent, suitable for cell culture |
| BlpI restriction enzymes | New England BioLabs | R0585S | |
| Corning Disposable Vacuum Filter/Storage Systems | FisherScientific | 09-761-1 | |
| Dimethyl sulfoxide, DMSO | Sigma-Aldrich | 472301 | ACS reagent, ≥99.9% |
| DNA Plasmid, pET28c-F30-2x Broccoli (5.4 kb), BrocApt. | Addgene | Plasmid #66788 | |
| DyLightTM550 Antibody Labeling kit (Invitrogen) | ThermoFisher Scientific | 84530 | |
| E. coli S30 extract system for circular DNA | Promega | L1020 | |
| Falcon Conical centrifuge tubes, 15 mL | FisherScientific | 14-959-53A | |
| Falcon Conical centrifuge tubes, 50 mL | 14-432-22 | ||
| Fisherbrand Microcentrifuge tubes, 1.5 mL | FisherScientific | 05-408-129 | |
| Hydrofluoric acid, HF | Sigma-Aldrich | 695068 | ACS reagent, 48% |
| Kanamycin sulfate | Sigma-Aldrich | 60615 | mixture of Kanamycin A (main component) and Kanamycin B and C |
| KpnI restriction enzymes | New England BioLabs | R0142S | |
| LB agar plate supplemented with 100 µg/mL ampicillin | Sigma-Aldrich | L5667 | pre-poured agar plates with 100 µg/mL ampicillin |
| LB agar plate supplemented with 50 µg/mL kanamycin | Sigma-Aldrich | L0543 | pre-poured agar plates with 50 µg/mL kanamycin |
| LB broth (Lennox grade) | Sigma-Aldrich | L3022 | |
| Lithium bromide, LiBr | Sigma-Aldrich | 213225 | ReagentPlus, ≥99% |
| Max Efficiency DH5-α competent E. coli strain | ThermoFisher Scientific | 18258012 | |
| Methanol | MilliporeSigma | 322415 | anhydrous, 99.8% |
| MilliQ-water | EMD MilliPore | Milli-Q Reference Water Purification System | |
| MinElute PCR Purification Kit | Qiagen | 28004 | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride, EDC | Sigma-Aldrich | E1769 | |
| PBS (phosphate buffered saline) | ThermoFisher Scientific | 10010023 | 1x PBS, pH 7.4 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| Polyethylenimine, branched | Sigma-Aldrich | 408727 | average Mw ~25,000 |
| PURExpress In Vitro Protein Synthesis Kit | New England BioLabs | E6800S | |
| QIAEX II Gel Extraction Kit | Qiagen | 20021 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| Quick-Load 2-Log DNA Ladder (0.1-10.0 kb) | New England BioLabs | N0469S | |
| SiO? silica microspheres, 4.0 µm | Polysciences, Inc. | 24331-15 | 10% aqueous solution |
| Slide-A-Lyzer G2 Dialysis Cassettes, 3.5K MWCO, 15 mL | ThermoFisher Scientific | 87724 | |
| Sodium carbonate, Na?CO? | Sigma-Aldrich | 222321 | ACS reagent, anhydrous, ≥99.5%, powder |
| Spectrum Spectra/Por Float-A-Lyzer G2 Dialysis Devices | FisherScientific | 08-607-008 | Spectrum G235058 |
| SYBR Safe DNA gel stain | ThermoFisher Scientific | S33102 | |
| T4 DNA Ligase (5 U/µL) | ThermoFisher Scientific | EL0011 | |
| Theophylline | Sigma-Aldrich | T1633 | anhydrous, ≥99%, powder |
| Tris Acetate-EDTA buffer (TAE buffer) | Sigma-Aldrich | T6025 | Contains 40 mM Tris-acetate and 1 mM EDTA, pH 8.3. |
| UltraPure DNase/RNase-Free Distilled Water | FisherScientific | 10-977-023 | |
| ZymoPURE II Plasmid MaxiPrep kit | ZymoResearch | D4202 |
References
- Slomovic, S., Pardee, K., Collins, J. J. Synthetic biology devices for in vitro and in vivo diagnostics. Proceedings of the National Academy of Sciences of the United States of America. 112 (47), 14429-14435 (2015).
- Harbaugh, S. V., Goodson, M. S., Dillon, K., Zabarnick, S., Kelley-Loughnane, N. Riboswitch-based reversible dual-color sensor. ACS Synthetic Biology. 6 (5), 766-781 (2017).
- König, H., Frank, D., Heil, R., Coenen, C. Synthetic genomics and synthetic biology applications between hopes and concerns. Current Genomics. 14 (1), 11-24 (2013).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: An expanded repertoire of applications. Nature Reviews Genetics. 21, 151-170 (2020).
- Chushak, Y., et al. Characterization of synthetic riboswitch in cell-free protein expression systems. RNA Biology. , 1-12 (2021).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- Grӓwe, A., et al. A paper-based, cell-free biosensor system for the detection of heavy metals and date rape drugs. PLoS One. 14 (3), 0210940(2019).
- Lin, X., et al. Portable environment-signal detection biosensors with cell-free synthetic biosystems. RSC Advances. 10 (64), 39261-39265 (2020).
- Caschera, F., Lee, J. W., Ho, K. K. Y., Liu, A. P., Jewett, M. C. Cell-free compartmentalized protein synthesis inside double emulsion templated liposomes with in vitro synthesized and assembled ribosomes. Chemical Communications. 52 (31), 5467-5469 (2016).
- Niederholtmeyer, H., Chaggan, C., Devaraj, N. K. Communication and quorum sensing in non-living mimics of eukaryotic cells. Nature Communications. 9, 5027(2018).
- Timin, A. S., Gould, D. J., Sukkhorukov, G. B. Multi-layer microcapsules: Fresh insights and new applications. Expert Opinion on Drug Delivery. 14 (5), 583-587 (2017).
- Bomati, E. K., Haley, J. E., Noel, J. P., Deheyn, D. D. Spectral and structural comparison between bright and dim green fluorescent proteins in Amphioxus. Scientific Reports. 4, 5469(2014).
- Frey, B. Amplification of Genomic DNA by PCR. Molecular Diagnosis of Infectious Diseases. Methods in Molecular Medicine. Reischl, U. 13, Humana Press. Totowa, NJ. 143-156 (1998).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Zhou, Y., et al. Rapid regeneration and reuse of silica columns from PCR purification and gel extraction kits. Scientific Reports. 8, 12870(2018).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5α-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), 0137466(2015).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Drachuk, I., et al. Silk macromolecules with amino acid-Poly(Ethylene Glycol) grafts for controlling layer-by-layer encapsulation and aggregation of recombinant bacterial cells. ACS Nano. 9 (2), 1219-1235 (2015).
- Antipov, A. A., Sukhorukov, G. B. Polyelectrolyte multilayer capsules as vehicles with tunable permeability. Advances in Colloid and Interface Science. 111 (1-2), 49-61 (2004).
- Drachuk, I., Harbaugh, S., Chávez, J. L., Kelley-Loughnane, N. Improving the activity of DNA-encoded sensing elements through confinement in silk microcapsules. ACS Applied Materials & Interfaces. 12 (43), 48329-48339 (2020).
- Melnikov, S., Ben-Shem, A., Garreau de Loubresse, N., Jenner, L., Yusupova, G., Yusupov, M. Structural basis for the inhibition of the eukaryotic ribosome. Nature Structural & Molecular Biology. 19 (6), 560-567 (2012).
- Zhao, S., et al. The future of layer-by-layer assembly: A tribute to ACS Nano associate editor Helmuth Möhwald. ACS Nano. 13 (6), 6151-6169 (2019).
- Main, K. H. S., Provan, J. I., Haynes, P. J., Wells, G., Hartley, J. A., Pyne, A. L. B. Atomic force microscopy-A tool for structural and translational DNA research. APL Bioengineering. 5, 031504(2021).
- Riera, R., Feiner-Gracia, N., Fornaguera, C., Cascante, A., Borrós, S., Albertazzi, L. Tracking the DNA complexation state of pBAE polyplexes in cells with super resolution microscopy. Nanoscale. 11 (38), 17869-17877 (2019).
- Bilokapic, S., Strauss, M., Halic, M. Cryo-EM of nucleosome core particle interactions in trans. Scientific Reports. 8, 7046(2018).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Fritz, B. R., Jamil, O. K., Jewett, M. C. Implications of macromolecular crowding and reducing conditions for in vitro ribosome construction. Nucleic Acids Research. 43 (9), 4774-4784 (2015).
- Ge, X., Luo, D., Xu, J. Cell-free protein expression under macromolecular crowding conditions. PLoS One. 6 (12), 28707(2011).
- Cawte, A. D., Unrau, P. J., Rueda, D. S. Live cell imaging of single RNA molecules with fluorogenic mango II arrays. Nature Communications. 11, 1283(2020).
- Chen, X., et al. Visualizing RNA dynamics in live cells with bright and stable fluorescent RNAs. Nature Biotechnology. 37 (11), 1287-1293 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved