Method Article
加载编码RNA核酸适体和核糖开关的DNA质粒的多功能丝基微胶囊的制备
摘要
该协议描述了稳健且生物相容的富含DNA的微胶囊的形成,作为能够跟踪多种配体的多重体 外 生物传感器。
摘要
我们介绍了一种通过牺牲球形核心上的逐层(LbL)组装方法制备富含DNA的丝素蛋白微胶囊的方案。在吸附质层和DNA质粒后,在单个蚕丝层的急性脱水过程中诱导蚕丝二级结构中的β片,促进了健壮微胶囊的形成。因此,分层是通过多次氢键和疏水相互作用发生的。在吸附多层壳后,核壳结构可以用金纳米颗粒(AuNPs)和/或抗体(IgG)进一步功能化,用于遥感和/或靶向递送。在二氧化硅核心上顺序沉积关键大分子的过程中调整几个关键参数,例如聚合物引物的存在、DNA 和丝蛋白的浓度以及许多吸附层,从而产生具有可变渗透性和 DNA 负载量的生物相容性、富含 DNA 的微胶囊。在二氧化硅核心溶解后,该方案证明了空心和坚固的微胶囊的形成,其中DNA质粒固定在胶囊膜的内表面。在DNA质粒和外部环境之间建立选择性渗透的生物相容性膜,在长期储存期间保存DNA,并在改善空间受限质粒的输出响应中发挥重要作用。在 体外 转录和翻译反应(无细胞系统)期间测试DNA模板的活性及其可及性。编码RNA发光适配体和核糖开关的DNA质粒被相应的分析物成功激活,如在壳膜中定位荧光标记的RNA转录物或GFPa1蛋白时可视化的那样。
引言
合成生物学领域通过利用微生物进化的自然机制来监测其环境和潜在威胁,为发展传感能力提供了独特的机会。重要的是,这些传感机制通常与保护这些微生物免受有害暴露的反应有关,调节基因表达以减轻负面影响或防止摄入有毒物质。人们已经付出了巨大的努力来设计这些微生物,以利用这些自然反应来创建全细胞传感器,但重新定向它们以识别新靶标和/或产生可测量的信号,该信号可用于定量目的(通常是荧光)1,2。目前,由于整个细胞或其某些遗传物质的泄漏,即使封装在聚合物基质中,对使用转基因微生物(GMO)的担忧,特别是在环境或人体中释放时,也表明需要利用这些传感方法的替代方法3。
利用基于微生物的传感的好处而不用担心转基因生物部署的一种强大方法是使用体外转录/翻译(IVTT)系统。从实践的角度来看,IVTT系统由含有大部分处于活性状态的细胞成分的混合物组成,这些成分是通过不同方式从细胞中"提取"的,包括超声处理,珠子跳动或其他方式4。该过程的最终产品是已经优化为执行转录和翻译的生化反应混合物,可用于以"开放容器"格式测试不同的传感器,而不受与使用整个细胞相关的限制(膜扩散、转化效率、细胞毒性等)。重要的是,可以定量添加不同的传感器组件,并通过不同的光学和光谱技术研究它们的影响,正如我们所展示的5。已经注意到,IVTT系统的性能可能不一致;然而,最近的研究已经显示了标准化其制备和表征的方法,这对于研究它们在传感器设计中的性能有很大帮助6。最近,已经证明了许多IVTT系统通过冻干纸基质中的组分来创建纸质测定的例子,包括检测重金属离子,药物,群体传感元件等7,8,9。基于IVTT的传感器的一个令人兴奋的应用领域是它们在不同类型的环境中的传感应用,包括土壤、水和人体。为了将这些IVTT系统部署到这些具有挑战性的环境中,需要实施一种封装方法来包含IVTT组件并保护它们免受降解。
IVTT系统最常见的封装方法包括使用脂质胶囊,胶束,聚合物体和其他紧密封闭的微容器10,11,12。这种方法的一个缺点是需要结合被动或主动机制来将材料运入和运出容器,以允许与外部环境通信并提供传感功能。为了克服其中的一些问题,本文报告了一种方法,该方法提供了一种简单而有效的方法来封装要在IVTT系统中表达的不同传感器设计的编码材料。该方法基于在目标质粒存在下使用生物聚合物的逐层(LbL)沉积来创建具有高孔隙率的空心微胶囊,这使得受保护的遗传物质与所选IVTT的不同组分相互作用。该研究表明,封装的质粒在该聚合物基质中激活时可以指导转录和翻译,如质粒编码的适配体和核糖开关对其相应靶标的响应所示。此外,这种LbL包被可在没有任何特殊储存条件的情况下保护质粒数月。
研究方案
1.质粒载体的构建。
- 通过扩增茶碱核糖开关 (ThyRS) 的编码序列与来自 pJ201:23976-RS-GFPa1 载体(由 DNA2.0 设计和创建)的 GFPa1 偶联并插入大 肠杆菌 表达载体 pSAL13,构建质粒载体 (pSALv-RS-GFPa1, 3.4 kb)。使用正向 (5'-CGTGGTACCGGTGGTGATGATACCCATCGTCTTGATG-3') 和反向 (5'-CGTGCTCAGCTTAAGCCAGCTCGTAG-3') 引物扩增 ThyRS 与 GFPa1 偶联的编码序列,并根据制造商的方案14 使用 DNA 聚合酶在 50 μL 体积中进行 PCR 反应。
- 从 0.5 g 琼脂糖、50 mL TAE 缓冲液(40 mM 乙酸三酯、1 mM EDTA、pH 8.0)和 3 μL DNA 染色剂制备 1% 琼脂糖凝胶。
- 将 5 μL 等分试样的 PCR 扩增产物与 5 μL 无 RNase/DNase 的水和 2 μL 6x 凝胶上样染料混合,并通过琼脂糖凝胶电泳进行分析。加载DNA分子量标准(0.1-10.0 kb)作为参考。在120 V下运行凝胶,直到染料线几乎到达凝胶底部。
- 使用紫外透射仪成像系统可视化 DNA 片段,以检查 DNA15 的正确大小。
- 根据制造商的方案16使用PCR纯化试剂盒纯化PCR产物。
- 用 KpnI 和 BlpI 限制性内切酶在 15 μL 反应中消化 PCR 产物和 pSAL 表达载体,该反应含有 10 μL PCR 产物或质粒载体(浓度 20-50 ng/μL)、1.5 μL 10x 酶缓冲液、1 μL 每种酶和 1.5 μL 无 RNase/DNase 的水,在 37 °C 下消解 2 小时。
- 向反应混合物中加入 3 μL 6x 凝胶上样染料,并按照步骤 1.3-1.5 所述在 1% 琼脂糖凝胶上分离消化的片段。
- 根据制造商的方案16使用凝胶提取试剂盒纯化DNA片段。
- 使用 T4 DNA 连接酶和补充的连接酶缓冲液,将消化的 PCR 产物连接到酶解的线性化质粒载体 pSAL 中,在 10 μL 反应中,该反应含有 3-20 fmol 的消化载体、9-60 fmol 的消化 PCR 产物、2 μL 连接酶缓冲液、1 μL(1 单位)T4 DNA 连接酶和不含 DNase/RNase 的水。将连接反应在25°C孵育3小时。
注意:确保反应混合物中的总DNA含量为0.01-0.1μg。 - 根据制造商的方案17,用10ng的连接反应混合物转化大肠杆菌DH5α感受态细胞。
- 在补充有氨苄青霉素(100μg/ mL)的LB-琼脂平板上在37°C下培养转化的细胞过夜。
- 从平板中挑选 3-4 个细菌菌落,并将每个菌落无菌转移到补充有氨苄青霉素 (100 μg/mL) 的 5 mL LB 培养基中。在37°C下以225rpm的振荡培养箱中培养过夜。
- 通过在室温下以11× g 离心3分钟来沉淀过夜培养物。
- 使用纯化试剂盒根据制造商的方案16纯化质粒。
- 通过DNA测序验证纯化质粒的序列。质粒图谱和所得构建体的序列(pSALv-RS-GFPa1)如图 1所示。
2.大规模DNA纯化。
- 根据制造商的方案将质粒载体pSALv-RS-GFPa1(3.4kb)(编码茶碱核糖开关与GFPa1报告基因偶联)或pET28c-F30-2x西兰花(5.4 kb)(编码西兰花适体)转化为 大肠杆菌 DH5α感受态细胞17。
- 对于用pSALv-RS-GFPa1转化的细胞或卡那霉素(50μg/ mL)转化的细胞,在补充有氨苄青霉素(100μg/ mL)的LB-琼脂平板上生长转化的细胞过夜,用于用pET28c-F30-2x西兰花转化的细胞。
- 从平板中挑选 3-4 个细菌菌落,并将每个菌落无菌转移到补充有适当抗生素(100 μg/mL 氨苄西林或 50 μg/mL 卡那霉素)的 LB 培养基中。在37°C下以225rpm的振荡培养箱中培养过夜。
- 使用3mL过夜培养物接种到补充有适当抗生素(100μg/ mL氨苄青霉素或50μg/ mL卡那霉素)的150mLLB中,并在37°C下以225rpm的振荡培养箱中培养培养培养过夜。
- 通过在4°C下以≥3400× g 离心10分钟来沉淀细胞。
- 使用纯化试剂盒根据制造商的方案16纯化质粒。
- 用 0.5 mL 纯 DNA 酶/无 RNase 的水洗脱 DNA。测量 DNA 浓度并制备 1 mL DNA 储备溶液 (100 ng/μL)。将带有DNA的试管储存在4°C直至进一步使用。
3.丝素蛋白的提取和初始材料的制备。
- 根据其他地方详细描述的程序,从 Bombyx mori 蚕茧中制备重组丝素蛋白(SF)蛋白的水溶液,以占Silk-LiBr溶液的10%。
- 确定SF水溶液的最终浓度。将0.5mL丝溶液移液到60mm培养皿中,使其在60°C下干燥,并测量干燥丝膜的重量。将干重除以 0.5 mL 以计算每体积百分比的重量。
- 通过血清移液管缓慢加水,用不含 DNase/RNase 的蒸馏水稀释浓缩丝溶液,以获得 1 mg/mL 的终浓度。将溶液储存在4°C以备将来使用。
- 使用抗体标记试剂盒制备荧光标记的丝素蛋白。根据制造商的方案,使用 1 mL 的 2 mg/mL 丝素蛋白溶液将蛋白质的 N 末端 α-氨基基团与 NHS 酯激活的衍生染料偶联19。
- 制备 50 mL 浓度为 6 mg/mL 的聚乙烯亚胺 (PEI) 水溶液,用 HCl (1 M) 将 pH 值调节至 4。通过无菌0.2μm膜过滤溶液。可以在环境条件下储存数月。
- 准备 SiO2 内核。将 300 μL SiO 2 颗粒移液到2 mL 微量离心管中。用 1 mL 无 DNase/RNase 的水洗涤微粒两次,以 0.2 x g 离心 1 分钟。
4. 对质素层、DNA 质粒和丝层进行逐层沉积。
- 要将PEI主层沉积到SiO2 微粒上,将1mL PEI溶液添加到步骤3.6的离心沉淀中,并在环境条件下在温度混合器上以800rpm搅拌混合物15分钟。用 1 mL 不含 DNase/RNase 的去离子水以 0.2 x g 离心 1 分钟洗涤颗粒四次。
- 为了进行DNA层的沉积,将步骤2.7中的1mLDNA质粒水溶液添加到PEI引发的微粒中,并在4°C的温度混合器上以800rpm轻轻搅拌混合物15分钟。要制备具有不同 DNA 负载的微胶囊,请使用不含 DNase/RNase 的蒸馏水将 DNA 质粒的浓度调节为 50-200 ng/μL,并使用 1 mL 这些溶液沉积 DNA。通过以0.2× g 离心1分钟来收集微粒。
- 将编码茶碱核糖开关与GFPa1偶联的DNA质粒的试管标记为ThyRS-GFPa1,将编码西兰花适配体的DNA质粒标记为BrocApt。
注意:将带有DNA的微量离心管放在冰上。 - 小心地除去上清液,并用1mL无DNase / RNase的蒸馏水洗涤微粒四次,每次以0.2× g 离心1分钟后弃去上清液。除非另有说明,否则在室温(RT)下进行所有实验。
- 为了进行丝素蛋白层的沉积,将步骤3.3中的1mL重构SF水溶液加入DNA吸附的微粒中,在10°C的温度混合器上以750rpm轻轻涡旋和搅拌混合物15分钟。通过在4°C下以0.2× g 离心1分钟来收集微粒,除去上清液,然后用1mL无DNase / RNase的蒸馏水洗涤一次。重复离心并弃去上清液。
注意:在实验过程中,将真丝溶液保持在冰上以避免温度引起的凝胶化。 - 逐渐用甲醇处理颗粒,以诱导丝蛋白结构中β片的形成。首先,加入 0.5 mL 的 DNase/RNase 蒸馏水,涡旋微量离心管,然后加入 0.5 mL 的 100% 甲醇。在10°C下轻轻摇动热混合器上的颗粒5分钟。通过以0.2× g 离心1分钟来收集颗粒。除去上清液。
- 用甲醇处理颗粒以促进β片的形成,并确保丝层的强烈物理吸附。加入 1 mL 100% 甲醇。在10°C下以750rpm轻轻摇动热混合器上的颗粒10分钟。
- 通过在4°C下以0.2× g 离心1分钟来收集颗粒,每次用1mL无DNase / RNAase的蒸馏水洗涤两次,丢弃上清液并在下一次离心前轻轻涡旋。
- 重复步骤4.5-4.8 20次,得到丝绸多层核壳结构。对于最后一个沉积步骤,使用步骤 3.4 中的荧光标记丝绸(Silk-DyLight550,1 mL)。
- 执行最后的洗涤步骤,并在环境条件下将微粒保持在 1 mL 不含 DNase/RNase 的蒸馏水中。
注意:为避免在丝绸层沉积过程中颗粒聚集,请对颗粒悬浮液进行目视检查,并使用 1 mL 移液器吸头上下移液以促进均匀的颗粒分布。 - 使用公式1计算封装在每个微胶囊中的DNA质粒拷贝数, NDNA :
 (1)
(1)
其中 N = 6.769 × 1011 - 用于封装的 SiO2 内核的数量。从已知浓度的二氧化硅颗粒的标准曲线计算它,使用连续稀释和吸收A 320在λ =320nm 处;
C-用于吸附的DNA的初始浓度
V-用于吸附的DNA体积
0.8- 核上的DNA吸附效率
Mw- DNA质粒的分子量
NA- 阿伏伽德罗数 (6.022 × 1023)
5.溶解芯,得到蚕丝微胶囊。
- 用蒸馏水稀释储备溶液(48%),制备8%氢氟酸(HF)溶液,pH 5.5。获取 50 mL 离心管。小心移液 5 mL HF 并加入 25 mL 蒸馏水以获得 8% HF 溶液。
注意:HF是一种高腐蚀性酸,可能会对组织造成严重烧伤。在处理和使用HF进行实验时必须格外小心。遵守组织制定的标准操作程序(SOP),以正确使用和处理HF,以避免不良泄漏事故。请勿使用玻璃容器稀释HF酸。使用化学罩执行协议的此步骤。 - 通过将 1.5 mL 的 8% HF 溶液添加到步骤 4.10 中的颗粒核壳微粒中来溶解 SiO2 核心。轻轻涡旋,让核心在环境条件下溶解过夜,并以 450 rpm 的速度轻轻摇动。
注意:为避免HF溢出,请使用接枝胶带密封微量离心管。使用化学罩执行协议的此步骤。 - 准备一个装满 2 L 去离子水的 2 L 玻璃烧杯。将微胶囊溶液转移到透析装置(50kDa MWCO)中,并在接下来的3天内每3小时重复更换一次水,对去离子水进行透析。
注意:在前三次换水期间收集上清液,并根据危险废物的既定方案丢弃溶液。 - 使用 1 mL 移液器将悬浮液从透析设备转移到新的 2 mL 微量离心管中以收集微胶囊。
注意:将微胶囊的水溶液在环境条件下储存数年。
6.使用共聚焦激光扫描显微镜(CLSM)对丝素蛋白微胶囊进行成像。
- 使用 DNA 染料进行 DNA 染色。
- 将 300 μL 空心丝素蛋白微胶囊转移到新鲜的 1 mL 微量离心管中。加入 500 μL 不含 RNase/DNase 的蒸馏水。
- 加入 5 μL 的 DNA 染色染料,短暂涡旋,并在室温下避光孵育 2 小时。
- 通过每次在4°C下以0.1× g 离心20分钟来执行四个洗涤步骤,小心地除去400μL上清液并用400μL无RNase / DNase的蒸馏水补充。
- 使用100倍油浸物镜(NA 1.49)在配备三个主要激光器(405 nm,488 nm,561 nm)的倒置共聚焦系统上对丝胶囊进行成像。将 100 μL 胶囊样品转移到 8 孔室载玻片的单孔中,让胶囊在成像前沉淀 20-30 分钟。
注意:染料对光漂白非常敏感。用铝箔覆盖载玻片来保护样品。
7.使用分子量截止(MWCO)法估计空心微胶囊的渗透性。
- 制备不同Mw(4 kDa、20 kDa、40 kDa、70 kDa、150 kDa、250 kDa、500 kDa和2 MDa)的FITC标记葡聚糖荧光团溶液(20 μM,diH2O)各2 mL。
- 将100μL胶囊悬浮液移液到腔室载玻片的单个孔中。分别分析每个微胶囊设计(PEI浓度,DNA质粒上样数,丝素蛋白浓度和层数)。
- 向每个孔中加入 300 μL 特定荧光团溶液,从最低的 Mw 到最高,因此每个孔将对应于特定的荧光团溶液。通过上下移液混合,让混合物在室温下孵育1小时,直到荧光团溶液的扩散达到平衡。
- 将载玻片转移到共聚焦激光扫描显微镜(CLSM)上,并在激发λ = 488nm下使用100倍油浸物镜对每个孔成像。
- 通过调整焦平面来识别感兴趣的区域,以确保胶囊以最大直径的圆的形式出现。这通常发生在观察靠近井底的样品时,当胶囊由于重力而沉淀时。
- 通过在XY方向上移动载玻片来收集微胶囊样品的几张图像。捕获图像,每个样品最多可捕获 100-150 个胶囊。
- 使用 ImageJ 软件通过比较胶囊内外的荧光强度来分析胶囊膜在每个 Mw 荧光团溶液中的渗透性。为此,以圆圈的形式绘制一个感兴趣区域(ROI)以勾勒胶囊的周长,然后单击 分析/ 测量以测量内部的荧光强度。将数据制成表格到电子表格中。对每个微胶囊执行此操作,总共200-300个胶囊。
- 通过概述ROI并测量远离胶囊的强度,以相同的方式评估外部荧光强度。执行 3-5 次测量以进行统计分析。
- 为了进行统计分析,使用配对 t检验(p < 0.05)比较胶囊内外的荧光强度。
- 使用换算 表2 根据可变 Mw的FITC-葡聚糖的流体动力学半径估算微胶囊的渗透率。
8.合成茶碱核糖开关在丝微胶囊中的 体外 活化
- 准备 1 mL 茶碱储备溶液 (100 mM,DMSO)。通过在冰上解冻组分40分钟来制备用于环状DNA的大 肠杆菌 S30提取物系统。
- 获得 0.5 mL 无 DNase/RNase 的微量离心管。进行 体外 转录/翻译反应,按以下顺序(50 μL 总体积)将无细胞组分与微胶囊样品混合:不含氨基酸的 S30 预混料(20 μL);S30提取物,圆形(15μL);完全氨基酸混合物(5μL);含有来自步骤4.10(9μL)的ThyRS-GFPa1质粒的空心微胶囊;和茶碱,100 mM DMSO(1 μL)。
注意:添加所有组分后,短暂涡旋管并在0.2 × g 的短暂离心中收集样品几秒钟。 - 将管在30°C孵育4小时,并使用λ = 488nm的激发和GFP / FITC滤光片(510nm±20nm)的发射检查读板器上的荧光。
- 使用 488 nm 和 561 nm 激光器在任何 LCSM 系统上对胶囊进行成像。使用100倍油浸物镜和8孔腔载玻片获得最佳质量的图像。
9. 蚕丝微胶囊中西兰花适配体的 体外 活化
- 准备 1 mL DFHBI-1T 染料储备溶液(30 μM,diH2O)。通过在冰上解冻组分40分钟来制备PURE(使用重组元件的蛋白质合成)无细胞系统反应试剂盒。
- 获得 0.5 mL 无 DNase/RNase 的微量离心管。通过将无细胞反应组分与微胶囊样品按以下顺序(50 μL 总体积)混合来进行 体外 转录反应:溶液 A (20 μL);溶液B(15μL);含有步骤4.10(14μL)的BrocApt质粒的空心微胶囊;和 DFHBI-1T 染料 (1 μL)。
注意:添加所有组分后,短暂涡旋管并在0.2 × g 的短暂离心中收集样品几秒钟。 - 将管在37°C孵育6小时,并使用λex = 470nm的激发和λem = 510nm±20nm的发射在读板器上检查荧光。
- 使用 488 nm 和 561 nm 激光器在任何 LCSM 系统上对胶囊进行成像。使用100倍油浸物镜和8孔盖玻片腔室载玻片获得最佳质量的图像。
结果
在这里,该研究解决了编码不同传感器设计(两种类型的RNA调控转录/翻译元件)的DNA模板在封装在丝蛋白胶囊中的功能。通过模板化逐层(LbL)组装制备关键组分的微胶囊:素数层,编码传感器设计的DNA质粒和丝素蛋白生物聚合物(图2)。以分层方式沉积大分子允许根据吸收层之间的分子间和内相互作用与壳的厚度来控制胶囊膜的渗透性。该系统的可调通透性提供了控制基本分子扩散的潜力,同时限制了大不期望的大分子通过胶囊膜20的扩散。
当正确遵循方案时,可以产生尺寸均匀(4.5μm)和坚固的丝素蛋白微胶囊,壳厚度为~500nm(20层)的水合状态(图3)21。LbL方法允许根据质粒的初始浓度调整DNA模板的上样能力。通过将 DNA 模板的初始浓度从 50-200 ng/μL 变化,可以实现最佳 DNA 载样量。 表1表示完成LbL封装后保留在单个微胶囊中的DNA拷贝数,并根据公式 1 计算每个传感器设计的初始DNA浓度和DNA质粒的Mw 。ThyRS 和 BrocApt 传感器设计分别通过 32 个和 20 个 DNA 拷贝实现了最佳 DNA 上样能力。上样能力的评估对于准确估计封装的DNA浓度非常重要,以便能够通过添加更浓缩的胶囊样品在传感器的IVTT激活期间对其进行滴定。
胶囊壳的渗透性可以通过遵循MWCO方法进行系统分析。该方法根据无法穿透胶囊膜的溶质分子的分子量来估计膜的孔径。通过将微胶囊置于可变的Mw 荧光团分子中,并在对应于多个胶囊的最大直径的焦平面中进行共聚焦成像,可以评估壳膜的渗透性。ImageJ分析允许估计胶囊内部和外部的荧光强度,并识别完全可渗透(外部和内部荧光团强度相当),部分渗透(50%-70%的胶囊内部荧光低于外部)和不可渗透(内部荧光团强度低于外部强度)膜(图4)。将每个荧光团的Mw 转换为流体动力学半径可以估计胶囊膜的网孔尺寸(表2)。
在LbL沉积方案的系统优化过程中,通过使用不同浓度的素层(0-6 mg / mL),丝素蛋白的浓度(0.5-2 mg / mL)和沉积层数(10-25),可以实现蛋白质胶囊的选择性渗透性,直到达到最佳渗透性。在该协议中,以 6 mg/mL 的 PEI 作为质层和 20 层 1 mg/mL 的丝素蛋白在 LbL 组装过程中沉积,实现了 25-32 nm 之间的最佳通透性(图 4)。该渗透率范围非常适合IVTT系统的组件通过胶囊壳渗透。通常,任何IVTT系统中最大的分子复合物是原核核糖体单元30S和50S,当它们在核糖体复合物中被mRNA结合时,可以在22号上达到~20nm。开发的微胶囊壳的结构类似于高度交织的丝纤维层网络,这些层由LbL组装过程中产生的β片块物理交联。这种膜结构是半透性的:对小分子(例如,离子,氨基酸,肽,糖等)具有高度渗透性,并且仅限于大分子(例如,高分子量蛋白质,糖蛋白,细胞等),仅允许渗透流体动力学半径小于25nm的分子。因此,具有最佳DNA负载和膜通透性的丝素蛋白微胶囊可用作IVTT活化的生物反应器载体。
ThyRS和BrocApt设计传感器的转录和翻译活性可以使用市售的IVTT系统进行测试。ThyRS需要在茶碱配体存在下对报告基因进行翻译激活。合成 ThyRS 的激活涉及启动基因表达的几个步骤,包括 mRNA 合成、mRNA 序列与分析物结合时的构象变化、核糖体结合位点的释放以及报告蛋白 GFPa1 蛋白的合成。所有这些步骤都需要IVTT组分通过胶囊膜自由扩散。所提出的富含DNA的丝素蛋白微胶囊的设计改善了RNA调控传感器设计的活化参数:与游离的非固定化DNA相比,表达动力学和荧光输出均显着更高(图5A)。CLSM成像还证实,在装有编码ThyRS序列的DNA质粒的胶囊内成功激活GFPa1基因(图5B-D)。
或者,在支持T7 大肠杆菌 启动子偶联转录/翻译的IVTT系统中进行BrocApt传感器设计的激活,该系统在DHFBI-1T染料存在下。荧光输出是在荧光染料与mRNA序列结合后开始的。重要的是,与同等浓度的非封装DNA样品相比,丝绸微胶囊的输出信号高出几倍(图6)。因此,丝素蛋白微胶囊可以保留DNA编码传感器元件的基本功能,这对于设计新型体 外 生物传感器平台以快速灵敏地检测目标分析物非常重要。

图1:pSALv-RS-GFPa1的质粒图谱和序列。 (A)质粒含有茶碱核糖开关(ThyRS)序列,放置在GFPa1编码基因的上游,在PTAC启动子β-内酰胺酶(BLA)编码基因的控制下负责对氨苄青霉素的抗性。(B)ptac启动子序列以粗体和下划线显示;茶碱核糖开关序列以粗斜体显示;GFPa1 编码序列以粗体显示;限制位点序列带有下划线。请点击此处查看此图的大图。

图 2:使用逐层方法制备微胶囊的概述。 首先用PEI聚合物对原始SiO2 核进行功能化,然后依次沉积编码不同传感器设计和丝素蛋白层的DNA质粒,直到吸附所需数量的丝蛋白层。含有各种DNA传感器设计的空心原始微胶囊可以通过溶解牺牲核心来生产。封装在微胶囊中的每个生物传感器设计的激活可以在相应的配体存在下在IVTT反应期间实现。该图转载自Drachuk, I. et al.21。 请点击此处查看此图的大图。
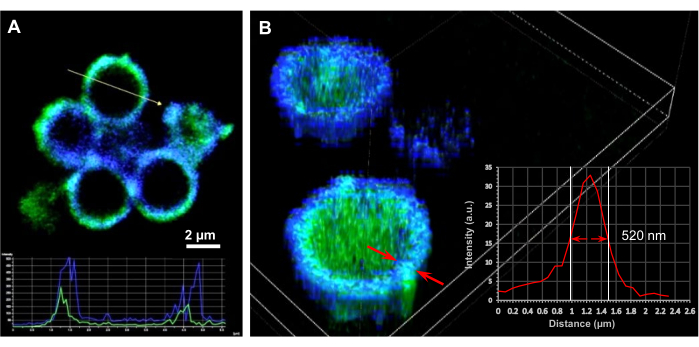
图 3:负载 DNA 的微胶囊的显微镜研究。 (A) 横截面 2D 和 (B) 空心 (SF)20 微胶囊的渲染 3D 共聚焦显微镜图像,这些微胶囊装载有编码 ThyRS 的 DNA 质粒(32 个 DNA 拷贝/胶囊),由 6 mg/mL PEI 引发的 SiO2 核心制成。应用丝素蛋白胶囊(DAPI通道,蓝色)和染色DNA(FITC通道,绿色)的自发荧光来鉴定DNA质粒的定位并估计胶囊膜厚度。(A)中的插图表示胶囊中DNA和丝素蛋白壳的强度分布。比例尺:2 μm。(B)中的插图表示蚕丝蛋白在胶囊外壳上的强度分布。测量膜厚度为半强度峰处的长度。横截面图像的处理和3D渲染是在尼康C2+ 系统上使用NIS成像软件进行的。该图转载自Drachuk, I. et al.21。 请点击此处查看此图的大图。
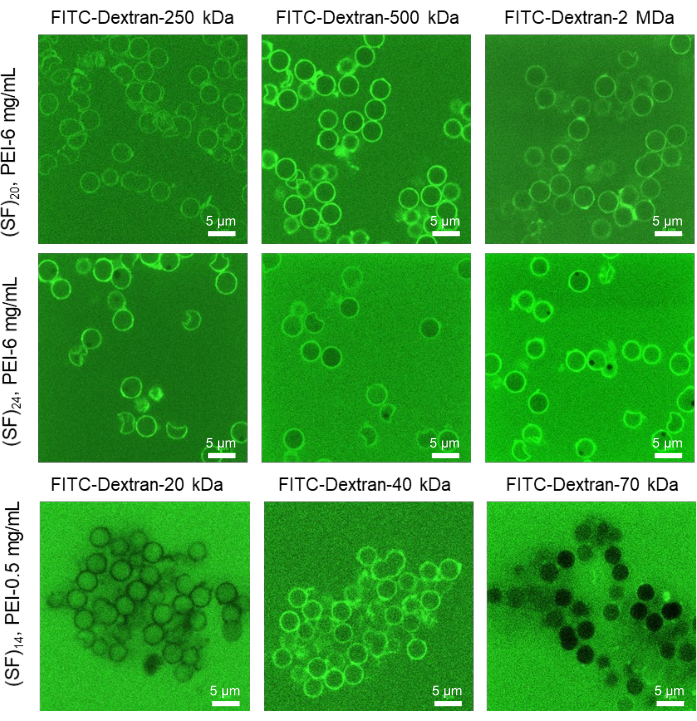
图4:使用MWCO方法估计丝微胶囊的膜渗透性。 对各种Mw (20μM,diH2O)的FITC-葡聚糖溶液进行空心丝素蛋白微胶囊的选择性CLSM代表性荧光图像。制备具有不同层数和PEI浓度的胶囊。质层浓度的增加导致具有更多渗透性壳的微胶囊的胶体稳定性增加,而素层的消除导致具有较少渗透性壳膜的胶囊聚集。比例尺:5 μm。该图转载自Drachuk, I. et al.21。 请点击此处查看此图的大图。

图 5:丝素蛋白微胶囊中 ThyRS 传感器设计的激活。 (A) ThyRS 活化过程中 GFPa1 表达的动力学,这些质粒来自装载到 20 层 SF 微胶囊(红色线)中的 DNA 质粒并对照非封装的 DNA(蓝色线)。从上到下,样品体积(50 μL)中的DNA浓度分别为6.5 ng/μL、4.5 ng/μL、2.5 ng/μL和0 ng/μL,与颜色强度的变化相对应。(B)丝素蛋白胶囊的CLSM图像,每个胶囊加载32个DNA拷贝。比例尺:5 μm。 (C)图像对应于对应于两个胶囊的图像(B)的横截面强度曲线(B中的白线)。红线代表蚕丝胶囊,绿线代表用胶囊表示的GFPa1。(D)该图像表示渲染的3D丝绸胶囊在IVTT系统中孵育后加载了32个DNA拷贝。绿色荧光对应于GFPa1信号,红色荧光对应于荧光标记的丝层。比例尺:2 μm。在IVTT系统(S30提取物)中孵育微胶囊期间,用茶碱(2mM,DMSO)进行ThyRS活化。该图转载自Drachuk, I. et al.21。请点击此处查看此图的大图。
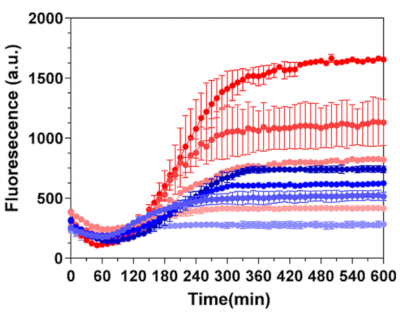
图6:丝素蛋白微胶囊中BroccApt的活化。 对每粒胶囊装载30个DNA拷贝的20层丝微胶囊(红色线)和对照非包封DNA(蓝色线)进行转录动力学比较。从上到下,样品中包封DNA的浓度为:3.6 ng/μL、2 ng/μL、1 ng/μL和0 ng/μL,对应于颜色强度的变化。非包封DNA的浓度为:20 ng/μL、10 ng/μL、5 ng/μL和0 ng/μL,与颜色强度的变化相对应。在PURE无细胞系统中孵育期间,用DHBFI-1T(100μM,diH2O)进行活化。该图转载自Drachuk, I. et al.21。 请点击此处查看此图的大图。
| DNA传感器设计 | 初始脱氧核糖核酸浓度(纳克/微升) | 每个胶囊的DNA拷贝数(DNA/胶囊) |
| 50 | 16 | |
| ThyRS | 100 | 32 |
| 150 | 48 | |
| 200 | 64 | |
| 50 | 10 | |
| 博罗亚普特 | 100 | 20 |
| 150 | 30 | |
| 200 | 40 |
表1:每种DNA设计的每粒胶囊的DNA拷贝数。 拷贝数根据公式1计算,并与DNA质粒的初始浓度、LbL沉积过程中DNA序列的保留亲和力以及DNA质粒的长度相关。
| 分子量 FITC-葡聚糖 (kDa) | 流体动力学半径(纳米) |
| 4 | 1.4 |
| 20 | 3.3 |
| 40 | 4.5 |
| 70 | 6 |
| 150 | 8.5 |
| 250 | 10 |
| 500 | 14 |
| 2,000 | 18 |
表2:FITC-葡聚糖的物理性质。 使用每个荧光团的流体动力学半径来估计空心丝素蛋白微胶囊的渗透性。
讨论
可以按照该协议制备装有各种类型的DNA编码传感器设计的选择性渗透水凝胶微胶囊。LbL方法的一个显着特点是能够在自下而上的组装过程中定制微胶囊的复杂性,这通常从牺牲模板上分子物质的吸附开始。通过仔细调整初始组分的浓度、pH条件和层数,可以制备具有不同DNA上样参数、功能和可调通透性的微胶囊23。为了增强胶囊的多功能性,可以使用AuNPs和IgG实现壳表面的进一步功能化,以实现用于 体内 诊断的生物相容性传感器载体。这两种替代途径都依赖于丝素蛋白的独特分子结构。由于存在能够在最佳还原缓冲液下还原金属离子的酪氨酸残基(5.3% mol.),因此可以实现 Au3+ 离子的原位还原。特异性抗体与AuNPs功能化蛋白质微胶囊表面的偶联可以通过实施碳化二亚胺活化化学 来完成 。这两个步骤都需要仔细开发和优化协议,以实现生物传感器胶囊在未来应用中的适当功能。例如,将这些微胶囊用作"智能"递送系统,其中分子货物在特定刺激(如pH或化学线索)下递送,应表征和调整这些胶囊的特定特性,包括递送效率,保留时间,给药途径和疾病模型治疗。
采用CLSM技术和荧光测量对负载DNA的微胶囊进行了表征。然而,其他表征方法,如原子力显微镜(AFM),低温电子断层扫描(CEM)和直接随机重建超分辨率显微镜(dSTORM)可用于区分微胶囊的特定结构,包括单个纤维,纳米结构域和DNA质粒的定位24,25,26。
开发的方案强调了丝素蛋白生物聚合物作为生物相容性网络材料的使用,该材料保留了加载的DNA质粒的三级结构。丝素蛋白网络中固定化DNA序列的稳定性通过疏水相互作用和/或氢键发生,这提供了防止pH失活,氧化或水解的保护微环境27。此外,丝素蛋白的β晶结构域提供了独特的机械屏障,限制了包埋的大分子的运动,并防止DNA质粒在水溶液中储存期间降解。
装载有DNA模板的丝素蛋白微胶囊的半透性为IVTT反应创造了独特的空间和物理化学条件。转录和翻译激活的RNA适配体和核糖开关固定在丝素蛋白微胶囊中,能够产生与游离非固定化传感器相比至少高三倍的输出信号。此外,DNA模板在微胶囊中的固定化可以显着增强封装传感器的活性,超过非封装传感器的检测限。虽然非封装传感器在低DNA浓度下具有最小的响应,但封装的传感器具有非常明显的输出响应,可以很容易地滴定以反映DNA浓度的细微变化。封装报告基因的反应信号改善可能是由于IVTT机制组件的无限制扩散和DNA质粒的迁移率降低。一些研究已经认识到,无细胞反应中蛋白质合成的产量取决于大分子环境28,29。将DNA质粒固定到丝网络中提供了一个有效的密闭环境,限制了寡核苷酸的运动,并加速了转录/翻译机制反应,甚至来自几个DNA拷贝21。
虽然LbL方法提供了一种非常通用的方法来以可控的方式构建多功能组件,但制造过程相对耗时,通常需要加工调整以提高微胶囊产量。制造基于生物分子的微胶囊的另一个考虑因素是任何给定系统与LbL沉积完成后核心溶解要求的兼容性。到目前为止,为了生产尺寸均匀且坚固的中空丝基DNA微胶囊,将壳沉积在牺牲二氧化硅(SiO2)核心模板上,随后需要通过氢氟(HF)酸蚀刻去除。HF处理或蚀刻也不被认为是生物相容性工艺,限制了其在实际应用中的广泛使用。碳酸盐核是 SiO2 无机胶体模板的替代品,在与聚合物层形成络合物时通常是惰性的,并且可以在温和条件下使用乙二胺四乙酸 (EDTA) 溶解。然而,调整牺牲芯可能会影响多层的沉积性能和壳结构的完整性,这需要进一步优化协议。
总之,目前的协议允许制备具有不同传感器设计的含有丝基DNA的微胶囊。LbL方法提供的受限微环境与丝素蛋白作为生物相容性材料的结合改善了封装DNA的传感特性。随着荧光RNA适配体技术的快速发展,含有DNA的丝微胶囊的潜在用途可以扩展到多重 体外 诊断。最近,基于RNA的荧光适配体的几种变体已成为强大的无背景技术,用于对活细胞中的RNA进行成像,具有高信噪比灵敏度30,31。通过应用合成RNA纳米技术设计人工RNA适配体,可以利用核酸适配体的荧光特性来检测目标的特定配体。这项技术对于监测不同形式的感兴趣生物标志物特别有价值,包括使用点纸基传感器、用于汗液或组织液的水凝胶贴片以及植入材料。
披露声明
此处提出的观点和意见是作者的观点和意见,不一定代表国防部或其组件的观点
致谢
这项工作得到了空军科学研究办公室的LRIR 16RH3003J资助,以及美国国防部副部长办公室负责研究和工程的军事环境应用研究促进科技优先事项(ARAP)计划的支持。
ThyRS 的质粒载体序列 (pSALv-RS-GFPa1, 3.4 kb) 由 J. Gallivan 博士慷慨提供。 来自Bombyx mori 的蚕茧由马萨诸塞州塔夫茨大学的D.L. Kaplan博士慷慨捐赠。
材料
| Name | Company | Catalog Number | Comments |
| (Z)-4-(3,5-difluoro-4-hydroxybenzylidene)-2-methyl-1-(2,2,2-trifluoroethyl)-1H-imidazol-5(4 H)-one (DFHBI-1T) | Lucerna | DFHBI-1T | |
| 5x T4 DNA Ligase Buffer | ThermoFisher Scientific | 46300-018 | |
| 6x Blue Gel Loading Dye | New England BioLabs | B7021S | |
| 96-well plates, black circular | Corning | 3601 | |
| Agarose | Sigma-Aldrich | A9539 | BioReagent, for molecular biology, low EEO |
| Ampicillin sodium salt | Sigma-Aldrich | A0166 | powder or crystals, BioReagent, suitable for cell culture |
| BlpI restriction enzymes | New England BioLabs | R0585S | |
| Corning Disposable Vacuum Filter/Storage Systems | FisherScientific | 09-761-1 | |
| Dimethyl sulfoxide, DMSO | Sigma-Aldrich | 472301 | ACS reagent, ≥99.9% |
| DNA Plasmid, pET28c-F30-2x Broccoli (5.4 kb), BrocApt. | Addgene | Plasmid #66788 | |
| DyLightTM550 Antibody Labeling kit (Invitrogen) | ThermoFisher Scientific | 84530 | |
| E. coli S30 extract system for circular DNA | Promega | L1020 | |
| Falcon Conical centrifuge tubes, 15 mL | FisherScientific | 14-959-53A | |
| Falcon Conical centrifuge tubes, 50 mL | 14-432-22 | ||
| Fisherbrand Microcentrifuge tubes, 1.5 mL | FisherScientific | 05-408-129 | |
| Hydrofluoric acid, HF | Sigma-Aldrich | 695068 | ACS reagent, 48% |
| Kanamycin sulfate | Sigma-Aldrich | 60615 | mixture of Kanamycin A (main component) and Kanamycin B and C |
| KpnI restriction enzymes | New England BioLabs | R0142S | |
| LB agar plate supplemented with 100 µg/mL ampicillin | Sigma-Aldrich | L5667 | pre-poured agar plates with 100 µg/mL ampicillin |
| LB agar plate supplemented with 50 µg/mL kanamycin | Sigma-Aldrich | L0543 | pre-poured agar plates with 50 µg/mL kanamycin |
| LB broth (Lennox grade) | Sigma-Aldrich | L3022 | |
| Lithium bromide, LiBr | Sigma-Aldrich | 213225 | ReagentPlus, ≥99% |
| Max Efficiency DH5-α competent E. coli strain | ThermoFisher Scientific | 18258012 | |
| Methanol | MilliporeSigma | 322415 | anhydrous, 99.8% |
| MilliQ-water | EMD MilliPore | Milli-Q Reference Water Purification System | |
| MinElute PCR Purification Kit | Qiagen | 28004 | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride, EDC | Sigma-Aldrich | E1769 | |
| PBS (phosphate buffered saline) | ThermoFisher Scientific | 10010023 | 1x PBS, pH 7.4 |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | M0530S | |
| Polyethylenimine, branched | Sigma-Aldrich | 408727 | average Mw ~25,000 |
| PURExpress In Vitro Protein Synthesis Kit | New England BioLabs | E6800S | |
| QIAEX II Gel Extraction Kit | Qiagen | 20021 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| Quick-Load 2-Log DNA Ladder (0.1-10.0 kb) | New England BioLabs | N0469S | |
| SiO? silica microspheres, 4.0 µm | Polysciences, Inc. | 24331-15 | 10% aqueous solution |
| Slide-A-Lyzer G2 Dialysis Cassettes, 3.5K MWCO, 15 mL | ThermoFisher Scientific | 87724 | |
| Sodium carbonate, Na?CO? | Sigma-Aldrich | 222321 | ACS reagent, anhydrous, ≥99.5%, powder |
| Spectrum Spectra/Por Float-A-Lyzer G2 Dialysis Devices | FisherScientific | 08-607-008 | Spectrum G235058 |
| SYBR Safe DNA gel stain | ThermoFisher Scientific | S33102 | |
| T4 DNA Ligase (5 U/µL) | ThermoFisher Scientific | EL0011 | |
| Theophylline | Sigma-Aldrich | T1633 | anhydrous, ≥99%, powder |
| Tris Acetate-EDTA buffer (TAE buffer) | Sigma-Aldrich | T6025 | Contains 40 mM Tris-acetate and 1 mM EDTA, pH 8.3. |
| UltraPure DNase/RNase-Free Distilled Water | FisherScientific | 10-977-023 | |
| ZymoPURE II Plasmid MaxiPrep kit | ZymoResearch | D4202 |
参考文献
- Slomovic, S., Pardee, K., Collins, J. J. Synthetic biology devices for in vitro and in vivo diagnostics. Proceedings of the National Academy of Sciences of the United States of America. 112 (47), 14429-14435 (2015).
- Harbaugh, S. V., Goodson, M. S., Dillon, K., Zabarnick, S., Kelley-Loughnane, N. Riboswitch-based reversible dual-color sensor. ACS Synthetic Biology. 6 (5), 766-781 (2017).
- König, H., Frank, D., Heil, R., Coenen, C. Synthetic genomics and synthetic biology applications between hopes and concerns. Current Genomics. 14 (1), 11-24 (2013).
- Silverman, A. D., Karim, A. S., Jewett, M. C. Cell-free gene expression: An expanded repertoire of applications. Nature Reviews Genetics. 21, 151-170 (2020).
- Chushak, Y., et al. Characterization of synthetic riboswitch in cell-free protein expression systems. RNA Biology. , 1-12 (2021).
- Cole, S. D., et al. Quantification of interlaboratory cell-free protein synthesis variability. ACS Synthetic Biology. 8 (9), 2080-2091 (2019).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- Grӓwe, A., et al. A paper-based, cell-free biosensor system for the detection of heavy metals and date rape drugs. PLoS One. 14 (3), 0210940(2019).
- Lin, X., et al. Portable environment-signal detection biosensors with cell-free synthetic biosystems. RSC Advances. 10 (64), 39261-39265 (2020).
- Caschera, F., Lee, J. W., Ho, K. K. Y., Liu, A. P., Jewett, M. C. Cell-free compartmentalized protein synthesis inside double emulsion templated liposomes with in vitro synthesized and assembled ribosomes. Chemical Communications. 52 (31), 5467-5469 (2016).
- Niederholtmeyer, H., Chaggan, C., Devaraj, N. K. Communication and quorum sensing in non-living mimics of eukaryotic cells. Nature Communications. 9, 5027(2018).
- Timin, A. S., Gould, D. J., Sukkhorukov, G. B. Multi-layer microcapsules: Fresh insights and new applications. Expert Opinion on Drug Delivery. 14 (5), 583-587 (2017).
- Bomati, E. K., Haley, J. E., Noel, J. P., Deheyn, D. D. Spectral and structural comparison between bright and dim green fluorescent proteins in Amphioxus. Scientific Reports. 4, 5469(2014).
- Frey, B. Amplification of Genomic DNA by PCR. Molecular Diagnosis of Infectious Diseases. Methods in Molecular Medicine. Reischl, U. 13, Humana Press. Totowa, NJ. 143-156 (1998).
- Lee, P. Y., Costumbrado, J., Hsu, C. -Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. Journal of Visualized Experiments. (62), e3923(2012).
- Zhou, Y., et al. Rapid regeneration and reuse of silica columns from PCR purification and gel extraction kits. Scientific Reports. 8, 12870(2018).
- Kostylev, M., Otwell, A. E., Richardson, R. E., Suzuki, Y. Cloning should be simple: Escherichia coli DH5α-mediated assembly of multiple DNA fragments with short end homologies. PLoS One. 10 (9), 0137466(2015).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Drachuk, I., et al. Silk macromolecules with amino acid-Poly(Ethylene Glycol) grafts for controlling layer-by-layer encapsulation and aggregation of recombinant bacterial cells. ACS Nano. 9 (2), 1219-1235 (2015).
- Antipov, A. A., Sukhorukov, G. B. Polyelectrolyte multilayer capsules as vehicles with tunable permeability. Advances in Colloid and Interface Science. 111 (1-2), 49-61 (2004).
- Drachuk, I., Harbaugh, S., Chávez, J. L., Kelley-Loughnane, N. Improving the activity of DNA-encoded sensing elements through confinement in silk microcapsules. ACS Applied Materials & Interfaces. 12 (43), 48329-48339 (2020).
- Melnikov, S., Ben-Shem, A., Garreau de Loubresse, N., Jenner, L., Yusupova, G., Yusupov, M. Structural basis for the inhibition of the eukaryotic ribosome. Nature Structural & Molecular Biology. 19 (6), 560-567 (2012).
- Zhao, S., et al. The future of layer-by-layer assembly: A tribute to ACS Nano associate editor Helmuth Möhwald. ACS Nano. 13 (6), 6151-6169 (2019).
- Main, K. H. S., Provan, J. I., Haynes, P. J., Wells, G., Hartley, J. A., Pyne, A. L. B. Atomic force microscopy-A tool for structural and translational DNA research. APL Bioengineering. 5, 031504(2021).
- Riera, R., Feiner-Gracia, N., Fornaguera, C., Cascante, A., Borrós, S., Albertazzi, L. Tracking the DNA complexation state of pBAE polyplexes in cells with super resolution microscopy. Nanoscale. 11 (38), 17869-17877 (2019).
- Bilokapic, S., Strauss, M., Halic, M. Cryo-EM of nucleosome core particle interactions in trans. Scientific Reports. 8, 7046(2018).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Fritz, B. R., Jamil, O. K., Jewett, M. C. Implications of macromolecular crowding and reducing conditions for in vitro ribosome construction. Nucleic Acids Research. 43 (9), 4774-4784 (2015).
- Ge, X., Luo, D., Xu, J. Cell-free protein expression under macromolecular crowding conditions. PLoS One. 6 (12), 28707(2011).
- Cawte, A. D., Unrau, P. J., Rueda, D. S. Live cell imaging of single RNA molecules with fluorogenic mango II arrays. Nature Communications. 11, 1283(2020).
- Chen, X., et al. Visualizing RNA dynamics in live cells with bright and stable fluorescent RNAs. Nature Biotechnology. 37 (11), 1287-1293 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。