Method Article
Модель среза мозга Ex Vivo для изучения и нацеливания на метастатический рост опухоли головного мозга рака молочной железы
В этой статье
Резюме
Мы представляем протокол для измерения лекарственного и радиационного ответа в режиме реального времени метастатических клеток рака молочной железы в органотипической модели среза мозга. Методы обеспечивают количественный анализ для изучения терапевтического воздействия различных методов лечения на метастазы в мозг от рака молочной железы ex vivo в интерфейсе микроокружения мозга.
Аннотация
Метастазы в мозг являются серьезным последствием рака молочной железы для женщин, поскольку эти опухоли трудно поддаются лечению и связаны с плохими клиническими результатами. Доклинические мышиные модели метастатического роста рака молочной железы (BCBM) полезны, но стоят дорого, и трудно отслеживать живые клетки и инвазию опухолевых клеток в паренхиме мозга. Здесь представлен протокол для культур срезов мозга ex vivo от ксенотрансплантированных мышей, содержащих внутрикраниально введенные клональные сублинии рака молочной железы. Клетки, помеченные люциферазой MDA-MB-231BR , вводились интракраниально в мозг самок мышей Nu/Nu, и после образования опухоли мозги были выделены, разрезаны и культивированы ex vivo. Срезы опухоли были сфотографированы для идентификации опухолевых клеток, экспрессирующих люциферазу, и мониторинга их пролиферации и инвазии в паренхиме головного мозга в течение 10 дней. Кроме того, протокол описывает использование покадровой микроскопии для изображения роста и инвазивного поведения опухолевых клеток после лечения ионизирующим излучением или химиотерапией. Реакция опухолевых клеток на лечение может быть визуализирована с помощью микроскопии с живой визуализацией, измерения интенсивности биолюминесценции и выполнения гистологии на срезе мозга, содержащем клетки BCBM. Таким образом, эта модель среза ex vivo может быть полезной платформой для быстрого тестирования новых терапевтических агентов отдельно или в сочетании с радиацией для идентификации лекарств, персонализированных для нацеливания на метастатический рост рака молочной железы отдельного пациента в микросреде мозга.
Введение
Метастазы рака молочной железы в мозг (BCBM) развиваются, когда клетки распространяются от первичной опухоли молочной железы к мозгу. Рак молочной железы является второй наиболее частой причиной метастазирования в мозг после рака легких, причем метастазы встречаются у 10-16% пациентов1. К сожалению, метастазы в мозг остаются неизлечимыми, так как >80% пациентов умирают в течение года после постановки диагноза метастазирования в мозг, а качество их жизни ухудшается из-за неврологических дисфункций2. Существует острая необходимость в определении более эффективных вариантов лечения. Однослойные двухмерные или трехмерные модели культур являются наиболее часто используемыми методами тестирования терапевтических агентов в лаборатории. Тем не менее, они не имитируют сложную микросреду BCBM, основной фактор фенотипа и роста опухоли. Хотя эти модели полезны, они не охватывают сложные опухолево-стромальные взаимодействия, уникальные метаболические требования и гетерогенность опухолей3. Чтобы более точно повторить опухолево-стромальные взаимодействия и гетерогенность микроокружения, наша группа и другие начали генерировать органотипические культуры метастазов в мозг с опухолевыми клетками, полученными от пациента (первичными или метастатическими) или раковыми клеточными линиями 4,5,6. По сравнению с классическими системами in vitro, эта краткосрочная модель ex vivo может обеспечить более подходящие условия для скрининга новых терапевтических средств до доклинической оценки в больших когортах животных.
Модели ex vivo были построены и успешно используются в первую очередь для выявления успешных методов лечения различных видов рака. Они требуют нескольких дней оценки и, кроме того, могут быть адаптированы к скринингу лекарств для конкретного пациента. Например, ткани мочевого пузыря и предстательной железы ex vivo показали дозозависимый противоопухолевый ответ доцетаксела и гемцитабина7. Подобные ткани колоректальной карциномы ex vivo были разработаны для скрининга химиотерапевтических препаратов Оксалиплатина, Цетуксимаба и Пембролизумаба8. Это применение широко используется при раке поджелудочной железы, учитывая существенное взаимодействие между стромальной средой и генотипическими и фенотипическими характеристиками аденокарциномы протоков поджелудочной железы 9,10. Кроме того, такие органотипические модели были разработаны для аналогичных скринингов опухолей головы, шеи, желудка и молочной железы11,12.
Здесь генерируется модель среза мозга ex vivo ксенотрансплантированных метастатических опухолевых клеток рака молочной железы в их микросреде. Мышам интракраниально вводили метастатические трофическиеклетки мозга MDA-MB-231BR рака молочной железы - общий участок метастазирования TNBC14,15 и позволяли развивать опухоли. Срезы мозга были получены из этих ксенотрансплантированных животных и поддерживались ex vivo как оловоорганические культуры, как описано16,17. Эта новая модель ex vivo позволяет анализировать рост клеток BCBM в паренхиме мозга и может быть использована для тестирования терапевтических агентов и радиационного воздействия на опухолевые клетки в микроокружении мозга.
протокол
Этот протокол был одобрен и следует руководящим принципам ухода за животными Комитетом по институциональному уходу и использованию животных Медицинского колледжа Университета Дрекселя (IACUC). В этом исследовании использовались nu/Nu атимические самки мышей (6-8 недель).
1. Внутричерепная инъекция опухолевых клеток
- Стерилизуйте все оборудование (пинцет, ножницы, шовные ножницы, ручную дрель) под сухим циклом автоклава до 45 мин в стерилизационных пакетах, включая индикатор стерилизации. При проведении операций на нескольких животных стерилизуйте инструменты между животными с помощью нагретого стерилизатора бусин (до 3x).
- Обезболивать мышей в соответствии с протоколом ухода за животными пользователей (например, изофлуран (4% для индукции, 1-2% поддержания) и вводить анальгезию (подкожную, 0,1 мл 0,1 мг / кг бупренорфина SR-LAB) до начала операции. Обеспечьте оптимальную глубину анестезии с помощью защемления пальца ноги.
- Поместите мышей в стереотаксическую рамку и обездвижите голову с помощью стандартных ушных вкладышей (рисунок 1А). Нанесите офтальмологическую мазь на глаза.
- Стерилизуют поверхность головки путем повторного, попеременного нанесения (3x) йодных тампонов и 70% этанола перед разрезом.
- Используйте хирургический скальпель, чтобы сделать разрез средней линии 1 см через кожу под небольшим диагональным углом к воображаемой линии, которая делит мозг мышей на две симметричные половины, чтобы обнажить череп. Протрите кровь ватным тампоном.
- Отклонить кожу вбок, чтобы обнажить место инъекции: 2 мм справа, 1 мм вперед по отношению к брегме (+2 медиолатеральной (+2 мл), +1 ростральной/каудальной (+1RC).
- Используйте долото (0,73 мм) для проникновения в череп +2ML, +1RC к брегме и просверлите отверстие, используя легкое давление и скручивающее движение.
- Используйте шприц для инъекций в мозг для инъекции 5 мкл 100 000 MDA-MB-231BR (стабильно экспрессирующих GFP-Люциферазу) клеток / мкл раствора в стерильных 1x PBS, первоначально вставляя шприц глубиной 3,5 мм в мозг.
- Дайте шприцу отстояться в течение 2 мин. Подтяните его вверх примерно на 1 мм, а через 2 мин медленно введите первую половину объема.
- Подождите еще 2 минуты, прежде чем вводить остальные, а затем медленно потяните шприц через 3 минуты после последней инъекции.
ПРИМЕЧАНИЕ: Медленная инъекция является эмпирической, позволяя объему хорошо поглощаться тканью мозга и не создавать утечку после вытягивания шприца, что может привести к росту раковых клеток за пределами предполагаемого места. - Нанесите костный воск на место инъекции на черепе, а затем используйте полипропиленовые швы для зашивания ткани. Мыши выздоравливают в течение 5 минут после снятия анестезии.
- Следите за их поведением сразу после операции в течение примерно 10 мин, 3 ч позже и на следующий день, чтобы определить, необходимо ли специальное лечение, включая инъекции физиологического раствора, мягкую пищу и т. Д., Чтобы помочь быстрому выздоровлению.
- Мониторинг роста опухоли с помощью биолюминесцентной визуализации на системе визуализации.
- Для этого, во-первых, включите кислород и изофлуран на системе визуализации. Разрешите распространить их в отдельную камеру за пределами коробки для обработки изображений.
- Затем включите программное обеспечение, инициализируйте инструмент и выберите подходящую опцию для визуализации и захвата всего тела мыши.
- Поместите мышей в отдельную камеру с изофлураном и обеспечьте оптимальную глубину анестезии с помощью защемления пальца ноги. Вводят мышам внутрибрюшинно с 200 мкл 30 мг/мл люциферина.
- Перенесите желудок мышей вниз к носу камеры визуализации, снабженному кислородом и изофлураном. Заблокируйте камеру и выберите 2 мин времени экспозиции, чтобы начать визуализацию.
- Используйте инструмент ROI (область интереса) программного обеспечения для количественной оценки биолюминесцентного сигнала опухоли.
- Чтобы проанализировать размер опухоли, выберите инструмент формы круга, подогнать его вокруг формы и размера опухоли. Измерьте рентабельность инвестиций и сообщите об общих показаниях.
- Допускайте солидный рост опухоли в течение 12-14 дней (или до тех пор, пока люцифераза не достигнет примерно 7,0 х 106 единиц) (рисунок 1B) до генерации срезов мозга.
ПРИМЕЧАНИЕ: Увеличение количества вводимых клеток приведет к более быстрому росту опухоли; поэтому генерация срезов мозга может произойти раньше, чем через 12 дней. С другой стороны, большая опухоль приведет к большему количеству срезов GFP +, если им позволить расти в течение 14 дней. Через 14 дней здоровье мышей начинает стремительно ухудшаться; следовательно, мониторинг здоровья животных должен быть увеличен до одного раза в день после 10-дневного периода времени, и любые мыши, проявляющие признаки боли и / или дискомфорта, должны использоваться для генерации срезов.
2. Генерация срезов мозга
ПРИМЕЧАНИЕ: Выполните шаги после изоляции мозга в стерильном ламинарной вытяжке. Обычно можно генерировать 35-40 отдельных срезов, содержащих опухолевые клетки (сигнал люциферазы), от одной мыши, введенной клетками MDA-MB-231BR (рисунок 1C).
- Стерилизуйте все хирургические инструменты в автоклаве. Поместите слайсер ткани в стерильный ламинарный вытяжной шкаф и очистите все инструменты и инструменты 70% этанолом.
- Через 12-14 дней после внутричерепной инъекции клеток MDA-MB-231BR обезболивают мышей в соответствии с протоколом ухода за животными пользователей, как описано в 1.2. Обеспечьте оптимальную глубину анестезии с помощью защемления пальца ноги.
- Быстро удалить и поместить их мозг (в течение 45 с) в ледяную (4 °C) сахарозу-ACSF, состоящую из следующих веществ: 280 мМ сахарозы, 5 мМ KCl, 2 мМ MgCl2, 1 мМ CaCl2, 20 мМ глюкозы, 10 мМ HEPES, 5 мМ Na+-аскорбата, 3 мМ тимочевины, 2 мМ Na+, 29 мМ пирувата; pH=7,3.
- Используя острый, стерильный скальпель или лезвие бритвы, отрежьте лишние участки мозга, которые не содержат никакой опухоли со всех сторон, включая нижнюю часть мозга.
- Доведите форму мозга до неидеального куба, чтобы он сидел ровно на смачиваемой фильтровальной бумаге ACSF на крышке тарелки диаметром 60 мм, чтобы облегчить нарезку.
ПРИМЕЧАНИЕ: Дополнительная ткань мозга, в которой опухоль вряд ли выросла, удаляется перед нарезкой, чтобы позволить генерировать в основном срезы GFP + и создавать форму мозга, которая стабильна на поверхности инструмента и не будет нарушена вибрациями, вызванными нарезкой. - Поместите несколько листов предварительно намоченных (с ACSF) кругов фильтровальной бумаги на режущую платформу и поместите заблокированную ткань поверх нее.
- Установите размер разреза на инструменте в 2 или 2,5 единицы на предусмотренной линейке, чтобы разрезать ткань на 200-250 мкм срезов.
ПРИМЕЧАНИЕ: Ломтики размером до 350 мкм или толщиной до 100 мкм являются жизнеспособными. Для срезов <200 мкм используйте вибратом или компрессом. - Используйте кисть (соболь) для переноса ломтиков мозга в блюдо, содержащее сахарозу ACSF, и отделяйте ломтики под световым микроскопом с помощью игл 27 G.
- Определите GFP-положительные срезы под флуоресцентным микроскопом и перенесите их в новую 60-миллиметровую посуду, содержащую 2-3 мл взрослой срезовой среды (нейробазальная среда A, 2% добавка B12, 1% добавка N2, 1% глутамина, 0,5% глюкозы, 10 ЕД / мл пенициллина и 100 мкг / мл стрептомицина), используя стерильную 1 мл отколовшуюся пипетку (широкое отверстие).
ПРИМЕЧАНИЕ: Срезы мозга, которые содержат опухолевые клетки, растущие над поверхностью мозга (возможно, из-за утечки инъекционных клеток и т. Д.), Исключаются. - Переложите по 3-5 ломтиков на каждые 30 мм, размером 0,4 мкм размером с поры культуры культуры вставляют в 6-луночные пластины на расстоянии, не позволяющем врастать друг в друга.
- Удалите лишнюю среду с поверхности вставки с помощью пипетки P1000, добавьте 1 мл взрослой мышиной среды под каждую вставку и уравновесьте носитель в инкубаторе перед нарезкой.
- Инкубируют ткани при 37 °C, 5% CO2 и 95% влажности в течение 24 ч перед визуализацией.
3. IVIS визуализация срезов
ПРИМЕЧАНИЕ: Выполните этапы добавления люциферазы и ингибитора в стерильной ламинарной вытяжке.
- Пипетка 5 мкл раствора люциферина 30 мг/мл в среду под вставками путем подъема вставки щипцами и помещения их обратно в лунку после добавления люциферина в среду в лунке.
- Поместите 6-луночную пластину с крышкой внутрь камеры визуализации инструмента под стационарной камерой и закройте дверцу камеры.
- Откройте программное обеспечение и инициализируйте инструмент.
- Выберите параметры камеры, которые позволяют визуализировать и захватывать только одну скважину на изображение. Переместите сцену вверх (FOV 5 см) и поместите колодец, который должен быть изображен, непосредственно под камерой.
- Установите время визуализации на наиболее подходящее в зависимости от интенсивности люциферазы, которую будет выделять опухоль, которая может варьироваться от 10 с до 5 мин. Начните с установки его на 10 с, а затем увеличьте, если сигнал низкий, но сохраняйте его последовательным для всех временных точек и условий до конца эксперимента (рисунок 1D).
- Используйте инструмент ROI (инструмент формы круга), поместите его вокруг формы и размера опухоли, измерьте ROI и сообщите общие показания для количественной оценки биолюминесцентного сигнала каждой опухоли на срезе.
- Поднесите пластину обратно к стерильному ламинарной вытяжке, используйте щипцы, чтобы слегка приподнять вставку из колодца.
- Аспирируйте среду, замените ее 1 мл свежей среды и поместите вставку обратно в лунку.
- Для экспериментов, где срезы обрабатывают различными соединениями, такими как ингибиторы, метаболиты и т. Д., Готовят соответствующую концентрацию реагента в 1,2 мл среды мозгового среза в трубке объемом 1,5 мл, а затем переносят 1 мл в скважину, содержащую срез.
- Повторяйте этот процесс каждые 48 ч в течение всего исследования.
4. Живая визуализация роста опухоли в срезах мозга ex vivo
ПРИМЕЧАНИЕ: Поставьте вставки с достаточным количеством среды (1,5 мл) для продолжительности эксперимента, так как невозможно добавить дополнительную среду во время визуализации в реальном времени.
- Поместите 6-луночную пластину на автоматический держатель пластин микроскопа внутри инкубатора (37 °C, 5% CO2 и 95% влажности).
- Откройте программное обеспечение, включите brightfield в первом квадранте, чтобы настроить экспозицию, необходимую для просмотра фрагментов. Чтобы найти положение (координаты «xy») среза, перемещайтесь с помощью «xy» по второму квадранту для управления координатами «xyz» микроскопа.
- Выберите 6-луночную пластину в качестве лабораторной посуды, используемой для этого эксперимента. Выберите редактор карт ROI и зарегистрируйте эту позицию, выбрав новую рентабельность инвестиций, добавьте и сохраните эту рентабельность инвестиций.
- Повторите те же шаги для всех других областей, представляющих интерес в других скважинах. После добавления всех ROI сохраните все ROI.
- В разделе Протокол выберите Очистить существующий и выберите Time-Lapse в разделе Приобретение, а затем выберите интересующие каналы (в данном случае GFP).
- Отключите автофокусировку в программе настройки фокусировки и вручную настройте соответствующий фокус для всех фрагментов. Наконец, отрегулируйте интенсивность Brightfield и время возбуждения флуоресцентного канала до соответствующего уровня.
- Установите протокол для получения изображений каждые 15 минут в течение 48 часов.
- Сохраните и запустите протокол. В конце эксперимента сохраненный файл будет содержать изображения brightfield и GFP, полученные для каждого ROI.
- Чтобы объединить изображения в видео, переименуйте все интересующие изображения с тем же именем, за которым следует двоичное число, чтобы упорядочить их в том порядке, в котором они были захвачены (например, ROI1 (1), RO1 (2) ...)
- Откройте ImageJ и импортируйте изображения, щелкнув Файл > Импорт > Последовательность изображений. Выберите имена файлов, которые отображаются в списке, и запишите содержимое имен файлов в поле Имя файла Содержит, которое будет отображаться для идентификации файлов, выбранных для видео.
- Сохраните объединенные изображения в разделе Файл > Сохранить как > AVI.
5. МТС анализ и иммуногистохимия тканей головного мозга ex vivo
- МТС Пробирж
- Иссечение срезов путем разрезания мембраны культуры ткани под каждым срезом вдоль краев ткани и переноса ткани, все еще прикрепленной к мембране, в 96-луночную пластину.
- Добавляют реагент МТС, смешанный в соотношении 1:5 с культуральной средой и 0,01% тритоном (1x), чтобы обеспечить проникновение раствора в ткань, в общем объеме 120 мкл в каждой лунке.
- Используйте 4% параформальдегида (PFA) в качестве агента, чтобы сделать срезы мозга нежизнеспособными и, таким образом, положительный контроль для этого эксперимента. Погрузите интересующий срез мозга в 4% PFA в течение 1 ч при RT (комнатная температура) или на ночь при 4 °C, прежде чем приступить к анализу MTS.
- Дайте реагенту МТС вступить в реакцию на срезы в течение 4 ч, извлеките срезы из лунок и измерьте поглощение при 490 нм для всех условий, включая пустой колодец без среза в качестве эталона.
- Отчет о показаниях в зависимости от области среза ткани, измеренной с помощью цифровой линейки суппорта.
- Иммуногистохимический препарат
- Погружайте срезы мозга, прикрепленные к мембранной вставке поверхности, в 10% формалин на ночь при 4 °C.
- Выполняйте встраивание, обработку, блокировку и генерируйте незапятнанные слайды ткани. Используйте стандартный протокол окрашивания иммуногистохимии для окрашивания H&E, Ki-67, gamma-H2AX, CC3, GFAP, GFP, DAPI
6. Облучение опухоли в срезах головного мозга ex vivo
- Облучают опухоль 6 Гр (рентген 310 кВп).
ПРИМЕЧАНИЕ: Единицы, введенные для получения общей дозы 6 Гр, составляют 3522 единицы после рассмотрения единиц R (измеренных с помощью электрометра Victoreen) и поправок на наперсток, плотность воздуха и cGy/R, как описано ранее18. Время экспозиции составляет 130,9 с. - Используйте 0,25 мм Cu +1 мм Al с добавлением фильтрации, 50 см SSD, 125 cGy в минуту.
- Выполняйте дозиметрию с помощью пучковой ионизационной камеры, откалиброванной по первичному стандарту.
- Ежедневно вносите поправки на влажность, температуру и барометрическое давление.
Результаты
Клетки MDA-MB-231BR-GFP-Люциферазы вводили интракраниально в правое полушарие 4-6-недельных мышей Nu/Nu, как описано выше (рисунок 1A), и позволяли расти в течение 12-14 дней, в течение которых рост опухоли контролировался с помощью биолюминесцентной визуализации (рисунок 1B). Мы ввели 100 000 раковых клеток интракраниально, как сообщают другие группы19, но можно ввести всего 20 000 клеток20. После генерации срезов мозга (рисунок 1C), как описано выше, срезы были изображены на IVIS для определения присутствия опухоли с помощью биолюминесцентной визуализации после 24-часовой инкубации. Это считается днем 0. Рост опухоли контролировали путем количественной оценки биолюминесцентной сигнализации каждые 48 ч, что указывало на прогрессирующий рост в течение 6 дней (рисунок 1D). Окрашивание H&E и GFP-положительная флуоресценция подтверждают наличие опухоли в срезе мозга (рисунок 1D). Мы также смогли обнаружить окрашивание реактивных астроцитов, визуализированное окрашиванием для глиального фибриллярного кислотного белка (GFAP)-положительных клеток, видимых между кластером раковых клеток (GFP-положительных) (рисунок 1D), аналогичных тому, что видно in vivo21. В отличие от моделей, которые прививают раковые клетки ex vivo в срезмозга мыши 22, эта модель содержит реактивные астроциты, которые являются важным аспектом микроокружения опухоли BCBM. Мы также обнаруживаем повышенное окрашивание Ki-67, подтверждающее, что раковые клетки являются высокопролиферативными (рисунок 1D). Таким образом, опухолевые клетки в паренхиме мозга могут выживать и размножаться в срезе мозга ex vivo в течение нескольких дней, а также содержать опухолеассоциированную строму.
Облучение (ИК) является одним из первых направлений лечения пациентов, у которых присутствуют метастазы в мозг в клинике. Чтобы понять, как модель среза ex vivo будет реагировать на такое лечение, срезы мозга, содержащие опухоли люциферазы MDA-MB-231BR-GFP, подвергались облучению 6Gy. Опухоли в срезах мозга, которые не подвергались облучению, продолжали расти ex vivo, в то время как опухоли, подвергшиеся облучению, показали застопорившийся рост (рисунок 2A). Срезы мозга, содержащие опухоли MDA-MB-231BR-GFP-Люциферазы, также контролировались с помощью живой визуализации в течение 48 ч после 4-го дня для визуализации роста опухоли в микроокружении мозга после ИК-лечения (рисунок 2B). В соответствии с биолюминесцентной визуализацией, контрольные раковые клетки быстро растут по мере увеличения интенсивности GFP, и ряд клеток вторгаются в паренхиму мозга (Видео 1). Напротив, раковые клетки в срезах мозга, обработанных 6Gy IR, являются цитостатическими, и интенсивность GFP поддерживается (видео 2). Окрашивание H &E подтверждает меньшие опухоли в ИК-обработанных клетках (рисунок 2C). Мы также обнаружили большие многоядерные раковые клетки и увеличение окрашивания маркера повреждения ДНК g-H2AX в раковых клетках, обработанных IR (рисунок 2C). Не было обнаружено увеличения апоптоза в срезах, обработанных ИК, что говорит о том, что ИК может уменьшить пролиферацию (рисунок 2C). Тем не менее, было обнаружено увеличение окрашивания в реактивных астроцитах, визуализированное окрашиванием для GFAP-положительных клеток, которые видны вокруг кластера раковых клеток (GFP-положительных), обработанных IR (Рисунок 2C). Это говорит о том, что эта модель ex vivo также может быть полезна для понимания того, как некоторые компоненты опухоли-стромы реагируют на лечение. Кроме того, мы не обнаружили никакого апоптоза, вызванного ИК-лечением срезов мозга мыши без опухолей (рисунок 2D).
Мы также проверили, будут ли преформированные опухоли MDA-MB-231BR в срезах мозга реагировать на химиотерапию. Срезы мозга, содержащие опухоли MDA-MB-231BR, обрабатывали различными концентрациями паклитаксела (рисунок 3A), химиотерапевтического препарата, используемого у пациентов с раком молочной железы23. Лечение уменьшало размер опухоли, что количественно определялось биолюминесцентной сигнализацией, но это ингибирование было значительным только после 10-го дня лечения (рисунок 3А). Это может быть связано с гетерогенным ответом на паклитаксел ex vivo. Например, в хорошо обработанных 40 нМ один срез, содержащий опухоль (сверху), уменьшается, в то время как опухоль (нижняя) в том же колодце, по-видимому, растет. Кроме того, некоторые из меньших опухолей, по-видимому, были более чувствительны к паклитакселу и демонстрировали сниженную биолюминесценцию, в то время как более крупные опухоли казались рефрактерными (рисунок 3A, лечение 80 нМ). В соответствии с уменьшением размера опухоли, увеличение апоптоза было обнаружено в опухолевых клетках, обработанных паклитакселом, по сравнению с контрольной группой (рисунок 3B). Важно отметить, что, используя анализ жизнеспособности MTS, адаптированный из Mews et al. для включения использования тритона24, мы проверили, что лечение ингибиторами не изменяет жизнеспособность ткани мозга (при отсутствии опухоли) (рисунок 3C). В соответствии с этим результатом мы не обнаружили и не увеличили апоптоз, измеренный расщепленным окрашиванием каспазы 3 в обработанном паклитакселом срезе мозга мыши без опухоли (рисунок 3D). Эти данные свидетельствуют о том, что эта модель может быть полезна для понимания химиотерапевтического ответа и резистентности BCBM в микросреде мозга. Из-за характера модели, установки ex vivo , которая сохраняет свойства и взаимодействие между головой и опухолью головного мозга, ее существенность заключается в предоставлении первичных доказательств ответа BCBM на химиотерапевтические реагенты и, таким образом, в устранении лекарств, которые не уменьшают опухоль в этой модели, из будущих испытаний in vivo , которые по-прежнему необходимы для проверки эффекта лекарств, которые обеспечивают положительные результаты в этой модели, системный ответ в организме и способность пересекать гематоэнцефалический барьер.
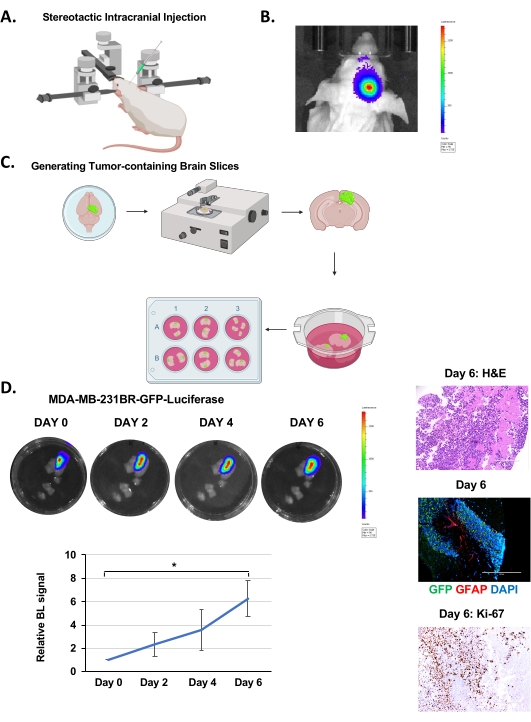
Рисунок 1. Внутричерепная инъекция, генерация срезов мозга и рост BCBM ex vivo. (А) Схематическое изображение мыши во время внутричерепной инъекции под стереотаксическим инструментом. (B) Репрезентативные изображения биолюминесцентного обнаружения опухолей у 4-6-недельных мышей Nu/Nu, которым вводили 5 x 105 клеток MDA-MB-231BR-GFP-Люциферазы через 12 дней после инъекции. (C) Схематическое изображение генерации срезов мозга мыши ex vivo из (B). (D) Репрезентативные изображения, изображающие рост опухоли в органотипических срезах мозга, полученных от мышей, интракраниально введенных с клетками MDA-MB-231BR-GFP-Люциферазы, обнаруженными с помощью биолюминесценции в течение 6 дней. H&E & Ki-67, GFP (опухолевые клетки) GFAP (реактивные астроциты) DAPI (ядро) окрашивание репрезентативного среза мозга с опухолью (увеличение изображения 20x, шкала: 200 мкм). Количественная оценка роста опухоли представляет собой сигнал биолюминесценции относительно дня 0 (n = 3). T-тест студента показал среднюю ± SEM, * p < 0,05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2. Обработка Олово-отрубов головного мозга БНБМ радиацией. (A) Репрезентативные изображения, изображающие рост опухоли в органотипических срезах мозга, полученных от мышей, которым интракраниально вводили клетки MDA-MB-231BR-GFP-Люциферазы, обнаруженные с помощью биолюминесценции. Опухоли не подвергаются облучению или облучению 6 Гр (одна доза) и допускаются к росту в течение указанных дней. Количественная оценка роста опухоли в указанные сутки (контроль. n = 3; 6Gy, n = 3). T-тест студента указан как средний ± SEM. * p < 0,05. (B) Срезы мозга визуализировались в течение 48 ч каждые 15 минут. Репрезентативные изображения видео необлученных и облученных образцов указывают на рост опухоли. (C) Срезы, обработанные в (A), были зафиксированы и проанализированы для окрашивания H&E, g-H2AX, DAPI, расщепленной каспазы-3 (CC3) и GFP (увеличение изображения 20x, шкала: 200 мкм). (D) Срезы мозга мыши без опухоли обрабатывали как в (A) и фиксировали и анализировали на CC3 и DAPI (увеличение изображения 20x, шкала: 200 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3. Лечение БКБМ органотипическими срезами головного мозга паклитакселом. (A) Срезы мозга, полученные от мышей, интракраниально вводили клетки MDA-MB-231BR-GFP-Люциферазы, обработанные ДМСО или после лечения паклитакселом при 40 нМ, 80 нМ, 160 нМ и 320 нМ в течение 10 дней, пополняя среду каждые 48 ч и позволяя расти в течение указанных дней (увеличение изображения 20x, шкала: 200 мкм). Количественная оценка роста опухоли в указанные сутки (контроль n = 6, Paclitaxel n = 3) (нижний). T-тест студента указан как средний ± SEM. * p < 0,05. (B) Срез мозга ex vivo , обработанный в (A) либо DMSO, либо 320 нМ паклитаксела, собирали, фиксировали и анализировали для GFP, CC3 и DAPI (увеличение изображения 20x, шкала: 200 мкм). (C) Срез мозга ex vivo , обработанный в (A) (без опухоли) либо DMSO, либо 320 нМ паклитаксела, собирали на 10-й день и анализировали на жизнеспособность клеток (анализ MTS). В качестве положительного контроля срезы обрабатывали параформальдегидом (PFA), который делает срезы мозга нежизнеспособными (n = 3) T-тест Стьюдента сообщил как средний ± SEM. * p < 0,05. (D) Срез мозга ex vivo , обработанный в (A) (без опухоли) либо DMSO, либо 320 нМ паклитакселом, собирали, фиксировали и анализировали для CC3 и DAPI (увеличение изображения 20x, шкала: 200 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1. Живая визуализация органотипических срезов мозга BCBM. Срезам мозга, полученным от мышей, интракраниально вводили клетки MDA-MB-231BR-GFP-Люциферазы, давали расти в течение 4 дней, а затем помещали под микроскоп живого изображения в течение 48 ч, где изображения делались каждые 15 мин и объединялись для создания видео с использованием ImageJ. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2. Живая визуализация облученных bcbm органотипических срезов мозга. Срезы мозга, полученные от мышей, интракраниально введенные с клетками MDA-MB-231BR-GFP-Люциферазы, облучались на следующий день после генерации срезов и через 4 дня воспроизводились каждые 15 минут в течение 48 ч. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Это исследование устанавливает новый метод культивирования мозга ex vivo для эксплантированных опухолей головного мозга ксенотрансплантата. Мы показываем, что клетки BCBM MDA-MB-231BR, интракрационно вводимые в мозг мышей, могут выживать и расти в срезах мозга ex vivo . Исследование также проверило внутрикраниально введенные клетки глиобластомы U87MG (GBM), а также обнаружило, что эти раковые клетки выживают и растут в срезах мозга (данные не показаны). Мы считаем, что эта модель может быть расширена за пределы BCBM и GBM на другие виды рака, которые легко метастазируют в мозг, включая рак легких и меланому. Были выбраны внутричерепные инъекции трофических клеток головного мозга рака молочной железы, поскольку это простой и быстрый метод генерации опухолей головного мозга и рассматривается как подходящая модель для макрометастазов мозга25. Тем не менее, подобные модели опухолевых срезов могут быть разработаны либо из внутрисердечной инокуляции, либо из ортотопических инъекций в первичные жировые прокладки. Оптимизация условий культивирования путем выращивания срезов мозга взрослого человека в бессывороточной среде и подачи свежей среды каждые 48 ч обеспечила лучшее сохранение жизнеспособности тканей, выживаемость и рост опухолей. Вставки размером 0,4 мкм, используемые в гипероксических условиях инкубатора, служат структурной поддержкой для срезов мозга ex vivo , а также обеспечивают связь с искусственным снабжением питательными веществами и кислородом тканей и опухолевых клеток при отсутствии кровоснабжения, которое, по-видимому, достаточно для поддержания жизнеспособности тканей в течение не менее десяти дней в культуре. Живая визуализация представляет рост опухоли как функцию увеличения сигнала GFP. Однако программное обеспечение имеет порог максимальной светимости GFP, который насыщает сигнал и не позволяет правильно идентифицировать подвижность одноклеточных клеток в микросреде мозга. Будущая модификация микроскопического программного обнаружения сигнала улучшит способность точно сообщать о временном увеличении сигнала GFP в зависимости от роста опухоли.
Эта модель также позволяет контролировать рост и жизнеспособность опухоли с помощью иммуногистохимического окрашивания. Важно отметить, что эта модель позволит проводить экспресс-тестирование эффективности радиационной чувствительности с или без ингибиторов малых молекул опухолей, выращенных в микросреде мозга. Мы показываем, что эта модель поддается как лечению радиацией, так и химиотерапии. Кроме того, эта система может быть использована для исследований омики, таких как протеомика, метаболомика и геномика, для дальнейшего понимания роста рака и ответа на лечение в микроокружении мозга. Кроме того, тестирование потенциального рецидива опухолей при удалении ингибиторов после более короткого воздействия позволит лучше понять хеморезистентные пути, уникальные для раковых клеток в микроокружении мозга.
Таким образом, мы разработали новый ex vivo мозговой срез культивирования опухолевой ткани ксенотрансплантата, который будет контролировать рост опухоли и взаимодействие с микроокружением опухоли головного мозга и для быстрого скрининга терапевтических агентов для блокирования роста опухоли в мозге.
Раскрытие информации
У авторов нет финансовых конфликтов, которые можно было бы декларировать.
Благодарности
Мы хотим поблагодарить Джулию Фарнан, Кайлу Грин и Тициану ДеАнджелис за их техническую помощь. Эта работа была частично поддержана Пенсильванской универсальной программой грантов на улучшение исследований (MJR, JGJ), UO1CA244303 (MJR), R01CA227479 (NLS), R00CA207855 (EJH) и благотворительными фондами W.W. Smith (EjH).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe, slip tip | BD | 309659 | |
| 30 G1/2 Needles | BD | 305106 | |
| 6-well plates | Genessee | 25-105 | |
| Automated microscope and LUMAVIEW software | Etaluma | LS720 | |
| B27 (GEM21) | Gemini Bio-Products | 400-160 | |
| Beaker 50 mL | Fisher | 10-210-685 | |
| Blunt sable paintbrush, Size #5/0 | Electron Microscopy Sciences | 66100-50 | |
| Bone Wax | ModoMed | DYNJBW25 | |
| Brain injection Syringe | Hamilton Company | 80430 | |
| CaCl2 | Fisher Scientific | BP510-250 | |
| Cleaved caspase 3 Antibody | Cell Signaling | 14220S | |
| DAPI | Invitrogen | P36935 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| Double edge razor blade | VWR | 55411-060(95-0043) | |
| Filter Paper (#1), quantitative circles, 4.25 cm | Fisher | 09-805a (1001-042) | |
| Fine sable paintbrush #2/0 | Electron Microscopy Sciences | 66100-20 | |
| Forceps | Fine Science Tools | 11251-20 | |
| Gamma-H2AX antibody | Millipore | 05-636 | |
| GFAP antibody | Thermo Fisher | 13-0300 | |
| GFP antibody | Santa Cruz | SC-9996 | |
| Glucose | Sigma Aldrich | G8270 | |
| Glutamine (200 mM) | Corning cellgrow | 25-005-Cl | |
| H&E and KI-67 | Jefferson Core Facility Pathology staining | ||
| Hand Drill Set with Micro Mini Twist Drill Bits | Amazon | YCQ2851920086082DJ | |
| HEPES, free acid | Fisher Scientific | BP299-1 | |
| Just for mice Stereotaxic Frame | Harvard Apparatus (Holliston, MA, USA). | 72-6049, 72-6044 | |
| KCl | Fisher Scientific | S271-10 | |
| Large surgical scissors | Fine Science Tools | 14001-18 | |
| MDA-MB-231BR cells | Kindly provided by Dr. Patricia Steeg | Ref 14 | |
| MgCl2·6H2O | Fisher Scientific | M33-500 | |
| Mice imaging device | Perkin Elmer | IVIS 200 system | |
| Mice imaging software | Caliper Life Sciences (Waltham, MA, USA). | Living Image Software | |
| Microplate Reader | Tecan Spark | ||
| Mounting solution | Invitrogen | P36935 | |
| MTS reagent | Promega CellTiter 96 Aqueous One Solution | (Cat:G3582) | |
| N2 supplement | Life Technologies | 17502-048 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nu/Nu athymic mice | Charles Rivers Labs (Wilmington, MA, USA) | ||
| Paraformaldehyde | Affymetrix | 19943 | |
| Pen/Strep | Life Technologies | 145140-122 | |
| Polypropylene Suture | Medex supply | ETH-8556H | |
| Povidone Iodine Swab sticks | DME Supply USA | Cat: 689286X | |
| Scalpel blade #11 (pk of 100) | Fine Science Tools | 10011-00 | |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | |
| Sodium Pyruvate | Sigma Aldrich | S8636 | |
| Spatula/probe | Fine Science Tools | 10090-13 | |
| SS Double edge uncoated razor blades (American safety razor co (95-0043)) | VWR | 55411-060 | |
| Sucrose | Amresco | 57-50-1 | |
| Surgical Scalpel | Exelint International | D29702 | |
| Tissue Chopper | Brinkman | (McIlwain type) | |
| Tissue culture inserts | Millipore | PICMORG50 or PICM03050 | |
| X-ray machine | Precision 250 kVp |
Ссылки
- Watase, C., et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives. Cancers. 13 (5), Basel. (2021).
- Niikura, N., et al. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Research and Treatment. 147 (1), 103-112 (2014).
- Fong, E. L., et al. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Parker, J. J., et al. A human glioblastoma organotypic slice culture model for study of tumor cell migration and patient-specific effects of anti-invasive drugs. Journal of Visualized Experiments: JoVE. (125), e53557(2017).
- Chuang, H. N., et al. Coculture system with an organotypic brain slice and 3D spheroid of carcinoma cells. Journal of Visualized Experiments: JoVE. (80), e50881(2013).
- Hohensee, I., et al. PTEN mediates the cross talk between breast and glial cells in brain metastases leading to rapid disease progression. Oncotarget. 8 (4), 6155-6168 (2017).
- van de Merbel, A. F., et al. An ex vivo Tissue culture model for the assessment of individualized drug responses in prostate and bladder cancer. Frontiers in Oncology. 8, 400(2018).
- Martin, S. Z., et al. Ex vivo tissue slice culture system to measure drug-response rates of hepatic metastatic colorectal cancer. BMC Cancer. 19 (1), 1030(2019).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5 (15), 1597-1601 (2006).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Palmieri, D., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Research. 67 (9), 4190-4198 (2007).
- Kyeong, S., et al. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 12 (11), 0188542(2017).
- Hengel, K., et al. Attributes of brain metastases from breast and lung cancer. International Journal of Clinical Oncology. 18 (3), 396-401 (2013).
- Jackson, J. G., et al. Neuronal activity and glutamate uptake decrease mitochondrial mobility in astrocytes and position mitochondria near glutamate transporters. Journal of Neuroscience. 34 (5), 1613-1624 (2014).
- Farnan, J. K., Green, K. K., Jackson, J. G. Ex vivo imaging of mitochondrial dynamics and trafficking in astrocytes. Current Protocols in Neuroscience. 92 (1), 94(2020).
- Simone, N. L., et al. Ionizing radiation-induced oxidative stress alters miRNA expression. PLoS One. 4 (7), 6377(2009).
- Couturier, C. P., et al. Single-cell RNA-seq reveals that glioblastoma recapitulates a normal neurodevelopmental hierarchy. Nature Communications. 11 (1), 3406(2020).
- Candolfi, M., et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. Journal of Neuro-Oncology. 85 (2), 133-148 (2007).
- Fitzgerald, D. P., et al. Reactive glia are recruited by highly proliferative brain metastases of breast cancer and promote tumor cell colonization. Clinical & Experimental Metastasis. 25 (7), 799-810 (2008).
- Kondru, N., et al. An Ex Vivo Brain Slice Culture Model of Chronic Wasting Disease: Implications for Disease Pathogenesis and Therapeutic Development. Scientific Reports. 10 (1), (2020).
- Abu Samaan, T. M., et al. Paclitaxel's mechanistic and clinical effects on breast cancer. Biomolecules. 9 (12), (2019).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice--a model for tauopathy studies. PLoS One. 7 (9), 45017(2012).
- Valiente, M., et al. Brain metastasis cell lines panel: A public resource of organotropic cell lines. Cancer Research. 80 (20), 4314-4323 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены