Method Article
Un modello di fetta di cervello Ex Vivo per studiare e indirizzare la crescita del tumore metastatico cerebrale del cancro al seno
In questo articolo
Riepilogo
Introduciamo un protocollo per misurare in tempo reale la risposta ai farmaci e alle radiazioni delle cellule metastatiche cerebrali del cancro al seno in un modello organotipico di fetta di cervello. I metodi forniscono un test quantitativo per studiare gli effetti terapeutici di vari trattamenti sulle metastasi cerebrali da cancro al seno in modo ex vivo all'interno dell'interfaccia del microambiente cerebrale.
Abstract
Le metastasi cerebrali sono una grave conseguenza del cancro al seno per le donne in quanto questi tumori sono difficili da trattare e sono associati a scarsi risultati clinici. I modelli murini preclinici di crescita metastatica cerebrale del cancro al seno (BCBM) sono utili ma sono costosi ed è difficile tracciare le cellule vive e l'invasione delle cellule tumorali all'interno del parenchima cerebrale. Qui viene presentato un protocollo per colture di fette di cervello ex vivo da topi xenografati contenenti sottolinee clonali di ricerca cerebrale per cancro al seno iniettato intracranicamente. Le cellule marcate con luciferasi MDA-MB-231BR sono state iniettate intracranicamente nel cervello dei topi femmina Nu / Nu e, dopo la formazione del tumore, i cervelli sono stati isolati, affettati e coltivati ex vivo. Le fette tumorali sono state fotografate per identificare le cellule tumorali che esprimono luciferasi e monitorare la loro proliferazione e invasione nel parenchima cerebrale per un massimo di 10 giorni. Inoltre, il protocollo descrive l'uso della microscopia time-lapse per visualizzare la crescita e il comportamento invasivo delle cellule tumorali dopo il trattamento con radiazioni ionizzanti o chemioterapia. La risposta delle cellule tumorali ai trattamenti può essere visualizzata mediante microscopia live-imaging, misurando l'intensità della bioluminescenza ed eseguendo l'istologia sulla fetta di cervello contenente cellule BCBM. Pertanto, questo modello di slice ex vivo può essere una piattaforma utile per la sperimentazione rapida di nuovi agenti terapeutici da soli o in combinazione con radiazioni per identificare farmaci personalizzati per indirizzare la crescita metastatica del cervello del cancro al seno di un singolo paziente all'interno del microambiente cerebrale.
Introduzione
Le metastasi cerebrali del cancro al seno (BCBM) si sviluppano quando le cellule si diffondono dal tumore mammario primario al cervello. Il cancro al seno è la seconda causa più frequente di metastasi cerebrali dopo il cancro del polmone, con metastasi che si verificano nel 10-16% dei pazienti1. Sfortunatamente, le metastasi cerebrali rimangono incurabili poiché >80% dei pazienti muore entro un anno dalla diagnosi di metastasi cerebrali e la loro qualità di vita è compromessa a causa di disfunzioni neurologiche2. C'è un urgente bisogno di identificare opzioni di trattamento più efficaci. I modelli di coltura monostrato bidimensionali o tridimensionali sono i metodi più comunemente usati per testare gli agenti terapeutici in laboratorio. Tuttavia, non imitano il complesso microambiente BCBM, uno dei principali driver del fenotipo tumorale e della crescita. Sebbene questi modelli siano utili, non catturano le complesse interazioni tumore-stromale, i requisiti metabolici unici e l'eterogeneità dei tumori3. Per ricapitolare più fedelmente le interazioni tumore-stromale e l'eterogeneità del microambiente, il nostro gruppo e altri hanno iniziato a generare metastasi cerebrali organotipiche "slice" colture con cellule tumorali derivate dal paziente (primarie o metastatiche) o linee cellulari tumorali 4,5,6. Rispetto ai sistemi classici in vitro, questo modello ex vivo a breve termine può fornire condizioni più rilevanti per lo screening di nuove terapie prima della valutazione preclinica in grandi coorti di animali.
Modelli ex vivo sono stati costruiti e utilizzati con successo principalmente per l'identificazione di trattamenti di successo di vari tumori. Richiedono alcuni giorni di valutazione e inoltre possono essere adattati allo screening farmacologico specifico del paziente. Ad esempio, i tessuti ex vivo del cancro della vescica e della prostata umano hanno mostrato una risposta antitumorale dose-dipendente di docetaxel e gemcitabina7. Simili tessuti di carcinoma colorettale ex vivo sono stati sviluppati per lo screening dei farmaci chemioterapici Oxaliplatino, Cetuximab e Pembrolizumab8. Questa applicazione è stata ampiamente utilizzata nel cancro del pancreas, considerando l'interazione essenziale tra l'ambiente stromale e le caratteristiche genotipiche e fenotipiche dell'adenocarcinoma duttale pancreatico 9,10. Inoltre, tali modelli organotipici sono stati sviluppati per screening simili nei tumori della testa, del collo, gastrici e della mammella11,12.
Qui, viene generato un modello ex vivo di fette di cervello di cellule tumorali metastatiche cerebrali xenografate del cancro al seno nel loro microambiente. I topi sono stati iniettati intracranicamente con carcinoma mammario cerebrale metastatico trofico mdA-MB-231BR cellule13 nel lobo parietale della corteccia cerebrale - un sito comune di metastasi TNBC14,15 e permesso di sviluppare tumori. Le fette di cervello sono state generate da questi animali xenografati e mantenute ex vivo come colture organotipiche come descritto16,17. Questo nuovo modello ex vivo consente l'analisi della crescita delle cellule BCBM all'interno del parenchima cerebrale e può essere utilizzato per testare agenti terapeutici ed effetti delle radiazioni sulle cellule tumorali all'interno del microambiente cerebrale.
Protocollo
Questo protocollo è stato approvato e segue le linee guida per la cura degli animali dal Drexel University College of Medicine Institutional Animal Care and Use Committee (IACUC). In questo studio sono stati utilizzati topi femmina atimici Nu/Nu (6-8 settimane di età).
1. Iniezione intracranica di cellule tumorali
- Sterilizzare tutte le attrezzature (pinzette, forbici, forbici da sutura, trapano a mano) sotto un ciclo a secco di un'autoclave per un massimo di 45 minuti in sacchetti di sterilizzazione, incluso un indicatore di sterilizzazione. Se si eseguono interventi chirurgici su più animali, sterilizzare gli strumenti tra gli animali utilizzando uno sterilizzatore per perline riscaldato (fino a 3x).
- Anestetizzare i topi secondo il protocollo di cura degli animali degli utenti (ad esempio, isoflurano (4% per induzione, 1-2% di mantenimento) e somministrare analgesia (sottocutanea, 0,1 ml di 0,1 mg / kg di buprenorfina SR-LAB) prima dell'inizio dell'intervento chirurgico. Garantire una profondità di anestesia ottimale con un pizzico della punta.
- Posizionare i mouse in una cornice stereotassica e immobilizzare la testa utilizzando barre auricolari standard (Figura 1A). Applicare unguento oftalmico agli occhi.
- Sterilizzare la superficie della testa mediante applicazione ripetuta e alternata (3x) di tamponi di iodio e etanolo al 70% prima dell'incisione.
- Usa un bisturi chirurgico per fare un'incisione della linea mediana di 1 cm attraverso la pelle con un angolo leggermente diagonale rispetto alla linea immaginaria che divide il cervello dei topi in due metà simmetriche per esporre il cranio. Pulire il sangue con un batuffolo di cotone.
- Deviare la pelle lateralmente per esporre il sito di iniezione: 2 mm a destra, 1 mm in avanti con riferimento al bregma (+2 mediolaterale (+2ML), +1 rostrale/caudale (+1RC).
- Utilizzare una punta di fresa (0,73 mm) per penetrare nel cranio +2ML, +1RC al bregma e praticare un foro usando una leggera pressione e movimento di torsione.
- Utilizzare una siringa per iniezione cerebrale per iniettare 5 μL di una soluzione di 100.000 MDA-MB-231BR (GFP-Luciferasi che esprime stabilmente) in soluzione sterile 1x PBS inserendo inizialmente la siringa a 3,5 mm di profondità nel cervello.
- Lasciare riposare la siringa per 2 minuti. Tirarlo su circa 1 mm e, dopo 2 minuti, iniettare lentamente la prima metà del volume.
- Attendere altri 2 minuti prima di iniettare il resto, quindi tirare lentamente la siringa 3 minuti dopo l'iniezione finale.
NOTA: l'iniezione lenta è empirica nel consentire al volume di essere ben assorbito dal tessuto cerebrale e non creare perdite dopo aver tirato la siringa, il che può portare alla crescita delle cellule tumorali al di fuori del sito previsto. - Applicare la cera ossea sul sito di iniezione sul cranio e quindi utilizzare suture in polipropilene per suturare il tessuto. I topi si riprenderanno entro 5 minuti dopo la rimozione dell'anestesia.
- Monitorare il loro comportamento subito dopo l'intervento chirurgico per circa 10 minuti, 3 ore dopo e il giorno seguente per determinare se sono necessari trattamenti speciali, tra cui iniezione salina, cibo morbido, ecc., Per aiutare un rapido recupero.
- Monitorare la crescita del tumore tramite imaging a bioluminescenza sul sistema di imaging.
- Per questo, in primo luogo, accendere l'ossigeno e l'isoflurano sul sistema di imaging. Consentire la distribuzione di entrambi nella camera separata all'esterno della scatola di imaging.
- Quindi, accendere il software, inizializzare lo strumento e scegliere l'opzione appropriata per visualizzare e catturare l'intero corpo del mouse.
- Posizionare i topi nella camera separata con isoflurano e garantire una profondità di anestesia ottimale con un pizzico di punta. Iniettare i topi per via intraperitoneale con 200 μL di 30 mg/mL di luciferina.
- Trasferire lo stomaco dei topi fino al naso della camera di imaging fornito di ossigeno e isoflurano. Blocca la camera e scegli un'esposizione di 2 minuti per avviare l'imaging.
- Utilizzare lo strumento ROI (regione di interesse) del software per quantificare il segnale bioluminescente del tumore.
- Per analizzare le dimensioni del tumore, scegliere lo strumento forma del cerchio, adattarlo alla forma e alle dimensioni del tumore. Misura il ROI e riporta le letture totali.
- Consentire la crescita del tumore solido per 12-14 giorni (o fino a quando la luciferasi raggiunge circa 7,0 x 106 unità) (Figura 1B) prima di generare fette di cervello.
NOTA: Aumentare il numero di cellule da iniettare porterà a una crescita tumorale più rapida; pertanto, la generazione di fette di cervello può avvenire prima di 12 giorni. D'altra parte, un tumore più grande porterà a più fette di GFP + se lasciato crescere per 14 giorni. Dopo 14 giorni, la salute dei topi inizia a deteriorarsi rapidamente; quindi il monitoraggio della salute degli animali dovrebbe essere aumentato a una volta al giorno dopo il punto temporale di 10 giorni e tutti i topi che mostrano segni di dolore e / o disagio dovrebbero essere usati per generare le fette.
2. Genera fette di cervello
NOTA: Eseguire i passaggi dopo l'isolamento cerebrale in una cappa a flusso laminare sterile. È tipicamente possibile generare 35-40 singole fette contenenti cellule tumorali (segnale luciferasi) da un topo iniettato con cellule MDA-MB-231BR (Figura 1C).
- Sterilizzare tutti gli strumenti chirurgici in autoclave. Posizionare l'affettatrice per tessuti nella cappa a flusso laminare sterile e pulire tutti gli strumenti e gli strumenti con etanolo al 70%.
- Dopo 12-14 giorni dall'iniezione intracranica di cellule MDA-MB-231BR, anestetizzare i topi secondo il protocollo di cura degli animali degli utenti come descritto in 1.2. Garantire una profondità di anestesia ottimale con un pizzico della punta.
- Rimuovere e posizionare rapidamente il cervello (entro 45 s) in saccarosio-ACSF ghiacciato (4 °C) composto dai seguenti: 280 mM saccarosio, 5 mM KCl, 2 mM MgCl2, 1 mM CaCl2, 20 mM glucosio, 10 mM HEPES, 5 mM Na+-ascorbato, 3 mM tiourea, 2 mM Na+, 29 mM piruvato; pH=7,3.
- Usando un bisturi affilato e sterile o una lama di rasoio, taglia via le parti in eccesso del cervello che non contengono alcun tumore da tutti i lati, compresa la parte inferiore del cervello.
- Porta la forma del cervello in un cubo non perfetto per sederti piatto sulla carta da filtro bagnata ACSF su un coperchio del piatto da 60 mm per facilitare l'affettamento.
NOTA: Il tessuto extra del cervello in cui è improbabile che il tumore sia cresciuto viene rimosso prima dell'affettamento per consentire la generazione di fette per lo più GFP + e creare una forma del cervello stabile sulla superficie dello strumento e non sarà perturbata dalle vibrazioni causate dall'affettamento. - Posizionare diversi fogli di cerchi di carta da filtro pre-bagnati (con ACSF) sulla piattaforma di taglio e posizionare il tessuto bloccato sopra questo.
- Impostare la dimensione del taglio sullo strumento su 2 o 2,5 unità sul righello fornito per tagliare il tessuto in sezioni da 200-250 μm.
NOTA: le fette fino a 350 μm o sottili fino a 100 μm sono vitali. Per le fette <200 μm, utilizzare un vibratoma o un compresstome. - Utilizzare un pennello (zibellino) per trasferire le fette di cervello in un piatto contenente saccarosio ACSF e separare le fette al microscopio ottico usando aghi da 27 G.
- Identificare le fette GFP positive al microscopio fluorescente e trasferirle in un nuovo piatto da 60 mm contenente 2-3 ml di slice media per adulti (mezzo neurobasale A, supplemento B12 al 2%, supplemento N2 all'1%, glutammina all'1%, glucosio allo 0,5%, penicillina 10 U/mL e streptomicina da 100 μg/mL) utilizzando una pipetta sterile da 1 mL rotta (ampia apertura).
NOTA: Le fette di cervello che contengono cellule tumorali che crescono sulla superficie del cervello (forse a causa di perdite di cellule di iniezione, ecc.) sono escluse. - Trasferire 3-5 fette su ogni coltura tissutale da 30 mm, 0,4 μm di dimensioni dei pori, inserire in piastre a 6 pozzetti a una distanza che non consente di crescere l'una nell'altra.
- Rimuovere il mezzo in eccesso dalla superficie dell'inserto utilizzando una pipetta P1000, aggiungere 1 mL di mezzo di fetta di topo adulto sotto ciascun inserto ed equilibrare il supporto nell'incubatrice prima dell'affettatura.
- Incubare i tessuti a 37 °C, 5% CO2 e 95% di umidità per 24 ore prima dell'imaging.
3. Imaging IVIS delle fette
NOTA: Eseguire le fasi di aggiunta di luciferasi e inibitori in una cappa a flusso laminare sterile.
- Pipettare 5 μL di 30 mg/mL di soluzione di luciferina nel mezzo sotto gli inserti sollevando l'inserto con una pinza e rimettendolo nel pozzetto dopo l'aggiunta di luciferina al supporto nel pozzo.
- Posizionare la piastra a 6 pozzetti con il coperchio all'interno della camera di imaging dello strumento sotto la telecamera fissa e bloccare la porta della camera.
- Aprire il software e inizializzare lo strumento.
- Scegli le impostazioni della fotocamera che consentono la visualizzazione e l'acquisizione di un solo pozzo per immagine. Spostare il palco verso l'alto (FOV di 5 cm) e posizionare il pozzetto che deve essere ripreso direttamente sotto la fotocamera.
- Impostare il tempo di imaging al più appropriato a seconda dell'intensità della luciferasi che il tumore emetterà, che può variare da 10 s a 5 min. Inizia con l'impostazione su 10 s e poi aumenta se il segnale è basso, ma mantienilo coerente per tutti i punti temporali e le condizioni fino alla fine dell'esperimento (Figura 1D).
- Utilizzare lo strumento ROI (strumento forma circolare), adattarlo alla forma e alle dimensioni del tumore, misurare il ROI e riportare le letture totali per quantificare il segnale bioluminescente di ciascun tumore sulla fetta.
- Riportare la piastra nella cappa a flusso laminare sterile, utilizzare una pinza per sollevare leggermente l'inserto dal pozzo.
- Aspirare il mezzo, sostituirlo con 1 ml di mezzo fresco e riposizionare l'inserto nel pozzetto.
- Per gli esperimenti in cui le fette vengono trattate con vari composti come inibitori, metaboliti, ecc., Preparare la concentrazione appropriata del reagente in 1,2 ml di terreno di fetta di cervello in un tubo da 1,5 ml e quindi trasferire 1 mL al pozzo contenente la fetta.
- Ripetere questo processo ogni 48 ore per tutta la durata dello studio.
4. Imaging dal vivo della crescita tumorale in fette di cervello ex vivo
NOTA: inserire di alimentazione con un supporto sufficiente (1,5 ml) per durare la durata dell'esperimento in quanto non è possibile aggiungere ulteriore supporto durante l'imaging dal vivo.
- Posizionare la piastra a 6 pozzetti sul supporto automatico della piastra del microscopio all'interno dell'incubatore (37 °C, 5% CO2 e 95% di umidità).
- Apri il software, attiva brightfield sul primo quadrante per regolare l'esposizione necessaria per visualizzare le fette. Per trovare la posizione (coordinate "xy") della fetta, navigare con "xy" sul secondo quadrante per controllare le coordinate "xyz" del microscopio.
- Selezionare la piastra a 6 pozzetti come labware utilizzato per questo esperimento. Seleziona l'editor di mappe ROI e registra quella posizione selezionando un nuovo ROI, aggiungi e salva quel ROI.
- Ripetere gli stessi passaggi per tutte le altre regioni di interesse in altri pozzi. Dopo aver aggiunto tutti i ROI, salva tutti i ROI.
- In Protocollo, selezionare Cancella esistente e selezionare Time-Lapse in Acquisizione, quindi selezionare i canali di interesse (in questo caso GFP).
- Disattivate la messa a fuoco automatica nella configurazione della messa a fuoco e regolate manualmente la messa a fuoco appropriata per tutte le sezioni. Infine, regolare l'intensità del campo luminoso e l'eccitazione del canale fluorescente e il tempo di esposizione al livello appropriato.
- Impostare il protocollo per acquisire immagini ogni 15 minuti per 48 ore.
- Salvare ed eseguire il protocollo. Al termine dell'esperimento, il file salvato conterrà sia le immagini brightfield che quelle GFP acquisite per ogni ROI.
- Per combinare le immagini in un video, rinominare tutte le immagini di interesse con lo stesso nome seguito da un numero binario per organizzarle nell'ordine in cui sono state acquisite (ad esempio, ROI1 (1), RO1 (2) ...)
- Apri ImageJ e importa le immagini facendo clic su File > Importa > sequenza di immagini. Selezionare i nomi dei file visualizzati in un elenco e scrivere il contenuto del nome dei file nella casella Nome file contiene che verrà visualizzata per identificare i file selezionati per il video.
- Salva le immagini combinate in File > Salva con nome > AVI.
5. Test MTS e immunoistochimica del tessuto cerebrale ex vivo
- TEST MTS
- Asportare le fette tagliando la membrana di coltura tissutale sotto ogni fetta lungo i bordi del tessuto e trasferire il tessuto, ancora attaccato alla membrana, in una piastra a 96 pozzetti.
- Aggiungere il reagente MTS miscelato in rapporto 1:5 con terreno di coltura e tritone allo 0,01% (1x) per consentire la penetrazione della soluzione nel tessuto, in un volume totale di 120 μL in ciascun pozzetto.
- Utilizzare il 4% di paraformaldeide (PFA) come agente per rendere le fette di cervello inaccessibili, e quindi un controllo positivo per questo esperimento. Immergere la fetta di cervello di interesse in PFA al 4% per 1 ora a RT (temperatura ambiente) o durante la notte a 4 °C prima di procedere con il test MTS.
- Lasciare che il reagente MTS reagisca sulle fette per 4 ore, rimuovere le fette dai pozzetti e misurare l'assorbanza a 490 nm per tutte le condizioni, incluso un pozzo vuoto senza fetta come riferimento.
- Riportare le letture in funzione dell'area della fetta di tessuto, misurata con un righello a pinza digitale.
- Preparazione immunoistochimica
- Immergere le fette di cervello attaccate alla superficie dell'inserto della membrana in formalina al 10% durante la notte a 4 °C.
- Eseguire l'incorporamento, l'elaborazione, il blocco e generare vetrini non macchiati del tessuto. Utilizzare il protocollo di colorazione immunoistochimica standard per colorare H&E, Ki-67, gamma-H2AX, CC3, GFAP, GFP, DAPI
6. Irradiazione del tumore in fette di cervello ex vivo
- Irradiare il tumore con 6 Gy (raggi X 310 kVp).
NOTA: Le unità inserite per ottenere la dose totale di 6 Gy sono 3522 unità dopo aver considerato le unità R (misurate utilizzando l'elettrometro Victoreen) e le correzioni per il ditale, la densità dell'aria e il cGy / R come precedentemente descritto18. Il tempo di esposizione è di 130,9 s. - Utilizzare 0,25 mm Cu + 1 mm Al filtrazione aggiunta, 50 cm SSD, 125 cGy al minuto.
- Eseguire la dosimetria mediante una camera di ionizzazione in-the-beam calibrata rispetto a uno standard primario.
- Apportare correzioni giornaliere per umidità, temperatura e pressione barometrica.
Risultati
Le cellule mdA-MB-231BR-GFP-luciferasi sono state iniettate intracranicamente nell'emisfero destro di topi Nu/Nu di 4-6 settimane come spiegato sopra (Figura 1A) e sono state lasciate crescere per 12-14 giorni, durante i quali la crescita tumorale è stata monitorata mediante imaging a bioluminescenza (Figura 1B). Abbiamo iniettato 100.000 cellule tumorali in modo intracranico come riportato da altri gruppi19, ma è possibile iniettare fino a 20.000 cellule20. Dopo la generazione di fette di cervello (Figura 1C), come descritto sopra, le fette sono state visualizzate sull'IVIS per determinare la presenza del tumore tramite imaging bioluminescente dopo incubazione di 24 ore. Questo è considerato come giorno 0. La crescita tumorale è stata monitorata quantificando la segnalazione bioluminescente ogni 48 ore, che ha indicato una crescita progressiva nell'arco di 6 giorni (Figura 1D). La colorazione H&E e la fluorescenza GFP-positiva confermano la presenza di un tumore nella fetta di cervello (Figura 1D). Siamo stati anche in grado di rilevare la colorazione di astrociti reattivi, visualizzata mediante colorazione per cellule positive alla proteina acida fibrillare gliale (GFAP), visibili tra il cluster di cellule tumorali (GFP-positive) (Figura 1D) simile a quanto visto in vivo21. A differenza dei modelli che inoculano le cellule tumorali ex vivo in una fetta di cervello di topo22, questo modello contiene astrociti reattivi che è un aspetto importante del microambiente tumorale BCBM. Rileviamo anche un aumento della colorazione Ki-67 confermando che le cellule tumorali sono altamente proliferative (Figura 1D). Pertanto, le cellule tumorali all'interno del parenchima cerebrale possono sopravvivere e proliferare all'interno di una fetta di cervello ex vivo per un certo numero di giorni e contenere anche stroma associato al tumore.
L'irradiazione (IR) è una delle prime linee di trattamento per i pazienti che presentano metastasi cerebrali in clinica. Per capire come il modello di slice ex vivo avrebbe risposto a tale trattamento, le fette di cervello contenenti tumori MDA-MB-231BR-GFP Luciferasi sono state esposte all'irradiazione 6Gy. I tumori nelle fette di cervello che non sono stati esposti all'irradiazione hanno continuato a crescere ex vivo, mentre i tumori esposti all'irradiazione hanno mostrato una crescita in stallo (Figura 2A). Anche le fette di cervello contenenti tumori MDA-MB-231BR-GFP-Luciferasi sono state monitorate tramite imaging dal vivo per 48 ore dopo il giorno 4 per visualizzare la crescita del tumore nel microambiente cerebrale dopo il trattamento IR (Figura 2B). Coerentemente con l'imaging bioluminescente, le cellule tumorali di controllo sono viste in rapida crescita con l'aumentare dell'intensità della GFP e un certo numero di cellule sono viste invadere il parenchima cerebrale (Video 1). Al contrario, le cellule tumorali nelle fette di cervello trattate con 6Gy IR sono citostatiche e l'intensità della GFP viene mantenuta (Video 2). La colorazione H&E conferma tumori più piccoli nelle cellule trattate con IR (Figura 2C). Abbiamo anche rilevato grandi cellule tumorali multinucleate e un aumento della colorazione del marcatore di danno al DNA g-H2AX nelle cellule tumorali trattate con IR (Figura 2C). Non è stato rilevato alcun aumento dell'apoptosi nelle fette trattate con IR, suggerendo che l'IR può ridurre la proliferazione (Figura 2C). Tuttavia, è stato rilevato un aumento della colorazione negli astrociti reattivi, visualizzato mediante colorazione per le cellule GFAP-positive, che sono visibili attorno al cluster di cellule tumorali (GFP-positive) trattate da IR (Figura 2C). Ciò suggerisce che questo modello ex vivo può anche essere utile per capire come alcuni componenti tumorali-stroma rispondono ai trattamenti. Inoltre, non abbiamo rilevato alcuna apoptosi causata dal trattamento IR di fette di topo cerebrale prive di tumore (Figura 2D).
Abbiamo anche testato se i tumori preformati MDA-MB-231BR nelle fette di cervello rispondevano alla chemioterapia. Le fette di cervello contenenti tumori MDA-MB-231BR sono state trattate con diverse concentrazioni di paclitaxel (Figura 3A), un farmaco chemioterapico utilizzato nei pazienti con cancro al seno23. Il trattamento ha ridotto le dimensioni del tumore come quantificato dalla segnalazione bioluminescente, ma questa inibizione è stata significativa solo dopo il giorno 10 del trattamento (Figura 3A). Ciò può essere dovuto a una risposta eterogenea al paclitaxel ex vivo. Ad esempio, nei 40 nM trattati bene, una fetta contenente un tumore (in alto) si riduce mentre il tumore (in basso) nello stesso pozzo sembra crescere. Inoltre, alcuni dei tumori più piccoli sembravano essere più sensibili al paclitaxel e mostravano una ridotta bioluminescenza, mentre i tumori più grandi sembravano refrattari (Figura 3A, trattamento 80 nM). Coerentemente con la riduzione delle dimensioni del tumore, è stato rilevato un aumento dell'apoptosi nelle cellule tumorali trattate con paclitaxel rispetto ai controlli (Figura 3B). È importante sottolineare che, utilizzando un test MTS di vitalità adattato da Mews et al. per incorporare l'uso del tritone24, abbiamo testato che il trattamento con inibitori non alterava la vitalità del tessuto cerebrale (in assenza di tumore) (Figura 3C). Coerentemente con questo risultato, non abbiamo rilevato e aumentato l'apoptosi misurata dalla colorazione della caspasi 3 scissa nella fetta di cervello di topo senza tumore trattata con paclitaxel (Figura 3D). Questi dati suggeriscono che questo modello può essere utile per comprendere la risposta chemioterapica e la resistenza del BCBM all'interno di un microambiente cerebrale. A causa della natura del modello, un ambiente ex vivo che conserva le proprietà e l'interazione cervello-tumore, la sua essenzialità sta nel fornire prove primarie della risposta del BCBM ai reagenti chemioterapici e quindi eliminare i farmaci che non riducono il tumore in questo modello dai futuri studi in vivo , che sono ancora essenziali per convalidare l'effetto dei farmaci che forniscono risultati positivi in questo modello, la risposta sistemica nell'organismo e la capacità di attraversare la barriera emato-encefalica.
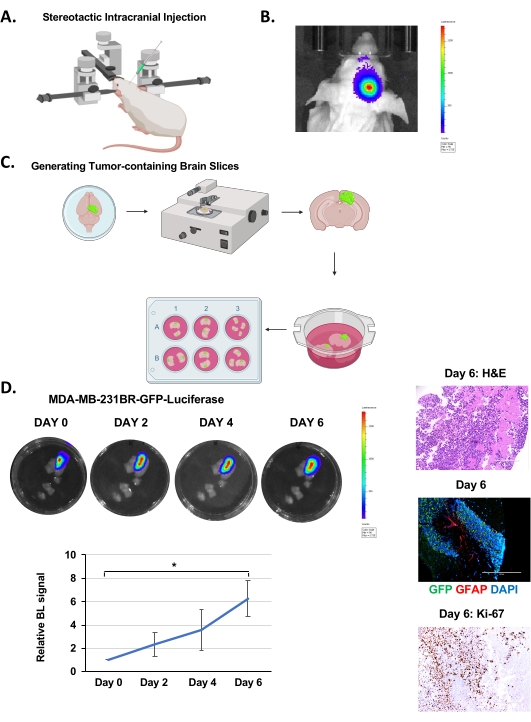
Figura 1. Iniezione intracranica, generazione di fette di cervello e crescita di BCBM ex vivo. (A) Rappresentazione schematica del topo durante l'iniezione intracranica sotto uno strumento stereotassico. (B) Immagini rappresentative di rilevamento bioluminescente di tumori da topi Nu/Nu di 4-6 settimane iniettati con 5 x 105 cellule MDA-MB-231BR-GFP-Luciferasi 12 giorni dopo l'iniezione. (C) Rappresentazione schematica della generazione di fette di cervello di topo ex vivo da (B). (D) Immagini rappresentative raffiguranti la crescita tumorale in fette di cervello organotipiche derivate da topi iniettati intracranicamente con cellule MDA-MB-231BR-GFP-Luciferasi rilevate tramite bioluminescenza nell'arco di 6 giorni. H&E & Ki-67, GFP (cellule tumorali) GFAP (astrociti reattivi) DAPI (nucleo) colorazione di una fetta cerebrale rappresentativa con tumore (ingrandimento dell'immagine 20x, barra della scala: 200 μm). La quantificazione della crescita tumorale rappresenta il segnale di bioluminescenza rispetto al giorno 0 (n = 3). Il t-test dello studente riportato come ± SEM, * p < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2. Trattamento di fette di cervello organotipico BCBM con radiazioni. (A) Immagini rappresentative raffiguranti la crescita tumorale in fette di cervello organotipiche derivate da topi iniettati intracranicamente con cellule MDA-MB-231BR-GFP-Luciferasi rilevate tramite bioluminescenza. I tumori sono esposti a nessuna irradiazione o irradiazione 6 Gy (una dose) e lasciati crescere per i giorni indicati. Quantificazione della crescita tumorale al giorno indicato (controllo. n = 3; 6Gy, n = 3). Il t-test dello studente riportato come ± SEM. * p < 0,05. (B) Le fette di cervello sono state fotografate per 48 ore ogni 15 minuti. Immagini rappresentative di video di campioni non irradiati e irradiati indicano la crescita del tumore. (C) Le fette, come trattate in (A), sono state fissate e analizzate per H&E, g-H2AX, DAPI, caspasi-3 scisso-3 (CC3) e colorazione GFP (ingrandimento dell'immagine 20x, barra di scala: 200 μm). (D) Le fette di cervello di topo prive di tumore sono state trattate come in (A) e sono state fissate e analizzate per CC3 e DAPI (ingrandimento dell'immagine 20x, barra della scala: 200 μm). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3. Trattamento di fette di cervello organotipiche BCBM con paclitaxel. (A) Fette di cervello derivate da topi iniettati intracranicamente con cellule MDA-MB-231BR-GFP-Luciferasi trattate con DMSO o in seguito a trattamento di paclitaxel a 40 nM, 80 nM, 160 nM e 320 nM per 10 giorni, reintegrando il mezzo ogni 48 ore e lasciando crescere per i giorni indicati (ingrandimento dell'immagine 20x, barra della scala: 200 μm). Quantificazione della crescita tumorale al giorno indicato (controllo n = 6, Paclitaxel n = 3) (in basso). Il t-test dello studente riportato come ± SEM. * p < 0,05. (B) La fetta di cervello ex vivo trattata in (A) con DMSO o paclitaxel 320 nM è stata raccolta, fissata e analizzata per GFP, CC3 e DAPI (ingrandimento dell'immagine 20x, barra della scala: 200 μm). (C) La fetta di cervello ex vivo trattata in (A) (senza tumore) con DMSO o paclitaxel 320 nM è stata raccolta al giorno 10 e analizzata per la vitalità cellulare (test MTS). Come controllo positivo, le fette sono state trattate con paraformaldeide (PFA) che rende le fette di cervello inaccessibili (n = 3) Il t-test dello studente riportato come medio ± SEM. * p < 0,05. (D) La fetta di cervello ex vivo trattata in (A) (senza tumore) con DMSO o paclitaxel 320 nM è stata raccolta, fissata e analizzata per CC3 e DAPI (ingrandimento dell'immagine 20x, barra della scala: 200 μm). Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1. Imaging dal vivo di fette di cervello organotipico BCBM. Le fette di cervello derivate da topi iniettati intracranicamente con cellule MDA-MB-231BR-GFP-Luciferasi sono state lasciate crescere per 4 giorni e poi poste sotto un microscopio di immagini dal vivo per 48 ore in cui le immagini sono state prese ogni 15 minuti e combinate per creare un video utilizzando ImageJ. Clicca qui per scaricare questo video.
Video 2. Imaging dal vivo di fette di cervello organotipico BCBM irradiato. Le fette di cervello derivate da topi iniettati intracranicamente con cellule MDA-MB-231BR-GFP-Luciferasi sono state irradiate il giorno dopo la generazione delle fette e 4 giorni dopo sono state riprese ogni 15 minuti per 48 ore. Clicca qui per scaricare questo video.
Discussione
Questo studio stabilisce un nuovo metodo di coltura cerebrale ex vivo per i tumori cerebrali allo xenotrapianto espiantato. Mostriamo che le cellule BCBM MDA-MB-231BR iniettate intracranicamente nel cervello dei topi possono sopravvivere e crescere in fette di cervello ex vivo . Lo studio ha anche testato le cellule di glioblastoma U87MG iniettate intracranicamente (GBM) e ha anche scoperto che queste cellule tumorali sopravvivono e crescono in fette di cervello (dati non mostrati). Riteniamo che questo modello possa essere esteso oltre BCBM e GBM ad altri tumori che metastatizzano facilmente al cervello, tra cui il cancro del polmone e il melanoma. Sono state scelte iniezioni intracraniche di cellule trofiche cerebrali del cancro al seno poiché è un metodo semplice e veloce per generare tumori cerebrali ed è considerato un modello adatto per le macrometastasi cerebrali25. Tuttavia, modelli di fette tumorali simili possono essere sviluppati dall'inoculazione intracardiaca o dalle iniezioni ortotopiche nei cuscinetti di grasso primario. L'ottimizzazione delle condizioni di coltura mediante la crescita di fette di cervello adulte in terreno privo di siero e la fornitura di terreno fresco ogni 48 ore ha fornito una migliore conservazione della vitalità dei tessuti e della sopravvivenza e della crescita dei tumori. Gli inserti da 0,4 μm utilizzati in condizioni iperossiche dell'incubatore fungono da supporto strutturale per le fette di cervello ex vivo e forniscono anche una connessione all'apporto artificiale di nutrienti e ossigeno al tessuto e alle cellule tumorali in assenza di afflusso di sangue che sembra essere adeguato per mantenere la vitalità dei tessuti per almeno dieci giorni in coltura. L'imaging dal vivo rappresenta la crescita del tumore in funzione dell'aumento del segnale GFP. Tuttavia, il software ha una soglia di luminosità GFP massima che satura il segnale e non consente una corretta identificazione della motilità a singola cellula nel microambiente cerebrale. La futura modifica del rilevamento del segnale microscopico-software migliorerà la capacità di segnalare con precisione l'aumento temporale del segnale GFP in funzione della crescita tumorale.
Questo modello consente anche il monitoraggio della crescita e della vitalità del tumore attraverso la colorazione immunoistochimica. È importante sottolineare che questo modello consentirà di testare rapidamente l'efficacia della sensibilità alle radiazioni con o senza inibitori di piccole molecole di tumori cresciuti nel microambiente cerebrale. Mostriamo che questo modello è suscettibile sia di trattamenti con radiazioni che di chemioterapici. Inoltre, questo sistema può essere utilizzato per studi omici come proteomica, metabolomica e genomica per comprendere ulteriormente la crescita del cancro e la risposta ai trattamenti all'interno del microambiente cerebrale. Inoltre, testare la potenziale ricaduta dei tumori dopo la rimozione degli inibitori dopo un'esposizione più breve consentirebbe un'ulteriore comprensione dei percorsi chemioresistenti unici per le cellule tumorali all'interno del microambiente cerebrale.
In sintesi, abbiamo sviluppato una nuova fetta di cervello ex vivo di coltura del tessuto tumorale xenotrapianto che monitorerà la crescita del tumore e l'interazione con il microambiente del tumore cerebrale e per uno screening rapido degli agenti terapeutici per bloccare la crescita tumorale nel cervello.
Divulgazioni
Gli autori non hanno conflitti finanziari da dichiarare.
Riconoscimenti
Vogliamo ringraziare Julia Farnan, Kayla Green e Tiziana DeAngelis per la loro assistenza tecnica. Questo lavoro è stato supportato in parte dal Pennsylvania Commonwealth Universal Research Enhancement Grant Program (MJR, JGJ), UO1CA244303 (MJR), R01CA227479 (NLS), R00CA207855 (EJH) e W.W. Smith Charitable Trusts (EjH).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringe, slip tip | BD | 309659 | |
| 30 G1/2 Needles | BD | 305106 | |
| 6-well plates | Genessee | 25-105 | |
| Automated microscope and LUMAVIEW software | Etaluma | LS720 | |
| B27 (GEM21) | Gemini Bio-Products | 400-160 | |
| Beaker 50 mL | Fisher | 10-210-685 | |
| Blunt sable paintbrush, Size #5/0 | Electron Microscopy Sciences | 66100-50 | |
| Bone Wax | ModoMed | DYNJBW25 | |
| Brain injection Syringe | Hamilton Company | 80430 | |
| CaCl2 | Fisher Scientific | BP510-250 | |
| Cleaved caspase 3 Antibody | Cell Signaling | 14220S | |
| DAPI | Invitrogen | P36935 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| Double edge razor blade | VWR | 55411-060(95-0043) | |
| Filter Paper (#1), quantitative circles, 4.25 cm | Fisher | 09-805a (1001-042) | |
| Fine sable paintbrush #2/0 | Electron Microscopy Sciences | 66100-20 | |
| Forceps | Fine Science Tools | 11251-20 | |
| Gamma-H2AX antibody | Millipore | 05-636 | |
| GFAP antibody | Thermo Fisher | 13-0300 | |
| GFP antibody | Santa Cruz | SC-9996 | |
| Glucose | Sigma Aldrich | G8270 | |
| Glutamine (200 mM) | Corning cellgrow | 25-005-Cl | |
| H&E and KI-67 | Jefferson Core Facility Pathology staining | ||
| Hand Drill Set with Micro Mini Twist Drill Bits | Amazon | YCQ2851920086082DJ | |
| HEPES, free acid | Fisher Scientific | BP299-1 | |
| Just for mice Stereotaxic Frame | Harvard Apparatus (Holliston, MA, USA). | 72-6049, 72-6044 | |
| KCl | Fisher Scientific | S271-10 | |
| Large surgical scissors | Fine Science Tools | 14001-18 | |
| MDA-MB-231BR cells | Kindly provided by Dr. Patricia Steeg | Ref 14 | |
| MgCl2·6H2O | Fisher Scientific | M33-500 | |
| Mice imaging device | Perkin Elmer | IVIS 200 system | |
| Mice imaging software | Caliper Life Sciences (Waltham, MA, USA). | Living Image Software | |
| Microplate Reader | Tecan Spark | ||
| Mounting solution | Invitrogen | P36935 | |
| MTS reagent | Promega CellTiter 96 Aqueous One Solution | (Cat:G3582) | |
| N2 supplement | Life Technologies | 17502-048 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nu/Nu athymic mice | Charles Rivers Labs (Wilmington, MA, USA) | ||
| Paraformaldehyde | Affymetrix | 19943 | |
| Pen/Strep | Life Technologies | 145140-122 | |
| Polypropylene Suture | Medex supply | ETH-8556H | |
| Povidone Iodine Swab sticks | DME Supply USA | Cat: 689286X | |
| Scalpel blade #11 (pk of 100) | Fine Science Tools | 10011-00 | |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | |
| Sodium Pyruvate | Sigma Aldrich | S8636 | |
| Spatula/probe | Fine Science Tools | 10090-13 | |
| SS Double edge uncoated razor blades (American safety razor co (95-0043)) | VWR | 55411-060 | |
| Sucrose | Amresco | 57-50-1 | |
| Surgical Scalpel | Exelint International | D29702 | |
| Tissue Chopper | Brinkman | (McIlwain type) | |
| Tissue culture inserts | Millipore | PICMORG50 or PICM03050 | |
| X-ray machine | Precision 250 kVp |
Riferimenti
- Watase, C., et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives. Cancers. 13 (5), (2021).
- Niikura, N., et al. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Research and Treatment. 147 (1), 103-112 (2014).
- Fong, E. L., et al. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Parker, J. J., et al. A human glioblastoma organotypic slice culture model for study of tumor cell migration and patient-specific effects of anti-invasive drugs. Journal of Visualized Experiments: JoVE. (125), e53557 (2017).
- Chuang, H. N., et al. Coculture system with an organotypic brain slice and 3D spheroid of carcinoma cells. Journal of Visualized Experiments: JoVE. (80), e50881 (2013).
- Hohensee, I., et al. PTEN mediates the cross talk between breast and glial cells in brain metastases leading to rapid disease progression. Oncotarget. 8 (4), 6155-6168 (2017).
- van de Merbel, A. F., et al. An ex vivo Tissue culture model for the assessment of individualized drug responses in prostate and bladder cancer. Frontiers in Oncology. 8, 400 (2018).
- Martin, S. Z., et al. Ex vivo tissue slice culture system to measure drug-response rates of hepatic metastatic colorectal cancer. BMC Cancer. 19 (1), 1030 (2019).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5 (15), 1597-1601 (2006).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Palmieri, D., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Research. 67 (9), 4190-4198 (2007).
- Kyeong, S., et al. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 12 (11), 0188542 (2017).
- Hengel, K., et al. Attributes of brain metastases from breast and lung cancer. International Journal of Clinical Oncology. 18 (3), 396-401 (2013).
- Jackson, J. G., et al. Neuronal activity and glutamate uptake decrease mitochondrial mobility in astrocytes and position mitochondria near glutamate transporters. Journal of Neuroscience. 34 (5), 1613-1624 (2014).
- Farnan, J. K., Green, K. K., Jackson, J. G. Ex vivo imaging of mitochondrial dynamics and trafficking in astrocytes. Current Protocols in Neuroscience. 92 (1), 94 (2020).
- Simone, N. L., et al. Ionizing radiation-induced oxidative stress alters miRNA expression. PLoS One. 4 (7), 6377 (2009).
- Couturier, C. P., et al. Single-cell RNA-seq reveals that glioblastoma recapitulates a normal neurodevelopmental hierarchy. Nature Communications. 11 (1), 3406 (2020).
- Candolfi, M., et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. Journal of Neuro-Oncology. 85 (2), 133-148 (2007).
- Fitzgerald, D. P., et al. Reactive glia are recruited by highly proliferative brain metastases of breast cancer and promote tumor cell colonization. Clinical & Experimental Metastasis. 25 (7), 799-810 (2008).
- Kondru, N., et al. An Ex Vivo Brain Slice Culture Model of Chronic Wasting Disease: Implications for Disease Pathogenesis and Therapeutic Development. Scientific Reports. 10 (1), (2020).
- Abu Samaan, T. M., et al. Paclitaxel's mechanistic and clinical effects on breast cancer. Biomolecules. 9 (12), (2019).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice--a model for tauopathy studies. PLoS One. 7 (9), 45017 (2012).
- Valiente, M., et al. Brain metastasis cell lines panel: A public resource of organotropic cell lines. Cancer Research. 80 (20), 4314-4323 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon