Method Article
Un modèle de tranche cérébrale ex vivo pour étudier et cibler la croissance tumorale métastatique du cancer du sein
Dans cet article
Résumé
Nous introduisons un protocole pour mesurer en temps réel la réponse médicamenteuse et radiologique des cellules métastatiques du cerveau du cancer du sein dans un modèle organotypique de tranches cérébrales. Les méthodes fournissent un test quantitatif pour étudier les effets thérapeutiques de divers traitements sur les métastases cérébrales du cancer du sein de manière ex vivo dans l’interface du microenvironnement cérébral.
Résumé
Les métastases cérébrales sont une conséquence grave du cancer du sein chez les femmes, car ces tumeurs sont difficiles à traiter et sont associées à de mauvais résultats cliniques. Les modèles murins précliniques de croissance métastatique du cerveau du cancer du sein (BCBM) sont utiles mais coûteux, et il est difficile de suivre les cellules vivantes et l’invasion des cellules tumorales dans le parenchyme cérébral. Présenté ici est un protocole pour les cultures de tranches de cerveau ex vivo de souris xénogreffées contenant des sous-lignées clonales de cancer du sein injectées par voie intracrânienne. Les cellules marquées par la luciférase MDA-MB-231BR ont été injectées par voie intracrânienne dans le cerveau de souris femelles Nu / Nu, et après la formation de tumeurs, les cerveaux ont été isolés, tranchés et cultivés ex vivo. Les tranches tumorales ont été imagées pour identifier les cellules tumorales exprimant la luciférase et surveiller leur prolifération et leur invasion dans le parenchyme cérébral pendant 10 jours. En outre, le protocole décrit l’utilisation de la microscopie time-lapse pour imager la croissance et le comportement invasif des cellules tumorales après un traitement par rayonnement ionisant ou chimiothérapie. La réponse des cellules tumorales aux traitements peut être visualisée par microscopie d’imagerie en direct, en mesurant l’intensité de la bioluminescence et en effectuant une histologie sur la tranche de cerveau contenant des cellules BCBM. Ainsi, ce modèle de tranche ex vivo peut être une plate-forme utile pour tester rapidement de nouveaux agents thérapeutiques seuls ou en combinaison avec des radiations afin d’identifier des médicaments personnalisés pour cibler la croissance métastatique du cerveau du cancer du sein d’une patiente individuelle dans le microenvironnement cérébral.
Introduction
Les métastases cérébrales du cancer du sein (BCBM) se développent lorsque les cellules se propagent de la tumeur mammaire primaire au cerveau. Le cancer du sein est la deuxième cause la plus fréquente de métastases cérébrales après le cancer du poumon, avec des métastases survenant chez 10 à 16% des patientes1. Malheureusement, les métastases cérébrales restent incurables car >80% des patients meurent dans l’année suivant leur diagnostic de métastases cérébrales et leur qualité de vie est altérée en raison de dysfonctionnements neurologiques2. Il est urgent d’identifier des options de traitement plus efficaces. Les modèles de culture monocouches bidimensionnelles ou tridimensionnelles sont les méthodes les plus couramment utilisées pour tester les agents thérapeutiques en laboratoire. Cependant, ils n’imitent pas le microenvironnement complexe BCBM, un moteur majeur du phénotype et de la croissance de la tumeur. Bien que ces modèles soient utiles, ils ne capturent pas les interactions complexes tumeur-stromale, les besoins métaboliques uniques et l’hétérogénéité des tumeurs3. Pour récapituler plus fidèlement les interactions tumeur-stromale et l’hétérogénéité du microenvironnement, notre groupe et d’autres ont commencé à générer des cultures de métastases cérébrales organotypiques en « tranches » avec des cellules tumorales dérivées du patient (primaires ou métastatiques) ou des lignées cellulaires cancéreuses 4,5,6. Comparé aux systèmes in vitro classiques, ce modèle ex vivo à court terme peut fournir des conditions plus pertinentes pour le dépistage de nouveaux traitements avant l’évaluation préclinique dans les grandes cohortes d’animaux.
Des modèles ex vivo ont été construits et utilisés avec succès principalement pour l’identification de traitements efficaces de divers cancers. Ils nécessitent quelques jours d’évaluation et peuvent en outre être adaptés au dépistage de médicaments spécifiques au patient. Par exemple, les tissus ex vivo du cancer de la vessie et de la prostate humains ont montré une réponse antitumorale dose-dépendante du docétaxel et de la gemcitabine7. Des tissus ex vivo similaires au carcinome colorectal ont été développés pour dépister les médicaments chimiothérapeutiques Oxaliplatin, Cetuximab et Pembrolizumab8. Cette application a été largement utilisée dans le cancer du pancréas, compte tenu de l’interaction essentielle entre l’environnement stromal et les caractéristiques génotypiques et phénotypiques de l’adénocarcinome canalaire pancréatique 9,10. En outre, de tels modèles organotypiques ont été développés pour des dépistages similaires dans les tumeurs de la tête, du cou, de l’estomac et du sein11,12.
Ici, un modèle de tranche de cerveau ex vivo de cellules tumorales métastatiques du cancer du sein xénogreffées dans leur microenvironnement est généré. Des souris ont été injectées par voie intracrânienne avec des cellules MDA-MB-231BR trophiques métastatiques du cerveau du cancer du sein13 dans le lobe pariétal du cortex cérébral - un site commun de métastases du CSTN14,15 et ont permis de développer des tumeurs. Des tranches de cerveau ont été générées à partir de ces animaux xénogreffés et maintenues ex vivo sous forme de cultures organotypiques comme décrit16,17. Ce nouveau modèle ex vivo permet d’analyser la croissance des cellules BCBM dans le parenchyme cérébral et peut être utilisé pour tester les agents thérapeutiques et les effets des radiations sur les cellules tumorales dans le microenvironnement cérébral.
Protocole
Ce protocole a été approuvé et suit les directives de soins aux animaux par le Drexel University College of Medicine Institutional Animal Care and Use Committee (IACUC). Des souris femelles athymiques Nu/Nu (âgées de 6 à 8 semaines) ont été utilisées dans cette étude.
1. Injection intracrânienne de cellules tumorales
- Stériliser tout l’équipement (pince à épiler, ciseaux, ciseaux de suture, perceuse à main) sous un cycle sec d’un autoclave jusqu’à 45 min dans des sachets de stérilisation, y compris un indicateur de stérilisation. Si vous effectuez des chirurgies sur plusieurs animaux, stérilisez les outils entre les animaux à l’aide d’un stérilisateur de perles chauffé (jusqu’à 3x).
- Anesthésier les souris selon le protocole de soins aux animaux des utilisateurs (p. ex. isoflurane (4 % pour l’induction, 1 à 2 % d’entretien) et administrer une analgésie (sous-cutanée, 0,1 mL de 0,1 mg/kg de buprénorphine SR-LAB) avant le début de la chirurgie. Assurer une profondeur d’anesthésie optimale avec un pincement des orteils.
- Placez les souris dans un cadre stéréotaxique et immobilisez la tête à l’aide de barres d’oreille standard (Figure 1A). Appliquez une pommade ophtalmique sur les yeux.
- Stériliser la surface de la tête par application répétée et alternée (3x) d’écouvillons d’iode et d’éthanol à 70% avant l’incision.
- Utilisez un scalpel chirurgical pour faire une incision médiane de 1 cm à travers la peau à un angle légèrement diagonal par rapport à la ligne imaginaire qui divise le cerveau de la souris en deux moitiés symétriques pour exposer le crâne. Essuyez tout sang avec un coton-tige.
- Dévier la peau latéralement pour exposer le site d’injection : 2 mm à droite, 1 mm vers l’avant par rapport au bregma (+2 médiolatéral (+2ML), +1 rostral/caudal (+1RC).
- Utilisez un mèche de fraise (0,73 mm) pour pénétrer dans le crâne +2ML, +1RC jusqu’au bregma et percez un trou en utilisant une légère pression et un mouvement de torsion.
- Utilisez une seringue d’injection cérébrale pour injecter 5 μL d’une solution de 100 000 MDA-MB-231BR (exprimant de manière stable la GFP-Luciférase) dans une solution stérile de 1x PBS en insérant initialement la seringue à 3,5 mm de profondeur dans le cerveau.
- Laissez la seringue se déposer pendant 2 min. Tirez-le vers le haut d’environ 1 mm et, après 2 minutes, injectez lentement la première moitié du volume.
- Attendez encore 2 minutes avant d’injecter le reste, puis tirez lentement la seringue 3 minutes après l’injection finale.
REMARQUE: L’injection lente est empirique en permettant au volume d’être bien absorbé par le tissu cérébral et de ne pas créer de fuite après avoir tiré la seringue, ce qui peut entraîner la croissance de cellules cancéreuses à l’extérieur du site prévu. - Appliquez de la cire osseuse sur le site d’injection sur le crâne, puis utilisez des sutures en polypropylène pour suturer le tissu. Les souris se rétabliront dans les 5 minutes suivant le retrait de l’anesthésie.
- Surveillez leur comportement juste après la chirurgie pendant environ 10 minutes, 3 heures plus tard et le lendemain pour déterminer si un traitement spécial, y compris l’injection de solution saline, les aliments mous, etc., est nécessaire pour aider à une récupération rapide.
- Surveiller la croissance tumorale via l’imagerie par bioluminescence sur le système d’imagerie.
- Pour cela, activez d’abord l’oxygène et l’isoflurane sur le système d’imagerie. Permettre aux deux d’être distribués dans la chambre séparée à l’extérieur de la boîte d’imagerie.
- Ensuite, allumez le logiciel, initialisez l’instrument et choisissez l’option appropriée pour visualiser et capturer tout le corps de la souris.
- Placez les souris dans la chambre séparée avec de l’isoflurane et assurez-vous d’une profondeur d’anesthésie optimale avec un pincement des orteils. Injecter aux souris par voie intrapéritonéale 200 μL de 30 mg/mL de luciférine.
- Transférez l’estomac de la souris jusqu’au nez de la chambre d’imagerie alimenté en oxygène et en isoflurane. Verrouillez la chambre et choisissez une exposition de 2 minutes pour commencer l’imagerie.
- Utilisez l’outil ROI (région d’intérêt) du logiciel pour quantifier le signal bioluminescent de la tumeur.
- Pour analyser la taille de la tumeur, choisissez l’outil de forme de cercle, ajustez-le autour de la forme et de la taille de la tumeur. Mesurez le retour sur investissement et rapportez les lectures totales.
- Permettre la croissance de la tumeur solide pendant 12-14 jours (ou jusqu’à ce que la luciférase atteigne environ 7,0 x 106 unités) (Figure 1B) avant de générer des tranches de cerveau.
REMARQUE: L’augmentation du nombre de cellules à injecter entraînera une croissance tumorale plus rapide; par conséquent, la génération de tranches de cerveau peut se produire avant 12 jours. D’autre part, une tumeur plus grosse conduira à plus de tranches de GFP + si on la laisse se développer pendant 14 jours. Après 14 jours, la santé des souris commence à se détériorer rapidement; par conséquent, la surveillance de la santé animale devrait être augmentée à une fois par jour après le point de 10 jours, et toute souris présentant des signes de douleur et / ou d’inconfort devrait être utilisée pour générer les tranches.
2. Générer des tranches de cerveau
REMARQUE: Effectuez les étapes après l’isolement cérébral dans une hotte à flux laminaire stérile. Il est généralement possible de générer 35 à 40 tranches individuelles contenant des cellules tumorales (signal de luciférase) à partir d’une souris injectée avec des cellules MDA-MB-231BR (Figure 1C).
- Stérilisez tous les outils chirurgicaux dans un autoclave. Placez la trancheuse de tissu dans la hotte à flux laminaire stérile et nettoyez tous les outils et instruments avec de l’éthanol à 70%.
- Après 12 à 14 jours après l’injection intracrânienne de cellules MDA-MB-231BR, anesthésier les souris conformément au protocole de soins aux animaux des utilisateurs décrit au point 1.2. Assurer une profondeur d’anesthésie optimale avec un pincement des orteils.
- Retirer et placer leur cerveau rapidement (dans les 45 s) dans le saccharose-ACSF glacé (4 °C) composé des éléments suivants : 280 mM de saccharose, 5 mM KCl, 2 mM MgCl2, 1 mM CaCl2, 20 mM de glucose, 10 mM HEPES, 5 mM Na+-ascorbate, 3 mM de thiourée, 2 mM Na+, 29 mM de pyruvate; pH = 7,3.
- À l’aide d’un scalpel ou d’une lame de rasoir tranchant et stérile, coupez les parties excédentaires du cerveau qui ne contiennent aucune tumeur de tous les côtés, y compris la partie inférieure du cerveau.
- Apportez la forme du cerveau à un cube non parfait pour vous asseoir à plat sur le papier filtre mouillé ACSF sur un couvercle de plat de 60 mm pour faciliter le tranchage.
REMARQUE: Le tissu supplémentaire du cerveau où il est peu probable que la tumeur se soit développée est enlevé avant le tranchage pour permettre la génération de tranches principalement GFP + et créer une forme du cerveau stable à la surface de l’instrument et ne sera pas perturbée par les vibrations causées par le tranchage. - Placez plusieurs feuilles de cercles de papier filtre pré-humides (avec ACSF) sur la plate-forme de coupe et placez le tissu bloqué au-dessus.
- Réglez la taille de coupe sur l’instrument à 2 ou 2,5 unités sur la règle fournie pour couper le tissu en sections de 200 à 250 μm.
REMARQUE: Des tranches jusqu’à 350 μm ou aussi fines que 100 μm sont viables. Pour les tranches <200 μm, utilisez un vibratome ou un compresstome. - Utilisez un pinceau (sable) pour transférer des tranches de cerveau dans un plat contenant du saccharose ACSF et séparez les tranches sous un microscope optique à l’aide d’aiguilles de 27 G.
- Identifier les tranches GFP positives au microscope fluorescent et les transférer dans un nouveau plat de 60 mm contenant 2 à 3 mL de milieux tranchés adultes (milieu neurobasal A, supplément de B12 à 2 %, supplément de N2 à 1 %, 1 % de glutamine, 0,5 % de glucose, 10 U/mL de pénicilline et 100 μg/mL de streptomycine) à l’aide d’une pipette stérile cassée de 1 mL (ouverture large).
REMARQUE: Les tranches de cerveau qui contiennent des cellules tumorales se développant sur la surface du cerveau (peut-être en raison d’une fuite de cellules d’injection, etc.) sont exclues. - Transférer 3 à 5 tranches sur chaque insert de culture tissulaire de 30 mm et de 0,4 μm de la taille d’un pore dans des plaques de 6 puits à une distance qui ne permet pas de se développer les uns dans les autres.
- Retirez l’excès de milieu de la surface de l’insert à l’aide d’une pipette P1000, ajoutez 1 mL de milieu de tranche de souris adulte sous chaque insert et équilibrez le milieu dans l’incubateur avant le tranchage.
- Incuber les tissus à 37 °C, 5 % de CO2 et 95 % d’humidité pendant 24 h avant l’imagerie.
3. Imagerie IVIS des tranches
REMARQUE: Effectuer des étapes d’ajout de luciférase et d’inhibiteur dans une hotte à écoulement laminaire stérile.
- Pipette 5 μL de solution de luciférine de 30 mg/mL dans le milieu sous les inserts en soulevant l’insert avec une pince et en les replaçant dans le puits après addition de luciférine au milieu dans le puits.
- Placez la plaque à 6 puits avec le couvercle à l’intérieur de la chambre d’imagerie de l’instrument sous la caméra fixe et verrouillez la porte de la chambre.
- Ouvrez le logiciel et initialisez l’instrument.
- Choisissez les paramètres de l’appareil photo qui permettent la visualisation et la capture d’un seul puits par image. Déplacez la scène vers le haut (FOV de 5 cm) et placez le puits qui doit être imagé directement sous la caméra.
- Réglez le temps d’imagerie sur le plus approprié en fonction de l’intensité de la luciférase que la tumeur émettra, qui peut varier de 10 s à 5 min. Commencez par le régler sur 10 s, puis augmentez si le signal est faible, mais maintenez-le cohérent pour tous les points temporels et conditions jusqu’à la fin de l’expérience (Figure 1D).
- Utilisez l’outil ROI (outil de forme de cercle), ajustez-le autour de la forme et de la taille de la tumeur, mesurez le retour sur investissement et rapportez les lectures totales pour quantifier le signal bioluminescent de chaque tumeur sur la tranche.
- Ramenez la plaque à la hotte à écoulement laminaire stérile, utilisez des pinces pour soulever légèrement l’insert du puits.
- Aspirer le milieu, le remplacer par 1 mL de milieu frais et replacer l’insert dans le puits.
- Pour les expériences où les tranches sont traitées avec divers composés tels que des inhibiteurs, des métabolites, etc., préparer la concentration appropriée du réactif dans 1,2 mL de milieu de tranche cérébrale dans un tube de 1,5 mL, puis transférer 1 mL dans le puits contenant la tranche.
- Répétez ce processus toutes les 48 heures pendant toute la durée de l’étude.
4. Imagerie en direct de la croissance tumorale dans des tranches de cerveau ex vivo
REMARQUE: Fournissez des inserts avec suffisamment de milieu (1,5 mL) pour durer toute la durée de l’expérience, car il n’est pas possible d’ajouter un support supplémentaire pendant l’imagerie en direct.
- Placez la plaque à 6 puits sur le support de plaque de microscope automatisé à l’intérieur de l’incubateur (37 °C, 5 % de CO2 et 95 % d’humidité).
- Ouvrez le logiciel, activez le champ lumineux sur le premier quadrant pour ajuster l’exposition nécessaire pour afficher les tranches. Pour trouver la position (coordonnées « xy ») de la tranche, naviguez avec « xy » sur le deuxième quadrant pour contrôler les coordonnées « xyz » du microscope.
- Sélectionnez la plaque à 6 puits comme matériel de laboratoire utilisé pour cette expérience. Sélectionnez l’éditeur de carte ROI et enregistrez cette position en sélectionnant un nouveau ROI, ajoutez et enregistrez ce ROI.
- Répétez les mêmes étapes pour toutes les autres régions d’intérêt dans d’autres puits. Après avoir ajouté tous les rois, enregistrez tous les retours sur investissement.
- Sous Protocole, sélectionnez Effacer existant et sélectionnez Time-Lapse sous Acquisition, puis sélectionnez les canaux d’intérêt (dans ce cas GFP).
- Désactivez la mise au point automatique dans la configuration de la mise au point et réglez manuellement la mise au point appropriée pour toutes les tranches. Enfin, ajustez l’intensité du champ lumineux et l’excitation et le temps d’exposition du canal fluorescent au niveau approprié.
- Réglez le protocole pour acquérir des images toutes les 15 minutes pendant 48 h.
- Enregistrez et exécutez le protocole. À la fin de l’expérience, le fichier enregistré contiendra à la fois les images en fond clair et les images GFP capturées pour chaque retour sur investissement.
- Pour combiner les images dans une vidéo, renommez toutes les images d’intérêt avec le même nom suivi d’un nombre binaire pour les organiser dans l’ordre dans lequel elles ont été capturées (par exemple, ROI1 (1), RO1 (2) ...)
- Ouvrez ImageJ et importez les images en cliquant sur Fichier > Importer > séquence d’images. Sélectionnez les noms de fichiers qui apparaissent dans une liste et écrivez le contenu du nom des fichiers dans la zone Nom de fichier contient qui apparaîtra pour identifier les fichiers sélectionnés pour la vidéo.
- Enregistrez les images combinées sous Fichier > Enregistrer sous > AVI.
5. Dosage MTS et immunohistochimie du tissu cérébral ex vivo
- ESSAI MTS
- Excisez les tranches en coupant la membrane de culture tissulaire sous chaque tranche le long des bords du tissu et transférez le tissu, toujours attaché à la membrane, dans une plaque de 96 puits.
- Ajouter le réactif MTS mélangé dans un rapport de 1:5 avec un milieu de culture et 0,01% de triton (1x) pour permettre la pénétration de la solution dans le tissu, dans un volume total de 120 μL dans chaque puits.
- Utilisez 4% de paraformaldéhyde (PFA) comme agent pour rendre les tranches de cerveau non viables, et donc un contrôle positif pour cette expérience. Immerger la tranche de cerveau d’intérêt dans 4% de PFA pendant 1 h à RT (température ambiante) ou pendant la nuit à 4 ° C avant de procéder au test MTS.
- Laissez le réactif MTS réagir sur les tranches pendant 4 h, retirez les tranches des puits et mesurez l’absorbance à 490 nm pour toutes les conditions, y compris un puits vide sans tranche comme référence.
- Rapportez les lectures en fonction de la zone de la tranche de tissu, mesurée à l’aide d’une règle d’étrier numérique.
- Préparation d’immunohistochimie
- Immerger les tranches de cerveau attachées à la surface de l’insert membranaire dans 10% de formol pendant la nuit à 4 °C.
- Effectuer l’intégration, le traitement, le blocage et générer des lames non colorées du tissu. Utiliser le protocole de coloration immunohistochimique standard pour colorer pour H&E, Ki-67, gamma-H2AX, CC3, GFAP, GFP, DAPI
6. Irradiation de la tumeur dans des tranches de cerveau ex vivo
- Irradier la tumeur avec 6 Gy (rayons X de 310 kVp).
REMARQUE: Les unités saisies pour obtenir la dose totale de 6 Gy sont de 3522 unités après avoir pris en compte les unités R (mesurées à l’aide de l’électromètre Victoreen) et les corrections pour le dé, la densité de l’air et cGy / R comme décrit précédemment18. Le temps d’exposition est de 130,9 s. - Utilisez 0,25 mm Cu + 1 mm Al de filtration ajoutée, SSD de 50 cm, 125 cGy par min.
- Effectuer la dosimétrie par une chambre d’ionisation dans le faisceau étalonnée par rapport à un étalon primaire.
- Apportez quotidiennement des corrections pour l’humidité, la température et la pression barométrique.
Résultats
Les cellules MDA-MB-231BR-GFP-Luciférase ont été injectées par voie intracrânienne dans l’hémisphère droit de souris Nu/Nu âgées de 4 à 6 semaines, comme expliqué ci-dessus (Figure 1A) et ont été autorisées à se développer pendant 12 à 14 jours, période pendant laquelle la croissance tumorale a été surveillée par imagerie par bioluminescence (Figure 1B). Nous avons injecté 100 000 cellules cancéreuses par voie intracrânienne, comme l’ont rapporté d’autres groupes19, mais il est possible d’injecter aussi peu que 20 000 cellules20. Après la génération de tranches cérébrales (Figure 1C), comme décrit ci-dessus, des tranches ont été imagées sur l’IVIS pour déterminer la présence tumorale par imagerie bioluminescente après 24 heures d’incubation. Ceci est considéré comme le jour 0. La croissance tumorale a été surveillée en quantifiant la signalisation bioluminescente toutes les 48 h, ce qui indiquait une croissance progressive sur 6 jours (Figure 1D). La coloration H&E et la fluorescence GFP-positive confirment la présence d’une tumeur dans la tranche de cerveau (Figure 1D). Nous avons également pu détecter une coloration des astrocytes réactifs, visualisée par coloration des cellules positives de la protéine acide fibrillaire gliale (GFAP), visibles entre le groupe de cellules cancéreuses (GFP-positives) (Figure 1D) similaires à ce qui est vu in vivo21. Contrairement aux modèles qui inoculent des cellules cancéreuses ex vivo dans une tranchede cerveau de souris 22, ce modèle contient des astrocytes réactifs qui sont un aspect important du microenvironnement tumoral BCBM. Nous détectons également une coloration accrue du Ki-67 confirmant que les cellules cancéreuses sont très prolifératives (Figure 1D). Ainsi, les cellules tumorales dans le parenchyme cérébral peuvent survivre et proliférer dans une tranche de cerveau ex vivo pendant un certain nombre de jours et contiennent également du stroma associé à la tumeur.
L’irradiation (RI) est l’une des premières lignes de traitement pour les patients qui présentent des métastases cérébrales en clinique. Pour comprendre comment le modèle de tranche ex vivo réagirait à un tel traitement, des tranches de cerveau contenant des tumeurs de la luciférase MDA-MB-231BR-GFP ont été exposées à une irradiation 6Gy. Les tumeurs dans les tranches de cerveau qui n’ont pas été exposées à l’irradiation ont continué à croître ex vivo, tandis que les tumeurs exposées à l’irradiation ont montré une croissance bloquée (Figure 2A). Les tranches de cerveau contenant des tumeurs MDA-MB-231BR-GFP-Luciférase ont également été surveillées par imagerie en direct pendant 48 h après le jour 4 pour visualiser la croissance tumorale dans le microenvironnement cérébral après un traitement IR (Figure 2B). Conformément à l’imagerie bioluminescente, on voit les cellules cancéreuses témoins croître rapidement à mesure que l’intensité du GFP augmente et qu’un certain nombre de cellules envahissent le parenchyme cérébral (vidéo 1). En revanche, les cellules cancéreuses dans les tranches de cerveau traitées avec 6Gy IR sont cytostatiques et l’intensité GFP est maintenue (Vidéo 2). La coloration H&E confirme des tumeurs plus petites dans les cellules traitées par IR (Figure 2C). Nous avons également détecté de grandes cellules cancéreuses multinucléées et une augmentation de la coloration du marqueur de dommages à l’ADN g-H2AX dans les cellules cancéreuses traitées par IR (Figure 2C). Aucune augmentation de l’apoptose dans les tranches traitées par IR n’a été détectée, ce qui suggère que l’IR peut réduire la prolifération (Figure 2C). Néanmoins, une augmentation de la coloration dans les astrocytes réactifs a été détectée, visualisée par coloration des cellules GFAP positives, qui sont visibles autour du groupe de cellules cancéreuses (GFP-positif) traitées par IR (Figure 2C). Cela suggère que ce modèle ex vivo peut également être utile pour comprendre comment certains composants du stroma tumoral répondent aux traitements. De plus, nous n’avons détecté aucune apoptose causée par le traitement IR de tranches de souris cérébrales sans tumeur (Figure 2D).
Nous avons également testé si les tumeurs préformées MDA-MB-231BR dans les tranches de cerveau répondraient à la chimiothérapie. Les tranches de cerveau contenant des tumeurs MDA-MB-231BR ont été traitées à différentes concentrations de paclitaxel (Figure 3A), un médicament chimiothérapeutique utilisé chez les patientes atteintes d’un cancer du sein23. Le traitement a diminué la taille de la tumeur telle que quantifiée par la signalisation bioluminescente, mais cette inhibition n’était significative qu’après le jour 10 du traitement (Figure 3A). Cela peut être dû à une réponse hétérogène au paclitaxel ex vivo. Par exemple, dans les 40 nM bien traités, une tranche contenant une tumeur (en haut) est réduite tandis que la tumeur (en bas) dans le même puits semble se développer. En outre, certaines des plus petites tumeurs semblaient être plus sensibles au paclitaxel et présentaient une bioluminescence réduite, tandis que les plus grandes tumeurs semblaient réfractaires (Figure 3A, traitement 80 nM). Conformément à la réduction de la taille de la tumeur, une augmentation de l’apoptose a été détectée dans les cellules tumorales traitées au paclitaxel par rapport aux témoins (Figure 3B). Fait important, en utilisant un test mtS de viabilité adapté de Mews et al. pour incorporer l’utilisation du triton24, nous avons testé que le traitement par inhibiteur n’altérait pas la viabilité des tissus cérébraux (en l’absence de tumeur) (Figure 3C). Conformément à ce résultat, nous n’avons pas détecté et augmenté l’apoptose mesurée par la coloration à la caspase 3 clivée dans une tranche de cerveau de souris sans tumeur traitée au paclitaxel (Figure 3D). Ces données suggèrent que ce modèle peut être utile pour comprendre la réponse chimiothérapeutique et la résistance du BCBM dans un microenvironnement cérébral. En raison de la nature du modèle, un environnement ex vivo qui conserve les propriétés et l’interaction cerveau-tumeur, son essentialité réside dans la fourniture de preuves primaires de la réponse du BCBM aux réactifs chimiothérapeutiques et élimine ainsi les médicaments qui ne rétrécissent pas la tumeur dans ce modèle des futurs essais in vivo , qui sont encore essentiels pour valider l’effet des médicaments qui fournissent des résultats positifs dans ce modèle, la réponse systémique dans l’organisme et la capacité de traverser la barrière hémato-encéphalique.
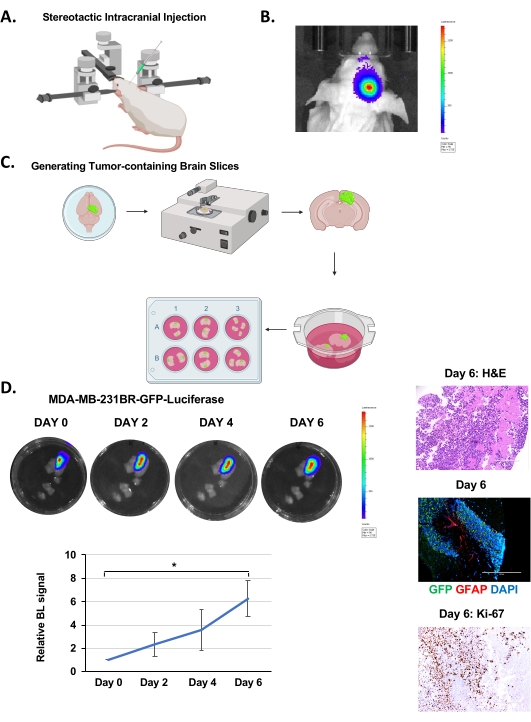
Graphique 1. Injection intracrânienne, génération de tranches cérébrales et croissance ex vivo du BCBM. (A) Représentation schématique de la souris lors d’une injection intracrânienne sous un instrument stéréotaxique. (B) Images représentatives de la détection bioluminescente de tumeurs de souris Nu/Nu âgées de 4 à 6 semaines auxquelles on a injecté 5 x 105 cellules MDA-MB-231BR-GFP-Luciférase 12 jours après l’injection. (C) Représentation schématique de la génération de tranches cérébrales de souris ex vivo à partir de (B). (D) Images représentatives représentant la croissance tumorale dans des tranches de cerveau organotypiques dérivées de souris injectées par voie intracrânienne avec des cellules MDA-MB-231BR-GFP-Luciferase détectées par bioluminescence pendant 6 jours. H&E & Ki-67, GFP (cellules tumorales) GFAP (astrocytes réactifs) DAPI (noyau) coloration d’une tranche de cerveau représentative avec tumeur (grossissement de l’image 20x, barre d’échelle: 200 μm). La quantification de la croissance tumorale représente le signal de bioluminescence par rapport au jour 0 (n = 3). Le test t de l’élève a été déclaré comme moyenne ± SEM, * p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Traitement des tranches de cerveau organotypiques BCBM avec rayonnement. (A) Images représentatives représentant la croissance tumorale dans des tranches de cerveau organotypiques dérivées de souris injectées par voie intracrânienne avec des cellules MDA-MB-231BR-GFP-Luciférase détectées par bioluminescence. Les tumeurs ne sont exposées à aucune irradiation ou à une irradiation de 6 Gy (une dose) et sont autorisées à se développer pendant les jours indiqués. Quantification de la croissance tumorale au jour indiqué (témoin. n = 3; 6Gy, n = 3). Le test t de l’élève a été rapporté comme moyenne ± SEM. * p < 0,05. (B) Les tranches de cerveau ont été imagées pendant 48 h toutes les 15 minutes. Des images représentatives de vidéos d’échantillons non irradiés et irradiés indiquent une croissance tumorale. (C) Les tranches, telles que traitées en (A), ont été fixées et testées pour la coloration H&E, g-H2AX, DAPI, Caspase-3 clivée (CC3) et GFP (grossissement de l’image 20x, barre d’échelle: 200 μm). (D) Les tranches cérébrales de souris sans tumeur ont été traitées comme dans (A) et ont été fixées et dosées pour CC3 et DAPI (grossissement de l’image 20x, barre d’échelle: 200 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Traitement des tranches de cerveau organotypiques BCBM avec du paclitaxel. (A) Tranches cérébrales dérivées de souris injectées par voie intracrânienne avec des cellules MDA-MB-231BR-GFP-Luciférase traitées avec du DMSO ou après traitement par paclitaxel à 40 nM, 80 nM, 160 nM et 320 nM pendant 10 jours, reconstituant le milieu toutes les 48 h et laissées croître pendant les jours indiqués (grossissement de l’image 20x, barre d’échelle: 200 μm). Quantification de la croissance tumorale au jour indiqué (contrôle n = 6, Paclitaxel n = 3) (bas). Le test t de l’élève a été rapporté comme moyenne ± SEM. * p < 0,05. (B) Des tranches de cerveau ex vivo traitées en (A) avec du DMSO ou du paclitaxel de 320 nM ont été collectées, fixées et testées pour la GFP, le CC3 et le DAPI (grossissement de l’image 20x, barre d’échelle: 200 μm). (C) Une tranche cérébrale ex vivo traitée en (A) (sans tumeur) avec du DMSO ou du paclitaxel de 320 nM a été collectée au jour 10 et analysée pour la viabilité cellulaire (test MTS). En tant que témoin positif, les tranches ont été traitées avec du paraformaldéhyde (PFA) qui rend les tranches cérébrales non viables (n = 3) Le test t de Student a rapporté que la moyenne ± SEM. * p < 0,05. (D) Des tranches de cerveau ex vivo traitées en (A) (sans tumeur) avec du DMSO ou du paclitaxel de 320 nM ont été collectées, fixées et testées pour CC3 et DAPI (grossissement de l’image 20x, barre d’échelle: 200 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo 1. Imagerie en direct de tranches de cerveau organotypiques BCBM. Les tranches de cerveau dérivées de souris injectées par voie intracrânienne avec des cellules MDA-MB-231BR-GFP-Luciferase ont été autorisées à se développer pendant 4 jours, puis placées sous un microscope à image en direct pendant 48 h où les images ont été prises toutes les 15 minutes et combinées pour créer une vidéo à l’aide d’ImageJ. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo 2. Imagerie en direct de tranches de cerveau organotypiques BCBM irradiées. Des tranches de cerveau dérivées de souris injectées par voie intracrânienne avec des cellules MDA-MB-231BR-GFP-Luciferase ont été irradiées le lendemain de la génération des tranches et 4 jours plus tard ont été imagées toutes les 15 minutes pendant 48 h. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Cette étude établit une nouvelle méthode de culture cérébrale ex vivo pour les tumeurs cérébrales explantées de xénogreffes. Nous montrons que les cellules BCBM MDA-MB-231BR injectées par voie intracrânienne dans le cerveau de souris peuvent survivre et se développer dans des tranches de cerveau ex vivo . L’étude a également testé des cellules de glioblastome U87MG (GBM) injectées par voie intracrânienne et a également constaté que ces cellules cancéreuses survivent et se développent dans des tranches de cerveau (données non montrées). Nous croyons que ce modèle peut être étendu au-delà du BCBM et du GBM à d’autres cancers qui métastasent facilement au cerveau, y compris le cancer du poumon et le mélanome. Les injections intracrâniennes de cellules trophiques cérébrales du cancer du sein ont été choisies car il s’agit d’une méthode simple et rapide pour générer des tumeurs cérébrales et est considérée comme un modèle approprié pour les macrométastases cérébrales25. Cependant, des modèles de tranches tumorales similaires peuvent être développés à partir d’une inoculation intracardiaque ou d’injections orthotopiques dans des coussinets de graisse primaires. L’optimisation des conditions de culture en cultivant des tranches de cerveau adultes dans un milieu sans sérum et en fournissant un milieu frais toutes les 48 heures a permis une meilleure préservation de la viabilité tissulaire, de la survie et de la croissance des tumeurs. Les inserts de 0,4 μm utilisés dans des conditions hyperoxiques de l’incubateur servent de support structurel aux tranches de cerveau ex vivo et fournissent également une connexion à l’apport artificiel de nutriments et d’oxygène aux tissus et aux cellules tumorales en l’absence d’apport sanguin qui semble être suffisant pour maintenir la viabilité des tissus pendant au moins dix jours en culture. L’imagerie en direct représente la croissance tumorale en fonction de l’augmentation du signal GFP. Cependant, le logiciel a un seuil de luminosité GFP maximale qui sature le signal et ne permet pas une identification correcte de la motilité unicellulaire dans le microenvironnement cérébral. La modification future de la détection du signal logiciel microscopique améliorera la capacité de signaler avec précision l’augmentation temporelle du signal GFP en fonction de la croissance tumorale.
Ce modèle permet également de surveiller la croissance et la viabilité de la tumeur par coloration immunohistochimique. Il est important de noter que ce modèle permettra de tester rapidement l’efficacité de la sensibilité aux rayonnements avec ou sans inhibiteurs de petites molécules de tumeurs cultivées dans le microenvironnement cérébral. Nous montrons que ce modèle se prête à la fois aux traitements par radiothérapie et aux agents chimiothérapeutiques. En outre, ce système peut être utilisé pour des études omiques telles que la protéomique, la métabolomique et la génomique afin de mieux comprendre la croissance du cancer et la réponse aux traitements dans le microenvironnement cérébral. En outre, tester la rechute potentielle des tumeurs lors de l’élimination des inhibiteurs après une exposition plus courte permettrait de mieux comprendre les voies chimiorésistantes uniques aux cellules cancéreuses dans le microenvironnement cérébral.
En résumé, nous avons développé une nouvelle tranche cérébrale ex vivo de culture de tissu tumoral de xénogreffe qui surveillera la croissance tumorale et l’interaction avec le microenvironnement de la tumeur cérébrale et pour le dépistage rapide des agents thérapeutiques pour bloquer la croissance tumorale dans le cerveau.
Déclarations de divulgation
Les auteurs n’ont aucun conflit financier à déclarer.
Remerciements
Nous tenons à remercier Julia Farnan, Kayla Green et Tiziana DeAngelis pour leur assistance technique. Ce travail a été soutenu en partie par le Pennsylvania Commonwealth Universal Research Enhancement Grant Program (MJR, JGJ), UO1CA244303 (MJR), R01CA227479 (NLS), R00CA207855 (EJH) et W.W. Smith Charitable Trusts (EjH).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe, slip tip | BD | 309659 | |
| 30 G1/2 Needles | BD | 305106 | |
| 6-well plates | Genessee | 25-105 | |
| Automated microscope and LUMAVIEW software | Etaluma | LS720 | |
| B27 (GEM21) | Gemini Bio-Products | 400-160 | |
| Beaker 50 mL | Fisher | 10-210-685 | |
| Blunt sable paintbrush, Size #5/0 | Electron Microscopy Sciences | 66100-50 | |
| Bone Wax | ModoMed | DYNJBW25 | |
| Brain injection Syringe | Hamilton Company | 80430 | |
| CaCl2 | Fisher Scientific | BP510-250 | |
| Cleaved caspase 3 Antibody | Cell Signaling | 14220S | |
| DAPI | Invitrogen | P36935 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| Double edge razor blade | VWR | 55411-060(95-0043) | |
| Filter Paper (#1), quantitative circles, 4.25 cm | Fisher | 09-805a (1001-042) | |
| Fine sable paintbrush #2/0 | Electron Microscopy Sciences | 66100-20 | |
| Forceps | Fine Science Tools | 11251-20 | |
| Gamma-H2AX antibody | Millipore | 05-636 | |
| GFAP antibody | Thermo Fisher | 13-0300 | |
| GFP antibody | Santa Cruz | SC-9996 | |
| Glucose | Sigma Aldrich | G8270 | |
| Glutamine (200 mM) | Corning cellgrow | 25-005-Cl | |
| H&E and KI-67 | Jefferson Core Facility Pathology staining | ||
| Hand Drill Set with Micro Mini Twist Drill Bits | Amazon | YCQ2851920086082DJ | |
| HEPES, free acid | Fisher Scientific | BP299-1 | |
| Just for mice Stereotaxic Frame | Harvard Apparatus (Holliston, MA, USA). | 72-6049, 72-6044 | |
| KCl | Fisher Scientific | S271-10 | |
| Large surgical scissors | Fine Science Tools | 14001-18 | |
| MDA-MB-231BR cells | Kindly provided by Dr. Patricia Steeg | Ref 14 | |
| MgCl2·6H2O | Fisher Scientific | M33-500 | |
| Mice imaging device | Perkin Elmer | IVIS 200 system | |
| Mice imaging software | Caliper Life Sciences (Waltham, MA, USA). | Living Image Software | |
| Microplate Reader | Tecan Spark | ||
| Mounting solution | Invitrogen | P36935 | |
| MTS reagent | Promega CellTiter 96 Aqueous One Solution | (Cat:G3582) | |
| N2 supplement | Life Technologies | 17502-048 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nu/Nu athymic mice | Charles Rivers Labs (Wilmington, MA, USA) | ||
| Paraformaldehyde | Affymetrix | 19943 | |
| Pen/Strep | Life Technologies | 145140-122 | |
| Polypropylene Suture | Medex supply | ETH-8556H | |
| Povidone Iodine Swab sticks | DME Supply USA | Cat: 689286X | |
| Scalpel blade #11 (pk of 100) | Fine Science Tools | 10011-00 | |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | |
| Sodium Pyruvate | Sigma Aldrich | S8636 | |
| Spatula/probe | Fine Science Tools | 10090-13 | |
| SS Double edge uncoated razor blades (American safety razor co (95-0043)) | VWR | 55411-060 | |
| Sucrose | Amresco | 57-50-1 | |
| Surgical Scalpel | Exelint International | D29702 | |
| Tissue Chopper | Brinkman | (McIlwain type) | |
| Tissue culture inserts | Millipore | PICMORG50 or PICM03050 | |
| X-ray machine | Precision 250 kVp |
Références
- Watase, C., et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives. Cancers. 13 (5), (2021).
- Niikura, N., et al. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Research and Treatment. 147 (1), 103-112 (2014).
- Fong, E. L., et al. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Parker, J. J., et al. A human glioblastoma organotypic slice culture model for study of tumor cell migration and patient-specific effects of anti-invasive drugs. Journal of Visualized Experiments: JoVE. (125), e53557 (2017).
- Chuang, H. N., et al. Coculture system with an organotypic brain slice and 3D spheroid of carcinoma cells. Journal of Visualized Experiments: JoVE. (80), e50881 (2013).
- Hohensee, I., et al. PTEN mediates the cross talk between breast and glial cells in brain metastases leading to rapid disease progression. Oncotarget. 8 (4), 6155-6168 (2017).
- van de Merbel, A. F., et al. An ex vivo Tissue culture model for the assessment of individualized drug responses in prostate and bladder cancer. Frontiers in Oncology. 8, 400 (2018).
- Martin, S. Z., et al. Ex vivo tissue slice culture system to measure drug-response rates of hepatic metastatic colorectal cancer. BMC Cancer. 19 (1), 1030 (2019).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5 (15), 1597-1601 (2006).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Palmieri, D., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Research. 67 (9), 4190-4198 (2007).
- Kyeong, S., et al. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 12 (11), 0188542 (2017).
- Hengel, K., et al. Attributes of brain metastases from breast and lung cancer. International Journal of Clinical Oncology. 18 (3), 396-401 (2013).
- Jackson, J. G., et al. Neuronal activity and glutamate uptake decrease mitochondrial mobility in astrocytes and position mitochondria near glutamate transporters. Journal of Neuroscience. 34 (5), 1613-1624 (2014).
- Farnan, J. K., Green, K. K., Jackson, J. G. Ex vivo imaging of mitochondrial dynamics and trafficking in astrocytes. Current Protocols in Neuroscience. 92 (1), 94 (2020).
- Simone, N. L., et al. Ionizing radiation-induced oxidative stress alters miRNA expression. PLoS One. 4 (7), 6377 (2009).
- Couturier, C. P., et al. Single-cell RNA-seq reveals that glioblastoma recapitulates a normal neurodevelopmental hierarchy. Nature Communications. 11 (1), 3406 (2020).
- Candolfi, M., et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. Journal of Neuro-Oncology. 85 (2), 133-148 (2007).
- Fitzgerald, D. P., et al. Reactive glia are recruited by highly proliferative brain metastases of breast cancer and promote tumor cell colonization. Clinical & Experimental Metastasis. 25 (7), 799-810 (2008).
- Kondru, N., et al. An Ex Vivo Brain Slice Culture Model of Chronic Wasting Disease: Implications for Disease Pathogenesis and Therapeutic Development. Scientific Reports. 10 (1), (2020).
- Abu Samaan, T. M., et al. Paclitaxel's mechanistic and clinical effects on breast cancer. Biomolecules. 9 (12), (2019).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice--a model for tauopathy studies. PLoS One. 7 (9), 45017 (2012).
- Valiente, M., et al. Brain metastasis cell lines panel: A public resource of organotropic cell lines. Cancer Research. 80 (20), 4314-4323 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon