Method Article
一 种研究 并靶向乳腺癌脑转移性肿瘤生长的离体脑切片模型
摘要
我们介绍了一种在有机结构脑切片模型中测量乳腺癌脑转移细胞的实时药物和辐射反应的方案。这些方法提供了一种定量测定法,以研究各种治疗对脑微环境界面内乳腺癌脑转移瘤的治疗效果。
摘要
脑转移瘤是乳腺癌对女性的严重后果,因为这些肿瘤难以治疗,并且与不良的临床结果有关。乳腺癌脑转移(BCBM)生长的临床前小鼠模型是有用的,但价格昂贵,并且很难跟踪活细胞和肿瘤细胞在脑实质内的侵袭。这里介绍的是来自异种移植小鼠的 离体 脑切片培养方案,其中包含颅内注射的乳腺癌寻脑克隆亚线。 将MDA-MB-231BR 荧光素酶标记的细胞颅内注射到Nu / Nu雌性小鼠的大脑中,肿瘤形成后,将大脑分离,切片并 离体培养。对肿瘤切片进行成像以鉴定表达荧光素酶的肿瘤细胞,并监测它们在脑实质中的增殖和侵袭长达10天。此外,该协议描述了使用延时显微镜对电离放疗或化疗后肿瘤细胞的生长和侵袭行为进行成像。肿瘤细胞对治疗的反应可以通过实时成像显微镜可视化,测量生物发光强度,并在含有BCBM细胞的脑切片上进行组织学。因此,这种 离体 切片模型可能是一个有用的平台,用于单独或与辐射联合使用新型治疗剂的快速测试,以鉴定个性化药物,以靶向个体患者的脑微环境中的乳腺癌脑转移生长。
引言
当细胞从原发性乳腺肿瘤扩散到大脑时,乳腺癌脑转移瘤(BCBM)就会发展。乳腺癌是仅次于肺癌的第二大脑转移原因,转移发生在10-16%的患者中1。不幸的是,脑转移瘤仍然无法治愈,因为>80%的患者在脑转移诊断后一年内死亡,并且由于神经功能障碍,他们的生活质量受损2。迫切需要确定更有效的治疗方案。单层二维或三维培养模型是在实验室中测试治疗剂最常用的方法。然而,它们不能模仿复杂的BCBM微环境,这是肿瘤表型和生长的主要驱动因素。虽然这些模型是有用的,但它们不能捕获复杂的肿瘤 - 基质相互作用,独特的代谢需求以及肿瘤的异质性3。为了更忠实地概括肿瘤 - 基质相互作用和微环境异质性,我们的小组和其他人已经开始用患者来源的肿瘤细胞(原发性或转移性)或癌细胞系4,5,6产生有机指型脑转移"切片"培养物。与传统的 体外 系统相比,这种短期 离体 模型可能为在大型动物队列的临床前评估之前筛选新疗法提供更多相关条件。
已经构建并成功用于鉴定各种癌症的成功治疗。它们需要几天的评估,此外还可以根据患者特定的药物筛查进行定制。例如,人膀胱癌和前列腺癌的离体组织已经显示出多西紫杉醇和吉西他滨7的剂量依赖性抗肿瘤反应。开发了类似的结直肠癌离体组织来筛选化疗药物奥沙利铂,西妥昔单抗和Pembrolizumab8。该应用已被广泛用于胰腺癌,考虑到基质环境与胰腺导管腺癌的基因型和表型特征之间的基本相互作用9,10。此外,已经开发了这种有机细胞模型,用于头,颈,胃和乳腺肿瘤的类似筛查11,12。
在这里,正在产生异种移植乳腺癌脑转移性肿瘤细胞在其微环境中的 离体 脑切片模型。将小鼠颅内注射乳腺癌脑转移性脑营养MDA-MB-231BR细胞13 在脑皮层顶叶 - TNBC转移的常见部位14,15 并允许发展肿瘤。从这些异种移植动物中产生脑切片,并作为有机细胞培养物进行 体外 保存,如16,17所述。这种新颖的 离体 模型可以分析BCBM细胞在脑实质内的生长,并可用于测试治疗剂和对脑微环境中肿瘤细胞的辐射作用。
研究方案
该协议已获得批准,并遵循德雷塞尔大学医学院机构动物护理和使用委员会(IACUC)的动物护理指南。本研究使用Nu / Nu无胸腺炎雌性小鼠(6-8周龄)。
1. 颅内注射肿瘤细胞
- 在高压灭菌器的干燥循环下,在灭菌袋中对所有设备(镊子,剪刀,缝合剪刀,手钻)进行灭菌长达45分钟的灭菌,包括灭菌指示剂。如果对多只动物进行手术,请使用加热的珠子灭菌器(最多3次)在动物之间对工具进行灭菌。
- 在手术开始前,根据使用者的动物护理方案(例如,异氟醚(4%用于诱导,1-2%维持)麻醉小鼠并给予镇痛(皮下注射,0.1mL 0.1mg / kg丁丙诺啡SR-LAB)。通过捏脚趾确保最佳的麻醉深度。
- 将小鼠放入立体定位框架中,并使用标准耳杆固定头部(图1A)。将眼药膏涂抹在眼睛上。
- 在切口前,通过重复交替施用(3x)碘拭子和70%乙醇对头部表面进行灭菌。
- 使用手术刀在皮肤上以略微对角角的角度制作一个1厘米的中线切口,该假想线将小鼠的大脑分成两个对称的半部分以暴露头骨。用棉签擦拭任何血液。
- 横向偏转皮肤以暴露注射部位:右侧2毫米,相对于前茅前1毫米(+2个中外侧(+2ML),+1个喙部/尾部(+1RC)。
- 使用钻头(0.73毫米)穿透颅骨+2ML,+1RC到前茅,并使用轻微的压力和扭曲运动钻一个洞。
- 使用脑注射注射器在无菌1x PBS中注射5μL的100,000 MDA-MB-231BR(稳定表达GFP-Luciferase)细胞/ μL溶液,方法是最初将注射器插入脑部3.5mm深处。
- 让注射器静置2分钟。将其向上拉约1毫米,2分钟后,慢慢注入体积的前半部分。
- 在注射其余部分之前再等待2分钟,然后在最终注射后3分钟缓慢拉动注射器。
注意:缓慢注射是经验性的,允许体积被脑组织很好地吸收,并且在拉动注射器后不会产生泄漏,这可能导致癌细胞在预期部位之外生长。 - 将骨蜡涂在颅骨上的注射部位,然后使用聚丙烯缝合线缝合组织。小鼠将在去除麻醉后5分钟内恢复。
- 在手术后约10分钟,3小时后和第二天监测他们的行为,以确定是否需要特殊治疗,包括盐水注射,软食等,以帮助快速恢复。
- 通过成像系统上的生物发光成像监测肿瘤生长。
- 为此,首先,打开成像系统上的氧气和异氟醚。允许两者被分配到成像盒外的单独腔室中。
- 然后,打开软件,初始化仪器并选择适当的选项来可视化和捕获整个鼠标主体。
- 用异氟醚将小鼠置于单独的腔室中,并用脚趾捏合确保最佳的麻醉深度。腹膜内注射小鼠200μL30mg / mL荧光素。
- 将小鼠胃向下转移到提供氧气和异氟醚的成像室的鼻孔中。锁定腔室,然后选择2分钟时间曝光以开始成像。
- 使用软件的ROI(感兴趣区域)工具来量化肿瘤的生物发光信号。
- 要分析肿瘤大小,请选择圆形工具,将其围绕肿瘤形状和大小进行调整。衡量投资回报率并报告总读数。
- 在产生脑切片之前,允许实体瘤生长12-14天(或直到荧光素酶达到约7.0×106 单位)(图1B)。
注意:增加注射细胞的数量将导致更快的肿瘤生长;因此,脑切片的产生可以早于12天发生。另一方面,如果允许生长14天,更大的肿瘤将导致更多的GFP +切片。14天后,小鼠的健康状况开始迅速恶化;因此,在10天时间点后,动物健康监测应增加到每天一次,并且任何表现出疼痛和/或不适迹象的小鼠都应用于生成切片。
2. 生成大脑切片
注意:在无菌层流罩中进行脑隔离后执行这些步骤。通常可以从一只注射有MDA-MB-231BR细胞的小鼠中产生35-40个含有肿瘤细胞(荧光素酶信号)的单独切片(图1C)。
- 对高压灭菌器中的所有手术工具进行消毒。将组织切片机放在无菌层流罩中,并用70%乙醇清洁所有工具和仪器。
- 颅内MDA-MB-231BR细胞注射后12-14天后,根据用户的动物护理方案麻醉小鼠,如1.2所述。通过捏脚趾确保最佳的麻醉深度。
- 取出并将他们的大脑快速(在45秒内)放入冰冷(4°C)蔗糖 - ACSF中,由以下物质组成:280 mM蔗糖,5 mM KCl,2 mM MgCl2,1 mM CaCl2,20 mM葡萄糖,10 mM HEPES,5 mM Na + -抗坏血酸,3 mM硫脲,2 mM Na +,29 mM丙酮酸盐;pH=7.3。
- 使用锋利,无菌的手术刀或剃刀刀片,从各个侧面切除不含任何肿瘤的大脑多余部分,包括大脑的底部。
- 将大脑的形状带到一个不完美的立方体中,平放在60毫米盘盖上的ACSF润湿滤纸上,以方便切片。
注意:在切片之前,肿瘤不太可能生长的大脑的额外组织被移除,以允许产生大部分GFP +切片,并创建一个在仪器表面上稳定的大脑形状,并且不会受到切片引起的振动的干扰。 - 将几张预湿(使用ACSF)滤纸圆圈放在切割平台上,并将堵塞的纸巾放在上面。
- 将仪器上的切割尺寸设置为提供的尺子上的2或2.5个单位,以将组织切片成200-250μm切片。
注意:最大350μm或薄至100μm的切片是可行的。对于<200 μm的切片,请使用振动切片机或压缩切片机。 - 使用画笔(黑貂)将脑切片转移到含有蔗糖ACSF的培养皿中,并使用27 G针在光学显微镜下分离切片。
- 在荧光显微镜下鉴定GFP阳性切片,并使用无菌1 mL破碎移液管(大开口)将其转移到含有2-3 mL成人切片培养基(神经基础培养基A,2%B12补充剂,1%N2补充剂,1%谷氨酰胺,0.5%葡萄糖,10 U / mL青霉素和100μg/ mL链霉素)的新60 mm培养皿中。
注意:包含生长在脑表面的肿瘤细胞的脑切片(可能是由于注射细胞泄漏等)被排除在外。 - 将3-5片转移到每个30mm,0.4μm孔径组织培养插入物中的6孔板中,其距离不允许彼此生长。
- 使用P1000移液管从插入物表面除去多余的培养基,在每个插入物下方加入1 mL成年小鼠切片培养基,并在切片前平衡培养箱中的培养基。
- 在成像前,将组织在37°C,5%CO2 和95%湿度下孵育24小时。
3. 切片的IVIS成像
注意:在无菌层流罩中执行荧光素酶和抑制剂添加步骤。
- 将5μL的30mg / mL荧光素溶液移液到插入物下方的培养基中,方法是用镊子提起插入物,并在将荧光素加入孔中的培养基后将其放回孔中。
- 将带盖子的6孔板放在固定相机下方的仪器成像室内,并锁定腔室门。
- 打开 软件 并 初始化 仪器。
- 选择允许每张图像仅可视化和捕获一个孔的相机设置。向上移动载物台(FOV为5 cm),并将必须直接成像的孔放在相机下方。
- 根据肿瘤将发射的荧光素酶的强度将成像时间设置为最合适的,其范围可以从10秒到5分钟不等。首先将其设置为10秒,如果信号较低,则增加信号,但在实验结束之前的所有时间点和条件下保持一致(图1D)。
- 使用ROI工具(圆形工具),将其围绕肿瘤形状和大小进行调整,测量ROI,并报告总读数以量化切片上每个肿瘤的生物发光信号。
- 将板带回无菌层流罩,使用镊子将插入物从孔中略微抬起。
- 吸出培养基,用1mL新鲜培养基替换,然后将插入物放回孔中。
- 对于用抑制剂,代谢物等各种化合物处理切片的实验,在1.5 mL管中1.2 mL脑切片培养基中制备适当浓度的试剂,然后将1 mL转移到含有切片的孔中。
- 在研究期间每48小时重复此过程。
4. 离体 脑切片肿瘤生长的实时成像
注意:为插入物提供足够的培养基(1.5 mL)以持续实验时间,因为在实时成像期间不可能添加额外的培养基。
- 将6孔板放在培养箱内的自动显微镜板支架上(37°C,5%CO2 和95%湿度)。
- 打开软件,打开第一象限上的明场以调整查看切片所需的曝光。要找到切片的位置(坐标"xy"),请在第二象限上使用"xy"进行导航,以控制显微镜的坐标"xyz"。
- 选择6孔板作为用于本实验的实验室器具。选择ROI地图编辑器,并通过选择新的ROI来注册该位置,添加并保存该ROI。
- 对其他孔中所有其他感兴趣的区域重复相同的步骤。添加完所有投资回报率后,保存所有投资回报率。
- 在"协议"下,选择"清除现有",然后选择"采集"下的"延时",然后选择感兴趣的通道(在本例中为 GFP)。
- 在 对焦 设置中关闭自动 对焦 ,然后手动调整到所有切片的相应对焦。最后,将 明场强度 和 荧光通道激发 和 曝光时间 调整到适当的水平。
- 将实验方案设置为每15分钟获取一次图像,持续48小时。
- 保存并运行协议。在实验结束时,保存的文件将包含为每个ROI捕获的明场和GFP图像。
- 要合并视频中的图像,请使用相同的名称重命名所有感兴趣的图像,后跟二进制数,以按捕获顺序组织它们(例如,ROI1(1),RO1(2)...
- 打开 ImageJ 并通过单击" 文件">"导入>图像序列"来导入图像。选择列表中显示的文件名,然后将文件名的内容写入" 文件名包含 "框中,该框将显示以标识为视频选择的那些文件。
- 将组合的图像保存在 "文件>另存为"> AVI 下。
5. MTS测定和离体 脑组织的免疫组化
- MTS 检测
- 通过沿着组织边缘切割每个切片下方的组织培养膜来切除切片,并将仍然附着在膜上的组织转移到96孔板中。
- 加入MTS试剂,以1:5的比例与培养基和0.01%曲拉通(1x)混合,以允许溶液渗透到组织中,每个孔的总体积为120μL。
- 使用4%多聚甲醛(PFA)作为试剂使脑切片存活,因此本实验的阳性对照。在进行MTS测定之前,将感兴趣的脑切片浸入4%PFA中1小时或在4°C下过夜。
- 让MTS试剂在切片上反应4小时,从孔中取出切片并测量所有条件下490nm处的吸光度,包括没有切片作为参考的空孔。
- 将读数报告为组织切片面积的函数,用数字卡尺测量。
- 免疫组化制备
- 将附着在膜插入面上的脑切片浸入10%福尔马林中,在4°C下过夜。
- 执行包埋,处理,封闭并生成未染色的组织载玻片。使用标准免疫组化染色方案对H&E,Ki-67,γ-H2AX,CC3,GFAP,GFP,DAPI进行染色
6. 离体 脑切片中肿瘤的照射
- 用6 Gy(310 kVp X射线)照射肿瘤。
注意:在考虑R单位(使用Victoreen静电计测量)和顶针,空气密度和cGy / R的校正后,输入的单位为3522个单位,如前所述18。曝光时间为130.9秒。 - 使用 0.25 毫米 Cu + 1 毫米铝添加过滤,50 厘米 SSD,每分钟 125 立方。
- 通过根据主要标准品校准的光束内电离室进行剂量测定。
- 每天对湿度、温度和气压进行校正。
结果
如上所述,将MDA-MB-231BR-GFP-荧光素酶细胞颅内注射到4-6周龄Nu / Nu小鼠的右半球(图1A)并允许生长12-14天,在此期间通过生物发光成像监测肿瘤生长(图1B)。正如其他小组19所报告的那样,我们在颅内注射了100,000个癌细胞,但有可能注射低至20,000个细胞20。如上所述,在脑切片生成(图1C)之后,在IVIS上对切片进行成像,以在孵育24小时后通过生物发光成像确定肿瘤的存在。这被视为第 0 天。通过每48小时定量生物发光信号来监测肿瘤生长,这表明在6天内进行性生长(图1D)。H&E染色和GFP阳性荧光证实了脑切片中存在肿瘤(图1D)。我们还能够检测反应性星形胶质细胞的染色,通过染色胶质纤维酸性蛋白(GFAP)阳性细胞可视化,在癌细胞簇(GFP阳性)之间可见(图1D),类似于 在体内21中看到的。与将癌细胞 离体 接种到小鼠脑切片22中的模型不同,该模型包含反应性星形胶质细胞,这是BCBM肿瘤微环境的一个重要方面。我们还检测到Ki-67染色增加,确认癌细胞具有高度增殖性(图1D)。因此,脑实质内的肿瘤细胞可以在离 体 脑切片内存活和增殖数天,并且还含有肿瘤相关的基质。
照射 (IR) 是临床上出现脑转移瘤患者的首要治疗线之一。为了了解 离体 切片模型如何对这种治疗作出反应,含有MDA-MB-231BR-GFP荧光素酶肿瘤的脑切片暴露于6Gy照射下。未暴露于照射的脑切片中的肿瘤继续 向外生长,而暴露于照射的肿瘤显示出停滞的生长(图2A)。含有MDA-MB-231BR-GFP-荧光素酶肿瘤的脑切片也在第4天后通过实时成像监测48小时,以可视化IR治疗后大脑微环境中的肿瘤生长(图2B)。与生物发光成像一致,对照癌细胞随着GFP强度的增加而迅速生长,并且观察到许多细胞侵入脑实质(视频1)。相比之下,用6Gy IR处理的脑切片中的癌细胞是细胞稳定的,并且GFP强度得以维持(视频2)。H&E染色确认IR处理细胞中较小的肿瘤(图2C)。我们还检测到大型多核癌细胞和红外处理癌细胞中DNA损伤标志物g-H2AX染色的增加(图2C)。在IR处理的切片中未检测到细胞凋亡的增加,这表明IR可以减少增殖(图2C)。然而,检测到反应性星形胶质细胞染色的增加,通过染色GFAP阳性细胞可视化,这些细胞在通过IR处理的癌细胞簇(GFP阳性)周围可见(图2C)。这表明这种 离体 模型也可能有助于理解一些肿瘤基质成分如何对治疗作出反应。此外,我们没有检测到由无肿瘤脑小鼠切片的IR治疗引起的任何细胞凋亡(图2D)。
我们还测试了脑切片中的MDA-MB-231BR预成型肿瘤是否对化疗有反应。将含有MDA-MB-231BR肿瘤的脑切片用不同浓度的紫杉醇(图3A)治疗,紫杉醇是一种用于乳腺癌患者的化疗药物23。治疗减少了通过生物发光信号学量化的肿瘤大小,但这种抑制仅在治疗第10天后才显着(图3A)。这可能是由于对紫杉醇 离体的异质反应。例如,在治疗良好的40 nM中,含有肿瘤的一片切片(顶部)减少,而同一孔中的肿瘤(底部)似乎正在生长。此外,一些较小的肿瘤似乎对紫杉醇更敏感,并表现出生物发光减少,而较大的肿瘤似乎难治(图3A,80nM治疗)。与肿瘤尺寸减小一致,与对照组相比,紫杉醇治疗的肿瘤细胞中检测到细胞凋亡的增加(图3B)。重要的是,使用改编自Mews等人的活力MTS测定来结合triton24的使用,我们测试了抑制剂治疗不会改变脑组织活力(在没有肿瘤的情况下)(图3C)。与此结果一致,我们没有检测和增加细胞凋亡,如在紫杉醇治疗的无肿瘤小鼠脑切片中切割半胱天冬酶3染色测量的那样(图3D)。这些数据表明,该模型可能有助于了解BCBM在大脑微环境中的化疗反应和抵抗。由于该模型的性质,即保存脑肿瘤特性和相互作用的 离体 设置,其本质在于提供BCBM对化疗试剂反应的主要证据,从而从未来的 体内试验中 消除在该模型中不会缩小肿瘤的药物,这些药物对于验证在该模型中提供积极结果的药物的作用仍然至关重要, 生物体的全身反应,以及穿过血脑屏障的能力。
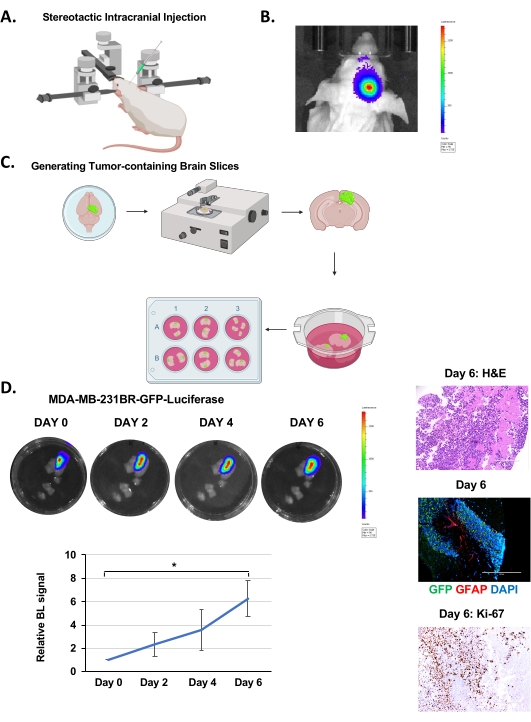
图 1.颅内注射,脑切片生成和BCBM离体生长。(A)在立体定向仪器下颅内注射期间小鼠的示意图。(B)注射后12天注射5×10 5 MDA-MB-231BR-GFP-荧光素酶酶细胞的4-6周龄Nu / Nu小鼠的肿瘤生物发光检测的代表性图像。(C)从(B)生成离体小鼠脑切片的示意图。(D)描述来自颅内注射MDA-MB-231BR-GFP-荧光素酶细胞的小鼠在6天内通过生物发光检测到的有机指型脑切片中肿瘤生长的代表性图像。H&E和Ki-67,GFP(肿瘤细胞)GFAP(反应性星形胶质细胞)DAPI(细胞核)染色具有代表性的脑切片与肿瘤(图像放大倍率为20倍,比例尺:200μm)。肿瘤生长的定量代表相对于第0天(n = 3)的生物发光信号。学生的 t 检验报告为 SEM ±平均值,* p < 0.05。请点击此处查看此图的大图。

图 2.用放射治疗BCBM组织型脑切片。 (A)描述通过生物发光检测到的MDA-MB-231BR-GFP-荧光素酶细胞的小鼠颅内注射的有机指型脑切片中肿瘤生长的代表性图像。肿瘤暴露于没有照射或6 Gy照射(一剂)并允许生长指定的天数。在指示日定量肿瘤生长(对照组n = 3; 6Gy,n = 3)。学生的 t 检验报告为 SEM ± 平均值 <。 (B)每15分钟对脑切片进行48小时的成像。非辐照和辐照样品视频的代表性图像表明肿瘤生长。(C)将(A)中处理的切片固定并测定H&E,g-H2AX,DAPI,裂解半胱天冬酶-3(CC3)和GFP染色(图像放大倍率为20x,比例尺:200μm)。(D)将无瘤小鼠脑切片按(A)中处理,并固定并测定CC3和DAPI(图像放大倍率为20x,比例尺:200μm)。 请点击此处查看此图的大图。

图 3.用紫杉醇治疗BCBM有机指型脑切片。 (A)来自颅内注射MDA-MB-231BR-GFP-荧光素酶细胞的小鼠的脑切片,用DMSO处理或在40 nM,80nM,160nM和320nM治疗紫杉醇10天后,每48小时补充培养基并允许生长指定的天数(图像放大20x,比例尺:200μm)。在指示日(对照n = 6,紫杉醇n = 3)(底部)定量肿瘤生长。学生的 t 检验报告为 SEM ± 平均值 <。 (B)收集,固定并测定(A)中用DMSO或320nM紫杉醇处理的 离体 脑切片,以检测GFP,CC3和DAPI(图像放大倍率为20x,比例尺:200μm)。(C)在第10天收集(A)(无肿瘤)中用DMSO或320nM紫杉醇处理的 离体 脑切片并分析细胞活力(MTS测定)。作为阳性对照,切片用多聚甲醛(PFA)处理,使大脑切片不存活(n = 3)学生的t检验报告为S D)收集,固定并测定CC3和DAPI(图像放大倍率为20x,比例尺:200μm)在(A)(无肿瘤)中处理的 离体 脑切片,用DMSO或320nM紫杉醇治疗。 请点击此处查看此图的大图。
视频 1.BCBM有机结构脑切片的实时成像。 从颅内注射MDA-MB-231BR-GFP-Luciferase细胞的小鼠中提取的脑切片允许生长4天,然后在实时图像显微镜下放置48小时,其中每15分钟拍摄一次图像并组合以使用ImageJ创建视频。 请点击此处下载此视频。
视频 2.辐照BCBM有机结构脑切片的实时成像。 从颅内注射MDA-MB-231BR-GFP-荧光素酶细胞的小鼠中提取的脑切片在切片产生后的第二天进行照射,4天后每15分钟成像一次,持续48小时 。
讨论
本研究建立了一种新的外植异种移植脑肿瘤的 离体 脑培养方法。我们表明,颅内注射在小鼠大脑中的BCBM细胞MDA-MB-231BR细胞可以在 离体 脑切片中存活和生长。该研究还测试了颅内注射的U87MG胶质母细胞瘤(GBM)细胞,还发现这些癌细胞在脑切片中存活和生长(数据未显示)。我们相信这个模型可以从BCBM和GBM扩展到其他容易转移到大脑的癌症,包括肺癌和黑色素瘤。选择颅内注射乳腺癌脑营养细胞,因为它是一种简单快速的脑肿瘤生成方法,并且被认为是脑巨转移的合适模型25。然而,类似的肿瘤切片模型可以从心内接种或原位注射到初级脂肪垫中来开发。通过在无血清培养基中生长成年脑切片并每48小时供应新鲜培养基来优化培养条件,从而更好地保存组织活力以及肿瘤的存活和生长。在培养箱的高氧条件下使用的0.4μm插入物用作 离体 脑切片的结构支撑,并且在缺乏血液供应的情况下,还为组织和肿瘤细胞提供营养物质和氧气的人工供应连接,这似乎足以在培养物中维持组织活力至少十天。实时成像表示肿瘤生长是GFP信号增加的函数。然而,该软件具有最大GFP光度的阈值,该阈值使信号饱和,并且不允许正确识别大脑微环境中的单细胞运动。未来对微观软件信号检测的修改将提高准确报告GFP信号作为肿瘤生长函数的时间增加的能力。
该模型还允许通过免疫组织化学染色监测肿瘤生长和活力。重要的是,该模型将允许快速测试在大脑微环境中生长的肿瘤的辐射敏感性的功效,无论有没有小分子抑制剂。我们表明,该模型适合放射和化疗治疗。此外,该系统可用于组学研究,如蛋白质组学,代谢组学和基因组学,以进一步了解癌症生长和对大脑微环境中治疗的反应。此外,在较短的暴露时间后去除抑制剂时测试肿瘤的潜在复发将允许进一步了解大脑微环境中癌细胞特有的化学阻断途径。
综上所述,我们开发了一种新型异种移植肿瘤组织培养的 离体 脑切片,它将监测肿瘤生长和与脑肿瘤微环境的相互作用,并用于快速筛选治疗剂以阻断大脑中的肿瘤生长。
披露声明
作者没有财务冲突需要声明。
致谢
我们要感谢Julia Farnan,Kayla Green和Tiziana DeAngelis的技术援助。这项工作得到了宾夕法尼亚州联邦通用研究增强资助计划(MJR,JGJ),UO1CA244303(MJR),R01CA227479(NLS),R00CA207855(EJH)和W.W.史密斯慈善信托基金(EjH)的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe, slip tip | BD | 309659 | |
| 30 G1/2 Needles | BD | 305106 | |
| 6-well plates | Genessee | 25-105 | |
| Automated microscope and LUMAVIEW software | Etaluma | LS720 | |
| B27 (GEM21) | Gemini Bio-Products | 400-160 | |
| Beaker 50 mL | Fisher | 10-210-685 | |
| Blunt sable paintbrush, Size #5/0 | Electron Microscopy Sciences | 66100-50 | |
| Bone Wax | ModoMed | DYNJBW25 | |
| Brain injection Syringe | Hamilton Company | 80430 | |
| CaCl2 | Fisher Scientific | BP510-250 | |
| Cleaved caspase 3 Antibody | Cell Signaling | 14220S | |
| DAPI | Invitrogen | P36935 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| Double edge razor blade | VWR | 55411-060(95-0043) | |
| Filter Paper (#1), quantitative circles, 4.25 cm | Fisher | 09-805a (1001-042) | |
| Fine sable paintbrush #2/0 | Electron Microscopy Sciences | 66100-20 | |
| Forceps | Fine Science Tools | 11251-20 | |
| Gamma-H2AX antibody | Millipore | 05-636 | |
| GFAP antibody | Thermo Fisher | 13-0300 | |
| GFP antibody | Santa Cruz | SC-9996 | |
| Glucose | Sigma Aldrich | G8270 | |
| Glutamine (200 mM) | Corning cellgrow | 25-005-Cl | |
| H&E and KI-67 | Jefferson Core Facility Pathology staining | ||
| Hand Drill Set with Micro Mini Twist Drill Bits | Amazon | YCQ2851920086082DJ | |
| HEPES, free acid | Fisher Scientific | BP299-1 | |
| Just for mice Stereotaxic Frame | Harvard Apparatus (Holliston, MA, USA). | 72-6049, 72-6044 | |
| KCl | Fisher Scientific | S271-10 | |
| Large surgical scissors | Fine Science Tools | 14001-18 | |
| MDA-MB-231BR cells | Kindly provided by Dr. Patricia Steeg | Ref 14 | |
| MgCl2·6H2O | Fisher Scientific | M33-500 | |
| Mice imaging device | Perkin Elmer | IVIS 200 system | |
| Mice imaging software | Caliper Life Sciences (Waltham, MA, USA). | Living Image Software | |
| Microplate Reader | Tecan Spark | ||
| Mounting solution | Invitrogen | P36935 | |
| MTS reagent | Promega CellTiter 96 Aqueous One Solution | (Cat:G3582) | |
| N2 supplement | Life Technologies | 17502-048 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nu/Nu athymic mice | Charles Rivers Labs (Wilmington, MA, USA) | ||
| Paraformaldehyde | Affymetrix | 19943 | |
| Pen/Strep | Life Technologies | 145140-122 | |
| Polypropylene Suture | Medex supply | ETH-8556H | |
| Povidone Iodine Swab sticks | DME Supply USA | Cat: 689286X | |
| Scalpel blade #11 (pk of 100) | Fine Science Tools | 10011-00 | |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | |
| Sodium Pyruvate | Sigma Aldrich | S8636 | |
| Spatula/probe | Fine Science Tools | 10090-13 | |
| SS Double edge uncoated razor blades (American safety razor co (95-0043)) | VWR | 55411-060 | |
| Sucrose | Amresco | 57-50-1 | |
| Surgical Scalpel | Exelint International | D29702 | |
| Tissue Chopper | Brinkman | (McIlwain type) | |
| Tissue culture inserts | Millipore | PICMORG50 or PICM03050 | |
| X-ray machine | Precision 250 kVp |
参考文献
- Watase, C., et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives. Cancers. 13 (5), Basel. (2021).
- Niikura, N., et al. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Research and Treatment. 147 (1), 103-112 (2014).
- Fong, E. L., et al. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Parker, J. J., et al. A human glioblastoma organotypic slice culture model for study of tumor cell migration and patient-specific effects of anti-invasive drugs. Journal of Visualized Experiments: JoVE. (125), e53557(2017).
- Chuang, H. N., et al. Coculture system with an organotypic brain slice and 3D spheroid of carcinoma cells. Journal of Visualized Experiments: JoVE. (80), e50881(2013).
- Hohensee, I., et al. PTEN mediates the cross talk between breast and glial cells in brain metastases leading to rapid disease progression. Oncotarget. 8 (4), 6155-6168 (2017).
- van de Merbel, A. F., et al. An ex vivo Tissue culture model for the assessment of individualized drug responses in prostate and bladder cancer. Frontiers in Oncology. 8, 400(2018).
- Martin, S. Z., et al. Ex vivo tissue slice culture system to measure drug-response rates of hepatic metastatic colorectal cancer. BMC Cancer. 19 (1), 1030(2019).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5 (15), 1597-1601 (2006).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Palmieri, D., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Research. 67 (9), 4190-4198 (2007).
- Kyeong, S., et al. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 12 (11), 0188542(2017).
- Hengel, K., et al. Attributes of brain metastases from breast and lung cancer. International Journal of Clinical Oncology. 18 (3), 396-401 (2013).
- Jackson, J. G., et al. Neuronal activity and glutamate uptake decrease mitochondrial mobility in astrocytes and position mitochondria near glutamate transporters. Journal of Neuroscience. 34 (5), 1613-1624 (2014).
- Farnan, J. K., Green, K. K., Jackson, J. G. Ex vivo imaging of mitochondrial dynamics and trafficking in astrocytes. Current Protocols in Neuroscience. 92 (1), 94(2020).
- Simone, N. L., et al. Ionizing radiation-induced oxidative stress alters miRNA expression. PLoS One. 4 (7), 6377(2009).
- Couturier, C. P., et al. Single-cell RNA-seq reveals that glioblastoma recapitulates a normal neurodevelopmental hierarchy. Nature Communications. 11 (1), 3406(2020).
- Candolfi, M., et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. Journal of Neuro-Oncology. 85 (2), 133-148 (2007).
- Fitzgerald, D. P., et al. Reactive glia are recruited by highly proliferative brain metastases of breast cancer and promote tumor cell colonization. Clinical & Experimental Metastasis. 25 (7), 799-810 (2008).
- Kondru, N., et al. An Ex Vivo Brain Slice Culture Model of Chronic Wasting Disease: Implications for Disease Pathogenesis and Therapeutic Development. Scientific Reports. 10 (1), (2020).
- Abu Samaan, T. M., et al. Paclitaxel's mechanistic and clinical effects on breast cancer. Biomolecules. 9 (12), (2019).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice--a model for tauopathy studies. PLoS One. 7 (9), 45017(2012).
- Valiente, M., et al. Brain metastasis cell lines panel: A public resource of organotropic cell lines. Cancer Research. 80 (20), 4314-4323 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。