Method Article
מודל פרוסת מוח Ex Vivo כדי לחקור ולמקד את צמיחת הגידול הגרורתי של סרטן השד במוח
In This Article
Summary
אנו מציגים פרוטוקול למדידת תגובת תרופות וקרינה בזמן אמת של תאים גרורתיים במוח של סרטן השד במודל פרוסת מוח אורגנוטיפית. השיטות מספקות בדיקה כמותית כדי לחקור את ההשפעות הטיפוליות של טיפולים שונים על גרורות במוח מסרטן השד באופן ex vivo בתוך ממשק המיקרו-סביבה של המוח.
Abstract
גרורות במוח הן תוצאה חמורה של סרטן השד עבור נשים מכיוון שגידולים אלה קשים לטיפול וקשורים לתוצאות קליניות גרועות. מודלים פרה-קליניים של עכברים של גדילה גרורתית של סרטן השד במוח (BCBM) הם שימושיים אך הם יקרים, וקשה לעקוב אחר תאים חיים ופלישה של תאי גידול בתוך הפרנכימה המוחית. מוצג כאן פרוטוקול לתרביות פרוסות מוח ex vivo מעכברים עם קסנוגרפט המכילים תתי-שורות קלונליות תוך גולגולתיות של סרטן שד מוזרקות באופן תוך גולגולתי. תאים מתויגים של MDA-MB-231BR luciferase הוזרקו באופן תוך גולגולתי לתוך מוחם של עכברי נקבות Nu/Nu, ובעקבות היווצרות הגידול, המוחות בודדו, נחתכו ותרביתו ex vivo. פרוסות הגידול צולמו כדי לזהות תאים סרטניים המבטאים לוציפראז ולנטר את התפשטותם ופלישתם בפרנכימה המוחית במשך עד 10 ימים. יתר על כן, הפרוטוקול מתאר את השימוש במיקרוסקופיה של קיטועי זמן כדי לדמות את הצמיחה וההתנהגות הפולשנית של תאי הגידול לאחר הטיפול בקרינה מייננת או בכימותרפיה. ניתן לדמיין את התגובה של תאי הגידול לטיפולים על ידי מיקרוסקופיה של הדמיה חיה, מדידת עוצמת הביולומינסנציה וביצוע היסטולוגיה על פרוסת המוח המכילה תאי BCBM. לפיכך, מודל פרוסת ex vivo זה עשוי להיות פלטפורמה שימושית לבדיקה מהירה של חומרים טיפוליים חדשניים בלבד או בשילוב עם קרינה כדי לזהות תרופות המותאמות אישית כדי להתמקד בצמיחה גרורתית של סרטן השד של מטופלת בודדת בתוך המיקרו-סביבה במוח.
Introduction
גרורות במוח של סרטן השד (BCBM) מתפתחות כאשר תאים מתפשטים מגידול השד הראשוני למוח. סרטן השד הוא הגורם השני בשכיחותו לגרורות במוח לאחר סרטן הריאות, כאשר גרורות מתרחשות אצל 10-16% מהחולות1. למרבה הצער, גרורות במוח עדיין חשוכות מרפא מכיוון >80% מהחולים מתים תוך שנה לאחר אבחון גרורות במוח, ואיכות חייהם נפגעת עקב תפקוד נוירולוגי2. יש צורך דחוף לזהות אפשרויות טיפול יעילות יותר. מודלים דו-ממדיים או תלת-ממדיים של תרביות חד-ממדיות הם השיטות הנפוצות ביותר בבדיקת חומרים טיפוליים במעבדה. עם זאת, הם אינם מחקים את המיקרו-סביבה המורכבת של BCBM, גורם עיקרי לפנוטיפ הגידול ולצמיחה. למרות שמודלים אלה שימושיים, הם אינם לוכדים את האינטראקציות המורכבות בין הגידול לסטרומל, את הדרישות המטבוליות הייחודיות ואת ההטרוגניות של הגידולים3. כדי לשחזר באופן נאמן יותר את האינטראקציות בין הגידול לסטרומל ואת ההטרוגניות של המיקרו-סביבה, הקבוצה שלנו ואחרים החלו ליצור תרביות "פרוסות" של גרורות מוחיות אורגנוטיפיות עם תאי גידול שמקורם בחולה (ראשוניים או גרורתיים) או קווי תאים סרטניים 4,5,6. בהשוואה למערכות מבחנה קלאסיות, מודל ex vivo קצר טווח זה עשוי לספק תנאים רלוונטיים יותר לבדיקת טיפולים חדשים לפני הערכה פרה-קלינית בקבוצות גדולות של בעלי חיים.
מודלים של Ex vivo נבנו ושימשו בהצלחה בעיקר לזיהוי טיפולים מוצלחים בסוגי סרטן שונים. הם דורשים כמה ימים של הערכה ובנוסף ניתן להתאים אותם לבדיקת תרופות ספציפיות למטופל. לדוגמה, רקמות ex vivo של שלפוחית השתן והערמונית האנושיות הראו תגובה אנטי-סרטנית תלוית מינון של דוקטקסל וגמציטאבין7. רקמות קרצינומה מעי גס דומות ex vivo פותחו כדי לסנן תרופות כימותרפיות Oxaliplatin, Cetuximab, ו Pembrolizumab8. יישום זה נמצא בשימוש נרחב בסרטן הלבלב, בהתחשב באינטראקציה החיונית בין הסביבה הסטרומלית לבין המאפיינים הגנוטיפיים והפנוטיפיים של אדנוקרצינומה של צינור הלבלב 9,10. יתר על כן, מודלים אורגנוטיפיים כאלה פותחו עבור בדיקות דומות בגידולי ראש, צוואר, קיבה ושד11,12.
כאן נוצר מודל פרוסת מוח ex vivo של תאי גידול גרורתיים של סרטן שד קסנוגרטיבי במוח במיקרו-סביבה שלהם. עכברים הוזרקו להם באופן תוך גולגולתי תאי MDA-MB-231BR טרופיים של סרטן השד במוח, 13 באונה הקודקודית של קליפת המוח - אתר נפוץ של גרורות TNBC14,15 והותר להם לפתח גידולים. פרוסות מוח נוצרו מחיות קסנוגרות אלה ושמרו על ex vivo כתרביות אורגנוטיפיות כמתואר16,17. מודל ex vivo חדשני זה מאפשר ניתוח של גדילת תאי BCBM בתוך הפרנכימה המוחית וניתן להשתמש בו כדי לבחון חומרים טיפוליים והשפעות קרינה על תאי הגידול בתוך המיקרו-סביבה של המוח.
Protocol
פרוטוקול זה אושר ועוקב אחר הנחיות הטיפול בבעלי חיים על ידי הוועדה המוסדית לטיפול בבעלי חיים של בית הספר לרפואה של אוניברסיטת דרקסל (IACUC). במחקר זה נעשה שימוש בעכברים נקבות נו/נו אתימיות (בנות 6-8 שבועות).
1. הזרקה תוך גולגולתית של תאי הגידול
- לעקר את כל הציוד (פינצטה, מספריים, מספריים תפירה, מקדחה ביד) תחת מחזור יבש של אוטוקלאב למשך עד 45 דקות בשקיות עיקור, כולל מחוון עיקור. אם מבצעים ניתוחים בבעלי חיים מרובים, יש לעקר כלים בין בעלי חיים באמצעות מעקר חרוזים מחומם (עד פי 3).
- מרדימים את העכברים על פי פרוטוקול הטיפול בבעלי חיים של המשתמשים (למשל, איזופלורן (4% לאינדוקציה, 1-2% תחזוקה) ומנהלים משכך כאבים (תת עורי, 0.1 מ"ל של 0.1 מ"ג/ק"ג בופרנורפין SR-LAB) לפני תחילת הניתוח. הקפידו על עומק הרדמה אופטימלי עם צביטה בבוהן.
- הכניסו את העכברים למסגרת סטריאוטקסית ושיתקו את הראש באמצעות מוטות אוזניים סטנדרטיים (איור 1A). יש למרוח משחה אופטלמית על העיניים.
- לעקר את פני השטח של הראש על ידי יישום חוזר לסירוגין (3x) של מטושים יוד ו 70% אתנול לפני החתך.
- השתמשו באזמל כירורגי כדי ליצור חתך בקו האמצע באורך 1 ס"מ דרך העור בזווית מעט אלכסונית לקו הדמיוני שמחלק את מוחם של העכברים לשני חצאים סימטריים כדי לחשוף את הגולגולת. נגבו כל דם עם צמר גפן.
- הסטת העור לרוחב כדי לחשוף את אתר ההזרקה: 2 מ"מ מימין, 1 מ"מ קדימה עם התייחסות לברגמה (+2 מדיולטרלי (+2ML), +1 רוסטרל/קאודל (+1RC).
- השתמש בביט בור (0.73 מ"מ) כדי לחדור את הגולגולת +2ML, +1RC לברגמה ולקדוח חור באמצעות לחץ קל ותנועת פיתול.
- השתמש במזרק הזרקת מוח כדי להזריק 5 μL של 100,000 MDA-MB-231BR (מבטא ביציבות GFP-Luciferase) תאים / μL תמיסה ב- PBS סטרילי 1x על ידי החדרת המזרק בתחילה לעומק של 3.5 מ"מ למוח.
- אפשרו למזרק להסתפק במשך 2 דקות. משכו אותו למעלה כ-1 מ"מ, ולאחר 2 דקות, הזריקו באיטיות את המחצית הראשונה של הווליום.
- המתן עוד 2 דקות לפני שתזריק את השאר, ואז משך באיטיות את המזרק 3 דקות לאחר הזריקה הסופית.
הערה: הזרקה איטית היא אמפירית בכך שהיא מאפשרת לנפח להיספג היטב ברקמת המוח ולא ליצור דליפה לאחר משיכת המזרק, מה שעלול להוביל לכך שתאים סרטניים יגדלו מחוץ לאתר המיועד. - יש למרוח שעוות עצם על אתר ההזרקה שעל הגולגולת ולאחר מכן להשתמש בתפרים פוליפרופילן כדי לתפור את הרקמה. עכברים יתאוששו תוך 5 דקות לאחר הסרת ההרדמה.
- עקוב אחר התנהגותם מיד לאחר הניתוח במשך כ -10 דקות, 3 שעות מאוחר יותר ולמחרת כדי לקבוע אם יש צורך בטיפול מיוחד, כולל הזרקת מלח, מזון רך וכו ', כדי לסייע בהתאוששות מהירה.
- עקוב אחר צמיחת הגידול באמצעות הדמיית bioluminescence במערכת ההדמיה.
- לשם כך, ראשית, להפעיל את החמצן ואת האיזופלורן על מערכת ההדמיה. אפשרו להפיץ את שניהם לתא הנפרד מחוץ לתיבת ההדמיה.
- לאחר מכן, הפעל את התוכנה, אתחל את המכשיר ובחר את האפשרות המתאימה להדמיה וללכידה של כל גוף העכבר.
- מניחים את העכברים בתא הנפרד עם איזופלורן ומבטיחים עומק הרדמה אופטימלי עם צביטה בבוהן. הזריקו לעכברים באופן תוך-צפקי עם 200 μL של 30 מ"ג/מ"ל לוציפרין.
- מעבירים את קיבת העכברים אל האף של תא ההדמיה המסופק עם חמצן ואיזופלורן. נעל את התא, ובחר חשיפה של שעתיים כדי להתחיל בהדמיה.
- השתמש בכלי ROI (אזור העניין) של התוכנה כדי לכמת את האות הביולומינסנטי של הגידול.
- כדי לנתח את גודל הגידול, בחר את כלי צורת העיגול, התאים אותו סביב צורת הגידול וגודלו. מדוד את ההחזר על ההשקעה ודווח על סך הקריאות.
- אפשר צמיחה של גידול מוצק למשך 12-14 יום (או עד שלוציפראז מגיע לכ-7.0 x 106 יחידות) (איור 1B) לפני יצירת פרוסות מוח.
הערה: הגדלת מספר התאים שיש להזריק תוביל לצמיחה מהירה יותר של הגידול; לכן, הדור של פרוסות המוח יכול להתרחש מוקדם יותר מ -12 ימים. מצד שני, גידול גדול יותר יוביל ליותר פרוסות GFP+ אם יורשה לו לגדול במשך 14 יום. לאחר 14 יום, בריאותם של העכברים מתחילה להידרדר במהירות; לפיכך יש להגביר את ניטור בריאות בעלי החיים לפעם אחת ביום לאחר נקודת הזמן של 10 ימים, וכל העכברים המציגים סימני כאב ו /או אי נוחות צריכים לשמש ליצירת הפרוסות.
2. צור פרוסות מוח
הערה: בצע את השלבים לאחר בידוד המוח במכסה זרימה למינרי סטרילי. בדרך כלל ניתן ליצור 35-40 פרוסות בודדות המכילות תאי גידול (אות לוציפראז) מעכבר אחד שהוזרק לו תאי MDA-MB-231BR (איור 1C).
- לעקר את כל כלי הניתוח באוטוקלב. מניחים את חותך הרקמות במכסה הזרימה הלמינרי הסטרילי ומנקים את כל הכלים והמכשירים עם 70% אתנול.
- לאחר 12-14 ימים לאחר הזרקת תאי MDA-MB-231BR תוך גולגולתיים, מרדימים את העכברים על פי פרוטוקול הטיפול בבעלי חיים של המשתמשים כמתואר ב-1.2. הקפידו על עומק הרדמה אופטימלי עם צביטה בבוהן.
- הסר והנח את מוחם במהירות (בטווח של 45 שניות) לתוך סוכרוז-ACSF קר כקרח (4 מעלות צלזיוס) המורכב מהבאים: 280 mM סוכרוז, 5 mM KCl, 2 mM MgCl2, 1 mM CaCl2, 20 mM גלוקוז, 10 mM HEPES, 5 mM Na+-ascorbate, 3 mM thiourea, 2 mM Na+, 29 mM pyruvate; pH=7.3.
- באמצעות אזמל חד וסטרילי או סכין גילוח, חותכים חלקים עודפים במוח שאינם מכילים שום גידול מכל הצדדים, כולל החלק התחתון של המוח.
- הביאו את צורת המוח לקובייה לא מושלמת כדי לשבת שטוח על נייר המסנן הרטוב ACSF על מכסה צלחת 60 מ"מ כדי להקל על החיתוך.
הערה: רקמה נוספת של המוח שבה לא סביר שהגידול גדל מוסרת לפני החיתוך כדי לאפשר יצירת פרוסות GFP+ בעיקר וליצור צורה של המוח היציבה על פני המכשיר ולא תופרע על ידי התנודות הנגרמות על ידי החיתוך. - הניחו מספר גיליונות של עיגולי נייר מסנן טרום-רטובים (עם ACSF) על פלטפורמת החיתוך והניחו את הרקמה החסומה על גבי זה.
- הגדר את גודל החיתוך במכשיר ל- 2 או 2.5 יחידות בסרגל שסופק כדי לפרוס את הרקמה למקטעים של 200-250 מיקרומטר.
הערה: פרוסות של עד 350 מיקרומטר או דקות עד 100 מיקרומטר הן בנות קיימא. עבור פרוסות <200 מיקרומטר, השתמש בוויברטום או בדחיסה. - השתמשו במכחול (סייבל) כדי להעביר פרוסות מוח לתוך צלחת המכילה סוכרוז ACSF ולהפריד את הפרוסות תחת מיקרוסקופ אור באמצעות מחטים של 27 גרם.
- זהה פרוסות חיוביות של GFP תחת המיקרוסקופ הפלואורסצנטי והעביר אותן למנה חדשה של 60 מ"מ המכילה 2-3 מ"ל של מדיית פרוסות למבוגרים (תוסף נוירובאסל A, 2% תוסף B12, תוסף N2 1%, 1% גלוטמין, 0.5% גלוקוז, 10 פניצילין U/mL ו-100 מיקרוגרם/מ"ל סטרפטומיצין) באמצעות פיפטה סטרילית של 1 מ"ל שבורה (פתיחה רחבה).
הערה: פרוסות המוח המכילות תאי גידול הגדלים על פני השטח של המוח (אולי עקב דליפת תאי הזרקה וכו ') אינן נכללות. - מעבירים 3-5 פרוסות על כל 30 מ"מ, 0.4 מיקרומטר נקבובית בגודל תרבית נקבובית מכניסים בצלחות של 6 בארות במרחק שאינו מאפשר צמיחה זה לתוך זה.
- הסר את המדיום העודף מפני השטח של התוסף באמצעות פיפטה P1000, הוסף 1 מ"ל של מדיום פרוסת עכבר בוגר מתחת לכל תוספת ואזזן את המדיה באינקובטור לפני החיתוך.
- דגירה של הרקמות בטמפרטורה של 37 מעלות צלזיוס, 5% CO2 ו-95% לחות למשך 24 שעות לפני ההדמיה.
3. הדמיית IVIS של פרוסות
הערה: בצעו שלבי תוספת לוציפראז ומעכבים במכסה זרימה למינרי סטרילי.
- פיפטה 5 μL של תמיסת לוציפרין של 30 מ"ג/מ"ל לתוך המדיום שמתחת לתוספות על ידי הרמת התוספת עם מלקחיים והנחתם בחזרה לתוך הבאר לאחר הוספת לוציפרין למדיה בבאר.
- הניחו את צלחת 6 הבארות עם המכסה בתוך תא ההדמיה של המכשיר מתחת למצלמה הנייחת ונעלו את דלת התא.
- פתח את התוכנה ואתחל את המכשיר.
- בחר הגדרות מצלמה המאפשרות תצוגה חזותית וצילום של באר אחת בלבד לכל תמונה. הזז את הבמה למעלה (FOV של 5 ס"מ) והנח את הבאר שיש לצלם ישירות מתחת למצלמה.
- הגדר את זמן ההדמיה למתאים ביותר בהתאם לעוצמת הלוציפראז שהגידול יפלוט, שיכול לנוע בין 10 שניות ל -5 דקות. התחילו בהגדרתו ל-10 שניות ולאחר מכן הגדילו אם האות נמוך אך שמרו עליו עקבי עבור כל נקודות הזמן והתנאים עד סוף הניסוי (איור 1D).
- השתמש בכלי ROI (כלי בצורת עיגול), התאם אותו סביב הצורה והגודל של הגידול, מדוד את ההחזר על ההשקעה ודווח על הקריאות הכוללות כדי לכמת את האות הביו-לומינסצנטי של כל גידול על הפרוסה.
- החזירו את הצלחת למכסה המנוע הסטרילי של הזרימה הלמינרית, השתמשו במלקחיים כדי להרים מעט את התוספת מהבאר.
- לשאוף את המדיום, להחליף אותו עם 1 מ"ל של מדיום טרי ולהניח את התוספת בחזרה לבאר.
- לניסויים שבהם הפרוסות מטופלות בתרכובות שונות כגון מעכבים, מטבוליטים וכו', הכינו את הריכוז המתאים של המגיב ב-1.2 מ"ל של מדיית פרוסת המוח בצינור של 1.5 מ"ל ואז העבירו 1 מ"ל לבאר המכילה את הפרוסה.
- חזור על תהליך זה כל 48 שעות למשך המחקר.
4. הדמיה חיה של צמיחת הגידול בפרוסות המוח ex vivo
הערה: אספקת תוספות עם מספיק תווך (1.5 מ"ל) כדי להחזיק מעמד לאורך הניסוי מכיוון שלא ניתן להוסיף מדיום נוסף במהלך ההדמיה החיה.
- הניחו את לוחית 6 הקידוחים על מחזיק לוחית המיקרוסקופ האוטומטית בתוך האינקובטור (37 מעלות צלזיוס, 5% CO2 ו-95% לחות).
- פתחו את התוכנה, הפעילו את Brightfield על הרביע הראשון כדי להתאים את החשיפה הדרושה כדי להציג את הפרוסות. כדי למצוא את המיקום (קואורדינטות "xy") של הפרוסה, נווט עם "xy" על הרביע השני כדי לשלוט בקואורדינטות "xyz" של המיקרוסקופ.
- בחר צלחת 6-well כמו כלי המעבדה המשמש לניסוי זה. בחר את עורך מפת ההחזר על ההשקעה ורשום מיקום זה על-ידי בחירת החזר השקעה חדש, הוסף ושמור את ההחזר על ההשקעה.
- חזור על אותם שלבים עבור כל אזורי העניין האחרים בבארות אחרות. לאחר הוספת כל ה- ROIs, שמור את כל ה- ROIs.
- תחת פרוטוקול, בחר נקה קיים ובחר Time-Lapse תחת רכישה, ולאחר מכן בחר את ערוצי העניין (במקרה זה GFP).
- כבה את המיקוד האוטומטי בהגדרת המיקוד והתכוונן באופן ידני למיקוד המתאים עבור כל הפרוסות. לבסוף, התאם את עוצמת ברייטפילד ואת עירור הערוץ הפלואורסצנטי ואת זמן החשיפה לרמה המתאימה.
- הגדר את הפרוטוקול לרכישת תמונות כל 15 דקות למשך 48 שעות.
- שמור והפעל את הפרוטוקול. בסיום הניסוי, הקובץ שנשמר יכיל גם את תמונות brightfield וגם את תמונות ה-GFP שצולמו עבור כל ROI.
- כדי לשלב את התמונות בסרטון, שנה את שם כל התמונות המעניינות עם אותו שם ואחריו מספר בינארי כדי לארגן אותן לפי הסדר שבו הן צולמו (למשל, ROI1 (1), RO1 (2) ...)
- פתח את ImageJ ויבא את התמונות על-ידי לחיצה על קובץ > ייבוא רצף תמונות >. בחר את שמות הקבצים המופיעים ברשימה וכתוב את תוכן שם הקבצים בתיבה 'שם הקובץ מכיל' שיופיעו כדי לזהות את הקבצים שנבחרו עבור הסרטון.
- שמור את התמונות המשולבות תחת קובץ > שמור כ- AVI >.
5. בדיקת MTS ואימונוהיסטוכימיה של רקמת המוח ex vivo
- בדיקת MTS
- הבלו את הפרוסות על ידי חיתוך קרום תרבית הרקמה שמתחת לכל פרוסה לאורך שולי הרקמה והעבירו את הרקמה, שעדיין מחוברת לממברנה, לצלחת של 96 בארות.
- הוסף את מגיב ה- MTS המעורב ביחס של 1:5 עם מדיית תרבית ו- 0.01% טריטון (1x) כדי לאפשר חדירה של התמיסה ברקמה, בנפח כולל של 120 μL בכל באר.
- השתמש ב-4% Paraformaldehyde (PFA) כסוכן כדי להפוך את פרוסות המוח לבלתי ניתנות לערעור, ובכך שליטה חיובית לניסוי זה. טבלו את פרוסת העניין במוח ב-4% PFA למשך שעה אחת ב-RT (טמפרטורת החדר) או למשך הלילה ב-4 מעלות צלזיוס לפני שתמשיכו עם בדיקת ה-MTS.
- אפשרו לריאגנט MTS להגיב על הפרוסות במשך 4 שעות, הסירו את הפרוסות מהבארות ומדדו את הספיגה ב-490 ננומטר עבור כל התנאים, כולל באר ריקה ללא פרוסה כהפניה.
- דווחו על הקריאות כפונקציה של שטח פרוסת הרקמה, הנמדדת באמצעות סרגל קליפר דיגיטלי.
- הכנה לאימונוהיסטוכימיה
- טבלו את פרוסות המוח המחוברות למשטח החדרת הממברנה ב-10% פורמלין למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
- בצע הטמעה, עיבוד, חסימה וצור שקופיות לא מוכתמות של הרקמה. השתמש בפרוטוקול צביעה אימונוהיסטוכימיה סטנדרטי כדי להכתים עבור H&E, Ki-67, גמא-H2AX, CC3, GFAP, GFP, DAPI
6. הקרנה של גידול בפרוסות מוח ex vivo
- להקרין את הגידול עם 6 Gy (310 kVp צילומי רנטגן).
הערה: היחידות שהוזנו כדי לקבל את המינון הכולל של 6 Gy הן 3522 יחידות לאחר ששקלו יחידות R (שנמדדו באמצעות אלקטרומטר ויקטורין) ותיקונים עבור thimble, צפיפות האוויר ו- cGy/R כפי שתואר קודם לכן18. זמן החשיפה הוא 130.9 שניות. - השתמש 0.25 מ"מ Cu + 1 מ"מ אל הוסיף סינון, 50 ס"מ SSD, 125 cGy לדקה.
- בצע דוזימטריה על ידי תא יינון בתוך הקרן המכויל כנגד תקן ראשי.
- בצע תיקונים מדי יום עבור לחות, טמפרטורה ולחץ ברומטרי.
תוצאות
תאי MDA-MB-231BR-GFP-Luciferase הוזרקו באופן תוך גולגולתי לתוך ההמיספרה הימנית של עכברי Nu/Nu בני 4-6 שבועות כפי שהוסבר לעיל (איור 1A) והורשו לגדול במשך 12-14 ימים, שבמהלכם ניתן היה לנטר את צמיחת הגידול על ידי הדמיית ביולומינסנציה (איור 1B). הזרקנו 100,000 תאים סרטניים באופן תוך גולגולתי כפי שדווח על ידי קבוצות אחרות19, אבל אפשר להזריק עד 20,000 תאים20. לאחר יצירת פרוסות מוח (איור 1C), כפי שתואר לעיל, צולמו פרוסות על ה-IVIS כדי לקבוע את נוכחות הגידול באמצעות הדמיה ביולומינסנטית לאחר דגירה של 24 שעות. זה נחשב ליום 0. צמיחת הגידולים נוטרה על ידי כימות איתות ביולומינסנטי כל 48 שעות, מה שהצביע על צמיחה הדרגתית במשך 6 ימים (איור 1D). צביעת H&E ופלואורסצנציה חיובית ל-GFP מאשרות את נוכחותו של גידול בפרוסת המוח (איור 1D). הצלחנו גם לזהות כתמים של אסטרוציטים תגובתיים, שהודמיינו על ידי צביעה עבור תאים חיוביים של חלבון חומצי גליאלי (GFAP), הנראים בין אשכול התאים הסרטניים (GFP-positive) (איור 1D) בדומה למה שנראה ב-vivo21. שלא כמו מודלים המחסנים תאים סרטניים ex vivo לתוך פרוסת מוח עכבר22, מודל זה מכיל אסטרוציטים תגובתיים המהווים היבט חשוב של המיקרו-סביבה של גידול BCBM. אנו גם מזהים צביעת Ki-67 מוגברת המאשרת שתאים סרטניים מתרבים מאוד (איור 1D). לפיכך, תאי הגידול בתוך הפרנכימה המוחית יכולים לשרוד ולהתרבות בתוך פרוסת מוח ex vivo במשך מספר ימים וגם להכיל סטרומה הקשורה לגידול.
הקרנה (IR) היא אחת משורות הטיפול הראשונות בחולים המציגים גרורות במוח במרפאה. כדי להבין כיצד המודל של פרוסת ex vivo יגיב לטיפול כזה, פרוסות מוח המכילות גידולי MDA-MB-231BR-GFP לוציפראז נחשפו להקרנה של 6Gy. גידולים בפרוסות מוח שלא נחשפו להקרנה המשיכו לגדול ב-ex vivo, בעוד שגידולים שנחשפו להקרנה הראו צמיחה מעוותת (איור 2A). פרוסות מוח המכילות גידולי MDA-MB-231BR-GFP-Luciferase נוטרו גם באמצעות הדמיה חיה במשך 48 שעות לאחר היום הרביעי כדי לדמיין את צמיחת הגידולים במיקרו-סביבה של המוח לאחר טיפול ב-IR (איור 2B). בהתאם להדמיה ביולומינסנטית, תאי סרטן בקרה נראים גדלים במהירות ככל שעוצמת ה-GFP עולה ומספר תאים נראים פולשים לפרנכימה המוחית (וידאו 1). לעומת זאת, תאים סרטניים בפרוסות מוח שטופלו ב-6Gy IR הם ציטוסטטיים, ועוצמת ה-GFP נשמרת (וידאו 2). צביעת H&E מאשרת גידולים קטנים יותר בתאים שטופלו ב-IR (איור 2C). זיהינו גם תאים סרטניים גדולים מרובי גרעינים ועלייה בכתמים של סמן הנזק לדנ"א g-H2AX בתאים סרטניים שטופלו ב-IR (איור 2C). לא זוהתה עלייה באפופטוזיס בפרוסות שטופלו ב-IR, מה שמרמז על כך ש-IR עשוי להפחית את ההתפשטות (איור 2C). אף על פי כן, זוהתה עלייה בכתמים באסטרוציטים תגובתיים, שהומחשה על ידי צביעה עבור תאים חיוביים ל-GFAP, הנראים סביב אשכול התאים הסרטניים (GFP-positive) שטופלו על-ידי IR (איור 2C). זה מצביע על כך שמודל ex vivo זה עשוי להיות שימושי גם בהבנת האופן שבו חלק ממרכיבי הגידול-סטרומה מגיבים לטיפולים. בנוסף, לא זיהינו שום אפופטוזיס שנגרם על ידי טיפול IR בפרוסות עכברי מוח ללא גידול (איור 2D).
בדקנו גם אם גידולים בעלי מבנה מקדים של MDA-MB-231BR בפרוסות המוח יגיבו לכימותרפיה. פרוסות המוח שהכילו גידולי מד"א-MB-231BR טופלו בריכוזים שונים של פקליטקסל (איור 3A), תרופה כימותרפית המשמשת בחולות סרטן שד23. הטיפול הפחית את גודל הגידול כפי שכומת על ידי איתות ביולומינסנטי, אך עיכוב זה היה משמעותי רק למחרת 10 של הטיפול (איור 3A). ייתכן שהסיבה לכך היא תגובה הטרוגנית לפקליטקסל ex vivo. לדוגמה, ב 40 ננומטר מטופל היטב, פרוסה אחת המכילה גידול (למעלה) מצטמצם בעוד הגידול (התחתון) באותה באר נראה גדל. כמו כן, נראה כי חלק מהגידולים הקטנים יותר היו רגישים יותר לפקליטקסל והפגינו ירידה בביולומינסנציה, בעוד שהגידולים הגדולים יותר נראו עקשנים (איור 3A, טיפול ב-80 ננומטר). בהתאם לירידה בגודל הגידול, זוהתה עלייה באפופטוזיס בתאי הגידול שטופלו בפקליטקסל בהשוואה לבקרות (איור 3B). חשוב לציין, תוך שימוש בבדיקת MTS כדאיות כפי שהותאם על ידי Mews et al. כדי לשלב את השימוש בטריטון24, בדקנו שטיפול במעכבים לא שינה את הכדאיות של רקמת המוח (בהיעדר גידול) (איור 3C). בהתאם לתוצאה זו, לא זיהינו והגברנו את האפופטוזיס כפי שנמדד על ידי צביעת קספאזה 3 מבוקעת בפצליטקסל ללא גידולים שטופלו בפקליטקסל (איור 3D). נתונים אלה מצביעים על כך שמודל זה עשוי לסייע בהבנת התגובה הכימותרפית והעמידות של BCBM בתוך מיקרו-סביבה במוח. בשל אופיו של המודל, הגדרת ex vivo המשמרת את תכונות המוח-גידול ואת האינטראקציה, חיוניותו עומדת במתן עדות ראשונית לתגובת BCBM לריאגנטים כימותרפיים ובכך לחסל תרופות שאינן מכווצות את הגידול במודל זה מניסויים עתידיים in vivo , אשר עדיין חיוניים באימות ההשפעה של תרופות המספקות תוצאות חיוביות במודל זה, את התגובה המערכתית באורגניזם, ואת היכולת לחצות את מחסום הדם-מוח.
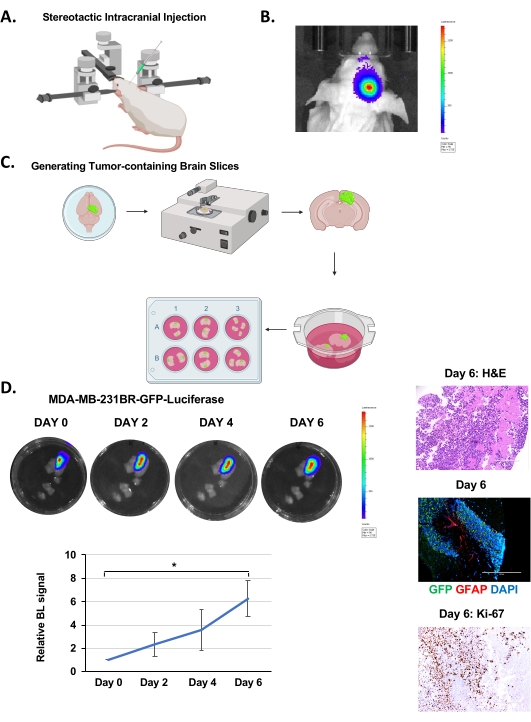
איור 1. הזרקה תוך גולגולתית, יצירת פרוסות מוח וצמיחת BCBM ex vivo. (A) ייצוג סכמטי של עכבר במהלך הזרקה תוך גולגולתית תחת מכשיר סטריאוטקטי. (B) תמונות מייצגות של זיהוי ביולומינסנט של גידולים מעכברי Nu/Nu בני 4-6 שבועות שהוזרקו להם 5 x 105 5 תאי MDA-MB-231BR-GFP-Luciferase 12 יום לאחר ההזרקה. (C) ייצוג סכמטי של יצירת פרוסות מוח של עכברי ex vivo מ-(B). (D) תמונות מייצגות המתארות את צמיחת הגידול בפרוסות מוח אורגנוטיפיות שמקורן בעכברים שהוזרקו באופן תוך גולגולתי עם תאי MDA-MB-231BR-GFP-Luciferase שזוהו באמצעות ביולומינסנציה במשך 6 ימים. H&E &Ki-67, GFP (תאי גידול) GFAP (אסטרוציטים תגובתיים) DAPI (גרעין) צביעה של פרוסת מוח מייצגת עם גידול (הגדלת תמונה 20x, סרגל קנה מידה: 200 מיקרומטר). כימות גדילת הגידול מייצג אות ביולומינסנציה ביחס ליום 0 (n = 3). מבחן t של התלמיד דווח כממוצע ± SEM, * p < 0.05. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2. טיפול בפרוסות מוח אורגנוטיפיות BCBM עם קרינה. (A) תמונות מייצגות המתארות את צמיחת הגידול בפרוסות מוח אורגנוטיפיות שמקורן בעכברים שהוזרקו באופן תוך גולגולתי לתאי MDA-MB-231BR-GFP-Luciferase שזוהו באמצעות ביולומינסנציה. גידולים נחשפים ללא הקרנה או הקרנה של 6 Gy (מנה אחת) ומותר להם לגדול במשך הימים המצוינים. כימות צמיחת הגידול ביום המצוין (שליטה. n = 3; 6Gy, n=3). מבחן t של התלמיד דווח כממוצע ± SEM. * p < 0.05. (B) פרוסות מוח צולמו במשך 48 שעות כל 15 דקות. תמונות מייצגות של סרטונים של דגימות לא מוקרנות ומוקרנות מצביעות על צמיחת הגידול. (C) פרוסות, כפי שטופלו ב-(A), תוקנו ונבדקו עבור H&E, g-H2AX, DAPI, cleaved-Caspase-3 (CC3) וצביעת GFP (הגדלה של תמונה 20x, סרגל קנה מידה: 200 מיקרומטר). (D) פרוסות מוח של עכברים ללא גידולים טופלו כמו ב-(A) והן תוקנו ונבדקו עבור CC3 ו-DAPI (הגדלה של תמונה 20x, סרגל קנה מידה: 200 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3. טיפול בפרוסות מוח אורגנוטיפיות BCBM עם פקליטקסל. (A) פרוסות מוח המופקות מעכברים שהוזרקו להם באופן תוך גולגולתי תאי MDA-MB-231BR-GFP-Luciferase שטופלו ב-DMSO או לאחר טיפול בפקליטקסל ב-40 ננומטר, 80 ננומטר, 160 ננומטר ו-320 ננומטר למשך 10 ימים, המחדשים את המלאכה כל 48 שעות ומאפשרים להם לגדול במשך הימים המצוינים (הגדלה של התמונה 20x, סרגל קנה מידה: 200 מיקרומטר). כימות צמיחת הגידול ביום המצוין (שליטה n = 6, פקליטקסל n = 3) (למטה). מבחן t של התלמיד דווח כממוצע ± SEM. * p < 0.05. (B) פרוסת מוח Ex vivo כפי שטופלה ב-(A) עם DMSO או 320 ננומטר פקליטקסל נאספו, תוקנו ונבדקו עבור GFP, CC3 ו-DAPI (הגדלת תמונה 20x, סרגל קנה מידה: 200 מיקרומטר). (C) פרוסת מוח Ex vivo כפי שטופלה ב-(A) (ללא גידול) עם DMSO או 320 ננומטר פקליטקסל נאספו ביום 10 ונותחו לצורך בדיקת MTS). כבקרה חיובית, פרוסות טופלו באמצעות paraformaldehyde (PFA) שהופך את פרוסות המוח לבלתי ניתנות לערעור (n = 3) בדיקת t של התלמיד דווחה כממוצעת ± SEM. * p < 0.05. (D) פרוסת מוח Ex vivo כפי שטופלה ב-(A) (ללא גידול) עם DMSO או 320 ננומטר פקליטקסל נאספו, תוקנו ונבדקו עבור CC3 ו-DAPI (הגדלת תמונה 20x, סרגל קנה מידה: 200 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
סרטון 1. הדמיה חיה של פרוסות מוח אורגנוטיפיות מסוג BCBM. פרוסות מוח שמקורן בעכברים שהוזרקו באופן תוך גולגולתי עם תאי MDA-MB-231BR-GFP-Luciferase הורשו לגדול במשך 4 ימים ולאחר מכן הונחו תחת מיקרוסקופ תמונה חי במשך 48 שעות שבו צולמו תמונות כל 15 דקות ושולבו כדי ליצור סרטון באמצעות ImageJ. אנא לחץ כאן כדי להוריד את הסרטון הזה.
וידאו 2. הדמיה חיה של פרוסות מוח אורגנוטיפיות BCBM מוקרנות. פרוסות מוח שמקורן בעכברים שהוזרקו באופן תוך גולגולתי עם תאי MDA-MB-231BR-GFP-Luciferase הוקרנו יום לאחר יצירת פרוסות ו-4 ימים לאחר מכן צולמו כל 15 דקות במשך 48 שעות. אנא לחץ כאן כדי להוריד את הסרטון הזה.
Discussion
מחקר זה מבסס שיטה חדשנית של תרבית מוח ex vivo עבור גידולי מוח של קסנוגרפט מוסברים. אנו מראים שתאי BCBM MDA-MB-231BR המוזרקים באופן תוך גולגולתי במוחם של עכברים יכולים לשרוד ולגדול בפרוסות מוח ex vivo . המחקר בחן גם תאי גליובלסטומה תוך גולגולתית מסוג U87MG (GBM) שהוזרקו להם, וגם מצא שתאים סרטניים אלה שורדים וגדלים בפרוסות מוח (נתונים שלא הוצגו). אנו מאמינים שניתן להרחיב את המודל הזה מעבר ל-BCBM ו-GBM לסוגי סרטן אחרים ששולחים גרורות בקלות למוח, כולל סרטן ריאות ומלנומה. זריקות תוך גולגולתיות של תאים טרופיים במוח של סרטן השד נבחרו מכיוון שזו שיטה פשוטה ומהירה ליצירת גידולי מוח ונחשבת למודל מתאים למקרומטסטזות במוח25. עם זאת, ניתן לפתח מודלים דומים של פרוסות גידול מחיסון תוך-לבבי או זריקות אורתוטופיות לתוך כריות שומן ראשוניות. אופטימיזציה של תנאי התרבית על ידי גידול פרוסות מוח למבוגרים במדיום ללא סרום ואספקת מדיום טרי כל 48 שעות סיפקו שימור טוב יותר של כדאיות הרקמה והישרדות וצמיחה של גידולים. התוספות של 0.4 מיקרומטר המשמשות בתנאים היפראוקסיים של האינקובטור משמשות כתמיכה מבנית לפרוסות המוח ex vivo וגם מספקות חיבור לאספקה מלאכותית של חומרים מזינים וחמצן לרקמות ולתאי הגידול בהיעדר אספקת דם אשר נראה כי היא מספקת לשמירה על כדאיות הרקמה במשך עשרה ימים לפחות בתרבית. ההדמיה החיה מייצגת את צמיחת הגידול כפונקציה של הגדלת אות GFP. עם זאת, לתוכנה יש סף של בהירות GFP מקסימלית שמרווה את האות ואינה מאפשרת זיהוי נכון של תנועתיות של תא יחיד בסביבת המיקרו-סביבה במוח. שינוי עתידי של זיהוי האותות המיקרוסקופיים-תוכנה יפחית את היכולת לדווח במדויק על העלייה הטמפורלית באות GFP כפונקציה של צמיחת הגידול.
מודל זה מאפשר גם ניטור של צמיחת הגידול וכדאיותו באמצעות כתמים אימונוהיסטוכימיים. חשוב לציין שמודל זה יאפשר בדיקה מהירה של יעילות הרגישות לקרינה עם או בלי מעכבי מולקולות קטנות של גידולים הגדלים במיקרו-סביבה במוח. אנו מראים כי מודל זה מקובל הן על טיפולים בהקרנות והן בכימותרפיה. בנוסף, מערכת זו עשויה להיות מנוצלת למחקרי אומיקה כגון פרוטאומיקה, מטבוליקה וגנומיקה כדי להבין עוד יותר את גדילת הסרטן ואת התגובה לטיפולים בתוך המיקרו-סביבה של המוח. יתר על כן, בדיקת ההישנות הפוטנציאלית של גידולים עם הסרת מעכבים לאחר חשיפה קצרה יותר תאפשר הבנה נוספת של מסלולים כימורסיסטיים הייחודיים לתאים סרטניים בתוך המיקרו-סביבה במוח.
לסיכום, פיתחנו פרוסת מוח חדשה של ex vivo של התרבות רקמת גידול קסנוגרפט אשר תעקוב אחר צמיחת הגידול והאינטראקציה עם המיקרו-סביבה של גידול במוח ולסינון מהיר של חומרים טיפוליים כדי לחסום את צמיחת הגידול במוח.
Disclosures
למחברים אין סכסוכים כספיים להצהיר עליהם.
Acknowledgements
אנו רוצים להודות לג'וליה פרנאן, קיילה גרין וטיזיאנה דה-אנג'ליס על הסיוע הטכני שלהן. עבודה זו נתמכה בחלקה על ידי תוכנית המענקים לשיפור המחקר האוניברסלי של חבר העמים של פנסילבניה (MJR, JGJ), UO1CA244303 (MJR), R01CA227479 (NLS), R00CA207855 (EJH) ו- W.W. Smith Charitable Trusts (EjH).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe, slip tip | BD | 309659 | |
| 30 G1/2 Needles | BD | 305106 | |
| 6-well plates | Genessee | 25-105 | |
| Automated microscope and LUMAVIEW software | Etaluma | LS720 | |
| B27 (GEM21) | Gemini Bio-Products | 400-160 | |
| Beaker 50 mL | Fisher | 10-210-685 | |
| Blunt sable paintbrush, Size #5/0 | Electron Microscopy Sciences | 66100-50 | |
| Bone Wax | ModoMed | DYNJBW25 | |
| Brain injection Syringe | Hamilton Company | 80430 | |
| CaCl2 | Fisher Scientific | BP510-250 | |
| Cleaved caspase 3 Antibody | Cell Signaling | 14220S | |
| DAPI | Invitrogen | P36935 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| Double edge razor blade | VWR | 55411-060(95-0043) | |
| Filter Paper (#1), quantitative circles, 4.25 cm | Fisher | 09-805a (1001-042) | |
| Fine sable paintbrush #2/0 | Electron Microscopy Sciences | 66100-20 | |
| Forceps | Fine Science Tools | 11251-20 | |
| Gamma-H2AX antibody | Millipore | 05-636 | |
| GFAP antibody | Thermo Fisher | 13-0300 | |
| GFP antibody | Santa Cruz | SC-9996 | |
| Glucose | Sigma Aldrich | G8270 | |
| Glutamine (200 mM) | Corning cellgrow | 25-005-Cl | |
| H&E and KI-67 | Jefferson Core Facility Pathology staining | ||
| Hand Drill Set with Micro Mini Twist Drill Bits | Amazon | YCQ2851920086082DJ | |
| HEPES, free acid | Fisher Scientific | BP299-1 | |
| Just for mice Stereotaxic Frame | Harvard Apparatus (Holliston, MA, USA). | 72-6049, 72-6044 | |
| KCl | Fisher Scientific | S271-10 | |
| Large surgical scissors | Fine Science Tools | 14001-18 | |
| MDA-MB-231BR cells | Kindly provided by Dr. Patricia Steeg | Ref 14 | |
| MgCl2·6H2O | Fisher Scientific | M33-500 | |
| Mice imaging device | Perkin Elmer | IVIS 200 system | |
| Mice imaging software | Caliper Life Sciences (Waltham, MA, USA). | Living Image Software | |
| Microplate Reader | Tecan Spark | ||
| Mounting solution | Invitrogen | P36935 | |
| MTS reagent | Promega CellTiter 96 Aqueous One Solution | (Cat:G3582) | |
| N2 supplement | Life Technologies | 17502-048 | |
| Neurobasal medium | Life Technologies | 21103049 | |
| Nu/Nu athymic mice | Charles Rivers Labs (Wilmington, MA, USA) | ||
| Paraformaldehyde | Affymetrix | 19943 | |
| Pen/Strep | Life Technologies | 145140-122 | |
| Polypropylene Suture | Medex supply | ETH-8556H | |
| Povidone Iodine Swab sticks | DME Supply USA | Cat: 689286X | |
| Scalpel blade #11 (pk of 100) | Fine Science Tools | 10011-00 | |
| Scalpel handle #3 | Fine Science Tools | 10003-12 | |
| Sodium Pyruvate | Sigma Aldrich | S8636 | |
| Spatula/probe | Fine Science Tools | 10090-13 | |
| SS Double edge uncoated razor blades (American safety razor co (95-0043)) | VWR | 55411-060 | |
| Sucrose | Amresco | 57-50-1 | |
| Surgical Scalpel | Exelint International | D29702 | |
| Tissue Chopper | Brinkman | (McIlwain type) | |
| Tissue culture inserts | Millipore | PICMORG50 or PICM03050 | |
| X-ray machine | Precision 250 kVp |
References
- Watase, C., et al. Breast cancer brain metastasis-overview of disease state, treatment options and future perspectives. Cancers. 13 (5), (2021).
- Niikura, N., et al. Treatment outcomes and prognostic factors for patients with brain metastases from breast cancer of each subtype: a multicenter retrospective analysis. Breast Cancer Research and Treatment. 147 (1), 103-112 (2014).
- Fong, E. L., et al. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Parker, J. J., et al. A human glioblastoma organotypic slice culture model for study of tumor cell migration and patient-specific effects of anti-invasive drugs. Journal of Visualized Experiments: JoVE. (125), e53557 (2017).
- Chuang, H. N., et al. Coculture system with an organotypic brain slice and 3D spheroid of carcinoma cells. Journal of Visualized Experiments: JoVE. (80), e50881 (2013).
- Hohensee, I., et al. PTEN mediates the cross talk between breast and glial cells in brain metastases leading to rapid disease progression. Oncotarget. 8 (4), 6155-6168 (2017).
- van de Merbel, A. F., et al. An ex vivo Tissue culture model for the assessment of individualized drug responses in prostate and bladder cancer. Frontiers in Oncology. 8, 400 (2018).
- Martin, S. Z., et al. Ex vivo tissue slice culture system to measure drug-response rates of hepatic metastatic colorectal cancer. BMC Cancer. 19 (1), 1030 (2019).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5 (15), 1597-1601 (2006).
- Lim, C. Y., et al. Organotypic slice cultures of pancreatic ductal adenocarcinoma preserve the tumor microenvironment and provide a platform for drug response. Pancreatology. 18 (8), 913-927 (2018).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. British Journal of Cancer. 110 (2), 479-488 (2014).
- Koerfer, J., et al. Organotypic slice cultures of human gastric and esophagogastric junction cancer. Cancer Medicine. 5 (7), 1444-1453 (2016).
- Palmieri, D., et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain. Cancer Research. 67 (9), 4190-4198 (2007).
- Kyeong, S., et al. Subtypes of breast cancer show different spatial distributions of brain metastases. PLoS One. 12 (11), 0188542 (2017).
- Hengel, K., et al. Attributes of brain metastases from breast and lung cancer. International Journal of Clinical Oncology. 18 (3), 396-401 (2013).
- Jackson, J. G., et al. Neuronal activity and glutamate uptake decrease mitochondrial mobility in astrocytes and position mitochondria near glutamate transporters. Journal of Neuroscience. 34 (5), 1613-1624 (2014).
- Farnan, J. K., Green, K. K., Jackson, J. G. Ex vivo imaging of mitochondrial dynamics and trafficking in astrocytes. Current Protocols in Neuroscience. 92 (1), 94 (2020).
- Simone, N. L., et al. Ionizing radiation-induced oxidative stress alters miRNA expression. PLoS One. 4 (7), 6377 (2009).
- Couturier, C. P., et al. Single-cell RNA-seq reveals that glioblastoma recapitulates a normal neurodevelopmental hierarchy. Nature Communications. 11 (1), 3406 (2020).
- Candolfi, M., et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. Journal of Neuro-Oncology. 85 (2), 133-148 (2007).
- Fitzgerald, D. P., et al. Reactive glia are recruited by highly proliferative brain metastases of breast cancer and promote tumor cell colonization. Clinical & Experimental Metastasis. 25 (7), 799-810 (2008).
- Kondru, N., et al. An Ex Vivo Brain Slice Culture Model of Chronic Wasting Disease: Implications for Disease Pathogenesis and Therapeutic Development. Scientific Reports. 10 (1), (2020).
- Abu Samaan, T. M., et al. Paclitaxel's mechanistic and clinical effects on breast cancer. Biomolecules. 9 (12), (2019).
- Mewes, A., Franke, H., Singer, D. Organotypic brain slice cultures of adult transgenic P301S mice--a model for tauopathy studies. PLoS One. 7 (9), 45017 (2012).
- Valiente, M., et al. Brain metastasis cell lines panel: A public resource of organotropic cell lines. Cancer Research. 80 (20), 4314-4323 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved