Method Article
Подготовка гомогенатов скелетных мышц крыс для измерения нитратов и нитритов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы представляем протоколы для трех различных методов гомогенизации четырех различных групп мышц скелетной мышечной ткани крыс для измерения и сравнения уровней нитратов и нитритов. Кроме того, мы сравниваем различные веса образцов, чтобы выяснить, влияет ли размер образца ткани на результаты гомогенизации.
Аннотация
Ионы нитратов (NO3-) когда-то считались инертными конечными продуктами метаболизма оксида азота (NO). Тем не менее, предыдущие исследования показали, что ионы нитратов могут быть преобразованы обратно в NO у млекопитающих с помощью двухэтапного механизма восстановления: нитрат восстанавливается до нитритов (NO2-) в основном пероральными комменсальными бактериями, а затем нитрит восстанавливается до NO несколькими механизмами, в том числе с помощью белков, содержащих гем или молибден. Этот восстановительный нитратный путь способствует усилению NO-опосредованных сигнальных путей, особенно в сердечно-сосудистой системе и во время мышечных упражнений. Уровни нитратов в организме до такого использования определяются двумя различными источниками: эндогенным окислением NO и потреблением нитратов с пищей, главным образом из растений. Чтобы прояснить сложный цикл NO в физиологических условиях, мы дополнительно изучили динамику его метаболитов, нитратов и нитрит-ионов, которые относительно стабильны по сравнению с NO. В предыдущих исследованиях скелетные мышцы были идентифицированы как основной орган хранения ионов нитратов у млекопитающих, а также как прямой источник NO во время физических упражнений. Поэтому создание надежной методологии измерения уровней нитратов и нитритов в скелетных мышцах важно и должно быть полезно для расширения ее применения на другие образцы тканей. В этой статье подробно объясняется подготовка образцов скелетных мышц с использованием трех различных методов гомогенизации для измерения нитратов и нитритов и обсуждаются важные вопросы, связанные с процессами гомогенизации, включая размер образцов. Концентрации нитратов и нитритов также сравнивались по четырем различным группам мышц.
Введение
Оксид азота (NO), небольшая газообразная сигнальная молекула, играет решающую роль в физиологических и патофизиологических процессах1. NO может быть продуцирован из L-аргинина эндогенными ферментами семейства синтазы оксида азота (NOS) до быстрого окисления до нитрата (NO3-) и, возможно, нитрита (NO2-) в крови и тканях 2,3. Недавно было показано, что эти анионы восстанавливаются обратно до NO в системахмлекопитающих 4. Нитрат превращается в нитрит, главным образом, комменсальными бактериальными нитратредуктазами в полости рта, действующими на ионы, выделяемые слюнными железами и непосредственно поглощаемые 5, и в некоторой степени ферментами млекопитающих, такими как ксантиноксидоредуктаза 6,7. Нитрит может быть дополнительно восстановлен до NO несколькими механизмами, включая дезоксигемоглобин8, дезоксимиоглобин9, молибденсодержащие ферменты10 и неферментативное восстановление в присутствии протонов11,12.
Этот путь нитрат-нитрит-NO усиливается в гипоксических условиях, в которых активность NOS уменьшается, потому что NOS требует кислорода для no generation4. Во многих недавних исследованиях сообщалось о благотворном влиянии диетических нитратов на регуляцию артериального давления и физическую активность, предполагая, что пути снижения нитратов способствуют увеличению передачи сигналов NO 13,14,15. Предыдущие исследования показали, что некоторые скелетные мышцы, вероятно, являются основными местами хранения нитратов в организме16. По сравнению с кровью или другими внутренними органами, такими как печень, скелетные мышцы (ягодичная мышца) содержат значительно более высокие уровни нитратов и имеют значительную массу в организме млекопитающих. Было показано, что упражнения на беговой дорожке усиливают снижение нитратов до нитритов и до NO в ягодичной мышце у крыс в модели7. Эти результаты подразумевают, что некоторые скелетные мышцы могут быть важными источниками NO через пути снижения нитратов в физиологических ситуациях. Более поздние исследования показывают, что эти результаты, включая изменения уровня мышечных нитратов во время физических упражнений, также происходят у людей17.
Два из нынешних авторов ранее установили метод измерения уровней нитратов и нитритов в крови и других жидких образцах18. Однако, когда уровни этих анионов в тканевых гомогенатах были первоначально проанализированы, подробные протоколы были недоступны. Чтобы понять динамику нитрат-нитрит-НЕТ в нескольких различных органах, наша цель состояла в том, чтобы разработать точный и эффективный метод измерения уровней нитратов и нитритов в тканях млекопитающих, включая скелетные мышцы. В более ранних исследованиях ткани грызунов использовались для разработки надежных процессов гомогенизации, а затем анализа содержания нитратов и нитритов в этих гомогенатах 7,16,19. Использование этого метода гомогенизации было распространено на образцы биопсии скелетных мышц человека, в результате чего значения были подтверждены, и, что важно, значения, наблюдаемые для мышц по сравнению с кровью / плазмой, были в аналогичных диапазонах и соотношениях с теми, которые наблюдались у грызунов17. В последние годы другие группы также начали измерять уровни нитратов и нитритов в гомогенатах скелетных мышц, сообщая о сопоставимых значениях с теми, о которых сообщила наша группа20,21.
Целью данной протокольной работы является подробное описание получения гомогенатов скелетных мышц с использованием трех различных методов гомогенизации для последующего измерения уровней нитратов и нитритов. Кроме того, изучалось влияние массы тканей, используемой для гомогенизации, на значения нитратов и нитритов в образцах скелетных мышц. Мы считаем, что эти методы могут быть легко применены к другим типам тканей млекопитающих. В последнее время, особенно в области физиологии физических упражнений, внимание было уделено возможным различиям в физиологии нитратов/нитритов/NO в зависимости от групп мышц. Мы также сообщаем о количестве нитратов и нитритов в четырех различных мышцах грызунов и находим неравномерное распределение обоих ионов между этими различными мышцами; наблюдение, требующее дальнейшего изучения.
протокол
Протокол для животных был одобрен Комитетом по уходу и использованию животных NIDDK (ASP K049-MMB-20). Животные обрабатывались и лечились в соответствии с действующим Руководством по уходу и использованию лабораторных животных, свободно доступным на веб-сайте AAALAC.
1. Коллекция скелетных мышц крыс
- Пока крыса находится под глубокой анестезией (5% изофлурана, подтвержденная отсутствующей реакцией на защемление хвоста / ноги), начните перфузию физиологическим раствором, содержащим гепарин, поместив иглу 19 г в вершину левого желудочка и сделав кольца на правом предсердии. Дайте физиологическому раствору с гепарином перфузиться через внутренние органы до тех пор, пока через ткань не пройдет не менее 1,5 литра / кг. В этот момент животные мертвы от экссангинации, а туши готовы к обработке для сбора образцов.
ПРИМЕЧАНИЕ: Достижение хорошей перфузии имеет решающее значение, особенно для точных измерений нитритов, потому что нитрит окисляется в нитраты любым оставшимся гемоглобином. - Определите целевые мышечные ткани и иссечение их из задних ног22 с помощью чистых хирургических инструментов. Удалите как можно больше жира и соединительных тканей из мышечных тканей.
- Поместите нужное количество мышц в микроцентрифужную трубку, а затем поместите на сухой лед. Храните тюбики, заполненные тканью, в морозильной камере -80 °C.
ПРИМЕЧАНИЕ: В случае образцов биопсии человека, тщательно промойте их сразу после сбора чистой марлей, чтобы удалить лишнюю кровь.
2. Подготовка к гомогенизации
- Приготовление нитритсодержащего раствора (стоп-раствора)
- Готовят прозрачный желтый раствор, содержащий 890 мМ феррицианида калия (K3Fe(CN)6) и 118 мМ NEM (N-этилмалеймид) в дистиллированной воде, обеспечивая отсутствие кристаллов. Добавьте неионное поверхностно-активное вещество (моющее средство) в соотношении 1:9 (v/v, таблица материалов) и аккуратно перемешайте, чтобы избежать вспенивания.
- Стоп-раствор разбавить в соотношении 1:9 дистиллированной водой. Поместите разбавленный стоп-раствор (соотношение мышечной ткани 1:5 к разбавленному стоп-раствору) в гомогенизационную трубку.
ПРИМЕЧАНИЕ: Двадцать миллиграммов ткани потребуют 100 мкл стоп-раствора, а 200 мг ткани потребуют 1000 мкл стоп-раствора в пробирке. Наличие моющего средства в добавленном растворе имеет решающее значение для разрушения клеточных мембран. Можно использовать любое неионное моющее средство, но необходимо позаботиться о том, чтобы убедиться, что оно не мешает методу хемилюминесценции.
- Подготовка тканей
- Выньте ткань из морозильной камеры при температуре -80 °C и медленно оттаивайте во льду. Удалите оставшийся жир и соединительную ткань из скелетной мышцы. Отрежьте кусочки скелетных мышц и промокайте на марле, чтобы высохнуть.
- Взвесьте количество ткани (20, 50 и 200 мг). Поместите предварительно взвешенную скелетную мышцу в стоп-раствор в гомогенизационных трубках или поместите предварительно взвешенную ткань в чистую микроцентрифужную трубку для последующего использования.
3. Гомогенизация
- Роторный гомогенизатор (рисунок 1)
- Поместите в машину трубку М-типа, содержащую предварительно взвешенную скелетную мышцу и предварительно измеренный стоп-раствор. Гомогенизируйте каждый образец дважды (установив наиболее разрушительный цикл гомогенизации) и поместите трубку на лед сразу после каждой гомогенизации в течение 5 минут для охлаждения.
- Центрифугируют кратковременно при 2000 × г и 4 °C в течение 5 мин. Поместите полный тюбик обратно на лед и добавьте соответствующий объем метанола (≥ 99,9 %, 10x веса ткани). Вихрь тщательно в течение 15 с.
ПРИМЕЧАНИЕ: Для 20 мг ткани используйте 200 мкл метанола. Метанол используется для осаждения белков из тканевого гомогената и не препятствует методу хемилюминесценции. Если используется другой метод осаждения белка, проверьте его совместимость с хемилюминесценцией. - Еще раз гомогенизировать и инкубировать на льду в течение 30 мин. Центрифугирование образцов в течение 35 мин при 4 °C и 3 500 × г. Аспирируйте супернатант и измеряйте уровни нитритов/нитратов или храните при -80 °C для последующего использования.
- Гомогенизатор бусин (рисунок 2)
- Поместите скелетную мышечную ткань в шарикодержащую трубку (соотношение 1:5 для ткани: разбавленный стоп-раствор) и гомогенизируйте дважды в течение 45 с на самой высокой скорости, доступной на используемом инструменте. Поместите трубку на лед сразу после каждой гомогенизации на 5 мин для охлаждения.
- Кратковременно центрифугировать с помощью небольшой настольной центрифуги (2 000 x g) в течение 5 секунд. Поместите трубку обратно на лед и добавьте соответствующий объем метанола (чистота ≥ 99,9 %, 10x веса ткани). Вихрь тщательно в течение 15 с.
ПРИМЕЧАНИЕ 1: Для 20 мг ткани используйте 200 мкл метанола.
ПРИМЕЧАНИЕ 2: Метанол используется для осаждения белков из тканевого гомогената и не препятствует методу хемилюминесценции. Если используется другой метод осаждения белка, проверьте его совместимость с хемилюминесценцией. - Гомогенизируйте еще раз в течение 45 с на самой высокой скорости, доступной на используемом инструменте. Инкубировать на льду в течение 30 мин. Центрифуга при 17 000 х г, 4 °C, 30 мин. Аспирируйте супернатант и измеряйте уровни нитритов/нитратов или храните при -80 °C для последующего использования.
- Измельчитель (рисунок 3)
- Подготовьте пробирки, содержащие разбавленный стоп-раствор (в 5 раз больше массы ткани) и взвесьте их. Запишите вес (трубка + стоп-раствор).
- Поместите инструмент для измельчения жидкого азота на сухой лед и подождите примерно 30 минут, пока он достигнет нужной температуры.
- Используя пинцет, охлажденный жидким азотом, перенесите один образец (вес ткани уже измерен) в пульверизатор. Добавьте небольшую ложку жидкого азота, чтобы убедиться, что ткань находится при температуре жидкого азота.
- После того, как 95% жидкого азота испарится, поместите дробильный инструмент поверх ткани и плотно надавите. Вы должны почувствовать раздавливание образца. С помощью молотка ударьте дробильным инструментом в 3-5 раз.
- Проверьте образец на наличие оставшихся кусков с помощью ложки, охлажденной жидким азотом. После охлаждения в жидком азоте используйте лист папиросной бумаги, чтобы протереть замерзшую воду, прежде чем прикасаться к ткани. Если кусок присутствует, переместите его в центр, а затем ударьте молотком еще 5-6 раз.
- Когда весь образец будет измельчен, используйте ложку с жидким азотным охлаждением для непосредственного переноса измельченной ткани в предварительно взвешенную трубку, содержащую разбавленный стоп-раствор (этап 3.3.1). Обязательно выполняйте этот шаг быстро, так как когда раздавленная скелетная мышца нагревается, она становится липкой и трудно переносимой.
- Вихрь на 15 с. Убедитесь, что никакая ткань не застряла в верхней части трубки, открыв трубку. Если есть, попробуйте выбить его, а затем снова вихрь.
- Центрифугирование образца в течение 2-3 с с помощью небольшой настольной центрифуги. Еще раз взвесьте трубку. Рассчитайте вес ткани, вычитая исходный вес трубки (шаг 3.3.1) из этого нового веса. Поместите трубку на лед.
ПРИМЕЧАНИЕ: Точные веса помогут определить точный вес ткани и то, сколько ткани было потеряно во время измельчения. - После того, как все образцы были обработаны до этапа 3.3.8, добавьте соответствующий объем метанола (≥ 99,9%, 10x веса ткани). Тщательно вихрь в течение 15 с, и насиживайте на льду в течение 30 мин.
ПРИМЕЧАНИЕ: Для 20 мг ткани используйте 200 мкл метанола. Метанол используется для осаждения белков из тканевого гомогената и не препятствует методу хемилюминесценции. Если используется другой метод осаждения белка, проверьте его совместимость с хемилюминесценцией. - Центрифуга при 17 000 × г, 4 °C, 30 мин. Аспирируйте супернатант и измеряйте уровни нитритов/нитратов или храните при -80 °C для последующего использования.
4. Измерение нитрит/нитрат с помощью анализатора оксида азота (NOA)
- Подготовьте все образцы одним из трех различных методов гомогенизации, описанных выше, и введите их в NOA для измерения нитратов и нитритов.
ПРИМЕЧАНИЕ: Подробные протоколы для использования NOA были опубликованы ранее19.
Результаты
Для получения репрезентативных результатов использовали скелетные мышечные ткани у 8 крыс Wistar (самцов и самок, вес 250 ± 50 г). Гомогенаты скелетных мышц крыс (50 мг ягодичной мышцы для каждого метода) получали тремя различными инструментами гомогенизации (роторный гомогенизатор, гомогенизатор бусин и измельчитель). Содержание нитратов и нитритов в этих гомогенатах затем определяли с помощью анализатора оксида азота (NOA) (рисунок 4). Уровни нитратов (рисунок 4А) в этих трех гомогенатных образцах были очень похожи друг на друга, варьируясь от 39,6 до 45,2 нмоль/г.
Интересно, что уровни нитритов (рисунок 4B) в гомогенатном образце, подготовленном измельчителем, показали наибольшее значение (0,99 ± 0,15 нмоль/г), и это статистически отличалось от двух других значений выборки. Чтобы проверить, повлияет ли размер тканей на эффективность гомогенизации и полученные в результате значения нитратов и нитритов, для гомогенизации гомогенизатором бусин использовались три различных размера скелетной мышечной ткани (ягодичная мышечная ткань 20, 50 и 200 мг). Ни уровни нитратов (рисунок 5А), ни нитритов (рисунок 5В) существенно не отличались между размерами мышечной выборки. Тем не менее, несколько более низкие концентрации нитратов наблюдались при увеличении размера выборки в многочисленных экспериментах по неясным причинам.
Затем были измерены уровни нитратов и нитритов в различных видах скелетных мышечных тканей ног грызунов (рисунок 6). В дополнение к большой ягодичной мышце, передние большеберцовые мышцы (TA), разгибатель digitorum longus (EDL) и икроножные мышцы (по 50 мг каждая) были выделены из ног крыс и гомогенизированы с использованием гомогенизатора бусин. Удивительно, но уровни нитратов в ягодичных мышцах (40,4 нмоль/г) были примерно в два раза выше, чем у трех других мышечных тканей, хотя в этом конкретном эксперименте эти различия не достигли статистической значимости (рисунок 6А). Концентрация нитритов в ягодичной мышце также была выше, чем в трех других мышечных тканях, и была значительно выше, чем в образце икроножной мышцы (рисунок 6B).
Мы определили коэффициент вариации для всех трех используемых методов, и результаты приведены в прилагаемой таблице. Для сравнения в таблице также приведены коэффициенты вариации, определяемые Troutman et al21.
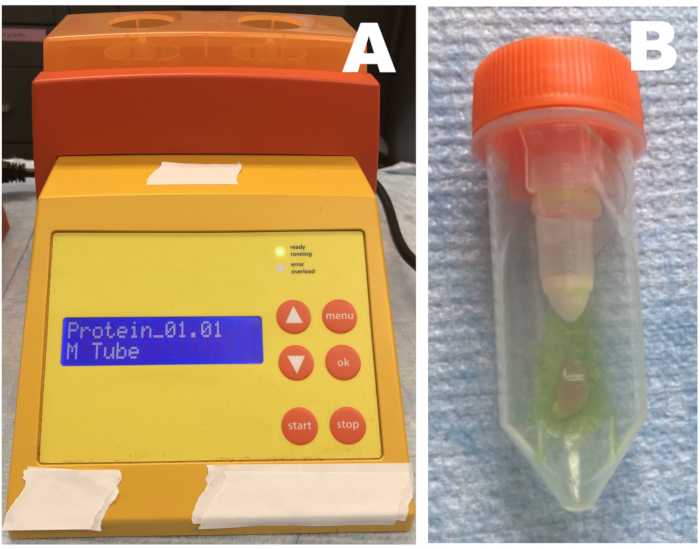
Рисунок 1: Роторный гомогенизатор. (А) Гомогенизатор; (B) трубка, содержащая ткань и стоп-раствор. Образцы скелетной мышечной ткани помещают в пробирку с разбавленным стоп-раствором и гомогенизируют три раза. Образцы должны быть немедленно помещены на лед после каждой стадии гомогенизации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Гомогенизатор бусин. а) гомогенизатор; (B) бусины, содержащие трубку. Образцы скелетной мышечной ткани помещают в шарикодержащую трубку (5 керамических шариков) с разбавленным стоп-раствором и гомогенизируют в общей сложности три раза (45 с на максимальной скорости за каждый раз). Образцы должны быть немедленно помещены на лед после каждой стадии гомогенизации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Измельчитель. (А) части измельчителя (Б) корпус измельчителя - раствор и пестик в собранном виде. (C) деталь сборки раствора и пестика. Детали измельчителя охлаждаются на сухом льду в течение 30 минут. Жидкий азот помещают в раствор, а затем добавляют предварительно взвешенную скелетную мышечную ткань. После того, как 90 процентов жидкого азота исчезает, верхняя часть - пестик - вводится в таз. Пестик растирают молотком 5-6 раз, пока образец не станет порошкообразным. Затем порошкообразную ткань переносят в трубку с стоп-раствором. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
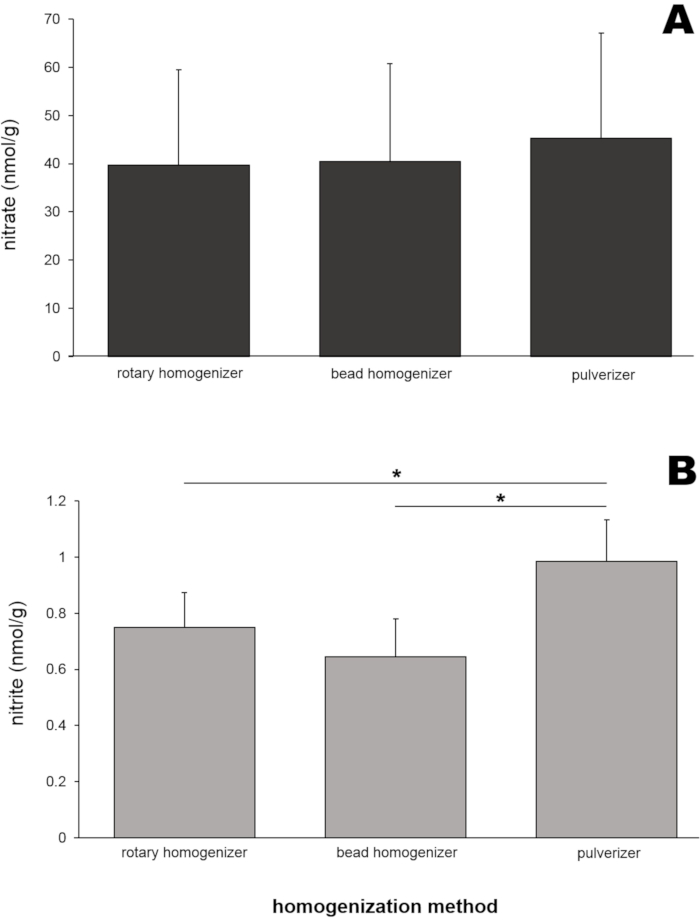
Рисунок 4: (А) Содержание нитратов и (В) нитритов в гомогенатах ягодичных мышц, полученных тремя различными методами гомогенизации. Пятьдесят миллиграммов ягодичной мышцы были гомогенизированы тремя различными методами гомогенизации. Метанол (500 мкл) добавляли к гомогенатам для осаждения белков. Стандартный метод хемилюминесценции с раствором хлорида ванадия или трийодида использовался для измерения уровней нитратов и нитритов, соответственно, в прозрачном супернатанте после центрифугирования; n=7 (нитрат); n=8 (нитрит); данные представлены в виде средних значений ± SD, * p < 0,05 с использованием односторонней ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: (А) Содержание нитратов и (В) нитритов в различных размерах выборки ягодичной мышцы. Три различных размера гомогенатов ягодичных мышц были получены с использованием гомогенизатора бусин. Стандартный метод хемилюминесценции с раствором хлорида ванадия или трийодида использовался для измерения уровней нитратов и нитритов, соответственно, в прозрачном супернатанте после центрифугирования; n=7 (нитрат); n=8 (нитрит); данные представлены в виде средних значений ± SD, Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
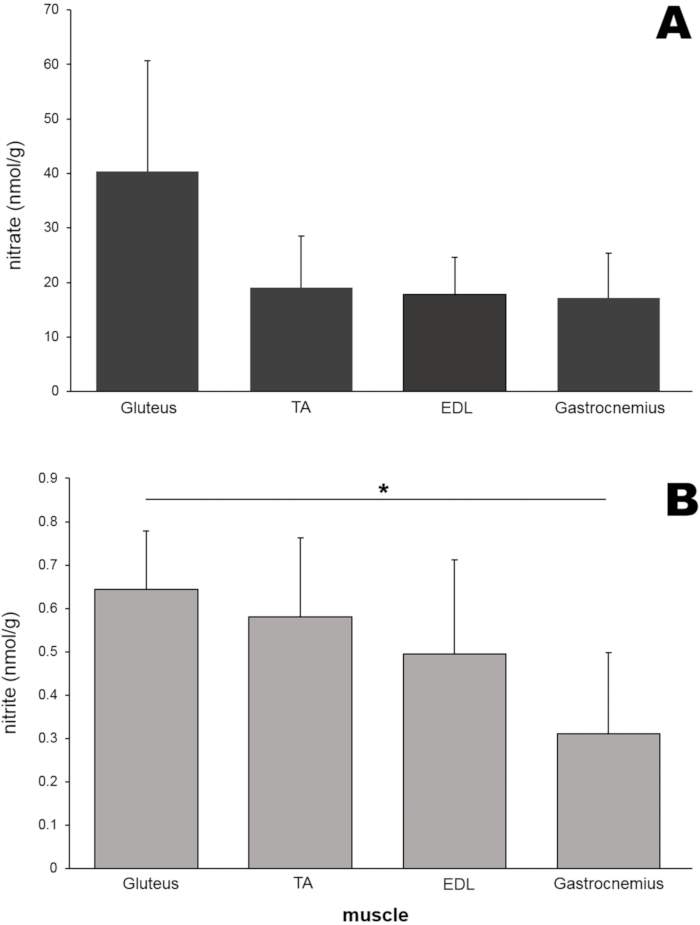
Рисунок 6: (А) Содержание нитратов и (В) нитритов в четырех различных мышцах. Каждая мышца (50 мг) гомогенизировалась с использованием гомогенизатора шариков, а стандартный метод хемилюминесценции с раствором ванадия хлорида или трийодида использовался для измерения уровней нитратов и нитритов, соответственно; n=4-7 (нитрат); n=3-8 (нитрит); данные представлены в виде средних значений ± SD, * p < 0,05 с использованием односторонней ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Чтобы контролировать изменения в метаболитах NO, нитратах и нитритах, в зависимости от физиологических вмешательств, необходимо измерить уровни этих ионов в различных органах, которые имеют решающее значение в их метаболизме. Поскольку гемоглобин в крови будет реагировать с NO и его метаболитами, также важно как можно быстрее удалить кровь из образцов тканей. Таким образом, животных перфузировали физиологическим раствором перед сбором скелетных мышечных тканей (ягодичные, ТА, ЭДЛ, икроножные мышцы), а соединительную ткань и жир вокруг мышцы-мишени немедленно удаляли. Для раствора гомогенизации «стоп-раствор» был специально разработан с феррицианидом, NEM и неионным поверхностно-активным веществом для сохранения нитрита в различных тканях19. Наличие неионного моющего средства имеет решающее значение для полного разрушения клеточных мембран. В случае двух машин гомогенизации, используемых в этом исследовании, роторного гомогенизатора и гомогенизатора шариков, объем стоп-раствора, необходимого для гомогенизации, в 5 раз превышал вес ткани, так что вся ткань была полностью погружена в раствор и обработана однородно.
Процесс гомогенизации выполняли в общей сложности три раза (два раза перед добавлением метанола и еще один раз после добавления метанола в осажденные белки), каждый раз с использованием запрограммированных настроек, определенных производителями приборов. Важно помещать образцы на лед сразу после каждой гомогенизации, чтобы предотвратить ухудшение качества образца в результате мягкого нагрева, который может возникнуть во время гомогенизации. Для метода измельчения образцы тканей первоначально измельчали в порошок, сохраняя их замороженными с использованием жидкого азота, затем образцы смешивали с стоп-раствором (5-кратный вес ткани). Во всех трех способах к образцам добавляли метанол (10-кратная масса ткани), и смесь инкубировали на льду в течение 30 мин для осаждения белков и полного извлечения нитратов и нитритов из тканей. Наличие белков в образце может вызвать чрезмерное вспенивание реакционного раствора в камере при использовании хемилюминесценции, поэтому необходимо осаждение белков из образцов. Может быть использован любой агент осаждения, но необходимо подтвердить, что такие агенты не будут мешать ни методу хемилюминесценции, ни вызывать какие-либо изменения в концентрациях нитритов/нитратов при взаимодействии с этими ионами.
Уровни нитратов во всех образцах ягодичной мышцы, полученных тремя методами, были очень похожи (39,6-45,2 нмоль/г, рисунок 4А), что позволяет предположить, что эти три метода гомогенизации в равной степени применимы к подготовке образцов мышц для анализа нитратов. Хотя уровни нитритов были несколько выше в образцах, полученных путем измельчения, по сравнению с двумя другими методами (рисунок 4B), все измеренные значения были в ограниченном диапазоне (0,64-0,99 нмоль/г). Влияние размера образца ткани на значения нитратов и нитритов в образцах скелетных мышц было изучено, потому что исследователи часто имеют дело с очень маленькими образцами, особенно от мелких животных или биопсии мышц человека. Ни уровни нитратов, ни нитритов существенно не отличались в диапазоне от 20 до 200 мг скелетной мышечной ткани в этих экспериментах (рисунок 5).
Однако следует отметить, что, хотя и не являются статистически значимыми, уровни нитратов, как правило, несколько ниже при измерении в более крупных выборках (рисунок 5). Мы заметили это явление в ходе наших опубликованных и неопубликованных исследований, но мы не понимаем причин этого. Поэтому, вероятно, важно учитывать веса образцов и в идеале поддерживать их согласованность на протяжении всего исследования при подготовке гомогенатов из нескольких образцов тканей. Еще одним соображением при работе с меньшими образцами (20 мг) является то, что конечный общий объем обрабатываемого образца составляет всего ~300 мкл, что значительно снижает возможность измерения одного и того же образца в несколько раз. Однако, особенно для исследований на людях, 20 мг является обычным приемлемым размером для биопсии мышц.
Чтобы проверить, будут ли разные мышцы в ногах крыс иметь различное содержание нитратов / нитритов, концентрации этих ионов сравнивали в четырех разных мышцах ног (рисунок 6). Уровни нитратов и нитритов были самыми высокими в ягодичной мышце по сравнению с тремя другими мышечными тканями, хотя различия не достигли статистической значимости в этом исследовании, предполагая, что метаболизм нитратов в различных типах мышц может регулироваться по-разному. В настоящее время это явление исследуется более подробно.
Другие исследовательские группы также сообщили о концентрациях нитратов в скелетных мышцах, что выявило значительную вариабельность этих значений. Группа Коггана показала, что уровни нитратов в камбаловидной мышце крысы Sprague Dawley варьируются от 62 до 124 нмоль/г в зависимости от методов подготовки мышц21. Та же группа сообщила о значениях нитратов у SD rat vastus lateralis (приблизительно 60 нмоль/г) и камбалы (приблизительно 215 нмоль/г) в другом исследовании23. Ohtake et al. измерили концентрацию нитратов в икроножной мышце мыши >300 нмоль/г; однако точные методы получения мышечного гомогената не были описаны24. Группа Вердейка сообщила о содержании нитратов в биопсии мышц человека (vastus lateralis) в диапазоне от 54 до 80 нмоль/г в зависимости от возрастаучастника 20 лет; в аналогичном исследовании Wylie et al. сообщают о 226 нмоль/г для той же группы мышц17. Эти результаты свидетельствуют о том, что концентрации нитратов / нитритов в образцах скелетных мышц отражают многие факторы - физиологические (например, состояние физической активности), окружающую среду (например, диета) и технические (детали анализа) - все из которых, по-видимому, способствуют изменчивости измерений.
Мы определили коэффициент изменчивости (CV) для всех трех методов, представленных здесь - см. прилагаемый дополнительный файл. Даже если CV далеки от идеала и варьируются в зависимости от используемых методов, наши значения CV сопоставимы с теми, которые были опубликованы Troutman et al. 21 с использованием аналогичных методов с различной обработкой образцов. К сожалению, до сих пор нет четкого объяснения, почему сохраняется такая высокая изменчивость; эта статья является единственным опубликованным подробным протоколом, который мы знаем для обработки образцов мышц для определения нитратов и нитритов.
Мы также измерили линейность и степень извлечения нитратов из образцов мышц с нитратными шипами (см. прилагаемый дополнительный файл). Когда мы добавили три различные концентрации нитратов в образцы ягодичной мышцы для гомогенизации, мы получили хороший линейный ответ в увеличении концентраций нитратов с ~ 80% восстановлением добавленного нитрата как для шариковых, так и для ротационных гомогенизаторов. Эти результаты показывают, что оба метода гомогенизации могут быть использованы для определения уровней нитратов и нитритов в биологических образцах с хорошей уверенностью. Потеря 20% добавленных нитратов, вероятно, происходит во время депротеинизации и центрифугирования гомогената мышечной ткани, когда некоторые ионы могут совместно выпадать в осадок с заряженными белками или другими частями клеток.
В целом, мы надеемся, что предложенный нами метод подготовки образцов мышц для измерения нитратов и нитритов окажется полезным не только в области физических упражнений, но и в клинических исследованиях. Существуют нервно-мышечные и / или метаболические расстройства, влияющие на большие популяции, которые могут быть связаны с нарушением цикла оксида азота и могут извлечь выгоду из поставок нитратов. Тем не менее, сначала нужно установить, действительно ли существует дефицит NO и может ли он быть исправлен диетическим вмешательством. Мы надеемся, что описанный здесь метод позволит контролировать судьбу нитратов и других метаболитов цикла NO в скелетных мышцах и других органах.
Мы знаем, что на данном этапе своего развития методы подготовки скелетных мышц к измерениям нитратов и нитритов с использованием хемилюминесценции (наиболее количественное из всех определений самих оксидов азота) все еще имеют неизвестные переменные, некоторые из которых обсуждаются выше. Однако даже при своих ограничениях описанные методы позволяют достаточно точно сравнивать уровни нитратов/нитритов различных органов, включая различные скелетные мышцы, и должны позволять формулировать гипотезы, которые затем могут быть проверены с разумной точностью.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов. Алан Н. Шехтер числится соавтором нескольких патентов, выданных Национальным институтам здравоохранения на использование нитритных солей для лечения сердечно-сосудистых заболеваний. Он получает роялти на основе лицензирования NIH этих патентов для клинической разработки, но без какой-либо другой компенсации. Эти договоренности не влияют на его приверженность политике журнала JoVE.
Благодарности
Эта работа была поддержана внутренним грантом NIH / NIDDK ZIA DK 0251041-14 Алану Н. Шехтеру, MD.
Материалы
| Name | Company | Catalog Number | Comments |
| gentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| gentle MACS M tube | Miltenyi Biotec | 130-093-236 | Length: 87 mm; Diameter: 30 mm |
| Heparin Sodium | Hospira | NDC-0409-7620-13 | |
| Isoflurane | Baxter | NDC-10019-360-60 | |
| Methanol | Sigma | 646377 | |
| Minilys bead homogenizer | Bertin Instruments | P000673-MLYS0-A | |
| NEM; N-ethylmaleimide | Sigma | 4260 | |
| Nitric Oxide analyzer | GE | Sievers NOA 280i | |
| NP-40; 4-Nonylphenylpolyethylene glycol | Sigma | 74385 | |
| Potassium ferricyanide; K3Fe(CN)6 | Sigma | 702587 | |
| Precellys lysing kit | Bertin Instruments | P000911-LYSK0-A | contains 2 mL tubes with 2.8 mm ceramic (zirconium oxide) beads for homogenization |
| Pulverizer kit | Cellcrusher | Cellcrusher kit |
Ссылки
- Ignarro, L. J. Nitric oxide as a unique signaling molecule in the vascular system: a historical overview. Journal of Physiology and Pharmacology. 53 (4), 503-514 (2002).
- Moncada, S., Higgs, A. The L-arginine-nitric oxide pathway. New England Journal of Medicine. 329 (27), 2002-2012 (1993).
- Thomas, D. D., Liu, X., Kantrow, S. P., Lancaster, J. R. The biological lifetime of nitric oxide: implications for the perivascular dynamics of NO and O2. Proceedings of the National Academy of Sciences of the United States of America. 98 (1), 355-360 (2001).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Govoni, M., Jansson, E. A., Weitzberg, E., Lundberg, J. O. The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide. 19 (4), 333-337 (2008).
- Jansson, E. A., et al. A mammalian functional nitrate reductase that regulates nitrite and nitric oxide homeostasis. Nature Chemical Biology. 4 (7), 411-417 (2008).
- Piknova, B., Park, J. W., Kwan Jeff Lam, K., Schechter, A. N. Nitrate as a source of nitrite and nitric oxide during exercise hyperemia in rat skeletal muscle. Nitric Oxide. 55-56, 54-61 (2016).
- Cosby, K., et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation. Nature Medicine. 9 (12), 1498-1505 (2003).
- Shiva, S., et al. Deoxymyoglobin is a nitrite reductase that generates nitric oxide and regulates mitochondrial respiration. Circulation Research. 100 (5), 654-661 (2007).
- Millar, T. M., et al. Xanthine oxidoreductase catalyses the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. FEBS Letter. 427 (2), 225-228 (1998).
- Benjamin, N., et al. Stomach NO synthesis. Nature. 368 (6471), 502 (1994).
- Lundberg, J. O., Weitzberg, E., Lundberg, J. M., Alving, K. Intragastric nitric oxide production in humans: measurements in expelled air. Gut. 35 (11), 1543-1546 (1994).
- Larsen, F. J., Ekblom, B., Sahlin, K., Lundberg, J. O., Weitzberg, E. Effects of dietary nitrate on blood pressure in healthy volunteers. New England Journal of Medicine. 355 (26), 2792-2793 (2006).
- Kapil, V., et al. Inorganic nitrate supplementation lowers blood pressure in humans: role for nitrite-derived NO. Hypertension. 56 (2), 274-281 (2010).
- Jones, A. M. Dietary nitrate supplementation and exercise performance. Sports Medicine. 44, 35-45 (2014).
- Piknova, B., et al. Skeletal muscle as an endogenous nitrate reservoir. Nitric Oxide. 47, 10-16 (2015).
- Wylie, L. J., et al. Human skeletal muscle nitrate store: influence of dietary nitrate supplementation and exercise. Journal of Physiology. 597 (23), 5565-5576 (2019).
- Piknova, B., Schechter, A. N. Measurement of nitrite in blood samples using the ferricyanide-based hemoglobin oxidation assay. Methods in Molecular Biology. 704, 39-56 (2011).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring Nitrite and Nitrate, Metabolites in the Nitric Oxide Pathway, in Biological Materials using the Chemiluminescence Method. Journal of Visualized Experiments. (118), e54879 (2016).
- Nyakayiru, J., et al. Sodium nitrate ingestion increases skeletal muscle nitrate content in humans. Journal of Applied Physiology. 123 (3), 637-644 (2017).
- Troutman, A. D., Gallardo, E. J., Brown, M. B., Coggan, A. R. Measurement of nitrate and nitrite in biopsy-sized muscle samples using HPLC. Journal of Applied Physiology. 125 (5), 1475-1481 (2018).
- Shinin, V., Gayraud-Morel, B., Tajbakhsh, S. Template DNA-strand co-segregation and asymmetric cell division in skeletal muscle stem cells. Methods in Molecular Biology. 482, 295-317 (2009).
- Long, G. M., Troutman, A. D., Fisher, A., Brown, M. B., Coggan, A. R. Muscle fiber type differences in nitrate and nitrite storage and nitric oxide signaling in rats. bioRxiv. , (2020).
- Ohtake, K., et al. Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKA(y) mice. Nitric Oxide. 44, 31-38 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены