Method Article
Herstellung von Ratten-Skelettmuskelhomogenaten für Nitrat- und Nitritmessungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir präsentieren Protokolle für drei verschiedene Methoden zur Homogenisierung von vier verschiedenen Muskelgruppen von Ratten-Skelettmuskelgewebe, um die Nitrat- und Nitritwerte zu messen und zu vergleichen. Darüber hinaus vergleichen wir verschiedene Probengewichte, um zu untersuchen, ob die Gewebeprobengröße die Ergebnisse der Homogenisierung beeinflusst.
Zusammenfassung
Nitrationen (NO3-) galten früher als inerte Endprodukte des Stickstoffmonoxid (NO)-Stoffwechsels. Frühere Studien zeigten jedoch, dass Nitrationen bei Säugetieren durch einen zweistufigen Reduktionsmechanismus wieder in NO umgewandelt werden können: Nitrat wird hauptsächlich von oralen kommensalen Bakterien zu Nitrit (NO2-) reduziert, dann wird Nitrit durch verschiedene Mechanismen, einschließlich über Häm- oder Molybdän-haltige Proteine, zu NO reduziert. Dieser reduktive Nitratweg trägt zur Verbesserung der NO-vermittelten Signalwege bei, insbesondere im Herz-Kreislauf-System und bei Muskeltraining. Der Nitratgehalt im Körper vor einer solchen Verwertung wird durch zwei verschiedene Quellen bestimmt: endogene NO-Oxidation und Nitrataufnahme über die Nahrung, hauptsächlich aus Pflanzen. Um den komplexen NO-Zyklus unter physiologischen Bedingungen aufzuklären, haben wir die Dynamik seiner Metaboliten, Nitrat- und Nitritionen, die im Vergleich zu NO relativ stabil sind, weiter untersucht. In früheren Studien wurde die Skelettmuskulatur als Hauptspeicherorgan für Nitrationen bei Säugetieren sowie als direkte Quelle von NO während des Trainings identifiziert. Daher ist die Etablierung einer zuverlässigen Methodik zur Messung des Nitrat- und Nitritspiegels in der Skelettmuskulatur wichtig und sollte hilfreich sein, um ihre Anwendung auf andere Gewebeproben auszudehnen. Dieser Artikel erläutert ausführlich die Vorbereitung von Skelettmuskelproben mit drei verschiedenen Homogenisierungsmethoden für Nitrat- und Nitritmessungen und diskutiert wichtige Fragen im Zusammenhang mit Homogenisierungsprozessen, einschließlich der Größe der Proben. Nitrat- und Nitritkonzentrationen wurden auch über vier verschiedene Muskelgruppen hinweg verglichen.
Einleitung
Stickstoffmonoxid (NO), ein kleines gasförmiges Signalmolekül, spielt eine entscheidende Rolle bei physiologischen und pathophysiologischen Prozessen1. NO kann aus L-Arginin durch endogene Enzyme der Familie der Stickstoffmonoxidsynthase (NOS) hergestellt werden, bevor es einer schnellen Oxidation zu Nitrat (NO3-) und möglicherweise Nitrit (NO2-) in Blut und Geweben 2,3 unterzogen wird. Kürzlich wurde gezeigt, dass diese Anionen in Säugetiersystemen wieder zu NO reduziert werden4. Nitrat wird in Nitrit umgewandelt, hauptsächlich durch kommensale bakterielle Nitratreduktasen in der Mundhöhle, die auf Ionen wirken, die von den Speicheldrüsen abgesondert und direkt aufgenommen werden 5, und in gewissem Maße durch Säugetierenzyme wie Xanthinoxidoreduktase 6,7. Nitrit kann durch verschiedene Mechanismen, einschließlich Desoxyhämoglobin8, Desoxymyoglobin9, molybdänhaltige Enzyme 10 und nicht-enzymatische Reduktion in Gegenwart von Protonen11,12, weiter zu NO reduziert werden.
Dieser Nitrat-Nitrit-NO-Weg wird unter hypoxischen Bedingungen verstärkt, wobei die NOS-Aktivität verringert wird, da NOS Sauerstoff für die NO-Erzeugung4 benötigt. Viele neuere Studien haben positive Auswirkungen von diätetischem Nitrat auf die Blutdruckregulierung und die Trainingsleistung berichtet, was darauf hindeutet, dass Nitratreduktionswege zur Verstärkung der NO-Signalisierung beitragen13,14,15. Frühere Studien haben gezeigt, dass einige Skelettmuskeln wahrscheinlich die wichtigsten Nitratspeicher im Körper sind16. Im Vergleich zu Blut oder anderen inneren Organen wie Leber enthält die Skelettmuskulatur (Gluteus maximus) deutlich höhere Nitratwerte und hat eine erhebliche Masse im Säugetierkörper. Es wurde gezeigt, dass Laufbandübungen die Nitratreduktion zu Nitrit und zu NO im Gesäß in einem Rattenmodell7 verstärken. Diese Ergebnisse deuten darauf hin, dass einige Skelettmuskeln wichtige Quellen für NO durch Nitratreduktionswege in physiologischen Situationen sein könnten. Neuere Studien deuten darauf hin, dass diese Ergebnisse, einschließlich Veränderungen des Muskelnitratspiegels während des Trainings, auch beim Menschen auftreten17.
Zwei der aktuellen Autoren hatten zuvor eine Methode zur Messung des Nitrat- und Nitritspiegels in Blut und anderen flüssigen Proben etabliert18. Als jedoch die Konzentrationen dieser Anionen in Gewebehomogenaten zunächst analysiert wurden, waren detaillierte Protokolle nicht verfügbar. Um die Nitrat-Nitrit-NO-Dynamik in verschiedenen Organen zu verstehen, war es unser Ziel, eine genaue und effiziente Methode zur Messung des Nitrat- und Nitritspiegels in Säugetiergeweben einschließlich der Skelettmuskulatur zu entwickeln. In früheren Studien wurden Nagetiergewebe verwendet, um zuverlässige Homogenisierungsprozesse zu entwickeln und dann den Nitrat- und Nitritgehalt in den Homogenaten 7,16,19 zu analysieren. Die Verwendung dieser Homogenisierungsmethode wurde auf menschliche Skelettmuskelbiopsieproben ausgeweitet, wobei die Werte bestätigt wurden und vor allem die für Muskeln im Vergleich zu Blut / Plasma beobachteten Werte in ähnlichen Bereichen und Verhältnissen lagen wie bei Nagetieren17. In den letzten Jahren haben auch andere Gruppen begonnen, den Nitrat- und Nitritgehalt in Skelettmuskelhomogenaten zu messen, und berichteten über vergleichbare Werte wie die unserer Gruppe20,21.
Ziel dieses Protokollpapiers ist es, die Herstellung von Skelettmuskelhomogenaten unter Verwendung von drei verschiedenen Homogenisierungsmethoden zur anschließenden Messung des Nitrat- und Nitritgehalts detailliert zu beschreiben. Zusätzlich wurden die Auswirkungen des zur Homogenisierung verwendeten Gewebegewichts auf die Werte von Nitrat und Nitrit in Skelettmuskelproben untersucht. Wir glauben, dass diese Methoden leicht auf andere Arten von Säugetiergeweben angewendet werden können. In jüngster Zeit wurde vor allem im Bereich der Sportphysiologie auf die möglichen Unterschiede in der Nitrat/Nitrit/NO-Physiologie nach Muskelgruppen geachtet. Wir berichten auch die Mengen an Nitrat und Nitrit in vier verschiedenen Nagetiermuskeln und finden eine ungleichmäßige Verteilung beider Ionen zwischen diesen verschiedenen Muskeln; Eine Beobachtung, die weiterer Untersuchungen bedarf.
Protokoll
Das Tierprotokoll wurde vom NIDDK Animal Care and Use Committee (ASP K049-MMB-20) genehmigt. Die Tiere wurden gemäß dem aktuellen Leitfaden für die Pflege und Verwendung von Labortieren behandelt und behandelt, der auf der AAALAC-Website frei verfügbar ist.
1. Sammlung von Skelettmuskeln der Ratte
- Während eine Ratte unter tiefer Narkose steht (5% Isofluran, bestätigt durch fehlende Reaktion auf Schwanz- / Beinklemmung), beginnen Sie mit der Perfusion mit Heparin-haltiger Kochsalzlösung, indem Sie eine 19-G-Nadel in eine Spitze des linken Ventrikels einführen und einen Nick im rechten Vorhof machen. Kochsalzlösung mit Heparin durch die inneren Organe durchsickern lassen, bis mindestens 1,5 Liter/kg durch das Gewebe geflossen sind. Zu diesem Zeitpunkt sind die Tiere durch Entblutung tot und die Kadaver sind bereit, für die Probenentnahme verarbeitet zu werden.
HINWEIS: Eine gute Perfusion ist entscheidend, insbesondere für genaue Messungen von Nitrit, da Nitrit durch das verbleibende Hämoglobin zu Nitrat oxidiert wird. - Identifizieren Sie Zielmuskelgewebe und entfernen Sie es aus den Hinterbeinen22 mit sauberen chirurgischen Instrumenten. Entfernen Sie so viel Fett und Bindegewebe wie möglich aus dem Muskelgewebe.
- Legen Sie die gewünschte Muskelmenge in ein Mikrozentrifugenröhrchen und legen Sie sie dann auf Trockeneis. Bewahren Sie die mit Gewebe gefüllten Röhrchen im -80 °C Gefrierschrank auf.
HINWEIS: Bei menschlichen Biopsieproben sofort nach der Entnahme gründlich mit sauberer Gaze abtupfen, um überschüssiges Blut zu entfernen.
2. Vorbereitung für die Homogenisierung
- Herstellung einer nitritkonservierenden Lösung (Stopplösung)
- Eine klare gelbe Lösung, die 890 mM Kaliumferricyanid (K3Fe (CN) 6) und 118 mM NEM (N-Ethylmaleimid) enthält, wird in destilliertem Wasser hergestellt, wobei keine Kristalle zu vermeiden sind. Fügen Sie nichtionisches Tensid (Reinigungsmittel) im Verhältnis 1:9 (v/v, Table of Materials) hinzu und mischen Sie vorsichtig, um Schaumbildung zu vermeiden.
- Die Stopplösung wird im Verhältnis 1:9 mit destilliertem Wasser verdünnt. Legen Sie die verdünnte Stopplösung (Verhältnis 1:5 von Muskelgewebe zu verdünnter Stopplösung) in das Homogenisierungsröhrchen.
HINWEIS: Zwanzig Milligramm Gewebe erfordern 100 μL Stop-Lösung und 200 mg Gewebe erfordern 1000 μL Stop-Lösung in der Röhre. Das Vorhandensein von Reinigungsmittel in der zugesetzten Lösung ist entscheidend für die Störung der Zellmembranen. Jedes nichtionische Reinigungsmittel kann verwendet werden, aber es muss darauf geachtet werden, dass es die Chemilumineszenzmethode nicht stört.
- Gewebepräparation
- Das Gewebe aus dem -80 °C Gefrierschrank nehmen und langsam in Eis auftauen. Entfernen Sie das restliche Fett und Bindegewebe aus der Skelettmuskulatur. Schneiden Sie Stücke der Skelettmuskulatur ab und tupfen Sie sie zum Trocknen auf Gaze.
- Wiegen Sie die Menge an Gewebe (20, 50 und 200 mg). Legen Sie den vorgewogenen Skelettmuskel in die Stop-Lösung in den Homogenisierungsröhrchen oder legen Sie das vorgewogene Gewebe zur späteren Verwendung in ein sauberes Mikrozentrifugenröhrchen.
3. Homogenisierung
- Rotationshomogenisator (Abbildung 1)
- Setzen Sie das M-Typ-Röhrchen mit der vorgewogenen Skelettmuskulatur und der vorgemessenen Stopplösung in das Gerät ein. Homogenisieren Sie jede Probe zweimal (Einstellung auf den zerstörerischsten Homogenisierungszyklus) und legen Sie das Röhrchen unmittelbar nach jeder Homogenisierung für 5 min zum Abkühlen auf Eis.
- Bei 2.000 × g und 4 °C 5 min kurz zentrifugieren. Legen Sie das volle Röhrchen wieder auf Eis und fügen Sie die entsprechende Menge Methanol hinzu (≥ 99,9 %, 10x des Gewebegewichts). Wirbel gründlich für 15 s.
HINWEIS: Verwenden Sie für 20 mg Gewebe 200 μL Methanol. Methanol wird verwendet, um Proteine aus Gewebehomogenat auszufällen und stört die Chemilumineszenzmethode nicht. Wenn eine andere Proteinfällungsmethode verwendet wird, testen Sie die Kompatibilität mit Chemilumineszenz. - Noch einmal homogenisieren und 30 min auf Eis inkubieren. Zentrifugieren Sie die Proben für 35 min bei 4 °C und 3.500 × g. Saugen Sie den Überstand ab und messen Sie den Nitrit-/Nitratgehalt oder lagern Sie ihn bei -80 °C für den späteren Gebrauch.
- Perlenhomogenisator (Abbildung 2)
- Legen Sie das Skelettmuskelgewebe in ein perlenhaltiges Röhrchen (Verhältnis 1:5 für Gewebe: verdünnte Stopplösung) und homogenisieren Sie zweimal für 45 s bei der höchsten Geschwindigkeit, die auf dem verwendeten Instrument verfügbar ist. Legen Sie das Röhrchen sofort nach jeder Homogenisierung für 5 min zum Abkühlen auf Eis.
- Mit einer kleinen Tischzentrifuge (2.000 x g) 5 Sek. kurz zentrifugieren. Legen Sie das Röhrchen wieder auf Eis und fügen Sie eine entsprechende Menge Methanol hinzu (Reinheit ≥ 99,9 %, 10x des Gewebegewichts). Wirbel gründlich für 15 s.
ANMERKUNG 1: Verwenden Sie für 20 mg Gewebe 200 μL Methanol.
ANMERKUNG 2: Methanol wird verwendet, um Proteine aus Gewebehomogenat auszufällen und stört nicht die Chemilumineszenzmethode. Wenn eine andere Proteinfällungsmethode verwendet wird, testen Sie die Kompatibilität mit Chemilumineszenz. - Homogenisieren Sie erneut für 45 s bei der höchsten Geschwindigkeit, die mit dem verwendeten Gerät verfügbar ist. Auf Eis 30 min inkubieren. Zentrifuge bei 17.000 x g, 4 °C, 30 min. Saugen Sie den Überstand ab und messen Sie den Nitrit-/Nitratgehalt oder lagern Sie ihn bei -80 °C für den späteren Gebrauch.
- Pulverisierer (Abbildung 3)
- Bereiten Sie Röhrchen mit verdünnter Stopplösung (5x des Gewebegewichts) vor und wiegen Sie sie. Notieren Sie das Gewicht (Schlauch + Anschlaglösung).
- Legen Sie das Flüssigstickstoffpulverwerkzeug auf Trockeneis und warten Sie ca. 30 Minuten, bis es die gewünschte Temperatur erreicht hat.
- Mit einer in flüssigem Stickstoff gekühlten Pinzette eine Probe (bereits gemessenes Gewebegewicht) in den Pulverisierer überführen. Fügen Sie einen kleinen Löffel flüssigen Stickstoff hinzu, um sicherzustellen, dass das Gewebe bei flüssiger Stickstofftemperatur ist.
- Nachdem 95% des flüssigen Stickstoffs verdampft sind, legen Sie das Zerkleinerungswerkzeug auf das Gewebe und drücken Sie fest. Sie sollten die Probe zerquetschen fühlen. Schlagen Sie mit dem Schlägel 3-5x auf das Brechwerkzeug.
- Überprüfen Sie die Probe mit einem in flüssigem Stickstoff gekühlten Löffel auf verbleibende Stücke. Nach dem Abkühlen in flüssigem Stickstoff verwenden Sie ein Stück Seidenpapier, um gefrorenes Wasser abzuwischen, bevor Sie das Gewebe berühren. Wenn ein Stück vorhanden ist, bewegen Sie es in die Mitte und schlagen Sie dann 5-6 weitere Male mit dem Schlägel.
- Wenn die gesamte Probe pulverisiert wurde, wird das zerkleinerte Gewebe mit dem mit flüssigem Stickstoff gekühlten Löffel direkt in das vorgewogene Röhrchen mit der verdünnten Stopplösung überführt (Schritt 3.3.1). Stellen Sie sicher, dass Sie diesen Schritt schnell ausführen, denn wenn sich der zerquetschte Skelettmuskel erwärmt, wird er klebrig und schwer zu übertragen.
- Wirbel für 15 s. Stellen Sie sicher, dass kein Gewebe an der Oberseite des Röhrchens steckt, indem Sie das Röhrchen öffnen. Wenn ja, versuchen Sie, es zu entfernen und dann wieder zu wirbeln.
- Zentrifugieren Sie die Probe für 2-3 s mit einer kleinen Tischzentrifuge. Wiegen Sie das Röhrchen erneut. Berechnen Sie das Gewebegewicht, indem Sie das ursprüngliche Schlauchgewicht (Schritt 3.3.1) von diesem neuen Gewicht abziehen. Legen Sie die Röhre auf Eis.
HINWEIS: Die genauen Gewichte helfen, das genaue Gewebegewicht zu bestimmen und wie viel Gewebe während der Pulverisierung verloren ging. - Nachdem alle Proben bis Schritt 3.3.8 verarbeitet wurden, wird ein geeignetes Volumen Methanol (≥ 99,9 %, 10x des Gewebegewichts) hinzugefügt. 15 s gründlich durchziehen und 30 min auf Eis inkubieren.
HINWEIS: Verwenden Sie für 20 mg Gewebe 200 μL Methanol. Methanol wird verwendet, um Proteine aus Gewebehomogenat auszufällen und stört die Chemilumineszenzmethode nicht. Wenn eine andere Proteinfällungsmethode verwendet wird, testen Sie die Kompatibilität mit Chemilumineszenz. - Zentrifuge bei 17.000 × g, 4 °C, 30 min. Saugen Sie den Überstand ab und messen Sie den Nitrit-/Nitratgehalt oder lagern Sie ihn bei -80 °C für die spätere Verwendung.
4. Nitrit/Nitrat-Messung mit Stickstoffmonoxid-Analysator (NOA)
- Bereiten Sie alle Proben mit einer der drei verschiedenen oben beschriebenen Homogenisierungsmethoden vor und injizieren Sie sie in eine NOA für die Nitrat- und Nitritmessung.
HINWEIS: Detaillierte Protokolle für die NOA-Verwendung wurden zuvorveröffentlicht 19.
Ergebnisse
Um repräsentative Ergebnisse zu erhalten, wurde Skelettmuskelgewebe von 8 Wistar-Ratten (Männchen und Weibchen, Gewicht 250 ± 50 g) verwendet. Ratten-Skelettmuskelhomogenate (50 mg Musculus gluteus maximus für jede Methode) wurden mit drei verschiedenen Homogenisierungswerkzeugen (rotierender Homogenisator, Perlenhomogenisator und Pulverisierer) hergestellt. Die Nitrat- und Nitritgehalte dieser Homogenate wurden dann mit einem Stickstoffmonoxid-Analysator (NOA) bestimmt (Abbildung 4). Die Nitratgehalte (Abbildung 4A) in diesen drei Homogenatproben waren einander sehr ähnlich und lagen zwischen 39,6 und 45,2 nmol/g.
Interessanterweise zeigten die Nitritgehalte (Abbildung 4B) in einer mit einem Pulverisierer hergestellten Homogenatprobe den höchsten Wert (0,99 ± 0,15 nmol/g), und dieser unterschied sich statistisch von den beiden anderen Probenwerten. Um zu testen, ob die Größe der Gewebe die Homogenisierungseffizienz und die daraus resultierenden Nitrat- und Nitritwerte beeinflusst, wurden drei verschiedene Skelettmuskelgewebegrößen (Gesäßmuskelgewebe von 20, 50 und 200 mg) für die Homogenisierung durch einen Perlenhomogenisator verwendet (Abbildung 5). Weder Nitrat (Abbildung 5A) noch Nitrit (Abbildung 5B) unterschieden sich signifikant zwischen den Muskelprobengrößen. Etwas niedrigere Nitratkonzentrationen wurden jedoch beobachtet, wenn die Stichprobengröße erhöht wurde, in mehreren Experimenten aus unklaren Gründen.
Als nächstes wurden Nitrat- und Nitritspiegel in verschiedenen Arten von Nagetier-Bein-Skelettmuskelgeweben gemessen (Abbildung 6). Zusätzlich zum Musculus gluteus maximus wurden die Muskeln Tibialis anterior (TA), Extensor digitorum longus (EDL) und Gastrocnemius (jeweils 50 mg) aus Rattenbeinen isoliert und mit einem Perlenhomogenisator homogenisiert. Überraschenderweise waren die Nitratwerte des Gesäßmuskels (40,4 nmol/g) etwa doppelt so hoch wie die der anderen drei Muskelgewebe, obwohl diese Unterschiede in diesem speziellen Experiment keine statistische Signifikanz erreichten (Abbildung 6A). Die Nitritkonzentration im Gesäßmuskel war ebenfalls höher als die der anderen drei Muskelgewebe und signifikant höher als in der Gastrocnemius-Probe (Abbildung 6B).
Wir haben den Variationskoeffizienten für alle drei verwendeten Methoden bestimmt, und die Ergebnisse sind in der beigefügten Tabelle aufgeführt. Zum Vergleich zeigt die Tabelle auch die von Troutman et al.21 ermittelten Variationskoeffizienten.
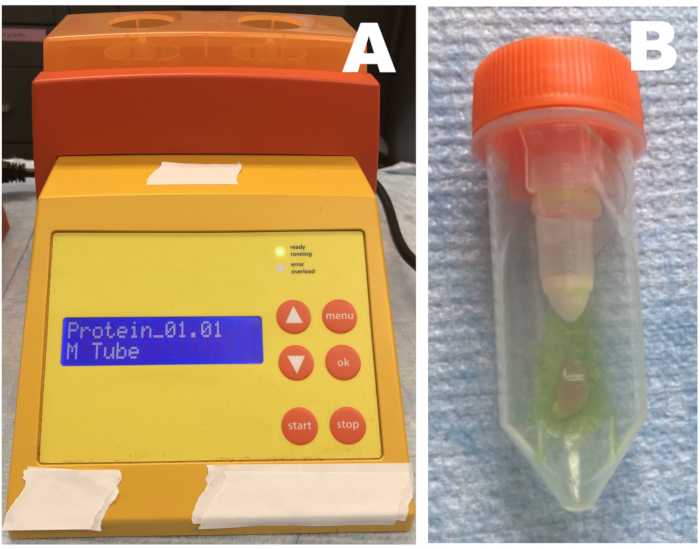
Abbildung 1: Rotationshomogenisator. (A) Homogenisator; (B) Röhrchen mit Gewebe und Stopplösung. Skelettmuskelgewebeproben werden in ein Röhrchen mit verdünnter Stopplösung gegeben und dreimal homogenisiert. Die Proben sollten nach jedem Homogenisierungsschritt sofort auf Eis gelegt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Perlenhomogenisator. a) Homogenisator; (B) Perlen mit Röhrchen. Skelettmuskelgewebeproben werden in ein perlenhaltiges Röhrchen (5 Keramikperlen) mit verdünnter Stopplösung gegeben und insgesamt dreimal homogenisiert (jeweils 45 s bei höchster Geschwindigkeit). Die Proben sollten nach jedem Homogenisierungsschritt sofort auf Eis gelegt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Pulverisierer. (A) Teile des Pulverisierers (B) Pulverisierkörper - Mörser und Stößel montiert. c) Einzelheiten der Mörser- und Pistillmontage. Pulverisierteile werden 30 Minuten auf Trockeneis gekühlt. Flüssiger Stickstoff wird in den Mörser gegeben und dann vorgewogenes Skelettmuskelgewebe hinzugefügt. Nachdem 90 Prozent des flüssigen Stickstoffs verschwunden sind, wird der obere Teil - der Stößel - in das Becken eingeführt. Der Stößel wird 5-6 mal mit einem Schlägel geschlagen, bis die Probe pulverförmig ist. Das pulverförmige Gewebe wird dann in ein Röhrchen mit Stopplösung überführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
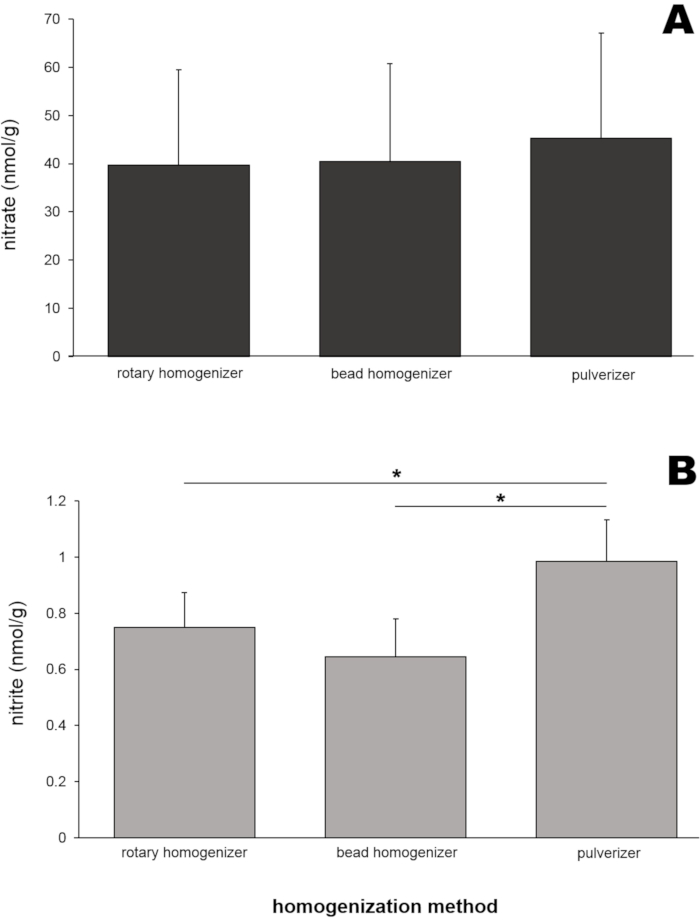
Abbildung 4: (A) Nitrat- und (B) Nitritgehalte in Gesäßmuskelhomogenaten, hergestellt durch drei verschiedene Homogenisierungsmethoden. Fünfzig Milligramm Gesäßmuskel wurden durch drei verschiedene Homogenisierungsmethoden homogenisiert. Methanol (500 μL) wurde den Homogenaten zugesetzt, um Proteine auszufällen. Eine Standard-Chemilumineszenzmethode mit Vanadiumchlorid- oder Trijodidlösung wurde verwendet, um den Nitrat- bzw. Nitritgehalt im klaren Überstand nach der Zentrifugation zu messen; n=7 (Nitrat); n=8 (Nitrit); Die Daten werden als Durchschnittswerte ± SD, * p < 0,05 unter Verwendung einer Einweg-ANOVA dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: (A) Nitrat- und (B) Nitritgehalte in verschiedenen Probengrößen des Gesäßmuskels. Drei verschiedene Größen von Gesäßmuskelhomogenaten wurden unter Verwendung eines Perlenhomogenisators hergestellt. Eine Standard-Chemilumineszenzmethode mit Vanadiumchlorid- oder Trijodidlösung wurde verwendet, um den Nitrat- bzw. Nitritgehalt im klaren Überstand nach der Zentrifugation zu messen; n=7 (Nitrat); n=8 (Nitrit); Die Daten werden als Durchschnittswerte ± SD dargestellt, Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
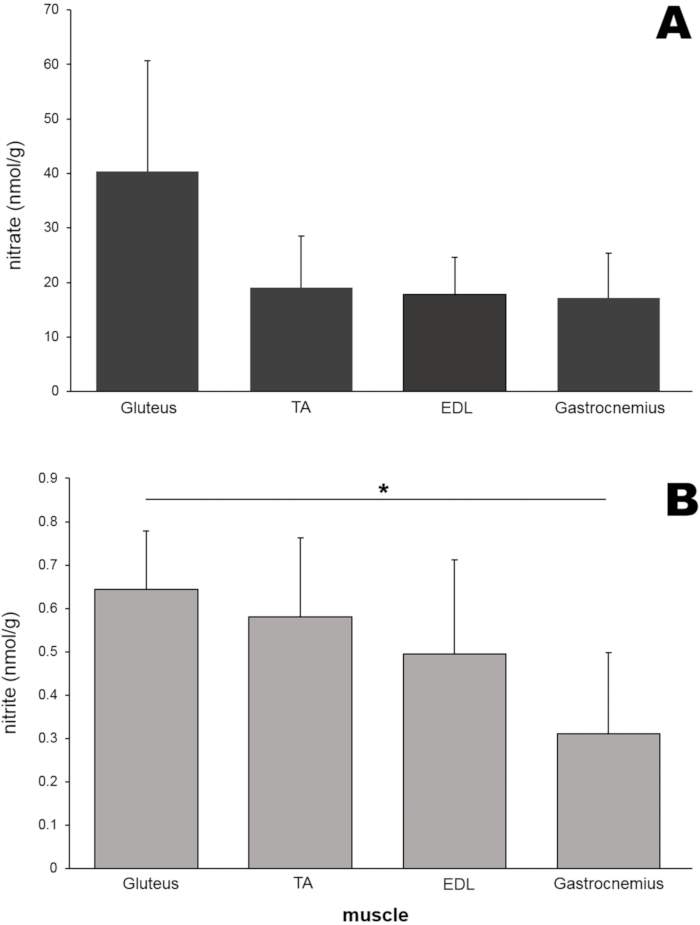
Abbildung 6: (A) Nitrat- und (B) Nitritgehalt in vier verschiedenen Muskeln. Jeder Muskel (50 mg) wurde unter Verwendung eines Perlenhomogenisators homogenisiert, und eine Standard-Chemilumineszenzmethode mit Vanadiumchlorid oder Trijodidlösung wurde verwendet, um den Nitrat- bzw. Nitritgehalt zu messen; n=4-7 (Nitrat); n=3-8 (Nitrit); Die Daten werden als Durchschnittswerte ± SD, * p < 0,05 unter Verwendung einer Einweg-ANOVA dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Um Veränderungen der NO-Metaboliten, Nitrat und Nitrit, in Abhängigkeit von physiologischen Eingriffen zu überwachen, ist es unerlässlich, die Spiegel dieser Ionen in den verschiedenen Organen zu messen, die für ihren Stoffwechsel entscheidend sind. Da Hämoglobin im Blut mit NO und seinen Metaboliten reagiert, ist es auch wichtig, Blut so schnell wie möglich aus Gewebeproben zu entfernen. So wurden die Tiere mit Kochsalzlösung perfundiert, bevor sie Skelettmuskelgewebe (Gesäß, TA, EDL, Gastrocnemius-Muskel) sammelten, und Bindegewebe und Fett um den Zielmuskel wurden sofort entfernt. Für die Homogenisierungslösung wurde eine "Stopplösung" speziell mit Ferricyanid, NEM und nichtionischem Tensid formuliert, um Nitrit in verschiedenen Geweben zu erhalten19. Das Vorhandensein von nichtionischem Reinigungsmittel ist entscheidend für die vollständige Zerstörung der Zellmembranen. Im Falle der beiden in dieser Studie verwendeten Homogenisierungsmaschinen, dem Rotationshomogenisator und dem Perlenhomogenisator, betrug das für die Homogenisierung erforderliche Volumen der Stopplösung das 5-fache des Gewebegewichts, so dass das gesamte Gewebe vollständig in die Lösung eingetaucht und homogen verarbeitet wurde.
Der Homogenisierungsprozess wurde insgesamt dreimal durchgeführt (zweimal vor der Zugabe von Methanol und ein weiteres Mal nach Zugabe von Methanol zur Ausfällung von Proteinen), jedes Mal mit einer programmierten Einstellung, die von den Geräteherstellern festgelegt wurde. Es ist wichtig, die Proben unmittelbar nach jeder Homogenisierung auf Eis zu legen, um eine Verschlechterung der Probe durch die leichte Erwärmung zu verhindern, die während der Homogenisierung entstehen kann. Für die Pulverisierungsmethode wurden Gewebeproben zunächst zu Pulver zerkleinert, während sie mit flüssigem Stickstoff gefroren wurden, dann wurden die Proben mit Stopplösung (5x Gewebegewicht) gemischt. Bei allen drei Methoden wurde Methanol (10x Gewebegewicht) zu den Proben gegeben, und die Mischung wurde 30 min auf Eis inkubiert, um Proteine auszufällen und Nitrat und Nitrit vollständig aus den Geweben zu extrahieren. Das Vorhandensein von Proteinen in der Probe kann bei Verwendung von Chemilumineszenz zu einer übermäßigen Schaumbildung der Reaktionslösung in der Kammer führen, so dass es notwendig ist, Proteine aus den Proben auszufällen. Jedes Fällungsmittel kann verwendet werden, aber es muss bestätigt werden, dass solche Mittel weder die Chemilumineszenzmethode stören noch durch Reaktion mit diesen Ionen Veränderungen der Nitrit/Nitrat-Konzentrationen verursachen.
Die Nitratgehalte in allen Gesäßproben, die mit den drei Methoden hergestellt wurden, waren sehr ähnlich (39,6-45,2 nmol/g, Abbildung 4A), was darauf hindeutet, dass diese drei Homogenisierungsmethoden gleichermaßen für die Vorbereitung von Muskelproben für die Nitratanalyse geeignet sind. Obwohl die Nitritgehalte in Proben, die durch Pulverisierung hergestellt wurden, im Vergleich zu den beiden anderen Methoden etwas höher waren (Abbildung 4B), lagen alle Messwerte in einem begrenzten Bereich (0,64-0,99 nmol/g). Der Einfluss der Gewebeprobengröße auf die Nitrat- und Nitritwerte in Skelettmuskelproben wurde untersucht, da Forscher oft mit sehr kleinen Proben zu tun haben, insbesondere von Kleintieren oder menschlichen Muskelbiopsien. Weder Nitrat- noch Nitritspiegel unterschieden sich in diesen Experimenten signifikant im Bereich von 20 bis 200 mg Skelettmuskelgewebe (Abbildung 5).
Es ist jedoch bemerkenswert, dass die Nitratgehalte, obwohl statistisch nicht signifikant, tendenziell etwas niedriger sind, wenn sie in größeren Stichproben gemessen werden (Abbildung 5). Wir haben dieses Phänomen im Laufe unserer veröffentlichten und unveröffentlichten Studien bemerkt, aber wir verstehen die Gründe dafür nicht. Daher ist es wahrscheinlich wichtig, die Probengewichte zu berücksichtigen und idealerweise während einer Studie konsistent zu halten, wenn Homogenate aus mehreren Gewebeproben hergestellt werden. Eine weitere Überlegung bei der Arbeit mit kleineren Proben (20 mg) ist, dass das endgültige Gesamtvolumen der verarbeiteten Probe nur ~ 300 μL beträgt, was die Möglichkeit, dieselbe Probe mehrmals zu messen, erheblich reduziert. Insbesondere für Studien am Menschen ist jedoch 20 mg die übliche akzeptable Größe für Muskelbiopsien.
Um zu untersuchen, ob verschiedene Muskeln in Rattenbeinen unterschiedliche Nitrat-/Nitritgehalte aufweisen, wurden die Konzentrationen dieser Ionen in vier verschiedenen Beinmuskeln verglichen (Abbildung 6). Sowohl der Nitrat- als auch der Nitritspiegel waren im Gesäßmuskel im Vergleich zu drei anderen Muskelgeweben am höchsten, obwohl die Unterschiede in dieser Studie keine statistische Signifikanz erreichten, was darauf hindeutet, dass der Nitratstoffwechsel in verschiedenen Muskeltypen unterschiedlich gesteuert werden kann. Dieses Phänomen wird derzeit genauer untersucht.
Andere Forschungsgruppen haben ebenfalls über Skelettmuskelnitratkonzentrationen berichtet, die eine signifikante Variabilität dieser Werte aufzeigen. Die Coggan-Gruppe zeigte, dass die Nitratwerte im Sprague Dawley Ratten-Soleus-Muskel je nach Muskelvorbereitungsmethode zwischen 62 und 124 nmol/g variieren21. Die gleiche Gruppe berichtete in einer anderen Studie über Nitratwerte bei SD-Ratte vastus lateralis (ca. 60 nmol/g) und Soleus (ca. 215 nmol/g)23. Ohtake et al. maßen Nitratkonzentrationen im Mausmuskel Gastrocnemius von >300 nmol/g; Genaue Methoden zur Herstellung von Muskelhomogenaten wurden jedoch nicht beschrieben24. Die Verdijk-Gruppe berichtete über Nitratgehalte in menschlichen Muskelbiopsien (Vastus lateralis) im Bereich von 54 bis 80 nmol/g je nachAlter des Teilnehmers von 20 Jahren; In einer ähnlichen Studie berichten Wylie et al. 226 nmol/g für die gleiche Muskelgruppe17. Diese Ergebnisse deuten darauf hin, dass die Konzentrationen von Nitrat/Nitrit in Skelettmuskelproben viele Faktoren widerspiegeln - physiologisch (z. B. Trainingsstatus), Umwelt (z. B. Ernährung) und technisch (Assay-Details) - die alle vermutlich zur Messvariabilität beitragen.
Wir haben den Variabilitätskoeffizienten (CV) für alle drei hier vorgestellten Methoden bestimmt - siehe beigefügte Zusatzdatei. Auch wenn CV alles andere als ideal ist und je nach verwendeter Methode variiert, sind unsere CV-Werte vergleichbar mit denen, die von Troutman et al. 21 veröffentlicht wurden, die ähnliche Methoden mit unterschiedlicher Behandlung von Proben verwenden. Leider gibt es immer noch keine klare Erklärung, warum eine so hohe Variabilität fortbesteht; Diese Arbeit ist das einzige veröffentlichte detaillierte Protokoll, das wir für die Verarbeitung von Muskelproben zur Nitrat- und Nitritbestimmung kennen.
Wir haben auch die Linearität und den Grad der Nitratausbeute aus nitrathaltigen Muskelproben gemessen (siehe beigefügte Zusatzdatei). Wenn wir drei verschiedene Nitratkonzentrationen zur Homogenisierung in Gesäßproben gaben, erhielten wir eine gute lineare Reaktion bei der Erhöhung der Nitratkonzentrationen mit ~ 80% Rückgewinnung von zugesetztem Nitrat sowohl für Perlen- als auch für Rotationshomogenisatoren. Diese Ergebnisse zeigen, dass beide Homogenisierungsmethoden zur Bestimmung des Nitrat- und Nitritgehalts in biologischen Proben mit guter Sicherheit verwendet werden können. Der Verlust von 20% zugesetztem Nitrat tritt wahrscheinlich während der Deproteinisierung und Zentrifugation von Muskelgewebehomogenat auf, wenn einige Ionen mit geladenen Proteinen oder anderen Zellteilen zusammenfallen können.
Generell hoffen wir, dass sich unsere vorgeschlagene Methode der Muskelprobenvorbereitung für Messungen von Nitrat und Nitrit nicht nur im Bereich der Bewegungsforschung, sondern auch in klinischen Studien als nützlich erweisen wird. Es gibt neuromuskuläre und/oder metabolische Störungen, die große Populationen betreffen, die mit einer Fehlfunktion des Stickstoffmonoxidzyklus zusammenhängen und von der Nitratversorgung profitieren könnten. Allerdings muss man zunächst feststellen, ob tatsächlich KEIN Mangel vorliegt und ob er durch diätetische Intervention behoben werden kann. Wir hoffen, dass mit der hier beschriebenen Methode das Schicksal von Nitrat und anderen Metaboliten des NO-Zyklus in der Skelettmuskulatur und anderen Organen überwacht werden kann.
Wir sind uns bewusst, dass zum Zeitpunkt ihrer Entwicklung Methoden der Skelettmuskelpräparation für Nitrat- und Nitritmessungen mit Chemilumineszenz (die quantitativste aller Bestimmungen der Stickoxide selbst) noch unbekannte Variablen haben, von denen einige oben diskutiert wurden. Trotz ihrer Einschränkungen ermöglichen die beschriebenen Methoden jedoch einen einigermaßen genauen Vergleich der Nitrat/Nitrit-Spiegel verschiedener Organe, einschließlich verschiedener Skelettmuskeln, und sollten die Formulierung von Hypothesen ermöglichen, die dann mit angemessener Genauigkeit getestet werden können.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben. Alan N. Schechter ist als Miterfinder mehrerer Patente aufgeführt, die an die National Institutes of Health für die Verwendung von Nitritsalzen zur Behandlung von Herz-Kreislauf-Erkrankungen erteilt wurden. Er erhält Lizenzgebühren auf der Grundlage der NIH-Lizenzierung dieser Patente für die klinische Entwicklung, aber keine andere Vergütung. Diese Vereinbarungen haben keinen Einfluss auf seine Einhaltung der JoVE-Zeitschriftenrichtlinien.
Danksagungen
Diese Arbeit wurde durch das interne NIH / NIDDK-Stipendium ZIA DK 0251041-14 an Alan N Schechter, MD, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| gentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| gentle MACS M tube | Miltenyi Biotec | 130-093-236 | Length: 87 mm; Diameter: 30 mm |
| Heparin Sodium | Hospira | NDC-0409-7620-13 | |
| Isoflurane | Baxter | NDC-10019-360-60 | |
| Methanol | Sigma | 646377 | |
| Minilys bead homogenizer | Bertin Instruments | P000673-MLYS0-A | |
| NEM; N-ethylmaleimide | Sigma | 4260 | |
| Nitric Oxide analyzer | GE | Sievers NOA 280i | |
| NP-40; 4-Nonylphenylpolyethylene glycol | Sigma | 74385 | |
| Potassium ferricyanide; K3Fe(CN)6 | Sigma | 702587 | |
| Precellys lysing kit | Bertin Instruments | P000911-LYSK0-A | contains 2 mL tubes with 2.8 mm ceramic (zirconium oxide) beads for homogenization |
| Pulverizer kit | Cellcrusher | Cellcrusher kit |
Referenzen
- Ignarro, L. J. Nitric oxide as a unique signaling molecule in the vascular system: a historical overview. Journal of Physiology and Pharmacology. 53 (4), 503-514 (2002).
- Moncada, S., Higgs, A. The L-arginine-nitric oxide pathway. New England Journal of Medicine. 329 (27), 2002-2012 (1993).
- Thomas, D. D., Liu, X., Kantrow, S. P., Lancaster, J. R. The biological lifetime of nitric oxide: implications for the perivascular dynamics of NO and O2. Proceedings of the National Academy of Sciences of the United States of America. 98 (1), 355-360 (2001).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Govoni, M., Jansson, E. A., Weitzberg, E., Lundberg, J. O. The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide. 19 (4), 333-337 (2008).
- Jansson, E. A., et al. A mammalian functional nitrate reductase that regulates nitrite and nitric oxide homeostasis. Nature Chemical Biology. 4 (7), 411-417 (2008).
- Piknova, B., Park, J. W., Kwan Jeff Lam, K., Schechter, A. N. Nitrate as a source of nitrite and nitric oxide during exercise hyperemia in rat skeletal muscle. Nitric Oxide. 55-56, 54-61 (2016).
- Cosby, K., et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation. Nature Medicine. 9 (12), 1498-1505 (2003).
- Shiva, S., et al. Deoxymyoglobin is a nitrite reductase that generates nitric oxide and regulates mitochondrial respiration. Circulation Research. 100 (5), 654-661 (2007).
- Millar, T. M., et al. Xanthine oxidoreductase catalyses the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. FEBS Letter. 427 (2), 225-228 (1998).
- Benjamin, N., et al. Stomach NO synthesis. Nature. 368 (6471), 502 (1994).
- Lundberg, J. O., Weitzberg, E., Lundberg, J. M., Alving, K. Intragastric nitric oxide production in humans: measurements in expelled air. Gut. 35 (11), 1543-1546 (1994).
- Larsen, F. J., Ekblom, B., Sahlin, K., Lundberg, J. O., Weitzberg, E. Effects of dietary nitrate on blood pressure in healthy volunteers. New England Journal of Medicine. 355 (26), 2792-2793 (2006).
- Kapil, V., et al. Inorganic nitrate supplementation lowers blood pressure in humans: role for nitrite-derived NO. Hypertension. 56 (2), 274-281 (2010).
- Jones, A. M. Dietary nitrate supplementation and exercise performance. Sports Medicine. 44, 35-45 (2014).
- Piknova, B., et al. Skeletal muscle as an endogenous nitrate reservoir. Nitric Oxide. 47, 10-16 (2015).
- Wylie, L. J., et al. Human skeletal muscle nitrate store: influence of dietary nitrate supplementation and exercise. Journal of Physiology. 597 (23), 5565-5576 (2019).
- Piknova, B., Schechter, A. N. Measurement of nitrite in blood samples using the ferricyanide-based hemoglobin oxidation assay. Methods in Molecular Biology. 704, 39-56 (2011).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring Nitrite and Nitrate, Metabolites in the Nitric Oxide Pathway, in Biological Materials using the Chemiluminescence Method. Journal of Visualized Experiments. (118), e54879 (2016).
- Nyakayiru, J., et al. Sodium nitrate ingestion increases skeletal muscle nitrate content in humans. Journal of Applied Physiology. 123 (3), 637-644 (2017).
- Troutman, A. D., Gallardo, E. J., Brown, M. B., Coggan, A. R. Measurement of nitrate and nitrite in biopsy-sized muscle samples using HPLC. Journal of Applied Physiology. 125 (5), 1475-1481 (2018).
- Shinin, V., Gayraud-Morel, B., Tajbakhsh, S. Template DNA-strand co-segregation and asymmetric cell division in skeletal muscle stem cells. Methods in Molecular Biology. 482, 295-317 (2009).
- Long, G. M., Troutman, A. D., Fisher, A., Brown, M. B., Coggan, A. R. Muscle fiber type differences in nitrate and nitrite storage and nitric oxide signaling in rats. bioRxiv. , (2020).
- Ohtake, K., et al. Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKA(y) mice. Nitric Oxide. 44, 31-38 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten