Method Article
질산염 및 아질산염 측정을 위한 쥐 골격근 균질액의 제조
* 이 저자들은 동등하게 기여했습니다
요약
우리는 질산염과 아질산염의 수준을 측정하고 비교하기 위해 쥐 골격근 조직의 4 가지 근육 그룹의 균질화를위한 세 가지 다른 방법에 대한 프로토콜을 제시합니다. 또한 조직 샘플 크기가 균질화 결과에 영향을 미치는지 여부를 조사하기 위해 다양한 샘플 가중치를 비교합니다.
초록
질산염 이온 (NO3-)은 한때 산화 질소 (NO) 대사의 불활성 최종 생성물로 생각되었습니다. 그러나 이전의 연구는 질산염 이온이 2 단계 환원 메커니즘을 통해 포유류에서 NO로 다시 전환 될 수 있음을 입증했다 : 질산염은 주로 경구 공생 박테리아에 의해 아질산염 (NO2-)으로 환원되고, 아질산염은 헴 또는 몰리브덴 함유 단백질을 포함한 여러 메커니즘에 의해 NO로 환원된다. 이 환원성 질산염 경로는 특히 심혈관계 및 근육 운동 중에 NO 매개 신호 전달 경로를 향상시키는 데 기여합니다. 이러한 활용 전에 신체의 질산염 수준은 주로 식물에서 내인성 NO 산화 및식이 질산염 섭취의 두 가지 다른 원인에 의해 결정됩니다. 생리적 환경에서 복잡한 NO 순환을 설명하기 위해 우리는 NO에 비해 상대적으로 안정적인 대사 산물, 질산염 및 아질산염 이온의 역학을 추가로 조사했습니다. 이전 연구에서 골격근은 포유류에서 질산염 이온의 주요 저장 기관이자 운동 중 NO의 직접적인 공급원으로 확인되었습니다. 따라서 골격근에서 질산염 및 아질산염 수준을 측정하기 위한 신뢰할 수 있는 방법론을 수립하는 것이 중요하며 다른 조직 샘플로 적용을 확장하는 데 도움이 되어야 합니다. 이 논문은 질산염 및 아질산염 측정을 위해 세 가지 다른 균질화 방법을 사용하여 골격근 샘플의 준비를 자세히 설명하고 샘플의 크기를 포함하여 균질화 과정과 관련된 중요한 문제에 대해 논의합니다. 질산염과 아질산염 농도는 또한 4 개의 다른 근육 그룹에서 비교되었습니다.
서문
작은 기체 신호 분자인 산화질소(NO)는 생리학적 및 병리생리학적 과정에서 중요한 역할을 합니다1. NO는 질산염 (NO 3-) 및 아마도 혈액 및 조직에서 아질산염 (NO2-)으로 빠르게 산화되기 전에 산화 질소 합성 효소 (NOS) 계열의 내인성 효소에 의해 L- 아르기닌으로부터 생성 될 수있다 2,3. 최근에, 이들 음이온은 포유류 시스템4에서 NO로 다시 환원되는 것으로 나타났다. 질산염은 주로 타액선에서 분비되고 직접 섭취되는 이온에 작용하는 구강 내 공생 박테리아 질산염 환원 효소 5에 의해 아질산염으로 전환되며, 어느 정도는 크 산틴 산화 환원 효소 6,7과 같은 포유류 효소에 의해 전환됩니다. 아질산염은 데옥시헤모글로빈8, 데옥시미오글로빈9, 몰리브덴 함유 효소(10) 및 양성자의 존재 하에서의 비효소적 환원(11,12)을 포함하는 여러 메커니즘에 의해 NO로 더 감소될 수 있다.
이 질산염-아질산염-NO 경로는 NOS가 NO 생성4에 산소를 필요로하기 때문에 NOS 활성이 감소하는 저산소 조건 하에서 강화됩니다. 최근의 많은 연구에서는 식이 질산염이 혈압 조절 및 운동 수행에 유익한 효과를 보고했으며, 이는 질산염 감소 경로가 NO 신호 전달13,14,15의 증가에 기여한다는 것을 시사합니다. 이전의 연구는 일부 골격근이 신체의 주요 질산염 저장 장소 일 가능성이 있음을 보여주었습니다16. 혈액이나 간과 같은 다른 내부 장기와 비교할 때 골격근 (대둔근)은 상당히 높은 수준의 질산염을 함유하고 포유류 신체에 상당한 질량을 가지고 있습니다. 트레드밀 운동은 쥐 모델7에서 아질산염과 둔근의 NO로의 질산염 감소를 향상시키는 것으로 나타났습니다. 이러한 결과는 일부 골격근이 생리적 상황에서 질산염 환원 경로를 통해 NO의 중요한 공급원이 될 수 있음을 의미합니다. 보다 최근의 연구에 따르면 운동 중 근육 질산염 수준의 변화를 포함한 이러한 발견은 인간에서도 발생합니다17.
현재 저자 중 두 명은 이전에 혈액 및 기타 액체 샘플에서 질산염 및 아질산염 수준을 측정하는 방법을 확립했습니다18. 그러나 조직 균질액에서 이러한 음이온의 수준을 처음 분석했을 때 자세한 프로토콜을 사용할 수 없었습니다. 여러 기관에서 질산염-아질산염-NO 역학을 이해하기 위해 우리의 목표는 골격근을 포함한 포유류 조직에서 질산염 및 아질산염 수준을 측정하는 정확하고 효율적인 방법을 개발하는 것이 었습니다. 초기 연구에서, 설치류 조직은 신뢰할 수있는 균질화 공정을 개발 한 다음 이들 균질 물 7,16,19에서 질산염 및 아질산염 함량을 분석하는 데 사용되었다. 이 균질화 방법의 사용은 인간 골격근 생검 샘플로 확장되어 값이 확인되었으며, 중요한 것은 혈액/혈장과 비교하여 근육에 대해 관찰된 값이 설치류17에서 관찰된 값과 유사한 범위 및 비율에 있다는 것입니다. 최근 몇 년 동안 다른 그룹도 골격근 균질 액에서 질산염과 아질산염 수준을 측정하기 시작하여 우리 그룹20,21에서보고 한 것과 비슷한 값을보고했습니다.
이 프로토콜 논문의 목적은 질산염 및 아질산염 수준의 후속 측정을 위해 세 가지 다른 균질화 방법을 사용하여 골격근 균질액의 제조를 자세히 설명하는 것입니다. 또한, 골격근 샘플에서 질산염 및 아질산염 값에 대한 균질화에 사용 된 조직 중량의 영향을 조사했다. 우리는 이러한 방법이 다른 유형의 포유류 조직에 쉽게 적용될 수 있다고 믿습니다. 최근 특히 운동 생리학 분야에서는 근육 그룹에 따른 질산염 / 아질산염 / NO 생리학의 가능한 차이에주의를 기울였습니다. 우리는 또한 네 개의 다른 설치류 근육에서 질산염과 아질산염의 양을보고하고 이러한 다른 근육 사이에서 두 이온의 불균일 한 분포를 찾습니다. 추가 연구가 필요한 관찰.
프로토콜
동물 프로토콜은 NIDDK 동물 관리 및 사용 위원회(ASP K049-MMB-20)에 의해 승인되었다. 동물은 AAALAC 웹사이트에서 무료로 제공되는 현재 실험실 동물의 관리 및 사용 가이드에 따라 취급 및 처리되었습니다.
1. 쥐 골격근 수집
- 쥐가 깊은 마취 (5 % 이소 플루 란, 꼬리 / 다리 꼬집음에 반응이없는 것으로 확인)에있는 동안 19G 바늘을 좌심실의 정점에 놓고 우심방에 흠집을 만들어 헤파린이 함유 된 식염수로 관류를 시작하십시오. 적어도 1.5 리터 / kg이 조직을 통해 흐를 때까지 헤파린이 함유 된 식염수가 내부 장기를 통해 관류되도록하십시오. 이 시점에서 동물은 방혈로 사망하고 시체는 샘플 수집을 위해 처리 할 준비가됩니다.
알림: 아질산염은 남아 있는 헤모글로빈에 의해 질산염으로 산화되기 때문에 특히 아질산염의 정확한 측정을 위해서는 우수한 관류를 달성하는 것이 중요합니다. - 표적 근육 조직을 확인하고 깨끗한 수술 도구를 사용하여 뒷다리(22 )로부터 이들을 절제한다. 근육 조직에서 가능한 한 많은 지방과 결합 조직을 제거하십시오.
- 원하는 양의 근육을 미세 원심 분리기 튜브에 넣은 다음 드라이 아이스에 놓습니다. 티슈로 채워진 튜브를 -80 °C 냉동고에 보관하십시오.
알림: 인간 생검 샘플의 경우 수집 즉시 깨끗한 거즈로 철저히 닦아 과도한 혈액을 제거하십시오.
2. 균질화를위한 준비
- 아질산염 보존 용액의 제조 (정지 용액)
- 증류수에 890mM 페리시안화 칼륨 (K3Fe (CN) 6) 및 118 mM NEM (N- 에틸 말레 이미드)을 함유 한 투명한 노란색 용액을 준비하여 결정이 없는지 확인합니다. 비이온성 계면활성제(세제)를 1:9 비율(v/v, 재료 표)로 첨가하고 거품이 생기지 않도록 부드럽게 혼합합니다.
- 정지 용액을 증류수로 1:9 비율로 희석합니다. 희석된 정지 용액(희석된 정지 용액에 대한 근육 조직의 1:5 비율)을 균질화 튜브에 넣습니다.
참고: 20mg의 조직에는 100μL의 정지 용액이 필요하고 200mg의 조직에는 튜브에 1000μL의 정지 용액이 필요합니다. 첨가 된 용액에 세제가 존재하는 것은 세포막의 파괴에 중요합니다. 임의의 비이온성 세제가 사용될 수 있지만, 그것이 화학발광 방법을 방해하지 않는지 확인하기 위해 주의해야 한다.
- 조직 준비
- -80 °C 냉동고에서 티슈를 꺼내 얼음에서 천천히 해동합니다. 골격근에서 남은 지방과 결합 조직을 제거하십시오. 골격근 조각을 잘라 내고 거즈로 닦아서 말립니다.
- 조직의 양을 측정합니다 (20, 50 및 200mg). 미리 칭량된 골격근을 균질화 튜브의 정지 용액에 넣거나 나중에 사용할 수 있도록 미리 칭량된 조직을 깨끗한 미세 원심분리 튜브에 넣습니다.
3. 균질화
- 로타리 균질화기(그림 1)
- 미리 계량된 골격근과 미리 측정된 정지 용액이 들어 있는 M형 튜브를 기계에 넣습니다. 각 샘플을 두 번 균질화하고(가장 파괴적인 균질화 주기로 설정) 각 균질화 직후 튜브를 얼음 위에 놓고 5분 동안 냉각시킵니다.
- 2,000 × g 및 4 ° C에서 5 분 동안 잠시 원심 분리합니다. 전체 튜브를 얼음 위에 다시 놓고 적절한 양의 메탄올(≥ 99.9%, 조직 무게의 10배)을 추가합니다. 15 초 동안 철저히 소용돌이.
참고: 20mg의 조직에는 200μL의 메탄올을 사용하십시오. 메탄올은 조직 균질액으로부터 단백질을 침전시키는데 사용되며, 화학발광법을 방해하지 않는다. 다른 단백질 침전 방법을 사용하는 경우 화학 발광과의 상용성을 테스트하십시오. - 한 번 더 균질화하고 얼음에서 30분 동안 배양합니다. 샘플을 4°C 및 3,500× g에서 35분 동안 원심분리합니다. 상청액을 흡인하고 아질산염/질산염 수준을 측정하거나 나중에 사용하기 위해 -80°C에서 보관하십시오.
- 비드 균질화기(그림 2)
- 골격근 조직을 비드 함유 튜브(조직에 대한 1:5 비율:희석된 정지 용액)에 넣고 사용된 기기에서 사용할 수 있는 최고 속도로 45초 동안 두 번 균질화합니다. 각 균질화 직후 튜브를 얼음 위에 놓고 5분 동안 식힙니다.
- 소형 데스크탑 원심분리기(2,000 x g)를 사용하여 5초 동안 간단히 원심분리합니다. 튜브를 얼음 위에 다시 놓고 적절한 양의 메탄올(순도 ≥ 99.9%, 조직 중량의 10배)을 추가합니다. 15 초 동안 철저히 소용돌이.
참고 1: 20mg의 조직에는 200μL의 메탄올을 사용하십시오.
참고 2: 메탄올은 조직 균질액으로부터 단백질을 침전시키는 데 사용되며 화학발광 방법을 방해하지 않습니다. 다른 단백질 침전 방법을 사용하는 경우 화학 발광과의 상용성을 테스트하십시오. - 사용된 기기에서 사용할 수 있는 최고 속도로 45초 동안 한 번 더 균질화합니다. 얼음 위에서 30분 동안 배양합니다. 17,000 x g, 4 °C, 30분에서 원심분리기 상청액을 흡인하고 아질산염/질산염 수준을 측정하거나 나중에 사용하기 위해 -80°C에서 보관하십시오.
- 분쇄기(그림 3)
- 희석 된 정지 용액 (조직 무게의 5 배)이 들어있는 튜브를 준비하고 무게를 잰다. 무게 (튜브 + 정지 용액)를 기록하십시오.
- 액체 질소 분쇄기 도구를 드라이 아이스에 놓고 원하는 온도에 도달 할 때까지 약 30 분 동안 기다립니다.
- 액체 질소로 식힌 핀셋을 사용하여 하나의 샘플 (이미 측정 된 조직 중량)을 분쇄기로 옮깁니다. 조직이 액체 질소 온도에 있는지 확인하기 위해 작은 숟가락의 액체 질소를 추가하십시오.
- 액체 질소의 95 %가 기화 된 후 분쇄 도구를 조직 위에 놓고 단단히 누릅니다. 샘플 호감을 느껴야합니다. 망치를 사용하여 분쇄 도구를 3-5 번 치십시오.
- 액체 질소로 냉각된 숟가락을 사용하여 샘플에 남아 있는 덩어리가 있는지 확인합니다. 액체 질소에서 식힌 후 티슈를 만지기 전에 티슈 페이퍼를 사용하여 얼어붙은 물을 닦아냅니다. 덩어리가 있으면 중앙으로 옮긴 다음 망치로 5-6 번 더 치십시오.
- 전체 샘플이 분쇄되면 액체 질소 냉각 스푼을 사용하여 분쇄 된 조직을 희석 된 정지 용액이 들어있는 사전 칭량 튜브로 직접 옮깁니다 (단계 3.3.1). 분쇄 된 골격근이 가열되면 끈적 거리고 옮기기가 어려우므로이 단계를 신속하게 수행하십시오.
- 15 초 동안 소용돌이. 튜브를 열어 튜브 상단에 붙어 있는 조직이 없는지 확인하십시오. 있는 경우 제거한 다음 다시 소용돌이를 시도하십시오.
- 작은 데스크탑 원심 분리기를 사용하여 샘플을 2-3 초 동안 원심 분리합니다. 튜브의 무게를 다시 잰다. 이 새 무게에서 원래 튜브 무게(단계 3.3.1)를 공제하여 조직 무게를 계산합니다. 튜브를 얼음 위에 놓습니다.
알림: 정확한 무게는 정확한 조직 무게와 분쇄 중에 손실된 조직의 양을 결정하는 데 도움이 됩니다. - 모든 샘플이 3.3.8 단계까지 처리되면 적절한 부피의 메탄올을 첨가합니다 (≥ 99.9 %, 조직 중량의 10 배). 15 초 동안 완전히 소용돌이하고 30 분 동안 얼음에서 배양합니다.
참고: 20mg의 조직에는 200μL의 메탄올을 사용하십시오. 메탄올은 조직 균질액으로부터 단백질을 침전시키는데 사용되며, 화학발광법을 방해하지 않는다. 다른 단백질 침전 방법을 사용하는 경우 화학 발광과의 상용성을 테스트하십시오. - 17,000 × g, 4 °C, 30 분에서 원심 분리. 상청액을 흡입하고 아질산염/질산염 수준을 측정하거나 나중에 사용할 수 있도록 -80°C에서 보관하십시오.
4. 산화질소 분석기(NOA)를 사용한 아질산염/질산염 측정
- 위에서 설명한 세 가지 균질화 방법 중 하나로 모든 샘플을 준비하고 질산염 및 아질산염 측정을 위해 NOA에 주입합니다.
참고: NOA 사용에 대한 자세한 프로토콜은 이전에19에 게시되었습니다.
결과
대표적인 결과를 얻기 위해, 8마리의 Wistar 쥐(수컷 및 암컷, 체중 250 ± 50g)로부터의 골격근 조직을 사용하였다. 래트 골격근 균질물(각 방법에 대해 대둔근 50mg)을 3개의 상이한 균질화 도구(회전 균질화기, 비드 균질화기 및 분쇄기)에 의해 제조하였다. 그런 다음 이러한 균질액의 질산염 및 아질산염 함량을 산화질소 분석기(NOA)를 사용하여 측정했습니다(그림 4). 이 세 가지 균질액 샘플의 질산염 수준(그림 4A)은 39.6에서 45.2nmol/g 범위로 서로 매우 유사했습니다.
흥미롭게도 분쇄기로 제조 한 균질 액 샘플의 아질산염 수준 (그림 4B)이 가장 높은 값 (0.99 ± 0.15 nmol / g)을 보였으며 이는 다른 두 샘플 값과 통계적으로 달랐습니다. 조직의 크기가 균질화 효율과 생성된 질산염 및 아질산염 값에 영향을 미치는지 테스트하기 위해 비드 균질화기에 의한 균질화에 세 가지 다른 골격근 조직 크기(20, 50 및 200mg의 대둔근 조직)를 사용했습니다(그림 5). 질산염 (그림 5A)이나 아질산염 (그림 5B) 수준은 근육 샘플 크기간에 크게 다르지 않았습니다. 그러나 샘플 크기가 증가했을 때 약간 낮은 질산염 농도가 관찰되었으며, 불분명 한 이유로 여러 실험에서 관찰되었습니다.
다음으로, 다양한 종류의 설치류 다리 골격근 조직에서 질산염과 아질산염 수준을 측정했습니다(그림 6). 대둔근 이외에, 전경골 (TA), 신근 디지토룸 롱 구스 (EDL) 및 비복근 근육 (각각 50mg)을 래트 다리로부터 분리하고, 비드 균질화를 사용하여 균질화하였다. 놀랍게도, 둔근의 질산염 수준 (40.4 nmol / g)은이 특정 실험에서 이러한 차이가 통계적 유의성에 도달하지 못했지만 다른 세 근육 조직보다 약 2 배 높았습니다 (그림 6A). 대둔근의 아질산염 농도도 다른 세 근육 조직보다 높았으며 비복근 샘플보다 훨씬 높았습니다 (그림 6B).
사용된 세 가지 방법 모두에 대한 변동 계수를 결정했으며 결과는 첨부된 표에 있습니다. 비교를 위해 표는 Troutman etal 21에 의해 결정된 변동 계수도 보여줍니다.
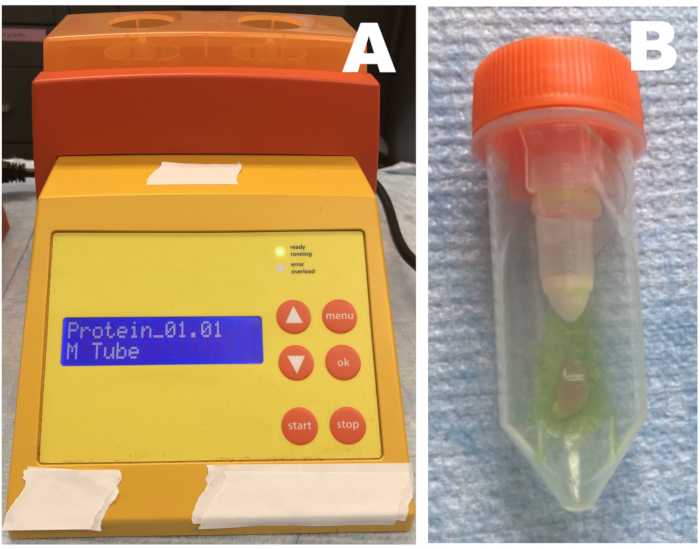
그림 1: 로타리 균질화기. (A) 균질화기; (b) 조직 및 정지 용액을 포함하는 튜브. 골격근 조직 샘플을 희석 된 정지 용액으로 튜브에 넣고 3 회 균질화합니다. 샘플은 각 균질화 단계 후에 즉시 얼음 위에 놓아야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 비드 균질화기. (a) 균질화기; (b) 비드 함유 튜브. 골격근 조직 샘플을 희석 된 정지 용액으로 비드 함유 튜브 (5 개의 세라믹 비드)에 넣고 총 3 회 균질화합니다 (각 시간에 대해 최고 속도로 45 초). 샘플은 각 균질화 단계 후에 즉시 얼음 위에 놓아야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 분쇄기 . (A) 분쇄기 부품 (B) 분쇄기 본체 - 모르타르와 유봉 조립. (C) 박격포 및 유봉 조립의 세부 사항. 분쇄기 부품을 드라이 아이스에서 30 분 동안 냉각시킵니다. 액체 질소를 모르타르에 넣은 다음 미리 무게를 잰 골격근 조직을 추가합니다. 액체 질소의 90 %가 사라진 후, 상단 부분 (유봉)이 분지에 삽입됩니다. 유봉은 샘플이 가루가 될 때까지 망치로 5-6 번 두드립니다. 그런 다음 분말 조직을 정지 용액이 있는 튜브로 옮깁니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
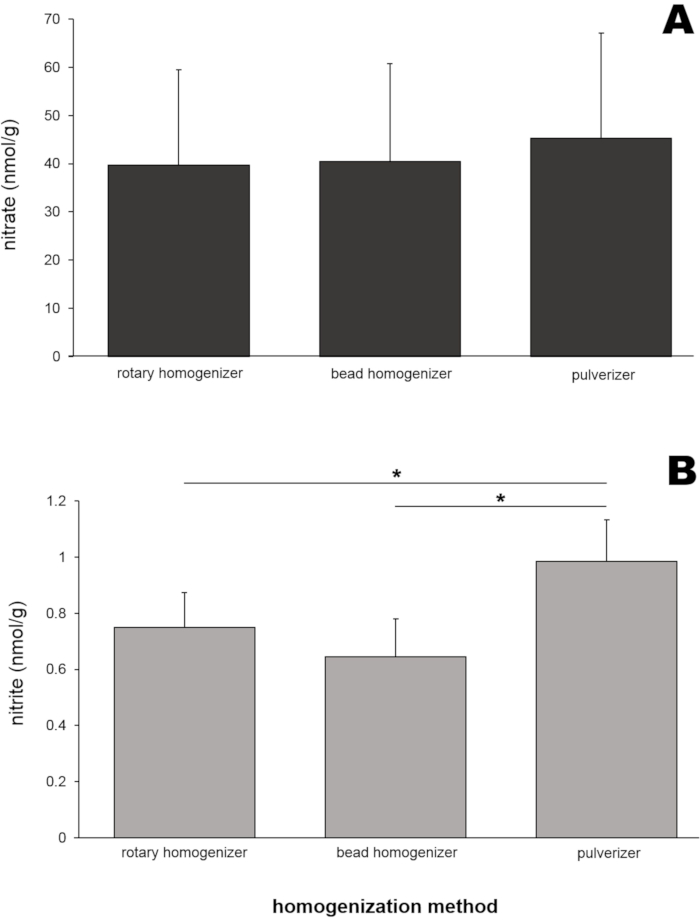
그림 4: (A) 질산염 및 (B) 세 가지 다른 균질화 방법으로 제조된 둔근 균질액의 아질산염 함량. 50 밀리그램의 둔근을 세 가지 다른 균질화 방법으로 균질화했습니다. 메탄올(500 μL)을 균질액에 첨가하여 단백질을 침전시켰다. 염화바나듐 또는 트리요오드화물 용액을 사용한 표준 화학발광법을 사용하여 원심분리 후 투명한 상청액에서 각각 질산염 및 아질산염 수준을 측정했습니다. n = 7 (질산염); n = 8 (아질산염); 데이터는 단방향 분산 분석을 사용하여 SD, *p < 0.05± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: (A) 질산염 및 (B) 아질산염 함량, 다양한 샘플 크기의 둔근. 3가지 상이한 크기의 대둔근 균질액을 비드 균질기를 사용하여 제조하였다. 염화바나듐 또는 트리요오드화물 용액을 사용한 표준 화학발광법을 사용하여 원심분리 후 투명한 상청액에서 각각 질산염 및 아질산염 수준을 측정했습니다. n = 7 (질산염); n = 8 (아질산염); 데이터는 SD± 평균으로 표시되며, 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
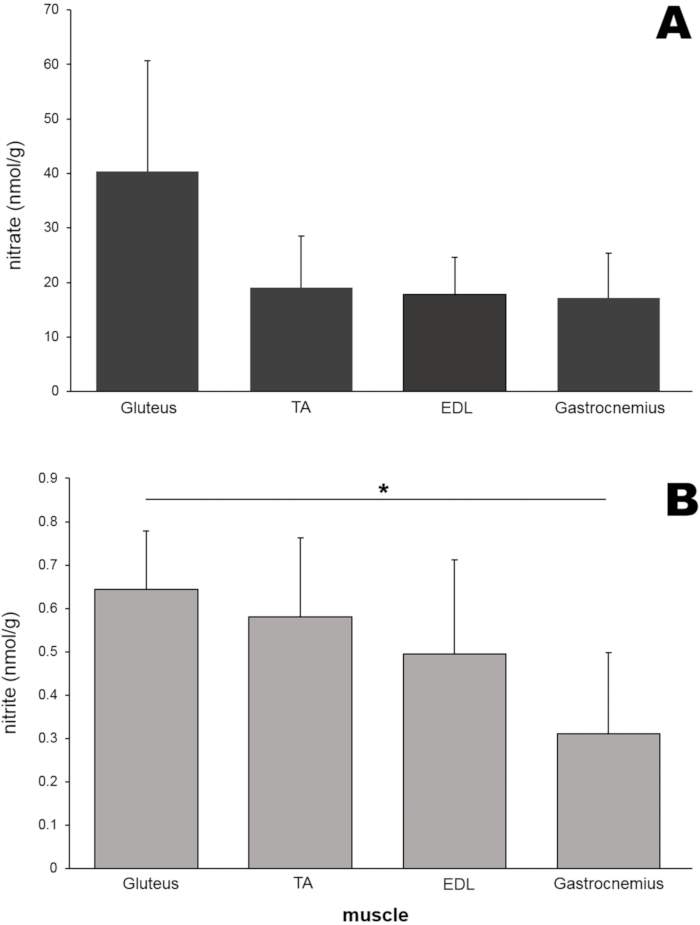
그림 6: (A) 질산염 및 (B) 아질산염 함량(4개의 다른 근육). 각 근육 (50mg)을 비드 균질화를 사용하여 균질화하고, 염화 바나듐 또는 트리 요오드화물 용액을 사용한 표준 화학 발광 방법을 사용하여 각각 질산염 및 아질산염 수준을 측정하고; n = 4-7 (질산염); n = 3-8 (아질산염); 데이터는 단방향 분산 분석을 사용하여 SD, *p < 0.05± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
생리적 개입의 기능으로 NO 대사 산물, 질산염 및 아질산염의 변화를 모니터링하려면 신진 대사에 중요한 여러 기관에서 이러한 이온의 수준을 측정하는 것이 필수적입니다. 혈액 내의 헤모글로빈은 NO 및 그 대사 산물과 반응하므로 가능한 한 조직 샘플에서 혈액을 신속하게 제거하는 것도 중요합니다. 따라서 골격근 조직 (대둔근, TA, EDL, 비복근)을 수집하기 전에 동물을 식염수로 관류시키고 표적 근육 주변의 결합 조직과 지방을 즉시 제거했습니다. 균질화 용액의 경우, '정지 용액'을 페리시안화물, NEM 및 비이온성 계면활성제로 특별히 제조하여 다양한 조직에서 아질산염을 보존하였다(19). 비이온성 세제의 존재는 세포막의 완전한 파괴에 중요합니다. 이 연구에 사용된 두 개의 균질화 기계인 회전식 균질화기와 비드 균질화기의 경우, 균질화에 필요한 정지 용액의 부피는 조직 중량의 5배로 전체 조직이 용액에 완전히 잠기고 균질하게 처리되었습니다.
균질화 공정은 총 3회(메탄올을 첨가하기 전에 2회, 메탄올을 첨가하여 단백질을 침전시키기 위해 메탄올을 첨가한 후 1회 더) 수행되었으며, 매번 기기 제조업체가 결정한 프로그래밍된 설정을 사용했습니다. 균질화 중에 발생할 수 있는 온화한 가열에 의한 샘플 열화를 방지하기 위해 각 균질화 직후 샘플을 얼음 위에 놓는 것이 중요합니다. 분쇄 방법의 경우, 조직 샘플을 초기에 액체 질소를 사용하여 동결 유지하면서 분말로 분쇄 한 다음 샘플을 정지 용액 (조직 중량 5 배)과 혼합했습니다. 세 가지 방법 모두에서 메탄올 (10x 조직 중량)을 샘플에 첨가하고 혼합물을 얼음에서 30 분 동안 배양하여 단백질을 침전시키고 조직에서 질산염과 아질산염을 완전히 추출했습니다. 샘플에 단백질이 존재하면 화학 발광을 사용할 때 챔버에서 반응 용액이 과도하게 거품을 일으킬 수 있으므로 샘플에서 단백질을 침전시켜야합니다. 임의의 침전제가 사용될 수 있지만, 그러한 약제가 화학발광법을 방해하거나 이들 이온과 반응하여 아질산염/질산염 농도의 변화를 일으키지 않는다는 것을 확인할 필요가 있다.
세 가지 방법으로 준비된 모든 둔근 샘플의 질산염 수준은 매우 유사했으며(39.6-45.2 nmol/g, 그림 4A), 이는 이 세 가지 균질화 방법이 질산염 분석을 위한 근육 샘플 준비에 동일하게 적용될 수 있음을 시사합니다. 아질산염 수준은 다른 두 가지 방법에 비해 분쇄로 제조 된 샘플에서 약간 높았지만 (그림 4B) 모든 측정 값은 제한된 범위 (0.64-0.99 nmol / g)에있었습니다. 골격근 샘플의 질산염 및 아질산염 값에 대한 조직 샘플 크기의 영향은 연구자들이 종종 매우 작은 샘플, 특히 작은 동물이나 인간 근육 생검에서 다루기 때문에 조사되었습니다. 질산염이나 아질산염 수준은 이들 실험에서 골격근 조직의 20에서 200mg 범위에서 유의하게 다르지 않았다 (그림 5).
그러나 통계적으로 유의하지는 않지만 질산염 수준은 더 큰 샘플에서 측정할 때 약간 더 낮은 경향이 있다는 점은 주목할 만합니다(그림 5). 우리는 출판 및 미발표 연구 과정에서 이러한 현상을 발견했지만 그 이유를 이해하지 못합니다. 따라서 샘플 중량을 고려하고 여러 조직 샘플에서 균질액을 준비할 때 연구 전반에 걸쳐 일관되게 유지하는 것이 이상적일 수 있습니다. 더 작은 샘플(20mg)로 작업할 때 고려해야 할 또 다른 사항은 처리된 샘플의 최종 총 부피가 ~300μL에 불과하여 동일한 샘플을 여러 번 측정할 가능성이 크게 감소한다는 것입니다. 그러나 특히 인간 연구의 경우 20mg이 근육 생검에 일반적으로 허용되는 크기입니다.
쥐 다리의 다른 근육이 다른 질산염 / 아질산염 함량을 갖는지 여부를 조사하기 위해 4 개의 다른 다리 근육에서 이러한 이온의 농도를 비교했습니다 (그림 6). 질산염과 아질산염 수치는 모두 다른 세 개의 근육 조직에 비해 둔근에서 가장 높았지만, 이 연구에서는 차이가 통계적 유의성에 도달하지 못하여 다양한 근육 유형의 질산염 대사가 다르게 지배될 수 있음을 시사합니다. 이 현상은 현재 더 자세히 조사되고 있습니다.
다른 연구 그룹도 골격근 질산염 농도를보고하여 이러한 값의 상당한 변동성을 보여줍니다. Coggan 그룹은 Sprague Dawley 쥐 솔레 우스 근육의 질산염 수치가 근육 준비 방법21에 따라 62에서 124 nmol / g까지 다양하다는 것을 보여주었습니다. 같은 그룹은 다른 연구23에서 SD 쥐 광대 외측 (약 60 nmol / g)과 솔레 우스 (약 215 nmol / g)에서 질산염 값을보고했다. Ohtake et al. 마우스 비복근에서 >300 nmol / g의 질산염 농도를 측정했습니다. 그러나, 근육 균질액 제조를 위한 정확한 방법은 기재되지 않았다24. Verdijk 그룹은 참가자 연령 20 세에 따라 54에서80 nmol / g 범위의 인간 근육 생검 (vastus lateralis)에서 질산염 함량을보고했습니다. 유사한 연구에서 Wylie et al. 동일한 근육 그룹17에 대해 226 nmol / g을보고합니다. 이러한 결과는 골격근 샘플의 질산염/아질산염 농도가 생리학적(예: 운동 상태), 환경적(예: 식단) 및 기술적(분석 세부 사항)과 같은 많은 요인을 반영한다는 것을 시사하며, 이 모든 요인은 아마도 측정 변동성에 기여할 것입니다.
여기에 제시된 세 가지 방법 모두에 대해 변동 계수 (CV)를 결정했습니다 (첨부 된 보충 파일 참조). CV가 이상적이지 않고 사용 된 방법에 따라 다르더라도 CV 값은 Troutman et al. 21 샘플의 다른 처리와 유사한 방법을 사용합니다. 불행히도 이러한 높은 변동성이 지속되는 이유에 대한 명확한 설명은 아직 없습니다. 이 논문은 질산염 및 아질산염 측정을 위해 근육 샘플을 처리하기 위해 우리가 알고 있는 유일한 상세한 프로토콜입니다.
또한 질산염 스파이크 근육 샘플에서 질산염 회수의 선형성과 정도를 측정했습니다(첨부된 보충 파일 참조). 균질화를 위해 둔근 샘플에 세 가지 다른 농도의 질산염을 추가했을 때, 비드 및 회전식 균질화기 모두에 대해 추가된 질산염의 ~80% 회수와 함께 질산염 농도 증가에서 우수한 선형 반응을 얻었습니다. 이러한 결과는 두 균질화 방법 모두 생물학적 샘플에서 질산염 및 아질산염 수준을 측정하는 데 사용할 수 있음을 보여줍니다. 첨가된 질산염의 20% 손실은 일부 이온이 하전된 단백질 또는 다른 세포 부분과 공침전될 수 있는 근육 조직 균질액의 탈단백질화 및 원심분리 중에 발생할 가능성이 있습니다.
일반적으로 질산염과 아질산염 측정을 위해 제안된 근육 샘플 준비 방법이 운동 연구 분야뿐만 아니라 임상 연구에도 유용하기를 바랍니다. 많은 인구에 영향을 미치는 신경근 및/또는 대사 장애가 있으며, 이는 산화질소 주기 오작동과 관련될 수 있으며 질산염 공급의 혜택을 받을 수 있습니다. 그러나 먼저 결핍이 실제로 존재하지 않는지, 식이 중재로 교정할 수 있는지 확인해야 합니다. 여기에 설명 된 방법으로 질산염 및 NO주기의 다른 대사 산물의 운명을 골격근 및 기타 기관에서 모니터링 할 수 있기를 바랍니다.
우리는 개발의이 시점에서 화학 발광 (질소 산화물 자체의 모든 결정 중 가장 정량적)을 사용하여 질산염 및 아질산염 측정을위한 골격근 준비 방법이 여전히 알려지지 않은 변수를 가지고 있음을 알고 있으며, 그 중 일부는 위에서 논의되었습니다. 그러나 그 한계에도 불구하고 설명 된 방법은 다른 골격근을 포함하여 다른 기관의 질산염 / 아질산염 수준을 합리적으로 정확하게 비교할 수 있으며 합리적인 정확도로 테스트 할 수있는 가설의 공식화를 허용해야합니다.
공개
저자는 이해 상충이 없다고 선언합니다. Alan N. Schechter는 심혈관 질환 치료를위한 아질산염 사용에 대해 국립 보건원에 발행 된 여러 특허의 공동 발명가로 등재되어 있습니다. 그는 임상 개발을 위해 이러한 특허에 대한 NIH 라이센스를 기반으로 로열티를 받지만 다른 보상은 받지 않습니다. 이러한 조치는 JoVE 저널 정책 준수에 영향을 미치지 않습니다.
감사의 말
이 작업은 교내 NIH / NIDDK 보조금 ZIA DK 0251041-14에서 Alan N Schechter, MD에게 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| gentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| gentle MACS M tube | Miltenyi Biotec | 130-093-236 | Length: 87 mm; Diameter: 30 mm |
| Heparin Sodium | Hospira | NDC-0409-7620-13 | |
| Isoflurane | Baxter | NDC-10019-360-60 | |
| Methanol | Sigma | 646377 | |
| Minilys bead homogenizer | Bertin Instruments | P000673-MLYS0-A | |
| NEM; N-ethylmaleimide | Sigma | 4260 | |
| Nitric Oxide analyzer | GE | Sievers NOA 280i | |
| NP-40; 4-Nonylphenylpolyethylene glycol | Sigma | 74385 | |
| Potassium ferricyanide; K3Fe(CN)6 | Sigma | 702587 | |
| Precellys lysing kit | Bertin Instruments | P000911-LYSK0-A | contains 2 mL tubes with 2.8 mm ceramic (zirconium oxide) beads for homogenization |
| Pulverizer kit | Cellcrusher | Cellcrusher kit |
참고문헌
- Ignarro, L. J. Nitric oxide as a unique signaling molecule in the vascular system: a historical overview. Journal of Physiology and Pharmacology. 53 (4), 503-514 (2002).
- Moncada, S., Higgs, A. The L-arginine-nitric oxide pathway. New England Journal of Medicine. 329 (27), 2002-2012 (1993).
- Thomas, D. D., Liu, X., Kantrow, S. P., Lancaster, J. R. The biological lifetime of nitric oxide: implications for the perivascular dynamics of NO and O2. Proceedings of the National Academy of Sciences of the United States of America. 98 (1), 355-360 (2001).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Govoni, M., Jansson, E. A., Weitzberg, E., Lundberg, J. O. The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide. 19 (4), 333-337 (2008).
- Jansson, E. A., et al. A mammalian functional nitrate reductase that regulates nitrite and nitric oxide homeostasis. Nature Chemical Biology. 4 (7), 411-417 (2008).
- Piknova, B., Park, J. W., Kwan Jeff Lam, K., Schechter, A. N. Nitrate as a source of nitrite and nitric oxide during exercise hyperemia in rat skeletal muscle. Nitric Oxide. 55-56, 54-61 (2016).
- Cosby, K., et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation. Nature Medicine. 9 (12), 1498-1505 (2003).
- Shiva, S., et al. Deoxymyoglobin is a nitrite reductase that generates nitric oxide and regulates mitochondrial respiration. Circulation Research. 100 (5), 654-661 (2007).
- Millar, T. M., et al. Xanthine oxidoreductase catalyses the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. FEBS Letter. 427 (2), 225-228 (1998).
- Benjamin, N., et al. Stomach NO synthesis. Nature. 368 (6471), 502 (1994).
- Lundberg, J. O., Weitzberg, E., Lundberg, J. M., Alving, K. Intragastric nitric oxide production in humans: measurements in expelled air. Gut. 35 (11), 1543-1546 (1994).
- Larsen, F. J., Ekblom, B., Sahlin, K., Lundberg, J. O., Weitzberg, E. Effects of dietary nitrate on blood pressure in healthy volunteers. New England Journal of Medicine. 355 (26), 2792-2793 (2006).
- Kapil, V., et al. Inorganic nitrate supplementation lowers blood pressure in humans: role for nitrite-derived NO. Hypertension. 56 (2), 274-281 (2010).
- Jones, A. M. Dietary nitrate supplementation and exercise performance. Sports Medicine. 44, 35-45 (2014).
- Piknova, B., et al. Skeletal muscle as an endogenous nitrate reservoir. Nitric Oxide. 47, 10-16 (2015).
- Wylie, L. J., et al. Human skeletal muscle nitrate store: influence of dietary nitrate supplementation and exercise. Journal of Physiology. 597 (23), 5565-5576 (2019).
- Piknova, B., Schechter, A. N. Measurement of nitrite in blood samples using the ferricyanide-based hemoglobin oxidation assay. Methods in Molecular Biology. 704, 39-56 (2011).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring Nitrite and Nitrate, Metabolites in the Nitric Oxide Pathway, in Biological Materials using the Chemiluminescence Method. Journal of Visualized Experiments. (118), e54879 (2016).
- Nyakayiru, J., et al. Sodium nitrate ingestion increases skeletal muscle nitrate content in humans. Journal of Applied Physiology. 123 (3), 637-644 (2017).
- Troutman, A. D., Gallardo, E. J., Brown, M. B., Coggan, A. R. Measurement of nitrate and nitrite in biopsy-sized muscle samples using HPLC. Journal of Applied Physiology. 125 (5), 1475-1481 (2018).
- Shinin, V., Gayraud-Morel, B., Tajbakhsh, S. Template DNA-strand co-segregation and asymmetric cell division in skeletal muscle stem cells. Methods in Molecular Biology. 482, 295-317 (2009).
- Long, G. M., Troutman, A. D., Fisher, A., Brown, M. B., Coggan, A. R. Muscle fiber type differences in nitrate and nitrite storage and nitric oxide signaling in rats. bioRxiv. , (2020).
- Ohtake, K., et al. Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKA(y) mice. Nitric Oxide. 44, 31-38 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유