Method Article
用于硝酸盐和亚硝酸盐测量的大鼠骨骼肌匀浆的制备
* 这些作者具有相同的贡献
摘要
我们提出了三种不同方法的方案,用于大鼠骨骼肌组织的四个不同肌肉群的均质化,以测量和比较硝酸盐和亚硝酸盐的水平。此外,我们比较不同的样品重量,以研究组织样品大小是否会影响均质化的结果。
摘要
硝酸盐离子(NO3-)曾经被认为是一氧化氮(NO)代谢的惰性最终产物。然而,先前的研究表明,硝酸盐离子可以通过两步还原机制在哺乳动物中转化为NO:硝酸盐主要通过口服共生细菌还原为亚硝酸盐(NO2-),然后亚硝酸盐通过多种机制还原为NO,包括通过含血红素或钼的蛋白质。这种还原性硝酸盐途径有助于增强NO介导的信号通路,特别是在心血管系统和肌肉运动期间。在这种利用之前,体内硝酸盐的水平由两个不同的来源决定:内源性NO氧化和膳食硝酸盐摄入量,主要来自植物。为了阐明生理环境中复杂的NO循环,我们进一步研究了其代谢物,硝酸盐和亚硝酸盐离子的动力学,与NO相比,它们相对稳定。在以前的研究中,骨骼肌被确定为哺乳动物硝酸盐离子的主要储存器官,也是运动期间NO的直接来源。因此,建立一种可靠的方法来测量骨骼肌中的硝酸盐和亚硝酸盐水平非常重要,并且应该有助于将其应用扩展到其他组织样本。本文详细解释了使用三种不同的均质化方法制备骨骼肌样品,用于硝酸盐和亚硝酸盐测量,并讨论了与均质化过程相关的重要问题,包括样品的大小。硝酸盐和亚硝酸盐浓度也比较了四个不同的肌肉群。
引言
一氧化氮(NO)是一种小的气态信号分子,在生理和病理生理过程中起着关键作用1。NO可以通过一氧化氮合酶(NOS)家族的内源性酶从L-精氨酸产生,然后快速氧化为硝酸盐(NO 3-),并且可能在血液和组织中的亚硝酸盐(NO2-)2,3。最近,这些阴离子已被证明在哺乳动物系统中被还原回NO4。硝酸盐转化为亚硝酸盐,主要是通过口腔内共生细菌硝酸盐还原酶作用于唾液腺分泌的离子而直接摄入5,并在一定程度上通过哺乳动物酶如黄嘌呤氧化还原酶6,7。亚硝酸盐可以通过几种机制进一步还原为NO,包括脱氧血红蛋白8,脱氧肌红蛋白9,含钼酶10和质子存在下的非酶还原11,12。
这种硝酸盐 - 亚硝酸盐 - NO途径在缺氧条件下增强,其中NOS活性降低,因为NOS需要氧气才能产生NO4。最近的许多研究报告了膳食硝酸盐对血压调节和运动表现的有益影响,这表明硝酸盐减少途径有助于NO信号传导的增强13,14,15。先前的研究表明,一些骨骼肌可能是体内主要的硝酸盐储存场所16。与血液或其他内脏器官(如肝脏)相比,骨骼肌(臀大肌)含有更高水平的硝酸盐,并且在哺乳动物体内具有相当大的质量。在大鼠模型中,跑步机运动显示可增强硝酸盐减少到亚硝酸盐和臀大肌中的NO7。这些结果表明,一些骨骼肌可能是生理情况下通过硝酸盐减少途径获得NO的重要来源。最近的研究表明,这些发现,包括运动期间肌肉硝酸盐水平的变化,也发生在人类身上17。
目前的两位作者之前已经建立了一种测量血液和其他液体样品中硝酸盐和亚硝酸盐水平的方法18。然而,当最初分析组织匀浆中这些阴离子的水平时,没有详细的方案。为了了解几个不同器官中的硝酸盐-亚硝酸盐-NO动力学,我们的目标是开发一种准确有效的方法来测量哺乳动物组织(包括骨骼肌)中的硝酸盐和亚硝酸盐水平。在早期的研究中,啮齿动物组织用于开发可靠的均质过程,然后分析这些匀浆中的硝酸盐和亚硝酸盐含量7,16,19。这种均质化方法的使用扩展到人类骨骼肌活检样本,从而确认了这些值,重要的是,与血液/血浆相比,观察到的肌肉值与在啮齿动物中观察到的值相似17。近年来,其他小组也开始测量骨骼肌匀浆中的硝酸盐和亚硝酸盐水平,报告的值与我们小组20,21报告的数值相当。
本协议论文的目的是详细描述使用三种不同的匀浆方法制备骨骼肌匀浆,以便随后测量硝酸盐和亚硝酸盐水平。此外,还研究了用于均质化的组织重量对骨骼肌样品中硝酸盐和亚硝酸盐值的影响。我们相信这些方法可以很容易地应用于其他类型的哺乳动物组织。近年来,特别是在运动生理学领域,人们开始关注硝酸盐/亚硝酸盐/NO生理学根据肌肉群可能存在的差异。我们还报告了四种不同啮齿动物肌肉中硝酸盐和亚硝酸盐的含量,并发现这两种离子在这些不同的肌肉中分布不均匀;需要进一步研究的观察结果。
研究方案
动物方案已获得NIDDK动物护理和使用委员会(ASP K049-MMB-20)的批准。动物是根据AAALAC网站上免费提供的现行实验动物护理和使用指南进行处理和治疗的。
1.大鼠骨骼肌采集
- 当大鼠处于深度麻醉状态(5%异氟醚,通过对尾部/腿部挤压没有反应来证实),通过将19G针头放入左心室的顶点并在右心房上划开切口,开始用含有肝素的盐水灌注。让含有肝素的生理盐水灌注到内脏器官,直到至少 1.5 升/千克流过组织。此时,动物因放血而死亡,尸体已准备好进行处理以进行样本采集。
注意:实现良好的灌注至关重要,特别是对于亚硝酸盐的准确测量,因为亚硝酸盐会被任何剩余的血红蛋白氧化成硝酸盐。 - 识别目标肌肉组织并使用干净的手术器械从后腿22 中切除它们。尽可能多地从肌肉组织中去除脂肪和结缔组织。
- 将所需量的肌肉放入微量离心管中,然后放在干冰上。将装满组织的试管储存在-80°C冰箱中。
注意:如果是人体活检样本,请在收集后立即用干净的纱布彻底吸干以去除多余的血液。
2. 均质准备
- 亚硝酸盐保存溶液(终止液)的制备
- 在蒸馏水中制备含有890 mM铁氰化钾(K3Fe(CN)6)和118 mM NEM(N-乙基马来酰亚胺)的透明黄色溶液,确保没有晶体。以1:9的比例(v/v, 材料表)加入非离子表面活性剂(洗涤剂),轻轻混合以避免起泡。
- 用蒸馏水以1:9的比例稀释终止溶液。将稀释的终止溶液(肌肉组织与稀释的终止溶液的比例为1:5)放入均质管中。
注意:20 毫克组织将需要 100 μL 终止溶液,200 mg 组织需要管中 1000 μL 终止溶液。添加溶液中洗涤剂的存在对于细胞膜的破坏至关重要。可以使用任何非离子洗涤剂,但必须注意验证它不会干扰化学发光方法。
- 组织制备
- 将组织从-80°C冰箱中取出,在冰中缓慢解冻。从骨骼肌中去除剩余的脂肪和结缔组织。切下骨骼肌碎片,在纱布上吸干。
- 称出组织量(20、50 和 200 毫克)。将预先称重的骨骼肌放入均质管中的终止溶液中,或将预先称重的组织放入干净的微量离心管中以供以后使用。
3. 均质化
- 旋转均质机(图1)
- 将装有预先称重的骨骼肌和预先测量的停止溶液的M型管放入机器中。将每个样品均质化两次(设置最具破坏性的均质循环),并在每次均质后立即将管放在冰上5分钟以冷却。
- 在2,000× g 和4°C下短暂离心5分钟。将整个试管放回冰上,加入适当体积的甲醇(≥99.9%,组织重量的10倍)。彻底涡旋15秒。
注意:对于 20 mg 组织,请使用 200 μL 甲醇。甲醇用于从组织匀浆中沉淀蛋白质,并且不会干扰化学发光方法。如果使用其他蛋白质沉淀方法,请测试其与化学发光的相容性。 - 再次均质并在冰上孵育30分钟。将样品在4°C和3,500 ×g下离心35分钟。吸出上清液,并测量亚硝酸盐/硝酸盐水平,或储存在-80°C以备后用。
- 磁珠均质机(图2)
- 将骨骼肌组织放入含珠的管中(组织的比例为1:5:5:稀释的终止溶液),并以所用仪器上可用的最高速度匀浆两次45秒。每次均质化后立即将管子放在冰上5分钟以冷却。
- 使用小型台式离心机(2,000 x g)短暂离心5秒。将试管放回冰上,加入适量的甲醇(纯度≥99.9%,组织重量的10倍)。彻底涡旋15秒。
注1:对于20毫克组织,使用200μL甲醇。
注2:甲醇用于从组织匀浆中沉淀蛋白质,不干扰化学发光法。如果使用其他蛋白质沉淀方法,请测试其与化学发光的相容性。 - 以所用仪器上可用的最高速度再次均质 45 秒。在冰上孵育30分钟。以17,000×g离心,4°C,30分钟。吸出上清液,并测量亚硝酸盐/硝酸盐水平,或储存在-80°C以备后用。
- 粉碎机(图3)
- 准备含有稀释终止溶液(组织重量的5倍)的试管并称重。记录重量(管+停止溶液)。
- 将液氮粉碎机工具放在干冰上,等待约30分钟以达到所需温度。
- 使用在液氮中冷却的镊子,将一个样品(已测量的组织重量)转移到粉碎机中。加入一小勺液氮,确保组织处于液氮温度。
- 95%的液氮汽化后,将破碎工具放在组织顶部,并用力按压。你应该感觉到样品的挤压。用木槌敲击破碎工具3-5倍。
- 使用在液氮中冷却的勺子检查样品是否有任何剩余的块。在液氮中冷却后,在接触纸巾之前,用一张薄纸擦去任何冷冻水。如果存在一块,请将其移动到中心,然后用木槌再敲击 5-6 次。
- 当整个样品粉碎后,使用液氮冷却的勺子将粉碎的组织直接转移到含有稀释终止溶液的预称重管中(步骤3.3.1)。请务必快速执行此步骤,因为当压碎的骨骼肌变热时,它会变得粘稠且难以转移。
- 涡旋15秒。打开试管,检查试管顶部是否有组织卡住。如果有,请尝试将其移开,然后再次涡旋。
- 使用小型台式离心机将样品离心2-3秒。再次称量试管。通过从该新重量中减去原始管重量(步骤3.3.1)来计算组织重量。将试管放在冰上。
注意:确切的重量将有助于确定确切的组织重量以及粉碎过程中损失的组织量。 - 一旦所有样品都处理完毕至步骤3.3.8,加入适量的甲醇(≥99.9%,组织重量的10倍)。彻底涡旋15秒,并在冰上孵育30分钟。
注意:对于 20 mg 组织,请使用 200 μL 甲醇。甲醇用于从组织匀浆中沉淀蛋白质,并且不会干扰化学发光方法。如果使用其他蛋白质沉淀方法,请测试其与化学发光的相容性。 - 在17,000 ×g,4°C下离心30分钟。吸出上清液并测量亚硝酸盐/硝酸盐水平,或储存在-80°C以备后用。
4. 使用一氧化氮分析仪(NOA)测量亚硝酸盐/硝酸盐
- 通过上述三种不同的均质化方法之一制备所有样品,并将它们注入NOA中进行硝酸盐和亚硝酸盐测量。
注意:NOA使用的详细协议之前已发布19。
结果
为了获得具有代表性的结果,使用了来自8只Wistar大鼠(雄性和雌性,体重250±50g)的骨骼肌组织。通过三种不同的均质工具(旋转均质机,珠均质机和粉碎机)制备大鼠骨骼肌匀浆(每种方法50mg臀大肌)。然后使用一氧化氮分析仪(NOA)测定这些匀浆的硝酸盐和亚硝酸盐含量(图4)。这三个匀浆样品中的硝酸盐水平(图4A)彼此非常相似,范围为39.6至45.2 nmol / g。
有趣的是,粉碎机制备的匀浆样品中的亚硝酸盐水平(图4B)显示出最高值(0.99±0.15 nmol / g),这与其他两个样品值在统计学上不同。为了测试组织的大小是否会影响均质效率以及产生的硝酸盐和亚硝酸盐值,使用三种不同的骨骼肌组织尺寸(20、50和200mg的臀肌组织)通过珠均质器进行均质化(图5)。硝酸盐(图5A)和亚硝酸盐(图5B)水平在肌肉样本量之间均无显着差异。然而,在多个实验中,由于尚不清楚的原因,在多个实验中观察到略低的硝酸盐浓度。
接下来,测量不同种类的啮齿动物腿部骨骼肌组织中的硝酸盐和亚硝酸盐水平(图6)。除臀大肌外,从大鼠腿中分离胫骨前肌(TA),长指伸肌(EDL)和腓肠肌(各50mg),并使用珠均质器进行均质化。令人惊讶的是,臀肌的硝酸盐水平(40.4 nmol / g)比其他三种肌肉组织的硝酸盐水平高约两倍,尽管在这个特定的实验中,这些差异没有达到统计学意义(图6A)。臀肌中的亚硝酸盐浓度也高于其他三种肌肉组织,并且明显高于腓肠肌样品中的亚硝酸盐浓度(图6B)。
我们确定了所有三种方法的变异系数,结果见附表。为了进行比较,该表还显示了由Troutman等人确定的变异系数21。
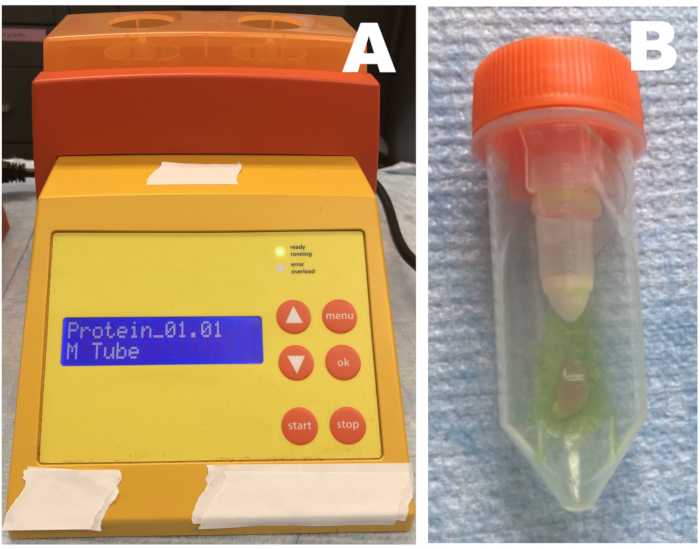
图1:旋转均质机。 (a) 均质机;(B)装有组织的管和停止溶液。将骨骼肌组织样品置于具有稀释终止溶液的管中并匀浆三次。每个均质步骤后,应立即将样品放在冰上。 请点击此处查看此图的大图。

图 2:珠子均质器。 (a) 均质机;(二)含管珠。将骨骼肌组织样品置于含有珠子的管(5个陶瓷珠)中,并稀释终止溶液并总共匀浆三次(每次以最高速度45秒)。每个均质步骤后,应立即将样品放在冰上。 请点击此处查看此图的大图。

图 3: 粉碎机。 (A)粉碎机零件 (B)粉碎机本体——研钵和研杵组装而成。(三)砂浆和研杵组装的细节。粉碎机部件在干冰上冷却30分钟。将液氮放入研钵中,然后加入预先称重的骨骼肌组织。90%的液氮消失后,顶部 - 杵 -入盆中。用木槌敲打杵5-6次,直到样品呈粉末状。然后将粉末组织转移到带有终止溶液的管中。 请点击此处查看此图的大图。
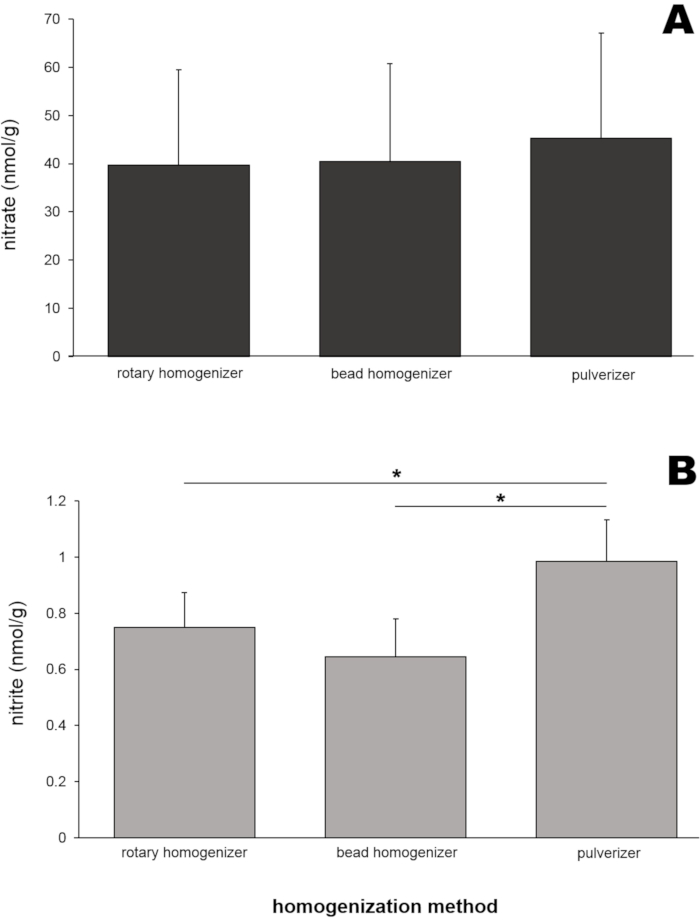
图4:(A)通过三种不同的均质方法制备的臀肌匀浆中的硝酸盐和(B)亚硝酸盐含量。 50毫克臀肌通过三种不同的均质方法均质化。将甲醇(500μL)加入匀浆中以沉淀蛋白质。采用氯化钒或三碘化物溶液的标准化学发光法分别测定离心后透明上清液中的硝酸盐和亚硝酸盐含量;n = 7(硝酸盐);n=8(亚硝酸盐);数据以平均值表示±SD,* p < 0.05,使用单因子方差分析。 请点击此处查看此图的大图。

图5:(A)不同样本大小的臀肌中的硝酸盐和(B)亚硝酸盐含量。 使用磁珠均质机制备了3种不同大小的臀肌匀浆。采用氯化钒或三碘化物溶液的标准化学发光法分别测定离心后透明上清液中的硝酸盐和亚硝酸盐含量;n = 7(硝酸盐);n=8(亚硝酸盐);数据以SD±平均值表示, 请点击此处查看此数字的大图。
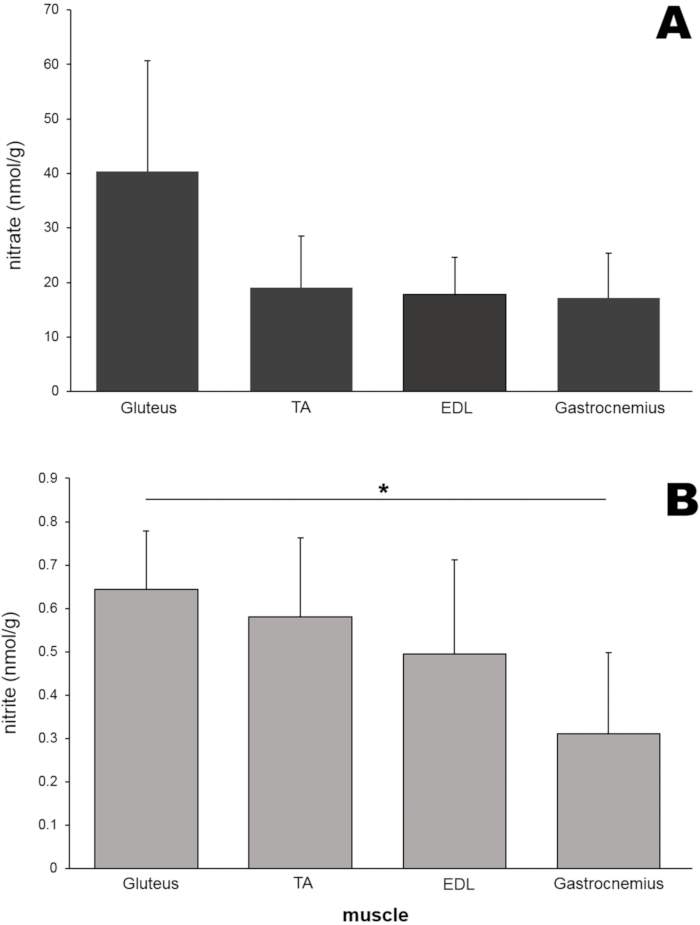
图6:(A)四种不同肌肉中的硝酸盐和(B)亚硝酸盐含量。 每块肌肉(50 mg)使用珠均质器均质,并分别使用氯化钒或三碘化物溶液的标准化学发光法测定硝酸盐和亚硝酸盐水平;n = 4-7(硝酸盐);n = 3-8(亚硝酸盐);数据以平均值表示±SD,* p < 0.05,使用单因子方差分析。 请点击此处查看此图的大图。
补充文件。请点击此处下载此文件。
讨论
为了监测NO代谢物,硝酸盐和亚硝酸盐的变化,作为生理干预的功能,必须测量这些离子在不同器官中的水平,这些离子在其代谢中至关重要。由于血液中的血红蛋白会与NO及其代谢物发生反应,因此尽可能从组织样本中快速去除血液也很重要。因此,在收集骨骼肌组织(臀肌,TA,EDL,腓肠肌)之前,用盐水灌注动物,并立即去除目标肌肉周围的结缔组织和脂肪。对于均质溶液,用铁氰化物、NEM 和非离子表面活性剂专门配制了"终止溶液",以在各种组织中保存亚硝酸盐19.非离子洗涤剂的存在对于细胞膜的完全破坏至关重要。在本研究中使用的两台均质机旋转均质机和珠式均质机的情况下,均质所需的停止溶液体积是组织重量的5倍,以便整个组织完全浸没在溶液中并均匀处理。
均质过程总共进行了三次(在加入甲醇之前两次,在加入甲醇沉淀蛋白质后再进行一次),每次使用仪器制造商确定的程序设置。重要的是在每次均质化后立即将样品放在冰上,以防止在均质过程中可能产生的温和加热导致样品变质。对于粉碎方法,首先将组织样品粉碎成粉末,同时使用液氮保持冷冻,然后将样品与终止溶液(5倍组织重量)混合。在所有三种方法中,将甲醇(10倍组织重量)加入样品中,并将混合物在冰上孵育30分钟以沉淀蛋白质并从组织中完全提取硝酸盐和亚硝酸盐。当使用化学发光时,样品中蛋白质的存在会导致反应溶液在腔室中过度起泡,因此有必要从样品中沉淀蛋白质。可以使用任何沉淀剂,但有必要确认这些沉淀剂不会干扰化学发光方法或通过与这些离子反应引起亚硝酸盐/硝酸盐浓度的任何变化。
三种方法制备的所有臀部样品中的硝酸盐水平非常相似(39.6-45.2 nmol / g, 图4A),表明这三种均质化方法同样适用于制备用于硝酸盐分析的肌肉样品。尽管与其他两种方法相比,通过粉碎制备的样品中的亚硝酸盐含量略高(图4B),但所有测量值都在有限的范围内(0.64-0.99 nmol / g)。研究了组织样本大小对骨骼肌样本中硝酸盐和亚硝酸盐值的影响,因为研究人员经常处理非常小的样本,特别是来自小动物或人类肌肉活检的样本。在这些实验中,硝酸盐和亚硝酸盐水平在20至200mg骨骼肌组织的范围内没有显着差异(图5)。
然而,值得注意的是,虽然没有统计学意义,但在较大样本中测量时,硝酸盐水平往往略低(图5)。我们在已发表和未发表的研究中注意到了这种现象,但我们不了解其原因。因此,在从多个组织样品制备匀浆时,考虑样品重量并理想情况下在整个研究中保持一致可能很重要。处理较小样品(20 mg)时的另一个考虑因素是,处理样品的最终总体积仅为~300 μL,这大大降低了多次测量同一样品的可能性。然而,特别是对于人体研究,20 毫克是肌肉活检通常可接受的大小。
为了检查大鼠腿部的不同肌肉是否具有不同的硝酸盐/亚硝酸盐含量,比较了这些离子在四种不同腿部肌肉中的浓度(图6)。与其他三种肌肉组织相比,臀肌中的硝酸盐和亚硝酸盐水平最高,尽管差异在本研究中没有达到统计学意义,这表明各种肌肉类型的硝酸盐代谢可能受到不同的控制。目前正在更详细地研究这种现象。
其他研究小组也报告了骨骼肌硝酸盐浓度,揭示了这些值的显着变化。Coggan小组表明,Sprague Dawley大鼠比目鱼肌中的硝酸盐水平从62到124 nmol / g不等,具体取决于肌肉制备方法21。在另一项研究中,同一组报告了SD大鼠侧侧(约60 nmol / g)和比目鱼(约215 nmol / g)的硝酸盐值23。Ohtake等人测量小鼠腓肠肌中的硝酸盐浓度为>300 nmol / g;然而,没有描述肌肉匀浆制备的精确方法24。Verdijk小组报告了人体肌肉活检(股外侧)中的硝酸盐含量,范围为54至80 nmol / g,具体取决于受试者的年龄20;在一项类似的研究中,Wylie等人报告同一肌肉群的226 nmol /g17。这些结果表明,骨骼肌样本中硝酸盐/亚硝酸盐的浓度反映了许多因素 - 生理(例如,运动状态),环境(例如,饮食)和技术(测定细节) - 所有这些因素都可能导致测量变异性。
我们确定了此处介绍的所有三种方法的变异系数(CV) - 参见随附的补充文件。即使CV远非理想,并且因使用的方法而异,我们的CV值也与Troutman等人发表的CV值相当。 21 使用类似的方法和不同的样品处理。不幸的是,仍然没有明确的解释为什么如此高的可变性持续存在;本文是我们所知道的唯一已发表的用于处理肌肉样品以进行硝酸盐和亚硝酸盐测定的详细方案。
我们还测量了硝酸盐加标肌肉样品的线性和硝酸盐回收程度(见随附的补充文件)。当我们在臀部样品中加入三种不同浓度的硝酸盐进行均质化时,我们在微球和旋转均质机的硝酸盐浓度增加和添加硝酸盐回收率为~80%时获得了良好的线性响应。这些结果表明,两种均质化方法均可用于生物样品中硝酸盐和亚硝酸盐含量的测定,具有较好的置信度。在肌肉组织匀浆的脱蛋白和离心过程中,当一些离子可能与带电蛋白质或其他细胞部分共同沉淀时,可能会发生20%添加硝酸盐的损失。
总的来说,我们希望我们提出的用于测量硝酸盐和亚硝酸盐的肌肉样品制备方法不仅在运动研究领域有用,而且在临床研究中都有用。有一些影响大量人群的神经肌肉和/或代谢紊乱可能与一氧化氮循环功能障碍有关,并可能受益于硝酸盐供应。然而,人们必须首先确定是否确实不存在缺乏症,以及它是否可以通过饮食干预来纠正。我们希望这里描述的方法能够监测骨骼肌和其他器官中硝酸盐和其他NO循环代谢物的命运。
我们知道,在其发展的这个阶段,使用化学发光(氮氧化物本身的所有定量测定中最定量的)测量硝酸盐和亚硝酸盐的骨骼肌制备方法仍然具有未知的变量,其中一些已在上面讨论。然而,即使有其局限性,所描述的方法也允许合理准确地比较不同器官(包括不同骨骼肌)的硝酸盐/亚硝酸盐水平,并且应该允许制定假设,然后可以合理准确地进行测试。
披露声明
作者声明他们没有利益冲突。Alan N. Schechter被列为美国国立卫生研究院颁发的几项专利的共同发明人,该专利涉及使用亚硝酸盐治疗心血管疾病。他根据NIH许可这些专利获得用于临床开发的特许权使用费,但没有其他补偿。这些安排不影响他对JoVE期刊政策的遵守。
致谢
这项工作得到了校内NIH / NIDDK授予医学博士Alan N Schechter的ZIA DK 0251041-14的支持。
材料
| Name | Company | Catalog Number | Comments |
| gentleMACS dissociator | Miltenyi Biotec | 130-093-235 | |
| gentle MACS M tube | Miltenyi Biotec | 130-093-236 | Length: 87 mm; Diameter: 30 mm |
| Heparin Sodium | Hospira | NDC-0409-7620-13 | |
| Isoflurane | Baxter | NDC-10019-360-60 | |
| Methanol | Sigma | 646377 | |
| Minilys bead homogenizer | Bertin Instruments | P000673-MLYS0-A | |
| NEM; N-ethylmaleimide | Sigma | 4260 | |
| Nitric Oxide analyzer | GE | Sievers NOA 280i | |
| NP-40; 4-Nonylphenylpolyethylene glycol | Sigma | 74385 | |
| Potassium ferricyanide; K3Fe(CN)6 | Sigma | 702587 | |
| Precellys lysing kit | Bertin Instruments | P000911-LYSK0-A | contains 2 mL tubes with 2.8 mm ceramic (zirconium oxide) beads for homogenization |
| Pulverizer kit | Cellcrusher | Cellcrusher kit |
参考文献
- Ignarro, L. J. Nitric oxide as a unique signaling molecule in the vascular system: a historical overview. Journal of Physiology and Pharmacology. 53 (4), 503-514 (2002).
- Moncada, S., Higgs, A. The L-arginine-nitric oxide pathway. New England Journal of Medicine. 329 (27), 2002-2012 (1993).
- Thomas, D. D., Liu, X., Kantrow, S. P., Lancaster, J. R. The biological lifetime of nitric oxide: implications for the perivascular dynamics of NO and O2. Proceedings of the National Academy of Sciences of the United States of America. 98 (1), 355-360 (2001).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Govoni, M., Jansson, E. A., Weitzberg, E., Lundberg, J. O. The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide. 19 (4), 333-337 (2008).
- Jansson, E. A., et al. A mammalian functional nitrate reductase that regulates nitrite and nitric oxide homeostasis. Nature Chemical Biology. 4 (7), 411-417 (2008).
- Piknova, B., Park, J. W., Kwan Jeff Lam, K., Schechter, A. N. Nitrate as a source of nitrite and nitric oxide during exercise hyperemia in rat skeletal muscle. Nitric Oxide. 55-56, 54-61 (2016).
- Cosby, K., et al. Nitrite reduction to nitric oxide by deoxyhemoglobin vasodilates the human circulation. Nature Medicine. 9 (12), 1498-1505 (2003).
- Shiva, S., et al. Deoxymyoglobin is a nitrite reductase that generates nitric oxide and regulates mitochondrial respiration. Circulation Research. 100 (5), 654-661 (2007).
- Millar, T. M., et al. Xanthine oxidoreductase catalyses the reduction of nitrates and nitrite to nitric oxide under hypoxic conditions. FEBS Letter. 427 (2), 225-228 (1998).
- Benjamin, N., et al. Stomach NO synthesis. Nature. 368 (6471), 502 (1994).
- Lundberg, J. O., Weitzberg, E., Lundberg, J. M., Alving, K. Intragastric nitric oxide production in humans: measurements in expelled air. Gut. 35 (11), 1543-1546 (1994).
- Larsen, F. J., Ekblom, B., Sahlin, K., Lundberg, J. O., Weitzberg, E. Effects of dietary nitrate on blood pressure in healthy volunteers. New England Journal of Medicine. 355 (26), 2792-2793 (2006).
- Kapil, V., et al. Inorganic nitrate supplementation lowers blood pressure in humans: role for nitrite-derived NO. Hypertension. 56 (2), 274-281 (2010).
- Jones, A. M. Dietary nitrate supplementation and exercise performance. Sports Medicine. 44, 35-45 (2014).
- Piknova, B., et al. Skeletal muscle as an endogenous nitrate reservoir. Nitric Oxide. 47, 10-16 (2015).
- Wylie, L. J., et al. Human skeletal muscle nitrate store: influence of dietary nitrate supplementation and exercise. Journal of Physiology. 597 (23), 5565-5576 (2019).
- Piknova, B., Schechter, A. N. Measurement of nitrite in blood samples using the ferricyanide-based hemoglobin oxidation assay. Methods in Molecular Biology. 704, 39-56 (2011).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring Nitrite and Nitrate, Metabolites in the Nitric Oxide Pathway, in Biological Materials using the Chemiluminescence Method. Journal of Visualized Experiments. (118), e54879 (2016).
- Nyakayiru, J., et al. Sodium nitrate ingestion increases skeletal muscle nitrate content in humans. Journal of Applied Physiology. 123 (3), 637-644 (2017).
- Troutman, A. D., Gallardo, E. J., Brown, M. B., Coggan, A. R. Measurement of nitrate and nitrite in biopsy-sized muscle samples using HPLC. Journal of Applied Physiology. 125 (5), 1475-1481 (2018).
- Shinin, V., Gayraud-Morel, B., Tajbakhsh, S. Template DNA-strand co-segregation and asymmetric cell division in skeletal muscle stem cells. Methods in Molecular Biology. 482, 295-317 (2009).
- Long, G. M., Troutman, A. D., Fisher, A., Brown, M. B., Coggan, A. R. Muscle fiber type differences in nitrate and nitrite storage and nitric oxide signaling in rats. bioRxiv. , (2020).
- Ohtake, K., et al. Dietary nitrite supplementation improves insulin resistance in type 2 diabetic KKA(y) mice. Nitric Oxide. 44, 31-38 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。