Method Article
Создание упрощенной трехмерной модели «кожа на чипе» на микрообрабатываемой микрофлюидной платформе
В этой статье
Резюме
Здесь мы представляем протокол для создания трехмерной упрощенной и недифференцированной модели кожи с использованием микрообрабатываемой микрофлюидной платформы. Параллельный поточный подход позволяет наживать in situ кожный компартмент для посева эпителиальных клеток сверху, управляемых шприцевыми насосами.
Аннотация
Эта работа представляет собой новую, экономически эффективную и надежную микрофлюидную платформу с потенциалом для создания сложных многослойных тканей. В качестве доказательства концепции была смоделирована упрощенная и недифференцированная кожа человека, содержащая дермальный (стромальный) и эпидермальный (эпителиальный) компартмент. Для достижения этой цели было разработано универсальное и надежное устройство на основе винила, разделенное на две камеры, преодолевающее некоторые недостатки, присутствующие в микрофлюидных устройствах на основе полидиметилсилоксана (PDMS) для биомедицинских применений, таких как использование дорогостоящего и специализированного оборудования или поглощение небольших гидрофобных молекул и белков. Кроме того, был разработан новый метод, основанный на параллельном потоке, позволяющий осуществлять осаждение in situ как кожного, так и эпидермального компартментов. Конструкция кожи состоит из фибриновой матрицы, содержащей первичные фибробласты человека и монослой из увековеченных кератиноцитов, посеянных сверху, который впоследствии поддерживается в условиях динамической культивации. Эта новая микрофлюидная платформа открывает возможность моделировать кожные заболевания человека и экстраполировать метод для генерации других сложных тканей.
Введение
В последнее время были достигнуты успехи в разработке и производстве моделей кожи человека in vitro для анализа токсичности косметических и фармацевтических продуктов1. Исследователи в фармацевтической и коже промышленности используют животных, мышей которых мышей являются наиболее распространенными, для тестирования своих продуктов2,3,4,5. Однако тестирование продуктов на животных не всегда предсказывает реакцию у людей, что часто приводит к отказу лекарств или неблагоприятным последствиям у людей и, следовательно, к экономическим потерям5,6. Великобритания была первой страной, которая запретила использование животных для косметического тестирования в 1998 году. Позже, в 2013 году, ЕС запретил тестирование и апробацию косметики на животных (Регламент ЕС по косметике No 1223/2009)7.
Этот запрет также рассматривается другими странами, такими как «Закон о гуманистической косметике» в США8. В дополнение к этическим соображениям, анатомические различия между кожей животных и человека делают тестирование на животных трудоемким, дорогостоящим и часто неэффективным. Кроме того, ожидается, что к 2025 году объем мирового рынка токсикологических испытаний in vitro достигнет 26,98 млрд долларовСША9. По этим причинам существует необходимость в разработке новых методов и альтернатив для этих исследований in vitro, таких как биоинженерные модели кожи человека, которые позволяют тестировать безопасность и токсическое воздействие косметики и лекарств без использования животных.
Существует два различных вида коммерчески доступных, in vitro, моделей человеческой кожи. Первый тип состоит из стратифицированных эпидермальных эквивалентов, содержащих несколько слоев дифференцирующих кератиноцитов, которые высеиваются на разных материалах. Некоторые из них были одобрены Организацией экономического сотрудничества и развития (ОЭСР) и одобрены (Европейским центром валидации альтернативных методов (ECVAM) для тестирования на коррозию и раздражение кожи, таких как EpiDerm или SkinEthic10,11,12. Второй тип представляют собой полнокожные эквиваленты со слоем дифференцированных кератиноцитов человека, посеянных на трехмерном (3D) каркасе, который содержит фибробласты, такие как T-Skin и EpiDerm-FT. Однако эти модели культивируются в статических условиях, что делает их неспособными точно представлять физиологические условия человека.
Недавний интерес был сосредоточен на создании in vitro 3D-моделей кожи в форматах клеточной культуры-вставки (CCI) с динамической перфузией13,14,15,16,17,18,19. Тем не менее, эти системы не могут рассматриваться stricto sensu как микрофлюидные «кожа на чипах» в соответствии с их классическим определением в этой области. Определение Ингбера для органов на чипе гласит, что орган должен быть помещен внутрь микрофлюидных каналов, что является условием, что только несколько устройств удовлетворяют20,21. Skin-on-chips до сих пор моделировали в основном простой эпителий в виде одноклеточных слоев и/или слоев кожных клеток, разделенных пористой мембраной22,23. Хотя были достигнуты некоторые успехи в моделировании кожи в микрофлюидных системах16,24,в настоящее время нет литературы, показывающей систему «орган на чипе», которая соответствует определению Ингбера, способная производить многослойную кожу in situ и включающая как эпителиальные, так и стромальные компоненты.
В этой работе представлена новая, экономичная, надежная микрофлюидная платформа на основе винила для приложений «кожа на чипе». Данная платформа была изготовлена путем микрообработки, что обеспечивает большую простоту в процессе изготовления, а также повышенную гибкость и универсальность в компоновке устройства, преодолевая некоторые ограничения PDMS25. Также был разработан способ введения упрощенной конструкции обшивки через параллельный поток, управляемый шприцевыми насосами. Параллельный поток позволяет двум жидкостям с очень разной вязкостью (в данном случае буферу и прегелю фибрина) перфузиться через канал без смешивания друг с другом. В качестве доказательства концепции в устройство была введена дермо-эпидермальная конструкция, содержащая фибробласты, встроенные в фибриновую матрицу, имитируя дерму, поверх которой был загружен монослой кератиноцитов для эмуляции недифференцированного эпидермиса. Высота кожного отсека может модулироваться путем изменения скорости потока. Главной новинкой этой работы, по сравнению с ранее описанными моделями22,26,27,28,29,является разработка 3D-конструкции внутри микрокамеры с помощью микрофлюидики. Хотя в этой статье представлена упрощенная недифференцированная кожа, долгосрочная цель состоит в том, чтобы создать и охарактеризовать полностью дифференцированную конструкцию кожи, чтобы продемонстрировать ее жизнеспособность и функциональность для целей лекарственного и косметического тестирования.
протокол
1. Конструкция чипа и параметры микрообработки
- Проектирование микрофлюидных слоев чипа с помощью программного обеспечения для проектирования с открытым исходным кодом FreeCAD; размеры каналов приведены в таблице 1. Включите в конструкцию четыре отверстия диаметром 2,54 мм, чтобы использовать изготовленный на заказ элайнер для правильной суперпозиции слоя.
| Длина (мкм) | Ширина (мкм) | |
| Нижняя камера | 28,400 | 800 |
| Верхняя камера | 31,000 | 800 |
Таблица 1:Размеры верхнего и нижнего каналов прибора.
- Нарежьте прозрачные виниловые листы толщиной 95 мкм на квадраты размером 30 см х 30 см, чтобы правильно вписаться в плоттер.
- Используйте программное обеспечение Brother CanvasWorkspace для создания рабочего пространства размером 30 см x 30 см и заполните его разработанными узорами для различных слоев чипа(рисунок 1A). Сохраните его в .svg файле.
- Вырежьте виниловые листы размером 30 см х 30 см с помощью краевых плоттеров(рисунок 1B-D).
- Приклейте виниловый лист к низкому клеевкому мату и при необходимости устраните все пузырьки воздуха.
- Загрузите файл .svg в плоттер и задайте параметры резания: режущее лезвие: уровень 3; давление резания: уровень 0; скорость резания: уровень 1. Поместите клейкий коврик с винилом в плоттер и начните процесс резки.
- Вырежьте рисунок верхнего канала на двусторонней ленте винил толщиной 12 мкм, выполнив предыдущие шаги.

Рисунок 1:Проектирование чипа и процесс микрообработки. ( A )Программнаякомпоновка, показывающая рабочее пространство, заполненное как верхними, так и нижними шаблонами, предназначенными для чипа. (B)Кромочные плоттеры в процессе резки; показано режущее лезвие, целый виниловый лист и клейкий коврик. (C) Узорчатый винил отделяется от разрезаемого листа. (D) Образец клеевого винилового слоя с рисунком верхнего канала. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Изготовление слоев PDMS
- Смешайте PDMS и отверждатель в соотношении 10:1 (v/v) и поместите смесь в вакуум на 15 мин, чтобы удалить пузырьки воздуха. Вылейте 55 мл смеси в квадратную культурную посуду площадью55 см2 для получения слоя толщиной 2 мм. Удалите пузырьки иглой.
- Отверждение смеси (этап 2.1) в духовке в течение 1 ч при 80 °С. Отформуйте PDMS и разрежьте его на прямоугольники с размерами чипа. Сделайте отверстия для трубки с помощью иглы шприца 18 г.
3. Сборка чипа
ПРИМЕЧАНИЕ: Для лучшего понимания см. Рисунок 2.
- Соберите все устройство с помощью элайнера для правильной регулировки каналов, входов и розеток. Нагромождение четырех виниловых слоев (с соответствующим нижним микроструктурным) для сборки нижнего канала, сохраняя покровную ленту нижнего слоя, чтобы избежать прилипания к элайнеру.
- Вырежьте и поместите пористую мембрану из поликарбоната (ПК) поверх нижнего канала, чтобы отделить его от верхнего. Будьте осторожны, чтобы не закрывать входы нижнего канала.
- Добавьте десять виниловых слоев с конструкцией верхней камеры. Наклейте двусторонний виниловый слой ленты с рисунком верхнего канала сверху. Извлеките чип из элайнера и наклейте его на стеклянную горку.
- Поместите лист PDMS толщиной 2 мм поверх двустороннего винилового слоя ленты, чтобы обеспечить соответствующее крепление для труб и избежать утечки. Оставьте вес поверх чипа на ночь, чтобы убедиться, что чип полностью водонепроницаем. Стерилизуют чип промывкой 70% v/v этанола в течение 5 мин, а затем промывают дистиллированнойH2O.

Рисунок 2:Микрофлюидная сборка чипа. (А)Общая схема сборки устройства. Нижняя и верхняя камеры состоят из четырех и одиннадцати наложенных виниловых листов соответственно. (B) Верхний и боковой вид микрофлюидного чипа. Верхний и нижний каналы представлены в розовом и синем цветах соответственно. (C) Изображение сборки чипа с помощью изготовленного на заказ элайнера. (D) Изображение чипа после полной сборки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Соединения насосов
ПРИМЕЧАНИЕ: Графическое представление соединений насосов показано на рисунке 3.
- Подключите насос 1 к входу в верхнюю камеру 1 (UCi1).
- Подключите насос 2 к входу в верхнюю камеру 2 (UCi2).
- Подключите насос 3 к входу нижней камеры (LCi).
- Подключите выход верхней камеры (UCo) и выход нижней камеры (LCo) к отработаной трубе.
- Подключите шприцы к каждому входу с помощью политетрафторэтиленовых (PTFE) трубок и соединителей из нержавеющей стали 18 Г.

Рисунок 3:Расположение соединений насосов и входов/выпускных отверстий. (A) Схема, показывающая соединение трех различных насосов с их соответствующими входами. Розетки подключаются к контейнеру для отходов. (B) Изображение чипа с маркированными входами и выходами. Сокращения: LCi = нижний вход камеры; LCo = выход из нижней камеры; UCi1 = вход в верхнюю камеру 1; UCi2 = вход в верхнюю камеру 2; UCo = выход из верхней камеры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Клеточная культура
ПРИМЕЧАНИЕ: Клеточная линия HaCaT имеет коммерческое происхождение. Первичные фибробласты человека поступают от здоровых доноров и были получены из коллекции биологических образцов человеческого происхождения, зарегистрированных в "Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III".
- Работают в клетке культуры капюшона, предварительно стерилизуемом под ультрафиолетовым светом и протираемым этанолом.
- Оттаить клетки H2B-GFP-HaCaT (увековеченные кератиноциты кожи человека, hKCs) и GFP-человеческие первичные фибробласты (hFBs) при 37 °C, добавить 2 мл питательной среды и центрифугу в течение 7 мин при 20 °C при 250 × г.
ПРИМЕЧАНИЕ: Клетки H2B-GFP-HaCaT представляют собой увековеченные человеком кератиноциты, модифицированные для экспрессии гибридного гистина H2B-зеленого флуоресцентного белка (GFP), обеспечивающего их ядра зеленой флуоресценцией. GFP-hFB представляют собой первичные фибробласты человека, преобразованные вектором pLZRS-IRES-EGFP для экспрессии цитоплазматической зеленой флуоресценции. Эти клетки были модифицированы в соответствии с ранее опубликованными протоколами30,31 - Культивируем как hKCs, так и hFBs в 1x DMEM, дополненный 10% фетальной бытовой сывороткой и 1% антибиотиком/антимикотическим раствором. Перед использованием предварительно разогреть культурную среду при 37 °C.
- Отсоедините клетки, промыв их 1x фосфат-буферным физиологическим раствором (PBS), добавив 2 мл трипсина / этилендиамина тетрауксусной кислоты (ЭДТА) и инкубируя их в течение 10 минут при 37 °C.
- Инактивируют трипсин, добавляя 4 мл питательной среды. Повторно суспендировать клетки и перенести их в трубку 15 мл. Удалите 10 мкл, чтобы подсчитать клетки в камере Нойбауэра и определить соответствующую концентрацию.
- Центрифугировать 15 мл в течение 7 мин при 20 °C при 250 × г. Удалите супернатант и повторно суспендируют гранулы в желаемой концентрации: hFBs в 50 000 клеток/мл и hKCs в 5·× 106 клеток/мл.
6. Фибриноген прегель препарат
- Активируют тромбин путем добавления 1 млCaCl2 (1% мас./об.в NaCl) во флакон.
- Для получения 1 мл гидрогеля фибрина добавляют следующие компоненты при конечной концентрации фибрина 3,5 мг/мл: 59 мкл активированного тромбина (10 единиц NIH/мл), 59 мкл транексамовойкислоты (Таблица материалов,100 мг/мл), 764 мкл культурального материала, содержащего 50 000 гФБ/мл, 118 мкл фибриногена (20 мг/мл в NaCl (0,9% мас./об.)).
ПРИМЕЧАНИЕ: Фибриноген должен быть добавлен в последний момент.
7. Протокол параллельного потока
- Насос 1x PBS с насосом 3 через LCi при 50 мкл/мин в течение всего процесса.
- Перекачивайте жертвенную жидкость (1x PBS) с насосом 2 через UCi2 со скоростью 100 мкл/мин.
- Загрузите шприц с предварительным гелем, быстро поместите его в насос 1 и запустите его со скоростью 200 мкл/мин(рисунок 4A).
- Остановите насосы 1 и 2, как только предварительный гель выйдет из UCo.
- Оставьте чип без снятия трубки при 37 °C в течение не менее 10 минут, чтобы обеспечить гелеобразование.
- Перекачиваем культурную среду со скоростью 50 мкл/ч с насосом 3 через UCi2 в течение ночи.
- Блок UCi1 с колпачком.
8. однослойный посев hKCs
- Проверьте под микроскопом, что hFB распространяются через 24 ч после генерации кожного отсека.
- Вводят гКК с насосом 2 через UCi2 при 5 ×·106 клеток/мл при 40 мкл/мин в течение 1 мин(рисунок 4В).
- Оставьте чип на ночь при температуре 37 °C в насыщенном влажностью инкубаторе для прикрепления клеток.
- Перекачиваем свежую питательную среду с насосом 3 только через LCi при 50 мкл/мин(рисунок 4C).

Рисунок 4:Микрофлюидный протокол для генерации дермо-эпидермальной конструкции. (A) Поперечное поперечное сечение, показывающее процесс параллельного потока для генерации дермального компартмента. (B)Посев монослоя кератиноцитов через 24 ч после генерации дермального компартмента. (C)Поддержание клеточной культуры внутри микрофлюидного устройства. (D) Поперечное восстановление кожи внутри чипа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
9. Анализ жизнеспособности клеток
ПРИМЕЧАНИЕ: Live/Dead kit окрашивает клетки с зеленой или красной флуоресценцией в зависимости от их живого или мертвого состояния. Для правильной дифференциации жизнеспособности на этом этапе необходимо использовать нефлуоресцентные гКК и гФУ. Все этапы процедуры проводятся через UCi2 с насосом 2.
- Промыть верхний канал с 1x PBS в течение 5 мин при 50 мкл/мин для удаления питательной среды.
- Перекачиваем воздух для удаления 1x PBS со скоростью 50 мкл/мин.
- Приготовьте раствор кальцеина AM/ethidium homodimer-1 Kit (Live/Dead), следуя инструкциям производителя.
- Перекачивать живой/мертвый раствор при 50 мкл/мин в течение 2 мин.
- Инкубировать 30 мин при 37 °C в темноте.
- Промывайте верхний канал, перекачивая 1x PBS со скоростью 50 мкл/мин в течение 2 мин, чтобы удалить оставшийся реагент.
- Наблюдайте за образцом под конфокальным микроскопом. Используйте длину волны возбуждения 495/590 нм и длину волны излучения 519/617 нм для живых и мертвых клеток соответственно.
Результаты
Спроектированный чип состоит из двух жидкостных камер, разделенных мембраной PC размером пор 5 мкм, которая позволяет расти клетке, позволяя проходить молекулам, способствующим росту, из нижней камеры. Верхняя камера удерживает тканевую конструкцию, в данном случае монослой гКЦ на гидрогеле фибрина, содержащем hFBs.
Высота каналов определяется количеством клеевых листов, добавляемых к каждому каналу. Нижняя камера состоит из 4 слоев (380 мкм), а верхняя из 10 односторонних слоев ленты и двусторонней (962 мкм). Размеры чипа составляют 4 см х 2 см, что усиливает его манипуляции. Клейкие виниловые листы обеспечивают водонепроницаемость и прозрачность для визуального осмотра устройства. Слой PDMS был полезен для правильного крепления труб, чтобы избежать утечки из отверстий, где были закреплены трубы.
Согласно опубликованной литературе, о вводимости клеточно-содержащих гидрогелей в микрофлюидные камеры с использованием шприцевых насосов до настоящего времени не сообщалось. По этой причине необходимо было оценить инъекционную способность пре-геля фибрина. Мы заметили, что при расходе 50 мкл/мин шприц блокировался. Однако скорость потока выше 200 мкл/мин может повредить клетки. Проведены реологические исследования для проверки истончения сдвига пре-геля фибрина, получения вязкостей от 10 до 50 сП в пределах выбранного диапазона скорости потока (50-200 мкл/мин). Эти результаты помогли установить условия работы этой системы.
В данной работе был разработан метод параллельного потока, основанный на генерации двух наложенных ламинарного потока, нижний из которых является прегелем, а верхний - жертвенной жидкостью (PBS). Численно решая уравнения Навье-Стокса и накладывая соответствующие граничные условия, мы обнаружили, что существует множество возможных решений для получения желаемой высоты. Учитывая пределы скорости сдвига, установленные ранее, для достижения гидрогеля высотой около 500 мкм скорость потока составляла 104 и 222 мкл / мин для жертвенного PBS и пре-геля соответственно. На практике для простоты использовались скорости микропотока 100 и 200 мкл/мин. При повторном введении в модель было обнаружено, что эти значения приводят к высоте геля 576 мкм, что очень похоже на ожидаемые значения(рисунок 5B). Для экспериментальной проверки функционирования предложенного способа измеряли высоту гидрогеля вдоль верхней камеры. Наблюдалась средняя высота 550 мкм(рисунок 5А),весьма похожая на предсказание нашей математической модели.
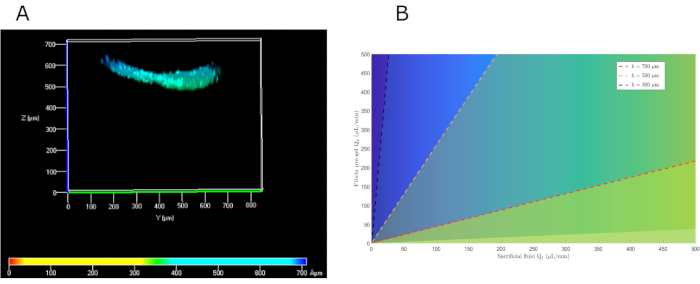
Рисунок 5:Математические решения параллельного потока для выбора соответствующих прегелевых и жертвенных потоков жидкости для получения желаемой высоты дермы. (A) Вид спереди конфокального изображения hKCs, посеянных поверх фибринового геля для оценки его высоты. (B) Математическое решение для различных высот в зависимости от скорости потока пре-геля и PBS. Сокращения: hKCs = увековеченные кератиноциты кожи человека; PBS = фосфатно-буферный физиологический раствор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
При установлении протокола в начале PBS не промывали через нижний канал, что приводило к расхождениям между теоретической высотой геля и измеренной. Эта разница в росте составила ~40% по сравнению с расчетной(рисунок 6). Как только протокол был оптимизирован и PBS прокачан через нижнюю камеру, эта потеря в высоте была разрешена(рисунок 5).
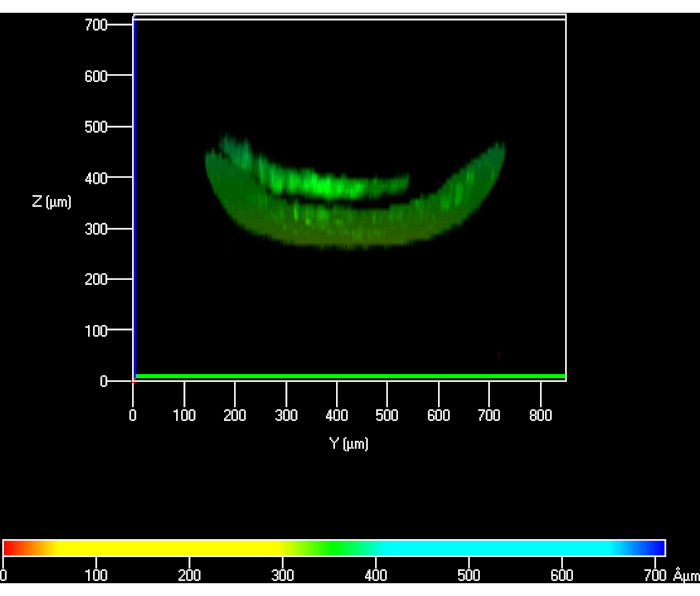
Рисунок 6:Конфокальный вид гКЦ, посеянных поверх гидрогеля для измерения его высоты, когда PBS не прокачивался через нижнюю камеру. Сокращения: hKCs = увековеченные кератиноциты кожи человека; PBS = фосфатно-буферный физиологический раствор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На фиг.7А показано флуоресцентное изображение верхней камеры сверху, содержащее фибриновый гидрогель со встроенными GFP-hFB, демонстрирующее, что через 24 ч после нагрузки ячейки равномерно распределены вдоль камеры и хорошо распределены. На рисунке 7B показаны слие GFP-hKCs, посеянные поверх гидрогеля.
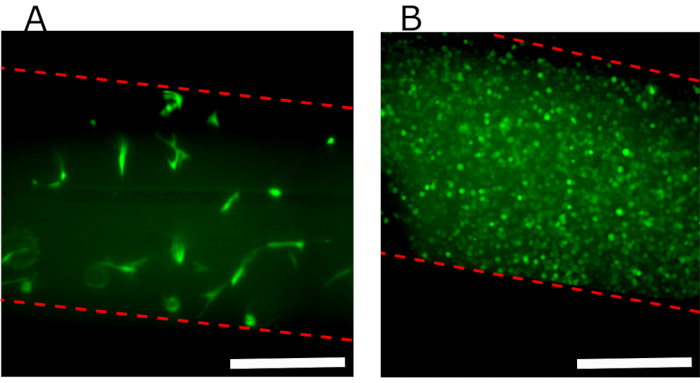
Рисунок 7:Флуоресцентные изображения верхнего канала, показывающие различные клетки, засеянные в устройстве. (A) Вид сверху верхней камеры через 24 ч после протокола параллельного потока, показывающий hFB, встроенные в фибриновый гель. (B)Конфлюент GFP-hKCs, посеянный поверх гидрогеля через 24 ч после получения гидрогеля. Пунктирная красная линия обозначает стены канала. Шкала стержней: 400 мкм. Сокращения: hFBs = первичные фибробласты человека; GFP-hKCs = зеленые флуоресцентные белково-экспрессные кератиноциты кожи человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Важно держать систему закрытой в течение ночи до тех пор, пока hKCs не отложатся и не прикрепятся к поверхности гидрогеля. Когда трубка удаляется перед присоединением клеток, пузырьки воздуха входят в канал и смещают ячейки, что приводит к неоднородному слежному монослою, как показано на рисунке 8.

Рисунок 8:Вид сверху поверхности гидрогеля при снятии трубки сразу после посева гКЦ. Пунктирная красная линия обозначает стены канала. Шкала: 400 мкм. Сокращения: hKCs = увековеченные кератиноциты кожи человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Тест на жизнеспособность клеток, выполненный на hFB, встроенных в гидрогель, проводили через 24 ч после загрузки с использованием метода параллельного потока, показывая жизнеспособность ячейки ~95%. Тот же тест, проведенный на клетках hKCs через 24 ч после посева их на гидрогель фибрина, показал аналогичные результаты. Следующим шагом было создание дермо-эпидермальной конструкции и изучение ее структуры с помощью конфокальной микроскопии через 24 ч(рисунок 9).
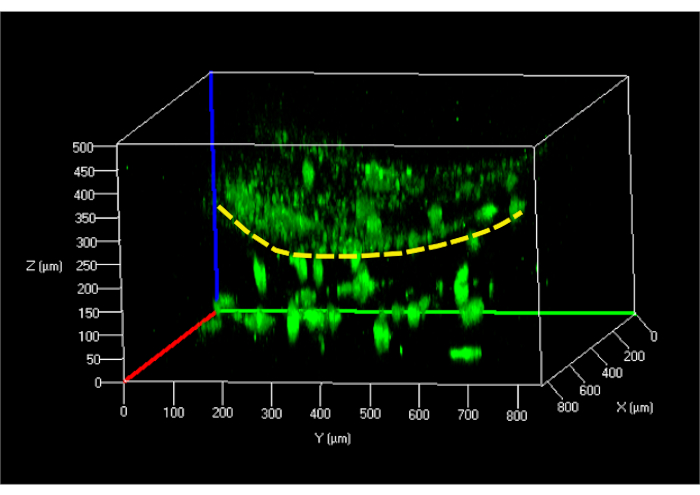
Рисунок 9:Реконструированное 3D конфокальное изображение недифференцированной модели кожи в микрофлюидном чипе. Желтая пунктирная линия указывает на поверхность гидрогеля, отделяющего гКЦ (сверху) от гФУ, встроенных в гель (снизу). Сокращения: hFBs = первичные фибробласты человека; hKCs = увековеченные кератиноциты кожи человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Крайне важно найти равновесие между поведением истончения фибриногенного геля и временем его гелеобразования: если для установления параллельного потока требуется слишком много времени, он коагулирует и блокирует систему; если процесс гелеобразования слишком медленный, hFBs в гидрогеле будут отстойник, как показано на рисунке 10. Поведение этого переходного состояния можно регулировать, варьируя концентрацию тромбина.

Рисунок 10:Конфокальное изображение гидрогеля фибрина, показывающее осажденные hFBs (красным цветом) из-за медленного времени гелеобразования фибрина. Поверх геля показан монослой hKCs (синим цветом). Сокращения: hFBs = первичные фибробласты человека; hKCs = увековеченные кератиноциты кожи человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В ходе планирования устройства и задних экспериментальных практик возникли некоторые осложнения, которые пришлось решать для получения оптимально функционирующего устройства и хорошо структурированной ткани. Эти проблемы показаны в таблице 2вместе с решениями для устранения неполадок.
| Проблемы | Решения |
| Введение 3D-гидрогеля в верхнюю камеру, оставляя свободное пространство сверху для посева кератиноцитов сверху после кожной генерации | Примените параллельный поток двух жидкостей (PBS и пре-гель) с различной вязкостью, чтобы создать кожный отсек с контролируемой высотой. |
| Смещение каналов при укладке винилового листа | Использование изготовленного на заказ элайнера для складки всех листов в нужное место |
| Получение монослоя кератиноцитов в верхней части фибринового геля для имитации эпидермиса | Позвольте клеткам прикрепиться к гелю перед удалением трубок из чипа, предотвращая попадание пузырьков воздуха в канал и смещение клеток. |
| Потеря высоты гидрогеля вдоль канала из-за утечки предварительного геля в нижний канал при протоколе параллельного потока через пористую мембрану. | Перекачивайте PBS через нижний канал во время установления параллельного потока. |
| Фибробластная оседания внутри геля | Концентрация тромбина была немного увеличена для ускорения гелеобразования фибрина |
Таблица 2:Вопросы, обнаруженные в ходе разработки текущей работы и применяемые решения.
Обсуждение
Мотивацией для разработки этого метода было желание моделировать кожные заболевания и изучать эффекты новых и инновационных методов лечения на высокопроизводительной платформе. На сегодняшний день эта лаборатория производит эти дермо-эпидермальные эквиваленты путем литья — вручную или с помощью технологии 3D-биопечати — фибринового геля с фибробластами в пластину вставки клеточной культуры и посева кератиноцитов поверх нее. Как только кератиноциты достигают слияния, 3D-культура подвергается воздействию воздушно-жидкого интерфейса, который индуцирует дифференцировку кератиноцитов, генерируя стратифицированный эпидермис и, следовательно, полностью развитую межфолликулярную кожу человека32,33,34. Однако эти 3D-культуры, хотя и очень актуальны клинически, являются дорогостоящими, трудоемкими и не имитируют физиологические условия.
Технология «ткань на чипе» обеспечивает платформу для эмуляции физиологических состояний в клеточной культуре, что позволяет лучше понять токсичность, эффективность и доставку лекарств-кандидатов13,14,15,16,17,18,19,35. Большинство тканей, смоделированные на микрофлюидных «классических» чипах, состоят из одиночных слоев клеток, в основном эпителиальных клеток22,26,42,27,28,36,37,38,39,40,41 . Моделирование более сложных, многослойных тканей затруднено из-за сложности создания однородных и наложенных слоев ткани.
Главной новинкой этой работы, по сравнению с предыдущими устройствами22,43,является разработка метода генерации недифференцированного и упрощенного конструкта кожи с помощью микрофлюидики. Кроме того, еще одним важным новшеством в отношении других опубликованных технологий44 является разработка относительно простой, экономически эффективной, удобной в использовании одноразовой системы чипов, изготовленной из биосовместимых виниловых листов, позволяющей осуществлять специальное изготовление. Эта система позволяет избежать использования кремниевых пластин и сложных процедур плазменного связывания, необходимых с PDMS25. Чипы на основе этого материала требуют генерации пластин, специфичных для каждой отдельной конструкции чипа, что повышает цену процесса прототипирования. Все это делает нынешнюю «классическую» технологию дорогой, сложной и не очень гибкой.
Чтобы преодолеть эти ограничения, используя кожу в качестве модели ткани, мы представляем очень гибкую, дешевую и надежную микрофлюидную платформу на основе виниловых слоев, производимых микрообработкой. Мы также представляем новую методологию, основанную на параллельном потоке ламинарной жидкости, которая позволяет создавать in situ двухслойную конструкцию кожи с нижним кожным компартментом, содержащим hFBs, и верхним эпидермальным компартментом, состоящим из монослоя hKCs. Чип состоит из двух камер, разделенных пористой мембраной ПК. Верхний канал содержит конструкцию кожи и оставляет свободное пространство, чтобы обеспечить дифференциацию и стратификацию hKC и / или перфузию культуральной среды, воздуха или даже лекарств в будущем. Нижняя камера непрерывно перфузирована питательной средой для стимулирования роста клеток. Использование пористой мембраны может привести к потере части прегеля из верхней камеры в нижнюю при воздействии высокого давления из-за перекачиваемой силы. Введение потока PBS в нижнюю камеру компенсирует эту разницу давлений и позволяет избежать этой утечки.
Распределение гКК на поверхности гидрогеля является важным аспектом при создании модели кожи. Когда они не распределены однородно, генерация однородного монослоя и, следовательно, эпидермальная дифференциация могут быть затруднены. Точно так же hFB должны быть равномерно распределены внутри гидрогеля, чтобы напоминать их естественное местоположение, в котором они находятся в реальной коже. Чтобы избежать осаждения клеток или закупорки трубок, необходимо тщательно изучить состав гидрогеля (особенно концентрацию тромбина) для контроля времени гелеобразования и поведения при истончении сдвига.
Несмотря на эти обнадеживающие результаты, необходима будущая работа для демонстрации долгосрочного функционирования системы, необходимой для содействия правильному распространению и дифференциации монослоя hKC для формирования хорошо дифференцированной кожи человека, включая роговой слой. Помимо кожи, эта система позволит создавать другие сложные, многослойные тканевые конструкции.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы искренне благодарим д-ра Хавьера Родригеса, д-ра Марию Луизу Лопес, Карлоса Мателлана и Хуана Франсиско Родригеса за очень полезные предложения, обсуждения и/или предварительные данные. Мы также благодарим Серхио Фернандеса, Педро Эррероса и Лару Штольценбург за вклад в этот проект. Особая благодарность доктору Марте Гарсия за HFB и hKCs с маркировкой GFP. Наконец, мы отмечаем прекрасную техническую помощь Гильермо Вискаино и Анжелики Корраль. Эта работа была поддержана «Программой деятельности I+D entre Grupos de Investigación de la Comunidad de Madrid», проект S2018/BAA-4480, Biopieltec-CM. Эта работа была также поддержана "Программой превосходства", проектом EPUC3M03, CAM. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Материалы
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Ссылки
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387(2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress. , Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016).
- Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015. , Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526(2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43(2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471(2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898(2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006(2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535(2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены