Method Article
マイクロマシンマイクロ流体プラットフォームにおける簡単な3次元スキンオンチップモデルの生成
要約
ここでは、マイクロマシンマイクロ流体プラットフォームを用いて、3次元の簡易および未分化皮膚モデルを生成するプロトコルを提示する。平行流アプローチは上の上の上皮細胞の播種のための真皮のコンパートメントの その場の 堆積を可能にし、すべてシリンジポンプによって制御される。
要約
この研究は、複雑な多層組織を生成する可能性を持つ新しい、費用対効果の高い、信頼性の高いマイクロ流体プラットフォームを提示します。概念実証として、真皮(間質)および表皮(上皮)コンパートメントを含む、簡素で未分化のヒト皮膚がモデル化されている。これを達成するために、2つのチャンバーに分かれた汎用性と堅牢なビニール系デバイスが開発され、高価で特殊な機器の使用や、小型の疎水性分子およびタンパク質の吸収など、生物医学の用途に適したポリジメチルシロキサン(PDMS)に基づくマイクロ流体デバイスに存在する欠点の一部を克服しました。さらに、平行流に基づく新しい方法が開発され、真皮および表皮コンパートメントの両方の イン・ザ・ポジション 堆積が可能となる。皮膚構築物は、ヒト原発性線維芽細胞を含むフィブリンマトリックスと、上に播種された不死化角化ケラチノサイトの単層から構成され、その後、動的培養条件下で維持される。この新しいマイクロ流体プラットフォームは、ヒトの皮膚疾患をモデル化し、他の複雑な組織を生成する方法を推定する可能性を開きます。
概要
近年、化粧品および医薬品1の毒性分析のためのヒト皮膚モデルの開発・生産に向けた進歩が見られている。医薬品およびスキンケア産業の研究者は、動物を使用してきました, マウスは最も一般的です, 自社製品をテストするために2,3,4,5.しかし、動物の試験製品は、ヒトにおける反応を予測するとは限らず、しばしばヒトにおける薬物不全または副作用を引き起こし、その結果経済的損失5,6に至る。英国は、1998年に化粧品検査のための動物の使用を禁止した最初の国でした。その後、2013年に、EUは動物の化粧品の試験と承認を禁止しました (EU化粧品規則第1223/2009)7.
この禁止は、米国の「人道的化粧品法」など他の国々でも検討されています。倫理的な懸念に加えて、動物と人間の皮膚の解剖学的な違いは、動物のテストに時間がかかり、高価で、しばしば効果がありません。さらに、世界 のインビトロ 毒物学の検査市場規模は、20259年までに269億8000万米ドルに達すると予想されています。これらの理由から、動物を使用せずに化粧品や薬物の安全性と毒性効果のテストを可能にする、バイオエンジニアリングされたヒト皮膚モデルなどの インビトロ 研究のための新しい方法と代替案を開発する必要があります。
市販の2種類、インビトロ、ヒトの皮膚モデルがあります。第1のタイプは、異なる材料に播種された分化角化細胞の複数の層を含む層状表皮等価物で構成される。そのうちのいくつかは経済協力開発機構(OECD)によって承認され、エピダームやSkinEthic10、11、12などの皮膚腐食および刺激試験のための(欧州代替方法検証センター(ECVAM)によって検証されています。第2のタイプは、T-SkinやEpiDerm-FTなどの線維芽細胞を含む3次元(3D)足場に播種されたヒトケラチノサイトの層を持つフルスキン同等物である。しかし、これらのモデルは静的な条件下で培養されるため、ヒトの生理学的状態を正確に表すことができません。
最近の関心は、動的灌流13、14、15、16、17、18、19の細胞培養挿入(CCI)フォーマットでin vitro 3Dスキンモデルを生成することに焦点を当てています。しかし、これらのシステムは、現場での古典的な定義に従って、マイクロ流体スキンオンチップとして厳密な感覚とは考えられません。Ingberの臓器オンチップの定義は、器官がマイクロ流体チャネルの中に配置されなければならないと述べています。スキンオンチップは、これまでのところ、多孔質膜22、23によって分離された単一細胞層および/または真皮細胞層として、ほとんどが単純な上皮をモデル化してきた。マイクロ流体系16,24では皮膚をモデル化する進歩がいくつかあったが、現在のところ、Ingberの定義に合った臓器オンチップシステムを示す文献はなく、その場で多層皮膚を産生することができ、上皮成分と間質成分の両方を含む。
この研究では、スキンオンチップアプリケーション用の新しい、費用対効果の高い、堅牢な、ビニールベースのマイクロ流体プラットフォームが発表されています。このプラットフォームは、PDMS25の制限の一部を克服し、デバイスのレイアウトにおける柔軟性と汎用性の向上と同様に、製造プロセスにおいてよりシンプルさを提供するマイクロ加工によって製造された。シリンジポンプで制御された平行流を通して簡単な皮膚構造を導入する方法も設計されました。平行流は非常に異なった粘着性を持つ2つの液体(この場合は緩衝液およびフィブリンプレゲル)が互いに混合されることなくチャネルを通して浸透することを可能にする。概念実証として、真皮を模したフィブリンマトリックスに埋め込まれた線維芽細胞を含む真皮構造をデバイスに導入し、その上にケラチノサイトの単層をロードして未分化表皮をエミュレートした。真皮コンパートメントの高さは流量を変更することによって変調することができる。この研究の主な目新しさは、前に説明したモデル22、26、27、28、29と比較して、マイクロ流体によるマイクロチャンバー内の3D構造の開発である。この記事では、未分化肌を単純化したものの、長期目標は、完全に差別化された皮膚構造を生成し、特徴付け、薬物および化粧品検査目的の生存率と機能性を実証することです。
プロトコル
1. チップ設計とマイクロマシニングパラメータ
- FreeCADオープンソース設計ソフトウェアを使用してマイクロ流体チップ層を設計します。チャネルの寸法については 、表 1 を参照してください。設計に直径2.54mmの穴を4つ含めて、正しいレイヤーの重ね合わせにカスタムメイドのアライナを使用します。
| 長さ(μm) | 幅 (μm) | |
| 下室 | 28,400 | 800 |
| 上院 | 31,000 | 800 |
表1:デバイスの上下チャネルの寸法
- 厚さ95μm、粘着、透明なビニールシートを30cm x 30cmの正方形に切り、プロッタに適切に収めます。
- 30 cm x 30 cm のワークスペースを作成し、チップの異なるレイヤー用に設計されたパターンで埋めるには、ブラザー CanvasWorkspace ソフトウェアを使用します (図 1A)。.svg ファイルに格納します。
- エッジプロッタで30cm x 30cmビニルシートをカットします(図1B-D)。
- ビニールシートを低タック粘着マットに貼り付け、必要に応じてすべての気泡を除去します。
- プロッタに.svgファイルをアップロードし、切削パラメータを設定します: 切断刃: レベル 3;切削圧: レベル 0;切断速度:レベル1。ビニールを入れ、粘着マットをプロッタに入れ、切削処理を開始します。
- 前の手順に従って、厚さ12μmの両面テープビニールのトップチャンネルパターンをカットします。

図1: チップ設計とマイクロマシニングプロセス. (A) チップ用に設計された上下のパターンで埋まった作業スペースを示すソフトウェアレイアウト。(B) 切断プロセス中のエッジ プロッタ;切削刃、ビニールシート全体、粘着マットが示されています。(C)パターン化されたビニールがカットシートから切り離されている。(D)トップチャネル設計でパターン化された接着ビニル層のサンプル。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. PDMS層の製作
- PDMSと硬化剤を10:1(v/v)の比率で混合し、15分間真空下に置いて気泡を除去します。55cm2 四角い培養皿に55mLの混合物を注ぎ、2mm厚層を得る。針で泡を取り除きます。
- 混合物(ステップ2.1)を80°Cで1時間オーブンで硬化させる。 PDMS をアンモールドし、チップ寸法の長方形にカットします。18 Gの注射針でチューブ用の穴を作ります。
3. チップアセンブリ
注: 理解を深めるには、 図 2を参照してください。
- アライナを使用してデバイス全体を組み立てて、チャンネル、入口、アウトレットを適切に調整します。下のチャンネルを組み立てるために4つのビニール層(対応するボトムマイクロパターン)を積み重ね、アライナーに付着しないように底層のカバーテープを保持します。
- ポリカーボネート(PC)多孔質膜を下側のチャネルの上に切って置き、上の溝から分離します。下チャンネルの入口を覆わないように注意してください。
- 上部の部屋の設計と10のビニール層を追加します。上部にトップチャンネルパターンを持つ両面テープビニール層を貼り付けます。チップをアライナーから取り外し、ガラススライドに貼り付けます。
- 2 mm 厚の PDMS シートを両面テープビニール層の上に置き、チューブに適切なアンカーを提供し、漏れを防ぎます。チップが完全に水密であることを確認するために、チップの上に一晩重量を残します。70%v/vエタノールを5分間洗浄し、蒸留したH2Oで洗浄してチップを殺菌します。

図2:マイクロ流体チップアセンブリ (A) デバイスのアセンブリの一般的なスキーム。下側および上部のチャンバーは、それぞれ4枚と11枚の重ね合わせビニルシートで構成されています。(B)マイクロ流体チップの上部および横のビュー。トップチャンネルとボトムチャンネルはそれぞれピンクとブルーで表されます。(C) カスタムアライナを使用したチップアセンブリのイメージ。(D)完全なアセンブリ後のチップイメージ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
4. ポンプ接続
注: ポンプ接続のグラフィカルな表現を図 3に示します。
- ポンプ1を上室入口1(UCi1)に接続します。
- ポンプ2を上部チャンバーインレット2(UCi2)に接続します。
- ポンプ3を下室入口(LCi)に接続します。
- アッパーチャンバーアウトレット(UCo)と下室アウトレット(LCo)を廃棄物管に接続します。
- ポリテトラフルオロエチレン(PTFE)チューブと18 Gステンレス鋼コネクタを使用して、各インレットに注射器を接続します。

図3:ポンプ接続とインレット/出口位置を 示す図(A)それぞれの入り口への3つの異なるポンプの接続を示す図。アウトレットは、廃棄物容器に接続します。(B)チップ画像に、入口とアウトレットのラベルが付いています。略語: LCi = 下チャンバー入口;LCo =下チャンバー出口;UCi1 = 上部チャンバー入口 1;UCi2 = 上部チャンバー入口 2;UCo = 上部チャンバー出口。 この図の大きなバージョンを表示するには、ここをクリックしてください。
5. 細胞培養
注意:HaCaT細胞株は商業的起源を有する。ヒト原発性線維芽細胞は健康なドナーから来ており、「レジストロ・ナシオナル・デ・バイオバンコス・パラ・インスベスティガシオン・ビオメディカ・デル・インスティトゥート・デ・サルド・カルロス3世」に登録されたヒト起源の生物学的サンプルのコレクションから得られた。
- 細胞培養フードで働き、以前は紫外線で殺菌し、エタノールで拭いた。
- H2B-GFP-HaCaT細胞(ヒト不死化皮膚ケラチノサイト、hKCs)およびGFPヒト原発性線維芽細胞(hFP)を37°Cで解凍し、2mLの培養培地を添加し、250×gで20°Cで7分間遠心分離機を加 える。
注:H2B-GFP-HaCaT細胞は、ヒトの不死化角化ケラチノサイトを改変して、H2B-緑色蛍光タンパク質(GFP)のハイブリッドを発現させ、その核に緑色蛍光を与えます。GFP-hFBsは、細胞質の緑色蛍光を発現するベクターpLZRS-IRES-EGFPで形質転換されたヒト原発性線維芽細胞である。これらのセルは、以前に公開されたプロトコル30、31 に従って変更されました。 - 1x DMEMのhKCとhHBの両方を10%の胎児ウシ血清と抗生物質/抗抗欠薬溶液の1%で補った。使用前に37°Cで培養液を予温する。
- 細胞を1xリン酸緩衝生理食塩水(PBS)で洗浄し、トリプシン/エチレンセアミンテトラ酢酸(EDTA)を2mL加え、37°Cで10分間インキュベートします。
- 4 mLの培養培地を添加したトリプシンを不活性化する。細胞を再懸濁し、15mLチューブに移します。10 μL を取り出して、ノイバウアーチャンバー上の細胞を数え、適切な濃度を決定します。
- 250×gで20°Cで7分間15mLチューブを遠心分離します。 上清を取り除き、所望の濃度でペレットを再懸濁します:50,000細胞/mLのhFBと5·×106細胞/mLのhCC。
6. フィブリノーゲンプレゲル製剤
- 1mLのCaCl 2(NaClで1%w/v)をバイアルに加えてトロンビンを活性化します。
- フィブリンの最終濃度3.5 mg/mLでフィブリンヒドロゲルの1mLを得るために次の成分を加える:59 μLの活性化トロンビン(10 NIH単位/mL)、トラネキサム酸59 μL(材料表、100 mg/mL)、培地764 μLの培地に50,000hF/mLを含む培地の764 μL フィブリノーゲンの118 μL(NaClで20 mg/mL(0.9%w/v))。
注:フィブリノゲンは、最後の瞬間に追加する必要があります。
7. 並列フロープロトコル
- 全体のプロセスの間に50 μL/minでLCiを通してポンプ3と1x PBSをポンプ。
- 100 μL/min で UCi2 を通してポンプ 2 を使用して、犠牲液 (1x PBS) をポンプします。
- プレゲルでシリンジをロードし、ポンプ1に素早く入れ、200 μL/minで動かします(図4A)。
- プレゲルがUCoを終了したら、ポンプ1と2を停止します。
- 37°Cでチューブを取り外さずに、少なくとも10分間、ゲル化を可能にします。
- ポンプ3からUCi2を通して一晩で50 μL/hでポンプ培養培地。
- キャップ付きのブロック UCi1.
8. hKCs単層シード
- hFBsが真皮コンパートメントの生成後24時間広がっていることを顕微鏡で確認してください。
- UCi2 を通して UCi2 を通して hKCs を導入し、5 ×·106 セル/mL で 40 μL/mL で 1 分間 (図 4B)を導入します。
- 細胞の取り付けのための湿度飽和インキュベーターで37°Cでチップを一晩残します。
- 50 μL/min で LCi を通じてのみポンプ 3 で新鮮な培養培地をポンプします (図 4C)。

図4:ダーモ表皮構築物の生成のためのマイクロ流体プロトコル(A)真皮コンパートメントを生成する平行流過程を示す横断面。(B)ケラチノサイト単層播種24時間後に真皮コンパートメント発生後。(C)マイクロ流体装置内部の細胞培養の維持。(D) チップ内の皮膚の断面レクリエーション。この図の大きなバージョンを表示するには、ここをクリックしてください。
9. 細胞生存率アッセイ
注:ライブ/デッドキットは、生きている状態や死んだ状態に応じて、緑色または赤色の蛍光で細胞を染色します。適切な生存率分化のために、非蛍光hKCsおよびhFBをこのステップで使用する必要があります。手順のすべてのステップは、ポンプ2でUCi2を介して行われます。
- トップチャネルを50 μL/minで5分間1x PBSで洗浄し、培地を除去します。
- 空気をポンプで送り、50 μL/分で1x PBSを取り除く。
- Calcein AM/エチジウムホモジマー-1キット(ライブ/デッド)ソリューションをメーカーの指示に従って準備します。
- 50 μL/minで2分間のポンプライブ/デッドソリューション。
- 暗闇の中で37°Cで30分インキュベートします。
- 50 μL/minで1x PBSを2分間ポンピングして、残りの試薬を除去して上チャンネルを洗浄します。
- コンフォーカル顕微鏡でサンプルを観察します。生細胞と死細胞に対しては、励起波長495/590 nm、発光波長519/617nmをそれぞれ使用します。
結果
設計されたチップは、下のチャンバからの成長促進分子の通過を可能にすることによって細胞の成長を可能にする5μmの細孔サイズPC膜によって分離された2つの流体室から構成される。上のチャンバは組織構築物を保持し、この場合、hFBを含むフィブリンヒドロゲル上のhKCsの単層である。
チャネルの高さは、各チャンネルに追加される粘着シートの数によって決まります。下の部屋は4つの層(380 μm)および10個の片面テープ層の上の1つと両面1(962 μm)で構成されています。チップの寸法は4 cm x 2 cmで、操作性を高めます。粘着性のビニールシートは装置の目視点検のための水締まりおよび透明を提供する。PDMS層は、チューブが固定された穴からの漏れを避けるために、チューブの適切なアンカーに役立ちました。
公表された文献によると、シリンジポンプを用いたマイクロ流体室への細胞含有ヒドロゲルの注射能は現在までに報告されていない。このため、フィブリンプレゲルの注射能を評価しなければならなかった。50μL/minの流れの下で、シリンジがブロックされていることを観察した。ただし、200 μL/min を超える流量は細胞にダメージを与える可能性があります。レオロジー研究を行い、フィブリンプレゲルの剪断薄化挙動を試験し、選択した流量範囲(50~200μL/min)内で10~50cPの粘度を得た。これらの結果は、このシステムの労働条件を確立するのに役立ちました。
本研究では、下層がプレゲルである2つの重畳層流を生成し、上方の積層流が犠牲液(PBS)であった生成に基づいて並列流動法が開発された。ナビエ・ストークス方程式を数値的に解き、適切な境界条件を課すことにより、所望の高さを得るための複数の解法があることがわかった。前に確立されたせん断速度制限を考慮すると、約500μmの高さのヒドロゲルを達成するために、流量はそれぞれ犠牲PBSとプレゲルのための104および222 μL/分であった。実際には、100 μL/minのマイクロフローレートを簡便化に使用しました。モデルに再導入すると、これらの値は期待値と非常によく似た576 μmのゲル高さを生じることが判明した(図5B)。提案された方法の機能を実験的にチェックするために、上部チャンバに沿ったヒドロゲルの高さを測定した。平均高さ550μm(図5A)は、数学的モデルの予測と非常によく似ています。
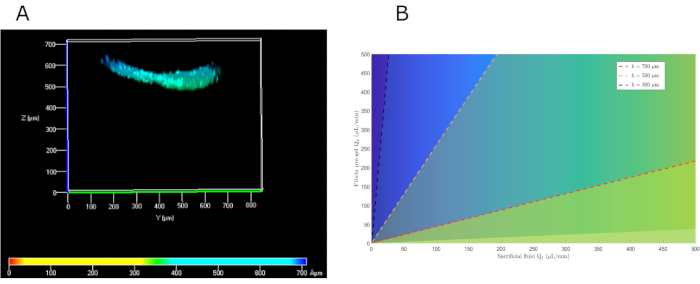
図5:望ましい真皮高さを得るために適切なプレゲルおよび犠牲流体フローを選択する平行流数学的解法。 (B)プレゲルとPBS流量に応じて異なる高さの数学的解法。略語: hKCs = ヒト不死化皮膚角化細胞;PBS = リン酸緩衝生理食塩分。この図の大きなバージョンを表示するには、ここをクリックしてください。
最初にプロトコルを確立するとき、PBSは下のチャネルを通してフラッシュされず、ゲルの理論的高さと測定されたものとの間に不一致を引き起こし得ました。この高さの差は推定値と比較して約40%であった(図6)。プロトコルが最適化され、PBSが下の部屋を通ってポンプで送られたら、この高さの損失は解決された(図5)。
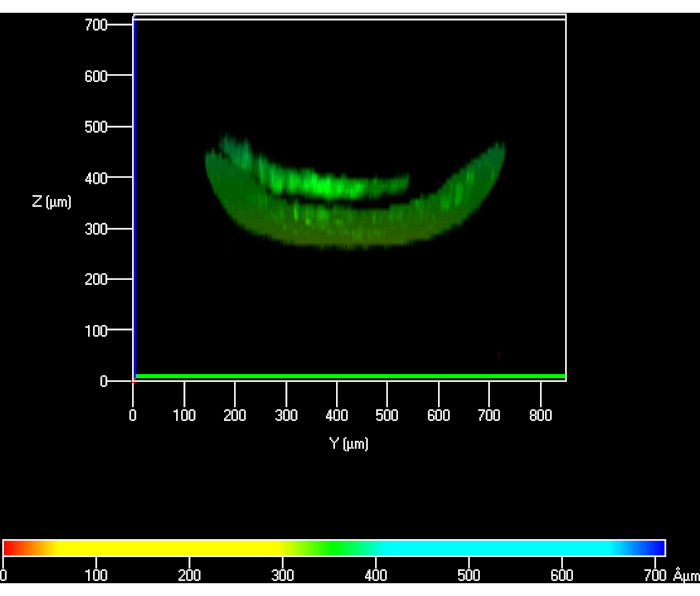
図6:水素ゲルの上に播種したhKCsの共焦点図は、PBSが下のチャンバーを通ってポンピングされなかったときにその高さを測定する。 略語: hKCs = ヒト不死化皮膚角化細胞;PBS = リン酸緩衝生理食塩分。 この図の大きなバージョンを表示するには、ここをクリックしてください。
図7A は、GFP-hFBsが埋め込まれたフィブリンヒドロゲルを含む上房の蛍光トップビュー画像を示し、24時間の荷重後、細胞がチャンバーに沿って均一に分布し、良好に広がっていることを実証する。 図7B は、ハイドロゲルの上に播種されたコンフルエントGFP-hKCsを示す。
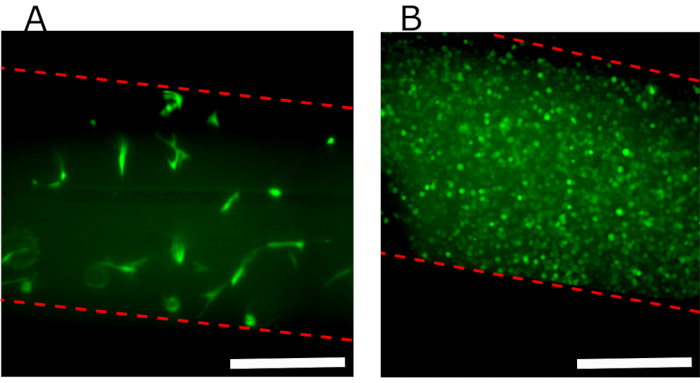
図7:装置に播種された異なる細胞を示す上流路の蛍光画像(A)フィブリンゲルに埋め込まれたhFBを示す並列流動プロトコルの後の上室24時間のトップビュー。(B)ハイドロゲル生成後24時間のヒドロゲルの上に播種されたコンフルエントGFP-hKCs。赤い破線は、チャネルの壁を示します。スケールバー:400 μm。略語: hFBs = ヒト原発性線維芽細胞;GFP-hKCs= 緑色蛍光タンパク質発現ヒト不死化皮膚ケラチノサイトこの図の大きなバージョンを表示するには、ここをクリックしてください。
hKCsが沈み、ヒドロゲル表面に付着するまで、システムを一晩閉じておく事が重要です。チューブが細胞の付着前に除去されると、気泡がチャネルに入り、細胞を変位させ、 図8に示すように不均一なコンフルエント単層を導く。

図8:hKCsの播種直後にチューブを取り除くときのヒドロゲル表面のトップビュー。 赤い破線は、チャネルの壁を示します。スケールバー:400 μm。略語: hKCs = ヒト不死化皮膚角化細胞。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ヒドロゲルに埋め込まれたhHBに対して行った細胞生存率試験は、並列流法を用いてロード後24時間実施し、〜95%の細胞生存率を示した。フィブリンヒドロゲルに播種した後24時間hKCs細胞に対して行った同じ試験は同様の結果を示した。次のステップは、24時間後に、ダーモ表皮構造を生成し、共焦点顕微鏡を用いてその構造を研究することであった(図9)。
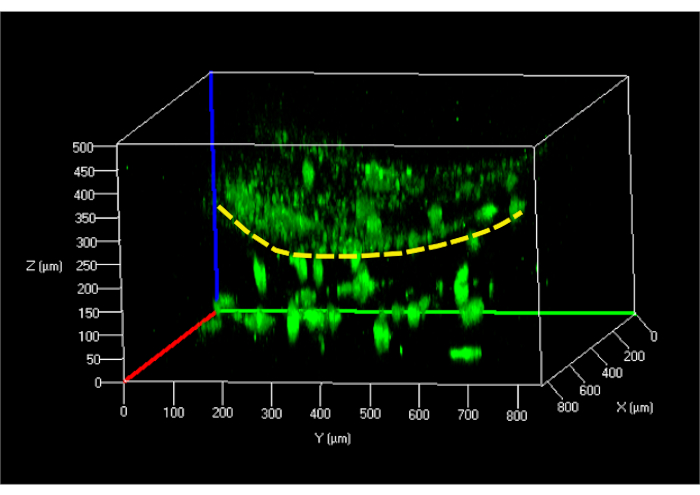
図9:マイクロ流体チップにおける未分化皮膚モデルの再構成3D共焦点像 黄色の破線は、ゲル(下部)に埋め込まれたhFBからhKU(上)を分離するヒドロゲルの表面を示します。略語: hFBs = ヒト原発性線維芽細胞;hKCs =ヒト不死化皮膚ケラチノサイト。 この図の大きなバージョンを表示するには、ここをクリックしてください。
フィブリノーゲンゲルのせん断間線の挙動とそのゲル化時間との間の均衡を見つけることが重要です:平行流を確立するのに時間がかかりすぎると、システムを凝結させ、ブロックします。ゲル化プロセスが遅すぎると、ハイドロゲル中のhFBが 図10に示すように沈下します。この過渡状態の挙動は、トロンビン濃度を変化させることによって調節することができる。

図10:フィブリンゲル化時間が遅いために沈積したhFB(赤色)を示すフィブリンヒドロゲルの共焦点像。hKCsの単層(青色)がゲルの上に示されています。略語: hFBs = ヒト原発性線維芽細胞;hKCs =ヒト不死化皮膚ケラチノサイト。 この図の大きなバージョンを表示するには、ここをクリックしてください。
装置の計画化および後部の実験的練習の間に、最適に機能する装置および十分に構造化された組織を得るために解決されなければならなかったいくつかの合併症が起こった。これらの問題は、トラブルシューティングのソリューションと共に表 2に示されています。
| 問題 | ソリューション |
| 上の部屋に3Dヒドロゲルを導入し、真皮発生後に角化細胞を上に播種するための空きスペースを残す | 異なる粘度を持つ2つの流体(PBSおよびプレゲル)の平行な流れを適用して、高さを制御した真皮コンパートメントを作成します。 |
| ビニルシートスタッキング中のチャンネルのずれ | カスタムメイドのアライナを使用して、すべてのシートを正しい場所に積み重ねる |
| フィブリンゲルの上にコンフルエントケラチノサイト単層を達成し、表皮をシミュレートする | チップからチューブを取り外す前に細胞をゲルに取り付け、気泡がチャネルに入るのを防ぎ、細胞を置き換えます。 |
| 多孔質膜を通る平行流プロトコルの間に下側チャネルに漏れる前ゲルによるチャネルに沿ったヒドロゲルの高さの損失。 | 並列流の確立の間に下チャネルを通してポンプPBS。 |
| ゲル内の線維芽細胞沈入 | トロンビン濃度は、フィブリンのゲル化を促進するためにわずかに増加した |
表2: 現在の作業の開発中に見つかった問題と適用されるソリューション
ディスカッション
この方法を開発する動機は、皮膚疾患をモデル化し、ハイスループットプラットフォームで新しい革新的な治療法の効果を研究したいという願望でした。現在までに、この研究室は、手動で、または3Dバイオプリンティング技術の助けを借りて、繊維芽細胞を含むフィブリンゲルを細胞培養インサートプレートに播種し、その上に角化細胞を播種することによって、これらの皮膚表皮等価物を生産する。角化細胞が合流に達すると、3D培養物が空気・液体界面に曝され、ケラチノサイト分化を誘導し、成層表皮を生成し、その結果、完全に発達した脳間ヒト皮膚32、33、34となる。しかし、これらの3D培養は、臨床的には非常に関連性はあるが、高価で時間がかかり、生理学的状態を模倣しない。
ティッシュオンチップ技術は、細胞培養における生理学的状態をエミュレートするプラットフォームを提供し、したがって、毒性、有効性、および薬物候補13、14、15、16、17、18、19、35の毒性、有効性、および送達のより良い理解を可能にする。マイクロ流体「古典的な」チップをモデルにした組織のほとんどは、細胞の単一層で構成されており、主に上皮細胞22、26、42、27、28、36、37、38、39、40、41.より複雑で多層組織のモデリングは、均質で重ね合わせた組織層を生成する難しさによって妨げられてきた。
この研究の主な目新しさは、以前の装置22,43と比較して、マイクロ流体を用いて未分化かつ簡便な皮膚構築物を生成する方法の開発である。また、他の公表技術44に関するもう一つの重要な革新は、臨時製造を可能にする生体適合性ビニルシートからなる比較的シンプルで費用対効果の高い、使いやすい使い捨てチップシステムの設計である。このシステムは、PDMS25で必要とされるシリコンウェーハや複雑なプラズマボンディング手順の使用を回避します。この材料に基づくチップは、プロトタイピングプロセスの価格を上げる、各異なるチップ設計に固有のウェーハの生成を必要とします。このすべては、現在の「古典的な」技術を高価で複雑で、あまり柔軟にしません。
これらの制限を克服するために、皮膚を組織モデルとして使用して、マイクロマシニングによって生成されたビニル層に基づいて、非常に柔軟で安価で堅牢なマイクロ流体プラットフォームを提示します。また、hFBを含む下真皮コンパートメントとhKCsの単層からなる上表皮コンパートメントを有する二層皮膚構築物のイン ・シンチ 生成を可能にする層流体の平行流に基づく新しい方法論を提示する。チップは、多孔質PC膜によって分離された2つのチャンバーで構成されています。上流路は皮膚の構造を含み、将来の培養培地、空気、あるいは薬物のhKC分化および階層化および/または灌流を可能にする自由なスペースを残す。下のチャンバーは、細胞増殖を促進するために培養培地と絶えず浸透している。多孔質膜を使用すると、ポンプ力による高圧を受けると、上室から下側の部屋にプレゲルの一部が失われることがあります。下の部屋にPBSの流れを導入することはこの圧力の相違を償い、この漏れを避ける。
ヒドロゲル表面での hKCs の分布は、スキン モデルを生成する際の重要な側面です。均質に広がっていないとき、均一な単層の生成は、したがって、表皮分化が妨げられる可能性がある。同様に、hFBは、実際の皮膚に見られる自然な位置に似たヒドロゲル内に均等に分布する必要があります。細胞沈めやチューブの閉塞を避けるために、ヒドロゲル組成物(特にトロンビン濃度)を慎重に検討してゲル化時間と剪断薄化行動を制御する必要があります。
これらの励ましの所見にもかかわらず、将来の作業は、角層を含む十分に分化されたヒト皮膚を形成するために、hKC単層の正しい増殖と分化を促進するために必要なシステムの長期的な機能を実証するために必要とされる。皮膚に加えて、このシステムは、他の複雑な、多層組織構造の生成を可能にするであろう。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
ハビエル・ロドリゲス博士、マリア・ルイサ・ロペス博士、カルロス・マテラン、フアン・フランシスコ・ロドリゲスの皆様に、ご意見、ご意見、ご意見、予備データをお願い申し上げます。また、セルヒオ・フェルランデス、ペドロ・エレーロス、ララ・ストルツェンブルクの貢献に感謝します。GFPラベル付きhFPとhKUについては、マルタ・ガルシア博士に感謝します。最後に、ギレルモ・ヴィズカイノとアンジェリカ・コラルの優れた技術支援を認めています。この作品は「プログラム・デ・アクティビダーデス・デ・I+Dアントル・グルポス・デ・インベスティガシオン・デ・ラ・コムニダード・デ・マドリード」、プロジェクトS2018/BAA-4480、バイオピエルテック-CMによって支えられた。この研究は、"プログラム・デ・エクセレンシア"、プロジェクトEPUC3M03、CAMによってもサポートされました。コンセヘリア・デ・エドゥカシオン・エ・インベスティガシオン
資料
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
参考文献
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387(2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress. , Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016).
- Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015. , Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526(2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43(2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471(2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898(2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006(2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535(2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved