Method Article
יצירת דגם תלת מימדי תלת מימדי של עור על שבב בפלטפורמה מיקרופלואידית מיקרו-מכונות
In This Article
Summary
כאן, אנו מציגים פרוטוקול ליצירת מודל עור תלת מימדי פשוט ובלתי מופרע באמצעות פלטפורמה מיקרופלואידית מיקרו-מכונות. גישת זרימה מקבילה מאפשרת תצהיר במקום של תא עורי לזרוע של תאי אפיתל על גבי, כל נשלט על ידי משאבות מזרק.
Abstract
עבודה זו מציגה פלטפורמה מיקרופלואידית חדשה, חסכונית ואמינה עם פוטנציאל ליצור רקמות מרובות שכבות מורכבות. כהוכחה לרעיון, עור אנושי פשוט ובלתי מובחן המכיל תא עורי (סטרומי) ותא אפיתל (אפיתל). לשם כך פותח מכשיר רב-תכליתי וחזק המבוסס על ויניל המחולק לשני תאים, המתגבר על חלק מהחסרונות הקיימים במכשירים מיקרופלואידיים המבוססים על פולידימתילסילוקסן (PDMS) ליישומים ביו-רפואיים, כגון שימוש בציוד יקר ומיוחל או ספיגת מולקולות וחלבונים קטנים והידרופוביים. יתר על כן, פותחה שיטה חדשה המבוססת על זרימה מקבילה, המאפשרת תצהיר במקום של תאי העור והאפידרמיס. מבנה העור מורכב מטריצת פיברין המכילה פיברובלסטים ראשוניים אנושיים ומונו-שכבתית של קרטינוציטים מונצחים המושרשת למעלה, אשר נשמרת לאחר מכן בתנאי תרבות דינמיים. פלטפורמה מיקרופלואידית חדשה זו פותחת את האפשרות לדגמן מחלות עור אנושיות ולהסיק את השיטה ליצירת רקמות מורכבות אחרות.
Introduction
לאחרונה, חלה התקדמות לקראת פיתוח וייצור של מודלים מעור אנושי במבחנה לניתוח הרעילות של מוצרי קוסמטיקה ותרופות1. חוקרים בתעשיות התרופות וטיפוח העור משתמשים בבעלי חיים, עכברים הם הנפוצים ביותר, כדי לבדוק את המוצרים שלהם2,3,4,5. עם זאת, בדיקת מוצרים על בעלי חיים אינה תמיד מנבאת את התגובה בבני אדם, אשר מוביל לעתים קרובות לכשל תרופתי או תופעות לוואי בבני אדם וכתוצאה מכך להפסדים כלכליים5,6. בריטניה הייתה המדינה הראשונה שאסרה על שימוש בבעלי חיים לבדיקות קוסמטיות בשנת 1998. מאוחר יותר, בשנת 2013, האיחוד האירופי אסר על בדיקה והרחקה של מוצרי קוסמטיקה בבעלי חיים (תקנה קוסמטיקה של האיחוד האירופי מס '1223/2009)7.
איסור זה נשקלת גם על ידי מדינות אחרות כגון "חוק הקוסמטיקה ההומנית" בארה"ב8. בנוסף לחששות אתיים, ההבדלים האנטומיים בין עור בעלי חיים לבני אדם הופכים את הניסויים בבעלי חיים לגוזלי זמן רב, יקרים ולעתים קרובות לא יעילים. יתר על כן, גודל השוק העולמי לבדיקות רעלים במבחנה צפוי להגיע ל -26.98 מיליארד דולר עד 20259. מסיבות אלה, יש צורך לפתח שיטות וחלופות חדשות עבור אלה במחקרי מבחנה, כגון מודלים של עור אנושי ביו-הנדסה, המאפשרים בדיקות לבטיחות והשפעות רעילות של קוסמטיקה ותרופות ללא שימוש בבעלי חיים.
ישנם שני סוגים שונים של מודלים מסחריים זמינים, במבחנה, עור אנושי. הסוג הראשון מורכב משכבות אפידרמיס המקבילות שכבות מרובות של קרטינוציטים הבחנה כי הם זרעים על חומרים שונים. חלקם אושרו על ידי הארגון לשיתוף פעולה ופיתוח כלכלי (OECD) ואומתו על ידי (המרכז האירופי לאימות שיטות חלופיות (ECVAM) לבדיקות קורוזיה וגירוי בעור, כגון EpiDerm או SkinEthic10,11,12. הסוג השני הוא שווה ערך לעור מלא עם שכבה של קרטינוציטים אנושיים מובחנים המושרשים על פיגום תלת מימדי (3D) המכיל פיברובלסטים, כגון T-Skin ו- EpiDerm-FT. עם זאת, מודלים אלה הם תרבותיים בתנאים סטטיים, מה שהופך אותם לא מסוגל לייצג במדויק תנאים פיזיולוגיים אנושיים.
העניין האחרון התמקד ביצירת מודלים של עור במבחנה תלת-ממדית בפורמטים של הוספת תרבית תאים (CCI) עם זלוף דינמי13,14,15,16,17,18,19. עם זאת, מערכות אלה לא יכולות להיחשב קפדניות sensu כמו עור על שבבים microfluidic לפי ההגדרה הקלאסית שלהם בתחום. ההגדרה של אינגר לאיברים על שבב קובעת כי האיבר חייב להיות ממוקם בתוך הערוצים microfluidic, שהוא מצב כי רק כמה מכשירים למלא20,21. עור על שבבים יש עד כה מודל בעיקר אפיתליה פשוטה כמו שכבות תא יחיד ו / או שכבות תא עור מופרדות על ידי קרום נקבובי22,23. למרות שהיו כמה התקדמות מידול העור במערכות microfluidic16,24, אין כרגע ספרות המציגה מערכת איבר על שבב שמתאימה להגדרה של אינגר, מסוגל לייצר עור רב שכבתי במקום וכולל הן רכיבים אפיתל סטרומיים.
בעבודה זו מוצגת פלטפורמה מיקרופלואידית חדשה, חסכונית, חזקה ומבוססת ויניל עבור יישומי עור על שבב. פלטפורמה זו הופקה על ידי עיבוד מיקרו, המספק פשטות רבה יותר בתהליך הייצור, כמו גם גמישות מוגברת ורב-תכליתיות בפריסת המכשיר, תוך התגברות על חלק מהמגבלות של PDMS25. כמו כן תוכננה דרך להציג מבנה עור פשוט באמצעות זרימה מקבילה הנשלטת באמצעות משאבות מזרק. זרימה מקבילה מאפשרת שני נוזלים עם צמיגות שונה מאוד (חיץ ופיברין pre-gel במקרה זה) להיות perfused דרך ערוץ מבלי לערבב אחד עם השני. כהוכחה לרעיון, הוכנס למכשיר מבנה דרמו-אפידרמיס המכיל פיברובלסטים המוטבעים במטריצת פיברין המחקה את הדרמיס, ומעליו נטען מונולייר של קרטינוציטים כדי לחקות את האפידרמיס הגלי. ניתן לאפנן את גובה התא העורי על-ידי שינוי קצבי הזרימה. החידוש העיקרי של עבודה זו, בהשוואה לדגמים שתוארו בעבר22,26,27,28,29, הוא פיתוח של מבנה תלת מימדי בתוך microchamber באמצעות מיקרופלואידיקה. למרות מאמר זה מציג עור פשוט לא מובחן, המטרה לטווח ארוך היא ליצור ולאפיין מבנה עור מובחן לחלוטין כדי להדגים את הכדאיות שלה ואת הפונקציונליות למטרות בדיקה סמים וקוסמטיים.
Protocol
1. עיצוב שבבים ומיקרו-מכונות פרמטרים
- עצב את שכבות השבב המיקרופלואידיות באמצעות תוכנת עיצוב קוד פתוח של FreeCAD; עיין בטבלה 1 עבור ממדי הערוצים. כלול ארבעה חורים בקוטר 2.54 מ"מ בעיצוב לשימוש ביישר יישור מותאם אישית עבור שכבת-על נכונה.
| אורך (מיקרומטר) | רוחב (מיקרומטר) | |
| תא תחתון | 28,400 | 800 |
| תא עליון | 31,000 | 800 |
טבלה 1: מידות הערוצים העליונים והתחתונים של ההתקן.
- חותכים 95 מיקרומטר עבה, דבק, יריעות ויניל שקופות לתוך 30 ס"מ x 30 ס"מ ריבועים כדי להתאים את התווין כראוי.
- השתמש בתוכנת Brother CanvasWorkspace כדי ליצור סביבת עבודה של 30 ס"מ על 30 ס"מ, ולמלא אותה בתבניות המעוצבות לשכבות השונות של השבב(איור 1A). אחסן אותו בקובץ .svg.
- חותכים את יריעות ויניל בגודל 30 ס"מ על 30 ס"מ עם נתח הקצה(איור 1B-D).
- יש לתקוע את יריעת הוויניל על מחצלת דבק נמוכה, ולחסל את כל בועות האוויר במידת הצורך.
- העלה את קובץ .svg לתוויה, והגדר את פרמטרי החיתוך: להב חיתוך: רמה 3; חיתוך לחץ: רמה 0; מהירות חיתוך: רמה 1. מניחים את מחצלת הדבק עם הוויניל לתוך הקושר, ומתחילים את תהליך החיתוך.
- גזור את תבנית הערוץ העליון על ויניל סרט דו-צדדי בעובי 12 מיקרומטר על-ידי ביצוע השלבים הקודמים.

איור 1: עיצוב שבב ותהליך מיקרו-מכונות. (A)פריסת תוכנה המציגה את מרחב העבודה המלא בתבניות העליונות והתחתון המיועדות לשבב. (B)קושר קצה במהלך תהליך חיתוך; להב חיתוך, יריעת ויניל שלמה ומחצלת דבק מוצגים. (ג)ויניל בדוגמת ניתוק מגיליון החיתוך. (D)דגימה של שכבת ויניל דבק בדוגמת עיצוב הערוץ העליון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. ייצור שכבת PDMS
- מערבבים את ה-PDMS ואת סוכן הריפוי ביחס של 10:1 (v/v), ומניחים את התערובת תחת ואקום למשך 15 דקות להסרת בועות אוויר. יוצקים 55 מ"ל מהתערובת לצלחת תרבות של 55 ס"מ2 ריבועית כדי לקבל שכבה בעובי 2 מ"מ. הסר בועות עם מחט.
- לרפא את התערובת (שלב 2.1) בתנור במשך 1 שעה ב 80 °C (80 °F). תפרקו את ה-PDMS וחתכו אותו למלבנים עם מידות השבב. לעשות חורים עבור צינורות עם מחט מזרק 18 G.
3. הרכבת שבב
הערה: להבנה טובה יותר, ראו איור 2.
- הרכב את ההתקן כולו באמצעות קשת יישור להתאמת ערוצים, פרצונים ושקעים כראוי. עורמים ארבע שכבות ויניל (עם המיקרו-פלטרן התחתון המתאים) להרכבת הערוץ התחתון, תוך שמירה על סרט הכיסוי של השכבה התחתונה כדי להימנע מהדבקה ליישר היישור.
- לחתוך ולהניח את הקרום פוליקרבונט (PC) נקבובי על גבי הערוץ התחתון כדי להפריד אותו מן העליון. היזהר לא לכסות את המפרצונים של הערוץ התחתון.
- הוסף עשר שכבות ויניל עם עיצוב התא העליון. תקע שכבת ויניל דו-צדדית עם תבנית הערוץ העליון למעלה. הסר את השבב מיישר היישור ותדביק אותו על שקופית הזכוכית.
- הניחו גיליון PDMS בעובי 2 מ"מ על גבי שכבת ויניל סרט דו-צדדית כדי לספק עיגון מתאים לצינורות ולהימנע מדליפה. השאר משקל על גבי השבב לילה כדי להבטיח את השבב הוא אטום לחלוטין. לחטא את השבב על ידי שטיפה 70% v / v אתנול במשך 5 דקות, ולאחר מכן לשטוף עם מזוקק H2O.

איור 2: הרכבה של שבב מיקרופלואידי. (א)ערכה כללית של הרכבת ההתקן. התאים התחתונים והעליונים מורכבים מארבעה ואחד עשר יריעות ויניל על גבי, בהתאמה. (B)נופים עליונים ו לרוחב של השבב המיקרופלואידי. הערוצים העליונים והתחתונים מיוצגים בוורוד וכחול, בהתאמה. (C)תמונה של הרכבת השבב באמצעות קשת יישור מותאמת אישית. (D)תמונת שבב לאחר הרכבה מלאה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. חיבורי משאבה
הערה: הייצוג הגרפי של חיבורי המשאבות מוצג באיור 3.
- חבר את משאבה 1 למפרצון העליון 1 (UCi1).
- חבר משאבה 2 למפרצון התא העליון 2 (UCi2).
- חברו את משאבה 3 למפרצון התא התחתון (LCi).
- חבר שקע תא עליון (UCo) ושקע תא תחתון (LCo) לצינור פסולת.
- חבר את המזרקים לכל מפרצון באמצעות צינורות פוליטרפלואורואתילן (PTFE) ומחברי נירוסטה 18 G.

איור 3: חיבורי משאבה ומיקום מכניסות/שקעים. (A)דיאגרמה המציגה את החיבור של שלוש המשאבות השונות למפרצונים המתאימים להן. שקעים מתחברים למיכל פסולת. (B)תמונת שבב עם מפרצונים ושקעים מסומנים. קיצורים: LCi = מפרצון התא התחתון; LCo = שקע תא תחתון; UCi1 = מפרצון התא העליון 1; UCi2 = מפרצון החדר העליון 2; UCo = שקע תא עליון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. תרבות התא
הערה: לקו התא של ה-HaCaT מקור מסחרי. פיברובלסטים ראשוניים אנושיים מגיעים מתורמים בריאים והושגו מאוסף של דגימות ביולוגיות ממוצא אנושי הרשומות ב"Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III".
- לעבוד בשכונת תרבית תאים, בעבר מעוקר תחת אור אולטרה סגול וניגב עם אתנול.
- הפשרת תאי H2B-GFP-HaCaT (קרטינוציטים מונצחים אנושיים בעור, hKCs) ופיברובלסטים ראשיים GFP-אנושיים (hFBs) ב 37 °C (57 °C), להוסיף 2 מ"ל של בינוני תרבות, וצנטריפוגה במשך 7 דקות ב 20 °C (50 °F) ב 250 × גרם.
הערה: תאי H2B-GFP-HaCaT הם קרטינוציטים מונצחים אנושיים המותאמים כדי לבטא חלבון פלואורסצנטי הירידי H2B-ירוק (GFP), המספק את הגרעינים שלהם עם פלואורסצנטיות ירוקה. GFP-hFBs הם פיברובלסטים ראשוניים אנושיים שהשתנו עם pLZRS-IRES-EGFP וקטור כדי לבטא פלואורסצנטיות ירוקה ציטופלסמית. תאים אלה שונו בעקבות פרוטוקולים שפורסמו בעבר30,31 - תרבית הן hKCs והן hFBs ב- 1x DMEM בתוספת סרום בקר עוברי 10% ו-1% מהפתרון האנטיביוטי/אנטי-ממיקוטי. מחממים מראש את המדיום התרבותי ב 37 °C (50 °F) לפני השימוש.
- לנתק את התאים על ידי שטיפת אותם עם 1x תמיסת מלח חוצץ פוספט (PBS), הוספת 2 מ"ל של טריפסין / אתילנדיאמין חומצה טטראצטית (EDTA) ודגורת אותם במשך 10 דקות ב 37 °C (50 °F).
- טריפסין לא מומת הוספת 4 מ"ל של מדיום תרבות. respend התאים, ולהעביר אותם לצינור 15 מ"ל. הסר 10 μL לספור תאים על תא Neubauer ולקבוע את הריכוז המתאים.
- צנטריפוגה צינור 15 מ"ל במשך 7 דקות ב 20 °C (50 °F) ב 250 × גרם. הסר את supernatant, ו resuspend הכדורים בריכוז הרצוי: hFBs ב 50,000 תאים / mL ו hKCs ב 5·× 106 תאים / מ"ל.
6. הכנת פיברינוגן לפני ג'ל
- הפעל תרומבין על ידי הוספת 1mL של CaCl2 (1% w/v ב- NaCl) לבקביון.
- הוסף את הרכיבים הבאים כדי להשיג 1 מ"ל של הידרוג'ל פיברין בריכוז הסופי של פיברין של 3.5 מ"ג / מ"ל: 59 μL של תרומבין מופעל (10 יחידות NIH / מ"ל), 59 μL של חומצה טרנקסמית (טבלת חומרים, 100 מ"ג / מ"ל), 764 μL של בינוני תרבות המכיל 50,000 hFBs / mL, 118 μL של פיברינוגן (20 מ"ג / מ"ל ב NaCl (0.9% w / v)).
הערה: פיברינוגן חייב להתווסף ברגע האחרון.
7. פרוטוקול זרימה מקבילית
- משאבה 1x PBS עם משאבה 3 דרך LCi ב 50 μL / min במהלך כל התהליך.
- משאבת נוזל הקרבה (1x PBS) עם משאבה 2 דרך UCi2 ב 100 μL / min.
- טענו את המזרק עם הג'ל שלפני, הניחו אותו במהירות במשאבה 1, והפעילו אותו במהירות של 200 μL/min(איור 4A).
- עצור משאבות 1 ו -2 ברגע שהג'ל מראש יוצא UCo.
- השאירו את השבב מבלי להסיר את הצינורות ב 37 °C (50 °F) לפחות 10 דקות כדי לאפשר gelation.
- משאבת תרבות בינונית ב 50 μL / שעה עם משאבה 3 עד UCi2 לילה.
- חסום את UCi1 עם מכסה.
8. זריעת מונו-שכבתית hKCs
- בדוק מתחת למיקרוסקופ כי hFBs מפוזרים 24 שעות לאחר הדור של התא העורי.
- הציגו את ה-hKCs עם משאבה 2 עד UCi2 ב-5 ×·106 תאים/מ"ל ב-40 μL/min למשך דקה אחת(איור 4B).
- השאירו את השבב למשך הלילה ב 37 °C בקו חממה רווית לחות עבור חיבור לתא.
- משאבת תרבות טרייה בינונית עם משאבה 3 רק דרך LCi ב 50 μL / min (איור 4C).

איור 4: פרוטוקול מיקרופלואידי ליצירת המבנה הדרמו-אפידרמלי. (A)חתך רוחבי המציג את תהליך הזרימה המקביל ליצירת התא העורי. (B)קרטינוציט מונו-שכבתית זורעת 24 שעות לאחר יצירת תא עורי. (C)תחזוקת תרבית התא בתוך המכשיר המיקרופלואידי. (ד)בילוי חתך של העור בתוך השבב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
9. תוואי התא
הערה: ערכה חיה/מתה מכתימה תאים עם פלואורסצנטיות ירוקה או אדומה בהתאם למצבם החי או המת. לבידול כדאיות, בשלב זה יש להשתמש ב- hKCs ו- hFBs שאינם פלואורסצנטיים. כל השלבים בהליך מתבצעים באמצעות UCi2 עם משאבה 2.
- לשטוף את הערוץ העליון עם 1x PBS במשך 5 דקות ב 50 μL / min כדי להסיר בינוני תרבות.
- לשאוב אוויר כדי להסיר את 1x PBS ב 50 μL / min.
- הכן Calcein AM / אתידיום הומודימר-1 ערכת (חי/ מת) פתרון על ידי ביצוע הוראות היצרן.
- משאבה חי / מת פתרון ב 50 μL / דקה במשך 2 דקות.
- דגירה 30 דקות ב 37 °C (50 °F) בחושך.
- לשטוף את הערוץ העליון על ידי שאיבת 1x PBS ב 50 μL / min במשך 2 דקות כדי להסיר כל ריאגנט הנותרים.
- שים לב לדגימה מתחת למיקרוסקופ הקונפוקלי. השתמש אורך גל עירור של 495/590 ננומטר ואורך גל פליטה של 519/617 ננומטר עבור תאים חיים ומתים, בהתאמה.
תוצאות
השבב המעוצב מורכב משני תאים נוזליים המופרדים על ידי קרום מחשב בגודל 5 מיקרומטר המאפשר את צמיחת התא על ידי מתן אפשרות למעבר של מולקולות מקדמות צמיחה מהתא התחתון. התא העליון מחזיק את מבנה הרקמה, במקרה זה, monolayer של hKCs על הידרוג'ל פיברין המכיל hFBs.
גובה הערוצים נקבע לפי מספר גליונות הדבקה שנוספו לכל ערוץ. התא התחתון מורכב מ-4 שכבות (380 מיקרומטר) והתא העליונה של 10 שכבות סרט חד-צדדיות ואחת דו-צדדית (962 מיקרומטר). מידות השבב הן 4 ס"מ על 2 ס"מ, מה שמגביר את המניפולציה שלו. יריעות ויניל דבק לספק מתיחות מים ושקיפות לבדיקה חזותית של המכשיר. שכבת PDMS הייתה שימושית לעגינה נכונה של צינורות llthe כדי למנוע כל דליפה מהחורים שבהם הצינורות תוקנו.
על פי הספרות שפורסמה, הזרקת הידרוג'ל המכיל תאים לתאים מיקרופלואידיים באמצעות משאבות מזרק לא דווחה עד כה. מסיבה זו, הזרקת הפיברין לפני ג'ל היה צריך להיות מוערך. ראינו שתחת זרימה של 50 μL / min, המזרק נחסם. עם זאת, קצבי זרימה גבוהים מ 200 μL / min עלולים לפגוע בתאים. מחקרים ריולוגיים בוצעו כדי לבדוק את התנהגות דילול הגיזה של הפיברין טרום ג'ל, קבלת צמיגות מ 10 עד 50 cP בתוך טווח קצב הזרימה שנבחר (50-200 μL / min). תוצאות אלה עזרו לקבוע את תנאי העבודה של מערכת זו.
בעבודה זו פותחה שיטת זרימה מקבילה המבוססת על דור של שתי זרמי למינאר על גבי החלק התחתון הוא טרום ג'ל, ואילו העליון היה נוזל הקרבה (PBS). פתרון מספרי של משוואות נאבייר-סטוקס והטלת תנאי הגבול המתאימים, מצאנו כי ישנם פתרונות אפשריים מרובים כדי להשיג את הגובה הרצוי. בהתחשב במגבלות קצב הגיזה שנקבעו קודם לכן, כדי להשיג הידרוג'ל בגובה של כ -500 מיקרומטר, שיעורי הזרימה היו 104 ו 222 μL / min עבור PBS ההקרבה ואת pre-gel, בהתאמה. בפועל, קצבי זרימה זעירים של 100 ו 200 μL / min שימשו לפשטות. כאשר הציגו אותם מחדש במודל, ערכים אלה נמצאו כתוצאה של גובה ג'ל של 576 מיקרומטר, דומה מאוד לערכים הצפויים(איור 5B). כדי לבדוק באופן ניסיוני את תפקוד השיטה המוצעת, נמדד גובה ההידרוג'ל לאורך התא העליון. גובה ממוצע של 550 מיקרומטר נצפה (איור 5A),די דומה לתחזית של המודל המתמטי שלנו.
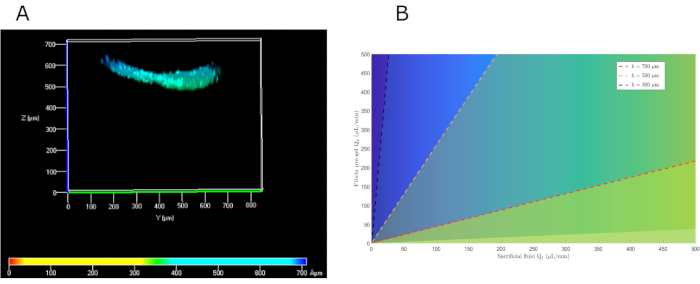
איור 5: פתרונות מתמטיים של זרימה מקבילה לבחירת זרמי נוזל הקדם-ג'ל וההקרבה המתאימים כדי להשיג את הגובה העורי הרצוי. (A) מבט קדמי על התמונה הקונפוקלית של hKCs שנזרעו על גבי ג'ל הפיברין כדי להעריך את גובהו. (B)פתרון מתמטי לגבהים שונים בהתאם לשיעורי הזרימה שלפני הג'ל וה- PBS. קיצורים: hKCs = קרטינוציטים מונצחים בעור אנושי; PBS = תמיסת מלח עם אגירה בפוספט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בעת קביעת הפרוטוקול בהתחלה, PBS לא היה שטיפה דרך הערוץ התחתון, מה שמוביל פערים בין הגובה התיאורטי של הג'ל לבין זה שנמדד. הבדל זה בגובה היה כ-40% בהשוואה להערכה (איור 6). לאחר שהפרוטוקול עבר אופטימיזציה ו-PBS עברה דרך התא התחתון, אובדן הגובה נפתר(איור 5).
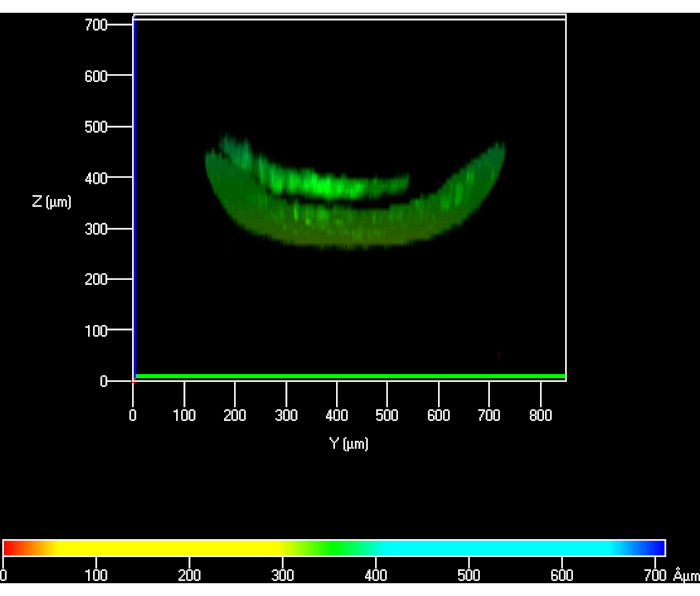
איור 6: מבט קונפוקללי של hKCs שנזרעו על גבי ההידרוג'ל כדי למדוד את גובהו כאשר PBS לא נשאב דרך התא התחתון. קיצורים: hKCs = קרטינוציטים מונצחים בעור אנושי; PBS = תמיסת מלח עם אגירה בפוספט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 7A מציג תמונת תצוגה עליונה פלואורסצנטית של התא העליון המכיל הידרוג'ל פיברין עם GFP-hFBs מוטבע, המוכיח כי 24 שעות לאחר הטעינה, תאים מופצים באופן אחיד לאורך התא ומתפשטים היטב. איור 7B מציג GFP-hKCs במפגש שנזרעו על גבי ההידרוג'ל.
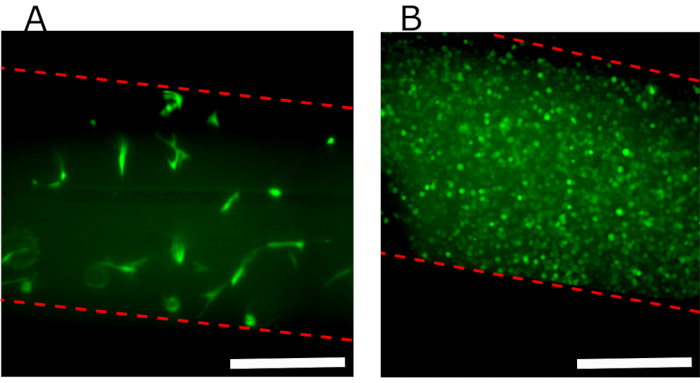
איור 7: תמונות פלואורסצנטיות של הערוץ העליון המציגות תאים שונים שנזרעו בהתקן. (A) תצוגה עליונה של התא העליון 24 שעות לאחר פרוטוקול זרימה מקבילה המציג את ה- hFBs מוטבע בג'ל הפיברין. (B)GFP-hKCs קונפלונטי זרע על גבי הידרוג'ל 24 שעות לאחר דור הידרוג'ל. קו אדום מקווקו מציין קירות ערוץ. מוטות קנה מידה: 400 מיקרומטר. קיצורים: hFBs = פיברובלסטים ראשוניים אנושיים; GFP-hKCs = חלבון פלואורסצנטי ירוק המבטא קרטינוציטים אנושיים מונצחים בעור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
חשוב לשמור על המערכת סגורה למשך הלילה עד למשק hKCs ולהיצמד למשטח ההידרוג'ל. כאשר הצינורות מוסרים לפני חיבור התא, בועות אוויר נכנסות לערוץ ומזיזות תאים, מה שמוביל למונו-שכבתי שאינו חד-יוני, כפי שמוצג באיור 8.

איור 8: מבט עליון על משטח ההידרוג'ל בעת הסרת צינורות מיד לאחר זריעת hKCs. קו אדום מקווקו מציין קירות ערוץ. סרגל קנה מידה: 400 מיקרומטר. קיצורים: hKCs = קרטינוציטים מונצחים בעור אנושי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בדיקת הכדאיות של התא שבוצעה ב- hFBs המוטמעים בהידרוג'ל בוצעה 24 שעות לאחר טעינה בשיטת הזרימה המקבילה, המציגה יכולת ערך לתא של ~ 95%. אותה בדיקה שבוצעה על תאי hKCs 24 שעות לאחר זריעתם על הידרוג'ל פיברין הראה תוצאות דומות. השלב הבא היה ליצור מבנה דרמו-אפידרמיס וללמוד את המבנה שלו באמצעות מיקרוסקופיה קונפוקלית לאחר 24 שעות(איור 9).
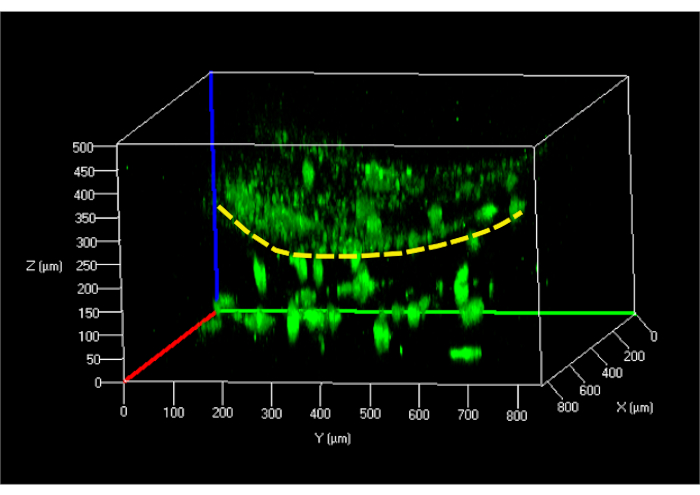
איור 9: תמונה תלת-ממדית משוחזרת של דגם העור הלא מופרע בשבב המיקרופלואידי. קו מקווקו צהוב מציין את פני השטח של הידרוג'ל המפריד בין hKCs (למעלה) מה- hFBs המוטמע בג'ל (למטה). קיצורים: hFBs = פיברובלסטים ראשוניים אנושיים; hKCs = קרטינוציטים של עור מונצח אנושי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
חשוב למצוא שיווי משקל בין התנהגות דילול הגיה של ג'ל פיברינוגן וזמן הג'ל שלו: אם לוקח יותר מדי זמן לבסס את הזרימה המקבילה, הוא מקרש וחוסם את המערכת; אם תהליך הג'ל איטי מדי, hFBs בהידרוג'ל ישתבשו כפי שמוצג באיור 10. ההתנהגות של מצב חולף זה יכול להיות מוסדר על ידי שינוי ריכוז תרומבין.

איור 10: תמונה קונפוצלית של הידרוג'ל פיברין המציג hFBs משתק (באדום) עקב זמן ג'לינג פיברין איטי. מונו-שכבתית hKCs (בכחול) מוצגת על גבי הג'ל. קיצורים: hFBs = פיברובלסטים ראשוניים אנושיים; hKCs = קרטינוציטים של עור מונצח אנושי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
במהלך תכנון המכשיר ושיטות ניסוי אחוריות, התעוררו כמה סיבוכים שהיו צריכים להיפתר כדי להשיג מכשיר מתפקד בצורה אופטימלית ורקמות מובנות היטב. בעיות אלה מוצגות בטבלה 2, יחד עם הפתרונות לפתרון בעיות.
| בעיות | פתרונות |
| הכירו הידרוג'ל תלת-ממדי בתא העליון, ומשאירים מקום פנוי למעלה לזרעי קרטינוציטים למעלה לאחר דור עורי | החל זרימה מקבילה של שני נוזלים (PBS ו pre-gel) עם צמיגות שונה כדי ליצור תא עור עם גובה מבוקר. |
| אי-התאמה של ערוץ במהלך ערימת גיליון ויניל | שימוש ביישר יישור מותאם אישית כדי לערום את כל הגליונות במקום הנכון |
| להשיג monolayer קרטינוציטים במפגש על גבי ג'ל פיברין כדי לדמות את האפידרמיס | אפשר חיבור לתאים לג'ל לפני הסרת הצינורות מהשבב, מניעת בועות אוויר מלהיכנס לערוץ ועקירת התאים. |
| אובדן גובה הידרוג'ל לאורך הערוץ עקב דליפת טרום ג'ל לערוץ התחתון במהלך פרוטוקול זרימה מקביל דרך הקרום הנקבובי. | שאבו PBS דרך הערוץ התחתון במהלך הקמת זרימה מקבילה. |
| משקעים פיברובלסט בתוך הג'ל | ריכוז תרומבין הוגדל מעט כדי להאיץ את ג'לציה פיברין |
טבלה 2: בעיות שנמצאו במהלך הפיתוח של העבודה הנוכחית ופתרונות מיושמים.
Discussion
המוטיבציה לפתח שיטה זו הייתה הרצון לדגמן מחלות עור וללמוד את ההשפעות של טיפולים חדשים וחדשניים בפלטפורמה בעלת תפוקה גבוהה. עד כה, מעבדה זו מייצרת את המקבילות הדרמו-אפידרמיס האלה על ידי יציקה - באופן ידני או בעזרת טכנולוגיית הביו-הדפסה התלת-ממדית - ג'ל הפיברין עם פיברובלסטים לתוך צלחת הכנסת צלחת של תרבית התא וזריעת הקרטינוציטים מעליה. ברגע הקרטינוציטים מגיעים למפגש, התרבות 3D נחשפת לממשק נוזלי אוויר, אשר מעורר בידול keratinocyte, יצירת אפידרמיס רבוד וכתוצאה מכך, עור אנושי בין-מפונקארי מפותח32,33,34. עם זאת, תרבויות תלת-ממד אלה, אם כי רלוונטיות מאוד מבחינה קלינית, הן יקרות, גוזלות זמן רב ואינן מחקות תנאים פיזיולוגיים.
טכנולוגיית רקמות על שבב מספקת פלטפורמה לחקות תנאים פיזיולוגיים בתרבית התאים, ובכך מאפשרת הבנה טובה יותר של הרעילות, היעילות והמשלוח של מועמדים לסמים13,14,15,16,17,18,19,35. רוב הרקמות שעוסבות בשבבים "קלאסיים" מיקרופלואידיים מורכבות משכבות בודדות של תאים, בעיקר תאי אפיתל22,26,42,27,28,36,37,38,39,40,41 . הדוגמנות של רקמות מורכבות ורב שכבתיות יותר נפגעה מהקושי לייצר שכבות רקמות הומוגניות ומונחות על גבי.
החידוש העיקרי של עבודה זו, בהשוואה למכשירים קודמים22,43, הוא פיתוח של שיטה ליצירת מבנה עור לא מופשט ופשוט באמצעות מיקרופלואידיקה. יתר על כן, חידוש חשוב נוסף ביחס לטכנולוגיות אחרות שפורסמו44 הוא עיצוב של מערכת שבבים חד פעמית פשוטה יחסית, חסכונית וקלה לשימוש העשויה מיריעות ויניל תואמות ביולוגית המאפשרת ייצור אד הוק. מערכת זו נמנעת משימוש בופלים מסיליקון ומהליכי מליטה מסובכים בפלזמה הדרושים ל- PDMS25. שבבים המבוססים על חומר זה דורשים ייצור של ופלים ספציפיים עבור כל עיצוב שבב שונה, אשר מעלה את המחיר של תהליך טיפוס. כל זה הופך את הטכנולוגיה ה"קלאסית" הנוכחית ליקרה, מורכבת ולא גמישה במיוחד.
כדי להתגבר על מגבלות אלה, תוך שימוש בעור כמודל רקמות, אנו מציגים פלטפורמה מיקרופלואידית גמישה, זולה וחזקה מאוד המבוססת על שכבות ויניל, המיוצרת על ידי מיקרו-מכונות. אנו מציגים גם מתודולוגיה חדשה המבוססת על זרימה מקבילה של נוזלי למינאר המאפשרת דור במקום של מבנה עור דו שכבתי עם תא עור תחתון המכיל hFBs ותא אפידרמיס עליון המורכב משכבת hKCs. השבב מורכב משני תאים המופרדים על ידי קרום מחשב נקבובי. הערוץ העליון מכיל את מבנה העור ומשאיר מקום פנוי כדי לאפשר בידול וריובוד hKC ו/או זלוף של תרבות בינונית, אוויר או אפילו סמים בעתיד. התא התחתון הוא per perfused ברציפות עם מדיום תרבות כדי לקדם את צמיחת התא. השימוש בקרום נקבובי עלול להוביל לאובדן חלק מהג'ל העליון לתא התחתון כאשר הוא נתון ללחץ גבוה עקב כוח שאיבה. הצגת זרימת PBS בתא התחתון מפצה על הפרש לחץ זה ומונעת דליפה זו.
התפלגות hKCs על פני השטח הידרוג'ל הוא היבט חשוב בעת יצירת מודל עור. כאשר הם אינם מפוזרים בצורה הומוגנית, דור של monolayer אחיד ולכן, ההבחנה האפידרמלית יכולה להיות מופרעת. באותו אופן, hFBs חייב להיות מופץ באותה מידה בתוך הידרוג'ל כדי להידמות המיקום הטבעי שלהם שבו הם נמצאים בעור אמיתי. כדי למנוע משקעים בתאים או חסימת צינורות, הרכב הידרוג'ל (במיוחד ריכוז תרומבין) יש ללמוד בקפידה כדי לשלוט בזמני ג'לציה והתנהגות דילול גיזה.
למרות ממצאים מעודדים אלה, דרושה עבודה עתידית כדי להדגים את תפקודה ארוך הטווח של המערכת הדרושה לקידום ההתפשטות וההבחנה הנכונות של המונו-שכבתית של hKC כדי ליצור עור אנושי מובחן היטב כולל קרנית שכבתית. מלבד העור, מערכת זו תאפשר ייצור של מבנים מורכבים ורב שכבתיים אחרים.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים מקרב לב לד"ר חוויאר רודריגז, ד"ר מריה לואיזה לופז, קרלוס מטלן וחואן פרנסיסקו רודריגז על הצעות מועילות מאוד, דיונים ו / או נתונים ראשוניים. אנו מודים בחביבות גם על תרומתם של סרג'יו פרננדז, פדרו הררוס ולארה סטולזנבורג לפרויקט זה. תודה מיוחדת ללכת ד"ר מרתה גרסיה עבור GFP-תווית hFBs ו hKCs. לבסוף, אנו מזהים את הסיוע הטכני המצוין של גיירמו ויזקאינו ואנג'ליקה קוראל. עבודה זו נתמכה על ידי "Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid", Project S2018/BAA-4480, Biopieltec-CM. עבודה זו נתמכה גם על ידי "Programa de excelencia", פרויקט EPUC3M03, CAM. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Materials
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
References
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387(2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress. , Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016).
- Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015. , Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526(2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43(2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471(2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898(2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006(2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535(2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved