Method Article
Generierung eines vereinfachten dreidimensionalen Skin-on-a-Chip-Modells in einer mikrobearbeiteten mikrofluidischen Plattform
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um ein dreidimensionales vereinfachtes und undifferenziertes Hautmodell unter Verwendung einer mikrobearbeiteten mikrofluidischen Plattform zu generieren. Ein paralleler Strömungsansatz ermöglicht die In-situ-Ablagerung eines Hautkompartiments für die Aussaat von Epithelzellen auf der Oberseite, die alle von Spritzenpumpen gesteuert werden.
Zusammenfassung
Diese Arbeit stellt eine neue, kostengünstige und zuverlässige mikrofluidische Plattform mit dem Potenzial dar, komplexe mehrschichtige Gewebe zu erzeugen. Als Proof of Concept wurde eine vereinfachte und undifferenzierte menschliche Haut modelliert, die ein dermales (stromales) und ein epidermales (epitheliales) Kompartiment enthält. Um dies zu erreichen, wurde ein vielseitiges und robustes, vinylbasiertes Gerät entwickelt, das in zwei Kammern unterteilt ist und einige der Nachteile mikrofluidischer Geräte auf Basis von Polydimethylsiloxan (PDMS) für biomedizinische Anwendungen überwindet, wie z.B. die Verwendung teurer und spezialisierter Geräte oder die Absorption kleiner, hydrophober Moleküle und Proteine. Darüber hinaus wurde eine neue Methode entwickelt, die auf parallelem Fluss basiert und die In-situ-Ablagerung sowohl des dermalen als auch des epidermalen Kompartiments ermöglicht. Das Hautkonstrukt besteht aus einer Fibrinmatrix, die menschliche primäre Fibroblasten enthält, und einer Monoschicht aus immortalisierten Keratinozyten, die oben ausgesät sind und anschließend unter dynamischen Kulturbedingungen aufrechterhalten werden. Diese neue mikrofluidische Plattform eröffnet die Möglichkeit, menschliche Hautkrankheiten zu modellieren und die Methode zu extrapolieren, um andere komplexe Gewebe zu erzeugen.
Einleitung
In jüngster Zeit wurden Fortschritte bei der Entwicklung und Produktion von In-vitro-Modellen für die menschliche Haut zur Analyse der Toxizität kosmetischer und pharmazeutischer Produkteerzielt 1. Forscher in der Pharma- und Hautpflegeindustrie haben Tiere verwendet, wobei Mäuse am häufigsten vorkommen, um ihre Produkte zu testen2,3,4,5. Das Testen von Produkten an Tieren ist jedoch nicht immer prädiktiv für das Ansprechen beim Menschen, was häufig zu Arzneimittelversagen oder nebenwirkungen beim Menschen und folglich zu wirtschaftlichen Verlusten führt5,6. Das Vereinigte Königreich war das erste Land, das 1998 die Verwendung von Tieren für kosmetische Tests verbot. Später, im Jahr 2013, verbot die EU die Prüfung und Approbation von Kosmetika an Tieren (EU-Kosmetikverordnung Nr. 1223/2009)7.
Dieses Verbot wird auch von anderen Ländern in Betracht gezogen, wie z.B. im "Humane Cosmetics Act" in den USA8. Neben ethischen Bedenken machen die anatomischen Unterschiede zwischen Tier- und Menschenhaut Tierversuche zeitaufwendig, teuer und oft unwirksam. Darüber hinaus wird erwartet, dass der globale Markt für In-vitro-Toxikologie-Tests bis 2025 26,98 Milliarden US-Dollar erreichenwird 9. Aus diesen Gründen besteht die Notwendigkeit, neue Methoden und Alternativen für diese In-vitro-Studien zu entwickeln, wie z. B. biotechnologisch hergestellte menschliche Hautmodelle, die es ermöglichen, die Sicherheit und toxische Wirkung von Kosmetika und Arzneimitteln ohne den Einsatz von Tieren zu testen.
Es gibt zwei verschiedene Arten von kommerziell erhältlichen, in vitro, menschlichen Hautmodellen. Der erste Typ besteht aus geschichteten epidermalen Äquivalenten, die mehrere Schichten differenzierender Keratinozyten enthalten, die auf verschiedenen Materialien ausgesät werden. Einige von ihnen wurden von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) genehmigt und vom Europäischen Zentrum zur Validierung alternativer Methoden (ECVAM) für Hautkorrosions- und Reizungstests validiert, wie EpiDerm oder SkinEthic10,11,12. Der zweite Typ sind Vollhautäquivalente mit einer Schicht differenzierender menschlicher Keratinozyten, die auf einem dreidimensionalen (3D) Gerüst ausgesät sind, das Fibroblasten wie T-Skin und EpiDerm-FT enthält. Diese Modelle werden jedoch unter statischen Bedingungen kultiviert, was sie nicht in der Lage macht, die physiologischen Bedingungen des Menschen genau darzustellen.
Das jüngste Interesse konzentrierte sich auf die Generierungvon In-vitro-3D-Hautmodellen in Zellkultur-Insert-Formaten (CCI) mit dynamischer Perfusion13,14,15,16,17,18,19. Diese Systeme können jedoch nicht streng sensu als mikrofluidische Skin-on-Chips im Sinne ihrer klassischen Definition im Feld betrachtet werden. Ingbers Definition für Organe auf einem Chip besagt, dass das Organ innerhalb der mikrofluidischen Kanäle platziert werden muss, was eine Bedingung ist, dass nur wenige Geräte20,21erfüllen. Skin-on-Chips haben bisher meist einfache Epithelien als Einzelzellschichten und/oder dermale Zellschichten modelliert, die durch eine poröse Membran getrennt sind22,23. Obwohl es einige Fortschritte bei der Modellierung der Haut in mikrofluidischen Systemen gegeben hat16,24, gibt es derzeit keine Literatur, die ein Organ-on-a-Chip-System zeigt, das Ingbers Definition entspricht, das in der Lage ist, eine mehrschichtige Haut in situ zu erzeugen und sowohl epitheliale als auch stromale Komponenten zu enthalten.
In dieser Arbeit wird eine neue, kostengünstige, robuste, vinylbasierte mikrofluidische Plattform für Skin-on-a-Chip-Anwendungen vorgestellt. Diese Plattform wurde durch Mikrobearbeitung hergestellt, die mehr Einfachheit im Herstellungsprozess sowie erhöhte Flexibilität und Vielseitigkeit im Layout des Geräts bietet und einige der Einschränkungen von PDMS25 überwindet. Es wurde auch eine Möglichkeit entwickelt, ein vereinfachtes Hautkonstrukt durch einen parallelen, mit Spritzenpumpen gesteuerten Durchfluss einzuführen. Durch den parallelen Fluss können zwei Flüssigkeiten mit sehr unterschiedlichen Viskositäten (in diesem Fall ein Puffer und ein Fibrin-Pre-Gel) durch einen Kanal durchblutet werden, ohne sich miteinander zu vermischen. Als Proof of Concept wurde ein dermo-epidermales Konstrukt mit Fibroblasten, die in eine Fibrinmatrix eingebettet sind, die die Dermis nachahmt, in das Gerät eingeführt, auf dem eine Monoschicht von Keratinozyten geladen wurde, um die undifferenzierte Epidermis zu emulieren. Die Höhe des Hautfachs kann durch Modifikation der Durchflussraten moduliert werden. Die Hauptneuheit dieser Arbeit ist im Vergleich zu den zuvor beschriebenen Modellen22,26,27,28,29, die Entwicklung eines 3D-Konstrukts innerhalb einer Mikrokammer mittels Mikrofluidik. Obwohl dieser Artikel eine vereinfachte undifferenzierte Haut vorstellt, besteht das langfristige Ziel darin, ein vollständig differenziertes Hautkonstrukt zu generieren und zu charakterisieren, um seine Lebensfähigkeit und Funktionalität für arzneimittel- und kosmetische Testzwecke zu demonstrieren.
Protokoll
1. Chipdesign und Mikrobearbeitungsparameter
- Entwerfen Sie die mikrofluidischen Chipschichten mit der Open-Source-Designsoftware FreeCAD. Die Abmessungen der Kanäle sind Tabelle 1 zu entnehmen. Fügen Sie vier Löcher mit einem Durchmesser von 2,54 mm in das Design ein, um einen maßgeschneiderten Aligner für eine korrekte Schichtüberlagerung zu verwenden.
| Länge (μm) | Breite (μm) | |
| Unterhaus | 28,400 | 800 |
| Obere Kammer | 31,000 | 800 |
Tabelle 1: Abmessungen des oberen und unteren Kanals des Geräts.
- Schneiden Sie 95 μm dicke, klebende, transparente Vinylplatten in 30 cm x 30 cm große Quadrate, damit sie richtig in den Plotter passen.
- Verwenden Sie die Brother CanvasWorkspace-Software, um einen 30 cm x 30 cm großen Arbeitsbereich zu erstellen und ihn mit den entworfenen Mustern für die verschiedenen Schichten des Chips zu füllen (Abbildung 1A). Speichern Sie es in einer .svg Datei.
- Schneiden Sie die 30 cm x 30 cm großen Vinylplatten mit dem Kantenplotter aus (Abbildung 1B-D).
- Kleben Sie die Vinylplatte auf eine Klebematte mit geringer Klebrigkeit und beseitigen Sie bei Bedarf alle Luftblasen.
- Laden Sie die .svg Datei auf den Plotter hoch und stellen Sie die Schnittparameter ein: Schneidklinge: Ebene 3; Schnittdruck: Stufe 0; Schnittgeschwindigkeit: Stufe 1. Legen Sie die Klebematte mit dem Vinyl in den Plotter und starten Sie den Schneidvorgang.
- Schneiden Sie das obere Kanalmuster auf 12 μm dickem doppelseitigem Klebeband-Vinyl aus, indem Sie die vorherigen Schritte ausführen.

Abbildung 1: Chip-Design und Mikrobearbeitungsprozess. (A) Software-Layout, das den Arbeitsbereich zeigt, der sowohl mit den oberen als auch mit den unteren Mustern gefüllt ist, die für den Chip entworfen wurden. ( B) Kantenplotter während des Schneidvorgangs; Schneidklinge, ganze Vinylplatte und Klebematte werden gezeigt. (C) Gemustertes Vinyl, das vom geschnittenen Blatt getrennt wird. (D) Probe einer selbstklebenden Vinylschicht, die mit dem oberen Kanaldesign gemustert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. PDMS-Schichtherstellung
- Mischen Sie das PDMS und das Härter im Verhältnis 10: 1 (v / v) und legen Sie die Mischung für 15 min unter Vakuum, um Luftblasen zu entfernen. Gießen Sie 55 ml der Mischung in eine 55 cm2 quadratische Kulturschale, um eine 2 mm dicke Schicht zu erhalten. Entfernen Sie Blasen mit einer Nadel.
- Härten Sie die Mischung (Schritt 2.1) im Ofen für 1 h bei 80 °C aus. Entformen Sie das PDMS und schneiden Sie es mit den Chipabmessungen in Rechtecke. Machen Sie mit einer 18 G Spritzennadel Löcher für den Schlauch.
3. Chipmontage
HINWEIS: Zum besseren Verständnis siehe Abbildung 2.
- Montieren Sie das gesamte Gerät mit einem Aligner, um Kanäle, Ein- und Auslässe richtig einzustellen. Stapeln Sie vier Vinylschichten (mit dem entsprechenden unteren Mikromuster) für die Montage des unteren Kanals und bewahren Sie das Abdeckband der unteren Schicht auf, um ein Verkleben am Aligner zu vermeiden.
- Schneiden Sie die poröse Membran aus Polycarbonat (PC) aus und legen Sie sie auf den unteren Kanal, um sie vom oberen kanal zu trennen. Achten Sie darauf, die Einlässe des unteren Kanals nicht zu bedecken.
- Fügen Sie zehn Vinylschichten mit dem oberen Kammerdesign hinzu. Kleben Sie eine doppelseitige Klebeband-Vinylschicht mit dem oberen Kanalmuster auf die Oberseite. Entfernen Sie den Chip aus dem Aligner und kleben Sie ihn auf den Glasobjektträger.
- Legen Sie eine 2 mm dicke PDMS-Folie auf die doppelseitige Bandvinylschicht, um eine angemessene Verankerung für den Schlauch zu gewährleisten und Leckagen zu vermeiden. Lassen Sie über Nacht ein Gewicht auf dem Chip, um sicherzustellen, dass der Chip vollständig wasserdicht ist. Sterilisieren Sie den Chip, indem Sie 70% v / v Ethanol für 5 min spülen, und waschen Sie ihn dann mit destilliertemH2O.

Abbildung 2: Mikrofluidische Chip-Baugruppe. (A) Allgemeines Schema der Montage des Produkts. Die untere und die obere Kammer bestehen aus vier bzw. elf übereinander liegenden Vinylplatten. (B) Obere und seitliche Ansichten des mikrofluidischen Chips. Der obere und untere Kanal werden in Rosa bzw. Blau dargestellt. (C) Bild der Chip-Baugruppe mit einem maßgeschneiderten Aligner. (D) Chipbild nach vollständiger Montage. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Pumpenanschlüsse
ANMERKUNG: Die grafische Darstellung der Pumpenanschlüsse ist in Abbildung 3 dargestellt.
- Schließen Sie Pumpe 1 an den oberen Kammereinlass 1 (UCi1) an.
- Schließen Sie Pumpe 2 an den oberen Kammereinlass 2 (UCi2) an.
- Schließen Sie Pumpe 3 an den Unteren Kammereinlass (LCi) an.
- Schließen Sie Upper Chamber Outlet (UCo) und Lower Chamber Outlet (LCo) an ein Abfallrohr an.
- Verbinden Sie die Spritzen mit Polytetrafluorethylen (PTFE)-Schläuchen und 18 G Edelstahlsteckern mit jedem Einlass.

Abbildung 3: Pumpenanschlüsse und Position der Ein-/Auslässe. (A) Diagramm, das den Anschluss der drei verschiedenen Pumpen an ihre jeweiligen Einlässe zeigt. Auslässe werden an einen Abfallbehälter angeschlossen. (B) Chipbild mit beschrifteten Ein- und Auslässen. Abkürzungen: LCi = Unterkammereinlass; LCo = unterer Kammerauslass; UCi1 = Oberkammereinlass 1; UCi2 = Oberkammereinlass 2; UCo = oberer Kammerauslass. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Zellkultur
HINWEIS: Die HaCaT-Zelllinie hat einen kommerziellen Ursprung. Menschliche primäre Fibroblasten stammen von gesunden Spendern und wurden aus der Sammlung biologischer Proben menschlichen Ursprungs gewonnen, die im "Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III" registriert sind.
- Arbeiten Sie in einer Zellkulturhaube, die zuvor unter ultraviolettem Licht sterilisiert und mit Ethanol abgewischt wurde.
- H2B-GFP-HaCaT-Zellen (humane immortalisierte Hautkeratinozyten, hKCs) und GFP-humane primäre Fibroblasten (hFBs) bei 37 °C auftauen, 2 ml Kulturmedium hinzufügen und 7 min bei 20 °C bei 250 × gzentrifugieren.
HINWEIS: H2B-GFP-HaCaT-Zellen sind humane immortalisierte Keratinozyten, die modifiziert wurden, um ein hybrides H2B-grün fluoreszierendes Protein (GFP) aus Histon zu exprimieren, das ihre Kerne mit grüner Fluoreszenz versorgt. GFP-hFBs sind humane primäre Fibroblasten, die mit dem Vektor pLZRS-IRES-EGFP transformiert wurden, um zytoplasmatische grüne Fluoreszenz zu exprimieren. Diese Zellen wurden nach den zuvor veröffentlichten Protokollen30,31 modifiziert. - Kultur sowohl hKCs als auch hFBs in 1x DMEM, ergänzt mit 10% fetalem Rinderserum und 1% antibiotischer/antimykotischer Lösung. Das Kulturmedium vor Gebrauch bei 37 °C vorwärmen.
- Lösen Sie die Zellen, indem Sie sie mit 1x phosphatgepufferter Kochsalzlösung (PBS) waschen, 2 ml Trypsin/Ethylendiamintetraessigsäure (EDTA) hinzufügen und 10 min bei 37 °C inkubieren.
- Inaktivieren Sie Trypsin und fügen Sie 4 ml Kulturmedium hinzu. Resuspendieren Sie die Zellen und übertragen Sie sie in eine 15 ml Röhre. Entfernen Sie 10 μL, um die Zellen auf einer Neubauer-Kammer zu zählen und die entsprechende Konzentration zu bestimmen.
- Zentrifugieren Sie das 15 mL Röhrchen für 7 min bei 20 °C bei 250 × g. Entfernen Sie den Überstand und resuspenieren Sie die Pellets in der gewünschten Konzentration: hFBs bei 50.000 Zellen/ml und hKCs bei 5·× 106 Zellen/ml.
6. Fibrinogen-Pre-Gel-Zubereitung
- Aktivieren Sie Thrombin, indem Sie 1 ml CaCl2 (1% w/v in NaCl) in die Durchstechflasche geben.
- Fügen Sie die folgenden Komponenten hinzu, um 1 ml eines Fibrinhydrogels bei einer Endgültigen Konzentration von Fibrin von 3,5 mg/ml zu erhalten: 59 μL aktiviertes Thrombin (10 NIH-Einheiten/ml), 59 μL Tranexamsäure(Materialtabelle,100 mg/ml), 764 μL Kulturmedium mit 50.000 hFBs/ml, 118 μL Fibrinogen (20 mg/ml in NaCl (0,9 % w/v)).
HINWEIS: Fibrinogen muss im letzten Moment hinzugefügt werden.
7. Paralleles Flussprotokoll
- Pumpe 1x PBS mit Pumpe 3 durch den LCi bei 50 μL/min während des gesamten Prozesses.
- Pumpen Sie Opferflüssigkeit (1x PBS) mit Pumpe 2 durch die UCi2 bei 100 μL/min.
- Laden Sie die Spritze mit dem Vorgel ein, legen Sie sie schnell in Pumpe 1 und lassen Sie sie mit 200 μL/min laufen(Abbildung 4A).
- Stoppen Sie die Pumpen 1 und 2, sobald das Vorgel das UCo verlässt.
- Lassen Sie den Chip, ohne den Schlauch zu entfernen, bei 37 °C für mindestens 10 min, um eine Gelierung zu ermöglichen.
- Pumpen Sie kulturmedium bei 50 μL/h mit Pumpe 3 bis UCi2 über Nacht.
- Blockieren Sie UCi1 mit einer Kappe.
8. hKCs Monolayer Seeding
- Überprüfen Sie unter dem Mikroskop, ob hFBs 24 h nach der Bildung des Hautkompartiments verteilt sind.
- Stellen Sie die hKCs mit Pumpe 2 bis UCi2 bei 5 ×·106 Zellen/ml bei 40 μL/min für 1 min vor (Abbildung 4B).
- Lassen Sie den Chip über Nacht bei 37 °C in einem feuchtigkeitsgesättigten Inkubator zur Zellbefestigung.
- Frischkulturmedium mit Pumpe 3 nur durch LCi bei 50 μL/min pumpen (Abbildung 4C).

Abbildung 4: Mikrofluidisches Protokoll zur Erzeugung des dermo-epidermalen Konstrukts. (A) Querquerschnitt, der den parallelen Strömungsprozess zur Erzeugung des dermalen Kompartiments zeigt. (B) Keratinozyten-Monolayer-Aussaat 24 h nach der Erzeugung des hauten Kompartiments. (C) Zellkulturpflege innerhalb der mikrofluidischen Vorrichtung. (D) Querschnittsnachbildung der Haut im Inneren des Chips. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
9. Zelllebensfähigkeitstest
HINWEIS: Das Live/Dead Kit färbt Zellen mit grüner oder roter Fluoreszenz, abhängig von ihrem lebenden oder toten Zustand. Für eine ordnungsgemäße Rentabilitätsdifferenzierung müssen in diesem Schritt nicht fluoreszierende hKCs und hFBs verwendet werden. Alle Schritte im Verfahren werden durch UCi2 mit Pumpe 2 durchgeführt.
- Waschen Sie den oberen Kanal mit 1x PBS für 5 min bei 50 μL/min, um das Kulturmedium zu entfernen.
- Pumpen Sie Luft, um die 1x PBS bei 50 μL/min zu entfernen.
- Bereiten Sie die Lösung Calcein AM/Ethidium homodimer-1 Kit (Live/Dead) vor, indem Sie die Anweisungen des Herstellers befolgen.
- Pumpe Lebend/Tot Lösung bei 50 μL/min für 2 min.
- 30 min bei 37 °C im Dunkeln inkubieren.
- Waschen Sie den oberen Kanal, indem Sie 1x PBS bei 50 μL /min für 2 min pumpen, um das verbleibende Reagenz zu entfernen.
- Beobachten Sie die Probe unter dem konfokalen Mikroskop. Verwenden Sie eine Anregungswellenlänge von 495/590 nm und eine Emissionswellenlänge von 519/617 nm für lebende bzw. tote Zellen.
Ergebnisse
Der entworfene Chip besteht aus zwei fluidischen Kammern, die durch eine 5 μm porengroße PC-Membran getrennt sind, die das Wachstum der Zelle ermöglicht, indem sie den Durchgang wachstumsfördernder Moleküle aus der unteren Kammer ermöglicht. Die obere Kammer hält das Gewebekonstrukt, in diesem Fall eine Monoschicht aus hKCs auf einem Fibrinhydrogel, das hFBs enthält.
Die Höhe der Kanäle wird durch die Anzahl der Klebefolien bestimmt, die jedem Kanal hinzugefügt werden. Die untere Kammer besteht aus 4 Schichten (380 μm) und die obere aus 10 einseitigen Bandschichten und einer doppelseitigen (962 μm). Die Abmessungen des Chips betragen 4 cm x 2 cm, was seine Manipulation verbessert. Die selbstklebenden Vinylplatten bieten Wasserdichtigkeit und Transparenz für die visuelle Inspektion des Geräts. Die PDMS-Schicht war nützlich für die ordnungsgemäße Verankerung der Schläuche, um Leckagen aus den Löchern zu vermeiden, in denen die Rohre befestigt waren.
Laut veröffentlichter Literatur wurde die Injektionsfähigkeit von zellhaltigen Hydrogelen in Mikrofluidikkammern mittels Spritzenpumpen bisher nicht berichtet. Aus diesem Grund musste die Injizierbarkeit des Fibrin-Pre-Gels beurteilt werden. Wir beobachteten, dass bei einem Durchfluss von 50 μL/min die Spritze blockiert war. Durchflussraten von mehr als 200 μL/min könnten die Zellen jedoch schädigen. Rheologische Studien wurden durchgeführt, um das Scherverdünnungsverhalten des Fibrin-Vorgels zu testen und Viskositäten von 10 bis 50 cP innerhalb des gewählten Durchflussbereichs (50-200 μL/min) zu erhalten. Diese Ergebnisse trugen dazu bei, die Arbeitsbedingungen dieses Systems festzulegen.
In dieser Arbeit wurde eine parallele Strömungsmethode entwickelt, die auf der Erzeugung von zwei überlagerten laminaren Strömungen basiert, von denen die untere das Vorgel ist, während die obere Opferflüssigkeit (PBS) war. Durch die numerische Lösung der Navier-Stokes-Gleichungen und die Auferlegung der entsprechenden Randbedingungen stellten wir fest, dass es mehrere mögliche Lösungen gab, um die gewünschte Höhe zu erhalten. Unter Berücksichtigung der zuvor festgelegten Scherratengrenzen betrugen die Durchflussraten für das Opfer-PBS bzw. das Vorgel 104 bzw. 222 μL/min, um ein Hydrogel von etwa 500 μm Höhe zu erreichen. In der Praxis wurden der Einfachheit halber Mikrodurchflussraten von 100 und 200 μL/min verwendet. Bei der Wiedereinführung in das Modell ergaben sich für diese Werte eine Gelhöhe von 576 μm, die den erwarteten Werten sehr ähnlich ist (Abbildung 5B). Um die Funktionsweise der vorgeschlagenen Methode experimentell zu überprüfen, wurde die Höhe des Hydrogels entlang der oberen Kammer gemessen. Es wurde eine durchschnittliche Höhe von 550 μm beobachtet (Abbildung 5A), ganz ähnlich der Vorhersage unseres mathematischen Modells.
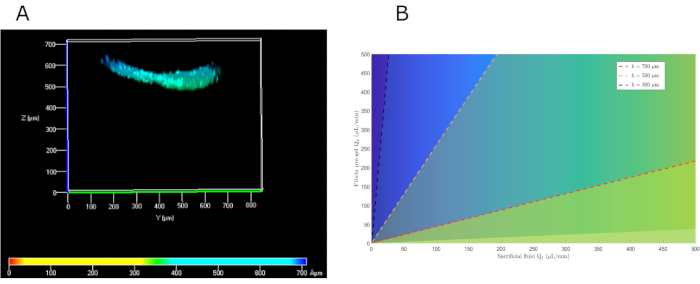
Abbildung 5: Mathematische Parallelflusslösungen zur Auswahl der geeigneten Vorgel- und Opferflüssigkeitsströme, um die gewünschte Hauthöhe zu erhalten. (A) Vorderansicht des konfokalen Bildes von hKCs, die auf dem Fibringel ausgesät sind, um seine Höhe zu beurteilen. (B) Mathematische Lösung für unterschiedliche Höhen in Abhängigkeit von den Vorgel- und PBS-Durchflussraten. Abkürzungen: hKCs = human immortalized skin keratinocytes; PBS = phosphatgepufferte Kochsalzlösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bei der Festlegung des Protokolls zu Beginn wurde PBS nicht durch den unteren Kanal gespült, was zu Diskrepanzen zwischen der theoretischen Höhe des Gels und der gemessenen führte. Dieser Höhenunterschied betrug ~40% im Vergleich zum geschätzten (Abbildung 6). Nachdem das Protokoll optimiert und PBS durch die untere Kammer gepumpt war, war dieser Höhenverlust behoben (Abbildung 5).
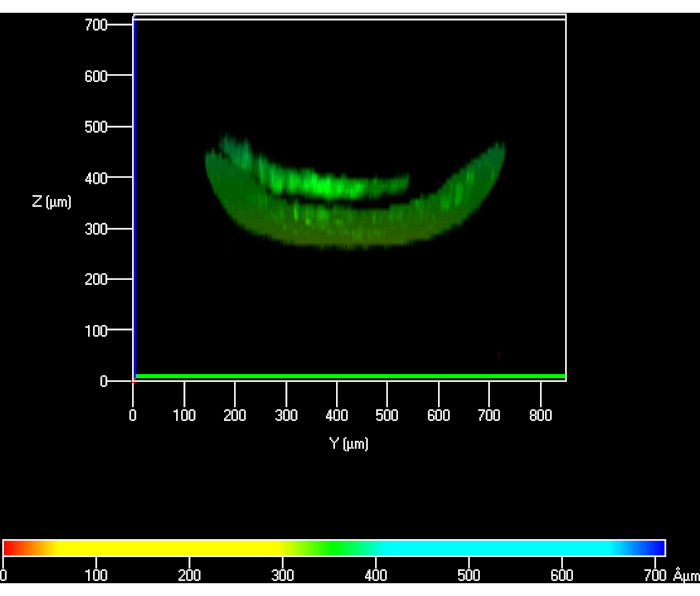
Abbildung 6: Konfokale Ansicht von hKCs, die auf dem Hydrogel ausgesät sind, um seine Höhe zu messen, wenn PBS nicht durch die untere Kammer gepumpt wurde. Abkürzungen: hKCs = human immortalized skin keratinocytes; PBS = phosphatgepufferte Kochsalzlösung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 7A zeigt ein fluoreszierendes Draufsichtsbild der oberen Kammer, das ein Fibrin-Hydrogel mit eingebetteten GFP-hFBs enthält, was zeigt, dass die Zellen 24 h nach dem Laden gleichmäßig entlang der Kammer verteilt und gut verteilt sind. Abbildung 7B zeigt konfluente GFP-hKCs, die auf dem Hydrogel ausgesät sind.
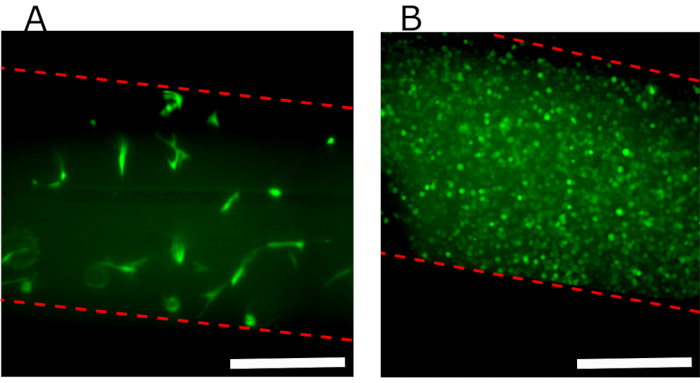
Abbildung 7: Fluoreszenzbilder des oberen Kanals, die verschiedene Zellen zeigen, die in der Vorrichtung ausgesät sind. (A) Draufsicht auf die obere Kammer 24 h nach parallelem Flussprotokoll, die die in das Fibringel eingebetteten hFBs zeigt. (B) Konfluente GFP-hKCs, die 24 h nach der Hydrogelerzeugung auf dem Hydrogel ausgesät werden. Gestrichelte rote Linie zeigt Kanalwände an. Maßstabsleisten: 400 μm. Abkürzungen: hFBs = humane primäre Fibroblasten; GFP-hKCs = grün fluoreszierende Protein-exprimierende menschliche immortalisierte Hautkeratinozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Es ist wichtig, das System über Nacht geschlossen zu halten, bis die hKCs sedimentieren und an der Hydrogeloberfläche haften. Wenn der Schlauch vor der Zellanlagerung entfernt wird, dringen Luftblasen in den Kanal ein und verdrängen zellen, was zu einer ungleichmäßigen konfluenten Monoschicht führt, wie in Abbildung 8 gezeigt.

Abbildung 8: Draufsicht auf die Hydrogeloberfläche beim Entfernen des Schlauches unmittelbar nach der hKCs-Aussaat. Gestrichelte rote Linie zeigt Kanalwände an. Maßstabsleiste: 400 μm. Abkürzungen: hKCs = human immortalized skin keratinocytes. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Zelllebensfähigkeitstest, der an in das Hydrogel eingebetteten hFBs durchgeführt wurde, wurde 24 h nach der Beladung unter Verwendung der Parallelflussmethode durchgeführt und zeigte eine Zelllebensfähigkeit von ~ 95%. Derselbe Test, der 24 h nach der Aussaat auf dem Fibrin-Hydrogel an hKCs-Zellen durchgeführt wurde, zeigte ähnliche Ergebnisse. Der nächste Schritt bestand darin, ein dermo-epidermales Konstrukt zu erzeugen und seine Struktur mittels konfokaler Mikroskopie nach 24 h zu untersuchen (Abbildung 9).
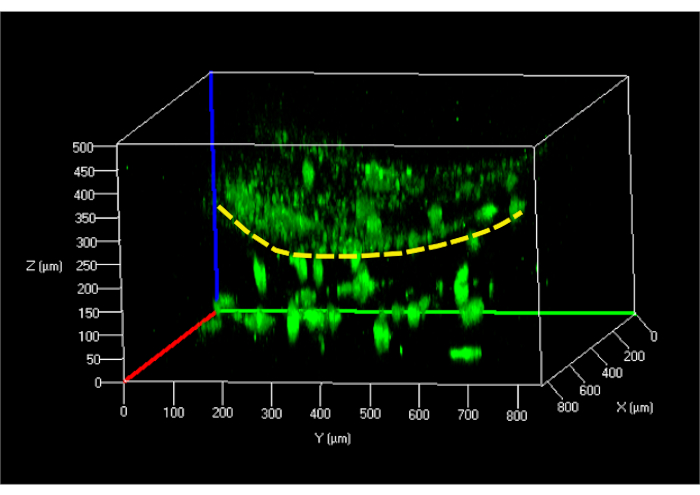
Abbildung 9: Rekonstruiertes konfokales 3D-Bild des undifferenzierten Hautmodells im mikrofluidischen Chip. Die gelbe gestrichelte Linie zeigt die Oberfläche des Hydrogels an, das hKCs (oben) von den im Gel eingebetteten hFBs trennt (unten). Abkürzungen: hFBs = humane primäre Fibroblasten; hKCs = humane immortalisierte Hautkeratinozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Es ist entscheidend, ein Gleichgewicht zwischen dem Scherverdünnungsverhalten des Fibrinogengels und seiner Gelierungszeit zu finden: Dauert es zu lange, um den Parallelfluss herzustellen, koaguliert es und blockiert das System; Wenn der Gelierungsprozess zu langsam ist, sedimentieren hFBs im Hydrogel, wie in Abbildung 10 gezeigt. Das Verhalten dieses transienten Zustands kann durch Variieren der Thrombinkonzentration reguliert werden.

Abbildung 10: Konfokales Bild eines Fibrinhydrogels, das sedimentierte hFBs (in rot) aufgrund einer langsamen Fibringelierungszeit zeigt. Eine hKCs-Monoschicht (in blau) ist auf der Oberseite des Gels abgebildet. Abkürzungen: hFBs = humane primäre Fibroblasten; hKCs = humane immortalisierte Hautkeratinozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Während der Geräteplanung und der nachträglichen experimentellen Praktiken traten einige Komplikationen auf, die gelöst werden mussten, um ein optimal funktionierendes Gerät und gut strukturiertes Gewebe zu erhalten. Diese Probleme sind in Tabelle 2zusammen mit den Lösungen zur Problembehandlung aufgeführt.
| Probleme | Lösungen |
| Einführung eines 3D-Hydrogels in der oberen Kammer, wodurch nach dermaler Erzeugung freier Raum bleibt, um Keratinozyten oben zu säen | Tragen Sie einen parallelen Fluss von zwei Flüssigkeiten (PBS und Pre-Gel) mit unterschiedlichen Viskositäten auf, um ein Hautkompartiment mit kontrollierter Höhe zu erzeugen. |
| Kanalfehlausrichtung beim Stapeln von Vinylblechen | Verwendung eines maßgeschneiderten Aligners, um alle Blätter an der richtigen Stelle zu stapeln |
| Erreichen Sie eine konfluente Keratinozyten-Monoschicht auf dem Fibringel, um die Epidermis zu simulieren | Erlauben Sie die Zellbefestigung am Gel, bevor Sie die Röhren vom Chip entfernen, um zu verhindern, dass Luftblasen in den Kanal eindringen und die Zellen verdrängen. |
| Hydrogelhöhenverlust entlang des Kanals aufgrund des Austretens des Vorgels in den unteren Kanal während des parallelen Strömungsprotokolls durch die poröse Membran. | Pumpen Sie PBS während des parallelen Durchflussaufbaus durch den unteren Kanal. |
| Fibroblastensedimentation im Gel | Thrombinkonzentration wurde leicht erhöht, um die Fibringelierung zu beschleunigen |
Tabelle 2: Probleme, die während der Entwicklung der laufenden Arbeit und der angewandten Lösungen festgestellt wurden.
Diskussion
Die Motivation, diese Methode zu entwickeln, war der Wunsch, Hauterkrankungen zu modellieren und die Auswirkungen neuer und innovativer Therapien in einer Hochdurchsatzplattform zu untersuchen. Bis heute produziert dieses Labor diese dermo-epidermalen Äquivalente, indem es - entweder manuell oder mit Hilfe der 3D-Bioprinting-Technologie - das Fibringel mit Fibroblasten in eine Zellkultur-Einlegeplatte gießt und die Keratinozyten darauf aussät. Sobald die Keratinozyten den Zusammenfluss erreichen, wird die 3D-Kultur der Luft-Flüssigkeits-Grenzfläche ausgesetzt, die die Keratinozytendifferenzierung induziert und eine geschichtete Epidermis und folglich eine voll entwickelte interfollikuläre menschliche Hauterzeugt 32,33,34. Diese 3D-Kulturen, obwohl klinisch sehr relevant, sind jedoch teuer, zeitaufwendig und ahmen keine physiologischen Bedingungen nach.
Die Tissue-on-a-Chip-Technologie bietet eine Plattform zur Nachahmung physiologischer Bedingungen in der Zellkultur und ermöglicht so ein besseres Verständnis der Toxizität, Wirksamkeit und Abgabe der Arzneimittelkandidaten13,14,15,16,17,18,19,35. Die meisten Gewebe, die mikrofluidischen "klassischen" Chips nachempfunden sind, bestehen aus einzelnen Zellschichten, meist Epithelzellen22,26,42,27,28,36,37,38,39,40,41 . Die Modellierung komplexerer, mehrschichtiger Gewebe wurde durch die Schwierigkeit behindert, homogene und überlagerte Gewebeschichten zu erzeugen.
Die Hauptneuheit dieser Arbeit ist im Vergleich zu früheren Geräten22,43die Entwicklung einer Methode zur Erzeugung eines undifferenzierten und vereinfachten Hautkonstrukts mittels Mikrofluidik. Darüber hinaus ist eine weitere wichtige Neuerung in Bezug auf andere veröffentlichte Technologien44 die Entwicklung eines relativ einfachen, kostengünstigen und einfach zu bedienenden Einweg-Chipsystems aus biokompatiblen Vinylplatten, das eine Ad-hoc-Herstellung ermöglicht. Dieses System vermeidet den Einsatz von Siliziumwafern und komplizierte Plasmabindungsverfahren, die mit PDMS25erforderlich sind. Chips, die auf diesem Material basieren, erfordern die Erzeugung von Wafern, die für jedes andere Chipdesign spezifisch sind, was den Preis des Prototyping-Prozesses erhöht. All dies macht die aktuelle "klassische" Technologie teuer, komplex und nicht sehr flexibel.
Um diese Einschränkungen zu überwinden, präsentieren wir unter Verwendung der Haut als Gewebemodell eine sehr flexible, kostengünstige und robuste mikrofluidische Plattform, die auf Vinylschichten basiert, die durch Mikrobearbeitung hergestellt werden. Wir stellen auch eine neue Methodik vor, die auf dem parallelen Fluss von laminaren Flüssigkeiten basiert und die In-situ-Erzeugung eines doppelschichtigen Hautkonstrukts mit einem unteren Hautkompartiment mit hFBs und einem oberen epidermalen Kompartiment, das aus einer Monoschicht von hKCs besteht, ermöglicht. Der Chip besteht aus zwei Kammern, die durch eine poröse PC-Membran getrennt sind. Der obere Kanal enthält das Hautkonstrukt und lässt Freiraum, um in Zukunft eine hKC-Differenzierung und -Schichtung und/oder eine Durchblutung von Kulturmedium, Luft oder sogar Medikamenten zu ermöglichen. Die untere Kammer wird kontinuierlich mit Kulturmedium durchblutet, um das Zellwachstum zu fördern. Die Verwendung einer porösen Membran kann zum Verlust eines Teils des Vorgels von der oberen in die untere Kammer führen, wenn sie aufgrund der Pumpkraft hohem Druck ausgesetzt wird. Die Einführung eines PBS-Durchflusses in der unteren Kammer gleicht diese Druckdifferenz aus und vermeidet diese Leckage.
Die Verteilung von hKCs auf der Hydrogeloberfläche ist ein wichtiger Aspekt bei der Erstellung eines Hautmodells. Wenn sie nicht homogen verteilt sind, könnte die Erzeugung einer gleichmäßigen Monoschicht und damit die epidermale Differenzierung behindert werden. Auf die gleiche Weise müssen hFBs innerhalb des Hydrogels gleichmäßig verteilt sein, um ihrem natürlichen Ort zu ähneln, an dem sie in echter Haut gefunden werden. Um Zellsedimentation oder Schlauchverstopfung zu vermeiden, muss die Hydrogelzusammensetzung (insbesondere die Thrombinkonzentration) sorgfältig untersucht werden, um die Gelierungszeiten und das Scherverdünnungsverhalten zu kontrollieren.
Trotz dieser ermutigenden Ergebnisse sind zukünftige Arbeiten erforderlich, um die langfristige Funktionsweise des Systems nachzuweisen, das notwendig ist, um die korrekte Proliferation und Differenzierung der hKC-Monoschicht zu fördern, um eine gut differenzierte menschliche Haut einschließlich eines Stratum corneum zu bilden. Neben der Haut würde dieses System die Erzeugung anderer komplexer, vielschichtiger Gewebekonstrukte ermöglichen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Wir danken Dr. Javier Rodríguez, Dr. María Luisa López, Carlos Matellán und Juan Francisco Rodríguez herzlich für sehr hilfreiche Anregungen, Diskussionen und/oder vorläufige Daten. Wir danken auch den Beiträgen von Sergio Férnandez, Pedro Herreros und Lara Stolzenburg zu diesem Projekt. Besonderer Dank geht an Dr. Marta García für GFP-gekennzeichnete hFBs und hKCs. Schließlich würdigen wir die hervorragende technische Unterstützung von Guillermo Vizcaíno und Angélica Corral. Diese Arbeit wurde unterstützt durch das "Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid", Projekt S2018/BAA-4480, Biopieltec-CM. Diese Arbeit wurde auch durch das "Programa de excelencia", Projekt EPUC3M03, CAM, unterstützt. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Materialien
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Referenzen
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387(2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress. , Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016).
- Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015. , Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018).
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526(2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43(2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471(2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898(2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006(2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535(2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten