Method Article
Кокультура стволовых клеток глиобластомы на узорчатых нейронах для изучения миграции и клеточных взаимодействий
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем простой в использовании анализ кокультуры для анализа миграции глиобластомы (GBM) на паттерновых нейронах. Мы разработали макрос в программном обеспечении FiJi для легкой количественной оценки миграции клеток GBM на нейронах и заметили, что нейроны модифицируют инвазивную емкость клеток GBM.
Аннотация
Глиобластомы (GBM), злокачественные глиомы IV степени, являются одним из самых смертоносных видов рака человека из-за их агрессивных характеристик. Несмотря на значительные успехи в генетике этих опухолей, то, как клетки GBM вторгаются в здоровую паренхиму мозга, не совсем понятно. В частности, было показано, что ячейки GBM вторгаются в перитуморальное пространство различными путями; основной интерес данной статьи представляет маршрут по трактам белого вещества (WMP). Взаимодействие опухолевых клеток с компонентами перитуморальных нервных клеток характеризуется недостаточно хорошо. Здесь описан способ, оцениваемый влияние нейронов на инвазию клеток GBM. В этой статье представлен передовой анализ кокультуры in vitro, который имитирует инвазию WMT путем анализа миграции стволовых клеток GBM на нейронах. Поведение клеток GBM в присутствии нейронов контролируется с помощью автоматизированной процедуры отслеживания с открытым исходным кодом и программным обеспечением свободного доступа. Этот метод полезен для многих применений, в частности, для функциональных и механистических исследований, а также для анализа эффектов фармакологических агентов, которые могут блокировать миграцию клеток GBM на нейроны.
Введение
Первичные злокачественные глиомы, включая GBM, являются разрушительными опухолями со средней выживаемостью от 12 до 15 месяцев, зарегистрированной для пациентов с GBM. Современная терапия опирается на резекцию большой опухолевой массы и химиотерапию в сочетании с лучевой терапией, которая только продлевает выживаемость на несколько месяцев. Терапевтические неудачи тесно связаны с плохой доставкой лекарств через гематоэнцефалический барьер (ГЭБ) и инвазивным ростом в периваскулярных пространствах, мозговых оболочках и вдоль ВМТ1. Периваскулярная инвазия, также называемая сосудистым коовитацией, является хорошо изученным процессом, и молекулярные механизмы начинают выясняться; однако процесс инвазии клеток GBM вдоль WMT не совсем понятен. Опухолевые клетки мигрируют в здоровый мозг вдоль вторичных структур Шерера2. Действительно, почти столетие назад Ханс-Йоахим Шерер описал инвазивные пути ГБМ, которые теперь называют перинейрональным сателлитозом, периваскулярным сателлитозом, субпиальным распространением и инвазией вдоль WMT(рисунок 1A).
Некоторые хемокины и их рецепторы, такие как стромальный клеточный фактор-1α (SDF1α) и хемокиновый рецептор C-X-C (CXCR4), но не сосудистый эндотелиальный фактор роста (VEGF), по-видимому, причастны к инвазии WMT3. Совсем недавно было показано, что трансклеточная ось NOTCH1-SOX2 является важным путем при вторжении WMT в клетки GBM4. Авторы описали, как стволовые клетки GBM вторгаются в паренхиму мозга на частично немиелинированных нейронах, предполагая разрушение миелиновых оборок клетками GBM. Веха была достигнута в 2019 году, когда в журнале Nature были опубликованы три статьи, подчеркивающие роль электрической активности в развитии глиомы5,6. Основополагающая работа Монье и его коллег пролила свет на центральную роль электрической активности в секреции нейролигина-3, который способствует развитию глиомы.
Винклер и его коллеги описали связи между клетками GBM (микротрубками), которые имеют решающее значение на инвазивных этапах, а в последнее время взаимодействия между клетками GBM и нейронами через недавно описанные синапсы нейроглиомы. Эти структуры способствуют глутаматергической стимуляции рецепторов α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA), расположенных на клеточной мембране GBM, что способствует развитию опухоли и инвазии. Инвазия опухолевых клеток является центральным процессом в распространении метастазов или отдаленных вторичных очагов, как это наблюдается у пациентов с ГБМ. Было идентифицировано несколько факторов, имеющих важное значение при инвазии GBM, таких как тромбоспондин-1, трансформирующий фактор роста бета (TGFβ-регулируемый матрицеллюлярный белок или хемокина-рецептор CXCR3)7,8.
Здесь описана упрощенная биомиметическая модель для изучения инвазии GBM, в которой нейроны узорчатся на следах ламинина, а клетки GBM засеиваются на нее, как одиночные клетки или как сфероиды(рисунок 1B). Две экспериментальные установки направлены на повторение инвазии на нейроны, которая наблюдается в GBM9,10,11. Такие модели были разработаны в прошлом в виде выровненных биоматериалов из нановолокна (электроспининг ядра-оболочки), которые позволяют изучать миграцию клеток путем модуляции механических или химических свойств12. Модель кокультуры, описанная в этой статье, позволяет лучше понять, как клетки GBM убегают на нейроны, определяя новые молекулярные пути, участвующие в этом процессе.
протокол
Информированное письменное согласие было получено от всех пациентов (из больницы Хаукеланд, Берген, Норвегия, в соответствии с правилами местного комитета по этике). Этот протокол следует руководящим принципам комитетов по этике исследований человека и животных Университета Бордо. Беременных крыс размещали и лечили в животноводском учреждении Университета Бордо. Эвтаназия беременной крысы, временной E18, проводилась с использованием CO2. Все процедуры для животных были выполнены в соответствии с институциональными руководящими принципами и одобрены местным комитетом по этике. Все коммерческие продукты указаны в Таблице материалов.
1. Подготовка узорчатых слайдов
- Подготовка субстрата для микроструктурирования
- Обрабатывать 18 мм круглыми стеклянными крышками воздушно-плазменной активацией в течение 5 мин. Поместите крышки в закрытую камеру со 100 мкл (3-аминопропил)триэтоксисилана в адсорбаторе на 1 ч.
- Инкубат со 100 мг/мл поли (этиленгликоля)-сукцинимидилалерата (молекулярная масса 5000 (Peg-SVA)) в карбонатном буфере 10 мМ, рН > 8, в течение 1 ч. Тщательно промойте сверхчистой водой и высушите под химическим капотом.
ПРИМЕЧАНИЕ: На этом этапе образец можно хранить при 4 °C в темноте для дальнейшего использования. - Добавьте фотоинициатор, 4-бензоилбензил-триметиламмонийхлорид (PLPP), по 14,7 мг/мл в фосфатно-буферном физиологическом растворе (PBS).
ПРИМЕЧАНИЕ: Также может быть использована концентрированная форма PLPP, гель PLPP. Это приводит к более короткому ультрафиолетовому (УФ) освещению, необходимому для деградации щетки PEG (100 мДж /мм2).
- Осаждение фотоинициаторного геля
- Приготовьте смесь из 3 мкл геля PLPP и 50 мкл абсолютного этанола для осаждения в центре слайда. Поместите образец под химический капот до полного испарения абсолютного этанола.
ПРИМЕЧАНИЕ: На этом этапе образец можно хранить при 4 °C в темноте для дальнейшего использования.
- Приготовьте смесь из 3 мкл геля PLPP и 50 мкл абсолютного этанола для осаждения в центре слайда. Поместите образец под химический капот до полного испарения абсолютного этанола.
- Микроструктурирование стеклянных слайдов
- Установите крышку в камеру Ludin и поместите ее на моторизованную ступень микроскопа, оснащенного системой автофокусировки.
- Загрузите в программное обеспечение изображения, соответствующие предполагаемым микропаттернам. Применяют следующие параметры: репликация 4 х 4 раза, интервал 200 мкм, УФ-доза1000 мДж/мм2. После автоматической последовательности УФ-освещения смойте PLPP несколькими промывками PBS.
ПРИМЕЧАНИЕ: Если использовался гель PLPP, удалите его путем обширных промывок деионизированной водой, высушите в потокеN2и храните при 4 °C. - Инкубировать с ламинином (50 мкг/мл в PBS) в течение 30 мин. Тщательно мойте с помощью PBS.
ПРИМЕЧАНИЕ: Флуоресцентный раствор очищенного зеленого флуоресцентного белка (GFP, 10 мкг/мл в PBS) можно смешивать с ламинином для визуализации микроструктур с помощью флуоресцентной микроскопии.
2. Подготовка нейронов и клеток GBM к кокультуре
- Культура эмбриональных нейронов гиппокампа крыс
- Рассектать гиппокамп эмбриональных (E18) крыс и перенести ткань в сбалансированный раствор соли Хэнка (HBSS) / 1 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES) / пенициллин-стрептомицин раствор в пробирке 15 мл. Удалить излишки раствора, не пересушивая гиппокамп.
- Добавьте 5 мл трипсин-этилендиаминтетрауксусной кислоты (ЭДТА) в дополнение к пенициллину (10 000 единиц/мл)/стрептомицину (10 000 мкг/мл) и 1 мМ HEPES, и инкубировать в течение 15 мин при 37 °C. Промыть 2 раза раствором HBSS/HEPES/пенициллин-стрептомицина и дать тканям остаться в этом растворе в течение 2-3 мин.
- Диссоциируйте ткань с помощью двух огнеполированных пипеток Пастера, пипетируя вверх и вниз 10x с каждой тканью, заботясь о том, чтобы свести к минимуму пенообразование. Подсчитайте клетки и оцените жизнеспособность клеточной суспензии. Разложить нейроны на микроструктурированных покровных листах, как указано ниже.
ПРИМЕЧАНИЕ: Скорость жизнеспособности клеток составляет 85-90% после экстракции.
- Клеточная культура для нейронов на микроструктурированных покровных листах
- Регидратировать микроструктурированные стеклянные слайды с PBS и инкубировать полную среду культивирования нейрональных клеток.
- Засейте нейроны гиппокампа, полученные от крыс E18 Sprague-Dawley, непосредственно над микроструктурированным стеклянным покровом с плотностью 50 000 клеток насм2 в нейробазальной среде (NBM), обогащенной 3% конской сывороткой. Поместите микроструктурированные нейроны в инкубатор (37 °C, 5% CO2)на 48 ч.
ПРИМЕЧАНИЕ: Через ~ 6 ч можно увидеть первичные нейроны гиппокампа, прилипшие к микроструктурам ламинина.
- Кокультура стволовых клеток GBM человека на нейронах
ПРИМЕЧАНИЕ: Для этого исследования мембранные GFP-положительные и ядерные томатные клетки GBM, полученные из пациента, были выращены в соответствии с предыдущими опубликованными протоколами10.- По мере роста сфероидных клеток в суспензии центрифугируют суспензию в течение 5 мин при 200 × г. Промыть сфероиды 5 мл PBS и инкубировать клетки с 0,5 мл реагента диссоциации клеток (см. Таблицу материалов)в течение 5 мин при 37 °C.
- Добавьте 4,5 мл полного НБМ (дополненного добавкой B27, гепарином, фактором роста фибробластов 2, пенициллином и стрептомицином, как описаноранее 8)и подсчитайте клетки с помощью метода автоматического подсчета.
- Посейте 1000 клеток GBM над микроструктурированной нейронной культурой в NBM, обогащенной 3% конской сывороткой. Инкубировать пластину при 37 °C, 5% CO2и влажности 95%.
3. Визуализация живых клеток
- Сразу после посева клеток GBM поместите образец на ступень инвертированного микроскопа, оснащенного термостатной камерой. Выполняйте визуализацию живых клеток на микроскопе, оснащенном моторизованной сценой для записи нескольких позиций, используя многомерный набор инструментов для приобретений в программном обеспечении. Получайте изображения яркого поля и эпифлуоресценции GFP/Tomato каждые 5 минут в течение 12 ч с 20-кратным объективом в температурной (37 °C) и газоконтролируемой (5% CO2)среде.
4. Анализ изображений
ПРИМЕЧАНИЕ: Используя Фиджи, двумерный (2D) стек изображений был полуавтомально предварительно обработан или обработан с помощью самодельного и удобного инструмента (доступен по этому адресу: https://github.com/Guyon-J/Coculture_Gliomas-Neurons/blob/main/README.md), который написан на макроязыке IJ1(рисунок 2A). Автоматизированный рабочий процесс и процедуры обобщены на рисунке 2B.
- Анализ нейронных сетей(рисунок 2Bi)
- Выберите одно изображение стека. Щелкните правой кнопкой мыши инструмент «Сеть», чтобы открыть соответствующее диалоговое окно «Параметры» и настроить параметры (например, Threshold = Triangle, Li, Huang..., Gaussian Blurи Median filters = 1, 2, 3...) для получения точной сегментации изображений. Затем нажмите OK.
- Щелкните левой кнопкой мыши инструмент «Сеть», чтобы автоматически активировать следующую процедуру.
- Дублируйте выбранное изображение и разделите его на три цветовых канала (красный-серый-зеленый).
- Выберите серый канал (brightfield) и выполните функцию усиления контрастного растяжения (CSE), чтобы улучшить разделение между различными областями. Используйте краевой детектор Собеля (SED) для выполнения операции свертки обработки 2D-сигнала, уже сгруппированной под командой Find Edge.
- Для двойной фильтрации (F) примените размытие Гаусса и медианный фильтр для уменьшения шума и сглаживания сигнала объекта. Преобразование в маску (CM) путем выполнения адаптированных пороговых алгоритмов для получения двоичного изображения (BIN-серый) с черными пикселями (область ячейки) и белыми пикселями (фон). Скелетонизировать (Sk) область ячейки в простую сеть (NET) и фильтровать частицы (EP) в образе NET, удаляя мелкие, не сетевые частицы.
- Для красного и зеленого каналов (ядра и мембраны) выполните двойную фильтрацию, преобразуйте в Маску с помощью адаптированного метода порогового значения и позвольте BIN-зеленому определять морфологию клеток с помощью команды Analyze Particles.
- Объедините все каналы, используя интересующий их регион (ROI), с оператором OR (combine) и перенастройте их исходный цвет в простое RGB-изображение.
- Анализ подвижности одной клетки(Рисунок 2Bii)
- Щелкните правой кнопкой мыши инструмент «Отслеживание одиночных ячеек», чтобы открыть соответствующее диалоговое окно «Параметры», и отрегулируйте параметры (например, Тип следа = Ядро или мембрана, Порог = Треугольник, Ли, Хуан..., Проекция Z = Максимальная интенсивность, Сумма срезов ..., Размытие Гаусса и Медианные фильтры = 1, 2, 3 ...), чтобы получить точную сегментацию изображений. Затем нажмите OK.
- Щелкните левой кнопкой мыши инструмент отслеживания одиночных ячеек, чтобы автоматически активировать следующую процедуру.
- Удалите серый канал. Примените Z-проекцию к стеку, которая сгенерирует изображение, соответствующее стеку изображений в соответствии со временем (T-стек). Дважды отфильтруйте и преобразуйте в Маску следы, оставленные ячейками. Удалите мелкие частицы в BIN-красное/зеленое изображение.
- Используя окупаемости инвестиций, выделите каждый контур трассировки ячейки и установите флажок Пропустить обнаружение края в диалоговом окне Параметры, чтобы пропустить этот шаг предварительной обработки для последующих шагов.
- Изолируйте красный канал(Тип trail = Nucleus) на исходном стеке. Выберите один ROI и удалите внешнюю область. Дважды отфильтруйте все изображения и преобразуйте в Mask (BIN-красный). Определите положение центроида X/Y каждого бинаризированного ядра.
- Используя уже опубликованный макрос для программного обеспечения для электронных таблиц13,рассчитайте среднее смещение квадрата, коэффициент направленности и среднюю скорость для этой ячейки.
- Анализ отслеживания нескольких клеток(рисунок 2Biii)
- Щелкните правой кнопкой мыши инструмент отслеживания, чтобы открыть соответствующее диалоговое окно «Параметры» и настроить параметры (например, Threshold = Triangle, Li, Huang..., Gaussian Blur и Median фильтры = 1, 2, 3...) для получения точной сегментации изображений. Затем нажмите OK.
- Щелкните левой кнопкой мыши инструмент отслеживания, чтобы автоматически активировать следующую процедуру.
- Удалите серый канал.
- Разделите красный и зеленый каналы, дважды отфильтруйтеи преобразуйте в маску.
- Объедините каналы с помощью калькулятора изображений... с оператором AND, оставляя только сигнал ядра, найденный в мембранах.
ПРИМЕЧАНИЕ: Несколько плагинов на Фиджи могут быть использованы для определения положения X / Y нескольких ячеек в этом двоичном предварительно обработанном изображении одновременно (см. Таблицу материалов).
- Используя ранее описанныймакрос 13,рассчитайте график траектории, среднее квадратное смещение, коэффициент направленности и среднюю скорость для этих ячеек.
- Миграция сфероидов на нейронном мате(рисунок 2Biv)
- Щелкните правой кнопкой мыши инструмент Миграция, чтобы открыть соответствующее диалоговое окно «Параметры» и настроить параметры (например, Threshold = Triangle, Li, Huang..., Gaussian Blur и Median фильтры = 1, 2, 3...) для получения точной сегментации изображений. Затем нажмите OK.
- Щелкните левой кнопкой мыши средство миграции, чтобы автоматически активировать следующую процедуру.
- Удалите красный канал.
- Разделите зеленый и серый каналы.
- Для серого канала вручную нарисуйте контур нейронного мата и измерьте его площадь.
- Для зеленого канала дважды отфильтруйте стек и преобразуйте в Mask. Удалите область за пределами шаблона (BIN) и определите бинаризированную область ячейки для каждого изображения.
ПРИМЕЧАНИЕ: Параметры, описанные выше, калибруются путем изменения их значений путем щелчка левой кнопкой мыши по интересующему значку. Эта обработка может быть выполнена вручную. Однако для большого количества изображений (примерно сотня на получение), каналов (обычно 3 канала) и этапов обработки автоматизированный или полуавтоматический инструмент был бы предпочтительнее.
Результаты
Узорчатые нейроны, культивируемые совместно с флуоресцентными клетками GBM, были подготовлены, как описано в разделе протокола, и были проведены эксперименты по отслеживанию. Клетки GBM быстро модифицировали свою форму во время миграции на нейронах(Рисунок 1B:панель 6 и Video 1). Клетки мигрировали вдоль расширений нейронов, в случайном движении(Видео 1). Флуоресцентные клетки GBM и нефлуоресцентные нейроны можно легко отличить, и это позволило отслеживать движения клеток с помощью макроса Fiji, как описано в разделе протокола(рисунок 2). Fiji - это программное обеспечение с открытой лицензией, которое облегчает обработку и анализ изображений. Ручные процедуры, которые относительно трудоемки для анализа многочисленных изображений, могут быть автоматизированы в макросе. Изображения импортируются с помощью процедуры перетаскивания, обрабатываются и количественно оцениваются, генерируя данные, доступные с помощью менеджера ROI.
При депонировании в папке Fiji.app | макросов | наборов инструментов инструмент Gliomas-Neurons был доступен в меню More Tools и отображал несколько значков(рисунок 2A). Рабочий процесс обработки изображения, полученный нажатием на иконки, проиллюстрирован на рисунке 2B (i-iv). Форма клетки может быть проанализирована по нейронной сети(рисунок 2B,i). Несколько параметров из отслеживания ячеек могут быть получены для одной(Рисунок 2B,ii)или нескольких ячеек(Рисунок 2B,iii)с помощью двух различных процессов изображения. Скорость восстановления сфероидными КЛЕТКАМИ GBM на нейронах также может быть проанализирована(рисунок 2B,iv). Клетки, посеянные на нейроны, демонстрировали вытянутую форму с множественными выступами, следующими за нейронными трактами(рисунок 3A,i),но имели круглую форму при культивировании непосредственно на ламинине(Рисунок 3A,ii). Клетки, культивируемые на нейронах, эффективно модифицировали свою форму, хотя они не были вытянуты при культивировании на ламинине(рисунок 3A,iii-v). Тонкие выступы, иногда связывающие две клетки, были замечены в клетках, культивированных совместно с нейронами на более поздних стадиях(Видео 1).
Миграционная способность клеток GBM, посеянных на нейронах, сравнивалась с клетками, непосредственно посеянными на ламинин. Клетки, посеянные на нейронах, имели большую миграционную способность, чем только на ламинин(рисунок 3B,i,ii). Случайное движение клеток P3 было обнаружено в обоих условиях, с большим расстоянием для клеток P3 на нейронах, как показано на графике траектории(рисунок 3B,i,ii). Подвижность клетки количественно оценивали по среднему квадратичному смещению (MSD), а ее логарифмическое представление снабжено линейной функцией14 (рисунок 3B,iii). Направленность и средняя скорость также были рассчитаны для обоих условий(рисунок 3B,iv,v). Клеточная миграция сфероидов P3 также сопровождалась обнаружением флуоресцентной области с течением времени на нейронах и сравнивалась с миграцией только на ламинине(рисунок 3C,i,ii и Video 2). Половина рисунка с нейронами была покрыта клетками GBM через 500 мин в линейном профиле; однако сфероиды не придерживались ламининового рисунка(рисунок 3D,iii и видео 2).
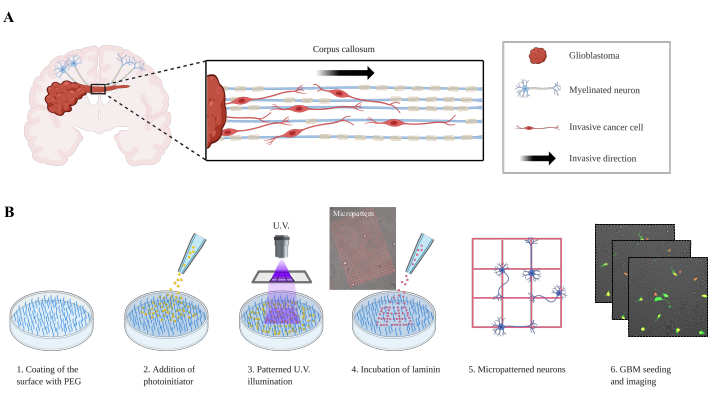
Рисунок 1:Экспериментальная установка клеток глиобластомы, мигрирующих по узорчатым нейронам. (A)Представление клеток глиобластомы, вторгающихся в контралатеральное полушарие через мозолистое тело. (B) Экспериментальная установка. На этапе 1 поверхность пластины покрывается противообрастающим слоем ПЭГ. Фотоинициатор добавляют на этапе 2, покрывая все покрытие. На этапе 3 УФ-широкоугольное изображение проецируется через объектив микроскопа, который локально активирует молекулы фотоинициатора. Активированный фотоинициатор локально расщепляет молекулы ПЭГ и позволяет последующую адсорбцию ламинина. На этапе 5 нейроны засеиваются и прилипают к массивам ламининов. Клетки P3 (GFP / Tomatonuclear)глиобластомы затем осаживаются на нейронном паттерне, и получаются изображения (шаг 6). Сокращения: ПЭГ = полиэтиленгликоль; УФ = ультрафиолет; GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Рабочий процесс представления и анализа инструментов Фиджи. (A) Инструмент под названием Gliomas-Neurons доступен в меню «Дополнительные инструменты», когда макрос добавляется в папку Fiji.app | макросы | наборы инструментов (левая панель). Он состоит из нескольких инструментов действий, описанных ниже (правая панель). (B) i. Сетевой инструмент: обработка изображений, которая используется для рисования нейронной сети и клеток глиомы в упрощенном представлении. ii. Инструмент отслеживания одной ячейки: обработка изображений, которая используется для рисования и выбора области движения клеток для анализа смещения одиночных ячеек. iii. Инструмент отслеживания: шаги предварительной обработки изображений для использования предустановленных плагинов отслеживания Фиджи. iv. Инструмент относительной миграции: обработка изображений, которая используется для определения относительной миграции ячеек по выбранному вручную шаблону. Некоторые параметры можно откалибровать левой кнопкой мыши по кнопке инструмента. Сокращения: CSE = усиление контрастного растяжения; SED = детектор краев Sobel; F = двойная фильтрация; CM = Конвертировать в маску; Sk = Скелетонизация; EP = Устранение частиц; OR (combine) = оператор Союза по выбранным ROI; AND = оператор соединения для выбранных ROI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
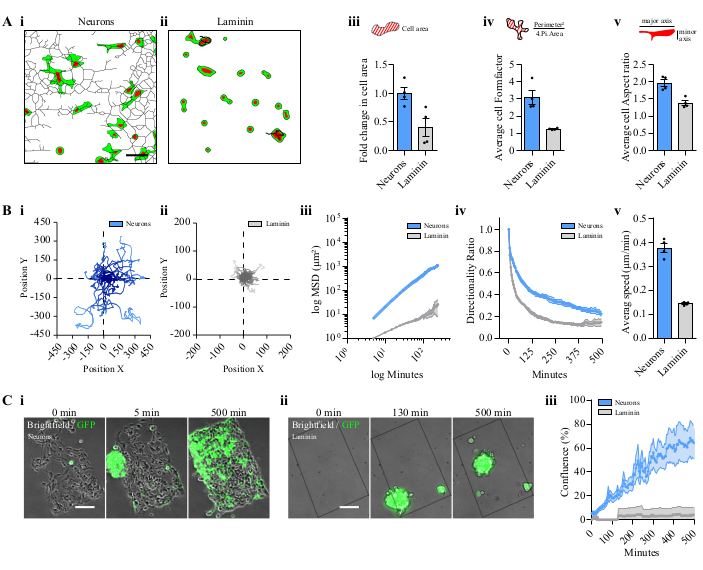
Рисунок 3:Сравнение P3-клеток или сфероидов на узорчатых нейронах и ламининовом покрытии. (A) Дескрипторы формы диссоциированных P3 GFP / томатныхядерных клеток на нейронах или на ламинине. Пример обработанных сетей P3 ячеек на i. паттерновые нейроны или на ii. ламининовое покрытие. Шкала бара = 50 мкм. iii. Средняя площадь клеток на узорчатых нейронах или на ламинине. iv. Формфактор - это отношение окружности к площади, нормализованной к окружности, обеспечивающее параметры по удлинению ячейки и ветвлению ячейки. против. Соотношение сторон — это отношение большой оси к малой оси ячейки. В iii, ivи v, 15 клеток были проанализированы на поле; 4 независимых паттерна; данные представлены в виде среднего ± S.E.M. (B) Отслеживание анализа диссоциированных клеток P3. Один репрезентативный график построения клеток на(i)узорчатых нейронах и(ii)на ламининовом покрытии. iii. MSD клеток P3, мигрирующих на нейронах или на ламининовом покрытии. Значения X/Y приведены в логарифмических масштабах. iv. Коэффициент направленности. против. Средняя скорость миграции ячеек. В iii, ivи v, 15 клеток были проанализированы на поле; 4 независимых паттерна; данные представлены в виде среднего ± S.E.M. (C) Миграционный анализ сфероидов P3 GFP. Репрезентативные изображения в разных временных точках сфероидов P3 на(i)узорчатых нейронах или на(ii)ламининовом покрытии. Шкала бар = 100 мкм. iii. Сфероидная миграция, представленная слиянием паттернов; 4 независимых паттерна; данные представлены в виде среднего ± S.E.M. Сокращения: GFP = зеленый флуоресцентный белок; S.E.M = стандартная погрешность среднего значения; MSD = Среднее квадратное смещение. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: P3-клетки на нейронах или ламинине записываются в течение 8 ч (визуазируются каждые 5 мин). На видео показана миграция P3 на одноклеточные нейроны (слева) и на ламининовое покрытие (справа). Клетки экспрессировали зеленый флуоресцентный белок (GFP, зеленый цвет) и ядерный томат (красный цвет). Bar = 50 мкм. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: Сфероиды P3 на нейронах или ламинине записываются в течение 8 ч (снимаемые каждые 5 мин). На видео показана миграция сфероидов P3 на нейроны (слева) и на ламининовом покрытии (справа). Клетки экспрессировали зеленый флуоресцентный белок (GFP, зеленый цвет). Bar = 100 мкм. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Глиобластомы широко вторгаются в паренхиму, используя различные режимы: коопалита окружающих кровеносных сосудов, интерстициальная инвазия или инвазия на WMT18. Этот последний способ не очень хорошо охарактеризован в литературе из-за трудности поиска подходящих моделей in vitro или in vivo, связанных с вторжением WMT. Здесь была предложена упрощенная модель, в которой культивируемые нейроны грызунов были завезены на поверхностях, покрытых ламинином, а флуоресцентные стволовые клетки GBM были посеяны поверх нейронов. В этом исследовании использовался сетчатый рисунок для улучшения анализа прикрепления опухолевых клеток, инвазии и пролиферации. Клетки GBM мигрировали более эффективно поверх нейронов, чем непосредственно на матрицу, которая была ламинином в этих экспериментах. Форма ячейки изменялась на протяжении всего процесса записи, и площадь поверхности ячейки увеличивалась одновременно. Стволовые клетки GBM, вероятно, будут притягиваться нейронными трактами посредством активации специфических сигнальных путей (т.е. NOTCH2/SOX2)4 или секретируемых факторов и сигналов от самих нейронов. Эта система хорошо подходит для анализа молекулярных обменов между клетками GBM и нейронами, которые могут включать метаболиты, нейротрансмиттеры или цитокины.
Недавно Венкатеш и его коллеги описали образование синапса нейроглиомы, в котором глутамат активирует свой рецептор AMPAR6. Участвуют ли подобные процессы во время WMT-инвазии клеток GBM? Это может быть исследовано с помощью этой экспериментальной системы с использованием фармакологического ингибирования или генетических подходов.
Следует отметить следующие критические моменты. Во-первых, во время этапов ПЕГилирования подложке не следует дать высохнуть, чтобы избежать влияния на целостность антиадгезивного покрытия. Следует отметить, что можно тщательно промыть раствор ПЭГ-СВА сверхчистой водой и высушить его под струей азота перед хранением при 4 °C в темноте. Во-вторых, макрос, разработанный для анализа миграции клеток GBM на нейронах, находится в режиме открытого доступа и совместим с программным обеспечением FiJi. Хотя этот макрос и его обновления доступны на GitHub, он требует соответствующей калибровки для обнаружения ячеек. Следовательно, может быть полезно проверить образцы вручную в качестве контроля качества при запуске анализа. Гибкость системы, используемой здесь, позволяет использовать различные формы паттерна, с параллельными линиями, разделяющими нейроны в разной степени. При таком подходе можно имитировать форму нескольких церебральных структур, как это наблюдается в мозолистом теле — самой большой структуре белого вещества в мозге человека , где в основном наблюдается вторжение WMT. Альтернативно, было показано, что тот же проекционный аппарат УФ-света структурирует чувствительные к УФ-излучению неадгезивные гидрогели z-контролируемым способом15,что позволяет стандартизировать образование сфероидов.
В этом контексте 3D-нейросферы могут быть сгенерированы для тестирования вторжения GBM. Этот метод также может быть применен для паттернинга других мозговых клеток, таких как эндотелиальные клетки мозга, для воспроизведения сосудовидной формы или имитации микроглиальной или других иммунных клеток. Таким образом, синергетические или ингибирующие эффекты церебральных клеток могут наблюдаться при совместной культивировании с клетками GBM. Одним из ограничений этого исследования является использование эмбриональных нейронов крыс в совместной культуре с клетками GBM человека, которые могут не имитировать истинные физиологические условия. Одним из способов преодоления этого недостатка было бы использование индуцированных человеком плюрипотентных нейронов, полученных из стволовых клеток, чтобы избежать перекрестной реактивности видов16. Однако клетки GBM быстро прилипают и эффективно мигрируют на нейронах крыс, как показано в этих экспериментах. Также было продемонстрировано, что церебральные клетки крыс (шванновские клетки) могут быть эффективно культивированы совместно с нейронами человека17. Другие методы включают использование 3D-нановолокна, которые предлагают хорошую модель для изучения миграции клеток глиомы12,но ограничивают контакт клеток с клетками, поскольку нановолокна считаются неживыми структурами.
Кроме того, 2D-культуры являются редукционистскими, упрощают наблюдение за клеточными процессами и могут ограничивать их валидность для контекста in vivo 10. Таким образом, 3D-кокультуры GBM-клеток и нейронов являются лучшими представителями ситуации in vivo. Сложные органоиды мозга, такие как мини-мозг18,были использованы в анализах вторжения конфронтации-культуры19. Основным преимуществом стратегии, описанной в настоящем описании, является воспроизводимость подхода кокультуры, т. е. первичные нейроны геометрически ограничены на микроструктурах, контролируемых размером, и взаимодействие с введенными клетками GBM не может происходить в другом месте. Кроме того, пространственная организация нейронов может быть настроена из-за универсальности системы УФ-проекции, что позволяет проводить дальнейшую оптимизацию. В конечном счете, разработка и валидация таких биомиметических подходов может также помочь в сокращении числа моделей на животных, используемых в биомедицинских исследованиях.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа была поддержана Fondation ARC 2020, Ligue Contre le Cancer (Comite de la Gironde), ARTC, Plan Cancer 2021, INCA PLBIO. Альвеол поддерживается Национальным агентством исследований (Грант Лабекс МОЗГ ANR-10-LABX-43). Йорис Гийон является стипендиатом Университетской больницы Тулузы (CHU Toulouse).
Материалы
| Name | Company | Catalog Number | Comments |
| (3-aminopropyl) triethoxysilane | Sigma | 440140-100ML | The amino group is useful for the bioconjugation of mPEG-SVA |
| 96-well round-bottom plate | Sarstedt | 2582624 | Used to prepare spheroids |
| Accutase | Gibco | A11105-01 | Stored at -20 °C (long-term) or 4 °C (short-term), sphere dissociation enzyme |
| B27 | Gibco | 12587 | Stored at -20 °C, defrost before use |
| Basic Fibroblast Growth Factor | Peprotech | 100-18B | Stored at -20 °C, defrost before use |
| Countess Cell Counting ChamberSlides | Invitrogen | C10283 | Used to cell counting |
| Coverslips | Marienfeld | 111580 | Cell culture substrate |
| Dessicator cartridges | Sigma | Z363456-6EA | Used to reduce mosture during (3-aminopropyl) triethoxysilane treatment |
| DPBS 10x | Pan Biotech | P04-53-500 | Stored at 4 °C |
| Fiji software, MTrack2 macro | ImageJ | Used to analyze pictures | |
| Flask 75 cm² | Falcon | 10497302 | |
| HBSS | Sigma | H8264-500ML | |
| Heparin sodium | Sigma | H3149-100KU | Stored at 4 °C |
| Laminin | 114956-81-9 | Promotes neuronal adhesion | |
| Leonardo software | loading of envisioned micropatterns | ||
| MetaMorph Software | Molecular Devices LLC | NA | Microscopy automation software |
| Methylcellulose | Sigma | M0512 | Diluted in NBM for a 2% final concentration |
| Neurobasal medium | Gibco | 21103-049 | Stored at 4 °C |
| Nikon TiE (S Fluor, 20x/0.75 NA) | inverted microscope equipped with a motorized stage | ||
| Penicillin - Streptomycin | Gibco | 15140-122 | Stored at 4 °C |
| PLPP | Alveole | PLPPclassic_1ml | Photoinitiator used to degrade the PEG brush |
| Poly(ethylene glycol)-Succinimidyl Valerate (mPEG-SVA) | Laysan Bio | VA-PEG-VA-5000-5g | Used as an anti-fouling coating |
| PRIMO | Alveole | PRIMO1 | Digital micromirror device (DMD)-based UV projection apparatus |
| Trypan blue 0.4% | ThermoFisher | T10282 | Used for cell counting |
| Trypsin-EDTA | Sigma | T4049-100ML | Used to detach adherent cells |
Ссылки
- Shergalis, A., Bankhead, A., Luesakul, U., Muangsin, N., Neamati, N. Current challenges and opportunities in treating glioblastoma. Pharmacology Reviews. 70, 412-445 (2018).
- Scherer, H. J. The forms of growth in gliomas and their practical significance. Brain. 63, 1-35 (1940).
- Zagzag, D., et al. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1α/CXCR4 expression in glioblastomas. American Journal of Pathology. 173, 545-560 (2008).
- Wang, J., et al. Invasion of white matter tracts by glioma stem cells is regulated by a NOTCH1-SOX2 positive-feedback loop. Nature Neurosciences. 22, 91-105 (2019).
- Venkataramani, V., et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538 (2019).
- Venkatesh, H. S., et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545 (2019).
- Boyé, K., et al. The role of CXCR3/LRP1 cross-talk in the invasion of primary brain tumors. Nature Communications. 8, 1571(2017).
- Daubon, T., et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development. Nature Communications. 10, 1146(2019).
- Gritsenko, P. G., et al. p120-catenin-dependent collective brain infiltration by glioma cell networks. Nature Cell Biology. 22, 97-107 (2020).
- Guyon, J., et al. A 3D spheroid model for glioblastoma. Journal of Visualized Experiments: JoVE. (158), (2020).
- Strale, P. O., et al. Multiprotein Printing by Light?Induced Molecular Adsorption. Advanced Materials. , (2015).
- Rao, S. S., et al. Mimicking white matter tract topography using core-shell electrospun nanofibers to examine migration of malignant brain tumors. Biomaterials. 34, 5181-5190 (2013).
- Visweshwaran, S. P., Maritzen, T. A simple 3D cellular chemotaxis assay and analysis workflow suitable for a wide range of migrating cells. MethodsX. 6, 2807-2821 (2019).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysics Journal. 60, 910-921 (1991).
- Pasturel, A., Strale, P. -O., Studer, V. Tailoring common hydrogels into 3D cell culture templates. Advance Healthcare Materials. 9, 2000519(2020).
- Dolmetsch, R., Geschwind, D. H. The human brain in a dish: the promise of iPSC-derived neurons. Cell. 145, 831-834 (2011).
- Clark, A. J., et al. Co-cultures with stem cell-derived human sensory neurons reveal regulators of peripheral myelination. Brain. 140, 898-913 (2017).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26, 3203-3211 (2019).
- Han, M., et al. Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling. Brain. 143, 512-530 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены