Method Article
תרבות משותפת של תאים דמויי גזע גליובלסטומה על נוירונים בדוגמת ללמוד הגירה ואינטראקציות הסלולר
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים מבחני תרבות משותפת קלים לשימוש כדי לנתח נדידת גליובלסטומה (GBM) על נוירונים בדוגמת. פיתחנו מאקרו בתוכנת FiJi לכימות קל של נדידת תאי GBM על נוירונים, והבחנו כי נוירונים לשנות קיבולת פולשנית של תא GBM.
Abstract
Glioblastomas (GBMs), כיתה IV גליומות ממאירות, הם אחד הסוגים הקטלניים ביותר של סרטן אנושי בגלל המאפיינים האגרסיביים שלהם. למרות ההתקדמות המשמעותית בגנטיקה של גידולים אלה, איך תאי GBM לפלוש parenchyma המוח בריא אינו מובן היטב. יש לציין כי הוכח כי תאי GBM פולשים לחלל הצמיגים בדרכים שונות; העניין העיקרי של נייר זה הוא המסלול לאורך דרכי חומר לבן (WMTs). האינטראקציות של תאים סרטניים עם רכיבי תאי העצבים הציצוניים אינן מאופיינים היטב. להלן, שיטה תוארה המעריכה את ההשפעה של נוירונים על פלישת תאים GBM. מאמר זה מציג תרבות משותפת מתקדמת במבחנה המחקה פלישת WMT על ידי ניתוח הנדידה של תאים דמויי גזע GBM על נוירונים. ההתנהגות של תאי GBM בנוכחות נוירונים מנוטרת באמצעות הליך מעקב אוטומטי עם תוכנת קוד פתוח וגישה חופשית. שיטה זו שימושית עבור יישומים רבים, בפרט, עבור מחקרים פונקציונליים ומכניסטיים, כמו גם לניתוח ההשפעות של סוכנים תרופתיים שיכולים לחסום נדידת תאים GBM על נוירונים.
Introduction
גליומות ממאירות ראשוניות, כולל GBMs, הן גידולים הרסניים, עם שיעור הישרדות בינוני של 12 עד 15 חודשים שדווחו לחולי GBM. הטיפול הנוכחי מסתמך על כריתה גדולה של מסת הגידול וכימותרפיה בשילוב עם הקרנות, אשר רק מאריך את שיעור ההישרדות בכמה חודשים. כשלים טיפוליים קשורים קשר הדוק לאספקת סמים לקויה על פני מחסום הדם - מוח (BBB) ולצמיחה פולשנית בחללים perivascular, קרום המוח, ולאורך WMTs1. פלישה Perivascular, המכונה גם שיתוף כלי דם אפשרות, הוא תהליך נחקר היטב, ואת המנגנונים המולקולריים מתחילים להיות ברורים; עם זאת, תהליך הפלישה לתא GBM לאורך WMTs אינו מובן היטב. תאים סרטניים נודדים למוח הבריא לאורך המבנים המשניים של שרר2. ואכן, לפני כמעט מאה שנה, הנס-יואכים שרר תיאר את הנתיבים הפולשניים של GBM, שכעת מכונים satellitosis פרינורונלי, satellitosis perivascular, התפשטות תת-צינורית, פלישה לאורך WMT (איור 1A).
כמה כימוקינים הקולטנים שלהם, כגון פקטור-1α (SDF1α) ו C-X-C מוטיב קולטן כימוקין 4 (CXCR4), אבל לא גורם גדילה אנדותל כלי הדם (VEGF), נראה מעורב פלישת WMT3. לאחרונה, ציר NOTCH1-SOX2 transcellular הוכח להיות מסלול חשוב בפלישה WMT של תאים GBM4. המחברים תיארו כיצד תאים דמויי גזע GBM לפלוש parenchyma המוח על נוירונים unmyelinated חלקית, מה שמרמז על הרס של נדן מיאלין על ידי תאים GBM. אבן דרך הושגה בשנת 2019 כאשר שלושה מאמרים פורסמו בכתב העת Nature, והדגישו את תפקידה של הפעילות החשמלית בפיתוח גליומה5,6. עבודה מכוננת של מונג'ה ומשתפי פעולה שופכת אור על התפקיד המרכזי של פעילות חשמלית בהפרשת נוירוליגין-3, המקדמת פיתוח גליומה.
וינקלר ומשתפי פעולה תיארו קשרים בין תאי GBM (microtubes) להיות חיוני בשלבים פולשניים, ולאחרונה, אינטראקציות בין תאים GBM ותאי עצב באמצעות סינפסות נוירוגליומה שתוארו לאחרונה. מבנים אלה מעדיפים גירוי גלוטמטרגי של קולטני α אמינו-3-הידרוקסי-5-מתיל-4-isoxazolepropionic (אמפא) הממוקמים בקרום התא GBM, המקדם התפתחות גידולים ופלישה. פלישת תאים סרטניים היא תהליך מרכזי בהפצת גרורות או מוקדים משניים מרוחקים, כפי שנצפה בחולי GBM. מספר גורמים זוהו להיות חשובים פלישת GBM כגון תרומבוספונדין-1, בטא גורם גדילה טרנספורמציה (חלבון מטריקוולרי מוסדר TGFβ, או קולטן כימוקין CXCR3)7,8.
כאן, מודל ביומימטי פשוט תואר לחקר פלישת GBM, שבו נוירונים מעוצבים על עקבות של למין, ותאי GBM נזרעים עליו, כתאים בודדים או כספרוידים(איור 1B). שתי ההגדרות הניסיוניות נועדו לשחזר את הפלישה לנוירונים, אשר נצפתה ב GBM9,10,11. מודלים כאלה פותחו בעבר כמו ביו-חומרים nanofiber מיושר (electrospinning קליפת ליבה) המאפשרים ללמוד נדידת תאים על ידי אפנון תכונות מכניות או כימיות12. מודל התרבות המשותפת המתואר במאמר זה מאפשר הבנה טובה יותר של האופן שבו תאי GBM בורחים על נוירונים על ידי הגדרת מסלולים מולקולריים חדשים המעורבים בתהליך זה.
Protocol
הסכמה מדעת בכתב התקבלה מכל החולים (מבית החולים האוקלאנד, ברגן, נורווגיה, על פי תקנות ועדת האתיקה המקומית). פרוטוקול זה פועל בהתאם להנחיות ועדות האתיקה של מחקר בני אדם ובעלי חיים באוניברסיטת בורדו. חולדות בהריון שוכנו וטופלו במתקן החיות של אוניברסיטת בורדו. המתת חסד של חולדה בהריון ב-E18 בוצעה באמצעות CO2. כל ההליכים בבעלי חיים נעשו בהתאם להנחיות המוסדיות ואושרו על ידי ועדת האתיקה המקומית. כל המוצרים המסחריים מוזכרים בטבלת החומרים.
1. הכנת השקופיות בדוגמת
- הכנת מצע למיקרופטרנינג
- לטפל 18 מ"מ זכוכית מעגלית coverslips על ידי הפעלת אוויר / פלזמה במשך 5 דקות. מניחים את הכיסויים בתא סגור עם 100 μL של (3-aminopropyl) triethoxysilane ב יבוש במשך 1 שעות.
- דגירה עם 100 מ"ג / מ"ל של פולי (אתילן גליקול)-succinimidyl valerate (משקל מולקולרי 5,000 (פג-SVA)) ב 10 mM מאגר קרבונט, pH > 8, עבור 1 שעות. יש לשטוף באופן נרחב במים אולטרה-דקים, ולייבש מתחת למכסה המנוע הכימי.
הערה: בשלב זה, המדגם יכול להיות מאוחסן ב 4 מעלות צלזיוס בחושך לשימוש נוסף. - הוסף את הפוטויניאטיאט, 4-בנזואילבנזיל-טרימתילמוניום כלוריד (PLPP), ב 14.7 מ"ג / מ"ל מלוחים אגירה פוספט (PBS).
הערה: ניתן להשתמש גם בצורה מרוכזת של PLPP, ג'ל PLPP. התוצאה היא זמן תאורה אולטרה סגול (UV) קצר יותר הנדרש כדי לבזות את מברשת PEG (100 mJ / mm2).
- תצהיר ג'ל פוטוניאטיאטור
- הכן תערובת של 3 μL של ג'ל PLPP ו 50 μL של אתנול מוחלט להפקיד במרכז המגלשה. מניחים את הדגימה מתחת למכסה המנוע הכימי עד לאידוי מלא של האתנול המוחלט.
הערה: בשלב זה, המדגם יכול להיות מאוחסן ב 4 מעלות צלזיוס בחושך לשימוש נוסף.
- הכן תערובת של 3 μL של ג'ל PLPP ו 50 μL של אתנול מוחלט להפקיד במרכז המגלשה. מניחים את הדגימה מתחת למכסה המנוע הכימי עד לאידוי מלא של האתנול המוחלט.
- מיקרו-patterning של שקופית זכוכית
- הר את הכיסוי בתא לודין, והנח אותו על הבמה הממונעת של מיקרוסקופ מצויד במערכת מיקוד אוטומטית.
- טען תמונות המתאימות למיקרופטרנים החזויים לתוכנה. החל פרמטרים אלה: שכפול 4 x 4 פעמים, מרווח של 200 מיקרומטר, מינון UV של 1,000 mJ / mm2. לאחר רצף תאורת UV אוטומטי, לשטוף את PLPP משם עם שטיפת PBS מרובים.
הערה: אם נעשה שימוש בג'ל PLPP, הסר אותו על ידי שטיפות נרחבות עם מים deionized, יבש בזרם של N2, ולאחסן ב 4 מעלות צלזיוס. - דגירה עם למין (50 מיקרוגרם / מ"ל ב PBS) במשך 30 דקות. לשטוף בהרחבה עם PBS.
הערה: פתרון פלואורסצנטי של חלבון פלואורסצנטי ירוק מטוהר (GFP, 10 מיקרוגרם / מ"ל ב- PBS) ניתן לערבב עם למין כדי לדמיין את micropatterns על ידי מיקרוסקופ פלואורסצנטי.
2. הכנת נוירונים ותאי GBM לתרבות משותפת
- תרבות של נוירונים היפוקמפוס עכברוש עוברי
- לנתח את ההיפוקמפוס של חולדות עובריות (E18), ולהעביר את הרקמה לתוך תמיסת מלח מאוזנת של האנק (HBSS)/1 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic חומצה (HEPES)/פניצילין-סטרפטומיצין פתרון בצינור 15 מ"ל. הסר פתרון עודף מבלי לייבש את ההיפוקמפוס.
- הוסף 5 מ"ל של חומצה טטראאצטית טריפסין-אתילנדיאמין (EDTA) בתוספת פניצילין (10,000 יחידות / מ"ל)/ סטרפטומיצין (10,000 מיקרוגרם / מ"ל) ו 1 mM HEPES, ודגרת במשך 15 דקות ב 37 °C (37 °F). לשטוף 2x עם HBSS / HEPES / פניצילין-סטרפטומיצין פתרון, ולתת את הרקמה להישאר בתמיסה זו במשך 2-3 דקות.
- לנתק את הרקמה באמצעות שתי פיפטות פסטר מלוטש להבה, על ידי pipetting למעלה ולמטה 10x עם כל רקמה, דואג למזער קצף. לספור את התאים, ולהעריך את הכדאיות של השעיית התא. צלחת הנוירונים על כיסויים micropatterned כפי שצוין להלן.
הערה: שיעור הכדאיות של התא הוא 85-90% לאחר החילוץ.
- תרבית תאים לנוירונים על עטיפות מיקרו-patterned
- Rehydrate שקופיות זכוכית micropatterned עם PBS, ולהדגיר מדיום תרבית תאים עצביים מלאה.
- זרעו את תאי העצב ההיפוקמפוסיים המתקבלים מעכברושים E18 Sprague-Dawley ישירות מעל כיסויי הזכוכית המיקרו-פטרונית בצפיפות של 50,000 תאים לס"מ2 במדיום נוירובאסלי (NBM) מועשר ב-3% סרום סוסים. מניחים את הנוירונים micropatterned באינקובטור (37 °C (37 °F, 5% CO2) עבור 48 שעות.
הערה: לאחר ~ 6 שעות, נוירונים היפוקמפוס ראשוני ניתן לראות דבק micropatterns למינין.
- תרבות משותפת של תאים דמויי גזע GBM אנושיים על נוירונים
הערה: עבור מחקר זה, ממברנה GFP חיובי ועגבניות גרעיניות נגזר תאים GBM נגזר החולה גדלו על פי פרוטוקולים קודמים שפורסמו10.- כמו תאים בצורת ספרואיד לגדול בהשעיה, צנטריפוגה ההשעיה במשך 5 דקות ב 200 × גרם. לשטוף את spheroids עם 5 מ"ל של PBS, ולהדגיר את התאים עם 0.5 מ"ל של מגיב ניתוק התא (ראה את הטבלה של חומרים)במשך 5 דקות ב 37 °C (69 °F).
- הוסף 4.5 מ"ל של NBM מלא (משלים עם תוספת B27, הפרין, גורם גדילה fibroblast 2, פניצילין, ו סטרפטומיצין, כמתואר קודםלכן 8), ולספור את התאים באמצעות טכניקת ספירה אוטומטית.
- זרעים 1,000 GBM תאים על התרבות העצבית micropatterned ב NBM מועשר 3% סרום סוס. דגירה את הצלחת ב 37 °C (67 °F), 5% CO2, ו 95% לחות.
3. הדמיית תאים חיה
- מיד לאחר זריעת תא GBM, מניחים את המדגם על הבמה של מיקרוסקופ הפוך מצויד בתא תרמוסטט. בצע הדמיה של תאים חיים במיקרוסקופ המצויד בשלב ממונע לרישום עמדות מרובות באמצעות ארגז כלים רב-ממדי לרכישות בתוכנה. לרכוש בהירות ו epifluorescence GFP / עגבניות תמונות כל 5 דקות מעל 12 שעות עם מטרה 20x בטמפרטורה (37 °C (37 °C) וגז מבוקר (5% CO2) הסביבה.
4. ניתוח תמונה
הערה: באמצעות פיג'י, מחסנית תמונות דו-ממדית (2D) עובדה או עובדה באופן חצי אוטומטי באמצעות כלי תוצרת בית וידידותי למשתמש (זמין בכתובת זו: https://github.com/Guyon-J/Coculture_Gliomas-Neurons/blob/main/README.md), הכתוב בשפת המאקרו IJ1 (איור 2A). זרימת העבודה וההליכים האוטומטיים מסוכמים באיור 2B.
- ניתוח רשת עצבית (איור 2Bi)
- בחר תמונה אחת של הערימה. לחץ באמצעות לחצן העכבר הימני על הכלי רשת כדי לפתוח את תיבת הדו-שיח 'אפשרויות' המתאימה ולהתאים את ההגדרות (למשל, סף = משולש, לי, הואנג..., טשטוש גאוסיאניומסננים חציוניים = 1, 2, 3...) כדי ליצור פילוח מדויק של תמונות. לאחר מכן, לחץ על אישור.
- לחץ באמצעות לחצן העכבר הימני על הכלי רשת כדי להפעיל באופן אוטומטי את ההליך הבא.
- שכפלו את התמונה שנבחרה ופיצלו אותה לשלושה ערוצי צבע (אדום-אפור-ירוק).
- בחרו בערוץ האפור (brightfield) ובצעו שיפור מתיחת ניגודיות (CSE) כדי לשפר את ההפרדה בין אזורים שונים. השתמש בגלאי קצה Sobel (SED) כדי לבצע את פעולת התבבולות של עיבוד אותות דו-מימדית שכבר מקובצה תחת הפקודה 'חפש קצה'.
- לסינון כפול (F), החל טשטוש גאוסיאני ומסנן חציוני כדי להפחית רעש ולהחליק את אות האובייקט. המר למסיכה (CM) על-ידי ביצוע אלגוריתמי סף מותאמים כדי להשיג תמונה בינארית (BIN-grey) עם פיקסלים שחורים (אזור תא) ופיקסלים לבנים (רקע). שלד (Sk) אזור התא לרשת פשוטה (NET), וחלקיקי סינון (EP) בתמונת NET על-ידי הסרת חלקיקים קטנים שאינם מרושתים.
- עבור ערוצים אדומים וירוקים (גרעין וממברנה), בצע סינון כפול, המר למסיכה בשיטת הסף המותאמת ואפשר ל- BIN-green לקבוע מורפולוגיה של תאים באמצעות הפקודה נתח חלקיקים.
- מזג את כל הערוצים באמצעות אזור העניין (ROI) שלהם עם האופרטור OR (לשלב), והתאם מחדש את הצבע הראשוני שלהם לתמונת RGB פשוטה.
- ניתוח תנועתיות חד-תאית (איור 2Bii)
- לחץ באמצעות לחצן העכבר הימני על הכלי מעקב אחר תא יחיד כדי לפתוח את תיבת הדו-שיח אפשרויות המתאימות, ולהתאים את ההגדרות (למשל, סוג שביל = גרעין או קרום, סף = משולש, לי, הואנג..., הקרנת Z = עוצמת מרבית, פרוסות סכום..., טשטוש גאוסיאני ומסננים חציוניים = 1, 2, 3...) כדי לייצר פילוח מדויק של תמונות. לאחר מכן, לחץ על אישור.
- לחץ באמצעות לחצן העכבר הימני על הכלי מעקב אחר תא בודד כדי להפעיל באופן אוטומטי את ההליך הבא.
- הסר את הערוץ האפור. החל הקרנת Z על המחסנית, שתיצור תמונה המתאימה לערימת תמונות בהתאם לשעה (מחסנית T). מסננים פעמיים וממירים למסווה את השבילים שהותירו התאים. הסר חלקיקים קטנים לתמונה BIN-אדום/ירוק.
- באמצעות החזר על ההשקעה, בחר כל מיתאר של מעקב התא וסמן את התיבה דלג על זיהוי קצה בתיבת הדו-שיח אפשרויות כדי לדלג על שלב עיבוד מקדים זה עבור השלבים הבאים.
- בודדו את הערוץ האדום(סוג שביל = גרעין) בערימה המקורית. בחר החזר החזר על ההשקעה אחד והסר את האזור החיצוני. סנן פעמיים את כל התמונות והמר למסיכה (BIN-red). קבעו את מיקום ה-X/Y של כל גרעין בינארי.
- באמצעות מאקרו שכבר פורסם עבור תוכנת גיליון אלקטרוני13, חשב את התזוזה הריבועית הממוצעת, את יחס הכיווניות ואת המהירות הממוצעת עבור תא זה.
- ניתוח מעקב אחר תאים מרובים (איור 2Biii)
- לחץ באמצעות לחצן העכבר הימני על הכלי מעקב כדי לפתוח את תיבת הדו-שיח אפשרויות המתאימות ולהתאים את ההגדרות (למשל, סף = משולש, לי, הואנג..., טשטוש גאוסיאני ומסננים חציוני = 1, 2, 3...) כדי לייצר פילוח מדויק של תמונות. לאחר מכן, לחץ על אישור.
- לחץ באמצעות לחצן העכבר הימני על הכלי מעקב כדי להפעיל באופן אוטומטי את ההליך הבא.
- הסר את הערוץ האפור.
- פצל את הערוצים האדומים והירוקים, סנן פעמיים והמר למסיכה.
- מזג את הערוצים באמצעות מחשבון תמונה... עם האופרטור AND, משאיר רק את אות הגרעין שנמצא בקרומים.
הערה: ניתן להשתמש במספר תוספים בפיג'י כדי לקבוע את מיקום ה- X/Y של מספר תאים בתמונה בינארית מעובדת מראש זו בו-זמנית (ראה טבלת החומרים).
- באמצעות מאקרו13שתואר קודם לכן , חשב את התוויית המסלול, ממוצע ההעתקה הריבועית, יחס הכיווניות והמהירות הממוצעת עבור תאים אלה.
- נדידת ספרואידים על המחצלת העצבית (איור 2Biv)
- לחץ באמצעות לחצן העכבר הימני על הכלי העברה כדי לפתוח את תיבת הדו-שיח אפשרויות המתאימות ולהתאים את ההגדרות (למשל, סף = משולש, לי, הואנג..., טשטוש גאוסיאני ומסננים חציוניים = 1, 2, 3...) כדי לייצר פילוח מדויק של תמונות. לאחר מכן, לחץ על אישור.
- לחץ באמצעות לחצן העכבר הימני על הכלי העברה כדי להפעיל באופן אוטומטי את ההליך הבא.
- הסר את הערוץ האדום.
- לפצל את הערוצים הירוקים והאפורים.
- עבור הערוץ האפור, צייר ידנית את קווי המתאר של המחצלת העצבית, ומדוד את האזור שלה.
- לערוץ הירוק, מסננים פעמיים את המחסנית וממירים למסיכה. הסר את האזור שמחוץ לדוגמת המילוי (BIN) וקבע את אזור התא הבינארי עבור כל תמונה.
הערה: הפרמטרים המתוארים לעיל מכוילים על-ידי שינוי הערכים שלהם על-ידי לחיצה שמאלית על סמל העניין. עיבוד זה יכול להיעשות באופן ידני. עם זאת, עבור מספר רב של תמונות (כמאה לכל רכישות), ערוצים (בדרך כלל 3 ערוצים) ושלבי עיבוד, כלי אוטומטי או אוטומטי למחצה יהיה עדיף.
תוצאות
נוירונים בעלי תבנית משותפת עם תאי GBM פלואורסצנטיים הוכנו כמתואר בסעיף הפרוטוקול, ובוצעו ניסויי מעקב. תאי GBM שינו במהירות את צורתם תוך כדי הגירה לנוירונים (איור 1B: לוח 6 ווידאו 1). תאים היגרו לאורך ההרחבות העצביות, בתנועה אקראית (וידאו 1). ניתן להבחין בקלות בין תאי GBM פלואורסצנטיים לבין תאי עצב שאינם פלואורסצנטיים, והדבר איפשר מעקב אחר תנועות תאים באמצעות המאקרו של פיג'י, כמתואר בסעיף הפרוטוקול (איור 2). פיג'י היא תוכנת רישיון פתוח המאפשר עיבוד וניתוח תמונה. ניתן להפוך פרוצדורות ידניות שגוזלות זמן רב יחסית לניתוח של תמונות רבות לאוטומטיות במאקרו. תמונות מיובאות על-ידי שגרת גרירה ושחרור, מעובדות וכומתות, ויוצרות נתונים הזמינים באמצעות מנהל החזר ההשקעה.
בעת הפקדה בתיקיית ערכות הכלים | פקודות מאקרו Fiji.app |, הכלי Gliomas-Neurons היה זמין בתפריט 'כלים נוספים' והציג מספר סמלים (איור 2A). זרימת עבודה של עיבוד התמונה, המתקבלת על ידי לחיצה על הסמלים, מאוירת באיור 2B (i-iv). ניתן לנתח צורת תא ברשת העצבית (איור 2B, i). ניתן להשיג מספר פרמטרים ממעקב אחר תאים עבור תא אחד (איור 2B, ii) או מספר תאים ( איור2B,iii) באמצעות שני תהליכי תמונה נפרדים. ניתן לנתח גם את מהירות ההחלמה על ידי תאי GBM ספרואידיים בנוירונים (איור 2B, iv). תאים שנזרעו על גבי נוירונים הציגו צורה מוארכת עם בליטות מרובות בעקבות דרכי העצב(איור 3A, i), אך היו בעלי צורה עגולה כאשר הם מתורבתים ישירות על למין(איור 3A, ii). תאים שתרביתו על נוירונים שינו ביעילות את צורתם, אם כי הם לא התארכו כאשר הם מתרבים על למין(איור 3A, iii-v). בליטות דקות, לפעמים קישור שני תאים, נראו בתאים במשותף עם נוירונים בשלבים מאוחרים יותר (וידאו 1).
יכולת הנדידה של תאי GBM שנזרעו על נוירונים הושוותה לתאים שנזרעו ישירות על למין. לתאים שנזרעו על נוירונים היו יכולות נדידה גדולות יותר מאשר על למין בלבד(איור 3B, i,ii). בשני התנאים זוהתה תנועה אקראית של תאי P3, עם מרחק גדול יותר לתאי P3 בנוירונים, כפי שמוצג בעלילת המסלול (איור 3B, i,ii). תנועתיות התאים הוערכה כמותית על ידי התזוזה המרובעת הממוצעת (MSD), וייצוג היומן שלה צויד בפונקציה ליניארית14 (איור 3B, iii). הכיווניות והמהירות הממוצעת חושבו גם עבור שני התנאים (איור 3B, iv,v). נדידת תאים של כדורי P3 לוותה גם בזיהוי אזור הפלואורסצנט לאורך זמן על הנוירונים ובהשוואה להגירה על למין בלבד (איור 3C, i,ii ו- Video 2). מחצית מהתבנית עם נוירונים כוסתה בתאי GBM לאחר 500 דקות בפרופיל ליניארי; עם זאת, הספרואידים לא דבקו בתבנית הלאמינין (איור 3D, iii ו-Video 2).
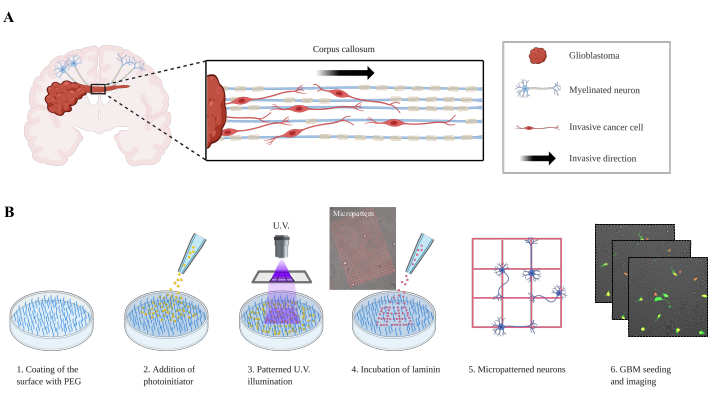
איור 1: התקנה ניסיונית של תאי גליובלסטומה הנודדים על נוירונים בדוגמאות. (A) ייצוג של תאי גליובלסטומה הפולשים לחצי הכדור הנגדי דרך כפיס המוח הקורפוס. (B)התקנה ניסיונית. בשלב 1, משטח הלוח מצופה בשכבת PEG אנטיפולינג. הפוטויניאטיאטור מתווסף לשלב 2, מכסה את כל הציפוי. בשלב 3, תמונה רחבה UV מוקרן באמצעות המטרה של המיקרוסקופ, אשר מפעיל באופן מקומי את מולקולות photoinitiator. הפוטוניאטיאט מופעל באופן מקומי cleaves מולקולות PEG ומאפשר את הספיחת הבאים של למין. בשלב 5, נוירונים הם זרע לדבוק מערכי למין. P3 (GFP / עגבניותגרעיניות)תאים גליובלסטומה מופקדים לאחר מכן על התבנית העצבית, ותמונות נרכשות (שלב 6). קיצורים: PEG = פוליאתילן גליקול; UV = אולטרה סגול; GFP = חלבון פלואורסצנטי ירוק. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: מצגת כלי פיג'י וזרימת עבודה של ניתוח. (A) הכלי הנקרא Gliomas-Neurons זמין בתפריט כלים נוספים כאשר המאקרו נוסף לתיקיה Fiji.app | פקודות מאקרו | ערכות כלים (לוח שמאלי). הוא מורכב ממספר כלי פעולה המתוארים להלן (לוח ימני). (B) i. כלי רשת: עיבוד תמונה, המשמש לציור הרשת העצבית ותאי גליומה בייצוג פשוט יותר. ii. כלי מעקב אחר תאים בודדים: עיבוד תמונה, המשמש לציור ובחירת אזור תנועת התא לניתוח ההעתקה של תאים בודדים. iii. כלי מעקב: שלבי עיבוד מראש של תמונה לשימוש בתוספי מעקב פיג'י מותקנים מראש. iv. כלי העברה יחסי: עיבוד תמונה, המשמש לקביעת העברת התאים היחסית בתבנית שנבחרה באופן ידני. פרמטרים מסוימים ניתן לכייל בלחיצה שמאלית על כפתור הכלי. קיצורים: CSE = שיפור מתיחת ניגודיות; SED = גלאי קצה סובל; F = סינון כפול; CM = המרה למסיכה; Sk = שלד; EP = חיסול של חלקיקים; OR (שילוב) = אופרטור איחוד ב- ROIs שנבחרו; ו = אופרטור צירוף ב- ROIs שנבחרו. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
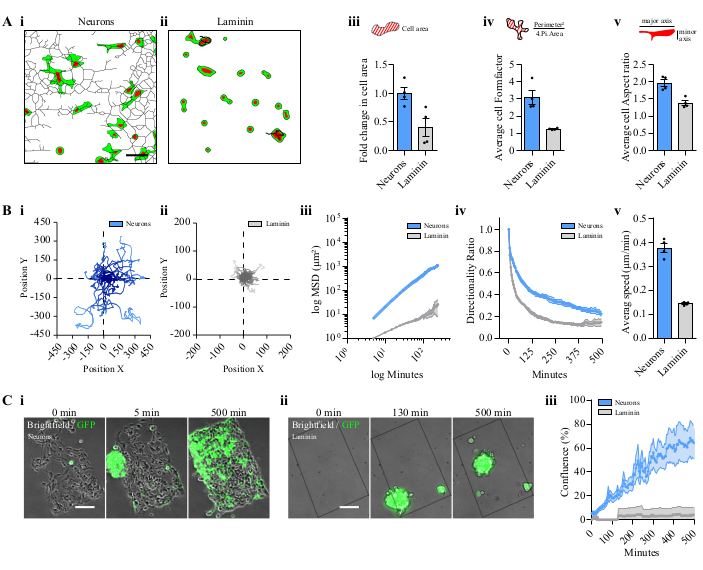
איור 3: השוואה בין תאי P3 או ספרואידים לנוירונים בדוגמת לעומת ציפוי למין. (A) מתארי צורה של תאיםגרעיניים P3 GFP / עגבניות מנותקים על נוירונים או על למין. דוגמה לרשתות מעובדות של תאי P3 ב- i. נוירונים בדוגמת או על ii. ציפוי למין. סרגל קנה מידה = 50 מיקרומטר iii. אזור תא ממוצע על נוירונים בדוגמת או על למין. iv. Formfactor הוא היחס בין ההיקף לאזור מנורמל לעיגול, מתן פרמטרים על התא הסתעפות. ו. יחס גובה-רוחב הוא היחס בין הציר הראשי לציר המשני של התא. ב iii, iv, ו - v, 15 תאים נותחו לכל שדה; 4 דפוסים בלתי תלויים; נתונים מיוצגים כ ממוצע ± S.E.M. (B) מעקב אחר ניתוח של תאי P3 מנותקים. תרשים מייצג אחד של תאים על (i) נוירונים בדוגמת ו - (ii) על ציפוי למין. iii. MSD של תאי P3 נודדים על נוירונים או על ציפוי למין. ערכי X/Y נמצאים בסולמות לוגריתמיים. iv. יחס כיווניות. ו. העברת מהירות תא ממוצעת. ב iii, iv, ו - v, 15 תאים נותחו לכל שדה; 4 דפוסים בלתי תלויים; הנתונים מיוצגים כ ממוצע ± S.E.M. (C) ניתוח הגירה של כדוריות GFP P3. תמונות מייצגות בנקודות זמן שונות של כדוריות P3 על (i) נוירונים בדוגמת או על (ii) ציפוי למין. סרגל קנה מידה = 100 מיקרומטר iii. נדידת ספרואיד המיוצגת על ידי מפגש התבנית; 4 דפוסים בלתי תלויים; הנתונים מיוצגים כמשמעותיים ± S.E.M. קיצורים: GFP = חלבון פלואורסצנטי ירוק; S.E.M. = שגיאת תקן של הממוצע; MSD = תזוזה מרובעת ממוצעת. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
וידאו 1: תאי P3 על נוירונים או למין נרשם מעל 8 שעות (בתמונה כל 5 דקות). הסרטון מציג נדידת תאים בודדים P3 על נוירונים (שמאל) ועל ציפוי למין (מימין). תאים הביעו חלבון פלואורסצנטי ירוק (GFP, צבע ירוק) ועגבנייה גרעינית (צבע אדום). סרגל = 50 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 2: P3 spheroids על נוירונים או למינין נרשם מעל 8 שעות (בתמונה כל 5 דקות). הסרטון מראה נדידת כדוריות P3 על נוירונים (משמאל) ועל ציפוי למין (מימין). תאים הביעו חלבון פלואורסצנטי ירוק (GFP, צבע ירוק). בר = 100 מיקרומטר. אנא לחץ כאן כדי להוריד וידאו זה.
Discussion
Glioblastomas לפלוש בהרחבה parenchyma באמצעות מצבים שונים: אפשרות משותפת של כלי הדם שמסביב, פלישה ביניים, או פלישה על WMTs18. מצב זה אינו מאופיין היטב בספרות בגלל הקושי למצוא מתאים במבחנה או במודלים vivo הקשורים פלישת WMT. כאן, מודל פשוט הוצע שבו נוירונים מכרסמים מתורבתים היו בדוגמת על משטחים מצופים למין, ותאים דמויי גזע GBM פלואורסצנטיים נזרעו על גבי הנוירונים. דפוס צורת רשת שימש במחקר זה כדי לשפר את הניתוח של חיבור תאים סרטניים, פלישה, והתפשטות. תאי GBM היגרו ביעילות רבה יותר על גבי הנוירונים מאשר ישירות על המטריצה, אשר היה למין בניסויים אלה. צורת התא השתנתה לאורך כל תהליך ההקלטה, ושטח פני התא גדל בו-זמנית. תאים דמויי גזע GBM צפויים להימשך על ידי דרכי נוירון באמצעות הפעלה של מסלולי איתות ספציפיים (כלומר, NOTCH2 / SOX2)4 או גורמים מופרשים ואותות מהנוירונים עצמם. מערכת זו מתאימה היטב לנתח את חילופי מולקולרי בין תאים GBM נוירונים, אשר עשוי לכלול מטבוליטים, נוירוטרנסמיטורים, או ציטוקינים.
לאחרונה, Venkatesh ומשתפי פעולה תיארו היווצרות של סינפסה נוירוגליומה שבה גלוטמט מפעיל את הקולטן שלה, AMPAR6. האם תהליכים דומים מעורבים במהלך פלישת WMT לתאי GBM? זה יכול להיחקר עם מערכת ניסיונית זו באמצעות עיכוב תרופתי או גישות גנטיות.
יש לציין את הנקודות הקריטיות הבאות. ראשית, במהלך שלבי PEGylation, אין לאפשר למצע להתייבש כדי למנוע השפעה על שלמות הציפוי נגד דבק. יש לציין, ניתן לשטוף בהרחבה את הפתרון PEG-SVA עם מים אולטרה סגולים לייבש אותו תחת זרם של חנקן לפני אחסון אותו ב 4 מעלות צלזיוס בחושך. שנית, המאקרו שפותח לניתוח העברת תאי GBM על נוירונים נמצא במצב גישה פתוחה ותואם לתוכנת FiJi. למרות שמאקרו זה והעדכונים שלו זמינים ב- GitHub, הוא דורש כיול מתאים לזיהוי תאים. לפיכך, זה עשוי להיות שימושי כדי לבדוק את הדגימות באופן ידני כבקרת איכות בעת הפעלת הניתוח. הגמישות של המערכת המשמשת כאן מאפשרת צורות שונות של התבנית, עם קווים מקבילים המפרידים בין הנוירונים בהיקפים שונים. עם גישה זו, ניתן לחקות את הצורה של מספר מבנים מוחיים, כפי שנצפה בקורפוס קלוסום - מבנה החומר הלבן הגדול ביותר במוח האנושי - שם פלישת WMT נצפתה בעיקר. לחלופין, אותו מנגנון הקרנת אור UV הוכח מבנה הידרוג'לים שאינם דבקים רגישים UV באופן מבוקר z15, המאפשר סטנדרטיזציה של היווצרות ספרואיד.
בהקשר זה, נוירוספרות 3D יכול להיווצר כדי לבדוק פלישת GBM. טכניקה זו יכולה להיות מיושמת גם עבור דפוס תאים מוחיים אחרים, כגון תאי אנדותל במוח, כדי לשחזר צורה דמוית כלי או לחקות microglial או תאים חיסוניים אחרים. לכן, השפעות סינרגטיות או מעכבות של תאים מוחיים ניתן לראות כאשר במשותף עם תאים GBM. מגבלה אחת של מחקר זה היא השימוש בנוירונים של חולדות עובריות בתרבות משותפת עם תאי GBM אנושיים, אשר לא יכול לחקות תנאים פיזיולוגיים אמיתיים. אחת הדרכים להתגבר על חיסרון זה תהיה להשתמש בתאי גזע פלוריפוטנטיים הנגרמים על ידי בני אדם כדי למנוע תגובתיות צולבת מינים16. עם זאת, תאי GBM במהירות לדבוק ביעילות לנדוד על נוירונים חולדה, כפי שמוצג בניסויים אלה. זה גם הוכח מאשר תאים מוחיים חולדה (תאי שוואן) יכול להיות שותף ביעילות עם נוירונים אנושיים17. שיטות אחרות כוללות את השימוש nanofibers 3D, אשר מציעים מודל טוב ללמוד נדידת תא גליומה12, אבל להגביל מגע תאים כמו nanofibers נחשבים מבנים שאינם חיים.
יתר על כן, תרבויות דו-מימדיות הן רדוקציוניסטיות, מפשטות את ההתבוננות בתהליכים תאיים, ועשויות להגביל את תוקפן להקשר in vivo 10. לכן, 3D co-תרבויות של תאים GBM ותאי עצב הם נציגים טובים יותר של המצב in vivo. אורגנואידים מורכבים של המוח, כגון מינימוחות 18, שימשו ב מבחני פלישה לתרבות העימותים19. היתרון העיקרי של האסטרטגיה המתוארת בזאת הוא הרבייה של גישת התרבות המשותפת, כלומר, הנוירונים העיקריים מוגבלים באופן גיאומטרי על מיקרופטרנים הנשלטים על ידי גודל, והאינטראקציה עם תאי GBM מוזרקים לא יכולה להתרחש במקום אחר. יתר על כן, הארגון המרחבי של נוירונים ניתן לכוונן בגלל צדדיות של מערכת הקרנת UV, המאפשר אופטימיזציה נוספת. בסופו של דבר, הפיתוח והאימות של גישות ביו-מימטיות כאלה יכולים גם לסייע בהפחתת מספר המודלים של בעלי חיים המשמשים במחקר ביו-רפואי.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי פונדציה ARC 2020, ליגה קונטרה לה סרטן (Comite de la Gironde), ARTC, תוכנית סרטן 2021, INCA PLBIO. Alveole נתמך על ידי סוכנות לאומית דה לה Recherche (גרנט Labex מוח ANR-10-LABX-43). ז'וריס גיאון הוא מקבל מלגת בית החולים האוניברסיטאי טולוז (CHU טולוז).
Materials
| Name | Company | Catalog Number | Comments |
| (3-aminopropyl) triethoxysilane | Sigma | 440140-100ML | The amino group is useful for the bioconjugation of mPEG-SVA |
| 96-well round-bottom plate | Sarstedt | 2582624 | Used to prepare spheroids |
| Accutase | Gibco | A11105-01 | Stored at -20 °C (long-term) or 4 °C (short-term), sphere dissociation enzyme |
| B27 | Gibco | 12587 | Stored at -20 °C, defrost before use |
| Basic Fibroblast Growth Factor | Peprotech | 100-18B | Stored at -20 °C, defrost before use |
| Countess Cell Counting ChamberSlides | Invitrogen | C10283 | Used to cell counting |
| Coverslips | Marienfeld | 111580 | Cell culture substrate |
| Dessicator cartridges | Sigma | Z363456-6EA | Used to reduce mosture during (3-aminopropyl) triethoxysilane treatment |
| DPBS 10x | Pan Biotech | P04-53-500 | Stored at 4 °C |
| Fiji software, MTrack2 macro | ImageJ | Used to analyze pictures | |
| Flask 75 cm² | Falcon | 10497302 | |
| HBSS | Sigma | H8264-500ML | |
| Heparin sodium | Sigma | H3149-100KU | Stored at 4 °C |
| Laminin | 114956-81-9 | Promotes neuronal adhesion | |
| Leonardo software | loading of envisioned micropatterns | ||
| MetaMorph Software | Molecular Devices LLC | NA | Microscopy automation software |
| Methylcellulose | Sigma | M0512 | Diluted in NBM for a 2% final concentration |
| Neurobasal medium | Gibco | 21103-049 | Stored at 4 °C |
| Nikon TiE (S Fluor, 20x/0.75 NA) | inverted microscope equipped with a motorized stage | ||
| Penicillin - Streptomycin | Gibco | 15140-122 | Stored at 4 °C |
| PLPP | Alveole | PLPPclassic_1ml | Photoinitiator used to degrade the PEG brush |
| Poly(ethylene glycol)-Succinimidyl Valerate (mPEG-SVA) | Laysan Bio | VA-PEG-VA-5000-5g | Used as an anti-fouling coating |
| PRIMO | Alveole | PRIMO1 | Digital micromirror device (DMD)-based UV projection apparatus |
| Trypan blue 0.4% | ThermoFisher | T10282 | Used for cell counting |
| Trypsin-EDTA | Sigma | T4049-100ML | Used to detach adherent cells |
References
- Shergalis, A., Bankhead, A., Luesakul, U., Muangsin, N., Neamati, N. Current challenges and opportunities in treating glioblastoma. Pharmacology Reviews. 70, 412-445 (2018).
- Scherer, H. J. The forms of growth in gliomas and their practical significance. Brain. 63, 1-35 (1940).
- Zagzag, D., et al. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1α/CXCR4 expression in glioblastomas. American Journal of Pathology. 173, 545-560 (2008).
- Wang, J., et al. Invasion of white matter tracts by glioma stem cells is regulated by a NOTCH1-SOX2 positive-feedback loop. Nature Neurosciences. 22, 91-105 (2019).
- Venkataramani, V., et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538 (2019).
- Venkatesh, H. S., et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545 (2019).
- Boyé, K., et al. The role of CXCR3/LRP1 cross-talk in the invasion of primary brain tumors. Nature Communications. 8, 1571(2017).
- Daubon, T., et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development. Nature Communications. 10, 1146(2019).
- Gritsenko, P. G., et al. p120-catenin-dependent collective brain infiltration by glioma cell networks. Nature Cell Biology. 22, 97-107 (2020).
- Guyon, J., et al. A 3D spheroid model for glioblastoma. Journal of Visualized Experiments: JoVE. (158), (2020).
- Strale, P. O., et al. Multiprotein Printing by Light?Induced Molecular Adsorption. Advanced Materials. , (2015).
- Rao, S. S., et al. Mimicking white matter tract topography using core-shell electrospun nanofibers to examine migration of malignant brain tumors. Biomaterials. 34, 5181-5190 (2013).
- Visweshwaran, S. P., Maritzen, T. A simple 3D cellular chemotaxis assay and analysis workflow suitable for a wide range of migrating cells. MethodsX. 6, 2807-2821 (2019).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysics Journal. 60, 910-921 (1991).
- Pasturel, A., Strale, P. -O., Studer, V. Tailoring common hydrogels into 3D cell culture templates. Advance Healthcare Materials. 9, 2000519(2020).
- Dolmetsch, R., Geschwind, D. H. The human brain in a dish: the promise of iPSC-derived neurons. Cell. 145, 831-834 (2011).
- Clark, A. J., et al. Co-cultures with stem cell-derived human sensory neurons reveal regulators of peripheral myelination. Brain. 140, 898-913 (2017).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26, 3203-3211 (2019).
- Han, M., et al. Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling. Brain. 143, 512-530 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved