Method Article
Co-coltura di cellule simili a staminali di glioblastoma su neuroni modellati per studiare la migrazione e le interazioni cellulari
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui presentiamo un saggio di co-coltura facile da usare per analizzare la migrazione del glioblastoma (GBM) sui neuroni modellati. Abbiamo sviluppato una macro nel software FiJi per una facile quantificazione della migrazione cellulare GBM sui neuroni, e abbiamo osservato che i neuroni modificano la capacità invasiva delle cellule GBM.
Abstract
I glioblastomi (GBM), gliomi maligni di IV grado, sono uno dei tipi più leciti di cancro umano a causa delle loro caratteristiche aggressive. Nonostante i significativi progressi nella genetica di questi tumori, come le cellule GBM invadano il parenchima cerebrale sano non è ben compreso. In particolare, è stato dimostrato che le cellule GBM invadono lo spazio peritumorale attraverso percorsi diversi; l'interesse principale di questo documento è il percorso lungo i tratti di materia bianca (WMT). Le interazioni delle cellule tumorali con i componenti delle cellule nervose peritumorali non sono ben caratterizzate. Qui è stato descritto un metodo che valuta l'impatto dei neuroni sull'invasione cellulare del GBM. Questo articolo presenta un saggio avanzato di co-coltura in vitro che imita l'invasione wmt analizzando la migrazione delle cellule staminali GBM sui neuroni. Il comportamento delle cellule GBM in presenza di neuroni viene monitorato utilizzando una procedura di tracciamento automatizzato con software open source e ad accesso libero. Questo metodo è utile per molte applicazioni, in particolare, per studi funzionali e meccanicistici nonché per analizzare gli effetti degli agenti farmacologici che possono bloccare la migrazione cellulare GBM sui neuroni.
Introduzione
I gliomi maligni primari, compresi i GBM, sono tumori devastanti, con un tasso medio di sopravvivenza da 12 a 15 mesi riportato per i pazienti affetti da GBM. La terapia attuale si basa su una grande resezione della massa tumorale e sulla chemioterapia accoppiata alla radioterapia, che estende il tasso di sopravvivenza solo di pochi mesi. I fallimenti terapeutici sono intimamente correlati allo scarso parto di farmaci attraverso la barriera ematica (BBB) e alla crescita invasiva in spazi perivascolari, meningi e lungo le WMT1. L'invasione perivascolare, chiamata anche co-opzione vascolare, è un processo ben studiato, e i meccanismi molecolari stanno iniziando ad essere chiariti; tuttavia, il processo di invasione cellulare GBM lungo le MMM non è ben compreso. Le cellule tumorali migrano nel cervello sano lungo le strutture secondarie2 diScherer . Infatti, quasi un secolo fa, Hans-Joachim Scherer descrisse le rotte invasive del GBM, che ora sono indicate come satellitosi perineuronale, satellitosi perivascolare, diffusione subpiale e invasione lungo la WMT (Figura 1A).
Alcune chemiochine e i loro recettori, come il fattore 1α derivato dalle cellule stromali (SDF1α) e il recettore della chemiochina con motivo C-X-C 4 (CXCR4), ma non il fattore di crescita endoteliale vascolare (VEGF), sembrano essere implicati nell'invasione WMT3. Più recentemente, un asse TRANSCELLULAR NOTCH1-SOX2 ha dimostrato di essere un percorso importante nell'invasione WMT delle cellule GBM4. Gli autori hanno descritto come le cellule staminali GBM invadano il parenchima cerebrale su neuroni parzialmente non mielinati, suggerendo la distruzione delle suone di mielina da parte delle cellule GBM. Una pietra miliare è stata raggiunta nel 2019 quando tre articoli sono stati pubblicati inconsacrazione sulla rivista Nature, sottolineando il ruolo dell'attività elettrica nello sviluppo del glioma5,6. Il lavoro seminale di Monje e collaboratori fa luce sul ruolo centrale dell'attività elettrica nella secrezione di neuroligin-3, che promuove lo sviluppo del glioma.
Winkler e collaboratori hanno descritto le connessioni tra cellule GBM (microtubi) cruciali in passaggi invasivi e, ultimamente, interazioni tra cellule GBM e neuroni attraverso sinapsi di neuroglioma appena descritte. Queste strutture favoriscono la stimolazione glutattergica dei recettori dell'acido α-ammino-3-idrossi-5-metil-4-isoxazolepropionico (AMPA) situati nella membrana cellulare GBM, che promuove lo sviluppo e l'invasione del tumore. L'invasione delle cellule tumorali è un processo centrale nella diffusione di metastasi o focolai secondari distanti, come osservato nei pazienti affetti da GBM. Diversi fattori sono stati identificati come importanti nell'invasione gbm come la trombospondina-1, un fattore di crescita beta trasformante (proteina matricellulare regolata da TGFβ o il recettore delle chemiochine CXCR3)7,8.
Qui, è stato descritto un modello biomimetico semplificato per lo studio dell'invasione GBM, in cui i neuroni sono modellati su tracce di laminina, e le cellule GBM sono seminate su di essa, come singole cellule o come sferoidi (Figura 1B). Le due impostazioni sperimentali sono finalizzate a ricapitolare l'invasione sui neuroni, che si osserva in GBM9,10,11. Tali modelli sono stati sviluppati in passato come biomateriali in nanofibra allineati (elettrofilatura a guscio centrale) che consentono di studiare la migrazione cellulare modulando le proprietà meccanicheo chimiche 12. Il modello di co-coltura descritto in questo articolo consente una migliore comprensione di come le cellule GBM fuggono sui neuroni definendo nuove vie molecolari coinvolte in questo processo.
Protocollo
Il consenso scritto informato è stato ottenuto da tutti i pazienti (dall'ospedale haukeland di Bergen, Norvegia, secondo le normative del comitato etico locale). Questo protocollo segue le linee guida dei comitati etici per la ricerca umana e animale dell'Università di Bordeaux. I ratti gravidi venivano ospitati e trattati nella struttura animale dell'Università di Bordeaux. L'eutanasia di un ratto incinta a tempo E18 è stata eseguita utilizzando CO2. Tutte le procedure sugli animali sono state fatte secondo le linee guida istituzionali e approvate dal comitato etico locale. Tutti i prodotti commerciali sono referenziati nella Tabella dei Materiali.
1. Preparazione delle diapositive modellate
- Preparazione del substrato per il micropatterning
- Trattare le coperture circolari in vetro da 18 mm con l'attivazione aria/plasma per 5 minuti. Posizionare le copertine in una camera chiusa con 100 μL di (3-amminopropil) trietossisilano in un essiccatore per 1 h.
- Incubare con 100 mg/mL di poli (glicole etilenico)-succinimidil valerato (peso molecolare 5.000 (Peg-SVA)) in tampone di carbonato da 10 mM, pH > 8, per 1 h. Risciacquare ampiamente con acqua ultrapura e asciugare sotto una cappa chimica.
NOTA: In questa fase, il campione può essere conservato a 4 °C al buio per un ulteriore utilizzo. - Aggiungere il fotoinizio, cloruro di 4-benzoilbenzil-trimetilammonio (PLPP), a 14,7 mg/mL in soluzione salina tamponata con fosfato (PBS).
NOTA: Può essere utilizzata anche una forma concentrata di PLPP, un gel PLPP. Si traduce in un tempo di illuminazione ultravioletto (UV) più breve necessario per degradare il pennello PEG (100 mJ/ mm2).
- Deposizione gel fotoiniziatore
- Preparare una miscela di 3 μL di gel PLPP e 50 μL di etanolo assoluto da depositare al centro dello scivolo. Posizionare il campione sotto una cappa chimica fino alla completa evaporazione dell'etanolo assoluto.
NOTA: In questa fase, il campione può essere conservato a 4 °C al buio per un ulteriore utilizzo.
- Preparare una miscela di 3 μL di gel PLPP e 50 μL di etanolo assoluto da depositare al centro dello scivolo. Posizionare il campione sotto una cappa chimica fino alla completa evaporazione dell'etanolo assoluto.
- Micropatterning di vetri
- Montare il coverslip in una camera Ludin e posizionarlo sullo stadio motorizzato di un microscopio dotato di un sistema di messa a fuoco automatica.
- Caricare immagini corrispondenti ai micropattern previsti nel software. Applicare questi parametri: replicazione 4 x 4 volte, spaziatura di 200 μm, dose UV di 1.000 mJ/mm2. Dopo la sequenza automatica di illuminazione UV, sciacquare il PLPP con più lavaggi PBS.
NOTA: Se è stato utilizzato il gel PLPP, rimuoverlo con lavaggi estesi con acqua deionizzata, asciugare in un flusso di N2e conservare a 4 °C. - Incubare con laminina (50 μg/mL in PBS) per 30 min. Lavare ampiamente con PBS.
NOTA: Una soluzione fluorescente di proteina fluorescente verde purificata (GFP, 10 μg/mL in PBS) può essere miscelata con laminina per visualizzare i micropattern mediante microscopia a fluorescenza.
2. Preparazione di neuroni e cellule GBM per la co-coltura
- Coltura dei neuroni ippocampali del ratto embrionale
- Sezionare l'ippocampo dei ratti embrionali (E18) e trasferire il tessuto nella soluzione salina bilanciata di Hank (HBSS)/1 mM 4-(2-idrossietil)-1-piperazinaetanosilfuronica (HEPES)/soluzione di penicillina-streptomicina in un tubo da 15 ml. Rimuovere la soluzione in eccesso senza asciugare l'ippocampo.
- Aggiungere 5 mL di acido tetraacetico tripsideina-etilendiammina (EDTA) integrato con penicillina (10.000 unità/mL)/streptomicina (10.000 μg/mL) e 1 mM HEPES e incubare per 15 min a 37 °C. Lavare 2 volte con la soluzione HBSS/HEPES/penicillina-streptomicina e lasciare che il tessuto rimanga in questa soluzione per 2-3 minuti.
- Dissociare il tessuto utilizzando due pipette Pasteur lucidate a fiamma, pipettando su e giù 10 volte con ogni tessuto, facendo attenzione a ridurre al minimo la schiuma. Contare le celle e valutare la fattibilità della sospensione cellulare. Placcare i neuroni su coverlips micropatterned come indicato di seguito.
NOTA: Il tasso di vitalità cellulare è dell'85-90% dopo l'estrazione.
- Coltura cellulare per neuroni su coverlips micropatterned
- Reidratare i vetri micropatterned con PBS e incubare il mezzo completo di coltura cellulare neuronale.
- Semina i neuroni ippocampali ottenuti dai ratti E18 Sprague-Dawley direttamente sopra il coverslip in vetro micropatterned ad una densità di 50.000 cellule per cm2 in mezzo neurobasale (NBM) arricchito con il 3% di siero di cavallo. Posizionare i neuroni micropatterned nell'incubatore (37 °C, 5% CO2) per 48 h.
NOTA: Dopo ~6 ore, i neuroni ippocampali primari possono essere visti aderire ai micropattern laminini.
- Co-coltura di cellule staminali GBM umane su neuroni
NOTA: Per questo studio, le cellule GBM derivate da pazienti con membrana GFP e pomodoro nucleare sono state coltivate secondo i precedenti protocollipubblicati 10.- Man mano che le cellule a forma di sferoide crescono in sospensione, centrifuga la sospensione per 5 minuti a 200 × g. Lavare gli sferoidi con 5 mL di PBS e incubare le cellule con 0,5 mL del reagente di dissociazione cellulare (vedi tabella dei materiali)per 5 minuti a 37 °C.
- Aggiungere 4,5 mL di NBM completo (completato con integratore B27, eparina, fattore di crescita dei fibroblasti 2, penicillina e streptomicina, come descrittoin precedenza 8), e contare le cellule utilizzando una tecnica di conteggio automatico.
- Semina 1.000 cellule GBM sulla coltura neuronale micropatterned in NBM arricchita con siero di cavallo al 3%. Incubare la piastra a 37 °C, 5% CO2e 95% di umidità.
3. Imaging cellulare vivo
- Subito dopo la semina cellulare GBM, posizionare il campione sul palco di un microscopio invertito dotato di camera termostato. Eseguire immagini a celle dal vivo al microscopio dotato di uno stadio motorizzato per la registrazione di più posizioni utilizzando una cassetta degli attrezzi di acquisizioni multidimensionali nel software. Acquisire immagini GFP/Pomodoro a campo luminoso ed epifluorescenza ogni 5 minuti su 12 h con un obiettivo 20x in un ambiente di temperatura (37 °C) e controllato a gas (5% CO2).
4. Analisi delle immagini
NOTA: utilizzando fiji, lo stack di immagini bidimensionale (2D) è stato pre-elaborato o elaborato semi-automaticamente utilizzando uno strumento fatto in casa e intuitivo (disponibile a questo indirizzo: https://github.com/Guyon-J/Coculture_Gliomas-Neurons/blob/main/README.md), che è scritto in linguaggio macro IJ1 (Figura 2A). Il flusso di lavoro e le procedure automatizzate sono riassunti nella figura 2B.
- Analisi della rete neuronale (Figura 2Bi)
- Selezionare un'immagine dello stack. Fare clic con il pulsante destro del mouse sullo strumento Rete per aprire la finestra di dialogo Opzioni corrispondente e regolare le impostazioni (ad esempio, Soglia = Triangolo, Li, Huang..., Sfocatura gaussianae Filtri mediani = 1, 2, 3...) per produrre una segmentazione precisa delle immagini. Quindi, fare clic su OK.
- Fare clic con il pulsante sinistro del mouse sullo strumento Rete per attivare automaticamente la procedura seguente.
- Duplicare l'immagine selezionata e dividerla in tre canali di colore (Rosso-Grigio-Verde).
- Selezionate il canale grigio (campo luminoso) ed eseguire il miglioramento dell'estensione di contrasto (CSE) per migliorare la separazione tra aree diverse. Utilizzate il rilevatore di spigoli Sobel (SED) per eseguire l'operazione di convoluzione di elaborazione del segnale 2D già raggruppata sotto il comando Trova spigolo (Find Edge).
- Per il doppio filtraggio (F), applicate una sfocatura gaussiana e un filtro mediano per ridurre il rumore e smussare il segnale dell'oggetto. Converti in maschera (CM) eseguendo algoritmi di soglia adattati per ottenere un'immagine binaria (BIN-grey) con pixel neri (area cella) e pixel bianchi (sfondo). Scheletrare (Sk) l'area cellulare in una rete semplice (NET) e filtrare le particelle (EP) in un'immagine NET rimuovendo piccole particelle non in rete.
- Per i canali rosso e verde (nucleo e membrana), eseguire il doppio filtraggio, convertire in Maschera utilizzando il metodo di soglia adattato e consentire a BIN-green di determinare la morfologia delle cellule con il comando Analizza particelle.
- Unisci tutti i canali usando la loro regione di interesse (ROI) con l'operatore OR (combine) e riadatta il colore iniziale in una semplice immagine RGB.
- Analisi della motilità a cella singola (Figura 2Bii)
- Fate clic con il pulsante destro del mouse sullo strumento Rilevamento celle singole (Single Cell Tracking) per aprire la finestra di dialogo Opzioni corrispondente e regolate le impostazioni (ad esempio, Tipo trail = Nucleo o Membrana, Soglia = Triangolo, Li, Huang..., Proiezione Z = Intensità massima, Fette sommate..., Sfocatura gaussiana e Filtri mediani = 1, 2, 3...) per produrre una segmentazione precisa delle immagini. Quindi, fare clic su OK.
- Fare clic con il pulsante sinistro del mouse sullo strumento Rilevamento celle singole per attivare automaticamente la procedura seguente.
- Rimuovere il canale grigio. Applicare una proiezione Z sullo stack, che genererà un'immagine corrispondente a uno stack di immagini in base all'ora (T-stack). Filtrare due e convertire in Maschera le tracce lasciate dalle celle. Rimuovere piccole particelle nell'immagine BIN-rosso/verde.
- Utilizzando il ROI, selezionare ogni contorno della traccia di cella e selezionare la casella Ignora rilevamento bordi nella finestra di dialogo Opzioni per ignorare questo passaggio di pre-elaborazione per i passaggi successivi.
- Isolare il canale rosso (Tipo trail = Nucleo) nella pila originale. Selezionare un ROI e rimuovere l'area esterna. Filtrare due ruote tutte le immagini e convertirsi in Maschera (rosso BIN). Determinare la posizione X/Y baricentro di ogni nucleo binarizzato.
- Utilizzando una macro già pubblicata per il software per foglidi calcolo 13, calcolare lo spostamento quadrato medio, il rapporto direzionalità e la velocità media per questa cella.
- Analisi del tracciamento a più celle (Figura 2Biii)
- Fate clic con il pulsante destro del mouse sullo strumento Tracciamento (Tracking) per aprire la finestra di dialogo Opzioni corrispondente e regolare le impostazioni (ad esempio, Soglia = Triangolo, Li, Huang..., Sfocatura gaussiana e Filtri mediani = 1, 2, 3...) per produrre una segmentazione precisa delle immagini. Quindi, fare clic su OK.
- Fare clic con il pulsante sinistro del mouse sullo strumento Rilevamento per attivare automaticamente la procedura seguente.
- Rimuovere il canale grigio.
- Dividere i canali rosso e verde, filtrare due e convertire in Mask.
- Unisci i canali usando Image Calculator... comando con l'operatore AND, lasciando solo il segnale del nucleo trovato nelle membrane.
NOTA: Diversi plugin nelle Figi possono essere utilizzati per determinare la posizione X/Y di diverse celle in questa immagine binaria pre-e-elaborazione contemporaneamente (vedere la Tabella dei Materiali).
- Utilizzando una macro13 descritta in precedenza, calcolare il plottaggio della traiettoria, lo spostamento quadrato medio, il rapporto direzionalità e la velocità media per queste celle.
- Migrazione sferoide sul tappetino neurale (Figura 2Biv)
- Fare clic con il pulsante destro del mouse sullo strumento Migrazione per aprire la finestra di dialogo Opzioni corrispondente e regolare le impostazioni (ad esempio, Soglia = Triangolo, Li, Huang..., Sfocatura gaussiana e Filtri mediani = 1, 2, 3...) per produrre una segmentazione precisa delle immagini. Quindi, fare clic su OK.
- Fare clic con il pulsante sinistro del mouse sullo strumento Di migrazione per attivare automaticamente la procedura seguente.
- Rimuovere il canale rosso.
- Dividi i canali verde e grigio.
- Per il canale grigio, disegnare manualmente il contorno del tappetino neuronale e misurarne l'area.
- Per il canale verde, filtrare due filtri e convertire in Mask. Rimuovere l'area esterna al modello (BIN) e determinare l'area della cella binarizzata per ogni immagine.
NOTA: I parametri sopra descritti vengono calibrati modificandone i valori facendo clic con il pulsante sinistro del mouse sull'icona di interesse. Questa elaborazione può essere eseguita manualmente. Tuttavia, per un gran numero di immagini (circa un centinaio per acquisizioni), canali (generalmente 3 canali) e fasi di elaborazione, sarebbe preferibile uno strumento automatizzato o semi-automatizzato.
Risultati
I neuroni modellati co-coltivati con cellule GBM fluorescenti sono stati preparati come descritto nella sezione del protocollo e sono stati eseguiti esperimenti di tracciamento. Le cellule GBM hanno rapidamente modificato la loro forma durante la migrazione sui neuroni (Figura 1B: pannello 6 e Video 1). Le cellule migrarono lungo le estensioni neuronali, in un movimento casuale (Video 1). Le cellule GBM fluorescenti e i neuroni non fluorescenti possono essere facilmente distinti, e questo ha permesso il tracciamento dei movimenti cellulari utilizzando la macro Fiji, come descritto nella sezione del protocollo (Figura 2). Fiji è un software a licenza aperta che facilita l'elaborazione e l'analisi delle immagini. Le procedure manuali che richiedono relativamente tempo per l'analisi di numerose immagini possono essere automatizzate in una macro. Le immagini vengono importate mediante procedura di trascinamento della selezione, elaborate e quantificate, generando dati disponibili tramite un gestore del ROI.
Quando è stato depositato nella cartella Fiji.app | macro | toolsets, lo strumento Gliomas-Neurons era disponibile nel menu Altri strumenti e visualizzava diverse icone ( Figura2A). Un flusso di lavoro dell'elaborazione delle immagini, ottenuto cliccando sulle icone, è illustrato nella figura 2B (i-iv). La forma cellulare può essere analizzata sulla rete neurale (Figura 2B, i). È possibile ottenere diversi parametri dal rilevamento delle celle per una (Figura 2B, ii) o per più celle ( Figura2B,iii) utilizzando due processi di immagine distinti. È inoltre possibile analizzare la velocità di recupero da parte delle cellule GBM sferoidi sui neuroni (Figura 2B, iv). Le cellule sementi sui neuroni mostravano una forma allungata con protrusioni multiple che seguivano i tratti neuronali (Figura 3A, i), ma avevano una forma rotonda quando coltivate direttamente sulla laminina (Figura 3A, ii). Le cellule coltivate sui neuroni hanno modificato in modo efficiente la loro forma, anche se non erano allungate quando coltivate sulaminina (Figura 3A, iii-v). Sporgenze sottili, a volte che collegano due cellule, sono state osservate in cellule co-coltivate con neuroni nelle fasi successive (Video 1).
La capacità migratoria delle cellule GBM sedate sui neuroni è stata confrontata con le cellule seminate direttamente sulla laminina. Le cellule sedate sui neuroni avevano maggiori capacità migratorie rispetto alla sola laminina(figura 3B, i,ii). Il movimento casuale delle cellule P3 è stato rilevato in entrambe le condizioni, con una maggiore distanza per le cellule P3 sui neuroni, come mostrato nel grafico di traiettoria (Figura 3B, i,ii). La motilità cellulare è stata stimata quantitativamente dallo spostamento quadrato medio (MSD), e la sua rappresentazione del tronco è stata dotata di unafunzione lineare 14 (Figura 3B, iii). La direzionalità e la velocità media sono state calcolate anche per entrambe lecondizioni (figura 3B, iv,v). La migrazione cellulare degli sferoidi P3 è stata seguita anche rilevando l'area fluorescente nel tempo sui neuroni e rispetto alla migrazione solo sulla laminina(Figura 3C,i,ii e Video 2). Metà del modello con neuroni era coperto da cellule GBM dopo 500 minuti in un profilo lineare; tuttavia, gli sferoidi non hanno aderito al modello laminin (Figura 3D, iii e Video 2).
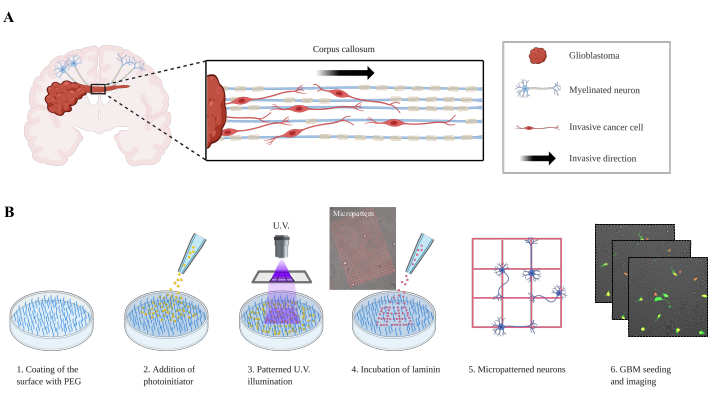
Figura 1: Configurazione sperimentale delle cellule del glioblastoma che migrano su neuroni modellati. (A) Rappresentazione delle cellule del glioblastoma che invadono l'emisfero conlaterale attraverso il corpo calloso. (B)Installazione sperimentale. Nella fase 1, la superficie della piastra è rivestita con uno strato PEG antivegetative. Il fotoinizionte viene aggiunto nel passaggio 2, coprendo l'intero rivestimento. Nel passaggio 3, un'immagine widefield UV viene proiettata attraverso l'obiettivo del microscopio, che attiva localmente le molecole del fotoinizio. Il fotoiniziologo attivato scide localmente le molecole PEG e consente il successivo adsorbimento della laminina. Nel passaggio 5, i neuroni vengono seminati e aderiscono agli array di laminine. Le cellule di glioblastoma P3 (GFP/Tomatonuclear)vengono quindi depositate sul modello neuronale e vengono acquisite immagini (fase 6). Abbreviazioni: PEG = polietilene glicole; UV = ultravioletto; GFP = proteina fluorescente verde. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Flusso di lavoro di presentazione e analisi degli strumenti fiji. (A) Lo strumento denominato Gliomas-Neurons è disponibile nel menu Altri strumenti quando la macro viene aggiunta Fiji.app una cartella | macro | set di strumenti (pannello sinistro). È composto da diversi strumenti d'azione descritti di seguito (pannello destro). (B) i. Strumento di rete: elaborazione delle immagini, che viene utilizzato per disegnare la rete neurale e le cellule di glioma in una rappresentazione semplificata. ii. Strumento di tracciamento a cella singola: elaborazione delle immagini, che viene utilizzata per disegnare e selezionare l'area di movimento cellulare per analizzare lo spostamento di singole celle. iii. Strumento di tracciamento: fasi di pre-elaborazione delle immagini per l'uso di plugin di tracciamento fiji preinstallati. iv. Strumento di migrazione relativa: elaborazione delle immagini, che viene utilizzata per determinare la migrazione relativa delle celle su un modello selezionato manualmente. Alcuni parametri possono essere calibrati con un clic sinistro sul pulsante dell'utensile. Abbreviazioni: CSE = Miglioramento dell'estensione del contrasto; SED = Sobel Edge Detector; F = doppio filtro; CM = Converti in maschera; Sk = Skeletonize; EP = Eliminazione delle particelle; OR (combine) = operatore dell'Unione su ROM selezionate; AND = Operatore di congiunzione su ROM selezionate. Clicca qui per visualizzare una versione più grande di questa figura.
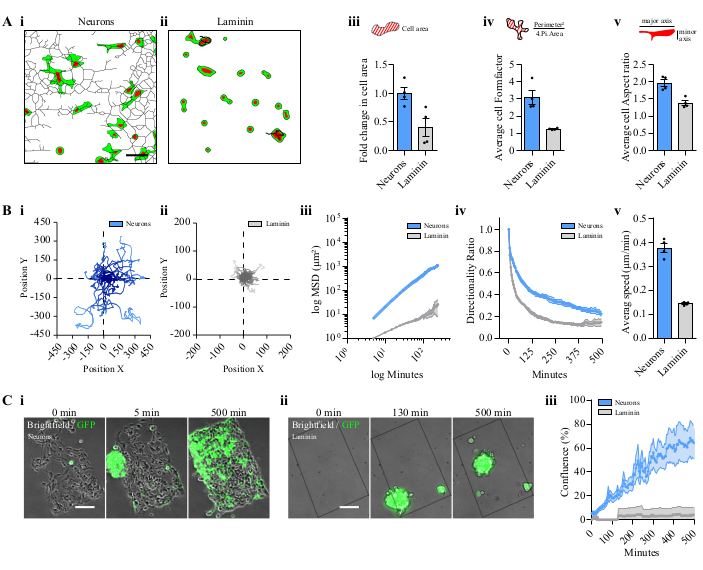
Figura 3: Confronto tra cellule P3 o sferoidi su neuroni modellati rispetto alrivestimento di laminina. (A) Descrittori di forma delle cellule nucleari dissociate P3 GFP/Pomodoro sui neuroni o sulla laminina. Esempio di reti elaborate di celle P3 su i. neuroni modellati o su ii. rivestimento laminina. Barra di scala = 50 μm. iii. Area cellulare media su neuroni modellati o su laminina. iv. Formfactor è il rapporto tra la circonferenza e l'area normalizzata in un cerchio, fornendo parametri sull'allungamento cellulare e sulla ramificazione cellulare. — (DE) Signor Presidente, signor Le proporzioni sono il rapporto tra l'asse maggiore e l'asse minore della cella. In iii, ive v, sono state analizzate 15 celle per campo; 4 modelli indipendenti; i dati sono rappresentati come ± S.E.M. (B) Analisi di tracciamento di cellule P3 dissociate. Un grafico rappresentativo delle cellule su (i) neuroni modellati e (ii) sul rivestimento laminino. iii. DMS di cellule P3 che migrano sui neuroni o sul rivestimento di laminina. I valori X/Y sono in scale logaritmiche. iv. Rapporto direzionalità. — (DE) Signor Presidente, signor Migrazione media della velocità cellulare. In iii, ive v, sono state analizzate 15 celle per campo; 4 modelli indipendenti; i dati sono rappresentati come ± S.E.M. (C) Analisi della migrazione degli sferoidi P3 GFP. Immagini rappresentative in diversi punti di tempo degli sferoidi P3 su (i) neuroni modellati o su (ii) rivestimento laminina. Barra di scala = 100 μm. iii. Migrazione sferoide rappresentata dalla confluenza del modello; 4 modelli indipendenti; i dati sono rappresentati come ± S.E.M. Abbreviazioni: GFP = proteina fluorescente verde; S.E.M. = errore standard della media; MSD = Spostamento quadrato medio. Clicca qui per visualizzare una versione più grande di questa figura.
Video 1: Cellule P3 su neuroni o laminina registrate oltre 8 ore (immagini ogni 5 minuti). Il video mostra la migrazione a singola cellula P3 sui neuroni (a sinistra) e sul rivestimento laminina (a destra). Cellule espresse proteine fluorescenti verdi (GFP, colore verde) e pomodoro nucleare (colore rosso). Bar = 50 μm. Fare clic qui per scaricare questo video.
Video 2: Sferoidi P3 su neuroni o laminina registrati oltre 8 h (con immagini ogni 5 minuti). Il video mostra la migrazione dello sferoide P3 sui neuroni (a sinistra) e sul rivestimento laminina (a destra). Cellule espresse proteine fluorescenti verdi (GFP, colore verde). Bar = 100 μm. Fare clic qui per scaricare questo video.
Discussione
I glioblastomi invadono ampiamente il parenchima usando diverse modalità: co-opzione dei vasi sanguigni circostanti, invasione interstiziale o invasione sulleRM 18. Quest'ultima modalità non è ben caratterizzata in letteratura a causa della difficoltà di trovare modelli adatti in vitro o in vivo relativi all'invasione WMT. Qui, è stato proposto un modello semplificato in cui i neuroni roditori coltivati sono stati modellati su superfici rivestite di laminina, e le cellule fluorescenti simili a staminali GBM sono state seminate sopra i neuroni. Un modello a forma di griglia è stato utilizzato in questo studio per migliorare l'analisi dell'attaccamento, dell'invasione e della proliferazione delle cellule tumorali. Le cellule GBM migrarono in modo più efficiente sopra i neuroni che direttamente sulla matrice, che era laminina in questi esperimenti. La forma della cella è cambiata durante tutto il processo di registrazione e l'area della superficie della cella è aumentata contemporaneamente. È probabile che le cellule staminali GBM siano attratte dai tratti neuronali attraverso l'attivazione di specifiche vie di segnalazione (ad esempio, NOTCH2/SOX2)4 o fattori e segnali secreti dai neuroni stessi. Questo sistema è adatto per analizzare gli scambi molecolari tra cellule GBM e neuroni, che possono includere metaboliti, neurotrasmettitori o citochine.
Recentemente, Venkatesh e collaboratori hanno descritto la formazione di una sinapsi neuroglioma in cui il glutammato attiva il suo recettore, AMPAR6. Processi simili sono coinvolti durante l'invasione WMT delle cellule GBM? Questo può essere studiato con questo sistema sperimentale utilizzando inibizione farmacologica o approcci genetici.
Si noti i seguenti punti critici. In primo luogo, durante le fasi di PEGylation, il substrato non deve essere lasciato asciugare per evitare di influire sull'integrità del rivestimento antiadesivo. Da notare che è possibile lavare ampiamente la soluzione PEG-SVA con acqua ultrapura e asciugarla sotto un flusso di azoto prima di conservarla a 4 °C al buio. In secondo luogo, la macro sviluppata per l'analisi della migrazione cellulare GBM sui neuroni è in modalità ad accesso aperto ed è compatibile con il software FiJi. Sebbene questa macro e i suoi aggiornamenti siano disponibili su GitHub, richiede una calibrazione appropriata per il rilevamento delle celle. Pertanto, può essere utile controllare manualmente i campioni come controllo di qualità durante l'avvio dell'analisi. La flessibilità del sistema qui utilizzato consente diverse forme del modello, con linee parallele che separano i neuroni in diverse estensioni. Con questo approccio, la forma di diverse strutture cerebrali può essere mimicked, come osservato nel corpo calloso- la più grande struttura di materia bianca nel cervello umano- dove si osserva principalmente l'invasione WMT. In alternativa, lo stesso apparato di proiezione a luce UV ha dimostrato di strutturare idrogel non adesivi sensibili ai raggi UV in modo controllato da Z15,consentendo la standardizzazione della formazione di sferoidi.
In questo contesto, le neurosfere 3D potrebbero essere generate per testare l'invasione del GBM. Questa tecnica può anche essere applicata per modellare altre cellule cerebrali, come le cellule endoteliali cerebrali, per riprodurre forme simili a vasi o imitare microgliali o altre cellule immunitarie. Pertanto, gli effetti sinergici o inibitori delle cellule cerebrali possono essere osservati quando co-coltivati con cellule GBM. Una limitazione di questo studio è l'uso di neuroni del ratto embrionale in co-coltura con cellule GBM umane, che potrebbero non imitare le vere condizioni fisiologiche. Un modo per superare questo inconveniente sarebbe quello di utilizzare neuroni derivati da cellule staminali pluripotenti indotte dall'uomo per evitare la reattività incrociata dellespecie 16. Tuttavia, le cellule GBM aderiscono rapidamente ed e migrano in modo efficiente sui neuroni dei ratti, come mostrato in questi esperimenti. È stato anche dimostrato che le cellule cerebrali del ratto (cellule di Schwann) potrebbero essere co-coltivate in modo efficiente con i neuroniumani 17. Altri metodi includono l'uso di nanofibre 3D, che offrono un buon modello per studiare la migrazione cellulare del glioma12, ma limitare il contatto cellulare-cellula come nanofibre sono considerate strutture non viventi.
Inoltre, le colture 2D sono riduzioniste, semplificano l'osservazione dei processi cellulari e possono limitare la loro validità per il contesto in vivo 10. Pertanto, le co-culture 3D di cellule GBM e neuroni sono migliori rappresentanti della situazione in vivo. Complessi organoidi cerebrali, come i mini-cervelli18, sono stati utilizzati nei test di invasione della cultura del confronto19. Il principale vantaggio della strategia descritta nel presente documento è la riproducibilità dell'approccio della co-coltura, cioè, i neuroni primari sono geometricamente vincolati su micropattern controllati dalle dimensioni e l'interazione con le cellule GBM iniettate non può verificarsi altrove. Inoltre, l'organizzazione spaziale dei neuroni può essere messa a punto grazie alla versatilità del sistema di proiezione UV, consentendo un'ulteriore ottimizzazione. In ultima analisi, lo sviluppo e la convalida di tali approcci biomimetici potrebbe anche contribuire a ridurre il numero di modelli animali utilizzati nella ricerca biomedica.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato da Fondation ARC 2020, Ligue Contre le Cancer (Comite de la Gironde), ARTC, Plan Cancer 2021, INCA PLBIO. Alveole è supportato da Agence Nationale de la Recherche (Grant Labex BRAIN ANR-10-LABX-43). Joris Guyon è un destinatario di una borsa di studio presso l'ospedale universitario di Tolosa (CHU Toulouse).
Materiali
| Name | Company | Catalog Number | Comments |
| (3-aminopropyl) triethoxysilane | Sigma | 440140-100ML | The amino group is useful for the bioconjugation of mPEG-SVA |
| 96-well round-bottom plate | Sarstedt | 2582624 | Used to prepare spheroids |
| Accutase | Gibco | A11105-01 | Stored at -20 °C (long-term) or 4 °C (short-term), sphere dissociation enzyme |
| B27 | Gibco | 12587 | Stored at -20 °C, defrost before use |
| Basic Fibroblast Growth Factor | Peprotech | 100-18B | Stored at -20 °C, defrost before use |
| Countess Cell Counting ChamberSlides | Invitrogen | C10283 | Used to cell counting |
| Coverslips | Marienfeld | 111580 | Cell culture substrate |
| Dessicator cartridges | Sigma | Z363456-6EA | Used to reduce mosture during (3-aminopropyl) triethoxysilane treatment |
| DPBS 10x | Pan Biotech | P04-53-500 | Stored at 4 °C |
| Fiji software, MTrack2 macro | ImageJ | Used to analyze pictures | |
| Flask 75 cm² | Falcon | 10497302 | |
| HBSS | Sigma | H8264-500ML | |
| Heparin sodium | Sigma | H3149-100KU | Stored at 4 °C |
| Laminin | 114956-81-9 | Promotes neuronal adhesion | |
| Leonardo software | loading of envisioned micropatterns | ||
| MetaMorph Software | Molecular Devices LLC | NA | Microscopy automation software |
| Methylcellulose | Sigma | M0512 | Diluted in NBM for a 2% final concentration |
| Neurobasal medium | Gibco | 21103-049 | Stored at 4 °C |
| Nikon TiE (S Fluor, 20x/0.75 NA) | inverted microscope equipped with a motorized stage | ||
| Penicillin - Streptomycin | Gibco | 15140-122 | Stored at 4 °C |
| PLPP | Alveole | PLPPclassic_1ml | Photoinitiator used to degrade the PEG brush |
| Poly(ethylene glycol)-Succinimidyl Valerate (mPEG-SVA) | Laysan Bio | VA-PEG-VA-5000-5g | Used as an anti-fouling coating |
| PRIMO | Alveole | PRIMO1 | Digital micromirror device (DMD)-based UV projection apparatus |
| Trypan blue 0.4% | ThermoFisher | T10282 | Used for cell counting |
| Trypsin-EDTA | Sigma | T4049-100ML | Used to detach adherent cells |
Riferimenti
- Shergalis, A., Bankhead, A., Luesakul, U., Muangsin, N., Neamati, N. Current challenges and opportunities in treating glioblastoma. Pharmacology Reviews. 70, 412-445 (2018).
- Scherer, H. J. The forms of growth in gliomas and their practical significance. Brain. 63, 1-35 (1940).
- Zagzag, D., et al. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1α/CXCR4 expression in glioblastomas. American Journal of Pathology. 173, 545-560 (2008).
- Wang, J., et al. Invasion of white matter tracts by glioma stem cells is regulated by a NOTCH1-SOX2 positive-feedback loop. Nature Neurosciences. 22, 91-105 (2019).
- Venkataramani, V., et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538 (2019).
- Venkatesh, H. S., et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545 (2019).
- Boyé, K., et al. The role of CXCR3/LRP1 cross-talk in the invasion of primary brain tumors. Nature Communications. 8, 1571(2017).
- Daubon, T., et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development. Nature Communications. 10, 1146(2019).
- Gritsenko, P. G., et al. p120-catenin-dependent collective brain infiltration by glioma cell networks. Nature Cell Biology. 22, 97-107 (2020).
- Guyon, J., et al. A 3D spheroid model for glioblastoma. Journal of Visualized Experiments: JoVE. (158), (2020).
- Strale, P. O., et al. Multiprotein Printing by Light?Induced Molecular Adsorption. Advanced Materials. , (2015).
- Rao, S. S., et al. Mimicking white matter tract topography using core-shell electrospun nanofibers to examine migration of malignant brain tumors. Biomaterials. 34, 5181-5190 (2013).
- Visweshwaran, S. P., Maritzen, T. A simple 3D cellular chemotaxis assay and analysis workflow suitable for a wide range of migrating cells. MethodsX. 6, 2807-2821 (2019).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysics Journal. 60, 910-921 (1991).
- Pasturel, A., Strale, P. -O., Studer, V. Tailoring common hydrogels into 3D cell culture templates. Advance Healthcare Materials. 9, 2000519(2020).
- Dolmetsch, R., Geschwind, D. H. The human brain in a dish: the promise of iPSC-derived neurons. Cell. 145, 831-834 (2011).
- Clark, A. J., et al. Co-cultures with stem cell-derived human sensory neurons reveal regulators of peripheral myelination. Brain. 140, 898-913 (2017).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26, 3203-3211 (2019).
- Han, M., et al. Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling. Brain. 143, 512-530 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon