Method Article
胶质母细胞瘤干细胞在模式神经元上共同培养,以研究迁移和细胞相互作用
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一个易于使用的共培养检测,以分析胶质母细胞瘤(GBM)迁移的模式神经元。我们在FiJi软件中开发了一个宏,用于简单量化神经元上的GBM细胞迁移,并观察到神经元会改变GBM细胞的侵入能力。
摘要
胶质母细胞瘤(GBMs),四级恶性胶质瘤,是人类癌症中最致命的类型之一,因为它们具有攻击性特征。尽管这些肿瘤的遗传学取得了重大进展,但GBM细胞如何侵入健康的脑帕伦奇马尚不清楚。值得注意的是,已证明GBM细胞通过不同的途径侵入永久空间:本文的主要兴趣是沿白质区(WMTs)的路线。肿瘤细胞与围产神经细胞成分的相互作用特征不充分。在此,描述了一种评估神经元对GBM细胞入侵的影响的方法。本文通过分析神经元上GBM干细胞的迁移,提出了一种先进的体外共培养检测,模拟WMT入侵。使用开源和自由访问软件的自动跟踪程序对GBM细胞在神经元存在时的行为进行监控。这种方法对许多应用都很有用,特别是对于功能和机械学研究,以及分析药理制剂对阻止GBM细胞迁移对神经元的影响。
引言
原发性恶性胶质瘤,包括GBM,是毁灭性的肿瘤,GBM患者的中等存活率为12至15个月。目前的治疗依赖于大肿瘤大规模切除和化疗加上放射治疗,这只会延长几个月的存活率。治疗失败与跨血脑屏障(BBB)的不良药物输送以及血管间空间、脑膜和WMT1沿线的侵入性生长密切相关。血管入侵,也称为血管共同选择,是一个经过充分研究的过程,分子机制开始被阐明:然而,沿WMT的GBM细胞入侵过程并不被很好地理解。肿瘤细胞沿着舍勒的次生结构2迁移到健康的大脑中。事实上,近一个世纪前,汉斯-约阿希姆·舍勒描述了GBM的侵入性路线,现在被称为腹膜饱腹症、腹膜饱腹症、亚皮亚传播和沿WMT(图1A)的入侵。
一些化疗因子及其受体,如频闪细胞衍生因子-1+(SDF1+)和C-X-C图案化学素受体4(CXCR4),但不是血管内皮生长因子(VEGF),似乎与WMT入侵3有关。最近,一个跨细胞的T1-SOX2轴已被证明是WMT入侵GBM细胞4的重要途径。作者描述了GBM干细胞如何侵入部分未髓化神经元的脑帕奇玛,这表明GBM细胞对骨髓护套的破坏。2019年,《自然》杂志发表了三篇文章,强调了电活动在胶质瘤发育中的作用。Monje 和合作者的开创性工作揭示了电活动在神经质-3分泌中的核心作用,这种分泌物促进胶质瘤的发展。
Winkler和合作者描述了GBM细胞(微管)之间的连接在侵入性步骤中至关重要,最近,GBM细胞和神经元之间通过新描述的神经胶质瘤突触相互作用。这些结构有利于对位于GBM细胞膜的α氨基-3-羟基-5-甲基-4-异氧丙烯酸(AMPA)受体进行谷氨酸刺激,从而促进肿瘤的发展和入侵。肿瘤细胞入侵是转移或远继发的传播过程中的一个中心过程,如GBM患者所观察到的。已确定在GBM入侵中很重要的几个因素,如血栓蓬丁-1,一种转化生长因子β(TGF+调节的基质细胞蛋白,或化学素受体CXCR3)7,8。
在这里,一个简化的生物仿生模型被描述为研究GBM入侵,其中神经元在层压素的轨道上成型,GBM细胞作为单细胞或球体(图1B)播种到它上面。这两个实验设置旨在回顾神经元的入侵,这是在GBM9,10,11观察到的。这种模型过去曾被开发成对齐的纳米纤维生物材料(核心壳电平),允许通过调节机械或化学特性12来研究细胞迁移。本文中描述的共同培养模型通过定义这个过程中涉及的新分子通路,可以更好地了解 GBM 细胞如何逃逸到神经元上。
研究方案
知情的书面同意是从所有患者(根据当地道德委员会的规定,从挪威卑尔根的豪克兰医院)获得的。该协议遵循波尔多大学人类和动物研究伦理委员会的指导方针。怀孕的老鼠被安置和治疗在波尔多大学的动物设施。使用二氧化碳对E18次怀孕大鼠进行安乐死。所有动物程序均按照机构准则完成,并经当地道德委员会批准。所有商业产品均参照 材料表。
1. 准备图案幻灯片
- 微模式的基板准备
- 通过空气/等离子激活处理 18 毫米圆形玻璃盖片 5 分钟。将盖片放在一个封闭的腔室中,用100微升(3-氨基)三氧西兰放在干燥器中1小时。
- 在 10 mM 碳酸盐缓冲器中孵化 100 毫克/mL 聚(乙二醇)-简洁的谷氨酸酯(分子重量 5,000 (Peg-SVA)),pH > 8,为 1 小时。用超纯水广泛冲洗,并在化学罩下干燥。
注:在此阶段,样品可存储在黑暗中的 4 °C 以供进一步使用。 - 加入光启动器,4-苯二苯甲酰-氯化铵(PLPP),在磷酸盐缓冲盐水(PBS)中为14.7毫克/mL。
注:也可以使用PLPP的浓缩形式,即PLPP凝胶。它导致降低PEG刷(100mJ/mm2)所需的较短的紫外线(UV)照明时间。
- 光启动器凝胶沉积
- 准备3μL的PLPP凝胶和50μL的绝对乙醇的混合物沉积在幻灯片的中心。将样品放在化学罩下,直到绝对乙醇完全蒸发。
注:在此阶段,样品可存储在黑暗中的 4 °C 以供进一步使用。
- 准备3μL的PLPP凝胶和50μL的绝对乙醇的混合物沉积在幻灯片的中心。将样品放在化学罩下,直到绝对乙醇完全蒸发。
- 玻璃滑动微模式
- 将盖子滑装在 Ludin 室中,并将其放置在配备自动对焦系统的显微镜的电动阶段。
- 将与设想的微模式相对应的图像加载到软件中。应用这些参数:复制4×4次,间距200微米,紫外线剂量1000mJ/mm2。在自动紫外线照明序列之后,用多个 PBS 洗涤冲洗 PLPP。
注意:如果使用PLPP凝胶,用除离子水进行广泛洗涤,在N2流中干燥,并储存在4°C。 - 用层压素(PBS中为50微克/mL)孵化30分钟。使用PBS广泛清洗。
注:纯绿色荧光蛋白(PBS中的GFP,10μg/mL)的荧光溶液可与层胺混合,通过荧光显微镜可视化显微模式。
2. 为共同培养准备神经元和GBM细胞
- 胚胎大鼠海马神经元的培养
- 解剖胚胎(E18)大鼠的海马体,并将组织转移到汉克的平衡盐溶液(HBSS)/1 mM 4-(2-羟基)-1-管道氨基硫酸(HEPES)/青霉素-链霉素溶液中,在15mL管中。在不干燥海马体的情况下去除多余的溶液。
- 加入5mL的三聚氰胺四乙酸(EDTA),辅以青霉素(10,000单位/mL)/链霉素(10,000微克/mL)和1毫米 HEPES,在37°C孵育15分钟。 用 HBSS/HEPES/青霉素-链霉素溶液清洗 2 次,让组织在此溶液中保留 2-3 分钟。
- 使用两个火焰抛光的巴斯德移液器分离组织,通过每个组织上下管道 10 倍,注意尽量减少发泡。计算细胞,并评估细胞悬架的可行性。将神经元放在显微模式盖片上,如下所示。
注:提取后细胞存活率为85-90%。
- 微模式盖片上神经元的细胞培养
- 用PBS补充微模式玻璃滑梯,并孵育完整的神经元细胞培养介质。
- 将从 E18 Sprague-Dawley 大鼠获得的海马神经元直接播种到微模式玻璃盖上,密度为每厘米 50,000 个细胞,神经巴沙介质 (NBM) 中含有 3% 马血清。将微模式神经元放置在孵化器中(37 °C,5% CO2)48小时。
注:约6小时后,可以看到主要海马神经元粘附在层压素微模式下。
- 神经元上人类GBM干细胞的共培养
注:在这项研究中,膜GFP阳性和核番茄患者衍生的GBM细胞是按照先前公布的协议10生长的。- 当球状细胞在悬浮中生长时,离心机悬浮5分钟,为200× 克。用 5 mL 的 PBS 清洗球体,用 0.5 mL 的细胞分离试剂(见 材料表)孵育细胞,在 37 °C 处 5 分钟。
- 添加 4.5 mL 的完整 NBM(辅以 B27 补充剂、肝素、成纤维细胞生长因子 2、青霉素和链霉素,如前所述 8),并使用自动计数技术计算细胞。
- 在 NBM 的微模式神经元培养物上播种 1,000 个 GBM 细胞,富含 3% 马血清。在 37 °C、5% CO2和 95% 湿度下孵化板。
3. 活细胞成像
- GBM细胞播种后,立即将样品放在装有恒温器室的倒显微镜的舞台上。使用软件中的多维采集工具箱,在配备电动舞台的显微镜上执行活细胞成像,用于记录多个位置。在 12 小时内每 5 分钟获取一次明亮场和表外荧光 GFP/番茄图像,在温度 (37 °C) 和气体控制 (5% CO 2) 环境中达到20倍的目标。
4. 图像分析
注:使用斐济,使用自制和用户友好的工具(可在此地址:https://github.com/Guyon-J/Coculture_Gliomas-Neurons/blob/main/README.md)半自动预处理或处理二维 (2D) 图像堆栈,该工具栈以 IJ1 宏语言(图 2A)编写。自动化工作流程和程序在 图 2B中进行总结。
- 神经元网络分析 (图2毕)
- 选择堆栈的一个图像。右键单击 网络 工具以打开相应的 选项 对话框并调整设置(例如 阈值 = 三角形、Li、黄。。。、 高斯模糊和 中位数 滤镜 = 1、2、3.。。)以生成图像的精确细分。然后,单击 "确定"。
- 左键单击 "网络 "工具以自动激活以下程序。
- 复制选定的图像,并将其 分成 三个颜色通道(红灰色-绿色)。
- 选择灰色通道(亮场),并执行 对比拉伸增强 (CSE),以增强不同区域之间的分离。使用 Sobel 边缘探测器 (SED) 执行已分组在 Find Edge 命令下的 2D 信号处理卷积操作。
- 对于 双滤 (F),应用高斯模糊和中位数滤光片以减少噪音并平滑对象信号。通过执行经过调整的阈值算法 转换为面膜 (CM),以获取带有黑色像素(细胞区域)和白色像素(背景)的二进制图片(BIN-灰色)。将 (Sk) 单元格区域 骨架化 为一个简单的网络 (NET),并通过去除小型非网络 粒子来过滤 NET 图像中的粒子 (EP)。
- 对于红色和绿色通道(原子核和膜),执行 双滤,使用调整后的阈值方法 转换为面膜 ,并允许 BIN-Green 通过 分析粒子命令确定细胞形态。
- 使用其感兴趣的区域 (ROI) 将所有通道与 OR( 组合)操作员合并,并将其初始颜色重新调整为简单的 RGB 图像。
- 单细胞运动分析 (图2比 )
- 右键单 细胞跟踪 工具打开相应的 选项 对话框,并调整设置(例如, 跟踪类型 = 核或膜、 阈值 = 三角形、Li、黄...、Z 投影 = 最大强度、总和切片、 高斯模糊 和 中位数 滤镜 = 1、2、3.。。),以生成图像的精确细分。然后,单击 "确定"。
- 左键单 细胞跟踪 工具,自动激活以下程序。
- 删除灰色通道。在堆栈上应用Z 投影,这将根据时间(T 栈)生成与图像堆栈相对应的图像。双滤并转换为遮蔽细胞留下的痕迹。将小颗粒移到 BIN-红色/绿色图像中。
- 通过使用 ROI,选择单元格跟踪的每个轮廓,并检查选项对话框中的框跳过边缘检测,以跳过此预处理步骤以了解后续步骤。
- 隔离 原始堆栈上的红色通道(跟踪类型 = 核)。选择一个投资回报率,并删除外部区域。 双滤所有 图像并 转换为面膜 (BIN-红色)。确定每个双核核的中心X/Y位置。
- 使用已经发布的宏电子表格软件13,计算该单元的平均方位、方向比和平均速度。
- 多细胞跟踪分析 (图2Biii)
- 右键单击 "跟踪 "工具以打开相应的 "选项 "对话框并调整设置(例如 阈值 = 三角形、Li、黄...、 高斯模糊 和 中位数 滤镜 = 1、2、3.。。)以生成图像的精确细分。然后,单击 "确定"。
- 左键单击 "跟踪 "工具以自动激活以下程序。
- 删除灰色通道。
- 拆分 红色和绿色通道, 双滤,并 转换为面膜。
- 使用 图像计算器合并通道...命令与 和 操作员,只留下在膜中找到的核信号。
注:斐济的几个插件可用于同时确定此二进制预处理图像中几个单元的 X/Y 位置(参见 材料表)。
- 使用先前描述的宏13计算这些单元的轨迹图、平均方位、方向比和平均速度。
- 神经垫上的球状迁移 (图2比夫)
- 右键单击 "迁移 "工具以打开相应的 "选项 "对话框并调整设置(例如 阈值 = 三角形、Li、黄...、 高斯模糊 和 中位数 滤镜 = 1、2、3.。。)以生成图像的精确细分。然后,单击 "确定"。
- 左键单击 "迁移 "工具以自动激活以下程序。
- 删除红色通道。
- 拆分 绿色和灰色通道。
- 对于灰色通道,手动 绘制 神经元垫的轮廓,并测量其区域。
- 对于绿色通道, 双滤 除堆栈并 转换为面膜。移除图案 (BIN) 以外的区域,并确定每个图像的二元化库区域。
注意:通过左键单击兴趣图标来更改其值,对上述参数进行校准。此处理可以手动完成。但是,对于大量图像(每次采集大约一百张)、通道(一般为 3 个通道)和处理步骤,最好使用自动或半自动工具。
结果
与荧光GBM细胞共同培养的模式神经元按照协议部分的描述进行了培养,并进行了跟踪实验。GBM细胞在神经元上迁移时迅速改变其形状(图1B:面板6 和 视频1)。细胞沿着神经元扩展迁移,以随机运动(视频1)。荧光GBM细胞和非荧光神经元可以很容易地区分,这允许使用斐济宏跟踪细胞运动,如协议部分(图2)所述。斐济是一个开放的许可证软件,方便图像处理和分析。分析大量图像相对耗时的人工程序可以在宏中自动进行。图像通过拖放程序导入、处理和量化,生成使用投资回报率管理器提供的数据。
当存入Fiji.app |宏|工具集文件夹时,Gliomas-神经元工具可在更多工具菜单中找到,并显示多个图标(图 2A)。图像处理的工作流程,通过点击图标获得,在图2B(i-iv)中说明。细胞形状可以在神经网络上分析(图2B,i)。通过使用两个不同的图像过程,可以从细胞跟踪中获取多个参数(图 2B、ii)或多个单元格(图 2B,iii)。也可以分析神经元上球状GBM细胞的恢复速度(图2B,iv)。播种到神经元的细胞在神经元区域(图3A,i)后呈现出多发性突起的拉长形状,但当直接在层压素上培养时,具有圆形(图3A,ii)。在神经元上培养的细胞有效地改变了它们的形状,尽管它们在层压素(图3A,iii-v)上培养时没有拉长。在后期与神经元共同培养的细胞中,可以看到薄突起,有时连接两个细胞(视频1)。
将神经元上播种的GBM细胞的迁移能力与直接在层蛋白上播种的细胞进行比较。神经元上播种的细胞比单靠层蛋白具有更大的迁移能力(图3B,i,ii)。在这两种条件下都检测到P3细胞的随机运动,神经元上的P3细胞距离更大,如轨迹图(图3B,i,ii)所示。细胞运动性按平均方位移 (MSD) 进行定量估计,其日志表示具有线性函数14(图 3B,iii)。方向和平均速度也计算这两个条件(图3B,iv,v)。P3球体的细胞迁移也随之而来,检测神经元上的荧光区,并与单单层蛋白的迁移(图3C,i,ii和视频2)进行比较。神经元的模式有一半在500分钟后被GBM细胞覆盖在线性轮廓中;然而,球体不坚持层压素模式(图3D,iii和视频2)。
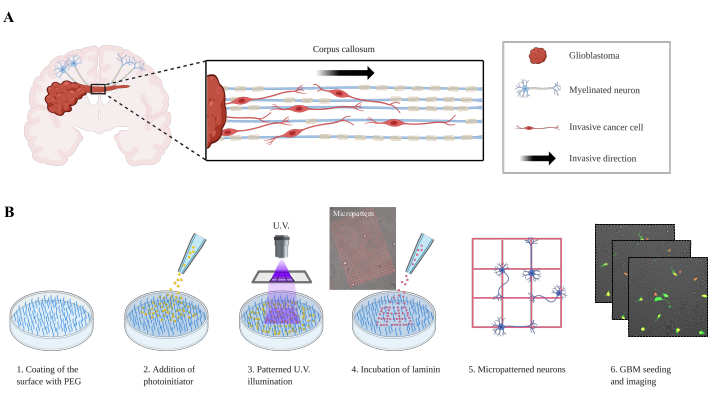
图1:在模式化神经元上迁移的胶质母细胞的实验设置。(A) 胶质母细胞通过语料库卡洛苏姆侵入反向半球的表示。(B) 实验设置。在第 1 步中,板面涂有防污 PEG 层。照片启动器在第 2 步中添加,覆盖整个涂层。在第 3 步中,通过显微镜的目标投射紫外线宽场图像,显微镜可局部激活光启动器分子。激活的光启动器局部切割PEG分子,并允许随后吸附层蛋白。在第5步中,神经元被播种并粘附在层压素阵列上。P3 (GFP/番茄核) 胶质母细胞然后沉积在神经元模式,图像被获取(步骤6)。缩写:PEG = 聚乙二醇;紫外线=紫外线:GFP=绿色荧光蛋白。请单击此处查看此图的较大版本。

图2:斐济工具演示和分析工作流程。(A) 当将宏添加到 Fiji.app 文件夹中时,称为Gliomas-神经元的工具在"更多工具"菜单中可用,|宏|工具集(左面板)。它由以下几个操作工具(右面板)组成。(B )网络工具:图像处理,用于以简化的表示方式绘制神经网络和胶质瘤细胞。ii.单细胞跟踪工具:图像处理,用于绘制和选择细胞运动区域,用于分析单细胞的位移。iii.跟踪工具:使用预安装的斐济跟踪插件的图像预处理步骤。iv.相对迁移工具:用于在手动选择的模式上确定相对单元格迁移的图像处理。某些参数可以通过左键单击工具按钮进行校准。缩写:CSE = 对比度拉伸增强;SED=索贝尔边缘探测器;F = 双重过滤;CM=转换为面膜:Sk=骨架化:EP = 消除颗粒;或(合并) = 选定投资回报率的联盟运营商;和=选定投资回报率的联合操作员。请单击此处查看此图的较大版本。
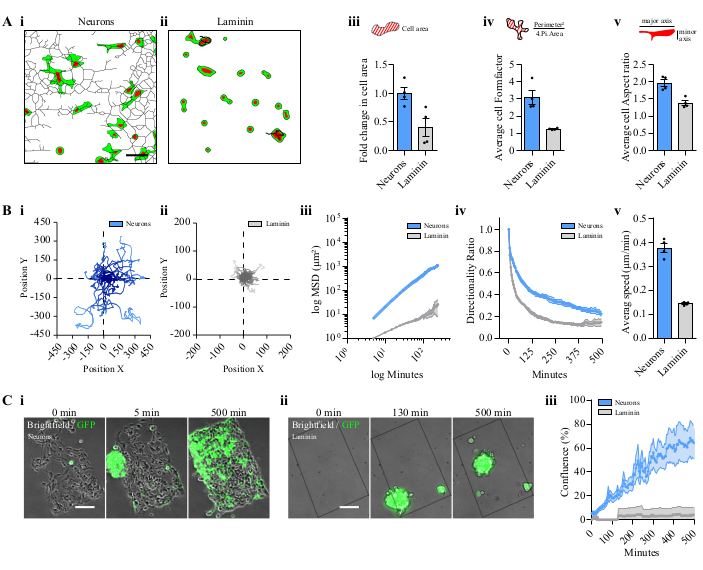
图3:对P3细胞或球体在图案神经元与层压素涂层的比较。(A) 在神经元或层压素上分离的P3 GFP/番茄核细胞的形状描述。在i.图案神经元或二。层压素涂层。比例杆 = 50μm. iii.模式化神经元或层压素的平均细胞面积。iv.形成因素是圆周与规范化区域与圆的区域的比率,提供细胞拉长和细胞分支的参数。v.纵横比是主轴与细胞小轴的比率。在iii、 iv和v 中,每个领域分析了 15 个单元格:4 个独立模式;数据表示为平均± S.E..M (B) 分离的 P3 细胞的跟踪分析。(i)图案神经元上的细胞图和(ii)层蛋白涂层上的细胞的一个代表性图表图。iii. P3细胞的MSD在神经元或层压素涂层上迁移。X/Y 值处于对数级。iv.方向性比率。v.平均细胞速度迁移。在iii、 iv和v 中,每个领域分析了 15 个单元格:4 个独立模式;数据表示为P3 GFP球体的平均±S.E..M(C)迁移分析。在(i)图案神经元或(ii)层蛋白涂层上 P3 球形的不同时间点的代表性图像。比例杆 =100μm. iii.以模式汇流为代表的球形迁移;4 个独立模式;数据表示为平均± S. e. .M 缩写: Gfp = 绿色荧光蛋白;S.E..M= 平均标准误差;MSD=平均方位移。请单击此处查看此图的较大版本。
视频1:神经元或层压素上的P3细胞记录超过8小时(每5分钟成像一次)。该视频显示P3单细胞迁移神经元(左)和层压素涂层(右)。细胞表示绿色荧光蛋白(GFP,绿色)和核番茄(红色)。酒吧 = 50μm.请点击这里下载此视频。
视频2:在神经元或层压素上的P3球体记录超过8小时(图像每5分钟)。该视频显示P3球形迁移在神经元(左)和层压素涂层(右)。细胞表示绿色荧光蛋白(GFP,绿色)。酒吧 = 100μm.请点击这里下载此视频。
讨论
胶质母细胞瘤广泛入侵帕奇马使用不同的模式:共同选择周围的血管,间歇性入侵,或在WMTs18入侵。后一种模式在文献中没有很好的特征,因为很难找到合适的体外或体内模型与WMT入侵有关。在这里,提出了一个简化的模型,其中培养啮齿动物神经元在层压涂层表面上进行图案,荧光GBM干细胞在神经元之上播种。本研究采用网格形状模式,改进肿瘤细胞附着、入侵和增殖的分析。GBM细胞在神经元顶部的迁移效率比直接在基质上迁移更有效,基质是这些实验中的层蛋白。在整个记录过程中,细胞形状发生变化,细胞表面积同时增加。GBM干细胞可能通过激活特定信号通路(即NORCH2/SOX2)4或来自神经元本身的分泌因子和信号被神经元区域吸引。该系统非常适合分析GBM细胞和神经元之间的分子交换,其中可能包括代谢物、神经递质或细胞因子。
最近,文卡捷什和合作者描述了一种神经胶质瘤突触的形成,其中谷氨酸激活其受体,AMPAR6。在 WMT 入侵 GBM 细胞期间,也涉及类似的过程吗?这可以通过这个实验系统使用药理抑制或遗传方法来研究。
应注意以下关键点。首先,在 PEGylation 步骤中,不应允许基板干燥,以避免影响防粘剂涂层的完整性。值得注意的是,可以用超纯水广泛清洗PEG-SVA溶液,并在氮流下干燥,然后将其储存在黑暗中的4°C。其次,用于分析神经元GBM细胞迁移的宏处于开放访问模式,与FiJi软件兼容。虽然这个宏和它的更新可以在GitHub上,它需要一个适当的校准来检测细胞。因此,在开始分析时手动检查样品作为质量控制可能是有用的。此处使用的系统的灵活性允许模式的不同形状,并行线将神经元分隔到不同程度。通过这种方法,可以模仿几个大脑结构的形状,正如在语料库中观察到的,这是人类大脑中最大的白质结构,主要观察到WMT入侵。另外,同一紫外光投影装置已被证明以z控制的方式15结构紫外敏感非粘合水凝胶,从而使球体形成标准化。
在此背景下,可以生成 3D 神经球来测试 GBM 入侵。该技术还可用于对其他脑细胞(如脑内皮细胞)进行模式化,以复制血管状形状或模仿微胶质或其他免疫细胞。因此,当与GBM细胞共同培养时,可以观察到脑细胞的协同或抑制作用。这项研究的一个局限性是使用胚胎大鼠神经元与人类GBM细胞共同培养,这可能不模仿真实的生理条件。克服这一缺点的一种方法是利用人类诱导的多能干细胞衍生神经元来避免物种交叉反应16。然而,GBM细胞在老鼠神经元上快速粘附并高效迁移,如这些实验所示。它也已被证明比大鼠脑细胞(施万细胞)可以有效地与人类神经元17共同培养。其他方法包括使用3D纳米纤维,这为研究胶质瘤细胞迁移12提供了一个很好的模型,但限制细胞-细胞接触,因为纳米纤维被认为是非活体结构。
此外,2D文化是减少的,简化了对细胞过程的观察,并可能限制其 在体内 语境10的有效性。因此,GBM细胞和神经元的3D共生是 体内 情况的更好代表。复杂的脑器官,如迷你脑18,已用于对抗文化入侵分析19。此处描述的战略的主要优点是共同培养方法的可重复性,即主要神经元在几何上受大小控制的微模式的限制,与注射的GBM细胞的相互作用不可能在其他地方发生。此外,由于紫外线投影系统的多功能性,神经元的空间组织可以调整,从而进一步优化。归根结底,这种仿生方法的开发和验证也有助于减少生物医学研究中使用的动物模型的数量。
披露声明
作者宣称他们没有利益冲突。
致谢
这项工作得到了ARC基金会2020年,联赛癌症(吉隆德委员会),ARTC,计划癌症2021年,INCA PLBIO的支持。阿尔韦奥勒得到国家雷彻奇(格兰特·拉贝克斯·布雷恩-10-LABX-43)的支持。乔里斯·古永是图卢兹大学医院(楚图卢兹)的奖学金获得者。
材料
| Name | Company | Catalog Number | Comments |
| (3-aminopropyl) triethoxysilane | Sigma | 440140-100ML | The amino group is useful for the bioconjugation of mPEG-SVA |
| 96-well round-bottom plate | Sarstedt | 2582624 | Used to prepare spheroids |
| Accutase | Gibco | A11105-01 | Stored at -20 °C (long-term) or 4 °C (short-term), sphere dissociation enzyme |
| B27 | Gibco | 12587 | Stored at -20 °C, defrost before use |
| Basic Fibroblast Growth Factor | Peprotech | 100-18B | Stored at -20 °C, defrost before use |
| Countess Cell Counting ChamberSlides | Invitrogen | C10283 | Used to cell counting |
| Coverslips | Marienfeld | 111580 | Cell culture substrate |
| Dessicator cartridges | Sigma | Z363456-6EA | Used to reduce mosture during (3-aminopropyl) triethoxysilane treatment |
| DPBS 10x | Pan Biotech | P04-53-500 | Stored at 4 °C |
| Fiji software, MTrack2 macro | ImageJ | Used to analyze pictures | |
| Flask 75 cm² | Falcon | 10497302 | |
| HBSS | Sigma | H8264-500ML | |
| Heparin sodium | Sigma | H3149-100KU | Stored at 4 °C |
| Laminin | 114956-81-9 | Promotes neuronal adhesion | |
| Leonardo software | loading of envisioned micropatterns | ||
| MetaMorph Software | Molecular Devices LLC | NA | Microscopy automation software |
| Methylcellulose | Sigma | M0512 | Diluted in NBM for a 2% final concentration |
| Neurobasal medium | Gibco | 21103-049 | Stored at 4 °C |
| Nikon TiE (S Fluor, 20x/0.75 NA) | inverted microscope equipped with a motorized stage | ||
| Penicillin - Streptomycin | Gibco | 15140-122 | Stored at 4 °C |
| PLPP | Alveole | PLPPclassic_1ml | Photoinitiator used to degrade the PEG brush |
| Poly(ethylene glycol)-Succinimidyl Valerate (mPEG-SVA) | Laysan Bio | VA-PEG-VA-5000-5g | Used as an anti-fouling coating |
| PRIMO | Alveole | PRIMO1 | Digital micromirror device (DMD)-based UV projection apparatus |
| Trypan blue 0.4% | ThermoFisher | T10282 | Used for cell counting |
| Trypsin-EDTA | Sigma | T4049-100ML | Used to detach adherent cells |
参考文献
- Shergalis, A., Bankhead, A., Luesakul, U., Muangsin, N., Neamati, N. Current challenges and opportunities in treating glioblastoma. Pharmacology Reviews. 70, 412-445 (2018).
- Scherer, H. J. The forms of growth in gliomas and their practical significance. Brain. 63, 1-35 (1940).
- Zagzag, D., et al. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1α/CXCR4 expression in glioblastomas. American Journal of Pathology. 173, 545-560 (2008).
- Wang, J., et al. Invasion of white matter tracts by glioma stem cells is regulated by a NOTCH1-SOX2 positive-feedback loop. Nature Neurosciences. 22, 91-105 (2019).
- Venkataramani, V., et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538 (2019).
- Venkatesh, H. S., et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545 (2019).
- Boyé, K., et al. The role of CXCR3/LRP1 cross-talk in the invasion of primary brain tumors. Nature Communications. 8, 1571(2017).
- Daubon, T., et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development. Nature Communications. 10, 1146(2019).
- Gritsenko, P. G., et al. p120-catenin-dependent collective brain infiltration by glioma cell networks. Nature Cell Biology. 22, 97-107 (2020).
- Guyon, J., et al. A 3D spheroid model for glioblastoma. Journal of Visualized Experiments: JoVE. (158), (2020).
- Strale, P. O., et al. Multiprotein Printing by Light?Induced Molecular Adsorption. Advanced Materials. , (2015).
- Rao, S. S., et al. Mimicking white matter tract topography using core-shell electrospun nanofibers to examine migration of malignant brain tumors. Biomaterials. 34, 5181-5190 (2013).
- Visweshwaran, S. P., Maritzen, T. A simple 3D cellular chemotaxis assay and analysis workflow suitable for a wide range of migrating cells. MethodsX. 6, 2807-2821 (2019).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysics Journal. 60, 910-921 (1991).
- Pasturel, A., Strale, P. -O., Studer, V. Tailoring common hydrogels into 3D cell culture templates. Advance Healthcare Materials. 9, 2000519(2020).
- Dolmetsch, R., Geschwind, D. H. The human brain in a dish: the promise of iPSC-derived neurons. Cell. 145, 831-834 (2011).
- Clark, A. J., et al. Co-cultures with stem cell-derived human sensory neurons reveal regulators of peripheral myelination. Brain. 140, 898-913 (2017).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26, 3203-3211 (2019).
- Han, M., et al. Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling. Brain. 143, 512-530 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。