Method Article
パターン化ニューロン上の神経膠芽腫幹細胞の共培養による移動と細胞相互作用の研究
* これらの著者は同等に貢献しました
要約
ここでは、パターン化されたニューロン上で神経膠芽腫(GBM)の移行を分析するための使いやすい共培養アッセイを提示する。我々は、ニューロン上のGBM細胞移動を容易に定量化するためのFiJiソフトウェアでマクロを開発し、ニューロンがGBM細胞侵襲能力を変更することを観察した。
要約
グレードIV悪性神経膠腫(GBM)は、その積極的な特性のためにヒト癌の最も致命的なタイプの一つです。これらの腫瘍の遺伝学の有意な進歩にもかかわらず、GBM細胞が健康な脳のパレンチマに侵入する方法はよく理解されていない。特に、GBM細胞が異なる経路を介して心房に侵入することが示されている。本稿の主な関心事は、白物庫(WMT)に沿った経路である。腫瘍細胞と腹分神経細胞成分との相互作用は十分に特徴付けられていない。本明細書において、GBM細胞浸潤に対するニューロンの影響を評価する方法が記載されている。本論文は、ニューロン上のGBM幹細胞様細胞の移動を解析することによってWMTの侵入を模倣する、高度な共培養イン・ニューロンを紹介する。ニューロンの存在下でのGBM細胞の挙動は、オープンソースおよびフリーアクセスソフトウェアを用いた自動追跡手順を使用して監視される。この方法は、多くの用途、特に機能的および機械学的研究、ならびにニューロンに対するGBM細胞の移動をブロックすることができる薬理学的薬剤の影響を分析するのに有用である。
概要
GBMを含む原発性悪性神経膠腫は壊滅的な腫瘍であり、GBM患者の中生存率は12〜15ヶ月である。現在の治療は、大規模な腫瘍大量切除術と化学療法に依存し、放射線療法と相まって、生存率を数ヶ月しか延長していない。治療障害は、血液脳関門(BBB)を横切る薬物送達不良と、血管内腔、髄液、およびWMTs1に沿った侵襲的な成長に密接に関連している。血管内侵入は血管の共同オプションとも呼ばれ、よく研究されたプロセスであり、分子機構が解明され始めています。しかし、WMTに沿ったGBM細胞浸潤のプロセスは十分に理解されていません。腫瘍細胞は、シェラーの二次構造に沿って健康な脳に移行する2.確かに、ほぼ1世紀前、ハンス・ヨアヒム・シェラーは、現在、脳血管内サテリトーシス、血管内サテリアトーシス、亜脈広がり、WMTに沿った侵略と呼ばれているGBMの侵襲的なルートを説明しました(図1A)。
一部のケモカインおよびその受容体は、例えば、間質細胞由来因子-1α(SDF1α)およびC-X-Cモチーフケモカイン受容体4(CXCR4)など、血管内皮増殖因子(VEGF4)には関与していないが、WMT浸潤因子3に関与しているようである。さらに最近では、細胞内NOTCH1-SOX2軸がGBM細胞4のWMT浸潤において重要な経路であることが示されている。著者らは、GBM幹細胞が部分的に非髄鞘のニューロン上で脳のパレンチマに侵入する方法を説明し、GBM細胞によるミエリン鞘の破壊を示唆した。2019年に3つの論文が連続してネイチャージャーナルに掲載され、グリオーマ開発における電気活動の役割を強調したマイルストーンに達しました5,6.Monjeと共同研究者による精細な研究は、神経膠腫の発達を促進するニューロリジン-3の分泌における電気活動の中心的な役割に光を当てた。
ウィンクラーと共同研究者は、侵襲的なステップにおいて重要であるGBM細胞(マイクロチューブ)間の接続、および最近、新たに記述された神経神経膠腫シナプスを介したGBM細胞とニューロン間の相互作用について説明した。これらの構造は、α-アミノ-3-ヒドロキシ-メチル-4-イソキサゾアプロピオン酸(AMPA)受容体のグルタミン酸刺激を好み、腫瘍の発生と浸潤を促進するGBM細胞膜に位置する。腫瘍細胞浸潤は、GBM患者において観察される転移または遠隔二次病巣の普及における中心的なプロセスである。トロンボシン−1のようなGBMの浸潤において重要であることがいくつかの要因が同定されている、変換成長因子β(TGFβ調節されたマトリセルタンパク質、またはケモカイン受容体CXCR3)7、8。
ここでは、ニューロンがラミニンの軌跡にパターン化され、GBM細胞が単一細胞またはスフェロイドとして播種されるGBMの浸潤を研究するための単純化されたバイオミメティックモデルが説明されている(図1B)。2つの実験設定は、GBM9、10、11で観察されるニューロンへの侵入を再現することを目的としています。このようなモデルは、機械的または化学的特性12を調節することによって細胞移動を研究することを可能にするアライメントナノファイバー生体材料(コアシェルエレクトロスピニング)として過去に開発されてきた。この記事で説明する共培養モデルは、このプロセスに関与する新しい分子経路を定義することによって、GBM細胞がニューロン上で脱出する方法をよりよく理解することを可能にする。
プロトコル
インフォームド・コンセントは、すべての患者(地元の倫理委員会の規則に従って、ノルウェーのベルゲンのハウケランド病院から)から得られました。このプロトコルはボルドー大学の人間と動物の研究倫理委員会のガイドラインに従います.妊娠中のラットは、ボルドー大学の動物施設に収容され、治療されました.E18タイミングの妊娠ラットの安楽死は、CO2を用いて行った。すべての動物の手順は、制度上のガイドラインに従って行われ、地元の倫理委員会によって承認されています。すべての商用製品は、 資料一覧で参照されています。
1. パターン化されたスライドの準備
- マイクロパフォーミング用基板調製
- 18 mmの円形ガラスカバーリップを空気/プラズマ活性化で5分間処理します。1時間のデシケーターに100 μLのトリエトキシシラン(3-アミノプロピル)トリエトキシシランを用いて、カバースリップを閉じたチャンバーに入れます。
- 10mMカーボネート緩衝液中のポリ(エチレングリコール)-スクシニミジルバレレート(分子量5,000(Peg-SVA))を100mg/mLでインキュベートし、pH>8、1時間用。超純水で広範囲にすすい、化学フードの下で乾燥させます。
注:この段階では、サンプルは暗い4°Cで保存して、さらに使用することができます。 - 光新生剤、4-ベンゾイルベンジルトリメチルアンモニウムクロリド(PLPP)をリン酸緩衝生理食塩分(PBS)に14.7mg/mLで加えます。
注: PLPP ゲルの濃縮形式も使用できます。これは、PEGブラシ(100 mJ/mm2)を劣化させるために必要な短い紫外線(UV)照明時間をもたらす。
- 光新刺激体ゲル堆積物
- スライド中央に沈着するPLPPゲル3μLと無数エタノール50μLの混合物を調製します。絶対エタノールが完全に蒸発するまで、サンプルを化学フードの下に置きます。
注:この段階では、サンプルは暗い4°Cで保存して、さらに使用することができます。
- スライド中央に沈着するPLPPゲル3μLと無数エタノール50μLの混合物を調製します。絶対エタノールが完全に蒸発するまで、サンプルを化学フードの下に置きます。
- ガラススライドマイクロパターニング
- ラダン室にカバースリップを取り付け、オートフォーカスシステムを装備した顕微鏡の電動ステージに置きます。
- 想定されるマイクロパターンに対応する画像をソフトウェアにロードします。これらのパラメータを適用する:複製4 x 4回、200 μmの間隔、1,000 mJ/mm2のUV線量。自動UV照明シーケンスの後、PLPPを複数のPBSを洗い流して洗い流します。
注:PLPPゲルを使用した場合は、脱イオン水で広範な水を流して取り除き、N2の流れで乾燥し、4°Cで保管してください。 - ラミニン(PBSで50 μg/mL)を30分間インキュベートします。PBSで広範囲に洗います。
注:精製された緑色蛍光タンパク質(GFP、PBS中10μg/mL)の蛍光溶液をラミニンと混合して、蛍光顕微鏡でマイクロパターンを可視化することができます。
2. 共培養のためのニューロンとGBM細胞の調製
- 胚性ラット海馬ニューロンの培養
- 胚(E18)ラットの海馬を解剖し、ハンクのバランス塩溶液(HBSS)/1 mM 4-(2-ヒドロキシェチル)-1-ピペラジネタンスルホン酸(HEPES)/ペニシリンストレプトマイシン溶液に15mLチューブで組織を移管する。海馬を乾燥させることなく余分な溶液を除去する。
- ペニシリン(10,000単位/mL)/ストレプトマイシン(10,000 μg/mL)および1 mM HEPESを添加したトリプシンエチレン酢酸(EDTA)5 mLを加え、37°Cで15分間インキュベートします。 HBSS/HEPES/ペニシリンストレプトマイシン溶液で2倍洗浄し、この溶液中に2〜3分間組織を残します。
- 2つの炎で磨かれたパスツールピペットを使用して組織を解約し、各組織で10倍上下にピペット化することで、発泡を最小限に抑えるように注意する。細胞を数え、細胞懸濁液の生存率を評価する。以下に示すように、マイクロパターン化されたカバーリップにニューロンをプレートします。
注:細胞生存率は抽出後85〜90%です。
- マイクロパターン化されたカバーリップ上のニューロンの細胞培養
- PBSでマイクロパターン化ガラススライドを再水和し、完全な神経細胞培養培地をインキュベートする。
- E18スプレイグドーリーラットから得られた海馬ニューロンを、3%の馬血清で濃縮された神経基底培地(NBM)のcm2当たり50,000細胞の密度でマイクロパターン化ガラスカバースリップの上に直接種付けします。マイクロパターン化されたニューロンをインキュベーター(37°C、5%CO2)に48時間置きます。
注:〜6時間後、主要な海馬ニューロンは、ラミニンマイクロパターンに付着して見ることができます。
- ニューロン上のヒトGBM幹細胞の共培養
注:この研究のために、膜GFP陽性および核トマト患者由来GBM細胞は、以前に公表されたプロトコル10に従って増殖した。- スフェロイド状の細胞が懸濁液で成長するにつれて、200×gで5分間の懸濁液を遠心分離する。5 mLのPBSでスフェロイドを洗浄し、細胞を0.5 mLの細胞解離試薬(材料表参照)で37°Cで5分間インキュベートします。
- 4.5 mLの完全なNBM(B27サプリメント、ヘパリン、線維芽細胞成長因子2、ペニシリン、ストレプトマイシンを補う)を加え、自動計数技術を使用して細胞を数える。
- 3%の馬の血清で富化NBMの微パターン神経培養の上に1,000 GBMの細胞をシード。プレートを37°C、5%CO2、湿度95%でインキュベートします。
3. ライブセルイメージング
- GBM細胞の播種直後に、サーモスタットチャンバーを装備した反転顕微鏡のステージ上にサンプルを置きます。ソフトウェアの多次元取得ツールボックスを使用して、複数の位置を記録するための電動ステージを備えた顕微鏡でライブセルイメージングを行います。温度(37°C)およびガス制御(5%CO2)環境で20倍の目的で、12時間にわたって5分ごとに明視野および蛍光GFP/トマト画像を取得します。
4. 画像解析
注: フィジーを使用して、IJ1 マクロ言語で記述された、2 次元 (2D) イメージ スタックは、半自動処理または、IJ1 マクロ言語で記述された、自家製のユーザー フレンドリツール (このアドレスで入手可能: https://github.com/Guyon-J/Coculture_Gliomas-Neurons/blob/main/README.md) を使用して処理されました (図 2A)。自動化されたワークフローと手順を 図 2Bに要約します。
- 神経回路ネットワーク解析 (図 2Bi)
- スタックのイメージを 1 つ選択します。 ネットワーク ツールを右クリックして、対応する [オプション] ダイアログ ボックスを開き、設定 ( しきい値 = トライアングル、Li、黄、 ガウス ブラー、 中央値 フィルタ = 1、2、3.) を調整して、画像の正確なセグメンテーションを作成します。次に 、[OK] をクリックします。
- [ネットワーク] ツールを左クリックすると、次の手順が自動的にアクティブになります。
- 選択した画像を複製し、3 つのカラーチャンネル(レッドグレー-グリーン)に 分割 します。
- グレーのチャンネル(明視野)を選択し、異なる領域間の分離を強化するために コントラストストレッチエンハンスメント (CSE)を実行します。 Sobel エッジ ディテクタ (SED)を使用して、[ エッジの検索 ]コマンドですでにグループ化されている 2D 信号処理畳み込み操作を実行します。
- ダブルフィルタリング(F)の場合は、ガウスブラーと中央値フィルタを適用してノイズを低減し、オブジェクト信号を滑らかにします。黒のピクセル (セル領域) と白のピクセル (背景) を持つバイナリ画像 (BIN-グレー) を取得する調整されたしきい値アルゴリズムを実行してマスク (CM) に変換します。小さな非ネットワーク化されたパーティクルを除去することにより、セル領域を単純なネットワーク (NET) にスケルトン化(Sk) し、NET イメージ内のパーティクル (EP) をフィルター処理します。
- 赤と緑のチャンネル(核と膜)の場合は 、二重フィルタリングを実行し、適合した閾値法 を使用してマスクに変換 し、[ パーティクルを分析]コマンドを使用して BIN-green で細胞の形態を決定できるようにします。
- 関心領域 (ROI) を OR (結合 ) 演算子で使用するすべてのチャネルを結合し、初期色を単純な RGB 画像に再割り当てします。
- 単細胞運動性解析(図2Bii)
- [単一セルトラッキング]ツールを右クリックして対応するオプションダイアログボックスを開き、設定を調整します(例えば、トレイルタイプ= 核または膜、しきい値= トライアングル、Li..、Z投影= 最大強度、合計スライス、ガウスブラーフィルタ、中央値フィルタ= 1、2、3.)を調整して、画像の正確なセグメンテーションを作成します。次に、[OK] をクリックします。
- [単一セルトラッキング]ツールを左クリックすると、次の手順が自動的にアクティブになります。
- グレーのチャンネルを削除します。時間(Tスタック)に応じてイメージスタックに対応する画像を生成するスタックに Z投影 を適用します。 ダブルフィルター し、セルによって残された軌跡を マスクに変換 します。小さなパーティクルを BIN-RED/緑のイメージに削除します。
- ROI を使用して、セル トレースの各輪郭を選択し、[オプション]ダイアログ ボックスの[エッジ検出をスキップ] チェックボックスをオンにして、後続の手順でこの前処理手順をスキップします。
- 元のスタック上の赤いチャネル(トレイルタイプ= nucleus)を分離します。1 つの ROI を選択し、外側の領域を削除します。すべての画像をダブルフィルターし、マスク(ビンレッド)に変換します。各二項核の重心X/Y位置を決定します。
- スプレッドシート ソフトウェア13に対して既に公開されているマクロを使用して、このセルの平均平方変位、方向比、平均速度を計算します。
- 多細胞追跡解析 (図 2Biii)
- トラッキングツールを右クリックして、対応するオプションダイアログボックスを開き、設定(閾値= トライアングル、Li、黄、ガウスブラー 、中央値フィルタ = 1、2、3.)など)を調整して、画像の正確なセグメンテーションを作成します。次に、[OK] をクリックします。
- 追跡ツールを左クリックすると、次の手順が自動的にアクティブになります。
- グレーのチャンネルを削除します。
- 赤と緑のチャンネルを分割し、ダブルフィルタを行い、マスクに変換します。
- 画像計算機を使用してチャンネルをマージ.コマンドはAND演算子で、膜内に見つかった核信号のみを残します。
注:フィジーのいくつかのプラグインは、同時にこのバイナリ前処理された画像内のいくつかのセルのX / Y位置を決定するために使用することができます( 資料表を参照してください)。
- 先に説明したマクロ13を用いて、これらのセルの軌道プロット、平均平方変位、方向比、平均速度を計算する。
- ニューラルマット上のスフェロイド移動 (図2Biv)
- [移行] ツールを右クリックして、対応する[オプション]ダイアログ ボックスを開き、設定 (しきい値= トライアングル、Li、黄、ガウス ブラー 、中央値フィルター = 1、2、3.) を調整して、画像の正確なセグメンテーションを作成します。次に、[OK] をクリックします。
- 移行ツールを左クリックすると、次の手順が自動的にアクティブになります。
- 赤いチャンネルを削除します。
- 緑と灰色のチャンネルを分割します。
- グレーのチャンネルの場合は、手動でニューロンマットの輪郭を 描 き、その面積を測定します。
- 緑のチャンネルでは、スタック をダブルフィルタ し、 マスクに変換します。パターンの外側の領域 (BIN) を削除し、各画像の二値化セル領域を決定します。
注: 上記のパラメータは、目的のアイコンを左クリックして値を変更することで調整されます。この処理は手動で行うことができます。ただし、多数の画像(取得あたり約100)、チャンネル(一般的には3チャンネル)、および処理ステップの場合は、自動化されたツールまたは半自動ツールが適しています。
結果
蛍光GBM細胞と共培養したパターン化されたニューロンは、プロトコルセクションに記載されているように調製し、追跡実験を行った。GBM細胞は、ニューロン上で移行しながら、それらの形状を素早く変更しました(図1B:パネル6 と ビデオ1)。細胞は、ランダムな動きで、ニューロンの拡張に沿って移行しました (ビデオ 1).蛍光GBM細胞と非蛍光ニューロンは容易に区別することができ、これはプロトコルセクション(図2)に記載されているように、フィジーマクロを使用して細胞の動きを追跡することを可能にした。フィジーは、画像処理と分析を容易にするオープンライセンスソフトウェアです。多数の画像の分析に比較的時間がかかる手動プロシージャは、マクロで自動化できます。画像は、ドラッグアンドドロップの手順でインポートされ、処理され、定量化され、ROIマネージャを使用して利用可能なデータが生成されます。
Fiji.app | マクロ|ツールセットフォルダに保存すると、Gliomas-ニューロンツールは[その他のツール]メニューで使用でき、いくつかのアイコンが表示されていました (図 2A)。アイコンをクリックして取得した画像処理のワークフローを図2B (i-iv)に示します。細胞形状はニューラルネットワーク上で解析できる(図2B、i)。セル追跡から複数のパラメータを得ることができます (図 2B, ii) または複数のセル ( 図2B,iii) 2 つの異なる画像プロセスを使用して。ニューロン上のスフェロイドGBM細胞による回復速度も解析できる(図2B,iv)。ニューロンに播種された細胞は、ニューロンの管に続く複数の突起を有する細長い形状を示した(図3A、i)が、ラミニン上で直接培養すると丸い形状を有していた(図3A、ii)。ニューロン上で培養された細胞は、ラミニン上で培養した場合には伸長しなかったものの、効率的に形状を改変した(図3A、iii-v)。薄い突起は、時には2つの細胞を連結し、後の段階でニューロンと共培養した細胞に見られた(ビデオ1)。
ニューロンに播種されたGBM細胞の回遊能力を、ラミニンに直接播種した細胞と比較した。ニューロンに播種された細胞は、ラミニン単独よりも大きな回遊能力を有していた(図3B、i,ii)。P3細胞のランダムな動きは、両方の条件で検出され、軌道プロットに示すように、ニューロン上のP3細胞の距離が大きい(図3B、i,ii)。細胞運動量は平均二乗変位(MSD)によって定量的に推定され、その対数表現は線形関数14を装着した(図3B、iii)。方向と平均速度は両方の条件について計算されました (図 3B, iv,v)。P3スフェロイドの細胞移動はまた、ニューロン上の経時の蛍光領域を検出し、ラミニン単独での移動と比較した(図3C、i、iiおよびビデオ2)。ニューロンを持つパターンの半分は、線形プロファイルで500分後にGBM細胞で覆われていました。しかし、回転楕円体はラミニンパターン(図3D、iii、ビデオ2)に付着しませんでした。
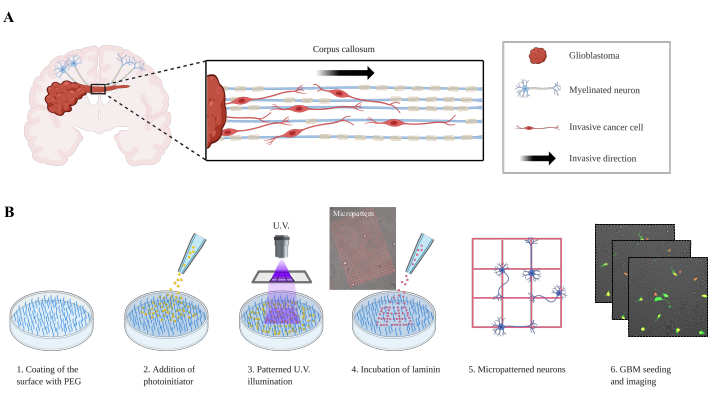
図1:パターン化されたニューロン上で移行する神経膠芽腫細胞の実験的設定(A) 脳梁を介して対側半球に侵入する神経膠芽腫細胞の表現。(B) 実験用セットアップ。ステップ1では、プレート表面が防汚PEG層で被覆される。フォトイチエーターは、ステップ2で、コーティング全体をカバーして追加されます。ステップ3では、UVワイドフィールド画像が顕微鏡の目的を通して投影され、光起即体分子を局所的に活性化する。活性化された光刺激体は、PEG分子を局所的に切断し、ラミニンのその後の吸着を可能にする。ステップ5では、ニューロンを播種し、ラミニンアレイに付着する。P3(GFP/トマト核)神経膠芽腫細胞を神経細胞パターンに堆積させ、画像を取得する(ステップ6)。略語: PEG = ポリエチレングリコール;紫外線 = 紫外線;GFP = 緑色蛍光タンパク質この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:フィジーツールのプレゼンテーションと分析のワークフロー(A) Gliomas-Neuronsと呼ばれるツールは、マクロがツールセット|のマクロ Fiji.app フォルダー |に追加されたときに、その他のツールメニューで利用できます。これは、以下に説明するいくつかのアクションツール(右パネル)で構成されています。(B) i.ネットワークツール: 画像処理は、簡略表示でニューラルネットワークと神経膠腫細胞を描画するために使用されます。ii.単一細胞追跡ツール:画像処理は、単一細胞の変位を分析するための細胞移動領域を描画し、選択するために使用されます。iii.トラッキングツール:事前にインストールされたフィジーの追跡プラグインを使用するための画像前処理の手順。相対移動ツール:画像処理は、手動で選択したパターン上の相対的な細胞の移行を決定するために使用されます。一部のパラメータは、ツールボタンを左クリックして調整できます。略語: CSE = コントラストストレッチの強調;SED = ソベルエッジ検出器;F = ダブルフィルタリング;CM = マスクに変換します。Sk = スケルトン化;EP = パーティクルの除去;OR (結合) = 選択された ROI の和演算子。AND = 選択した ROI の結合演算子。この図の大きなバージョンを表示するには、ここをクリックしてください。
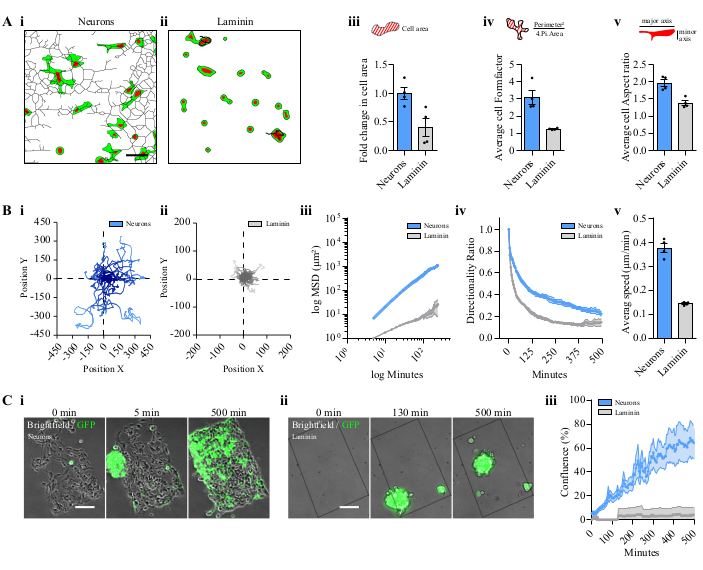
図3:パターン化されたニューロンと. ラミニンコーティングにおけるP3細胞またはスフェロイドの比較(A)解き分けたP3 GFP/トマト核 細胞の形状記述子をニューロン上またはラミニン上に置く。 i上の P3 セルの処理されたネットワークの例。パターン化されたニューロンまたは ii.ラミニンコーティング。スケールバー = 50 μm. iii. パターン化されたニューロンまたはラミニン上の平均細胞面積。 フォーム ファクターは、円に正規化された領域に対する円周の比率で、細胞伸長および細胞分岐に関するパラメータを提供します。 v. 縦横比は、セルの短軸に対する主軸の比率です。 iii, iv, および vでは、1 つのフィールドにつき 15 個のセルを分析しました。4つの独立したパターン。データは、S.E.M) (B) 解±解き取りされた P3 細胞の追跡分析の平均として表されます。ラミニンコーティング上の(i)パターン化されたニューロンと(ii)上の細胞の代表的なチャートプロット。 iii. ニューロン上またはラミニンコーティング上で移行するP3細胞のMSD。X/Y 値は対数スケールで表示されます。 iv. 方向性比。 v. 平均セル速度移行。 iii, iv, および vでは、1 つのフィールドにつき 15 個のセルを分析しました。4つの独立したパターン。データは、S.E.M±平均値として表されます(C) P3 GFPスフェロイドのマイグレーション分析.P3スフェロイドの異なる時点での代表的な画像(i)パターン化ニューロンまたは(ii)ラミニンコーティング上。スケールバー = 100 μm. iii. パターン合流によって表されるスフェロイド移動;4つの独立したパターン。データはS.E.M略語±平均として表されます: GFP = 緑色蛍光タンパク質;S.E.M= 平均の標準誤差MSD = 平均二乗変位。この図の大きなバージョンを表示するには、ここをクリックしてください。
ビデオ1:ニューロンまたはラミニン上のP3細胞は8時間にわたって記録された(5分ごとに画像化)。ビデオは、ニューロン(左)とラミニンコーティング(右)でのP3単細胞移動を示しています。緑色蛍光タンパク質(GFP、緑色)と核トマト(赤色)を発現する細胞。バー = 50 μm.こちらをクリックしてこのビデオをダウンロードしてください。
ビデオ2:8時間にわたって記録されたニューロンまたはラミニン上のP3スフェロイド(5分ごとに画像化)。ビデオは、ニューロン(左)とラミニンコーティング(右)でのP3スフェロイド移動を示しています。緑色蛍光タンパク質(GFP、緑色)を発現した細胞。バー = 100 μm.こちらをクリックしてこのビデオをダウンロードしてください。
ディスカッション
神経膠芽腫は、周囲の血管のコオプション、間質の侵略、またはWMTs18への侵入など、さまざまなモードを使用して広くパレンチマに侵入する。この後者のモードは、WMTの侵略に関連するインビトロまたはインビボモデルで適切な発見に困難があるため、文献で十分に特徴付けられていない。ここでは、培養げっ歯類ニューロンをラミニンコーティングされた表面にパターン化し、蛍光GBM幹細胞をニューロンの上に播種する簡略モデルが提案されている。この研究では、腫瘍細胞の付着、浸潤、増殖の解析を改善するために、グリッド形状パターンを用いた。GBM細胞は、これらの実験でラミニンであったマトリックス上で直接よりもニューロンの上に効率的に移動しました。記録処理を通してセル形状が変化し、同時にセル表面積が増加した。GBM幹細胞様細胞は、特定のシグナル経路(すなわち、NOTCH2/SOX2)4または分泌された因子およびニューロン自体からのシグナルの活性化を介してニューロン管によって引き付けられる可能性がある。このシステムは、GBM細胞とニューロンの分子交換を分析するのに適しており、代謝産物、神経伝達物質、またはサイトカインを含む可能性があります。
最近、Venkateshと共同研究者は、グルタミン酸がその受容体AMPAR 6を活性化する神経膠腫シナプスの形成を説明した。同様のプロセスは、GBM細胞のWMTの侵入中に関与していますか?これは薬理学的阻害または遺伝的アプローチを用いて、この実験システムで調べることができる。
以下の重要な点に注意する必要があります。まず、PEGylationステップの間に、基材は、抗接着コーティングの完全性に影響を与えることを避けるために乾燥させてはならない。注意すべきは、PEG-SVA溶液を超純水で広範囲に洗浄し、窒素の流れの下で乾燥させてから、暗闇の中で4°Cで貯蔵することが可能です。第二に、ニューロン上のGBM細胞移動を分析するために開発されたマクロは、オープンアクセスモードであり、FiJiソフトウェアと互換性があります。このマクロとその更新プログラムは GitHub で入手できますが、セルを検出するには適切なキャリブレーションが必要です。したがって、分析を開始する際に、サンプルを品質管理として手動でチェックすると便利です。ここで使用されるシステムの柔軟性は、異なる範囲にニューロンを分離する平行線で、パターンの異なる形状を可能にします。このアプローチにより、脳梁で観察されるいくつかの脳構造の形状を模倣することができ、ヒト脳内で最大の白質構造であるWMTの侵入が主に観察される。あるいは、同じUV光投射装置が、z制御された方法でUV感受性非粘着ヒドロゲルを15に構成することが示されており、スフェロイド形成の標準化を可能にする。
この文脈では、GBMの侵入をテストするために3D神経球を生成することができる。この技術は、脳内皮細胞などの他の脳細胞をパターニングして、血管状の形状を再現したり、ミクログリアまたは他の免疫細胞を模倣するために適用することもできる。従って、GBM細胞と共培養した場合に、脳細胞の相乗的または抑制効果が観察される。この研究の1つの制限は、ヒトGBM細胞との共培養における胚性ラットニューロンの使用であり、これは真の生理学的状態を模倣しない可能性がある。この欠点を克服する1つの方法は、ヒト誘導多能性幹細胞由来ニューロンを使用して、種の交差反応性16を回避する。しかし、これらの実験に示すように、GBM細胞はラットニューロン上で迅速に接着し、効率的に移行する。また、ラットの脳細胞(シュワン細胞)よりも、ヒトニューロン17と効率的に共培養できることが実証されている。他の方法としては、3Dナノファイバーの使用が挙げられるが、これは、グリオーマ細胞遊学12を研究するための良好なモデルを提供するが、ナノファイバーとしての細胞間接触を制限することは非生きている構造と考えられる。
さらに、2D培養は還元的であり、細胞プロセスの観察を単純化し、 生体内 コンテキスト10に対するそれらの有効性を制限し得る。従って、GBM細胞およびニューロンの3D共培養は 、インビボ 状況のより良い代表である。複雑な脳オルガノイドは、ミニ脳18のような、対立文化侵略アッセイ19で使用されてきた。本明細書に記載されている戦略の主な利点は、共培養アプローチの再現性、すなわち、一次ニューロンがサイズ制御されたマイクロパターンに幾何学的に拘束され、注入されたGBM細胞との相互作用は他の場所では起こり得ない。さらに、ニューロンの空間的な構成は、UV-投影システムの汎用性のために調整することができ、さらなる最適化を可能にする。最終的には、このようなバイオミメティックアプローチの開発と検証は、生物医学研究で使用される動物モデルの数を減らすのにも役立つ可能性があります。
開示事項
著者らは、利益相反はないと宣言している。
謝辞
この研究はフォンダシオンARC 2020、リーグ・コントル・ル・ガン(コミテ・ド・ラ・ジロンド)、ARTC、プランガン2021、INCA PLBIOによって支えられていました。アルベオールはアジェンス・ナショナル・デ・ラ・レシェルシュ(グラント・ラベックス・ブレインANR-10-LABX-43)によってサポートされています。ジョリス・ギヨンはトゥールーズ大学病院(CHUトゥールーズ)からフェローシップを受けています。
資料
| Name | Company | Catalog Number | Comments |
| (3-aminopropyl) triethoxysilane | Sigma | 440140-100ML | The amino group is useful for the bioconjugation of mPEG-SVA |
| 96-well round-bottom plate | Sarstedt | 2582624 | Used to prepare spheroids |
| Accutase | Gibco | A11105-01 | Stored at -20 °C (long-term) or 4 °C (short-term), sphere dissociation enzyme |
| B27 | Gibco | 12587 | Stored at -20 °C, defrost before use |
| Basic Fibroblast Growth Factor | Peprotech | 100-18B | Stored at -20 °C, defrost before use |
| Countess Cell Counting ChamberSlides | Invitrogen | C10283 | Used to cell counting |
| Coverslips | Marienfeld | 111580 | Cell culture substrate |
| Dessicator cartridges | Sigma | Z363456-6EA | Used to reduce mosture during (3-aminopropyl) triethoxysilane treatment |
| DPBS 10x | Pan Biotech | P04-53-500 | Stored at 4 °C |
| Fiji software, MTrack2 macro | ImageJ | Used to analyze pictures | |
| Flask 75 cm² | Falcon | 10497302 | |
| HBSS | Sigma | H8264-500ML | |
| Heparin sodium | Sigma | H3149-100KU | Stored at 4 °C |
| Laminin | 114956-81-9 | Promotes neuronal adhesion | |
| Leonardo software | loading of envisioned micropatterns | ||
| MetaMorph Software | Molecular Devices LLC | NA | Microscopy automation software |
| Methylcellulose | Sigma | M0512 | Diluted in NBM for a 2% final concentration |
| Neurobasal medium | Gibco | 21103-049 | Stored at 4 °C |
| Nikon TiE (S Fluor, 20x/0.75 NA) | inverted microscope equipped with a motorized stage | ||
| Penicillin - Streptomycin | Gibco | 15140-122 | Stored at 4 °C |
| PLPP | Alveole | PLPPclassic_1ml | Photoinitiator used to degrade the PEG brush |
| Poly(ethylene glycol)-Succinimidyl Valerate (mPEG-SVA) | Laysan Bio | VA-PEG-VA-5000-5g | Used as an anti-fouling coating |
| PRIMO | Alveole | PRIMO1 | Digital micromirror device (DMD)-based UV projection apparatus |
| Trypan blue 0.4% | ThermoFisher | T10282 | Used for cell counting |
| Trypsin-EDTA | Sigma | T4049-100ML | Used to detach adherent cells |
参考文献
- Shergalis, A., Bankhead, A., Luesakul, U., Muangsin, N., Neamati, N. Current challenges and opportunities in treating glioblastoma. Pharmacology Reviews. 70, 412-445 (2018).
- Scherer, H. J. The forms of growth in gliomas and their practical significance. Brain. 63, 1-35 (1940).
- Zagzag, D., et al. Hypoxia- and vascular endothelial growth factor-induced stromal cell-derived factor-1α/CXCR4 expression in glioblastomas. American Journal of Pathology. 173, 545-560 (2008).
- Wang, J., et al. Invasion of white matter tracts by glioma stem cells is regulated by a NOTCH1-SOX2 positive-feedback loop. Nature Neurosciences. 22, 91-105 (2019).
- Venkataramani, V., et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature. 573, 532-538 (2019).
- Venkatesh, H. S., et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 573, 539-545 (2019).
- Boyé, K., et al. The role of CXCR3/LRP1 cross-talk in the invasion of primary brain tumors. Nature Communications. 8, 1571(2017).
- Daubon, T., et al. Deciphering the complex role of thrombospondin-1 in glioblastoma development. Nature Communications. 10, 1146(2019).
- Gritsenko, P. G., et al. p120-catenin-dependent collective brain infiltration by glioma cell networks. Nature Cell Biology. 22, 97-107 (2020).
- Guyon, J., et al. A 3D spheroid model for glioblastoma. Journal of Visualized Experiments: JoVE. (158), (2020).
- Strale, P. O., et al. Multiprotein Printing by Light?Induced Molecular Adsorption. Advanced Materials. , (2015).
- Rao, S. S., et al. Mimicking white matter tract topography using core-shell electrospun nanofibers to examine migration of malignant brain tumors. Biomaterials. 34, 5181-5190 (2013).
- Visweshwaran, S. P., Maritzen, T. A simple 3D cellular chemotaxis assay and analysis workflow suitable for a wide range of migrating cells. MethodsX. 6, 2807-2821 (2019).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysics Journal. 60, 910-921 (1991).
- Pasturel, A., Strale, P. -O., Studer, V. Tailoring common hydrogels into 3D cell culture templates. Advance Healthcare Materials. 9, 2000519(2020).
- Dolmetsch, R., Geschwind, D. H. The human brain in a dish: the promise of iPSC-derived neurons. Cell. 145, 831-834 (2011).
- Clark, A. J., et al. Co-cultures with stem cell-derived human sensory neurons reveal regulators of peripheral myelination. Brain. 140, 898-913 (2017).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Reports. 26, 3203-3211 (2019).
- Han, M., et al. Interfering with long non-coding RNA MIR22HG processing inhibits glioblastoma progression through suppression of Wnt/β-catenin signalling. Brain. 143, 512-530 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved