Method Article
Экстракция хроматина из замороженной химерной ткани печени для анализа иммунопреципитации хроматина
В этой статье
Резюме
Этот протокол фокусируется на получении хроматина из замороженных тканей и подходит для иммунопреципитации сшивающего хроматина (X-ChIP) с последующим количественным анализом ПЦР (X-ChIP-qPCR) или подходами к секвенированию следующего поколения (X-ChIP-seq).
Аннотация
Сшивание иммунопреципитации хроматина (X-ChIP) является широко используемым методом для оценки уровней гистоновых меток и занятости факторов транскрипции на хроматине хозяина и/или патогена. Получение хроматина из тканей создает дополнительные проблемы, которые необходимо преодолеть для получения воспроизводимых и надежных протоколов, сравнимых с теми, которые используются для культивирования клеток. Разрушение и фиксация тканей являются важными шагами для достижения эффективного сдвига хроматина. Сосуществование различных типов клеток и кластеров также может потребовать разного времени сдвига для достижения оптимального размера фрагмента и препятствует воспроизводимости сдвига. Целью этого метода является получение надежных и воспроизводимых препаратов хроматина хозяина из замороженной ткани (печени), пригодных как для ChIP-qPCR, так и для секвенирования следующего поколения (NGS). Мы наблюдали, что комбинация измельчения тканей жидким азотом с последующей гомогенизацией приводит к повышенной воспроизводимости по сравнению только с гомогенизацией, поскольку она обеспечивает суспензию, состоящую в основном из диссоциированных одиночных клеток, которые могут быть эффективно срезаны. Кроме того, этап фиксации должен выполняться при мягком вращении, чтобы обеспечить однородную сшивку. Затем фиксированный материал пригоден для выделения ядер на основе буфера, чтобы уменьшить загрязнение цитоплазматического белка и патогенных ДНК и РНК (если применимо), избегая трудоемких градиентов центрифугирования. Последующая обработка ультразвуком завершит ядерный лизис и сдвиг хроматина, производя определенный диапазон размеров в соответствии с выбранными условиями сдвига. Диапазон размеров должен составлять от 100 до 300 нт для приложений NGS, в то время как для анализа ChIP-qPCR он может быть выше (300-700 нт). Такая адаптация протокола может значительно улучшить анализ хроматина из замороженных образцов тканей.
Введение
С момента своего открытия эпигенетическая регуляция в клетках млекопитающих получает все большее признание1, учитывая, что понимание таких механизмов обеспечит ключевую информацию не только в клеточной биологии, но и в биологии болезней и опухолей. Кроме того, инфекционные агенты могут также вызывать эпигенетические изменения хозяина 2, тогда как механизмклетки-хозяина может также влиять на хроматин патогенов, таких как персистирующие ДНК-вирусы 3,4. Это взаимодействие хозяина и патогена, по-видимому, играет роль в персистенции инфекции. 2
Благодаря обратимой ассоциации с ДНК гистоновые белки образуют комплекс, называемый нуклеосомой. Нуклеосомы, в свою очередь, достигают более высокого уровня организации, известного как хроматин. Известно, что ремоделирование хроматина жестко регулирует экспрессию генов, предоставляя или отказывая в доступе к транскрипционным факторам (TF)5. Эти факторы могут либо запускать, либо блокировать рекрутирование РНК-полимеразы II (PolII) на промоторы генов, влияя на синтез мРНК из матрицыДНК 6. Гистоновые белки содержат хвосты7, фланкирующие оба конца гистоновой складки, которые могут подвергаться посттрансляционным модификациям (PTM), обеспечивая жесткую регуляцию транскрипции гена структурными изменениями хроматина. Большинство гистоновых PTM расположены на хвостовом N-конце, причем ацетилирование и метилирование являются наиболее изученными PTM, хотя также сообщалось о фосфорилировании8, убиквитинировании9 и рибозилировании10 . Характеристика и изучение таких белков необходимы для глубокого понимания регуляции генов.
В настоящее время существует несколько хорошо зарекомендовавших себя методов и инструментов для изучения прямых взаимодействий ДНК с белками: электрофоретический анализ сдвига подвижности (EMSA), одногибридный анализ дрожжей (Y1H) и следы ДНК11. Однако эти методы сами по себе сосредоточены на единичных взаимодействиях ДНК-белка и неприменимы для полногеномных исследований. Другим ограничением этих методов является отсутствие ассоциации гистонов с исследуемыми сегментами ДНК. Таким образом, такие подходы не предназначены для отражения сложности транскрипционного механизма in vivo и не учитывают важные структурные изменения12 или другие необходимые ферменты/кофакторы13 , которые могут влиять (либо способствуя, либо ингибируя) связывание белка с ДНК.
Идея о том, что фиксация клеток с помощью таких агентов, как формальдегид (FA), может обеспечить in vivo снимок взаимодействий белка и ДНК, создала основу для разработки анализов иммунопреципитации хроматина (ChIP)14. Это, наряду с доступностью технологии количественной ПЦР (кПЦР) и высокоспецифичных антител, позволило разработать анализы ХИП-кПЦР. Впоследствии, появление методов секвенирования следующего поколения (NGS), стоимость которых становится все более доступной, позволило объединить эксперименты ChIP с подходами NGS (ChIP-seq), тем самым предоставив исследователям новые мощные инструменты, позволяющие исследовать регуляцию хроматина. В этих анализах изолированные или культивируемые клетки фиксируются с помощью дисукцинимидилглутарата (DSG) и/или FA, ядра выделяются, хроматин затем фрагментируется и осаждается интересующим антителом. Далее ДНК очищается и анализируется с помощью подходов ПЦР или NGS. В отличие от EMSA, Y1H и отпечатков ДНК, анализы ChIP способны обеспечить глобальный снимок взаимодействия белка с ДНК в клетке. Это обеспечивает гибкость и позволяет анализировать несколько локусов в одном образце. Однако, из-за характера анализа, ХИП может, в конечном итоге, обнаруживать не только прямые, но и косвенные взаимодействия, не предлагая точности вышеупомянутых методов, когда речь идет о прямых взаимодействиях белка с ДНК.
Протоколы получения хроматина из материала клеточной культуры хорошо зарекомендовали себя15 и обладают высокой воспроизводимостью, что позволяет пользователю получить хроматин, подходящий как для кПЦР, так и для NGS-подходов, за 1-2 рабочих дня. Тем не менее, получение высококачественного хроматина из целых тканей по-прежнему представляет собой проблему из-за необходимости диссоциации клеток внутри ткани при достижении оптимальной фиксации и сдвига хроматина. Кроме того, состав и морфология различных типов тканей варьируются, что требует корректировки существующих протоколов16,17. Использование криоконсервированной ткани создает дополнительные проблемы по сравнению со свежими образцами. Это связано с трудностью получения одноячеистой суспензии без обширных материальных потерь. Это приводит к неправильной резке, что затрудняет последующее применение. Тем не менее, доступ к замороженным образцам тканей, а не к свежим аналогам, не только повышает гибкость работы, но и может представлять собой единственный вариант для исследователей, работающих с образцами, полученными в результате продольных или сравнительных исследований. Было опубликовано несколько протоколов приготовления хроматина для замороженных тканей. Они в основном основаны на размораживании образца с последующим измельчением, ручной/машинной диссоциацией или измельчением жидким азотом на этапах18,19,20.
Здесь мы описываем оптимизированный методполучения хроматина 15 для замороженных нефиксированных образцов печени, который сочетает измельчение ткани в жидком азоте с гомогенизацией пестика для достижения воспроизводимого сдвига хроматина, подходящего для подходов X-ChIP, направленных на анализ как вирусных, так и хост-геномов.
протокол
Отбор образцов тканей химерных мышейпечени человека 21 был проведен в соответствии с директивой Европейского Союза 86/609/EEC и одобрен этическим комитетом города и земли Гамбург в соответствии с принципами Хельсинкской декларации.
1. Приготовление реагентов
- Приготовьте 1,25 М раствора глицина в деионизированной воде. Стерильный фильтр с фильтром размером пор 0,22 мкм. Хранить при температуре 4 °C.
- Приготовьте 5 М раствор хлорида натрия (NaCl). Хранить при комнатной температуре.
- Приготовьте раствор CaCl 2: 300 мМ CaCl2 и 10 мМ Tris-HCl pH 8 в деионизированной воде. Стерильный фильтр с фильтром размером пор 0,22 мкм и хранить при RT.
- Приготовьте 10%-ное разведение Triton X-100 в деионизированной воде. Хранить в RT.
- Приготовьте буфер Tris-EDTA: 1 мМ EDTA и 10 мМ Tris pH 8 в деионизированной воде. Хранить при температуре 4 °C.
- Подготовьте следующие буферы в соответствии с требуемым количеством:
- Приготовьте буфер A: 50 мМ Hepes-KOH pH 7,5, 140 мМ NaCl, 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 10% глицерина, 0,5% NP-40 и 0,25% Triton X-100 в деионизированной воде. Стерильный фильтр с фильтром размером пор 0,22 мкм. Хранить при температуре 4 °C.
- Приготовьте буфер B: 10 мМ Tris-HCl pH 8, 200 мМ NaCl, 1 мМ ЭДТА, 0,5 мМ эгтазиновой кислоты (EGTA). Стерильный фильтр с фильтром размером пор 0,22 мкм. Хранить при температуре 4 °C.
- Приготовьте буфер C: 1% SDS, 10 мМ ЭДТА и 50 мМ Tris-HCl pH 8 в деионизированной воде. Стерильный фильтр с фильтром размером пор 0,22 мкм. Хранить в RT.
- Приготовьте буфер для разбавления хроматина: 0,01% SDS, 1,1% Triton X-100, 1,2 мМ ЭДТА, 16,6 мМ Tris-HCl pH 8 и 166 мМ NaCl в деионизированной воде. Стерильный фильтр с фильтром размером пор 0,22 мкм. Хранить при температуре 4 °C.
2. Подготовка материала
- Собирайте сухой лед, лед и жидкий азот.
ВНИМАНИЕ: Обращайтесь с сухим льдом и жидким азотом с необходимой осторожностью, чтобы избежать ожогов. - Предварительно охладите центрифугу до 4 °C.
ПРИМЕЧАНИЕ: Этот шаг важен, чтобы избежать деградации белка и декросслинкинга во время этапов промывки, так как это снизит качество хроматина. - Положите стерильную тарелку на сухой лед и дайте ему остыть.
ПРИМЕЧАНИЕ: Убедитесь, что пластина достаточно большая, чтобы облегчить процесс резки. Рекомендуется 100-миллиметровая чашка Петри/чашка для культивирования клеток. - Выньте необходимую аликвоту глицина 1,25 М и дайте ей дойти до RT.
- Выньте необходимые аликвоты буфера A, B и PBS. Добавьте протеазу и/или ингибиторы деацетилазы и фосфатазы до достижения 1-кратной концентрации и оставьте их на льду.
- Выньте необходимую аликвоту буфера C, оставив ее на RT. Не добавляйте протеазу и/или ингибиторы деацетилазы и фосфатазы до тех пор, пока не будет указано иное.
- Выньте нужную аликвоту РТ ПБС.
ВНИМАНИЕ: Буфер C содержит додецилсульфат натрия (SDS). Примите соответствующие меры безопасности при приготовлении буфера.
ПРИМЕЧАНИЕ: SDS осаждается на льду, а ингибиторы протеазы и деацетилазы нестабильны при ЛТ. - Предварительно охладите раствор, заливая жидкий азот в его камеру, строго следуя инструкциям поставщика. Охладите металлический пестик в сухом льду не менее 5 минут.
ПРИМЕЧАНИЕ: Можно использовать миномет, альтернативный предложенному. Однако устройство, используемое в этом протоколе, благодаря своей своеобразной конструкции, позволяет работать с небольшим количеством ткани без существенных потерь в процессе измельчения. - Предварительно охладите гомогенизатор Dounce с помощью соответствующего пестика A на льду.
ПРИМЕЧАНИЕ: Пестик А имеет свободную посадку с гомогенизатором. Это позволяет получить одноклеточную суспензию без значительного лизиса клеток.
3. Тканевая сшивка
- Вырежьте около 50 мг замороженной ткани прямо на блюде на сухом льду с помощью скальпеля и пинцета.
ПРИМЕЧАНИЕ: Рекомендуется держать скальпель в точке RT, так как это облегчит процесс резки. Избегайте слишком сильного давления на скальпель, так как это увеличит риск разброса кусочков ткани за пределами области разреза. Отметим, что 50 мг ткани (в данном случае печени) должны дать около 5 миллионов клеток. Обратите внимание, что теплое лезвие разморозит режущую кромку. Однако, учитывая относительно большой размер куска ткани, это должно иметь ограниченный эффект. Когда меньшие кусочки разрезаются, может быть полезно использовать холодный скальпель, обращая внимание, чтобы избежать рассыпания ткани. - Положите разрезанную ткань в пробирку объемом 1,5 мл, уже охлажденную на сухом льду. Избегайте размораживания тканей.
- Переместите пробирку, содержащую ткань, в ступку, оставив ее там на 5 минут.
ПРИМЕЧАНИЕ: Если оставить образец в растворе, его температура снизится (с -80 °C до -196 °C). Это повышает его прочность и облегчает этап измельчения. - Надавливайте на образец с помощью предварительно охлажденного пестика до тех пор, пока не исчезнут твердые крошки.
ПРИМЕЧАНИЕ: Важно избегать нагрева пестика чрезмерными силами вращения, так как это приведет к оттаиванию образца. После измельчения каждого образца очищайте пестик 70% этанолом (EtOH) и снова дайте ему остыть на сухом льду. - Извлеките пробирку с образцом из раствора и добавьте 950 мкл ледяного PBS с необходимыми ингибиторами. Аккуратно пипеткой вверх и вниз до полной ресуспендирования образца. Немедленно перейдите к шагу 3.6.
- Перенесите тканевую суспензию в гомогенизатор и нанесите 20-30 ударов пестиком А для получения более мелкой суспензии. Избегайте пенообразования.
ПРИМЕЧАНИЕ: Количество штрихов должно быть оптимизировано в соответствии с консистенцией ткани. Этот шаг далее диссоциирует небольшие скопления клеток, полученные после измельчения. Неправильная гомогенизация может повлиять на эффективность сдвига. - Перелейте гомогенат в новую пробирку объемом 1,5 мл, уже предварительно охлажденную на льду.
- Центрифугу в течение 5 мин при 1 300 x g при 4 °C и осторожно удалите надосадочную жидкость.
- Полностью ресуспендируйте гранулы в 950 мкл RT PBS путем осторожного пипетирования и добавьте 63,6 мкл 16% ЖК без MeOH, чтобы получить конечную концентрацию 1%. Сразу переходите к шагу 3.10.
ВНИМАНИЕ: FA является токсичным химическим веществом. Обрабатывайте его под вытяжным шкафом с соблюдением надлежащих мер безопасности.
ПРИМЕЧАНИЕ: Неполная ресуспендирование может спровоцировать агрегацию клеток на этапе фиксации. Это затрудняет процесс лизиса и сдвига. - Вращайте 10 минут при RT. Сразу переходите к шагу 3.11
ПРИМЕЧАНИЕ: Вращение необходимо, чтобы избежать агрегатов. Количество времени, необходимое для фиксации, должно быть оптимизировано в соответствии с интересующей целью и типом образца. Важно отметить, что чрезмерное время фиксации может помешать правильной резке. - Добавьте 113 мкл 1,25 М глицина при RT до получения конечной концентрации 125 мМ и вращайте в течение 5 мин.
ПРИМЕЧАНИЕ: Глицин гасит реакцию фиксации, избегая чрезмерного сшивания. - Центрифуга при 1 300 x g в течение 3 мин при 4 °C.
- Откажитесь от надосадочной жидкости и осторожно ресуспендируйте гранулу, пипетируя 950 мкл ледяного PBS с необходимыми ингибиторами.
- Центрифуга при 1 300 x g в течение 3 мин при 4 °C.
- Повторите шаги 3.13-3.14 и сразу же приступайте к этапам выделения хроматина.
4. Выделение хроматина
- Добавьте в гранулу 950 мкл буфера А с необходимыми ингибиторами. Аккуратно перемешайте пипеткой до полного ресуспендирования гранул и вращайте 10 минут при 4 °C.
ПРИМЕЧАНИЕ: На этом этапе лизируется фиксированная одноклеточная суспензия без лизиса ядер. Это позволяет избавить образец от цитозольных белков и РНК. Продление времени лизиса может быть полезным для труднолизируемых клеток, увеличивая, однако, время обработки ткани. На этом этапе можно проверить препарат под микроскопом после окрашивания трипановым синим / DAPI, чтобы проверить размер кластеров и наличие единичных клеток. Тем не менее, отдельные ядра может быть нелегко оценить из-за фиксированного тканевого материала. - Центрифугу при 2 000 x g в течение 5 мин при 4 °C и осторожно удалите надосадочную жидкость.
- Добавьте в гранулу 950 мкл буфера B с необходимыми ингибиторами. Аккуратно перемешайте пипеткой до полного ресуспендирования гранул и вращайте 10 минут при 4 °C.
ПРИМЕЧАНИЕ: На этом этапе происходит вымывание буфера лизиса из подготовки ядер, чтобы избежать дальнейшего нежелательного лизиса. - Центрифуга при 2000 x g в течение 5 мин при 4 °C. Тем временем добавьте необходимые ингибиторы (то же, что и на этапе 2.5) в буфер C.
- Аккуратно удалите надосадочную жидкость.
- Энергично добавьте 300 мкл RT буфера C в гранулы и пипетку.
- Встряхните образец в течение 15-30 секунд и ненадолго покрутите пробирку, чтобы собрать капли на крышке.
ПРИМЕЧАНИЕ: Этот шаг важен для высвобождения и лизиса фиксированных ядер. Чтобы сохранить целостность образца и в то же время избежать осаждения SDS, храните образец до обработки ультразвуком в пластиковой стойке, хранящейся на льду, для поддержания температуры 9-11 °C.
5. Фрагментация хроматина
- Перенесите образец в три чистые пробирки объемом 0,65 мл, сертифицированные ультразвуком, обеспечивающие 100 мкл суспензии лизированных ядер на пробирку.
ПРИМЕЧАНИЕ: Можно использовать 1,5 мл сертифицированных ультразвуком пробирок с максимальным объемом 300 мкл. Для этих трубок необходим специальный держатель. 0,65 мл должны обеспечить более однородный сдвиг из-за меньшего объема образца на пробирку. - Обрабатывайте хроматин ультразвуком в течение 28 циклов с высокой интенсивностью с настройкой 30 с ВКЛ и 30 с ВЫКЛ. Убедитесь, что ванна ультразвукового аппарата должным образом охлаждена (лед или охлаждающее устройство).
ПРИМЕЧАНИЕ: Этот шаг нуждается в оптимизации почти в каждом случае. Пользователь должен иметь в виду, что увеличение времени резки приведет к получению более мелких и однородных фрагментов; Однако это может увеличить вероятность снижения качества хроматина. Выберите наименьшее количество циклов, обеспечивающее необходимый размер фрагмента. Во время оптимизации этого шага полезно выполнить ядерное окрашивание, чтобы проверить, было ли количество циклов достаточным для лизирования большинства ядер. - Перенесите обработанный ультразвуком хроматин в новую пробирку объемом 1,5 мл, предварительно охлажденную на льду.
- Добавьте 30 мкл 10% раствора Triton X-100 и встряхните в течение 5-10 с.
ПРИМЕЧАНИЕ: Triton X-100 связывает SDS, предотвращая дальнейшее осаждение при 4 ° C. Итоговое количество Triton X-100 всегда должно составлять 1%. - Центрифуга при 16 000 x g в течение 15 мин при 4 °C.
- Переложите надосадочную жидкость в чистую пробирку объемом 1,5 мл, предварительно охлажденную на льду.
- ПРИМЕЧАНИЕ: Надосадочная жидкость содержит срезанный хроматин и должна казаться прозрачной. Гранула содержит «не поддающиеся сдвигу» остатки, и она должна оставаться довольно маленькой (в основном коричневой в случае ткани печени). Обратите внимание на признаки неудачной резки: раствор хроматина, который не стал более прозрачным, и размеры гранул, аналогичные тем, которые были на шаге 4.5.
6. Очистка ДНК
- Перенесите 10-25 мкл срезанного хроматина в новую пробирку и добавьте буфер C, чтобы достичь конечного объема 200 мкл. Храните оставшуюся часть хроматина при -80 ° C до дальнейшего использования. При необходимости процедура может быть прервана на этом этапе и образец хранится при температуре -20 °C.
- Добавьте 8 мкл 5 M NaCl и инкубируйте не менее 6 ч при 65 °C в нагревательном блоке при встряхивании при 1000 об/мин.
ПРИМЕЧАНИЕ: На этом этапе удаляются сшивки хроматина. Безопаснее продлить декросслинкинг на ночь, когда это возможно. Наличие NaCl делает процесс более эффективным. - Дайте образцам остыть при РТ в течение 5 минут и добавьте 2 мкл РНКазы А.
- Инкубировать в течение 1 ч при 37 °C при встряхивании при 1000 об/мин.
- Извлеките образцы из нагревательного блока и добавьте 7 мкл 300 мМ CaCl 2 и2 мкл протеиназы K.
- Установите нагревательный блок на 56 °C и выдерживайте в течение 30 минут при встряхивании при 1000 об/мин. Тем временем подготовьте одну пробирку для разделения фаз для каждого образца, центрифугируя их при 16 000 x g в течение 1 мин при 4 ° C.
ПРИМЕЧАНИЕ: Эти специальные трубки облегчают разделение фаз во время экстракции фенол-хлороформа нуклеиновых кислот. - Извлеките трубки из нагревательного блока и дайте им уравновеситься при RT в течение 3 минут.
- Перенесите 400 мкл образца в предварительно центрифугированную пробирку с разделением фаз.
- Добавьте 400 мкл раствора фенол-хлороформ-изоамилового спирта (ЧКВ) и встряхните в течение 5 с.
ВНИМАНИЕ: PCI является высоколетучим и токсичным соединением. Пожалуйста, обращайтесь с ним с необходимыми мерами безопасности под вытяжным шкафом. - Центрифуга при 16 000 x g в течение 5 мин при 4 °C.
- Добавьте 400 мкл хлороформа и встряхните в течение 5 с.
ВНИМАНИЕ: Хлороформ является высоколетучим и токсичным соединением. Пожалуйста, обращайтесь с ним с необходимыми мерами безопасности под вытяжным шкафом.
ПРИМЕЧАНИЕ: Этот шаг вымывает возможные остатки фенола, которые могут помешать последующим приложениям ПЦР. - Центрифуга при 16 000 x g в течение 5 мин при 4 °C.
- Перенесите 400 мкл верхней фазы в новую пробирку объемом 1,5 мл, куда добавляли 24 мкл 5 М NaCl и 0,75 мкл гликогена. Кратковременный вихрь.
- Добавьте 1,055 мкл 100% EtOH и тщательно перемешайте. Обеспечьте правильное перемешивание.
- Инкубировать при -80 °C в течение 1 часа или при -20 °C в течение ночи (вкл.).
ПРИМЕЧАНИЕ: Этот шаг осаждает срезанную ДНК; Для максимизации выхода рекомендуется выбирать инкубацию ON. - Центрифуга при 16 000 x g в течение 30 мин при 4 °C.
- Осторожно удалите надосадочную жидкость, обращая внимание на то, чтобы не вывихнуть гранулы.
- Добавьте 500 мкл холодного 70% EtOH. Осторожно наклоните трубку, чтобы гранулы были вымыты.
ПРИМЕЧАНИЕ: Этот шаг необходим для удаления остатков солей, которые могли выпасть в осадок вместе с нуклеиновыми кислотами. Соли могут мешать другим последующим применениям. - Центрифуга при 16 000 x g в течение 15 мин при 4 °C.
- Осторожно удалите всю надосадочную жидкость и дайте гранулам высохнуть при RT.
ПРИМЕЧАНИЕ: Инкубация трубки на нагревательном блоке при 37 °C сократит время, необходимое для сушки. - Добавьте 50 мкл раствора Tris-EDTA (TE-Buffer) и поместите трубку на нагревательный блок при температуре 37 °C на 5-10 минут при встряхивании при 300 об/мин.
ПРИМЕЧАНИЕ: Этот шаг обеспечивает растворение гранул. Здесь протокол можно приостановить, и образец можно хранить при температуре 4 °C до 1 недели или при -20 °C для более длительного хранения. - Проведите анализ ДНК на 1% агарозном геле.
7. Анализ размера ДНК
- Приготовьте 1% агарозный гель, смешав 1 г агарозы на 100 мл проточного буфера (т.е. трис-ацетат-ЭДТА (ТАЭ) или трис-борат-ЭДТА (TBE)). Нагрейте суспензию до полного растворения агарозы. Добавьте 10 мкл EtBr на каждые 100 мл раствора агарозы перед заливкой раствора геля.
ВНИМАНИЕ: EtBr является интеркаляторным агентом ДНК, который, как известно, является канцерогеном. Пожалуйста, обращайтесь с ним с необходимыми мерами безопасности под вытяжным шкафом.
ПРИМЕЧАНИЕ: Настоятельно рекомендуется окрашивание EtBr (непосредственно в геле или после прогона). Другие ДНК-интеркалирующие красители плохо работали в наших руках при работе с мазками ДНК. Узкие загрузочные колодцы обеспечивают лучшее разрешение по сравнению с более широкими. - Смешайте 10 мкл образца с 2 мкл 6-кратного загрузочного красителя. Затем загрузите 10 мкл образца в гель и запускайте его до тех пор, пока последняя полоса загрузочного красителя не пробежит 2/3 геля. Обязательно добавьте лестницу ДНК.
- Изобразите гель и проверьте, не попадает ли размер мазка в диапазон для желаемого применения.
Если хроматин проходит контроль качества, его можно использовать для последующих применений.
Результаты
Получение хроматина является важным шагом в достижении успешного ХИП. Чтобы получить хроматин хорошего качества из замороженных образцов, мы должны обеспечить эффективное разрушение тканей перед фиксацией, чтобы избежать присутствия тканевых комков, которые могут помешать эффективному сдвигу. На рисунке 1 показан сводный конвейер протокола. Одного измельчения недостаточно для полной диссоциации ткани, поскольку она производит клеточные кластеры переменного размера и несколько отдельных клеток (рис. 1а). Связывая первую стадию измельчения с гомогенизацией Dounce, количество тканевых комков сильно уменьшается, а остальные меньше (рис. 1b). После этапов фиксации и лизиса количество видимых одиночных ядер (рис. 1c) увеличивается, в то время как типичный сферический вид теряется. После обработки ультразвуком в течение 28 циклов ядерное окрашивание (Hoechst 33258 / DAPI) в основном больше не видно. Это действительно признак успешной стрижки (рис. 1d). После декросслинкинга аликвоты хроматина и визуализации ДНК на агарозном геле успешную резку можно распознать по наличию фрагментов в диапазоне 100-300.н. (рис. 2а) Количество ДНК может варьироваться в зависимости от состава подготовленного куска ткани. Такой хроматин может быть успешно использован для ХИП-кПЦР. Как показано на рисунке 2b, хроматин может быть успешно осажден антителами H3K4me3, H3K27ac (модификации, связанные с активными генами) и H3K27me3 (модификация, связанная с молчаливыми генами). Открытая рамка считывания хромосомы 1 43 (C1orf43), протеасома 20S субъединицы бета 2 (PSMB2) и промоторные области глицеральдегид-3-фосфатдегидрогеназы (mGapdh) были обогащены H3K4me3 и H3K27ac по сравнению с промоторными областями гомеобокса C13 (HOXC13), гомеобокса C12 (HOXC12) и промотора миелинового фактора транскрипции 1 мыши (mMyt1) (таблица 1). Это связано с тем, что C1orf43, PSMB2 и mGapdh конститутивно транскрибируются в печени, в то время как HOXC13, HOXC12 и mMyt1 подавляются. H3K27me3 демонстрирует противоположное поведение, подтверждающее успех анализа ChIP. Тот факт, что печень этих мышей является химерой, позволил проанализировать как мышиный, так и человеческий хроматин. Кроме того, тот же хроматин может быть успешно использован для экспериментов ChIP-seq. После этапа секвенирования чтения были выровнены по индексу, состоящему как из мышиного, так и из человеческого геномов, чтобы уменьшить количество невыровненных фрагментов. Впоследствии показания были разделены по видам и дополнительно проанализированы с помощью EaSeq22. Затем интенсивность сигнала измеряли в месте начала транскрипции (TSS) каждого гена, и результат сортировали по интенсивности сигнала H3K4me3. На рисунках 3a и 3c показано заметное присутствие H3K4me3 и H3K27ac в TSS для значительной части генов как в мышином, так и в человеческом хроматине. Кроме того, H3K27me3 антикоррелирует с H3K4me3/H3K27ac. H3K27me3 присутствует на всей длине гена, а не только в TSS, как ожидается от этого PTM. На рисунках 3b и 3d показан кластер HOXC/HoxC, известный тем, что он обогащен H3K27me3 и транскрипционно неактивен как в печени мышей, так и в печени человека. Профилирование H3K4me3 и H3K27ac показывает пики для этих двух PTM, в то время как интенсивность сигнала H3K27me3 имеет тенденцию быть ниже и более распределенной.
Из-за сложности подготовки хроматина может произойти чрезмерная фиксация, время лизиса или обработки ультразвуком может быть неоптимальным, скопления больших клеток могут сохраняться или неадекватное обращение с образцом может быть неадекватным. Это все события, влияющие на качество препарата. В некоторых случаях обогащение фрагментов хроматина в пределах правильного размера все еще будет присутствовать или будет смещено к большему размеру. В других случаях может произойти потеря материала из-за преждевременного лизиса или неудачной резки. На рисунке 4 показаны некоторые примеры таких отрицательных и неоптимальных результатов. Полосы 3 и 4 показывают обогащение размера фрагмента от 200 до 800.н. Однако ясно, что размер фрагмента колеблется от 100 до >10 000.н. В полосах 5 и 6 наблюдается обогащение в диапазоне 100-250.н. с явной потерей материала во время подготовки. Это может объяснить, почему обработка ультразвуком произвела меньшие фрагменты. Полоса 7 показывает немного неоптимальную подготовку с увеличенным диапазоном фрагментов, в то время как полоса 8 показывает почти полную потерю материала. Это может быть вызвано преждевременным ядерным лизисом или недостаточной диссоциацией тканей с последующей потерей после этапа 5.5.

Рисунок 1: Обзор протокола приготовления хроматина. Снимки были сделаны после измельчения тканей (а), дополнительной ручной гомогенизации (б), после ядерного лизиса (с) и после обработки ультразвуком (до центрифугирования) (d). Ядерное окрашивание проводили с помощью Hoechst 33258/DAPI. Масштабная линейка = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативный сдвиг хроматина и его качество, оцененное с помощью ХИП-кПЦР . 1% агарозный гель с фрагментированными образцами хроматина по протоколам из разных препаратов хроматина. Добавляется контроль несрезанного хроматина, чтобы заранее убедиться в отсутствии деградации хроматина / ДНК (а). Срезанный хроматин был протестирован на качество с помощью анализа ChIP-qPCR. Антитела H3K4me3, H3K27ac и H3K27me3 использовали для осаждения свежеприготовленного хроматина. (b ) анализ кПЦР проводили на активных промоторах человека (C1orf43 и PSMB2), мышей (Gapdh) и неактивных промоторах человека (HOXC13, HOXC12), мышей (Myt1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
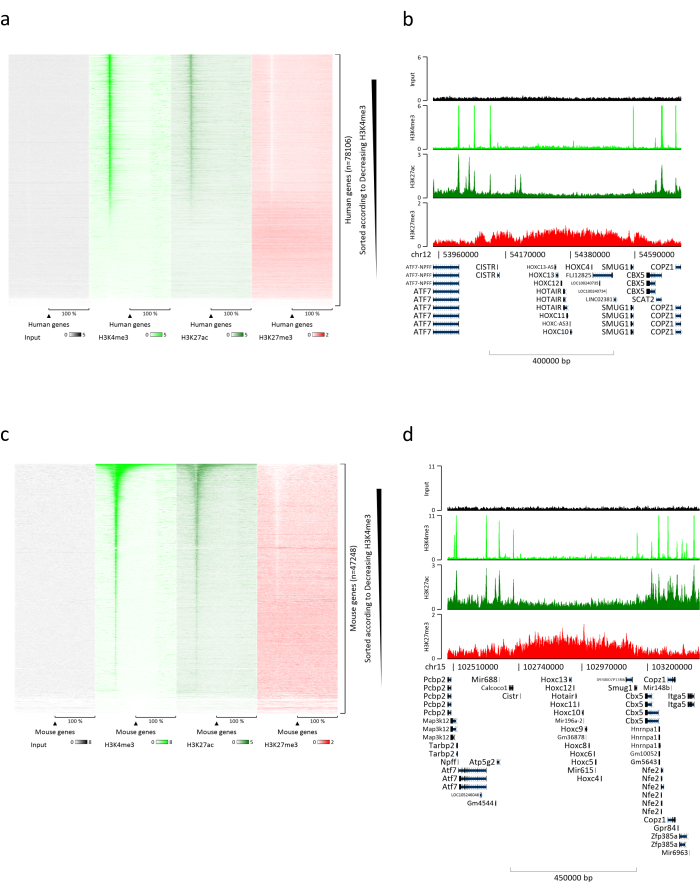
Рисунок 3: Репрезентативный анализ ChIP-seq. Показания были выровнены с индексом, созданным как с геномами человека, так и с геномами мыши (hg19 и mm10). После выравнивания человеческие и мышиные показания были разделены и дополнительно проанализированы. Тепловая карта генов человека, где сигнал был количественно определен в TSS и показан в порядке убывания интенсивности H3K4me3 (a). Пример кластера генов человека с подавленными генами (кластер HOX), окруженного активными генами (b). Тепловая карта мышиных генов, где сигнал был количественно определен в TSS и показан в порядке убывания интенсивности H3K4me3 (c). Пример мышиного генного кластера подавленных генов (Hox-кластер), окруженного активными генами (d). Все показанные данные были нормализованы EaSeq на миллион прочтений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Субоптимальные и неудачные препараты хроматина. 1% Агарозный гель с фрагментированными образцами хроматина по протоколу. На рисунке показан несрезанный хроматин, используемый в качестве контроля (полоса 2), неоптимальная резка (полоса 3-4), оптимальная резка с явными потерями материала (полоса 5-6), субоптимальная резка (полоса 7) и обширные потери материала (полоса 8). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Название букваря | Последовательность | |
| Промотор C1orf43 | Вперёд | AGTGGGTGGAGAATGCAGAC |
| Обратный | GAGATTACCCCACCCCCCCCCCCC | |
| Промоутер PSMB2 | Вперёд | CTTATTCAACCCCCGACAAA |
| Обратный | ГАТГААГГАГГГГГГГТГАГГА | |
| Дистальный промотор HOXC13 | Вперёд | GAGCCCGAGATTCCAAC |
| Обратный | TTATGCCCAGTTTGGGGTA | |
| Дистальный промотор HOXC12 | Вперёд | AAAGCTTCCCACTGCAAAGA |
| Обратный | AAATCTGGGGGCGAACTACT | |
| Промоутер mGAPDH | Вперёд | GGTCCAAAGAGAGGGAGGAG |
| Обратный | GCCCTGCTTATCCAGTCCTA | |
| Промоутер mMYT | Вперёд | CAGCCCAATTCTAGCCACAT |
| Обратный | CCAAAGCAGGGGAGTAGGAG |
Таблица 1: Список праймеров кПЦР для активных и неактивных генов, используемых для анализов ChIP-qPCR.
Обсуждение
Получение хроматина из замороженной ткани остается проблемой из-за количества этапов, которые необходимо оптимизировать для достижения воспроизводимых и надежных результатов. Большинство уже опубликованных протоколов16,23 требуют измельчения тканей перед ручной диссоциацией (дунтингом). Мы старались максимально избегать шагов, которые могли бы спровоцировать деградацию белка до фиксации образца. Стадия измельчения уже используется в замороженных препаратахпечени 24 и делает ручную диссоциацию более легкой и воспроизводимой (см. рис. 2а). При использовании раствора, специально разработанного для пробирок объемом 1,5 мл (см. Протоколы), потеря образца в процессе измельчения уменьшается, что позволяет обрабатывать небольшие количества ткани, такие как образцы биопсии печени. В принципе, можно использовать прямую гомогенизацию тканей без каких-либо этапов измельчения; Однако, по нашему опыту, гомогенизация тканей без предварительного измельчения имеет худшую воспроизводимость, и появление проблем для последующих применений было выше (данные не показаны).
Большинство проблем, возникающих при получении хроматина из тканей, связано с природой этих образцов и неспособностью должным образом проверить, достаточно ли малы клеточные кластеры для фиксации без потери качества. Более того, проверка каждой аликвоты на каждом этапе займет много времени, увеличивая вероятность деградации белка.
Фиксация (этап 3.9) является фундаментальной и важной частью подготовки хроматина. Из-за особенностей ткани этап фиксации был отложен до тех пор, пока ткань не будет гомогенизирована. Преимущество такой отложенной стадии фиксации заключается в получении более однородной клеточной суспензии. Тем не менее, мы признаем, что в случае особо чувствительных к манипуляциям целей может потребоваться выполнить фиксацию непосредственно перед шагом 3.6. Это поможет защитить чрезвычайно чувствительные белки или PTM, хотя это может увеличить размер клеточных кластеров, что при фиксации может привести к неоднородному сдвигу. Концентрация раствора ЖК, используемая в протоколе, является стандартной, однако ее можно модифицировать, чтобы попытаться улучшить общую фиксацию. Выбранное здесь время фиксации также отражает стандартные условия, обычно используемые в полевых условиях. В случае более высокой концентрации фиксирующего раствора время фиксации может быть уменьшено, а в случае меньшего количества его следует увеличить. Оператор должен учитывать, что изменение времени фиксации может либо привести к чрезмерной фиксации образца, либо создать место для деградации белка. В случае нацеливания на осаждение больших комплексов (или их части) и ТФ было бы целесообразно выполнить двухступенчатую фиксацию с использованием решения DSG с последующим FA25,26. DSG в этом случае стабилизирует белок-белковые взаимодействия, в то время как формальдегид действует в основном на прямые ДНК-белковые взаимодействия27.
Оператор должен учитывать возможность внедрения набора для очистки ДНК на основе колонки, начиная с шага 6.7, который является более быстрым и не использует токсичные соединения. Тем не менее, всегда будет определенное количество несвязанной ДНК, которая будет потеряна. По этой причине мы предлагаем использовать классическую фенол-хлороформную экстракцию с последующим осаждением EtOH. Кроме того, перед запуском агарозного геля (этап 7.2) может быть полезно измерить концентрацию ДНК и загрузить одинаковое количество для каждой лунки, чтобы иметь более четкую картину.
Ограничение этого протокола связано с тем, что мы исследовали и использовали этот протокол только с использованием образцов печени, полученных от химерных мышей28 печени человека. Сама по себе печень состоит из эпителиальной и соединительной ткани29. В случае заболевания может присутствовать фиброзная ткань и жировая ткань30,31, создавая дополнительные проблемы во время разрушения тканей. Тем не менее, мы признаем, что наш протокол не может быть использован на костной, мышечной и жировой ткани без оптимизации этапов диссоциации и обработки ультразвуком. Следует отметить, что каждая ткань требует некоторой оптимизации из-за отсутствия протокола, подходящего для всех из них, например, для образцовклеточных культур 15. Тем не менее, мы считаем, что с небольшой оптимизацией или вообще без нее этот протокол может быть успешно применен к другим тканям, которые имеют сходство с печенью по составу, таким как ткани легких, кишечника, желудка, поджелудочной железы или почек.
Наш протокол также был успешно использован для анализа TF и модификаций гистонов на ковалентно закрытой эписоме ДНК HBV (cccDNA)32. Это открывает возможность применить такой подход к другим вирусным геномам, влияющим на печень, таким как цитомегаловирус человека33 (hCMV) и аденовирусычеловека 34 (HAdV). Не исключено, что можно будет проанализировать другие ДНК-вирусы, которые устанавливают персистирующую инфекцию в других тканях, такие как вирус саркомыКапоши 35 (KHSV), вирус простого герпеса36 (HSV1/2), вирус Эпштейна-Барр37 (EBV).
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Исследование было поддержано Немецким научно-исследовательским обществом (DFG) грантом Мауры Дандри (SFB 841 A5) и землей Гамбург в рамках исследовательской программы (LFF-FV44: EPILOG).
Мы хотели бы поблагодарить доктора Тассило Фольца, Ивонн Ладигес и Аннику Вольмари за техническую помощь и критическое прочтение рукописи. Д-ру Томасу Гюнтеру и профессору Адаму Грундхоффу за предоставление очень полезных предложений и наборов праймеров для анализа ChIP-qPCR.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22µm sterile syringe filter | Labsolute | 7699822 | |
| 1.5 mL Safeseal tubes | Sarstedt | 7,27,06,400 | |
| 6x orange loading dye | Thermofisher | R0631 | |
| Benchtop refrigerated centrifuge | |||
| Bioruptor NGS | Diagenode | ||
| Blade or Scalpel | |||
| Calcium chloride dihydrate | Carl Roth | HN04 | |
| Chloroform | Sigma Aldrich (Merck) | C2432 | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | |
| Deacetylase Inhibitor | Active Motif | 37494 | |
| Dounce tissue grinder set | Sigma Aldrich (Merck) | DWK885300-0001-1EA | |
| EDTA 500 mM solution | PanReac AppliChem | A4892 | |
| EGTA | Sigma Aldrich (Merck) | E4378 | |
| EtBr | Carl Roth | 2218 | Concentration 10mg/mL |
| Ethanol absolute | CHEMSOLUTE | 2273 | |
| Glycerol | Sigma Aldrich (Merck) | G9012 | |
| Glycin | Carl Roth | 0079 | |
| Glycogen | Roche | 10901393001 | Concentration: 20mg/mL |
| Heating block | |||
| HEPES | Sigma Aldrich (Merck) | H4034 | |
| LE Agarose | Biozym | 840000 | |
| Liquid nitrogen cooled mini mortar | Bel-Art | H37260-0100 | |
| MeOH free Formaldehyde 16% | Thermofisher | 28908 | |
| NP-40 | Roche | 11332473001 | |
| PBS 1x | Thermofisher | 10010015 | |
| Pefabloc SC-Protease-Inhibitor | Sigma Aldrich (Merck) | 11429868001 | |
| Phase Lock Gel - Heavy | QuantaBio | 2302830 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | Sigma Aldrich (Merck) | P3803 | |
| Potassium chloride | Carl Roth | 6781 | |
| Potassium hydroxyde | Merck | 105033 | |
| Proteinase K | Lucigen | MPRK092 | Concentration: 50 µg/µL |
| RNAse A | Lucigen | MRNA092 | Concentration: 5 mg/mL |
| SDS 10% solution | PanReac AppliChem | A3950 | |
| Sodium carbonate anhydrous | Carl Roth | A135 | |
| Sodium chloride | Sigma Aldrich (Merck) | S7653 | |
| Sterile Petri dishes | Sarstedt | 83,39,02,500 | |
| Tris-HCl solution | Sigma Aldrich (Merck) | T2694 | |
| Triton-X100 | Sigma Aldrich (Merck) | X100 |
Ссылки
- Waddington, C. H., Pantelouris, E. M. Transplantation of nuclei in newt's eggs. Nature. 172 (4388), 1050-1051 (1953).
- Silmon de Monerri, N. C., Kim, K. Pathogens hijack the epigenome: A new twist on host-pathogen interactions. American Journal of Pathology. 184 (4), 897-911 (2014).
- Knipe, D. M., et al. Snapshots: chromatin control of viral infection. Virology. 435 (1), 141-156 (2013).
- Tropberger, P., et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 5715-5724 (2015).
- Sproul, D., Gilbert, N., Bickmore, W. A. The role of chromatin structure in regulating the expression of clustered genes. Nature Reviews Genetics. 6 (10), 775-781 (2005).
- Fischle, W., Wang, Y., Allis, C. D. Histone and chromatin cross-talk. Current Opinion in Cell Biology. 15 (2), 172-183 (2003).
- Ling, X., Harkness, T. A., Schultz, M. C., Fisher-Adams, G., Grunstein, M. Yeast histone H3 and H4 amino termini are important for nucleosome assembly in vivo and in vitro: redundant and position-independent functions in assembly but not in gene regulation. Genes & Development. 10 (6), 686-699 (1996).
- Zhang, L., Eugeni, E. E., Parthun, M. R., Freitas, M. A. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma. 112 (2), 77-86 (2003).
- Wang, H., et al. Role of histone H2A ubiquitination in Polycomb silencing. Nature. 431 (7010), 873-878 (2004).
- Hassa, P. O., Haenni, S. S., Elser, M., Hottiger, M. O. Nuclear ADP-ribosylation reactions in mammalian cells: where are we today and where are we going. Microbiology and Molecular Biology Reviews. 70 (3), 789-829 (2006).
- Dey, B., et al. DNA-protein interactions: methods for detection and analysis. Molecular and Cellular Biochemistry. 365 (1-2), 279-299 (2012).
- Hager, G. L., McNally, J. G., Misteli, T. Transcription dynamics. Molecular Cell. 35 (6), 741-753 (2009).
- Nagy, Z., Tora, L. Distinct GCN5/PCAF-containing complexes function as co-activators and are involved in transcription factor and global histone acetylation. Oncogene. 26 (37), 5341-5357 (2007).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Gunther, T., Theiss, J. M., Fischer, N., Grundhoff, A. Investigation of viral and host chromatin by ChIP-PCR or ChIP-Seq analysis. Current Protocols in Microbiology. 40, 11-21 (2016).
- Cotney, J. L., Noonan, J. P. Chromatin immunoprecipitation with fixed animal tissues and preparation for high-throughput sequencing. Cold Spring Harbor Protocols. 2015 (4), 419 (2015).
- Haim, Y., Tarnovscki, T., Bashari, D., Rudich, A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 305 (9), 1172-1177 (2013).
- Castellano-Castillo, D., et al. Chromatin immunoprecipitation improvements for the processing of small frozen pieces of adipose tissue. PLoS One. 13 (2), 0192314 (2018).
- Savic, D., Gertz, J., Jain, P., Cooper, G. M., Myers, R. M. Mapping genome-wide transcription factor binding sites in frozen tissues. Epigenetics Chromatin. 6 (1), 30 (2013).
- Perna, A., Alberi, L. A. TF-ChIP method for tissue-specific gene targets. Frontiers Cell Neuroscience. 13, 95 (2019).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. 67 (3), 542-552 (2018).
- Lerdrup, M., Johansen, J. V., Agrawal-Singh, S., Hansen, K. An interactive environment for agile analysis and visualization of ChIP-sequencing data. Nature Structural & Molecular Biology. 23 (4), 349-357 (2016).
- Perna, A., Alberi, L. A. TF-ChIP Method for Tissue-Specific Gene Targets. Frontiers in Cellular Neuroscience. 13, 95 (2019).
- Liang, N., Fan, R., Goni, S., Treuter, E. Preparation of Frozen Liver Tissues for Integrated Omics Analysis. Methods in Molecular Biology. 1951, 167-178 (2019).
- Liu, Z., et al. Proteomic and network analysis of human serum albuminome by integrated use of quick crosslinking and two-step precipitation. Scientific Reports. 7 (1), 9856 (2017).
- Singh, A. A., et al. Optimized ChIP-seq method facilitates transcription factor profiling in human tumors. Life Science Alliance. 2 (1), 201800115 (2019).
- Aoki, T., et al. Bi-functional cross-linking reagents efficiently capture protein-DNA complexes in Drosophila embryos. Fly. 8 (1), 43-51 (2014).
- Allweiss, L., Dandri, M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection. Journal of Hepatology. 64, 17-31 (2016).
- Krishna, M. Microscopic anatomy of the liver. Clinics in Liver Disease. 2, 4-7 (2013).
- Tannapfel, A., et al. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease. Virchows Archiv. 458 (5), 511-523 (2011).
- Schuppan, D., Afdhal, N. H. Liver cirrhosis. Lancet. 371 (9615), 838-851 (2008).
- Allweiss, L., et al. Therapeutic shutdown of HBV transcripts promotes reappearance of the SMC5/6 complex and silencing of the viral genome in vivo. Gut. , 322571 (2021).
- Gerna, G., Kabanova, A., Lilleri, D. Human cytomegalovirus cell tropism and host cell receptors. Vaccines. 7 (3), (2019).
- Echavarria, M. Adenoviruses in immunocompromised hosts. Clinical Microbiology Reviews. 21 (4), 704-715 (2008).
- Frohlich, J., Grundhoff, A. Epigenetic control in Kaposi sarcoma-associated herpesvirus infection and associated disease. Seminars in Immunopathology. 42 (2), 143-157 (2020).
- Nicoll, M. P., Proenca, J. T., Efstathiou, S. The molecular basis of herpes simplex virus latency. FEMS Microbiology Reviews. 36 (3), 684-705 (2012).
- Thorley-Lawson, D. A., Hawkins, J. B., Tracy, S. I., Shapiro, M. The pathogenesis of Epstein-Barr virus persistent infection. Current Opinion in Virology. 3 (3), 227-232 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены