Method Article
Модель сингенной ортотопической остеосаркомы Sprague Dawley Rat с ампутацией для контроля скорости метастазирования
В этой статье
Резюме
Здесь описана сингенная ортотопическая имплантация с последующей процедурой ампутации остеосаркомы со спонтанным легочным метастазированием, которая может быть использована для доклинического исследования биологии метастазирования и разработки новых терапевтических средств.
Аннотация
Самый последний прогресс в лечении остеосаркомы (ОС) произошел в 1980-х годах, когда было показано, что многоагентная химиотерапия улучшает общую выживаемость по сравнению с одной только хирургией. Для решения этой проблемы целью исследования является уточнение менее известной модели ОС у крыс с комплексным гистологическим, визуальным, биологическим, имплантационным и ампутационным хирургическим подходом, который продлевает выживание. Мы использовали иммунокомпетентную, беспородную модель Sprague-Dawley (SD), сингенную модель крысы с имплантированной клеточной линией ОС UMR106 (происходящей от SD-крысы) с ортотопическими имплантатами опухоли большеберцовой кости у 3-недельных самцов и самок крыс для моделирования педиатрической ОС. Мы обнаружили, что у крыс развиваются воспроизводимые первичные и метастатические опухоли легких, и что ампутации конечностей через 3 недели после имплантации значительно снижают частоту легочных метастазов и предотвращают неожиданные смерти. Гистологически первичные и метастатические ОС у крыс были очень похожи на ОС человека. Используя методы иммуногистохимии, исследование показывает, что ОС крыс инфильтрированы макрофагами и Т-клетками. Исследование экспрессии белка клеток ОС показывает, что эти опухоли экспрессируют киназы семейства ErbB. Поскольку эти киназы также высоко экспрессируются в большинстве ОС человека, эта модель крыс может быть использована для тестирования ингибиторов пути ErbB для терапии.
Введение
Остеосаркома (ОС) является наиболее распространенной первичной опухолью кости у детей, подростков и молодых людей. Самый последний прогресс в лечении ОС произошел в 1980-х годах, когда было показано, что многоагентная химиотерапия улучшает общую выживаемость по сравнению с одной только хирургией1. ОС развивается во время быстрого роста костей, обычно происходящего в длинных трубчатых костях, таких как бедренная кость, большеберцовая кость и плечевая кость. Они характеризуются остеолитическим, остеобластным или смешанным внешним видом с заметной периостальной реакцией2. Химиотерапия и хирургическая резекция могут улучшить исход для пациентов с 5-летней выживаемостью для 65% пациентов2,3. К сожалению, пациенты с ОС высокой степени с метастатическим заболеванием имеют 20% выживаемость. ОС вторгается регионально и метастазирует в основном в легкие или другие кости и более распространен у мужчин. Наиболее насущной потребностью для этих молодых пациентов является новая терапия, которая предотвращает и устраняет жизнеспособность отдаленных метастазов.
Рассмотрены доклинические модели ОС4,5,6,7 и разработано несколько доступных иммунокомпетентных моделей с использованием ампутации ортотопической ОС. В 2000 году была разработана важная модель с использованием мышей BALB/c с ортотопической сингенной ОС и ампутацией8. По сравнению с этой моделью мыши, модель крыс основана на генетически перерожденных и в 10 раз более крупных животных, что приводит к некоторым преимуществам. Крысиная модель UMR106 была разработана из 32P индуцированной ОС у крысы Sprague Dawley (SD), которая была выведена в клеточную линию9. В 2001 году ортотопическая имплантация UMR106-01 была впервые описана в имплантированные большеберцовые кости афимических мышей с быстрым, последовательным развитием первичной опухоли и рентгенологическими, гистологическими особенностями, общими с ОС у человека. Легочные метастазы развивались и зависели от ортотопического размещения UMR106 в костном микроокружении10. В 2009 году Yu et al.11 установили воспроизводимую ортотопическую модель ОС бедренной кости крысы с использованием клеток UMR106 у более крупных самцов SD-крыс. Успешные имплантации опухолей и частота метастазирования в легкие у крыс без ампутации были аналогичны данным, представленным здесь. В этом исследовании была выполнена дополнительная ампутация к модели с использованием молодых крыс, которая показала, что сроки первичного удаления опухоли имеют решающее значение для моделирования ОС, особенно связанных с метастатическим прогрессированием. Благодаря этому уточнению ампутация и визуализация in vivo улучшают эту модель для доклинических исследований для оценки новых лекарств для ОС.
протокол
Все процедуры и эксперименты с участием крыс проводились в соответствии с протоколами, утвержденными Комитетом по уходу и использованию животных Джона Хопкинса.
1. Протокол клеточной культуры SD rat OS UMR-106
- Выращивают клетки в DMEM, дополненном 10% (v/v) FBS, пенициллином (10 Ед/мл)-стрептомицином (10 Ед/мл) при 37 °C в увлажненной 5% co2 атмосфере. Проводят эксперименты с использованием клеток с проходами2-8 12.
2. Протокол внутриробной инъекции клеток ОС
ПРИМЕЧАНИЕ: Вовремя спаренные беременные крысы SD рожают в животном учреждении, и в возрасте 3 недель используются пометы (поскольку клеточная линия UMR 106 является сингенной для крыс SD, облучение не требуется).
- Индукция
- Поместите крысу в индукционную камеру среднего размера и индуцируйте анестезию 2%-3% изофлурана. Следите за глубиной анестезии животного непрерывно путем рефлекторного защемления пальца ноги, частоты дыхания и характера.
- Вставьте нос в носовой конус. При необходимости закрепите лентой.
- Удалите волосы на правой ноге до вентральной и спинной нижней части живота с помощью машинок для стрижки или используйте средство для депиляции. Поместите крысу в положение лежа на спине.
- Очистите хирургическую область асептически, используя 70% этанола и разбавите хлоргексидина ацетат или разбавите бетадин. Начните вокруг области колена и скрабируйте круговыми движениями как проксимально, так и дистально. Повторите этот шаг три раза. Для имплантации опухоли драпировка не используется.
- Нанесите глазную смазку на оба глаза крысы, чтобы предотвратить высыхание роговицы, вызванное анестезией. Поместите крысу на грелку с низким нагревом. Убедитесь, что крыса имеет нормальную температуру тела (37 ° C) и нормальную частоту дыхания.
- Хирургия
- Включите изофлуран при ~1,5%-2% (для обслуживания). Убедитесь, что животное находится в адекватной плоскости анестезии из-за отсутствия рефлекса защемления пальца ноги. Если нет, увеличьте процент изофлурана до 2,5%.
- Отметьте стерильную иглу (приблизительно 22 G) на расстоянии 10 мм от наконечника для указания глубины для вставки.
- Вставьте иглу на 10 мм вниз в диафиз большеберцовой кости, войдя в согнутое колено в середине большеберцового плато, протягивая иглу через метафиз в диафиз, используя легкое сверлоподобное движение, чтобы сделать отверстие. Извлеките иглу.
- Загрузите клеточную суспензию в шприц Гамильтона непосредственно перед инъекцией в большеберцовую кость. Для этого аккуратно перемешайте клетки перед втягиванием в шприц, так как гравитация заставляет клетки оседать в нижней части трубки.
ПРИМЕЧАНИЕ: Ячейки можно хранить в трубке объемом от 1,5 до 2 мл (при комнатной температуре) перед втягиванием в шприц Гамильтона (100 мкл) после тщательного перемешивания. Клетки могут храниться при комнатной температуре в течение 2-3 ч во время процедуры имплантации. Всегда проверяйте жизнеспособность клеток в трубке до и после сеанса имплантации. Исключение синего трипана является самым простым методом оценки жизнеспособности клеток. - После того, как кость будет пересечена первой иглой, вставьте вторую (иглу меньшего диаметра, также отмеченную на 10 мм) иглу, прикрепленную к шприцу Гамильтона объемом 100 мкл, загруженному клетками. Убедитесь, что игла вставлена до отметки 10 мм в то же отверстие, простирающееся в диафиз.
- Осторожно выгрузите 20 мкл 75 000 суспензии клеток ОС в PBS в диафиз и полость костного мозга.
ПРИМЕЧАНИЕ: Игла не должна колебаться в кости и должна чувствовать себя в безопасности. Если игла легко двигается, кора, возможно, была пересечена на диафизе. Повторите введение еще раз, чтобы получить более жесткое размещение перед инъекцией клеток. - Извлеките иглу Гамильтона из кости.
ПРИМЕЧАНИЕ: Если образуется небольшая капля крови, примените легкое давление. Если в месте прокола образуется прозрачная капля жидкости, игла, возможно, не была выдвинута достаточно далеко в кости, и суспензия опухолевой клетки могла просочиться обратно через отверстие. Запишите это в примечаниях, но, как правило, имплантация опухоли будет успешной. При наличии опыта процедура имплантации опухоли должна занимать 5 минут на крысу. Со стажем опухолевая имплантация клеток в кость станет проще. Случайное введение клеток в мышцу вокруг кости, может не привести к микроокружению опухоли, необходимому для легочного метастазирования.
- Выздоровление
- Убедитесь, что крыса нормотермическая. Поместите крысу в клетку с грелкой, помещенной под клетку для восстановления.
- После полного бодрствования, подвижности и хорошего дыхания вводите крысам бупренорфин (1,0-1,2 мг/кг SC).
ПРИМЕЧАНИЕ: Чтобы получить доступ к Бупренорфину, проконсультируйтесь с учреждением, чтобы увидеть варианты одобрения через ветеринарный персонал для размещения заказа. - Перемещайте крыс обратно в чистые клетки и контролируйте один раз в день, каждую неделю.
3. Измерение и мониторинг
- Измеряют размер опухоли через 9-10 дней после имплантации, а затем каждые 2 дня до 3 недель после имплантации для установления скорости роста. Измерьте максимальный диаметр большеберцовой кости с помощью электронного или ручного суппорта. Сохраните данные в электронной таблице с формулой для расчета объема опухоли. Измерьте контралатеральную (не имплантированную большеберцовую кость) в качестве исходного уровня.
ПРИМЕЧАНИЕ: Имплантированные диаметры задних конечностей используются в качестве суррогата для размера опухоли. Задние конечности измеряются перпендикулярно длинной оси большеберцовой кости при наибольшем диаметре для двух измерений, вентральных/дорсальных и средних/боковых на конечности. Расчетный объем опухоли рассчитывается по формуле11:Объем опухоли(мм3)= наибольший диаметр (мм) x наименьший диаметр (мм)2/2. - Рассмотрим крыс для ампутации выживания или химиотерапии, когда опухоли приближаются к 15 мм в наибольшем размере или через 3 недели после имплантации опухоли. Контралатеральная конечность составляет около 7-9 мм у большинства крыс в этом возрасте.
4. Доксорубицин внутривенное введение
- Обезболивают крыс 2% изофлураном. Подготовьте кожу над яремной веной тремя хирургическими промываниями с использованием бетадина и спирта, как описано13.
- При тщательном рассечении визуализируйте правую или левую яремную вену. Вставьте иглу в вышележащую мышцу, а затем направьте к голове крысы в просвет яремной вены, как это визуализируется в яремной вене, передней к грудной мышце.
- Когда игла вводится в яремную вену, осторожно втягивайте кровь в шприц, чтобы обеспечить правильное введение. Можно поверить, что игла проходит через вену, но игла находится под веной, а не в просвете. Если яремная вена становится слишком маленькой для инъекций при тупом рассечении, чтобы обнажить яремную вену, используйте другую яремную вену для инъекции.
- Вводят доксорубицин (2 мг/кг) медленно в течение 1 мин в объеме 100-150 мкл. Раствор может быть визуализирован внутривенно в яремную вену во время родов.
- Вводите аналогичные объемы нормального физиологического раствора контрольным крысам.
- Снимите иглу и мягко надавите на вену стерильной марлей.
- Закройте разрез кожи с помощью 3-4 намотанных зажимов. Удалите зажимы через 7-10 дней после инъекции.
ПРИМЕЧАНИЕ: Крысы обычно не пытаются удалить металлические зажимы, но кусают и снимают швы. Метод яремной инъекции предпочтительнее инъекций в хвостовые вены для доксорубицина, поскольку любой препарат, который просачивается за пределы сосуда, вызывает некроз хвоста, что может потребовать ампутации хвоста.
5. Протокол ампутации задних конечностей
- Индукция
- Поместите крысу в индукционную камеру среднего размера и индуцируйте анестезию 2%-4% изофлураном. Следите за крысой непрерывно на предмет глубины анестезии.
ПРИМЕЧАНИЕ: Индукционная камера подается в канистру с древесным углем, а любые другие газы удаляются с помощью стола с нисходящей тягой, используемого для хирургии. - Вставьте нос в носовой конус. При необходимости закрепите лентой.
ПРИМЕЧАНИЕ: Эта процедура выполняется на нисходящей таблице для удаления избыточных летучих газов (т.е. изофлурана). - Удалите волосы на правой ноге до вентральной и спинной нижней части живота с помощью машинок для стрижки или используйте средство для депиляции. Поместите крысу в положение лежа на спине.
- Очистите хирургическую область асептически, используя 70% этанола и разбавите хлоргексидина ацетат или разбавите бетадин. Подготовьте кожу к операции от середины икры до области кожи чуть выше тазобедренного сустава правой нижней части живота. Скрабируйте проксимальную часть ноги и дистальную область по окружности. Повторите этот шаг три раза.
- Нанесите глазную смазку на оба глаза крысы. Убедитесь, что крыса имеет нормальную температуру тела (37 ° C) и нормальные жизненные показатели. Контролируйте и регулируйте температуру тела с помощью грелки, которая подключена к ректальному датчику температуры.
- Поместите крысу в индукционную камеру среднего размера и индуцируйте анестезию 2%-4% изофлураном. Следите за крысой непрерывно на предмет глубины анестезии.
- Хирургия
- Включите изофлуран на 1,5%-3% (поддержание). Следите за глубиной анестезии, включая реакцию на защемление пальцев ног, частоту дыхания и характер. Регулируйте норму изофлурана по мере необходимости для поддержания соответствующей плоскости анестезии.
ПРИМЕЧАНИЕ: Частота дыхания под наркозом должна составлять от 50 до 100 вдохов в минуту. Глубокие, нечастые вдохи являются признаком того, что крыса слишком глубоко обезболена. - Открытые стерильные наборы инструментов и шторы и надевайте стерильные перчатки. Позаботьтесь о поддержании стерильности на протяжении всей процедуры. Основные необходимые стерильные хирургические инструменты включают держатель лезвия скальпеля, щипцы, гемостаты, держатель иглы, ножницы и раневой зажим.
- Протяните ногу крысы через вентиляционное отверстие стерильной хирургической драпировки. Убедитесь, что животное находится в адекватной плоскости анестезии с помощью рефлекса щипца.
- Используя лезвие скальпеля или хирургические ножницы, сделайте окружной, кожный разрез непосредственно проксимально к удушью (коленному суставу).
- Деглавировать заднюю конечность с помощью марли или тупого рассечения для обнажения бедренной артерии и вены на вентрально-медиальной поверхности задней конечности.
- Обжигайте сосуды с помощью 4-0 рассасывающихся швов на уровне средней бедренной кости и трансективно.
- Зажмите вену дистально, чтобы уменьшить утечку во время рассечения мышц.
ПРИМЕЧАНИЕ: Окружность мускулатуры будет транссектирована дистально до уровня перевязки сосудов бедренной артерии и мышц, поднятых от бедренной кости до уровня тазобедренного сустава. - Используя тупое рассечение, отводят тазобедренный сустав боковым вращением наружу.
- Найдите головку бедренной кости и выделите ее из вертлужной впадины. Отрежьте любую оставшуюся ткань, удерживающую ногу прикрепленной к телу.
- Дайте брызговик в вертлужную впадину и седалищный нерв примерно 6 мг/кг ропивакаина.
- Закройте мускулатуру над вертлужной впадиной с помощью простого прерванного шва (4-0, рассасывающийся шов).
ПРИМЕЧАНИЕ: Дополнительные 0,5% бупивакаина или лидокаина (всего 0,15-0,2 мг) могут вводиться в несколько участков вдоль закрытого мышечного слоя (местная инфильтрация/брызговик). - Укладывайте и закрывайте края кожи с помощью раневых зажимов, расставленных каждые 5-10 мм.
- Включите изофлуран на 1,5%-3% (поддержание). Следите за глубиной анестезии, включая реакцию на защемление пальцев ног, частоту дыхания и характер. Регулируйте норму изофлурана по мере необходимости для поддержания соответствующей плоскости анестезии.
- Выздоровление
- Поместите крысу в чистую клетку-рекуперацию с тепловой поддержкой с помощью грелки, помещенной под клетку.
ПРИМЕЧАНИЕ: Для предотвращения гипертермии грелка не должна находиться в непосредственном контакте с животным и не должна превышать 40 °C. - Наблюдайте за животным до тех пор, пока оно полностью не восстановится и не станет нормотермическим (37,5-39 °C).
ПРИМЕЧАНИЕ: Животное не следует оставлять без присмотра до полного сознания и кормового лежания и легкого перемещения по клетке. - После полного бодрствования, подвижности и хорошего дыхания вводите крысам бупренорфин (1,0-1,2 мг/кг SC).
ПРИМЕЧАНИЕ: Введение бупренорфина анестезированной крысе может ухудшить выздоровление. - Вводят 10 мл теплого лактированного раствора Рингера подкожно между лопатками.
- Переместите крыс обратно в чистую клетку и воссоединитесь с сородичами.
- Контролируйте всех животных два раза в день в течение следующего месяца на наличие признаков боли и дистресса, включая пилоэрекцию, сгорбленную осанку или неаппетитность или признаки инфекции места разреза, включая эритему, гнойные выделения или дегисценцию раны.
ПРИМЕЧАНИЕ: На сегодняшний день мы не наблюдали клинических признаков (таких как инфекции) после послеоперационного выздоровления ни у одного из животных. Только у одной крысы была дегисценция швами, после чего раневые клипсы использовались для закрытия ран без дальнейших проблем. - Вводят бупренорфин или мелоксикам животным, имеющим клинические признаки боли в опубликованных дозах, в консультации с ветеринаром лабораторных животных.
- Вводите антибиотики (т.е. цефалоспорин) животным, имеющим клинические признаки боли в опубликованных дозах, в консультации с ветеринаром лабораторных животных.
ПРИМЕЧАНИЕ: Любые животные, проявляющие затяжные признаки боли или дистресса, которые не улучшаются с анальгетиками, или животные, проявляющие признаки инфекции, которые не реагируют на антибиотики, должны быть гуманно усыплены.
- Поместите крысу в чистую клетку-рекуперацию с тепловой поддержкой с помощью грелки, помещенной под клетку.
6. Визуализация с помощью рентгеновского снимка
- После имплантации опухоли визуализируйте большеберцовую кость и легкие неинвазивно, чтобы обнаружить рост опухоли с помощью рентгеновского снимка с помощью машины, предназначенной для грызунов.
- Обезболивайте крыс, как это делалось ранее.
- Делайте снимки с 3-кратным увеличением в течение 6 с при 25 кВ.
- Обработайте пленку с помощью рентгеновского процессора. Рентгенограммы также могут быть отсканированы в цифровом виде.
7. Процедура некропсии
- Усыплите крыс с помощью CO2. Подтвердите смерть через отсутствие сердцебиения и немедленно возьмите 3 мл крови из сердца для образцов сыворотки или плазмы.
- Откройте грудную клетку и брюшную полость для осмотра.
- Изолируют трахею и каннулируют с помощью катетера (18 г). Чтобы закрепить катетер в трахее, завяжите шелковый шов вокруг обеих трахеи катетером.
- Подключите инфузионный катетер к шприцу объемом 3 или 5 мл. Вводят формалин или физиологический раствор, чтобы мягко надуть доли легких для улучшения гистологических образцов. При инфузии легкие будут надуваться и обеспечивать лучшую визуализацию легочных метастазов.
- Осмотрите, рассекните и взвесьте все выбранные органы грудной и брюшной полости (например, печень, почки).
- Зафиксируйте органы в формалине для гистопатологии или заморозьте на сухом льду, 2-метилбутане или жидком азоте.
- Для оценки экспрессии белка с помощью вестерн-блоттинга вводят лизаты замороженных тканей. Антитела, которые реагируют с тканями крыс, подробно описаны13.
8. Иммуногистохимия
- Обработайте первичную ткань ОС, встройте в парафин, и разделите ее для иммуногистохимического окрашивания.
- Извлечение антигена после депарафинизации с использованием цитратного буфера (рН 6,0). Инкубировать в 0,3%Н2О2в метаноле в течение 30 мин для гашения эндогенной пероксидазы.
- Блокируйте парафиновые срезы толщиной 5 мкм, используя обычную сыворотку.
- Инкубировать с первичными антителами против CD68 и CD3 (см. таблицу) в течение ночи при 4 °C.
- Промыть срезы в PBS и инкубировать их в полимере HRP с помощью комплекта обнаружения.
ПРИМЕЧАНИЕ: Иммуноокрашивание было разработано с диаминобензидином в качестве хромогена.
9. Вестерн-блоттинг
- Лизируйте клетки UMR-106 в 200-300 мкл лизисного буфера14 для выполнения стандартного гелевого электрофореза и западного блоттинга.
- Используйте от 4% до 12% гелей Бис-Трис.
- Инкубировать в анти-ErbB2, анти-ErbB4, анти-EGFR, анти-ERK, β-актине или антимышечном первичном антителе β2-AR (см. таблицу) и вторичном антителе, связанном с пероксидазой хрена.
- Добавить хемилюминесцентный субстрат. Подвергайте мембраны воздействию рентгеновской пленки.
ПРИМЕЧАНИЕ: β-актиновые уровни используются в качестве регуляторов нагрузки.
Результаты
Иммунокомпетентные SD беспородные крысы используются для этих исследований ОС, которые предлагают животную модель с интактной иммунной системой. Мы использовали клеточную линию UMR106 от ATCC, разработанную из клеток, которые были первоначально выделены из ОС крысы SD. Мы имплантировали клетки крысАм SD, тем самым обеспечивая сингенную модель для OS. Клетки UMR106 имплантируются в большеберцовую кость 3-недельных самцов и самок SD-крыс, имитируя педиатрическую модель ОС. Более того, ортотопическая имплантация клеток UMR106 непосредственно в метафиз/диафиз большеберцовой кости дает соответствующее микроокружение опухоли.
При имплантации опухолевых клеток игла должна быть введена правильно через плато большеберцовой кости (рисунок 1) под правильным углом (параллельно костному валу), вытягивая кончик иглы примерно на 10 мм в центральную полость кости. При этой процедуре у 95% (52/55) крыс развились опухоли в большеберцовой кости дистальнее колена. При опыте инъекций большеберцовой кости у 100% крыс развились опухоли. В группе крыс, которые не были ампутированы, средние объемы опухоли у самцов составляли 504мм3 через 3 недели и 1195 мм3 через5 недель после имплантации. У женщин объем опухоли в среднем составляет 285 мм3 через3 недели и 495 мм3 через5 недель после имплантации.
Сравнивались две когорты крыс, в том числе с ампутацией (23 крысы) (рисунок 2) и без ампутации (29 крыс). Обе когорты были усыплены через 7 недель после имплантации для изучения метастазирования опухоли в легкие. В группе ампутации (3/23) у крыс развились легочные метастазы. Эти три крысы умерли или были усыплены в течение 24 часов после операции из-за послеоперационных осложнений. Две крысы умерли от длительной анестезии, когда хирург изучал метод. У одной крысы развилась дегисценция, и она была усыплена на следующий день. Легкие этих трех крыс были оценены и три небольших метастаза (>1 мм) были обнаружены гистологически. У выживших 20 крыс не было метастазов в легкие через 7 недель после имплантации. Это указывало на то, что 3 недели после имплантационных ампутаций достаточны для уменьшения числа крыс с легочным метастазированием. Во второй группе из 29 крыс, у которых не было процедуры ампутации, у 26/29 крыс были метастазы в легкие, соответствующие ранее опубликованным данным11. Мы не видели закономерности в размере или количестве метастазов у этих крыс. Большинство крыс имеют более 10 грубо видимых метастазов диаметром 2-7 мм, которые были легко отобраны во время некропсии. Иногда крысы имели еще более крупные метастазы до 10 мм в диаметре. Важно имплантировать клетки UMR106 с низким числом прохода, так как исследования показали, что клетки с числом прохода 10 и выше становятся более агрессивными и метастазируют уже через 2-3 недели после имплантации. Причина природы неизвестна, но предположение заключается в том, что клетки в культуре могут развивать мутации, которые способствуют метастазированию.
В дополнение к операции по ампутации, еще одно усовершенствование методов включало рентгеновскую визуализацию для наблюдения за опухолью или при некропсии. Этот метод позволяет исследователю подтвердить инвазию костной опухоли у крыс под наркозом. Метод планарной рентгенографии также может быть использован на недавно ампутированных конечностях или формалиновых фиксированных конечностях. Метод быстрый (5 мин на крысу) и недорогой ($2-5/крыса) по сравнению с компьютерной томографией (КТ). Для мониторинга in vivo требуется, чтобы крысы были обезболены во время визуализации. На рисунке 3 показана подробная морфология, наблюдаемая при рентгеновской визуализации двух ранее ампутированных конечностей. Этот метод освещает остеолитическую и остеобластную природу этих опухолей. Обратите внимание на нарушение нормальной костной кортикальной архитектуры большеберцовой и малоберцовой костей в обоих примерах (белые стрелки). Рисунок 4 иллюстрирует рентгенографическую морфологию легких с метастазами и без них. Визуализация с помощью рентгена может быстро выявить в лаборатории необходимость эвтаназии для предотвращения ненужных спонтанных смертей.
Первичные и метастатические опухоли в легких гистологически похожи на ОС человека, проявляя как остеолитическую, так и остеобластную морфологию опухоли. У крысиной ОС морфология как остеолитической, так и остеобластной опухоли подтверждается гистопатологией ампутированной конечности на рисунках 5 и 6. Обратите внимание, что кортикальная кость отсутствует в этом примере, а соседняя кость также заменяется или укрепляется новой тканой костью (экзостозами), которая ориентирована перпендикулярно существующему стволу коры. Островки незрелого остеоида (аморфного внеклеточного материала) показаны в примере опухоли. Кроме того, микроскопическая морфология метастазов в легкие, некоторые с минерализованной костью, и опухолевые сосудистые эмболы показаны на рисунке 7.
Ампутация конечностей при ОС повышает выживаемость у крыс. Крысы могут умереть спонтанно из-за легочных метастазов, размещенных в течение более 7 недель после имплантации. Использование ампутации может позволить дальнейшее исследование стандартной или таргетной терапии рака в этой модели. Удлинение времени между имплантацией опухоли и ампутацией увеличит частоту метастазирования.
Доксорубицин является химиотерапевтическим средством, используемым для лечения ОС у людей. У крыс доксорубицин можно вводить с помощью яремных инъекций13 или катетера15, как описано здесь. Яремная инъекция требует 5-10 минут на крысу, но обеспечивает доставку дозы в открытую вену. В целом, яремные инъекции гораздо более воспроизводимы по сравнению с инъекциями вен крысиного хвоста. Если доксорубицин просачивается в дерму во время инъекций в хвостовую вену, может возникнуть некроз хвоста и предотвратить дальнейшее лечение. В этом исследовании пятерых крыс лечили дозой доксорубицина 2 мг/кг и усыпляли через 48 ч после инъекции для исследования гибели клеток в опухолях, как показано на рисунке 5A,B.
Пять контрольных крыс, получавших физиологический раствор, также были оценены для выбора антител, которые могут быть использованы для иммуноактивного окрашивания иммунных клеток в ОС крыс. Здесь два антитела были протестированы на иммунную реактивность. Для иммуногистохимических исследований опухоли фиксировали в формалине в течение 48-72 ч, а затем перемещали на 70% этанол для уменьшения сшивки белка, возникающей в формалине. Иммуногистохимия проводилась для инфильтратов иммунных клеток в первичных опухолях ОС и иммуноокрашенных для макрофагов (CD68) и Т-клеток (CD3). На рисунке 8 показаны два примера иммуностимунов инфильтратов иммунных клеток в микроокружении опухоли.
Были также изучены потенциальные цели терапевтического вмешательства. После ампутации конечностей с опухолями образцы ОС крыс были заморожены для будущей изоляции белка. В этом исследовании мы обнаружили, что клетки UMR106 экспрессируют белки пути семейства ErbB. Вестерн-блоттинги, выполняемые на лизатах клеточного белка UMR106, демонстрируют экспрессию ErbB2, EGFR, ErbB4 и других белков, которые взаимодействуют с этими путями(рисунок 9).

Рисунок 1:Большеберцовая кость с вставленной иглой для имплантации опухоли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Большеберцовая кость во время процедуры ампутации судаленной кожей (А),обнаженной бедренной артерией и веной(В),с мышцей, приподнятой от бедренной кости(С),и у крыс через 3 недели после операции по ампутации(D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
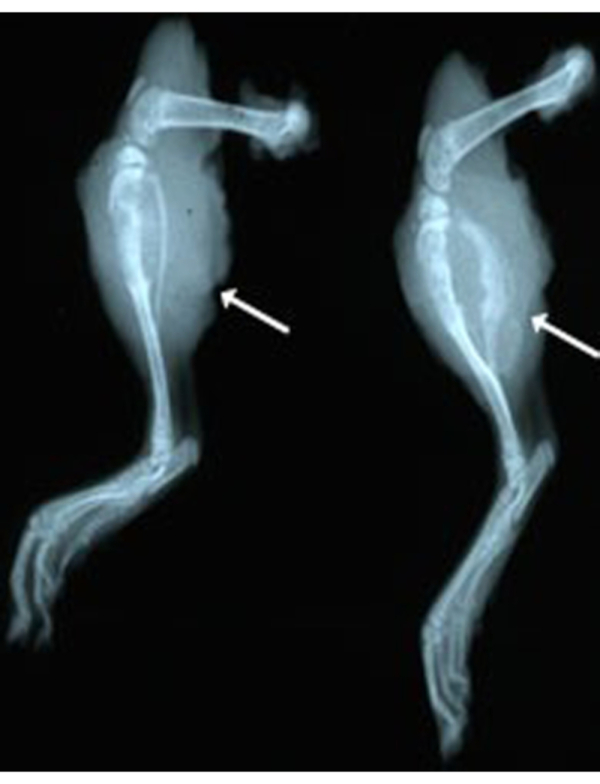
Рисунок 3:Рентгенологическая рентгенограмма правых ног после ампутации (ex vivo) у двух крыс с ОС. Обратите внимание на остеолитическую и остеобластную природу опухоли. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Рентгеновские снимки легких крыс. (А)без метастазов в легкие. (В) с ОС легочных метастазов. (С)корреляция с грубой патологией метастазов в раздутом легком. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: (А)Гистопатология ОС с 90% клеток, показывающих гибель клеток в опухоли большеберцовой кости через 48 ч после дозы 2 мг/кг доксорубицина. (B)Гибель опухолевых клеток (стрелка) в первичной ОС большеберцовой кости через 48 ч после дозы 2 мг/кг доксорубицина. Обратите внимание, что верхний правый и левый угол имеет жизнеспособные ячейки. (C) Инвазия ОС в кортикальную кость. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: (А)Гистопатология ОС, которая заменила клетки костного мозга и проникла в кору большеберцовой кости. Обратите внимание на сопровождающийся реактивный рост новой кости, поскольку она наслаивается снаружи и перпендикулярна ранее существовавшей коре. (B) Исследование опухолевых клеток ОС, прилегающих к острову кости. (C) Исследование более высокой мощности клеток ОС, встроенных в розово-синий внеклеточный матрикс (остеоид). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: (А)Множественные легочные метастазы у крыс с имплантацией опухоли большеберцовой кости. (B)Опухолевые ОС-клетки в эмболе в мелком сосуде ветви легочной артерии, прилегающем к бронхиоле ниже сосуда. (C) Некоторые легочные метастазы содержат островки кости, в то время как другие метастазы являются более клеточными. (D)Высшая сила метастазов с клетками ОС, смешанными с островками минерализованной кости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8:Иммуногистохимия (A) CD68 иммуноокрашающих макрофагов и (B) иммуноокрашающих Т-клеток, показывающих CD3-положительные клетки в ОС в большеберцовой кости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9:Белки пути ErbB, экспрессируемые в клетках ОС UMR106 из опухолей большеберцовой кости. Лизаты из первичных опухолей исследовали на экспрессию белка из пути сигнальной трансдукции семейства ErbB, включая ErbB2, EGFR, ErbB4, AKT, ERK1/2 и β2-адренергические рецепторы с актином в качестве контроля нагрузки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
У крыс с имплантатами ОС большеберцовой кости развиваются измеримые опухоли к 3 неделям после имплантации. Если конечности с опухолями ампутируют через 3 недели после имплантации, частота метастазирования в легкие значительно снижается. ОС являются как остеолитическими, так и остеобластными. У крыс без ампутации развиваются метастазы в легкие, множественные и переменного размера, наблюдаемые рентгенографией или при некропсии через 7 недель после имплантации. EGFR, ErbB2 и ErbB4 экспрессируются в крысиной ОС UMR106, аналогично человеческой OS16,17,18. CD3 Т-клетки и макрофаги легко обнаруживаются в ОС методами иммуногистохимии. Инъекции в яремную вену предпочтительнее хвостовой вены для доставки химиотерапевтического доксорубицина, препарата, назначаемого пациентам с ОС. Метод, описанный здесь, представляет собой полную ампутацию тазобедренной кости. Эта процедура является усовершенствованием и может рассматриваться как замена хирургического метода удаления опухоли (остеотомия бедренной кости), когда кость разрезается, оставляя культю для пациента8. Исследование предполагает полное удаление конечностей, чтобы уменьшить вероятность послеоперационной боли и осложнений.
В этом протоколе есть ряд критических шагов. Во-первых, важно отметить прохождение опухолевых клеток и использовать нижний проход клеток для исследований, чтобы сохранить модель последовательной от эксперимента к эксперименту. Старые клетки прохода со временем становятся более агрессивными в культуре. Во-вторых, использование иглы соответствующего размера и шприца Гамильтона поможет в правильном введении клеток в большеберцовую кость при очень небольшом объеме 20 мкл, объеме, определяемом как оптимальный и не вызывающем утечки. В-третьих, хирург должен изначально практиковать дисартикуляцию при проведении некропсии на крысах аналогичного возраста, чтобы изучить механику процедуры. В-четвертых, для успеха ампутации поддерживайте терморегуляцию и ограничивайте время операции. Опытный хирург может завершить ампутацию за 15 минут.
Было замечено,что i мплантация клеток в большеберцовой кости значительно улучшилась, когда для первоначального открытия использовалась игла с большим отверстием с последующим введением иглы для шприца Гамильтона с меньшим отверстием. Это защищает шприц Гамильтона от поломки и затупления с течением времени. Шприцы Гамильтона могут иметь объем до 10 мкл. Шприцы из туберкулина объемом 1 мл не будут достаточно точными для имплантации 20 мкл. Один и тот же шприц Гамильтона использовался для всех крыс, имплантированных в день, но мыли между хирургическими процедурами каждой крысы. Избегайте автоклавирования шприцев Hamilton, так как они склонны к поломке. В конце процедуры промыть его физиологическим раствором (10 раз), а затем 100% этанолом (10 раз) и дать ему высохнуть с удаленным поршенем для хранения.
Кожа и подкожные швы первоначально использовались для закрытия разреза, но одна крыса была обнаружена с дегисценцией на следующий день после операции. Использование раневых зажимов и хирургического клея для закрытия разреза улучшило метод. С этим уточнением ни у одной другой крысы не было такого послеоперационного осложнения. Включение рентгенографии легких с помощью рентгеновского излучения совершенствует эту модель, чтобы продемонстрировать метастазирование в легкие у крыс, что позволяет проводить эвтаназию, которая является своевременной и предотвращает неожиданные смерти. Рентгеновские снимки позволяют определить остеолитическую и остеобластную природу этих крысиных ОС, аналогично человеческим ОС.
Умеренный уровень хирургической экспертизы необходим для выполнения процедуры ампутации. Самым сложным этапом является рассечение мускулатуры для определения местонахождения тазобедренного сустава. Увеличение и хорошее освещение важны на этом этапе. Хирургический опыт может быть достигнут с практикой на животных, которые были усыплены. Примерно после 10 крыс хирург должен быть уверен, чтобы ампутировать конечность с ОС от живой крысы под наркозом.
Существующие методы удаления конечностей с саркомами у мышей и крыс основаны на удалении большеберцовой кости путем разрезания бедренной кости и мускулатуры среднего ствола и выхода из культи8. Хотя это может быть полезно для некоторых исследований, в этом исследовании была предпринята попытка полного удаления ноги. Процедура была признана удовлетворительной и не вызвала никаких послеоперационных осложнений. У крыс с культей задних конечностей может быть больше послеоперационных кожных, мышечных или нервных болей. Оставляя культю, крысы могли добраться до места операции и получить доступ к нему. Крысы очень хорошо себя чувствуют после ампутации и хорошо амбулируют в клетке с одной задней конечностью.
Преимущества полной ампутации конечностей включают удаление первичной опухоли до того, как она станет слишком большой и болезненной для крысы. Важно отметить, что удаление первичной опухоли поможет контролировать первичные метастазы опухоли в легкие. Крысы с ампутацией могут быть дополнительно изучены, чтобы проверить эффективность новых терапевтических средств на циркулирующих опухолевых клетках в крови или в микрометастазах в капиллярах легких или других костей.
Существует существенная потребность в разработке новых методов лечения рака для ОС и других сарком, особенно терапевтических средств, которые обладают лекарственной активностью против метастатического прогрессирования. По сравнению с новыми терапевтическими средствами, разработанными для других видов рака, терапевтические средства для ОС, к сожалению, не прогрессировали в течение многих десятилетий. В ответ на эту проблему было созвано совещание ключевых лидеров и экспертов в области ОС и метастазирования для разработки руководящих принципов по улучшению разработки лекарств от ОС19. Согласно предложениям группы, исследования были направлены на улучшение доклинической модели крыс, менее известной модели ОС. Таким образом, ампутация и визуализация уточняют доклиническую модель крыс для дальнейшего использования сообществом исследователей саркомы. Процедура ампутации позволит улучшить выживаемость пациентов в течение нескольких месяцев, что позволит оценить эффективность новых методов лечения микрометастазов или спящих опухолей или проверить токсичность лечения с помощью модели с лучшей долговечностью.
Таким образом, мы предоставляем преимущество этой модели ОС. Иммунокомпетентные SD беспородные крысы используются для обеспечения сингенной модели с имплантированной клеточной линией UMR106 OS, выделенной из ОС SD крысы. Первичная и метастатическая опухоль гистологически сходна с ОС у человека. Ювенильные самцы и самки крыс используются для исследований имплантации опухолей UMR106, моделирующих детскую саркому. Ортотопическое размещение имплантированных клеток делается непосредственно в большеберцовую кость для соответствующего микроокружения опухоли. Первичная опухоль метастазирует в легкое, и метастазы могут контролироваться с помощью визуализации in vivo рентгеновским методом. Крысиная ОС экспрессирует белки, общие с ОС человека, такие как ErbB2. По сравнению с ОС для собак, модель крыс позволяет одновременно использовать большее количество животных. Крысы в 10 раз крупнее мышей для удобства инъекций большеберцовой кости, хирургии, визуализации, забора крови и биопсии. Долголетие крыс более гарантировано при ампутации, и эта модель может сочетать неоадъювантную терапию, ампутацию и адъювантную терапию, что позволяет улучшить выживаемость пациентов, что позволяет оценить эффективность лечения микрометастазами или спящими опухолями. Оценка токсичности вне цели также может быть оценена в этой модели, где крыс можно лечить с помощью терапии рака, такой как доксорубицин, и контролировать долгосрочную сердечную токсичность или рецидив ОС, вызванную доксорубицином. Это позволило бы тестировать средства кардиозащиты в модели с ОС.
Раскрытие информации
Никакого раскрытия для декларирования.
Благодарности
Финансирование NIH через Национальный институт рака, грант # CA228582. Шун Исияма в настоящее время получает грант от Toray Medical Co., Ltd.
Материалы
| Name | Company | Catalog Number | Comments |
| AKT | Cell Signaling TECHNOLOGY | 4685S | |
| absorbable suture | Ethicon | J214H | |
| β-actin | SANTA CRUZ BIOTECHNOLOGY | sc-47778 | |
| β2-AR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-569 | replaced by β2-AR (E-3): sc-271322 |
| Bis–Tris gels | Thermo Fisher | NP0321PK2 | |
| Buprenorphine SR Lab | ZooPharm | IZ-70000-201908 | |
| CD3 antibody | Dako | #A0452 | |
| CD68 antibody | eBioscience | #14-0688-82 | |
| Chemiluminescent substrate | cytiva | RPN2232 | |
| CL-Xposure film | Thermo Fisher | 34089 | |
| Complete Anesthesia System | EVETEQUIP | 922120 | |
| diaminobenzidine | VECTOR LABORATORIES | SK-4100 | |
| Doxorubicin | Actavis | NDC 45963-733-60 | |
| EGFR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-03 | replaced by EGFR (A-10): sc-373746 |
| ERBB2 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-284 | replaced by Neu (3B5): sc-33684 |
| ERBB4 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-283 | replaced by ErbB4 (C-7): sc-8050 |
| ERK antibody | SANTA CRUZ BIOTECHNOLOGY | sc-514302 | |
| eye lubricant | PHARMADERM | NDC 0462-0211-38 | |
| Hamilton syringe (100 µL) | Hamilton | Model 1710 SN SYR | |
| horseradish peroxidase-linked secondary antibody | cytiva | NA934 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7401 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7402 | |
| isoflurane | BUTLER SCHEIN | NDC 11695-6776-2 | |
| isoflurane vaporizer | EVETEQUIP | 911103 | |
| UMR-106 cell | ATCC | CRL-1661 | |
| X-ray | Faxitron | UltraFocus | |
| X-ray processor | Hope X-Ray Peoducts Inc | MicroMax X-ray Processor | Hope Processors are not available in USA anymore |
| wound clips | BECTON DICKINSON | 427631 |
Ссылки
- Link, M. P., et al. The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity. New England Journal of Medicine. 314 (25), 1600-1606 (1986).
- Bielack, S. S., et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. Journal of Clinical Oncology. 20 (3), 776-790 (2002).
- Botter, S. M., Neri, D., Fuchs, B. Recent advances in osteosarcoma. Current Opinion in Pharmacology. 16, 15-23 (2014).
- Ek, E. T. H., Dass, C. R., Choong, P. F. M. Commonly used mouse models of osteosarcoma. Critical Reviews in Oncology Hematology. 60 (1), 1-8 (2006).
- Guijarro, M. V., Ghivizzani, S. C., Gibbs, C. P. Animal models in osteosarcoma. Frontiers Oncology. 4, 189(2014).
- Janeway, K. A., Walkley, C. R. Modeling human osteosarcoma in the mouse: From bedside to bench. Bone. 47 (5), 859-865 (2010).
- Mohseny, A. B., Hogendoorn, P. C., Cleton-Jansen, A. M. Osteosarcoma models: from cell lines to zebrafish. Sarcoma. 2012, 417271(2012).
- Khanna, C., et al. An orthotopic model of murine osteosarcoma with clonally related variants differing in pulmonary metastatic potential. Clinical & Experimental Metastasis. 18 (3), 261-271 (2000).
- Martin, T. J., et al. Parathyroid hormone-responsive adenylate cyclase in induced transplantable osteogenic rat sarcoma. Nature. 260 (5550), 436-438 (1976).
- Fisher, J. L., Mackie, P. S., Howard, M. L., Zhou, H., Choong, P. F. The expression of the urokinase plasminogen activator system in metastatic murine osteosarcoma: an in vivo mouse model. Clinical Cancer Research. 7 (6), 1654-1660 (2001).
- Yu, Z., et al. Establishment of reproducible osteosarcoma rat model using orthotopic implantation technique. Oncology Reports. 21 (5), 1175-1180 (2009).
- Zhang, P., et al. Homologous mesenchymal stem cells promote the emergence and growth of pulmonary metastases of the rat osteosarcoma cell line UMR-106. Oncology Letters. 8 (1), 127-132 (2014).
- Gabrielson, K., et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Research. 67 (4), 1436-1441 (2007).
- Sysa-Shah, P., et al. Bidirectional cross-regulation between ErbB2 and β-adrenergic signalling pathways. Cardiovascular Research. 109 (3), 358-373 (2016).
- Wachtman, L. M., Browning, M. D., Bedja, D., Pin, S., Gabrielson, K. L. Validation of the use of long-term indwelling jugular catheters in a rat model of cardiotoxicity. Journal of American Association Laboratory Animal Science. 45, 55-64 (2006).
- Abdou, A. G., et al. The Prognostic role of Ezrin and HER2/neu expression in osteosarcoma. Applied Immunohistochemistry & Molecular Morphology. 24 (5), 355-363 (2016).
- Hughes, D. P., Thomas, D. G., Giordano, T. J., McDonagh, K. T., Baker, L. H. Essential erbB family phosphorylation in osteosarcoma as a target for CI-1033 inhibition. Pediatric Blood & Cancer. 46 (5), 614-623 (2006).
- Wen, Y. H., et al. Epidermal growth factor receptor in osteosarcoma: expression and mutational analysis. Human Pathology. 38 (8), 1184-1191 (2007).
- Khanna, C., et al. Toward a drug development path that targets metastatic progression in osteosarcoma. Clinical Cancer Research. 20 (16), 4200-4209 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены