Method Article
A Syngeneic العظام العظام سبراغ داولي نموذج الفئران مع بتر للسيطرة على معدل الانبثاث
In This Article
Summary
هنا ، يتم وصف زرع تقويم العظام السينغي يليه إجراء بتر لساركوما العظام مع الانبثاث الرئوي التلقائي الذي يمكن استخدامه للتحقيق قبل السريري لبيولوجيا الانبثاث وتطوير علاجات جديدة.
Abstract
أحدث تقدم في علاج الساركوما العظمية (OS) حدث في 1980s عندما ثبت العلاج الكيميائي متعدد الوكلاء لتحسين البقاء على قيد الحياة عموما بالمقارنة مع الجراحة وحدها. ولمعالجة هذه المشكلة، تهدف الدراسة إلى تحسين نموذج أقل شهرة لنظام التشغيل في الفئران باستخدام نهج شامل في الهسولوجيا والتصوير والبيولوجيا والزرع والبتر يطيل أمد البقاء على قيد الحياة. استخدمنا مناعة، تفوق سبراغ دولي (SD)، نموذج الفئران السينجينية مع زرع UMR106 OS خط الخلية (التي تنشأ من الفئران SD) مع زرع الورم الظنبوبي التقويمي في الفئران الذكور والإناث 3 أسابيع لنموذج نظام التشغيل للأطفال. وجدنا أن الفئران تتطور الأورام الرئوية الأولية والنقية القابلة للاستنساخ، وأن بتر الأطراف في 3 أسابيع بعد الزرع يقلل بشكل كبير من حدوث الانبثاث الرئوي ويمنع الوفيات غير المتوقعة. من الناحية النسيجية ، كانت OSs الأولية والمنقوتة في الفئران مشابهة جدا لنظام التشغيل البشري. مسح التعبير البروتيني لخلايا نظام التشغيل يكشف أن هذه الأورام تعبر عن kinases الأسرة ErbB. وبما أن هذه kinases هي أيضا أعرب للغاية في معظم منظمة الدول الأمريكية الإنسان، يمكن استخدام هذا النموذج الفئران لاختبار مثبطات مسار ErbB للعلاج.
Introduction
أوستيوساركوما (OS) هو ورم العظام الأساسي الأكثر شيوعا في الأطفال والمراهقين والشباب. أحدث تقدم في علاج نظام التشغيل حدث في 1980s عندما تبين العلاج الكيميائي متعدد الوكلاء لتحسين البقاء على قيد الحياة عموما مقارنة مع الجراحة وحدها1. يتطور نظام التشغيل أثناء النمو السريع للعظام ، وعادة ما يحدث في العظام الأنبوبية الطويلة مثل عظم الفخذ والساق وعظم العضد. وهي تتميز بمظهر أوستيوليك، أو أوستيوبلاستيك، أو مختلط مع رد فعل ملحوظ من قبل الخلايا القيطية2. العلاج الكيميائي واستئصال الجراحية يمكن أن تحسن النتيجة للمرضى الذين يعانون من البقاء على قيد الحياة لمدة 5 سنوات ل 65٪ من المرضى2،3. لسوء الحظ، مرضى نظام التشغيل عالية الجودة مع مرض النقيلي لديهم البقاء على قيد الحياة 20٪. نظام التشغيل يغزو إقليميا وينتشر في المقام الأول إلى الرئتين أو العظام الأخرى وأكثر انتشارا في الذكور. الحاجة الأكثر إلحاحا لهؤلاء المرضى الصغار هو العلاج الجديد الذي يمنع ويزيل صلاحية الانبثاث البعيدة.
وقد استعرضت نماذج نظام التشغيل ما قبلالسريرية 4,5,6,7 وعدد قليل من النماذج المتاحة المناعية باستخدام بتر نظام التشغيل التقويمي وقد وضعت. في عام 2000، تم تطوير نموذج مهم باستخدام BALB / ج الفئران مع نظام التشغيل السنجني تقويم العظام وبتر8. بالمقارنة مع هذا النموذج الماوس، ويستند نموذج الفئران على الحيوانات الأصيلة وراثيا وأكبر 10 مرات مما يؤدي إلى بعض المزايا. تم تطوير نموذج UMR106 الفئران من نظام التشغيل المستحث 32P في الفئران داولي سبراغ (SD) ، والتي اشتقت إلى خط الخلية9. في عام 2001 ، تم وصف زرع تقويم العظام من UMR106-01 لأول مرة في الساق المزروعة من الفئران اللاهية مع تطور الورم الأولي السريع والمتسق والسمات الإشعاعية والهصلة المشتركة مع نظام التشغيل في البشر. تطورت الانبثاث الرئوي وكانت تعتمد على وضع تقويم العظام من UMR106 في البيئة الدقيقة العظام10. في عام 2009،أنشأ Yu وآخرون. كانت عمليات زرع الورم الناجحة ومعدل الانبثاث الرئوي في الفئران دون بتر مماثلة للبيانات المعروضة هنا. في هذه الدراسة، تم إجراء بتر إضافي للنموذج باستخدام الفئران الصغيرة، مما يشير إلى أن توقيت إزالة الورم الأولي أمر بالغ الأهمية في نمذجة نظام التشغيل، وخاصة فيما يتعلق بالتقدم النقيلي. مع هذا الصقل، وبتر والتصوير في الجسم الحي تحسين هذا النموذج للدراسات ما قبل السريرية لتقييم المخدرات رواية لنظام التشغيل.
Protocol
تم تنفيذ جميع الإجراءات والتجارب التي شملت الفئران وفقا للبروتوكولات التي وافقت عليها لجنة جونز هوبكنز لرعاية الحيوانات واستخدامها.
1. SD الفئران OS خط الخلية UMR-106 بروتوكول ثقافة الخلية
- تنمو الخلايا في DMEM، تكمل مع 10٪ (v/v) FBS، البنسلين (10 U/mL)-streptomycin (10 U/mL) في 37 درجة مئوية في الغلاف الجوي CO2 الرطوبة 5٪. إجراء التجارب باستخدام خلايا مع مقاطع من 2-812.
2. الحقن داخل الخلايا بروتوكول نظام التشغيل
ملاحظة: الفئران SD الحوامل تزاوج الوقت تلد في منشأة الحيوان وفي 3 أسابيع من العمر، وتستخدم القمامة (منذ UMR 106 خط الخلية هو syngeneic للفئران SD، ليست هناك حاجة إلى التشعيع).
- التعريفي
- ضع الجرذ في غرفة تعريف متوسطة الحجم واحفز التخدير مع isoflurane 2٪-3٪. مراقبة الحيوان باستمرار لعمق التخدير عن طريق رد الفعل لقرصة إصبع القدم، ومعدل التنفس، والحرف.
- أدخل الأنف في الأنف. آمنة مع الشريط، إذا لزم الأمر.
- إزالة الشعر على الساق اليمنى حتى البطن وأسفل البطن الظهري مع المقصات أو استخدام عامل إزالة الشعر. ضع الجرذ في وضع ية
- فرك المنطقة الجراحية بشكل مطهر باستخدام الإيثانول 70٪ وتمييع خلات الكلورهيكسيدين أو بتادين المخفف. تبدأ حول منطقة الركبة وفرك في حركة دائرية على حد سواء بشكل تقريبي وdistally. كرر هذه الخطوة ثلاث مرات. لا يتم استخدام ستارة لزرع الورم.
- تطبيق زيوت التشحيم العين في كل من عيون الفئران لمنع الجفاف القرنية الناجمة عن التخدير. ضع الجرذ على وسادة تسخين منخفضة الحرارة. تأكد من أن الجرذ لديه درجة حرارة الجسم العادية (37 درجة مئوية) ومعدل التنفس الطبيعي.
- جراحة
- بدوره على ايزوفلوران في ~ 1.5 ٪ - 2 ٪ (للصيانة). تأكد من أن الحيوان في مستوى كاف من التخدير عن طريق عدم وجود منعكس إصبع القدم قرصة. إذا لم يكن كذلك، زيادة نسبة isoflurane إلى 2.5٪.
- وضع علامة على إبرة معقمة (حوالي 22 غرام) في 10 ملم من طرف لتوجيه العمق لإدراج.
- أدخل الإبرة 10 ملم لأسفل في الغشاء الحاجز للظنبوب عن طريق إدخال الركبة المنحنية في منتصف الهضبة الظنبوبية ، وتمديد الإبرة من خلال الميتافيزيقي إلى الانبثاث باستخدام حركة خفيفة تشبه الحفر لإجراء فتحة. أزل الإبرة.
- تحميل تعليق الخلية في حقنة هاملتون مباشرة قبل الحقن في الساق. للقيام بذلك، اخلطي الخلايا برفق قبل الرسم في حقنة حيث أن الجاذبية تجعل الخلايا تستقر في الجزء السفلي من الأنبوب.
ملاحظة: يمكن تخزين الخلايا في أنبوب 1.5 إلى 2 مل (في درجة حرارة الغرفة) قبل الرسم في حقنة هاملتون (100 ميكرولتر) بعد الخلط الدقيق. يمكن الاحتفاظ بالخلايا في درجة حرارة الغرفة لمدة 2-3 ساعات أثناء إجراء الزرع. تحقق دائما من صلاحية الخلية للخلايا في الأنبوب قبل وبعد جلسة الزرع. استبعاد تريبان الأزرق هو أسهل طريقة لتقييم صلاحية الخلية. - بمجرد اجتياز العظم بالإبرة الأولى، أدخل إبرة ثانية (أصغر قطرا تم وضع علامة عليها أيضا عند 10 مم) إبرة متصلة بحقنة هاملتون 100 ميكرولتر المحملة بالخلايا. تأكد من إدخال الإبرة حتى علامة 10 مم في نفس الثقب الممتد إلى الانقباض.
- تصريف بلطف 20 ميكرولتر من 75،000 تعليق خلايا نظام التشغيل في برنامج تلفزيوني في تجويف الديافيزياء والنخاع.
ملاحظة: يجب أن لا تمايل الإبرة في العظام ويجب أن تشعر بالأمان. إذا تحركت الإبرة بسهولة، قد تكون القشرة قد اجتازت في الديافيس. كرر الإدخال مرة أخرى للحصول على موضع أكثر حزما قبل حقن الخلايا. - أزل إبرة هاملتون من العظم.
ملاحظة: إذا كان قطرة صغيرة من أشكال الدم، وتطبيق ضغط الضوء. إذا كانت أشكال انخفاض السوائل واضحة في موقع ثقب, الإبرة قد لا يكون تم تمديدها بعيدا بما فيه الكفاية في العظام وتعليق الخلايا السرطانية قد تسربت مرة أخرى من خلال ثقب. سجل هذا في الملاحظات ولكن عموما، زرع الورم سوف تكون ناجحة. مع الخبرة، يجب أن يستغرق إجراء زرع الورم 5 دقائق لكل فأر. مع الخبرة، وزرع الورم من الخلايا في العظام تصبح أسهل. الحقن العرضي للخلايا في العضلات حول العظام، قد لا يؤدي إلى البيئة الدقيقة الورم اللازمة للانبثاث الرئوي.
- الانتعاش
- تأكد من أن الجرذ هو ذرة. ضع الجرذ في قفص مع وسادة التدفئة وضعت تحت القفص للتعافي.
- بعد أن يستيقظ تماما, المحمول, والتنفس بشكل جيد, حقن الفئران مع البوبرينورفين (1.0-1.2 ملغ / كغ SC).
ملاحظة: للوصول إلى Buprenorphine، تحقق مع المؤسسة لمعرفة خيارات للموافقة من خلال الموظفين البيطريين لوضع النظام. - نقل الفئران مرة أخرى لتنظيف الأقفاص ورصد مرة واحدة في اليوم، كل أسبوع.
3. القياس والرصد
- قياس حجم الورم 9-10 أيام بعد الزرع ومن ثم كل 2 أيام حتى 3 أسابيع بعد زرع لتحديد معدل النمو. قياس القطر الأقصى للتيبيا باستخدام الفرجار الإلكترونية أو اليدوية. قم بتخزين البيانات في جدول بيانات مع صيغة لحساب حجم الورم. قياس الكونترالاتال (لا زرع الساق) كخط الأساس.
ملاحظة: يتم استخدام أقطار الأطراف الخلفية المزروعة كبديل لحجم الورم. يتم قياس الأطراف الخلفية عموديا على محور الساق الطويل في أكبر قطر لقياسين، البطني / الظهري والوسائط / الجانبي على الطرف. يتم حساب حجم الورم المقدر من خلال الصيغة11: حجم الورم (مم3)= أكبر قطر (مم) × أصغر قطر (مم)2/2. - النظر في الفئران لبتر البقاء على قيد الحياة أو العلاج الكيميائي عندما تقترب الأورام 15 ملم في البعد الأكبر أو 3 أسابيع بعد زرع الورم. يبلغ طول الطرف المقابل حوالي 7-9 مم في معظم الفئران في هذا العمر.
4. دوكسوروبيسين عن طريق الوريد
- تخدير الفئران مع 2٪ isoflurane. إعداد الجلد على الوريد الوداجي مع ثلاثة يغسل الجراحية باستخدام بيتادين والكحول كما هو موضح13.
- تحت تشريح دقيق، تصور الوريد الوداجي الأيمن أو الأيسر. أدخل الإبرة في العضلة المغطية ثم توجه نحو رأس الجرذ في تجويف الوريد الوداجي كما هو متصور في الوريد الوداجي الأمامي إلى عضلة الصدر.
- عندما يتم إدخال الإبرة في الوريد الوداجي، ارسم الدم برفق في الحقنة لضمان الإدراج السليم. من الممكن الاعتقاد بأن الإبرة هي من خلال الوريد ، ولكن الإبرة تحت الوريد وليس في التجويف. إذا أصبح الوريد الوداجي صغيرا جدا للحقن عند التشريح الحاد لفضح الوريد الوداجي، فاستخدم الوريد الوداجي الآخر للحقن.
- حقن الدوكسوروبيسين (2 ملغم/كغ) ببطء أكثر من دقيقة واحدة في حجم 100-150 ميكرولتر. يمكن تصور المحلول عن طريق الوريد في الوريد الوداجي أثناء الولادة.
- حقن كميات مماثلة من المالحة العادية في الفئران السيطرة.
- إزالة الإبرة وتطبيق ضغط لطيف على الوريد مع شاش معقم.
- أغلق شق الجلد باستخدام مقاطع الجرح 3-4. إزالة مقاطع في 7-10 أيام بعد الحقن.
ملاحظة: الفئران لا تحاول عادة لإزالة مقاطع معدنية ولكن سوف لدغة وإزالة الغرز. طريقة الحقن الوداجي هو أفضل لحقن الوريد الذيل للدوكسوروبيسين لأن أي دواء أن تسرب خارج السفينة يسبب نخر الذيل التي قد تتطلب بتر الذيل.
5. بروتوكول بتر الأطراف الخلفية
- التعريفي
- ضع الجرذ في غرفة تعريف متوسطة الحجم واحفز التخدير مع isoflurane 2٪-4٪. مراقبة الفئران باستمرار لعمق التخدير.
ملاحظة: يتم مسح غرفة التعريفي إلى عبوة الفحم ويتم إزالة أي غازات أخرى بواسطة طاولة أسفل المسودة المستخدمة للجراحة. - أدخل الأنف في الأنف. آمنة مع الشريط، إذا لزم الأمر.
ملاحظة: يتم هذا الإجراء على جدول مسودة لأسفل لمسح الغازات المتطايرة الزائدة (أي isoflurane). - إزالة الشعر على الساق اليمنى حتى البطن وأسفل البطن الظهري مع المقصات أو استخدام عامل إزالة الشعر. ضع الجرذ في وضع ية
- فرك المنطقة الجراحية بشكل مطهر باستخدام الإيثانول 70٪ وتمييع خلات الكلورهيكسيدين أو بتادين المخفف. إعداد الجلد لعملية جراحية من منتصف العجل إلى منطقة الجلد فقط فوق مفصل الورك من أسفل البطن الأيمن. فرك الساق القريبة ومنطقة البعيدة محيط. كرر هذه الخطوة ثلاث مرات.
- تطبيق مواد التشحيم العين في كل من عيون الفئران. تأكد من أن الجرذ لديه درجة حرارة الجسم العادية (37 درجة مئوية) وعلامات حيوية طبيعية. مراقبة وتنظيم درجة حرارة الجسم باستخدام وسادة التدفئة التي ترتبط إلى مراقبة مسبار درجة حرارة المستقيم.
- ضع الجرذ في غرفة تعريف متوسطة الحجم واحفز التخدير مع isoflurane 2٪-4٪. مراقبة الفئران باستمرار لعمق التخدير.
- جراحة
- بدوره على ايزوفلوران في 1.5٪ -3٪ (الصيانة). رصد لعمق مخدر، بما في ذلك رد فعل لقرصة إصبع القدم، ومعدل التنفس، والحرف. ضبط معدل isoflurane حسب الحاجة للحفاظ على مستوى مناسب من التخدير.
ملاحظة: يجب أن يتراوح معدل التنفس أثناء التخدير بين 50-100 نفس في الدقيقة. الأنفاس العميقة والنادرة هي مؤشر على أن الجرذ مخدر بعمق. - فتح حزم أداة معقمة والستائر وارتداء قفازات معقمة. الحرص على الحفاظ على العقم خلال مدة الإجراء. وتشمل الأدوات الجراحية العقيمة الأساسية اللازمة، حامل شفرة مشرط، ملقط، hemostats، حامل إبرة، مقص، ومطبق مقطع الجرح.
- سحب ساق الجرذ من خلال تنفيس الستائر الجراحية العقيمة. تأكد من أن الحيوان في مستوى كاف من التخدير عن طريق إصبع القدم قرصة منعكس.
- باستخدام شفرة مشرط أو مقص الجراحية، وجعل محيطي، شق الجلد فقط قريبة من خنق (مفصل الركبة).
- قفاز الطرف الخلفي باستخدام شاش أو تشريح حاد لفضح الشريان الفخذي والوريد على السطح البطني والوسط من الطرف الخلفي.
- Ligate السفن باستخدام 4-0 خياطة قابلة للامتصاص على مستوى منتصف الفخذ وعبر استئصال distally.
- المشبك الوريد distally للحد من التسرب أثناء تشريح العضلات.
ملاحظة: سيتم تحويل العضلات المحيطية إلى مستوى ربط وعاء الشريان الفخذي والعضلات المرتفعة من عظم الفخذ إلى مستوى المفصل كوكسوفيمورال. - باستخدام تشريح حاد، خطف مفصل الورك مع التناوب الخارجي الجانبي.
- العثور على رأس عظم الفخذ وفكه من الأسيتابولوم. قطع أي الأنسجة المتبقية حفظ الساق تعلق على الجسم.
- إعطاء كتلة دفقة إلى الأسيتابولوم والعصب الوركي مع ما يقرب من 6 ملغ / كغ Ropivacaine.
- أغلق العضلات فوق الأسيتابولوم باستخدام خياطة بسيطة متقطعة (4-0 ، خياطة قابلة للامتصاص).
ملاحظة: إضافية 0.5٪ bupivacaine أو الليدوكائين (0.15-0.2 ملغ المجموع) يمكن حقنها في عدة مواقع على طول طبقة العضلات المغلقة (التسلل المحلية / كتلة البداية). - معارضة وإغلاق حواف الجلد باستخدام قصاصات الجرح وضعت بعيدا كل 5-10 ملم.
- بدوره على ايزوفلوران في 1.5٪ -3٪ (الصيانة). رصد لعمق مخدر، بما في ذلك رد فعل لقرصة إصبع القدم، ومعدل التنفس، والحرف. ضبط معدل isoflurane حسب الحاجة للحفاظ على مستوى مناسب من التخدير.
- الانتعاش
- ضع الجرذ في قفص استعادة نظيف مع دعم الحرارة باستخدام وسادة التدفئة وضعت تحت القفص.
ملاحظة: لمنع ارتفاع الحرارة، ينبغي أن تكون وسادة التدفئة لا تكون على اتصال مباشر مع الحيوان ويجب أن لا تتجاوز 40 درجة مئوية. - مراقبة الحيوان حتى يتعافى تماما و normothermic (37.5-39 درجة مئوية).
ملاحظة: لا ينبغي ترك الحيوان دون مراقبة حتى يدرك تماما وصارما recumbent والتحرك بسهولة في جميع أنحاء القفص. - بعد أن يستيقظ تماما, المحمول, والتنفس بشكل جيد, حقن الفئران مع البوبرينورفين (1.0-1.2 ملغ / كغ SC).
ملاحظة: إعطاء البوبرينورفين في الفئران تخدير قد يضعف الانتعاش. - إدارة 10 مل من محلول رينغر الدافئة التي ترضع تحت الجلد بين شفرات الكتف.
- نقل الفئران مرة أخرى إلى قفص نظيفة وجمع شمل مع التخصصات.
- راقب جميع الحيوانات مرتين يوميا خلال الشهر التالي بحثا عن علامات الألم والضيق، بما في ذلك الانتفاخ أو الوضعية الحدبة أو فاتح الشهية أو علامات عدوى موقع الشق، بما في ذلك الحمامية أو التصريف القيحي أو تداهم الجروح.
ملاحظة: حتى الآن لم نلاحظ علامات سريرية (مثل العدوى) بعد التعافي بعد الجراحة في أي من الحيوانات. وكان فأر واحد فقط dehiscence مع الغرز، وبعد ذلك استخدمت مقاطع الجرح لإغلاق الجروح مع أي مشاكل أخرى. - إعطاء البوبرينورفين أو ميلوكسيكام للحيوانات التي تظهر علامات سريرية للألم في الجرعات المنشورة بالتشاور مع طبيب بيطري مختبر.
- إعطاء المضادات الحيوية (أي السيفالوسبورين) للحيوانات التي تظهر عليها علامات سريرية للألم بجرعات منشورة بالتشاور مع طبيب بيطري حيواني مختبري.
ملاحظة: أي تظهر عليها علامات طويلة من الألم أو الضيق لا تتحسن مع المسكنات أو الحيوانات التي تظهر عليها علامات العدوى التي لا تستجيب للمضادات الحيوية تحتاج إلى القتل الرحيم إنسانيا.
- ضع الجرذ في قفص استعادة نظيف مع دعم الحرارة باستخدام وسادة التدفئة وضعت تحت القفص.
6. التصوير بالأشعة السينية
- بعد زرع الورم، صور الساق والرئتين غير الغازية للكشف عن نمو الورم باستخدام الأشعة السينية مع جهاز مصمم للقوارض.
- تخدير الفئران كما فعلت سابقا.
- التقاط الصور في 3x التكبير لمدة 6 ق في 25 كيلو فولت.
- معالجة الفيلم باستخدام معالج الأشعة السينية. ويمكن أيضا مسح الصور الشعاعية رقميا.
7. إجراء التشريح
- القتل الرحيم الفئران مع CO2. تأكيد الوفاة عن طريق نقص ضربات القلب وسحب الدم على الفور 3 مل من القلب لعينات المصل أو البلازما.
- افتح الصدر والبطن لفحصها.
- عزل القصبة الهوائية والكنول مع قسطرة (18 غرام). لتأمين القسطرة في القصبة الهوائية، قم بربط خياطة حريرية حول القصبة الهوائية بالقسطرة.
- قم بتوصيل قسطرة التسريب بحقنة 3 أو 5 مل. غرس الفورمالين أو المالحة لتضخيم بلطف فصوص الرئة لعينات الأنسجة أفضل. على التسريب ، فإن الرئتين نفخة وتمكين تصور أفضل من الانبثاث الرئوي.
- فحص وتشريح ووزن جميع الأعضاء الصدرية والبطنية المختارة (مثل الكبد والكلى).
- إصلاح الأجهزة في الفورمالات لعلم الأمراض الأنسجة أو تجميد على الجليد الجاف، 2-ميثيل بوتان، أو النيتروجين السائل.
- لتقييم التعبير البروتين باستخدام لطخة الغربية، وجعل lysates من الأنسجة المجمدة. الأجسام المضادة التي تتفاعل مع أنسجة الفئران مفصلة13.
8. الكيمياء المناعية
- معالجة أنسجة نظام التشغيل الأولية، وتضمين في البارافين، وقسمه لتلطيخ المناعية الهسكيميائية.
- استرداد مستضد بعد إزالة التحلل باستخدام المخزن المؤقت سيترات (pH 6.0). احتضان في 0.3٪ H2O2 في الميثانول لمدة 30 دقيقة لإرواء البيروكسيداز الذاتية.
- كتلة أقسام البارافين سميكة 5 ميكرومتر باستخدام المصل العادي.
- احتضان مع الأجسام المضادة CD68 و CD3 الأولية (انظر الجدول) بين عشية وضحاها في 4 درجة مئوية.
- شطف المقاطع في برنامج تلفزيوني واحتضانها في البوليمر HRP باستخدام عدة الكشف.
ملاحظة: تم تطوير المناعة مع ديامينوبنزيدين ككروموجين.
9. النشاف الغربي
- Lyse الخلايا UMR-106 في 200-300 ميكرولتر من العازلة تحلل14 لأداء الكهربائي هلام القياسية والنشاف الغربي.
- استخدام 4٪ إلى 12٪ المواد الهلامية بيس تريس.
- احتضان في المضادة ErbB2، المضادة ErbB4، المضادة EGFR، المضادة للERK، β-أكتين أو المضادة للفأرة β2-AR الأجسام المضادة الأولية (انظر الجدول) والفجل الأجسام المضادة الثانوية المرتبطة peroxidase.
- إضافة الركيزة الشيميلوميني. تعريض الأغشية لفيلم الأشعة السينية.
ملاحظة: يتم استخدام مستويات β-actin كعناصر تحكم التحميل.
النتائج
وتستخدم الفئران المتجاوزة SD المناعة لهذه الدراسات نظام التشغيل، والذي يقدم نموذجا حيوانية مع نظام المناعة سليمة. لقد استخدمنا خط الخلية UMR106 من ATCC ، التي تم تطويرها من الخلايا التي تم عزلها في البداية من نظام التشغيل من فأر SD. زرعنا الخلايا في فئران SD ، وبالتالي توفير نموذج syngeneic لنظام التشغيل. يتم زرع خلايا UMR106 في الساق من الفئران SD الذكور والإناث البالغ من العمر 3 أسابيع ، ومحاكاة نموذج نظام التشغيل للأطفال. وعلاوة على ذلك، فإن زرع العظام من الخلايا UMR106 مباشرة في ميتافيزيقي الساق / diaphysis يعطي بيئة دقيقة الورم ذات الصلة.
عند زرع الخلايا السرطانية، يجب إدخال إبرة بشكل صحيح من خلال الهضبة الظنبوبية (الشكل 1) في الزاوية الصحيحة (بالتوازي مع رمح العظام) تمديد طرف الإبرة حوالي 10 ملم في التجويف المركزي للعظم. مع هذا الإجراء، 95٪ (52/55) من الفئران وضعت الأورام في الساق البعيدة في الركبة. مع تجربة الحقن الظنبوبي، 100٪ من الفئران وضعت الأورام. في مجموعة من الفئران التي لم يتم بترها، كان متوسط حجم الورم لدى الذكور 504 مم3 في 3 أسابيع و 1195 مم3 في 5 أسابيع بعد الزرع. في الإناث، يبلغ متوسط حجم الورم 285 مم3 في 3 أسابيع و 495 مم3 في 5 أسابيع بعد الزرع.
وقورنت مجموعتان من الفئران، بما في ذلك الفئران التي بترت (23 فأرا) (الشكل 2) والجرذان التي لم بتر (29 فأرا). تم قتل كلا الفوجين في 7 أسابيع بعد الزرع لفحص الانبثاث الورم إلى الرئتين. في مجموعة البتر (3/23) وضعت الفئران الانبثاث الرئوي. هذه الفئران الثلاثة ماتت أو تم قتلها في غضون 24 ساعة من الجراحة بسبب مضاعفات ما بعد الجراحة. توفي جرذان من التخدير لفترات طويلة بينما كان الجراح يتعلم هذه الطريقة. أصيب أحد الفئران بانحطاط وتم قتله في اليوم التالي. تم تقييم رئتي هذه الفئران الثلاثة وتم العثور على ثلاثة انبثاث صغيرة (>1 ملم) من الناحية النسيجية. الفئران ال 20 الناجية لم يكن لديها انبثاث رئوي بعد 7 أسابيع من الزرع. وهذا يشير إلى أن 3 أسابيع بعد الزرع بتر كافية لتقليل عدد الفئران مع الانبثاث الرئوي. في مجموعة ثانية من 29 الفئران التي لم يكن لديها إجراء البتر، وكان 26/29 الفئران الانبثاث الرئة بما يتفق مع البيانات المنشورة سابقا11. لم نر أي نمط في حجم أو عدد الانبثاث في هذه الفئران. معظم الفئران لديها أكثر من 10 الانبثاث قطرها 2-7 ملم مرئية بشكل صارخ التي تم أخذ عينات بسهولة أثناء التشريح. في بعض الأحيان ، كان لدى الفئران نقائل أكبر يصل قطرها إلى 10 مم. من المهم زرع خلايا UMR106 ذات عدد مرور منخفض ، حيث أظهرت الدراسات أن الخلايا ذات رقم المرور 10 أو أعلى تصبح أكثر عدوانية ونقائل في وقت مبكر من 2-3 أسابيع بعد الزرع. سبب الطبيعة غير معروف ولكن التكهنات هي أن الخلايا في الثقافة يمكن أن تتطور الطفرات التي تفضل الانبثاث.
بالإضافة إلى جراحة البتر، شملت عملية تحسين أخرى للطرق التصوير بالأشعة السينية لمراقبة الورم أو في التشريح. تسمح هذه الطريقة للباحث بتأكيد غزو ورم العظام في الفئران تحت التخدير. يمكن أيضا استخدام طريقة التصوير الشعاعي المخطط على الأطراف المبتورة مؤخرا أو الأطراف الثابتة. الطريقة سريعة (5 دقائق لكل فأر) وغير مكلفة ($2-5/rat) مقارنة بالتصوير المقطعي المحوسب (CT). بالنسبة لمراقبة الجسم الحي ، يتطلب تخدير الفئران أثناء التصوير. ويبين الشكل 3 الشكل المفصل الذي يراه التصوير بالأشعة السينية لأطراف مبتورة سابقا. هذه الطريقة تضيء الطبيعة العظمية والعظام لهذه الأورام. لاحظ اضطراب العمارة القشرية العظمية العادية للعظم والشظية في كلا المثالين (الأسهم البيضاء). يوضح الشكل 4 الشكل الإشعاعي للرئتين مع أو بدون الانبثاث. التصوير بالأشعة السينية يمكن أن تكشف بسرعة للمختبر، والحاجة إلى القتل الرحيم لمنع الوفيات العفوية لا لزوم لها.
الأورام الأولية والنقية إلى الرئة هي مماثلة من الناحية النسيجية لنظام التشغيل البشري عرض كل من العظام والعظام مورفولوجيا الورم. في نظام تشغيل الفئران، يتم تأكيد كل من مورفولوجيا الورم العظمي والعظام عن طريق علم الأنسجة للأطراف المبتورة في الشكل 5 والشكل 6. لاحظ أن العظم القشري غائب في هذا المثال ويتم أيضا استبدال العظام المجاورة أو محصنة بعظم منسوج جديد (exostoses) موجه عموديا إلى العمود الحالي للقشرة. تظهر جزر من العظم غير الناضج (مادة خارج الخلية غير متبلور) داخل مثال الورم. بالإضافة إلى ذلك ، تظهر مورفولوجيا المجهرية من الانبثاث الرئة ، وبعضها مع العظام المعدنية ، وورم الاوعية الدموية emboli في الشكل 7.
بتر الأطراف مع نظام التشغيل يزيد من البقاء على قيد الحياة في الفئران. يمكن أن تموت الفئران تلقائيا بسبب الانبثاث الرئوي الذي يؤوي لأكثر من 7 أسابيع بعد الزرع. يمكن أن يسمح استخدام البتر بإجراء مزيد من التحقيق في علاج السرطان القياسي أو المستهدف في هذا النموذج. إطالة الوقت بين زرع الورم وبتر الأطراف سيزيد من حدوث الانبثاث.
الدوكسوروبيسين هو عامل العلاج الكيميائي المستخدمة لعلاج نظام التشغيل في البشر. في الفئران، يمكن إعطاء الدوكسوروبيسين عن طريق الحقن الوداجي13 أو القسطرة15 كما هو موضح هنا. الحقن الوداجي لا تتطلب 5-10 دقيقة لكل فأر ولكن يضمن تسليم الجرعة في الوريد المكشوفة. عموما, الحقن الوداجي هي أكثر من ذلك بكثير استنساخها بالمقارنة مع حقن الوريد ذيل الفئران. إذا تسرب الدوكسوروبيسين إلى الأدمة أثناء حقن الوريد الذيل، يمكن أن يحدث نخر الذيل ومنع المزيد من العلاجات. في هذه الدراسة, تم علاج خمسة فئران مع 2 ملغم / كغ جرعة من الدوكسوروبيسين والقتل الرحيم 48 ح حقن آخر للتحقيق في موت الخلايا في الأورام كما هو مبين في الشكل 5A, B.
كما تم تقييم خمسة فئران مراقبة عولجت بالمحلول الملحي لاختيار الأجسام المضادة التي يمكن استخدامها لاحتواء الخلايا المناعية في الجرذان OSs. هنا، تم اختبار جسمين مضادين لالخمول المناعي. لدراسات الكيمياء المناعية، تم إصلاح الأورام في الفورمالين لمدة 48-72 ساعة ثم انتقلت إلى الإيثانول 70٪ للحد من البروتين عبر الربط الذي يحدث في الفورمالين. تم إجراء الكيمياء المناعية لاختراقات الخلايا المناعية في أورام نظام التشغيل الأولية وملطخة بالمناعة لل الضامة (CD68) والخلايا التائية (CD3). يظهر الشكل 8 مثالين على بقع المناعة للخلايا المناعية التي تتسلل داخل البيئة الدقيقة للورم.
كما تم استكشاف الأهداف المحتملة للتدخل العلاجي. بعد بتر الأطراف مع الأورام، تم تجميد عينات نظام التشغيل الفئران لعزل البروتين في المستقبل. في هذه الدراسة، اكتشفنا أن خلايا UMR106 تعبر عن بروتينات مسار عائلة ErbB. البقع الغربية التي أجريت على lysates البروتين الخلية UMR106 إظهار التعبير عن ErbB2، EGFR، ErbB4، وغيرها من البروتينات التي تتفاعل مع هذه المسارات (الشكل 9).

الشكل 1:الساق مع إبرة زرع الورم إدراجها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الساقية أثناء إجراء البتر مع إزالة الجلد (أ), الشريان الفخذي المكشوف والوريد (ب), مع العضلات مرتفعة من عظم الفخذ (C), وفي الفئران 3 أسابيع بعد جراحة البتر (D). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
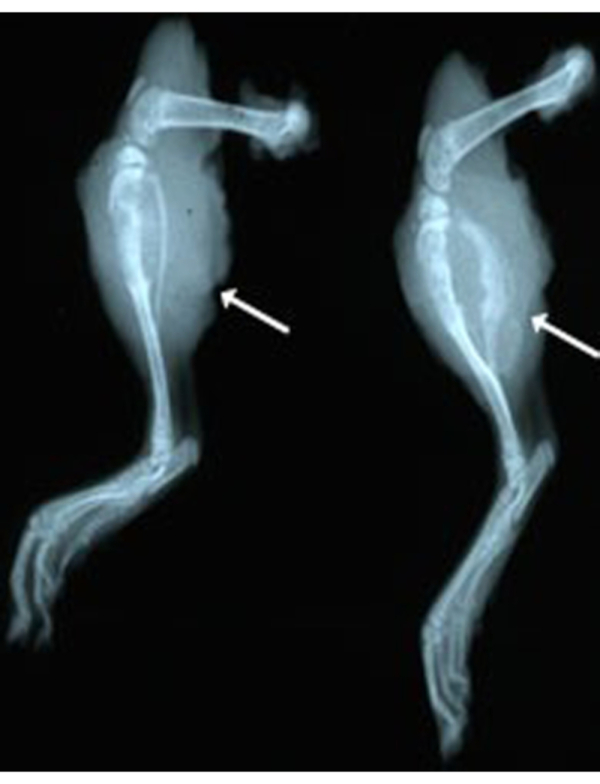
الشكل 3:الأشعة السينية بالأشعة السينية للساقين اليمنى بعد البتر (ex vivo) من جرذين مع نظام التشغيل. لاحظ الطبيعة العظمية والعظامية للورم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: صور الأشعة السينية لرئتي الفئران. (ب) مع الانبثاث الرئوي OS. (ج)ارتباط إلى الأمراض الإجمالية من الانبثاث في الرئة المتضخم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: (أ) الأنسجة الهستورية لنظام التشغيل مع 90٪ من الخلايا التي تظهر موت الخلية في ورم الساق 48 ح بعد جرعة من 2 ملغم / كغ دوكسوروبيسين. (ب) موت الخلايا السرطانية (السهم) في نظام التشغيل الأولي الظنبوبي في 48 ساعة بعد جرعة من 2mg/kg doxorubicin. لاحظ أن الزاوية العلوية اليمنى واليسارية تحتوي على خلايا قابلة للحياة. (ج) غزو نظام التشغيل في العظام القشرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: (أ) علم الأنسجة من نظام التشغيل الذي حل محل خلايا نخاع العظام وتسللت إلى القشريات من الساق. لاحظ نمو العظام الجديد التفاعلي المصاحب لأنه خارج الطبقات وعمودي إلى القشرة الموجودة من قبل. (ب) فحص الطاقة العالية من الخلايا السرطانية OS المتاخمة لجزيرة العظام. (ج) فحص الطاقة العالية من خلايا نظام التشغيل جزءا لا يتجزأ من مصفوفة خارج الخلية الوردي إلى الأزرق (osteoid). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: (أ) الانبثاث الرئوي متعددة في الفئران مع زرع ورم الساق. (ب) خلايا نظام التشغيل الورم في الانسداد في الشريان الرئوي الصغيرة فرع السفينة المتاخمة لبرونيكول تحت الوعاء. (ج)بعض الانبثاث الرئوي تحتوي على جزر من العظام في حين أن الانبثاث الأخرى هي أكثر الخلوية. (د) قوة أعلى من الانبثاث مع خلايا نظام التشغيل مختلطة مع جزر من العظام المعدنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8:الكيمياء المناعية (A) الضامة المناعية CD68 و (B) الخلايا التائية المناعية التي تظهر خلايا إيجابية CD3 في نظام التشغيل في الساق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: بروتينات مسار ErbB المعبر عنها في خلايا نظام التشغيل UMR106 من أورام الساق. تم فحص ال ليسات من الأورام الأولية للتعبير عن البروتين من مسار نقل إشارة إشارة ErbB ، بما في ذلك ErbB2 ، EGFR ، ErbB4 ، AKT ، ERK1 /2 ، ومستقبلات β2-adrenergic مع actin كتحكم في التحميل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الفئران مع زراعة الظنبوب OS تطوير أورام قابلة للقياس من قبل 3 أسابيع بعد زرع. إذا تم بتر الأطراف المصابة بالأورام بعد 3 أسابيع من الزرع ، يتم تقليل حدوث انبثاث الرئة بشكل كبير. OSs هي على حد سواء هشاشة العظام والعظام. الفئران دون بتر تطوير الانبثاث الرئة التي هي متعددة ومتباينة الحجم، لوحظ من قبل التصوير الشعاعي أو في التشريح من قبل 7 أسابيع بعد الزرع. يتم التعبير عن EGFR، ErbB2، وErbB4 في نظام التشغيل UMR106 الفئران، على غرار نظام التشغيل البشري16،17،18. CD3 يتم الكشف عن الخلايا T والكواعم بسهولة في نظام التشغيل عن طريق أساليب الكيمياء المناعية. ويفضل حقن الوريد الوداجي إلى الوريد الذيل لتسليم دوكسوروبيسين العلاج الكيميائي, دواء يعطى لمرضى نظام التشغيل. الطريقة الموصوفة هنا هي بتر كوكسوفيديمورال كامل. هذا الإجراء هو صقل ويمكن النظر في استبدال الورم إزالة الطريقة الجراحية (عظم الفخذ) حيث يتم قطع العظام وترك جذع للمريض8. وتقترح الدراسة إزالة الأطراف بالكامل للحد من احتمال الألم والمضاعفات بعد الجراحة.
هناك عدد من الخطوات الهامة في هذا البروتوكول. أولا، من المهم ملاحظة مرور الخلايا السرطانية واستخدام الممر السفلي للخلايا للدراسات للحفاظ على النموذج متسقا من تجربة إلى أخرى. خلايا المرور القديمة تصبح أكثر عدوانية مع مرور الوقت في الثقافة. ثانيا، استخدام إبرة من الحجم المناسب وحقنة هاملتون سوف تساعد في حقن الخلايا بشكل صحيح في الساق في حجم صغير جدا من 20 ميكرولتر، وهو حجم يحدد على أنه الأمثل ولم يسبب تسرب. ثالثا، يحتاج الجراح في البداية إلى ممارسة التفكك عند القيام بالنخر على الفئران ذات العمر المماثل لتعلم ميكانيكا الإجراء. رابعا، لنجاح البتر، حافظ على التنظيم الحراري وحد من وقت الجراحة. يمكن للجراح ذو الخبرة إكمال عملية البتر في غضون 15 دقيقة.
ولوحظ أن أناmplantation من الخلايا في الساق تحسنت كثيرا عندما تم استخدام إبرة أكبر تتحمل لجعل الفتحة الأولية تليها إدخال أصغر تحمل إبرة حقنة هاملتون. هذا يحمي حقنة هاملتون من الكسر ومملة مع مرور الوقت. يمكن أن تحتوي حقن هاملتون على أحجام صغيرة مثل 10 ميكرولتر. فإن 1 مل الحقن الدرنة لا تكون دقيقة بما يكفي لزرع 20 ميكرولتر. تم استخدام نفس حقنة هاملتون لجميع الفئران المزروعة في يوم واحد ولكن تم غسلها بين العمليات الجراحية لكل فأر. تجنب الالاستعباد التلقائي للمحاقن هاملتون لأنها عرضة للكسر. في نهاية الإجراء، اغسله بالمحلول الملحي (10 مرات) ثم مع الإيثانول بنسبة 100٪ (10 مرات) والسماح له بالجفاف مع إزالة المكبس لتخزينه.
تم استخدام الجلد والغرز تحت الجلد في البداية لإغلاق الشق ، ومع ذلك تم العثور على فأر واحد مع الانحطاط في اليوم التالي للجراحة. استخدام قصاصات الجرح والغراء الجراحي لإغلاق شق تحسين الأسلوب. مع هذا الصقل، لم يكن لدى أي فئران أخرى أي مضاعفات ما بعد الجراحة. إدراج التصوير الشعاعي للرئتين بالأشعة السينية يصقل هذا النموذج لإثبات الانبثاث الرئوي في الفئران مما يسمح بالقتل الرحيم الذي هو في الوقت المناسب ويمنع الوفيات غير المتوقعة. صور الأشعة السينية تسمح لنا لتحديد الطبيعة العظمية والعظام من هذه OSs الفئران، على غرار OSS الإنسان.
من الضروري وجود مستوى معتدل من الخبرة الجراحية لإجراء عملية البتر. الخطوة الأكثر صعوبة هي تشريح في العضلات لتحديد موقع المفصل كوكسوفيديمورال. التكبير والإضاءة الجيدة مهمة خلال هذه الخطوة. يمكن تحقيق الخبرة الجراحية من خلال الممارسة على الحيوانات التي تم قتلها. بعد حوالي 10 فئران ، يجب أن يكون الجراح واثقا من بتر أحد أطرافه باستخدام نظام التشغيل من فأر حي تحت التخدير.
وتستند الأساليب القائمة لإزالة الأطراف مع ساركوماس في الفئران والجرذان على إزالة الساق عن طريق قطع عظم الفخذ والعضلات منتصف رمح وترك الجذع8. على الرغم من أن هذا قد يكون مفيدا لبعض التحقيقات، في هذه الدراسة، تمت محاولة إزالة الساق بالكامل. وتبين أن الإجراء مرض ولم يقدم أي مضاعفات بعد الجراحة. في الفئران ذات جذع الأطراف الخلفية ، يمكن أن يكون هناك المزيد من آلام الجلد أو العضلات أو الأعصاب بعد الجراحة. ترك جذع، يمكن للفئران الوصول حولها والوصول إلى موقع الجراحة. الفئران تفعل بشكل جيد جدا بعد البتر وambulate جيدا في القفص مع hindlimb واحد.
تشمل مزايا بتر الأطراف الكامل إزالة الورم الأساسي قبل أن يصبح كبيرا ومؤلما جدا للفئران. الأهم من ذلك، إزالة الورم الأساسي سوف تساعد على السيطرة على الانبثاث الورم الأولي إلى الرئة. يمكن مواصلة دراسة الفئران التي بترت من أجل اختبار فعالية العلاجات الجديدة على الخلايا السرطانية المتداولة في الدم أو في الميثاستاز في الشعيرات الدموية في الرئتين أو العظام الأخرى.
هناك حاجة كبيرة لتطوير علاجات السرطان الجديدة لنظام التشغيل وغيره من الساركوما ، وخاصة العلاجات التي لديها نشاط المخدرات ضد التقدم النقيلي. بالمقارنة مع العلاجات الجديدة التي تم تطويرها لأنواع السرطان الأخرى ، فإن العلاجات لنظام التشغيل لم تتقدم للأسف في عقود عديدة. وردا على هذه المشكلة، عقد اجتماع للقادة والخبراء الرئيسيين في نظام التشغيل والانبثاث لوضع مبادئ توجيهية لتحسين تطوير الأدوية OS19. ووفقا لاقتراحات الفريق، وضعت دراسات لتحسين نموذج الفئران قبل السريرية، وهو نموذج أقل شهرة من نظام التشغيل. باختصار، يقوم البتر والتصوير بصقل نموذج الفئران قبل السريرية لمزيد من الاستخدام من قبل مجتمع أبحاث الساركوما. سيسمح إجراء البتر بتحسين بقاء المريض لعدة أشهر مما يتيح تقييم فعالية العلاجات الجديدة على الميكروميتاسيات أو الأورام الخاملة أو لاختبار سمية العلاجات مع نموذج مع طول عمر أفضل.
باختصار، نحن نقدم ميزة هذا النموذج نظام التشغيل. وتستخدم الفئران المناعة SD الأصيلة لتوفير نموذج syngeneic مع زرع UMR106 OS خط الخلية معزولة عن نظام التشغيل الفئران SD. الورم الأساسي والنقي يشبه نظام التشغيل في البشر. وتستخدم الفئران الذكور والإناث الأحداث لدراسات زرع الورم UMR106 النمذجة ساركوما الأطفال. يتم وضع العظام للخلايا المزروعة مباشرة في الساق لبيئة دقيقة الورم ذات الصلة. الورم الأساسي ينتشر إلى الرئة ويمكن رصد الانبثاث عن طريق التصوير في الجسم الحي مع طريقة الأشعة السينية. يعبر نظام تشغيل الفئران عن البروتينات المشتركة مع نظام التشغيل البشري ، مثل ErbB2. بالمقارنة مع نظام التشغيل الكلب، نموذج الفئران يسمح لأعداد أكبر من الحيوانات لاستخدامها في وقت واحد. الفئران هي 10 مرات أكبر من الفئران لسهولة الحقن الظنبوب، والجراحة، والتصوير، وسحوبات الدم، وخزعة. طول عمر الفئران هو أكثر ضمانا مع البتر وهذا النموذج يمكن الجمع بين العلاج neoadjuvant، وبتر والعلاج المساعد مما يسمح لتحسين بقاء المريض تمكين تقييم فعالية العلاجات على ميكروميتاستاس أو الأورام نائمة. ويمكن أيضا تقييم السمية خارج الهدف في هذا النموذج حيث يمكن علاج الفئران مع السرطان العلاجية مثل الدوكسوروبيسين ورصدها على المدى الطويل لسمية القلب الناجمة عن الدوكسوروبيسين أو تكرار نظام التشغيل. وهذا من شأنه أن يسمح لاختبار عوامل حماية القلب في نموذج مع نظام التشغيل.
Disclosures
لا إفصاح للإعلان عنه.
Acknowledgements
تمويل المعاهد القومية للصحة من خلال المعهد الوطني للسرطان، منحة # CA228582. شون إيشياما يتلقى حاليا منحة من شركة Toray الطبية المحدودة.
Materials
| Name | Company | Catalog Number | Comments |
| AKT | Cell Signaling TECHNOLOGY | 4685S | |
| absorbable suture | Ethicon | J214H | |
| β-actin | SANTA CRUZ BIOTECHNOLOGY | sc-47778 | |
| β2-AR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-569 | replaced by β2-AR (E-3): sc-271322 |
| Bis–Tris gels | Thermo Fisher | NP0321PK2 | |
| Buprenorphine SR Lab | ZooPharm | IZ-70000-201908 | |
| CD3 antibody | Dako | #A0452 | |
| CD68 antibody | eBioscience | #14-0688-82 | |
| Chemiluminescent substrate | cytiva | RPN2232 | |
| CL-Xposure film | Thermo Fisher | 34089 | |
| Complete Anesthesia System | EVETEQUIP | 922120 | |
| diaminobenzidine | VECTOR LABORATORIES | SK-4100 | |
| Doxorubicin | Actavis | NDC 45963-733-60 | |
| EGFR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-03 | replaced by EGFR (A-10): sc-373746 |
| ERBB2 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-284 | replaced by Neu (3B5): sc-33684 |
| ERBB4 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-283 | replaced by ErbB4 (C-7): sc-8050 |
| ERK antibody | SANTA CRUZ BIOTECHNOLOGY | sc-514302 | |
| eye lubricant | PHARMADERM | NDC 0462-0211-38 | |
| Hamilton syringe (100 µL) | Hamilton | Model 1710 SN SYR | |
| horseradish peroxidase-linked secondary antibody | cytiva | NA934 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7401 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7402 | |
| isoflurane | BUTLER SCHEIN | NDC 11695-6776-2 | |
| isoflurane vaporizer | EVETEQUIP | 911103 | |
| UMR-106 cell | ATCC | CRL-1661 | |
| X-ray | Faxitron | UltraFocus | |
| X-ray processor | Hope X-Ray Peoducts Inc | MicroMax X-ray Processor | Hope Processors are not available in USA anymore |
| wound clips | BECTON DICKINSON | 427631 |
References
- Link, M. P., et al. The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity. New England Journal of Medicine. 314 (25), 1600-1606 (1986).
- Bielack, S. S., et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. Journal of Clinical Oncology. 20 (3), 776-790 (2002).
- Botter, S. M., Neri, D., Fuchs, B. Recent advances in osteosarcoma. Current Opinion in Pharmacology. 16, 15-23 (2014).
- Ek, E. T. H., Dass, C. R., Choong, P. F. M. Commonly used mouse models of osteosarcoma. Critical Reviews in Oncology Hematology. 60 (1), 1-8 (2006).
- Guijarro, M. V., Ghivizzani, S. C., Gibbs, C. P. Animal models in osteosarcoma. Frontiers Oncology. 4, 189(2014).
- Janeway, K. A., Walkley, C. R. Modeling human osteosarcoma in the mouse: From bedside to bench. Bone. 47 (5), 859-865 (2010).
- Mohseny, A. B., Hogendoorn, P. C., Cleton-Jansen, A. M. Osteosarcoma models: from cell lines to zebrafish. Sarcoma. 2012, 417271(2012).
- Khanna, C., et al. An orthotopic model of murine osteosarcoma with clonally related variants differing in pulmonary metastatic potential. Clinical & Experimental Metastasis. 18 (3), 261-271 (2000).
- Martin, T. J., et al. Parathyroid hormone-responsive adenylate cyclase in induced transplantable osteogenic rat sarcoma. Nature. 260 (5550), 436-438 (1976).
- Fisher, J. L., Mackie, P. S., Howard, M. L., Zhou, H., Choong, P. F. The expression of the urokinase plasminogen activator system in metastatic murine osteosarcoma: an in vivo mouse model. Clinical Cancer Research. 7 (6), 1654-1660 (2001).
- Yu, Z., et al. Establishment of reproducible osteosarcoma rat model using orthotopic implantation technique. Oncology Reports. 21 (5), 1175-1180 (2009).
- Zhang, P., et al. Homologous mesenchymal stem cells promote the emergence and growth of pulmonary metastases of the rat osteosarcoma cell line UMR-106. Oncology Letters. 8 (1), 127-132 (2014).
- Gabrielson, K., et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Research. 67 (4), 1436-1441 (2007).
- Sysa-Shah, P., et al. Bidirectional cross-regulation between ErbB2 and β-adrenergic signalling pathways. Cardiovascular Research. 109 (3), 358-373 (2016).
- Wachtman, L. M., Browning, M. D., Bedja, D., Pin, S., Gabrielson, K. L. Validation of the use of long-term indwelling jugular catheters in a rat model of cardiotoxicity. Journal of American Association Laboratory Animal Science. 45, 55-64 (2006).
- Abdou, A. G., et al. The Prognostic role of Ezrin and HER2/neu expression in osteosarcoma. Applied Immunohistochemistry & Molecular Morphology. 24 (5), 355-363 (2016).
- Hughes, D. P., Thomas, D. G., Giordano, T. J., McDonagh, K. T., Baker, L. H. Essential erbB family phosphorylation in osteosarcoma as a target for CI-1033 inhibition. Pediatric Blood & Cancer. 46 (5), 614-623 (2006).
- Wen, Y. H., et al. Epidermal growth factor receptor in osteosarcoma: expression and mutational analysis. Human Pathology. 38 (8), 1184-1191 (2007).
- Khanna, C., et al. Toward a drug development path that targets metastatic progression in osteosarcoma. Clinical Cancer Research. 20 (16), 4200-4209 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved