Method Article
Ein syngenes orthotopes Osteosarkom Sprague Dawley Rattenmodell mit Amputation zur Kontrolle der Metastasenrate
In diesem Artikel
Zusammenfassung
Hier wird eine syngene orthotope Implantation gefolgt von einem Amputationsverfahren des Osteosarkoms mit spontaner Lungenmetastasierung beschrieben, das zur präklinischen Untersuchung der Metastasenbiologie und entwicklung neuartiger Therapeutika eingesetzt werden kann.
Zusammenfassung
Der jüngste Fortschritt in der Behandlung des Osteosarkoms (OS) erfolgte in den 1980er Jahren, als gezeigt wurde, dass die Multi-Agent-Chemotherapie das Gesamtüberleben im Vergleich zur Operation allein verbessert. Um dieses Problem anzugehen, besteht das Ziel der Studie darin, ein weniger bekanntes Modell des Os bei Ratten mit einem umfassenden histologischen, bildgebenden, biologischen, Implantations- und Amputationschirurgieansatz zu verfeinern, der das Überleben verlängert. Wir verwendeten ein immunkompetentes, ausgezüchtetes Sprague-Dawley (SD), syngenes Rattenmodell mit implantierter UMR106 OS-Zelllinie (ausgehend von einer SD-Ratte) mit orthotopen Tibiatumorimplantaten in 3 Wochen alte männliche und weibliche Ratten, um das pädiatrische OS zu modellieren. Wir fanden heraus, dass Ratten reproduzierbare primäre und metastasierende Lungentumoren entwickeln und dass Amputationen der Gliedmaßen 3 Wochen nach der Implantation die Inzidenz von Lungenmetastasen signifikant reduzieren und unerwartete Todesfälle verhindern. Histologisch gesehen waren die primären und metastasierenden OS bei Ratten dem menschlichen OS sehr ähnlich.Unter Verwendung immunhistochemischer Methoden zeigt die Studie, dass Ratten-OS mit Makrophagen und T-Zellen infiltriert werden. Eine Proteinexpressionsuntersuchung von OS-Zellen zeigt, dass diese Tumoren Kinasen der ErbB-Familie exprimieren. Da diese Kinasen auch in den meisten menschlichen Betriebssystemen stark exprimiert werden, könnte dieses Rattenmodell verwendet werden, um ErbB-Signalweginhibitoren für die Therapie zu testen.
Einleitung
Das Osteosarkom (OS) ist der häufigste primäre Knochentumor bei Kindern, Jugendlichen und jungen Erwachsenen. Der jüngste Fortschritt in der Behandlung von OS trat in den 1980er Jahren auf, als gezeigt wurde, dass die Multi-Agent-Chemotherapie das Gesamtüberleben im Vergleich zur Operation allein verbessert1. OS entwickelt sich während des schnellen Knochenwachstums, typischerweise in langen röhrenförmigen Knochen wie Femur, Tibia und Humerus. Sie zeichnen sich durch ein osteolytisches, osteoblastisches oder gemischtes Aussehen mit bemerkenswerter periostaler Reaktionaus 2. Chemotherapie und chirurgische Resektion können das Ergebnis für Patienten mit einem 5-Jahres-Überleben für 65% der Patienten verbessern2,3. Leider haben hochgradige OS-Patienten mit metastasierender Erkrankung ein Überleben von 20%. OS dringt regional ein und metastasiert hauptsächlich in die Lunge oder andere Knochen und ist häufiger bei Männern. Das dringendste Bedürfnis für diese jungen Patienten ist eine neuartige Therapie, die die Lebensfähigkeit von Fernmetastasen verhindert und beseitigt.
OS präklinische Modelle wurdenüberprüft 4,5,6,7 und es wurden nur wenige verfügbare immunkompetente Modelle unter Amputation des orthotopen OS entwickelt. Im Jahr 2000 wurde ein wichtiges Modell unter Verwendung von BALB/c-Mäusen mit orthotopem syngenem OS und Amputation entwickelt8. Im Vergleich zu diesem Mausmodell basiert das Rattenmodell auf genetisch gezüchteten und 10-mal größeren Tieren, was zu einigen Vorteilen führt. Das Rattenmodell UMR106 wurde aus einem 32P induzierten OS in einer Sprague Dawley (SD) Ratte entwickelt, das in eine Zelllinie9abgeleitet wurde. Im Jahr 2001 wurde die orthotope Implantation von UMR106-01 erstmals in implantierten Tibien von athymischen Mäusen mit schneller, konsistenter Primärtumorentwicklung und radiologischen, histologischen Merkmalen beschrieben, die mit dem Os beim Menschen gemeinsam sind. Lungenmetastasen entwickelten sich und waren abhängig von der orthotopischen Platzierung von UMR106 in der Knochenmikroumgebung10. Im Jahr 2009 etablierten Yu et al.11 ein reproduzierbares orthotopes Femur-OS-Rattenmodell unter Verwendung von UMR106-Zellen bei größeren männlichen SD-Ratten. Die erfolgreichen Tumorimplantationen und die Lungenmetastasierungsrate bei Ratten ohne Amputation ähnelten den hier vorgestellten Daten. In dieser Studie wurde eine zusätzliche Amputation des Modells mit jungen Ratten durchgeführt, was darauf hindeutet, dass der Zeitpunkt der Primärtumorentfernung für die Modellierung des OS entscheidend ist, insbesondere im Zusammenhang mit der metastatischen Progression. Mit dieser Verfeinerung verbessern Amputation und In-vivo-Bildgebung dieses Modell für präklinische Studien zur Bewertung neuartiger Medikamente für OS.
Protokoll
Alle Verfahren und Experimente mit Ratten wurden gemäß den vom Johns Hopkins Animal Care and Use Committee genehmigten Protokollen durchgeführt.
1. Das SD-Ratten-OS-Zelllinien-UMR-106-Zellkulturprotokoll
- Züchtung von Zellen in DMEM, ergänzt mit 10% (v/v) FBS, Penicillin (10 U/ml)-Streptomycin (10 U/ml) bei 37 °C in befeuchteter 5%CO2-Atmosphäre. Führen Sie Experimente mit Zellen mit Passagen von 2-812 durch.
2. Intratibiale Injektion von OS-Zellen Protokoll
HINWEIS: Zeitversetzte trächtige SD-Ratten gebären in der Tiereinrichtung und im Alter von 3 Wochen werden Würfe verwendet (da die UMR 106-Zelllinie mit SD-Ratten syngen ist, ist keine Bestrahlung erforderlich).
- Induktion
- Legen Sie die Ratte in eine mittelgroße Induktionskammer und induzieren Sie eine Anästhesie mit 2% -3% Isofluran. Überwachen Sie das Tier kontinuierlich auf die Tiefe der Anästhesie durch Reflex auf Zehendrücken, Atemfrequenz und Charakter.
- Führen Sie die Nase in den Nasenkegel ein. Bei Bedarf mit Klebeband sichern.
- Entfernen Sie die Haare am rechten Bein bis zum ventralen und dorsalen Unterbauch mit einem Haarschneider oder verwenden Sie Enthaarungsmittel. Legen Sie die Ratte in Rückenlage.
- Schrubben Sie den Operationsbereich aseptisch mit 70% Ethanol und verdünnen Sie Chlorhexidindiacetat oder verdünntes Betadin. Beginnen Sie um den Bereich des Knies herum und schrubben Sie in einer kreisförmigen Bewegung sowohl proximal als auch distal. Wiederholen Sie diesen Schritt dreimal. Für die Tumorimplantation wird kein Vorhang verwendet.
- Tragen Sie Augengleitmittel in beide Augen der Ratte auf, um eine durch Anästhesie verursachte Hornhautaustrocknung zu verhindern. Legen Sie die Ratte auf ein Heizkissen mit niedriger Wärmeeinstellung. Stellen Sie sicher, dass die Ratte eine normale Körpertemperatur (37 °C) und eine normale Atemfrequenz hat.
- Chirurgie
- Schalten Sie Isofluran bei ~ 1,5% -2% ein (zur Wartung). Stellen Sie sicher, dass sich das Tier auf einer angemessenen Anästhesieebene befindet, da kein Zehen-Pinch-Reflex vorhanden ist. Wenn nicht, erhöhen Sie den Isoflurananteil auf 2,5%.
- Markieren Sie eine sterile Nadel (ca. 22 G) 10 mm von der Spitze entfernt, um die Tiefe des Einsetzens zu bestimmen.
- Führen Sie die Nadel 10 mm nach unten in die Diaphyse der Tibia ein, indem Sie in das gebeugte Knie in der Mitte des Tibiaplateaus eintreten und die Nadel durch die Metaphyse in die Diaphyse mit einer leichten bohrerartigen Bewegung ausstrecken, um eine Öffnung zu machen. Entfernen Sie die Nadel.
- Laden Sie die Zellsuspension direkt vor der Injektion in die Tibia in die Hamilton-Spritze. Mischen Sie dazu die Zellen vorsichtig, bevor Sie sie in die Spritze ziehen, da sich die Zellen durch die Schwerkraft im Boden des Röhrchens niederlassen.
HINWEIS: Die Zellen können in einem 1,5 bis 2 ml Röhrchen (bei Raumtemperatur) gelagert werden, bevor sie nach sorgfältigem Mischen in die Hamilton-Spritze (100 μL) eingezogen werden. Die Zellen können während des Implantationsverfahrens für 2-3 h bei Raumtemperatur gehalten werden. Überprüfen Sie immer die Zelllebensfähigkeit der Zellen in der Röhre vor und nach der Implantationssitzung. Der Trypanblau-Ausschluss ist die einfachste Methode zur Beurteilung der Zelllebensfähigkeit. - Sobald der Knochen mit der ersten Nadel durchquert ist, führen Sie eine zweite Nadel (Nadel mit kleinerem Durchmesser, die ebenfalls bei 10 mm markiert ist) ein, die an der mit Zellen beladenen 100 μL Hamilton-Spritze befestigt ist. Stellen Sie sicher, dass Sie die Nadel bis zur 10-mm-Markierung in das gleiche Loch einführen, das in die Diaphyse reicht.
- Geben Sie 20 μL von 75.000 OS-Zellsuspensionen in PBS vorsichtig in die Diaphyse und die Markhöhle ab.
HINWEIS: Die Nadel sollte nicht im Knochen wackeln und sich sicher anfühlen. Wenn sich die Nadel leicht bewegt, kann der Kortex an der Diaphyse durchquert worden sein. Wiederholen Sie die Einführung erneut, um vor der Injektion von Zellen eine festere Platzierung zu erhalten. - Entfernen Sie die Hamilton-Nadel vom Knochen.
HINWEIS: Wenn sich ein kleiner Blutstropfen bildet, üben Sie leichten Druck aus. Wenn sich an der Punktionsstelle ein klarer Flüssigkeitstropfen bildet, wurde die Nadel möglicherweise nicht weit genug im Knochen ausgefahren und die Tumorzellsuspension ist möglicherweise durch das Loch zurückgesickert. Notieren Sie dies in den Notizen, aber im Allgemeinen wird die Tumorimplantation erfolgreich sein. Mit Erfahrung sollte das Tumorimplantationsverfahren 5 Minuten pro Ratte dauern. Mit der Erfahrung wird die Tumorimplantation von Zellen in den Knochen einfacher. Die versehentliche Injektion von Zellen in den Muskel um den Knochen herum führt möglicherweise nicht zu der Tumormikroumgebung, die für die Lungenmetastasierung erforderlich ist.
- Genesung
- Stellen Sie sicher, dass die Ratte normotherm ist. Legen Sie die Ratte in einen Käfig mit einem Heizkissen, das zur Genesung unter dem Käfig platziert ist.
- Nachdem sie vollständig wach, beweglich und gut atmen, injizieren Sie den Ratten Buprenorphin (1,0-1,2 mg/kg SC).
HINWEIS: Um Zugang zu Buprenorphin zu erhalten, erkundigen Sie sich bei der Institution, um Optionen für die Genehmigung durch das Veterinärpersonal zu sehen, um die Bestellung aufzugeben. - Bringen Sie die Ratten zurück in saubere Käfige und überwachen Sie sie einmal täglich, jede Woche.
3. Messung und Überwachung
- Messen Sie die Tumorgröße 9-10 Tage nach der Implantation und dann alle 2 Tage bis 3 Wochen nach der Implantation, um eine Wachstumsrate zu ermitteln. Messen Sie den maximalen Durchmesser des Schienbeins mit einem elektronischen oder manuellen Bremssattel. Speichern Sie die Daten in einer Tabelle mit einer Formel zur Berechnung des Tumorvolumens. Messen Sie die kontralaterale (nicht implantierte Tibia) als Basislinie.
HINWEIS: Die implantierten Hinterbeindurchmesser werden als Surrogat für die Tumorgröße verwendet. Die Hintergliedmaßen werden senkrecht zur Tibia-Längsachse am größten Durchmesser für zwei Messungen gemessen, ventral/dorsal und media/lateral an der Extremität. Das geschätzte Tumorvolumen wird nach der Formel11berechnet: Tumorvolumen (mm3)= größter Durchmesser (mm) x kleinster Durchmesser (mm)2/2. - Betrachten Sie die Ratten für die Überlebensamputation oder Chemotherapie-Behandlung, wenn sich Tumore 15 mm in der größten Dimension oder 3 Wochen nach der Tumorimplantation nähern. Die kontralaterale Extremität misst bei den meisten Ratten in diesem Alter etwa 7-9 mm.
4. Intravenöse Verabreichung von Doxorubicin
- Betäuben Sie die Ratten mit 2% Isofluran. Bereiten Sie die Haut über die Halsvene mit drei chirurgischen Waschungen unter Verwendung von Betadin und Alkohol wie beschriebenvor 13.
- Visualisieren Sie unter sorgfältiger Dissektion die rechte oder linke Jugularvene. Führen Sie die Nadel in den darüber liegenden Muskel ein und richten Sie sie dann in Richtung des Kopfes der Ratte in das Lumen der Jugularvene, wie es in der Jugularvene vor dem Musculus pectoralis sichtbar ist.
- Wenn die Nadel in die Halsvene eingeführt wird, ziehen Sie vorsichtig Blut in die Spritze, um eine ordnungsgemäße Einführung zu gewährleisten. Es ist möglich zu glauben, dass die Nadel durch die Vene ist, aber die Nadel ist unter der Vene und nicht im Lumen. Wenn die Jugularvene beim stumpfen Sezieren zu klein für Injektionen wird, um die Jugularvene freizulegen, verwenden Sie die andere Jugularvene für die Injektion.
- Doxorubicin (2 mg/kg) langsam über 1 min in einem Volumen von 100-150 μL injizieren. Die Lösung kann intravenös in der Vena jugularis während der Entbindung visualisiert werden.
- Injizieren Sie ähnliche Mengen normaler Kochsalzlösung in Kontrollratten.
- Entfernen Sie die Nadel und üben Sie mit einer sterilen Gaze sanften Druck auf die Vene aus.
- Schließen Sie den Hautschnitt mit 3-4 Wundclips. Entfernen Sie die Clips 7-10 Tage nach der Injektion.
HINWEIS: Ratten versuchen normalerweise nicht, Metallclips zu entfernen, sondern beißen und entfernen Nähte. Die juguläre Injektionsmethode ist den Schwanzveneninjektionen für Doxorubicin vorzuziehen, da jedes Medikament, das außerhalb des Gefäßes austritt, eine Nekrose des Schwanzes verursacht, die eine Schwanzamputation erfordern kann.
5. Protokoll zur Amputation der Hintergliedmaße
- Induktion
- Legen Sie die Ratte in eine mittelgroße Induktionskammer und induzieren Sie eine Anästhesie mit 2% -4% Isofluran. Überwachen Sie die Ratte kontinuierlich auf die Tiefe der Anästhesie.
HINWEIS: Die Induktionskammer wird zu einem Holzkohlekanister gespült und alle anderen Gase werden durch einen Down-Draft-Tisch entfernt, der für die Operation verwendet wird. - Führen Sie die Nase in einen Nasenkegel ein. Bei Bedarf mit Klebeband sichern.
HINWEIS: Dieses Verfahren wird auf einer Down-Draft-Tabelle durchgeführt, um überschüssige flüchtige Gase (z. B. Isofluran) abzufangen. - Entfernen Sie die Haare am rechten Bein bis zum ventralen und dorsalen Unterbauch mit einem Haarschneider oder verwenden Sie Enthaarungsmittel. Legen Sie die Ratte in Rückenlage.
- Schrubben Sie den Operationsbereich aseptisch mit 70% Ethanol und verdünnen Sie Chlorhexidindiacetat oder verdünntes Betadin. Bereiten Sie die Haut auf die Operation von der Mitte der Wade bis zum Hautbereich direkt über dem Hüftgelenk des rechten Unterbauchs vor. Schrubben Sie das Bein proximal und den distalen Bereich umlaufend. Wiederholen Sie diesen Schritt dreimal.
- Tragen Sie das Augengleitmittel in beide Augen der Ratte auf. Stellen Sie sicher, dass die Ratte eine normale Körpertemperatur (37 °C) und normale Vitalfunktionen aufweist. Überwachen und regulieren Sie die Körpertemperatur mit einem Heizkissen, das an einen rektalen Temperaturfühler-Monitor angeschlossen ist.
- Legen Sie die Ratte in eine mittelgroße Induktionskammer und induzieren Sie eine Anästhesie mit 2% -4% Isofluran. Überwachen Sie die Ratte kontinuierlich auf die Tiefe der Anästhesie.
- Chirurgie
- Schalten Sie Isofluran bei 1,5% -3% ein (Wartung). Überwachen Sie die Anästhesietiefe, einschließlich der Reaktion auf Zehendrücken, Atemfrequenz und Charakter. Passen Sie die Isofluranrate nach Bedarf an, um eine geeignete Anästhesieebene aufrechtzuerhalten.
HINWEIS: Die Atemfrequenz während der Narkose sollte zwischen 50-100 Atemzügen pro Minute liegen. Tiefe, seltene Atemzüge sind ein Hinweis darauf, dass die Ratte zu tief betäubt ist. - Öffnen Sie sterile Instrumentenpackungen und Vorhänge und ziehen Sie sterile Handschuhe an. Achten Sie darauf, die Sterilität während der gesamten Dauer des Eingriffs aufrechtzuerhalten. Zu den grundlegenden sterilen chirurgischen Instrumenten, die benötigt werden, gehören Skalpellklingenhalter, Pinzetten, Hämostatika, Nadelhalter, Schere und Wundclip-Applier.
- Ziehen Sie das Bein der Ratte durch die Entlüftung des sterilen chirurgischen Vorhangs. Stellen Sie sicher, dass sich das Tier über einen Zehen-Pinch-Reflex auf einer ausreichenden Anästhesieebene befindet.
- Machen Sie mit einer Skalpellklinge oder einer chirurgischen Schere einen umschneidenden, hautnahen Schnitt nur in der Nähe des Erstickens (Kniegelenk).
- Deglove der Hintergliedmaße mit Gaze oder stumpfer Dissektion, um die Oberschenkelarterie und -vene auf der ventral-medialen Oberfläche der Hintergliedmaße freizulegen.
- Ligatieren Sie die Gefäße mit 4-0 resorbierbaren Nähten auf Höhe des mittleren Femurs und transektieren Sie distal.
- Klemmen Sie die Vene distal, um leckage während der Muskeldissektion zu reduzieren.
HINWEIS: Die umlaufende Muskulatur wird distal auf die Ebene der Ligatur des Femurarteriengefäßes und der Muskeln vom Femur auf das Niveau des Coxofemoralgelenks durchtrennt. - Mit stumpfer Dissektion das Hüftgelenk mit seitlicher Rotation nach außen abführen.
- Finden Sie den Kopf des Femurs und disartikulieren Sie ihn aus dem Acetabulum. Schneiden Sie das verbleibende Gewebe ab und halten Sie das Bein am Körper befestigt.
- Geben Sie dem Acetabulum und dem Ischiasnerv einen Spritzblock mit etwa 6 mg/kg Ropivacain.
- Schließen Sie die Muskulatur über dem Acetabulum mit einer einfachen unterbrochenen Naht (4-0, resorbierbare Naht).
HINWEIS: Zusätzliche 0,5% Bupivacain oder Lidocain (insgesamt 0,15-0,2 mg) können an mehreren Stellen entlang der geschlossenen Muskelschicht injiziert werden (lokale Infiltration/Spritzblock). - Gegenlehnen und schließen Sie die Hautränder mit Wundklammern, die alle 5-10 mm auseinander gelegt werden.
- Schalten Sie Isofluran bei 1,5% -3% ein (Wartung). Überwachen Sie die Anästhesietiefe, einschließlich der Reaktion auf Zehendrücken, Atemfrequenz und Charakter. Passen Sie die Isofluranrate nach Bedarf an, um eine geeignete Anästhesieebene aufrechtzuerhalten.
- Genesung
- Legen Sie die Ratte in einen sauberen Rückgewinnungskäfig mit Wärmeunterstützung mit einem Heizkissen, das unter dem Käfig platziert ist.
HINWEIS: Um eine Hyperthermie zu verhindern, sollte das Heizkissen nicht in direktem Kontakt mit dem Tier stehen und 40 °C nicht überschreiten. - Überwachen Sie das Tier, bis es sich vollständig erholt hat und normotherm ist (37,5-39 °C).
HINWEIS: Das Tier sollte nicht unbeaufsichtigt bleiben, bis es bei vollem Bewusstsein und streng liegend ist und sich leicht im Käfig bewegt. - Nachdem sie vollständig wach, beweglich und gut atmen, injizieren Sie den Ratten Buprenorphin (1,0-1,2 mg/kg SC).
HINWEIS: Die Gabe von Buprenorphin bei einer betäubten Ratte kann die Genesung beeinträchtigen. - 10 ml warme laktierte Ringer-Lösung subkutan zwischen den Schulterblättern verabreichen.
- Bringen Sie die Ratten zurück in den sauberen Käfig und vereinen Sie sich wieder mit Artgenossen.
- Überwachen Sie alle Tiere zweimal täglich für den nächsten Monat auf Anzeichen von Schmerzen und Leiden, einschließlich Piloerection, gebeugte Haltung oder Inappetenz oder Anzeichen einer Infektion der Inzisionsstelle, einschließlich Erythem, eitriger Ausfluss oder Wunddehiszenz.
HINWEIS: Bis heute haben wir bei keinem der Tiere klinische Symptome (z. B. Infektionen) nach postoperativer Genesung beobachtet. Nur eine Ratte hatte eine Dehiszenz mit Nähten, wonach Wundklemmen verwendet wurden, um Wunden ohne weitere Probleme zu schließen. - Verabreichen Sie Buprenorphin oder Meloxicam bei Tieren mit klinischen Anzeichen von Schmerzen in veröffentlichten Dosen in Absprache mit einem Labortierarzt.
- Verabreichung von Antibiotika (z. B. Cephalosporin) an Tiere, die in veröffentlichten Dosen klinische Anzeichen von Schmerzen aufweisen, in Absprache mit einem Labortierarzt.
HINWEIS: Alle Tiere, die langwierige Anzeichen von Schmerzen oder Leiden aufweisen, die sich mit Analgetika nicht bessern, oder Tiere, die Anzeichen einer Infektion aufweisen, die nicht auf Antibiotika ansprechen, müssen human eingeschläfert werden.
- Legen Sie die Ratte in einen sauberen Rückgewinnungskäfig mit Wärmeunterstützung mit einem Heizkissen, das unter dem Käfig platziert ist.
6. Bildgebung mit Röntgen
- Bilden Sie nach der Tumorimplantation die Tibien und die Lunge nicht-invasiv ab, um das Tumorwachstum mithilfe von Röntgenaufnahmen mit einer für Nagetiere entwickelten Maschine zu erkennen.
- Betäuben Sie die Ratten wie zuvor.
- Nehmen Sie Bilder mit 3-facher Vergrößerung für 6 s bei 25 kV auf.
- Verarbeiten Sie den Film mit dem Röntgenprozessor. Röntgenbilder können auch digital gescannt werden.
7. Nekropsie-Verfahren
- Die Ratten mit CO2 einschläfern. Bestätigen Sie den Tod durch Herzschlagmangel und entnehmen Sie sofort 3 ml Blut aus dem Herzen für Serum- oder Plasmaproben.
- Öffnen Sie den Thorax und den Bauch zur Untersuchung.
- Isolieren Sie die Luftröhre und kanülieren Sie sie mit einem (18 G) Katheter. Um den Katheter in der Luftröhre zu sichern, binden Sie mit dem Katheter eine Seidennaht um die Luftröhre.
- Schließen Sie den Infusionskatheter an eine 3- oder 5-ml-Spritze an. Infusion von Formalin oder Kochsalzlösung, um die Lungenlappen sanft aufzublasen, um bessere Histologieproben zu erhalten. Bei der Infusion bläht sich die Lunge auf und ermöglicht eine bessere Visualisierung von Lungenmetastasen.
- Untersuchen, sezieren und wiegen Sie alle ausgewählten Thorax- und Bauchorgane (wie Leber, Nieren).
- Fixieren Sie die Organe in Formalin für die Histopathologie oder frieren Sie auf Trockeneis, 2-Methylbutan oder flüssigem Stickstoff ein.
- Zur Beurteilung der Proteinexpression mit Western Blot stellen Sie Lysate aus gefrorenem Gewebe her. Antikörper, die mit Rattengewebe reagieren, werden detailliertbeschrieben 13.
8. Immunhistochemie
- Verarbeiten Sie das primäre OS-Gewebe, betten Sie es in Paraffin ein und schneiden Sie es für die immunhistochemische Färbung.
- Rufen Sie das Antigen nach der Deparaffinisierung mit Citratpuffer (pH 6,0) ab. Inkubieren Sie in 0,3%H2O2in Methanol für 30 min, um endogene Peroxidase zu quenken.
- Blockieren Sie die 5 μm dicken Paraffinschnitte mit normalem Serum.
- Inkubieren Sie mit primären Anti-CD68- und CD3-Antikörpern (siehe Tabelle) über Nacht bei 4 °C.
- Spülen Sie die Abschnitte in PBS und inkubieren Sie sie in HRP-Polymer mit einem Detektionskit.
HINWEIS: Immunostaining wurde mit Diaminobenzidin als Chromogen entwickelt.
9. Western Blotting
- Lyse der UMR-106-Zellen in 200-300 μL Lysepuffer14, um Standard-Gelelektrophorese und Western Blotting durchzuführen.
- Verwenden Sie 4% bis 12% Bis-Tris Gele.
- Inkubieren sie in Anti-ErbB2-, Anti-ErbB4-, Anti-EGFR-, Anti-ERK-, β-Aktin- oder Anti-Maus-β2-AR-Primärantikörpern (siehe Tabelle) und Meerrettichperoxidase-verknüpften sekundären Antikörpern.
- Fügen Sie das chemilumineszierende Substrat hinzu. Setzen Sie die Membranen einem Röntgenfilm aus.
HINWEIS: β-Aktin-Gehalte werden als Belastungskontrollen verwendet.
Ergebnisse
Für diese OS-Studien werden immunkompetente SD-Outzüchtungsratten verwendet, die ein Tiermodell mit einem intakten Immunsystem bieten. Wir haben die UMR106-Zelllinie von ATCC verwendet, die aus Zellen entwickelt wurde, die ursprünglich aus einem OS einer SD-Ratte isoliert wurden. Wir implantierten die Zellen in SD-Ratten und lieferten so ein syngenes Modell für OS. UMR106-Zellen werden in die Tibia von 3 Wochen alten männlichen und weiblichen SD-Ratten implantiert und simulieren ein pädiatrisches OS-Modell. Darüber hinaus ergibt die orthotope Implantation von UMR106-Zellen direkt in die Tibia-Metaphyse/Diaphyse eine relevante Tumormikroumgebung.
Bei der Implantation von Tumorzellen muss eine Nadel korrekt durch das Tibiaplateau (Abbildung 1) im richtigen Winkel (parallel zum Knochenschaft) eingeführt werden, wobei die Nadelspitze etwa 10 mm in die zentrale Höhle des Knochens verlängert wird. Bei diesem Verfahren entwickelten 95% (52/55) der Ratten Tumore in tibias distal bis zum Knie. Mit Erfahrung mit der Tibia-Injektion entwickelten 100% der Ratten Tumore. In einer Gruppe von Ratten, die nicht amputiert wurden, betrug das durchschnittliche Tumorvolumen bei Männchen 504 mm3 nach 3 Wochen und 1195 mm3 nach 5 Wochen nach der Implantation. Bei Frauen liegt das Tumorvolumen durchschnittlich bei 285 mm3 nach 3 Wochen und 495 mm3 nach 5 Wochen nach der Implantation.
Zwei Kohorten von Ratten wurden verglichen, darunter solche mit Amputation (23 Ratten) (Abbildung 2) und solche ohne Amputation (29 Ratten). Beide Kohorten wurden 7 Wochen nach der Implantation eingeschläfert, um tumormetastasen in der Lunge zu untersuchen. In der Amputationsgruppe (3/23) entwickelten Ratten Lungenmetastasen. Diese drei Ratten starben oder wurden innerhalb von 24 Stunden nach der Operation aufgrund von Komplikationen nach der Operation eingeschläfert. Zwei Ratten starben an längerer Narkose, als der Chirurg die Methode lernte. Eine Ratte entwickelte eine Dehiszenz und wurde am nächsten Tag eingeschläfert. Lungen dieser drei Ratten wurden ausgewertet und drei kleine Metastasen (>1 mm) histologisch gefunden. Die überlebenden 20 Ratten hatten 7 Wochen nach der Implantation keine Lungenmetastasen. Dies zeigte, dass 3 Wochen nach der Implantation Amputationen ausreichend sind, um die Anzahl der Ratten mit Lungenmetastasen zu verringern. In einer zweiten Gruppe von 29 Ratten, die nicht über das Amputationsverfahren verfügten, wiesen 26/29 Ratten Lungenmetastasen auf, die mit den zuvor veröffentlichten Daten übereinstimmten11. Wir sahen kein Muster in der Größe oder Anzahl der Metastasen bei diesen Ratten. Die meisten Ratten haben mehr als 10 grob sichtbare Metastasen mit einem Durchmesser von 2-7 mm, die während der Nekropsie leicht entnommen werden konnten. Gelegentlich hatten Ratten noch größere Metastasen von bis zu 10 mm Durchmesser. Es ist wichtig, UMR106-Zellen mit einer niedrigen Passagenzahl zu implantieren, da die Studien gezeigt haben, dass die Zellen mit 10 oder höherer Passagenzahl aggressiver werden und bereits 2-3 Wochen nach der Implantation metastasieren. Der Grund für die Natur ist nicht bekannt, aber die Spekulation ist, dass die Zellen in Kultur Mutationen entwickeln könnten, die metastasieren.
Neben der Amputationsoperation umfasste eine weitere Verfeinerung der Methoden die Röntgenbildgebung zur Tumorüberwachung oder bei der Nekropsie. Diese Methode ermöglicht es dem Forscher, die Invasion von Knochentumoren bei Ratten unter Narkose zu bestätigen. Das planare Radiographieverfahren kann auch bei kürzlich amputierten Gliedmaßen oder formalinfixierten Gliedmaßen angewendet werden. Die Methode ist schnell (5 min pro Ratte) und kostengünstig ($ 2-5 / Ratte) im Vergleich zur Computertomographie (CT). Für die In-vivo-Überwachung müssen die Ratten während der Bildgebung betäubt werden. Abbildung 3 zeigt die detaillierte Morphologie, die durch Röntgenaufnahmen von zwei zuvor amputierten Gliedmaßen beobachtet wird. Diese Methode beleuchtet die osteolytische und osteoblastische Natur dieser Tumoren. Beachten Sie die Störung der normalen kortikalen Knochenarchitektur der Tibia und Fibula in beiden Beispielen (weiße Pfeile). Abbildung 4 veranschaulicht die radiologische Morphologie von Lungen mit und ohne Metastasen. Die Bildgebung durch Röntgenstrahlen kann dem Labor schnell die Notwendigkeit der Euthanasie aufzeigen, um unnötige spontane Todesfälle zu verhindern.
Primäre und metastasierende Tumoren in der Lunge sind dem menschlichen OS histologisch ähnlich und weisen sowohl osteolytische als auch osteoblastische Tumormorphologie auf. Im OS der Ratte wird sowohl die osteolytische als auch die osteoblastische Tumormorphologie durch Histopathologie der amputierten Extremität in Abbildung 5 und Abbildung 6bestätigt. Beachten Sie, dass der kortikale Knochen in diesem Beispiel fehlt und der benachbarte Knochen auch durch neuen gewebten Knochen (Exostosen) ersetzt oder verstärkt wird, der senkrecht zum vorhandenen Schaft des Kortex ausgerichtet ist. Inseln aus unreifem Osteoid (amorphes extrazelluläres Material) sind im Tumorbeispiel dargestellt. Zusätzlich ist die mikroskopische Morphologie der Lungenmetastasen, einige mit mineralisiertem Knochen, und der tumorvaskulären Embolie in Abbildung 7 dargestellt.
Die Amputation der Gliedmaßen mit OS erhöht das Überleben bei Ratten. Ratten können spontan an Lungenmetastasen sterben, die länger als 7 Wochen nach der Implantation untergebracht sind. Der Einsatz von Amputationen kann die weitere Untersuchung der Standard- oder gezielten Krebstherapie in diesem Modell ermöglichen. Die Verlängerung der Zeit zwischen Tumorimplantation und Amputation erhöht die Inzidenz von Metastasen.
Doxorubicin ist ein Chemotherapeutikum zur Behandlung von OS beim Menschen. Bei Ratten kann Doxorubicin über juguläre Injektionen13 oder einen Katheter15 verabreicht werden, wie hier beschrieben. Die juguläre Injektion erfordert 5-10 Minuten pro Ratte, stellt jedoch die Abgabe der Dosis in der exponierten Vene sicher. Insgesamt sind juguläre Injektionen im Vergleich zu den Rattenschwanzveneninjektionen viel reproduzierbarer. Wenn Doxorubicin während der Injektionen der Schwanzvene in die Dermis austritt, kann eine Nekrose des Schwanzes auftreten und weitere Behandlungen verhindern. In dieser Studie wurden fünf Ratten mit einer Dosis von 2 mg/kg Doxorubicin behandelt und 48 h nach der Injektion eingeschläfert, um den Zelltod in den Tumoren zu untersuchen, wie in Abbildung 5A,Bgezeigt.
Fünf Kontrollratten, die mit Kochsalzlösung behandelt wurden, wurden ebenfalls untersucht, um Antikörper auszuwählen, die zur Immunfärbung von Immunzellen in Rattenoss verwendet werden können. Hier wurden zwei Antikörper auf Immunreaktivität getestet. Für immunhistochemische Studien wurden Tumore in Formalin für 48-72 h fixiert und dann auf 70% Ethanol umgestellt, um die Proteinvernetzung zu reduzieren, die in Formalin auftritt. Immunhistochemie wurde für Immunzellinfilte in primären OS-Tumoren durchgeführt und für Makrophagen (CD68) und T-Zellen (CD3) immungefärbt. Abbildung 8 zeigt zwei Beispiele für Immunfärbungen von Immunzellinfiltraten innerhalb der Tumormikroumgebung.
Die potenziellen Ziele für therapeutische Interventionen wurden ebenfalls untersucht. Nach der Amputation von Gliedmaßen mit Tumoren wurden Ratten-OS-Proben für die zukünftige Proteinisolierung eingefroren. In dieser Studie entdeckten wir, dass UMR106-Zellen die Proteine des ErbB-Familienweges exprimieren. Western Blots, die an UMR106-Zellproteinlysaten durchgeführt wurden, zeigen die Expression von ErbB2, EGFR, ErbB4 und anderen Proteinen, die mit diesen Signalwegen interagieren (Abbildung 9).

Abbildung 1: Tibia mit eingesetzter Tumorimplantationsnadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Tibia während des Amputationsverfahrens mit entfernter Haut (A), exponierter Oberschenkelarterie und Vene (B), mit Muskelerhöhung aus dem Femur (C) und bei einer Ratte 3 Wochen nach der Amputationsoperation (D). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
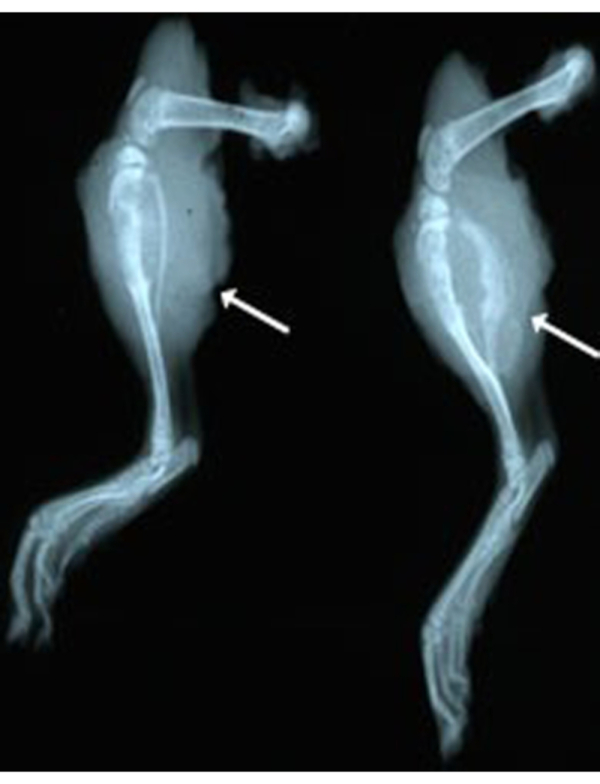
Abbildung 3: Röntgenaufnahme der rechten Beine nach Amputation (ex vivo) von zwei Ratten mit OS. Beachten Sie die osteolytische und osteoblastische Natur des Tumors. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Röntgenaufnahmen der Rattenlunge. (A) ohne Lungenmetastasen. (B) mit OS-Lungenmetastasen. (C) Korrelation zur groben Pathologie von Metastasen in einer aufgeblasenen Lunge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: (A) Histopathologie des Allgemeinbildes mit 90% der Zellen, die den Zelltod im Tibia-Tumor zeigen 48 h nach einer Dosis von 2 mg/kg Doxorubicin. (B) Tumorzelltod (Pfeil) bei tibialem primärem OS nach 48 h nach einer Dosis von 2 mg/kg Doxorubicin. Beachten Sie, dass die obere rechte und linke Ecke lebensfähige Zellen enthält. (C) OS-Invasion in kortikalen Knochen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: (A) Histopathologie von OS, die die Knochenmarkzellen ersetzt hat und in die Kortiken der Tibia eingedrungen ist. Beachten Sie das begleitete reaktive neue Knochenwachstum, da es außen und senkrecht zum bereits bestehenden Kortex geschichtet ist. (B) Untersuchung von OS-Tumorzellen mit höherer Leistung, die an eine Knocheninsel angrenzen. (C) Untersuchung von OS-Zellen mit höherer Leistung, die in rosa bis blaue extrazelluläre Matrix (Osteoid) eingebettet sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: (A) Multiple Lungenmetastasen bei Ratten mit Tibia-Tumorimplantation. (B) Tumor-OS-Zellen in einem Embolus in einem kleinen Lungenarterien-Astgefäß neben einer Bronchiole unterhalb des Gefäßes. (C) Einige Lungenmetastasen enthalten Knocheninseln, während andere Metastasen zellulärer sind. (D) Höhere Potenz von Metastasen mit OS-Zellen, die mit Inseln aus mineralisiertem Knochen vermischt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Immunhistochemie von (A) CD68-immunverträglichen Makrophagen und (B) immunverbindenden T-Zellen, die CD3-positive Zellen in OS im Schienbein zeigen.

Abbildung 9: ErbB-Signalwegproteine, die in UMR106-OS-Zellen aus Tibia-Tumoren exprimiert werden. Lysate aus Primärtumoren wurden auf Proteinexpression aus dem Signaltransduktionsweg der ErbB-Familie untersucht, einschließlich ErbB2-, EGFR-, ErbB4-, AKT-, ERK1/2- und β2-adrenergen Rezeptoren mit Aktin als Belastungskontrolle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Ratten mit OS-Tibiaimplantaten entwickeln messbare Tumore bis 3 Wochen nach der Implantation. Wenn Gliedmaßen mit Tumoren 3 Wochen nach der Implantation amputiert werden, ist die Inzidenz von Lungenmetastasen signifikant reduziert. Betriebssysteme sind sowohl osteolytisch als auch osteoblastisch. Ratten ohne Amputation entwickeln Lungenmetastasen, die multiple und variabel groß sind, beobachtet durch Radiographie oder bei Nekropsie bis 7 Wochen nach der Implantation. EGFR, ErbB2 und ErbB4 werden in Ratten UMR106 OS exprimiert, ähnlich wie das menschliche OS16,17,18. CD3-T-Zellen und Makrophagen können in OS durch immunhistochemische Methoden leicht nachgewiesen werden. Jugularveneninjektionen werden der Schwanzvene für die Verabreichung von Chemotherapie Doxorubicin, einem Medikament, das OS-Patienten verabreicht wird, bevorzugt. Die hier beschriebene Methode ist eine vollständige Coxofemoralamputation. Dieses Verfahren ist eine Verfeinerung und könnte in Betracht gezogen werden, um die tumorentfernungsfördernde chirurgische Methode (femorale Osteotomie) zu ersetzen, bei der der Knochen geschnitten wird und ein Stumpf für den Patientenverbleibt 8. Die Studie schlägt eine vollständige Entfernung der Gliedmaßen vor, um die Wahrscheinlichkeit von postoperativen Schmerzen und Komplikationen zu verringern.
Es gibt eine Reihe kritischer Schritte in diesem Protokoll. Erstens ist es wichtig, die Passage von Tumorzellen zu beachten und eine niedrigere Passage von Zellen für die Studien zu verwenden, um das Modell von Experiment zu Experiment konsistent zu halten. Die älteren Passagezellen werden mit der Zeit in Kultur aggressiver. Zweitens hilft die Verwendung der Nadel geeigneter Größe und der Hamilton-Spritze bei der korrekten Injektion der Zellen in die Tibia bei einem sehr kleinen Volumen von 20 μL, einem Volumen, das als optimal eingestuft wurde und keine Leckage verursachte. Drittens muss der Chirurg zunächst die Disartikulation üben, wenn er Nekropsien an ähnlich alten Ratten durchführt, um die Mechanik des Verfahrens zu erlernen. Viertens, für den Erfolg der Amputation, behalten Sie die Thermoregulation bei und begrenzen Sie die Operationszeit. Ein erfahrener Chirurg kann die Amputation in 15 Min abschließen.
Es wurde beobachtet, daß sichdie Transplantation von Zellen in der Tibia stark verbesserte, wenn eine größere Bohrnadel verwendet wurde, um die anfängliche Öffnung vorzunehmen, gefolgt von der Einführung einer Hamilton-Spritzennadel mit kleinerer Bohrung. Dies schützt die Hamilton-Spritze vor Bruch und Abstumpfung im Laufe der Zeit. Hamilton-Spritzen können Volumina von nur 10 μL haben. Die 1 mL Tuberkulinspritzen wären nicht genau genug für die Implantation von 20 μL. Die gleiche Hamilton-Spritze wurde für alle Ratten verwendet, die an einem Tag implantiert wurden, wurde aber zwischen den chirurgischen Eingriffen jeder Ratte gewaschen. Vermeiden Sie das Autoklavieren der Hamilton-Spritzen, da sie anfällig für Bruch sind. Am Ende des Verfahrens waschen Sie es mit Kochsalzlösung (10 Mal) und dann mit 100% Ethanol (10 Mal) und lassen Sie es trocknen, wobei der Kolben entfernt wird, um es zu lagern.
Haut- und subkutane Nähte wurden zunächst verwendet, um den Schnitt zu schließen, aber eine Ratte wurde am Tag nach der Operation mit Dehiszenz gefunden. Die Verwendung von Wundklammern und chirurgischem Klebstoff zum Schließen des Schnitts verbesserte die Methode. Mit dieser Verfeinerung hatte keine anderen Ratten eine solche postoperative Komplikation. Die Einbeziehung der Röntgenradiographie der Lunge verfeinert dieses Modell, um Lungenmetastasen bei Ratten nachzuweisen, die eine rechtzeitige Euthanasie ermöglichen und unerwartete Todesfälle verhindern. Röntgenbilder ermöglichen es uns, die osteolytische und osteoblastische Natur dieser Rattenosophen zu bestimmen, ähnlich wie bei menschlichen Betriebssystemen.
Ein moderates Maß an chirurgischer Expertise ist notwendig, um den Amputationsprozess durchzuführen. Der schwierigste Schritt ist die Dissektion in die Muskulatur, um das Coxofemoralgelenk zu lokalisieren. Vergrößerung und gute Beleuchtung sind bei diesem Schritt wichtig. Chirurgische Expertise kann durch Übung an Tieren erreicht werden, die eingeschläfert wurden. Nach etwa 10 Ratten sollte der Chirurg sicher sein, ein Glied mit OS von einer lebenden Ratte unter Narkose zu amputieren.
Bestehende Methoden zur Entfernung von Gliedmaßen mit Sarkomen bei Mäusen und Ratten basieren auf der Entfernung der Tibia durch Schneiden des Femurknochens und der Muskulatur in der Mitte des Schafts und Verlassen des Stumpfes8. Obwohl dies für einige Untersuchungen nützlich sein kann, wurde in dieser Studie die vollständige Beinentfernung versucht. Das Verfahren erwies sich als zufriedenstellend und bot keine postoperativen Komplikationen. Bei Ratten mit einem Stumpf der Hinterbeine könnte es mehr postoperative Haut-, Muskel- oder Nervenschmerzen geben. Wenn sie einen Stumpf verließen, konnten Ratten herumgreifen und auf die Operationsstelle zugreifen. Ratten geht es nach der Amputation sehr gut und sie gehen gut im Käfig mit einem Hinterbein.
Zu den Vorteilen einer Amputation der vollständigen Gliedmaßen gehört die Entfernung des Primärtumors, bevor er für die Ratte zu groß und schmerzhaft wird. Wichtig ist, dass die Entfernung des Primärtumors dazu beiträgt, die Metastasierung des Primärtumors in der Lunge zu kontrollieren. Ratten mit Amputation können weiter untersucht werden, um die Wirksamkeit neuartiger Therapeutika auf zirkulierende Tumorzellen im Blut oder in den Mikrometastasen in Kapillaren der Lunge oder anderen Knochen zu testen.
Es besteht ein erheblicher Bedarf an der Entwicklung neuer Krebstherapeutika für OS und andere Sarkome, insbesondere Therapeutika, die eine Arzneimittelaktivität gegen metastasierende Progression haben. Im Vergleich zu den neuartigen Therapeutika, die für andere Krebsarten entwickelt wurden, haben sich die Therapeutika für OS leider seit vielen Jahrzehnten nicht weiterentwickelt. Als Reaktion auf dieses Problem kam ein Treffen der wichtigsten Führungskräfte und Experten für OS und Metastasierung zusammen, um Leitlinien für eine verbesserte OS-Arzneimittelentwicklung zu entwickeln19. Gemäß den Vorschlägen des Panels wurden Studien durchgeführt, um das präklinische Modell der Ratten, ein weniger bekanntes Modell des Os, zu verbessern. Zusammenfassend lässt sich sagen, dass Amputation und Bildgebung das präklinische Modell der Ratte für die weitere Verwendung durch die Sarkom-Forschungsgemeinschaft verfeinert. Das Amputationsverfahren ermöglicht ein verbessertes Überleben des Patienten für mehrere Monate, was die Bewertung der Wirksamkeit neuartiger Behandlungen bei Mikrometastasen oder ruhenden Tumoren ermöglicht oder die Toxizität von Behandlungen mit einem Modell mit besserer Langlebigkeit testet.
Zusammenfassend bieten wir den Vorteil dieses Betriebssystemmodells. Immunkompetente SD-Outzüchtungsratten werden verwendet, um ein syngenes Modell mit implantierter UMR106-OS-Zelllinie bereitzustellen, die aus einem SD-Ratten-OS isoliert wurde. Der primäre und metastasierende Tumor ist dem OS beim Menschen histologisch ähnlich. Juvenile männliche und weibliche Ratten werden für UMR106-Tumorimplantationsstudien verwendet, die pädiatrische Sarkome modellieren. Die orthotope Platzierung implantierter Zellen erfolgt direkt in die Tibia für eine relevante Tumormikroumgebung. Der Primärtumor metastasiert in die Lunge und die Metastasen können durch In-vivo-Bildgebung mit Röntgenmethode überwacht werden. Das Ratten-OS exprimiert Proteine, die mit dem menschlichen OS gemeinsam sind, wie ErbB2. Im Vergleich zum Hunde-OS ermöglicht das Rattenmodell eine größere Anzahl von Tieren, die gleichzeitig verwendet werden können. Ratten sind 10-mal größer als Mäuse für die Leichtigkeit von Tibia-Injektionen, Operationen, Bildgebung, Blutentnahmen und Biopsie. Die Langlebigkeit von Ratten ist mit einer Amputation sicherer, und dieses Modell kann neoadjuvante Therapie, Amputation und adjuvante Therapie kombinieren, was ein verbessertes Überleben der Patienten ermöglicht und die Wirksamkeit von Behandlungen bei Mikrometastasen oder ruhenden Tumoren bewertet. Die Bewertung der Toxizität außerhalb des Ziels kann auch in diesem Modell bewertet werden, bei dem Ratten mit Krebstherapeutika wie Doxorubicin behandelt und langfristig auf Doxorubicin-induzierte kardiale Toxizität oder rezidivierendes OS überwacht werden können. Dies würde das Testen von Kardio-Schutzmitteln in einem Modell mit OS ermöglichen.
Offenlegungen
Keine Offenlegung zu deklarieren.
Danksagungen
NIH-Finanzierung durch das National Cancer Institute, Zuschuss # CA228582. Shun Ishiyama erhält derzeit einen Zuschuss von Toray Medical Co., Ltd.
Materialien
| Name | Company | Catalog Number | Comments |
| AKT | Cell Signaling TECHNOLOGY | 4685S | |
| absorbable suture | Ethicon | J214H | |
| β-actin | SANTA CRUZ BIOTECHNOLOGY | sc-47778 | |
| β2-AR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-569 | replaced by β2-AR (E-3): sc-271322 |
| Bis–Tris gels | Thermo Fisher | NP0321PK2 | |
| Buprenorphine SR Lab | ZooPharm | IZ-70000-201908 | |
| CD3 antibody | Dako | #A0452 | |
| CD68 antibody | eBioscience | #14-0688-82 | |
| Chemiluminescent substrate | cytiva | RPN2232 | |
| CL-Xposure film | Thermo Fisher | 34089 | |
| Complete Anesthesia System | EVETEQUIP | 922120 | |
| diaminobenzidine | VECTOR LABORATORIES | SK-4100 | |
| Doxorubicin | Actavis | NDC 45963-733-60 | |
| EGFR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-03 | replaced by EGFR (A-10): sc-373746 |
| ERBB2 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-284 | replaced by Neu (3B5): sc-33684 |
| ERBB4 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-283 | replaced by ErbB4 (C-7): sc-8050 |
| ERK antibody | SANTA CRUZ BIOTECHNOLOGY | sc-514302 | |
| eye lubricant | PHARMADERM | NDC 0462-0211-38 | |
| Hamilton syringe (100 µL) | Hamilton | Model 1710 SN SYR | |
| horseradish peroxidase-linked secondary antibody | cytiva | NA934 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7401 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7402 | |
| isoflurane | BUTLER SCHEIN | NDC 11695-6776-2 | |
| isoflurane vaporizer | EVETEQUIP | 911103 | |
| UMR-106 cell | ATCC | CRL-1661 | |
| X-ray | Faxitron | UltraFocus | |
| X-ray processor | Hope X-Ray Peoducts Inc | MicroMax X-ray Processor | Hope Processors are not available in USA anymore |
| wound clips | BECTON DICKINSON | 427631 |
Referenzen
- Link, M. P., et al. The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity. New England Journal of Medicine. 314 (25), 1600-1606 (1986).
- Bielack, S. S., et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. Journal of Clinical Oncology. 20 (3), 776-790 (2002).
- Botter, S. M., Neri, D., Fuchs, B. Recent advances in osteosarcoma. Current Opinion in Pharmacology. 16, 15-23 (2014).
- Ek, E. T. H., Dass, C. R., Choong, P. F. M. Commonly used mouse models of osteosarcoma. Critical Reviews in Oncology Hematology. 60 (1), 1-8 (2006).
- Guijarro, M. V., Ghivizzani, S. C., Gibbs, C. P. Animal models in osteosarcoma. Frontiers Oncology. 4, 189 (2014).
- Janeway, K. A., Walkley, C. R. Modeling human osteosarcoma in the mouse: From bedside to bench. Bone. 47 (5), 859-865 (2010).
- Mohseny, A. B., Hogendoorn, P. C., Cleton-Jansen, A. M. Osteosarcoma models: from cell lines to zebrafish. Sarcoma. 2012, 417271 (2012).
- Khanna, C., et al. An orthotopic model of murine osteosarcoma with clonally related variants differing in pulmonary metastatic potential. Clinical & Experimental Metastasis. 18 (3), 261-271 (2000).
- Martin, T. J., et al. Parathyroid hormone-responsive adenylate cyclase in induced transplantable osteogenic rat sarcoma. Nature. 260 (5550), 436-438 (1976).
- Fisher, J. L., Mackie, P. S., Howard, M. L., Zhou, H., Choong, P. F. The expression of the urokinase plasminogen activator system in metastatic murine osteosarcoma: an in vivo mouse model. Clinical Cancer Research. 7 (6), 1654-1660 (2001).
- Yu, Z., et al. Establishment of reproducible osteosarcoma rat model using orthotopic implantation technique. Oncology Reports. 21 (5), 1175-1180 (2009).
- Zhang, P., et al. Homologous mesenchymal stem cells promote the emergence and growth of pulmonary metastases of the rat osteosarcoma cell line UMR-106. Oncology Letters. 8 (1), 127-132 (2014).
- Gabrielson, K., et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Research. 67 (4), 1436-1441 (2007).
- Sysa-Shah, P., et al. Bidirectional cross-regulation between ErbB2 and β-adrenergic signalling pathways. Cardiovascular Research. 109 (3), 358-373 (2016).
- Wachtman, L. M., Browning, M. D., Bedja, D., Pin, S., Gabrielson, K. L. Validation of the use of long-term indwelling jugular catheters in a rat model of cardiotoxicity. Journal of American Association Laboratory Animal Science. 45, 55-64 (2006).
- Abdou, A. G., et al. The Prognostic role of Ezrin and HER2/neu expression in osteosarcoma. Applied Immunohistochemistry & Molecular Morphology. 24 (5), 355-363 (2016).
- Hughes, D. P., Thomas, D. G., Giordano, T. J., McDonagh, K. T., Baker, L. H. Essential erbB family phosphorylation in osteosarcoma as a target for CI-1033 inhibition. Pediatric Blood & Cancer. 46 (5), 614-623 (2006).
- Wen, Y. H., et al. Epidermal growth factor receptor in osteosarcoma: expression and mutational analysis. Human Pathology. 38 (8), 1184-1191 (2007).
- Khanna, C., et al. Toward a drug development path that targets metastatic progression in osteosarcoma. Clinical Cancer Research. 20 (16), 4200-4209 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten