Method Article
Un modèle de rat Sprague Dawley d’ostéosarcome orthotopique syngénique avec amputation pour contrôler le taux de métastases
Dans cet article
Résumé
Ici, une implantation orthotopique syngénique suivie d’une procédure d’amputation de l’ostéosarcome avec métastases pulmonaires spontanées pouvant être utilisée pour l’investigation préclinique de la biologie des métastases et le développement de nouvelles thérapies est décrite.
Résumé
L’avancée la plus récente dans le traitement de l’ostéosarcome (SG) s’est produite dans les années 1980, lorsqu’il a été démontré que la chimiothérapie multi-agents améliorait la survie globale par rapport à la chirurgie seule. Pour résoudre ce problème, l’objectif de l’étude est d’affiner un modèle moins connu de SG chez le rat avec une approche chirurgicale histologique, d’imagerie, biologique, d’implantation et d’amputation complète qui prolonge la survie. Nous avons utilisé un modèle de rat syngénique Sprague-Dawley (SD) immunocompétent et consanguin avec une lignée cellulaire UMR106 OS implantée (provenant d’un rat SD) avec des implants de tumeur tibiale orthotopique chez des rats mâles et femelles âgés de 3 semaines pour modéliser la SG pédiatrique. Nous avons constaté que les rats développent des tumeurs pulmonaires primaires et métastatiques reproductibles, et que les amputations de membres à 3 semaines après l’implantation réduisent considérablement l’incidence des métastases pulmonaires et préviennent les décès inattendus. Histologiquement, les SYSTÈMES primaires et métastatiques chez le rat étaient très similaires à ceux de la SG humaine. En utilisant des méthodes d’immunohistochimie, l’étude montre que la SG du rat est infiltrée par des macrophages et des cellules T. Une étude de l’expression protéique des cellules OS révèle que ces tumeurs expriment des kinases de la famille ErbB. Étant donné que ces kinases sont également fortement exprimées dans la plupart des systèmes d’exploitation humains, ce modèle de rat pourrait être utilisé pour tester les inhibiteurs de la voie ErbB pour le traitement.
Introduction
L’ostéosarcome (SG) est la tumeur osseuse primaire la plus courante chez les enfants, les adolescents et les jeunes adultes. L’avancée la plus récente dans le traitement de la SG a eu lieu dans les années 1980, lorsqu’il a été démontré que la chimiothérapie multi-agents améliorait la survie globale par rapport à la chirurgie seule1. La SG se développe au cours d’une croissance osseuse rapide, se produisant généralement dans les os tubulaires longs tels que le fémur, le tibia et l’humérus. Ils sont caractérisés par un aspect ostéolytique, ostéoblastique ou mixte avec une réaction périostée notable2. La chimiothérapie et la résection chirurgicale peuvent améliorer les résultats pour les patients ayant une survie à 5 ans pour 65% des patients2,3. Malheureusement, les patients atteints de SG de haut grade atteints d’une maladie métastatique ont une survie de 20%. La SG envahit la région et métastase principalement dans les poumons ou d’autres os et est plus répandue chez les hommes. Le besoin le plus impérieux pour ces jeunes patients est une nouvelle thérapie qui prévient et élimine la viabilité des métastases à distance.
Des modèles précliniques de SG ont été examinés4,5,6,7et peu de modèles immunocompétents disponibles utilisant l’amputation de la SG orthotopique ont été développés. En 2000, un modèle important a été développé en utilisant des souris BALB/c avec OS syngénique orthotopique et amputation8. Par rapport à ce modèle murin, le modèle de rat est basé sur des animaux génétiquement élevés et 10 fois plus gros, ce qui présente certains avantages. Le modèle UMR106 du rat a été développé à partir d’une SG induite par 32P chez un rat Sprague Dawley (SD), qui a été dérivé dans une lignée cellulaire9. En 2001, l’implantation orthotopique d’UMR106-01 a été décrite pour la première fois dans des tibias implantés de souris athymiques présentant un développement tumoral primaire rapide et cohérent et des caractéristiques radiologiques et histologiques en commun avec la SG chez l’homme. Des métastases pulmonaires se sont développées et dépendaient du placement orthotopique d’UMR106 dans le microenvironnement osseux10. En 2009, Yu et al.11 ont établi un modèle reproductible de rat OS du fémur orthotopique en utilisant des cellules UMR106 chez des rats SD mâles plus grands. Les implantations tumorales réussies et le taux de métastases pulmonaires chez le rat sans amputation étaient similaires aux données présentées ici. Dans cette étude, une amputation supplémentaire au modèle utilisant de jeunes rats a été effectuée, ce qui suggère que le moment de l’ablation de la tumeur primaire est crucial dans la modélisation de la SG, en particulier en ce qui concerne la progression métastatique. Grâce à ce raffinement, l’amputation et l’imagerie in vivo améliorent ce modèle pour les études précliniques d’évaluation des nouveaux médicaments pour la SG.
Protocole
Toutes les procédures et expériences impliquant des rats ont été effectuées conformément aux protocoles approuvés par le comité de soins et d’utilisation des animaux de Johns Hopkins.
1. Le protocole de culture cellulaire UMR-106 de la lignée cellulaire UMR-106 du rat SD
- Cultiver des cellules dans du DMEM, complété par 10% (v/v) FBS, pénicilline (10 U/mL)-streptomycine (10 U/mL) à 37 °C dans une atmosphère humidifiée de 5% de CO2. Effectuer des expériences en utilisant des cellules avec des passages de 2-812.
2. Protocole d’injection intratibiale de cellules OS
REMARQUE: Les rates SD gravides accouplées dans le temps donnent naissance dans l’établissement pour animaux et à l’âge de 3 semaines, des portées sont utilisées (puisque la lignée cellulaire UMR 106 est syngénique aux rats SD, aucune irradiation n’est nécessaire).
- Induction
- Placez le rat dans une chambre d’induction de taille moyenne et induisez une anesthésie avec 2% à 3% d’isoflurane. Surveillez l’animal en permanence pour la profondeur de l’anesthésie par le pincement réflexe aux orteils, la fréquence respiratoire et le caractère.
- Insérez le nez dans le nosecone. Sécurisez avec du ruban adhésif, si nécessaire.
- Enlevez les poils de la jambe droite jusqu’au bas-ventre ventral et dorsal avec des tondeuses ou utilisez un agent dépilatoire. Placez le rat en position couchée.
- Frottez la zone chirurgicale de manière aseptique à l’aide d’éthanol à 70% et diluez l’acétate de chlorhexidine ou la bétadine diluée. Commencez autour de la zone du genou et frottez dans un mouvement circulaire à la fois proximaux et distalement. Répétez cette étape trois fois. Aucun drapé n’est utilisé pour l’implantation de la tumeur.
- Appliquez du lubrifiant pour les yeux dans les deux yeux du rat pour prévenir la dessiccation de la cornée causée par l’anesthésie. Placez le rat sur un coussin chauffant à faible chaleur. Assurez-vous que le rat a une température corporelle normale (37 °C) et une fréquence respiratoire normale.
- Chirurgie
- Activez l’isoflurane à ~1,5%-2% (pour la maintenance). Assurez-vous que l’animal est à un plan d’anesthésie adéquat en l’absence d’un réflexe de pincement des orteils. Sinon, augmentez le pourcentage d’isoflurane à 2,5%.
- Marquez une aiguille stérile (environ 22 G) à 10 mm de la pointe pour guider la profondeur à insérer.
- Insérez l’aiguille de 10 mm dans la diaphyse du tibia en entrant dans le genou plié au milieu du plateau tibial, en étendant l’aiguille à travers la métaphyse dans la diaphyse à l’aide d’un léger mouvement de forage pour faire une ouverture. Retirez l’aiguille.
- Chargez la suspension cellulaire dans la seringue Hamilton directement avant l’injection dans le tibia. Pour ce faire, mélangez doucement les cellules avant de les aspirer dans la seringue car la gravité fait que les cellules se déposent dans le fond du tube.
REMARQUE: Les cellules peuvent être stockées dans un tube de 1,5 à 2 mL (à température ambiante) avant d’être aspirées dans la seringue Hamilton (100 μL) après un mélange minutieux. Les cellules peuvent être maintenues à température ambiante pendant 2-3 h pendant la procédure d’implantation. Vérifiez toujours la viabilité cellulaire des cellules dans le tube avant puis après la séance d’implantation. L’exclusion du bleu de trypan est la méthode la plus simple pour l’évaluation de la viabilité cellulaire. - Une fois l’os traversé avec la première aiguille, insérez une deuxième aiguille (aiguille de plus petit diamètre également marquée à 10 mm) attachée à la seringue Hamilton de 100 μL chargée de cellules. Assurez-vous d’insérer l’aiguille jusqu’à la marque de 10 mm dans le même trou s’étendant dans la diaphyse.
- Déchargez doucement 20 μL de suspension de 75 000 cellules OS dans le PBS dans la diaphyse et la cavité médullaire.
REMARQUE: L’aiguille ne doit pas vaciller dans l’os et doit se sentir en sécurité. Si l’aiguille se déplace facilement, le cortex peut avoir été traversé à la diaphyse. Répétez l’insertion à nouveau pour obtenir un placement plus ferme avant l’injection de cellules. - Retirez l’aiguille Hamilton de l’os.
REMARQUE: Si une petite goutte de sang se forme, appliquez une légère pression. Si une goutte de liquide claire se forme au site de ponction, l’aiguille peut ne pas avoir été étendue assez loin dans l’os et la suspension des cellules tumorales peut avoir fui à travers le trou. Notez cela dans les notes, mais généralement, l’implantation de la tumeur sera réussie. Avec l’expérience, la procédure d’implantation de la tumeur devrait prendre 5 minutes par rat. Avec l’expérience, l’implantation tumorale des cellules dans l’os deviendra plus facile. L’injection accidentelle de cellules dans le muscle autour de l’os peut ne pas conduire au microenvironnement tumoral nécessaire aux métastases pulmonaires.
- Récupération
- Assurez-vous que le rat est normotherme. Placez le rat dans une cage avec un coussin chauffant placé sous la cage pour la récupérer.
- Après avoir été complètement éveillé, mobile et bien respirer, injecter aux rats de la buprénorphine (1,0-1,2 mg / kg SC).
REMARQUE: Pour avoir accès à la buprénorphine, vérifiez auprès de l’établissement pour voir les options d’approbation par le personnel vétérinaire pour passer la commande. - Replacez les rats dans des cages propres et surveillez-les une fois par jour, chaque semaine.
3. Mesure et surveillance
- Mesurez la taille de la tumeur 9 à 10 jours après l’implantation, puis tous les 2 jours jusqu’à 3 semaines après l’implantation pour établir un taux de croissance. Mesurez le diamètre maximal du tibia à l’aide d’un étrier électronique ou manuel. Stockez les données dans une feuille de calcul avec une formule pour calculer le volume de la tumeur. Mesurez le tibia controlatéral (non implanté) comme ligne de base.
REMARQUE: Les diamètres des membres postérieurs implantés sont utilisés comme substitut pour la taille de la tumeur. Les membres postérieurs sont mesurés perpendiculairement à l’axe long du tibia au plus grand diamètre pour deux mesures, ventrale/dorsale et médiale/latérale sur le membre. Le volume tumoral estimé est calculé par la formule11: Volume tumoral (mm3)= plus grand diamètre (mm) x plus petit diamètre (mm)2/2. - Considérez les rats pour l’amputation de survie ou le traitement de chimiothérapie lorsque les tumeurs approchent 15 mm dans la plus grande dimension ou 3 semaines après l’implantation de la tumeur. Le membre controlatéral mesure environ 7 à 9 mm chez la plupart des rats à cet âge.
4. Administration intraveineuse de doxorubicine
- Anesthésier les rats avec 2% d’isoflurane. Préparer la peau sur la veine jugulaire avec trois lavages chirurgicaux à l’aide de bétadine et d’alcool comme décrit13.
- Sous dissection minutieuse, visualisez la veine jugulaire droite ou gauche. Insérez l’aiguille dans le muscle sus-jacent, puis dirigez-la vers la tête du rat dans la lumière de la veine jugulaire telle qu’elle est visualisée dans la veine jugulaire antérieure au muscle pectoral.
- Lorsque l’aiguille est insérée dans la veine jugulaire, aspirer doucement le sang dans la seringue pour assurer une insertion correcte. Il est possible de croire que l’aiguille est à travers la veine, mais l’aiguille est sous la veine et non dans la lumière. Si la veine jugulaire devient trop petite pour les injections lors d’une dissection émoussée pour exposer la veine jugulaire, utilisez l’autre veine jugulaire pour l’injection.
- Injecter la doxorubicine (2 mg/kg) lentement pendant 1 min dans un volume de 100-150 μL. La solution peut être visualisée par voie intraveineuse dans la veine jugulaire pendant l’accouchement.
- Injecter des volumes similaires de solution saline normale chez des rats témoins.
- Retirez l’aiguille et appliquez une légère pression sur la veine avec une gaze stérile.
- Fermez l’incision cutanée à l’aide de 3-4 pinces à plaie. Retirez les clips 7 à 10 jours après l’injection.
REMARQUE: Les rats n’essaient généralement pas d’enlever les clips métalliques, mais mordent et enlèvent les sutures. La méthode d’injection jugulaire est préférable aux injections de doxorubicine dans la veine caudale, car tout médicament qui fuit à l’extérieur du vaisseau provoque une nécrose de la queue pouvant nécessiter une amputation de la queue.
5. Protocole d’amputation du membre postérieur
- Induction
- Placez le rat dans une chambre d’induction de taille moyenne et induisez une anesthésie avec 2% à 4% d’isoflurane. Surveillez le rat en permanence pour la profondeur de l’anesthésie.
REMARQUE: La chambre d’induction est récupérée dans un bidon de charbon de bois et tous les autres gaz sont éliminés par une table à tirage descendant utilisée pour la chirurgie. - Insérez le nez dans un nosecone. Sécurisez avec du ruban adhésif, si nécessaire.
REMARQUE : Cette procédure est effectuée sur une table de tirage descendant pour éliminer les gaz volatils en excès (c.-à-d. l’isoflurane). - Enlevez les poils de la jambe droite jusqu’au bas-ventre ventral et dorsal avec des tondeuses ou utilisez un agent dépilatoire. Placez le rat en position couchée.
- Frottez la zone chirurgicale de manière aseptique à l’aide d’éthanol à 70% et diluez l’acétate de chlorhexidine ou la bétadine diluée. Préparez la peau pour la chirurgie du milieu du mollet à la zone de la peau juste au-dessus de l’articulation de la hanche du bas-ventre droit. Frottez la jambe proximale et la zone distale de manière circonférentielle. Répétez cette étape trois fois.
- Appliquez le lubrifiant pour les yeux dans les deux yeux du rat. Assurez-vous que le rat a une température corporelle normale (37 °C) et des signes vitaux normaux. Surveillez et régulez la température corporelle à l’aide d’un coussin chauffant connecté à un moniteur de sonde de température rectale.
- Placez le rat dans une chambre d’induction de taille moyenne et induisez une anesthésie avec 2% à 4% d’isoflurane. Surveillez le rat en permanence pour la profondeur de l’anesthésie.
- Chirurgie
- Activez l’isoflurane à 1,5% -3% (maintenance). Surveillez la profondeur de l’anesthésie, y compris la réaction au pincement des orteils, la fréquence respiratoire et le caractère. Ajuster le taux d’isoflurane au besoin pour maintenir un plan d’anesthésie approprié.
REMARQUE: La fréquence respiratoire sous anesthésie devrait être comprise entre 50 et 100 respirations par minute. Des respirations profondes et peu fréquentes sont une indication que le rat est trop profondément anesthésié. - Ouvrez des packs d’instruments stériles et des rideaux et enfilez des gants stériles. Prenez soin de maintenir la stérilité pendant toute la durée de la procédure. Les instruments chirurgicaux stériles de base nécessaires comprennent, le porte-lame de scalpel, la pince, les hémostats, le porte-aiguille, les ciseaux et l’applicateur de clip de plaie.
- Tirez la patte du rat à travers l’évent du drap chirurgical stérile. Assurez-vous que l’animal est à un niveau d’anesthésie adéquat par réflexe de pincement des orteils.
- À l’aide d’une lame de scalpel ou de ciseaux chirurgicaux, faites une incision cutanée circonférentielle juste proximale à l’étouffement (articulation du genou).
- Dégorgez le membre postérieur à l’aide de gaze ou d’une dissection émoussée pour exposer l’artère fémorale et la veine sur la surface ventrale-médiale du membre postérieur.
- Ligaturez les vaisseaux à l’aide de sutures résorbables 4-0 au niveau du milieu du fémur et transectez distalement.
- Serrez la veine distalement pour réduire les fuites pendant la dissection musculaire.
REMARQUE: La musculature circonférentielle sera transectée distale au niveau de la ligature des vaisseaux de l’artère fémorale et des muscles élevés du fémur au niveau de l’articulation coxofémorale. - À l’aide d’une dissection contondante, enlevez l’articulation de la hanche avec une rotation latérale vers l’extérieur.
- Trouvez la tête du fémur et désarticulez-la de l’acétabulum. Coupez tout tissu restant en gardant la jambe attachée au corps.
- Donner un bloc d’éclaboussures à l’acétabulum et au nerf sciatique avec environ 6 mg / kg de ropivacaïne.
- Fermez la musculature sur l’acétabulum à l’aide d’une simple suture interrompue (4-0, suture résorbable).
REMARQUE: 0,5% de bupivacaïne ou de lidocaïne supplémentaire (0,15-0,2 mg au total) peut être injecté dans plusieurs sites le long de la couche musculaire fermée (infiltration locale / bloc d’éclaboussures). - Opposez et fermez les bords de la peau à l’aide de clips de plaie placés séparés tous les 5 à 10 mm.
- Activez l’isoflurane à 1,5% -3% (maintenance). Surveillez la profondeur de l’anesthésie, y compris la réaction au pincement des orteils, la fréquence respiratoire et le caractère. Ajuster le taux d’isoflurane au besoin pour maintenir un plan d’anesthésie approprié.
- Récupération
- Placez le rat dans une cage de récupération propre avec support thermique à l’aide d’un coussin chauffant placé sous la cage.
REMARQUE: Pour prévenir l’hyperthermie, le coussin chauffant ne doit pas être en contact direct avec l’animal et ne doit pas dépasser 40 ° C. - Surveiller l’animal jusqu’à ce qu’il se rétablisse complètement et qu’il soit normotherme (37,5-39 °C).
REMARQUE: L’animal ne doit pas être laissé sans surveillance jusqu’à ce qu’il soit pleinement conscient et couché sévèrement et se déplace facilement autour de la cage. - Après avoir été complètement éveillé, mobile et bien respirer, injecter aux rats de la buprénorphine (1,0-1,2 mg / kg SC).
REMARQUE: L’administration de buprénorphine chez un rat anesthésié peut nuire à la récupération. - Administrer 10 mL de solution de Ringer chaude et lactée par voie sous-cutanée entre les omoplates.
- Replacez les rats dans la cage propre et réunissez-les avec des congénères.
- Surveillez tous les animaux deux fois par jour pendant le mois suivant pour détecter tout signe de douleur et de détresse, y compris la piloérection, la posture voûtée ou l’inappétence ou les signes d’infection du site d’incision, y compris l’érythème, l’écoulement purulent ou la déhiscence de la plaie.
REMARQUE: À ce jour, nous n’avons observé aucun signe clinique (comme des infections) après le rétablissement postopératoire chez aucun des animaux. Un seul rat avait une déhiscence avec des sutures, après quoi des clips de plaie ont été utilisés pour fermer les plaies sans autres problèmes. - Administrer de la buprénorphine ou du méloxicam à des animaux présentant des signes cliniques de douleur à des doses publiées en consultation avec un vétérinaire d’animaux de laboratoire.
- Administrer des antibiotiques (c.-à-d. céphalosporine) aux animaux présentant des signes cliniques de douleur aux doses publiées en consultation avec un vétérinaire des animaux de laboratoire.
REMARQUE: Tous les animaux présentant des signes prolongés de douleur ou de détresse qui ne s’améliorent pas avec des analgésiques ou les animaux présentant des signes d’infection qui ne répondent pas aux antibiotiques doivent être euthanasiés sans cruauté.
- Placez le rat dans une cage de récupération propre avec support thermique à l’aide d’un coussin chauffant placé sous la cage.
6. Imagerie par rayons X
- Après l’implantation de la tumeur, imagez le tibia et les poumons de manière non invasive pour détecter la croissance tumorale à l’aide d’une radiographie avec une machine conçue pour les rongeurs.
- Anesthésiez les rats comme cela a été fait précédemment.
- Prenez des images à un grossissement de 3x pendant 6 s à 25 kV.
- Traitez le film à l’aide du processeur à rayons X. Les radiographies peuvent également être numérisées numériquement.
7. Procédure de nécropsie
- Euthanasier les rats avec du CO2. Confirmez la mort par manque de rythme cardiaque et prélevez immédiatement 3 mL de sang du cœur pour des échantillons de sérum ou de plasma.
- Ouvrez le thorax et l’abdomen pour examen.
- Isolez la trachée et canulez avec un cathéter (18 G). Pour fixer le cathéter dans la trachée, attachez une suture de soie autour de la trachée avec le cathéter.
- Raccordez le cathéter de perfusion à une seringue de 3 ou 5 mL. Infuser du formol ou une solution saline pour gonfler doucement les lobes pulmonaires pour de meilleurs échantillons d’histologie. Lors de la perfusion, les poumons vont gonfler et permettre une meilleure visualisation des métastases pulmonaires.
- Examinez, disséquez et pesez tous les organes thoraciques et abdominaux sélectionnés (tels que le foie, les reins).
- Fixez les organes dans le formol pour l’histopathologie ou congelez sur de la glace sèche, du 2-méthylbutane ou de l’azote liquide.
- Pour l’évaluation de l’expression des protéines à l’aide du transfert western, fabriquez des lysats de tissus congelés. Les anticorps qui réagissent avec les tissus de rat sont détaillés13.
8. Immunohistochimie
- Traiter le tissu primaire de la SG, l’incorporer dans de la paraffine et le sectionner pour la coloration immunohistochimique.
- Récupérer l’antigène après déparaffinisation à l’aide d’un tampon de citrate (pH 6,0). Incuber dans 0,3%H2O2 dans du méthanol pendant 30 min pour éteindre la peroxydase endogène.
- Bloquez les sections de paraffine de 5 μm d’épaisseur à l’aide d’un sérum normal.
- Incuber avec des anticorps primaires anti-CD68 et CD3 (voir tableau) pendant la nuit à 4 °C.
- Rincez les sections dans PBS et incuubez-les dans un polymère HRP à l’aide d’un kit de détection.
REMARQUE: Immunostaining a été développé avec la diaminobenzidine comme chromogène.
9. Transfert western
- Lyser les cellules UMR-106 dans 200-300 μL de tampon de lyse14 pour effectuer l’électrophorèse sur gel standard et le western blot.
- Utilisez 4% à 12% de gels Bis-Tris.
- Incuber dans l’anticorps primaire anti-ErbB2, anti-ErbB4, anti-EGFR, anti-ERK, β-actine ou anti-souris β2-AR (voir tableau) et l’anticorps secondaire lié à la peroxydase de raifort.
- Ajouter le substrat chimiluminescent. Exposez les membranes à un film radiographique.
REMARQUE: les niveaux de β-actine sont utilisés comme contrôles de chargement.
Résultats
Des rats consanguins SD immunocompétents sont utilisés pour ces études sur la SG, qui offrent un modèle animal avec un système immunitaire intact. Nous avons utilisé la lignée cellulaire UMR106 d’ATCC, développée à partir de cellules initialement isolées d’un système d’exploitation d’un rat SD. Nous avons implanté les cellules dans des rats SD, fournissant ainsi un modèle syngénique pour OS. Les cellules UMR106 sont implantées dans le tibia de rats SD mâles et femelles âgés de 3 semaines, simulant un modèle de SYSTÈME D’EXPLOITATION pédiatrique. De plus, l’implantation orthotopique de cellules UMR106 directement dans la métaphyse/diaphyse du tibia donne un microenvironnement tumoral pertinent.
Lors de l’implantation de cellules tumorales, une aiguille doit être insérée correctement à travers le plateau tibial (Figure 1) à l’angle correct (parallèle à la tige osseuse) étendant la pointe de l’aiguille d’environ 10 mm dans la cavité centrale de l’os. Avec cette procédure, 95% (52/55) des rats ont développé des tumeurs du tibia distal au genou. Avec l’expérience de l’injection tibiale, 100% des rats ont développé des tumeurs. Dans un groupe de rats qui n’ont pas été amputés, les volumes tumoraux moyens chez les mâles étaient de 504 mm3 à 3 semaines et de 1195 mm3 à 5 semaines après l’implantation. Chez les femelles, les volumes tumoraux sont en moyenne de 285 mm3 à 3 semaines et de 495 mm3 à 5 semaines après l’implantation.
Deux cohortes de rats ont été comparées, y compris ceux amputés (23 rats) (Figure 2) et ceux sans amputation (29 rats). Les deux cohortes ont été euthanasiées 7 semaines après l’implantation pour examiner les métastases tumorales aux poumons. Dans le groupe d’amputation (3/23), les rats ont développé des métastases pulmonaires. Ces trois rats sont morts ou ont été euthanasiés dans les 24 heures suivant la chirurgie en raison de complications post-opératoires. Deux rats sont morts d’une anesthésie prolongée alors que le chirurgien apprenait la méthode. Un rat a développé une déhiscence et a été euthanasié le lendemain. Les poumons de ces trois rats ont été évalués et trois petites métastases (>1 mm) ont été trouvées histologiquement. Les 20 rats survivants n’ont pas eu de métastases pulmonaires 7 semaines après l’implantation. Cela indique que 3 semaines après l’implantation des amputations sont suffisantes pour diminuer le nombre de rats atteints de métastases pulmonaires. Dans un deuxième groupe de 29 rats qui n’ont pas subi la procédure d’amputation, 26/29 rats ont eu des métastases pulmonaires conformes aux données publiées précédemment11. Nous n’avons vu aucun motif dans la taille ou le nombre de métastases chez ces rats. La plupart des rats ont plus de 10 métastases de 2 à 7 mm de diamètre grossièrement visibles qui ont été facilement échantillonnées lors de la nécropsie. Parfois, les rats avaient des métastases encore plus grandes allant jusqu’à 10 mm de diamètre. Il est important d’implanter des cellules UMR106 avec un faible nombre de passages, car les études ont démontré que les cellules avec un nombre de passages de 10 ou plus deviennent plus agressives et métastasent dès 2-3 semaines après l’implantation. La raison de la nature n’est pas connue, mais la spéculation est que les cellules en culture pourraient développer des mutations qui favorisent les métastases.
En plus de la chirurgie d’amputation, un autre raffinement des méthodes comprenait l’imagerie par rayons X pour la surveillance tumorale ou lors de la nécropsie. Cette méthode permet au chercheur de confirmer l’invasion de tumeurs osseuses chez le rat sous anesthésie. La méthode de radiographie planaire peut également être utilisée sur des membres récemment amputés ou des membres fixes au formol. La méthode est rapide (5 min par rat) et peu coûteuse (2-5 $ / rat) par rapport à la tomodensitométrie (CT). Pour la surveillance in vivo, il nécessite que les rats soient anesthésiés pendant l’imagerie. La figure 3 illustre la morphologie détaillée observée par imagerie aux rayons X de deux membres précédemment amputés. Cette méthode éclaire la nature ostéolytique et ostéoblastique de ces tumeurs. Notez la perturbation de l’architecture corticale osseuse normale du tibia et du péroné dans les deux exemples (flèches blanches). La figure 4 illustre la morphologie radiographique des poumons avec et sans métastases. L’imagerie par rayons X peut rapidement révéler au laboratoire, la nécessité de l’euthanasie pour prévenir les décès spontanés inutiles.
Les tumeurs primaires et métastatiques du poumon sont histologiquement similaires à la SG humaine présentant à la fois une morphologie tumorale ostéolytique et ostéoblastique. Chez le rat OS, la morphologie tumorale ostéolytique et ostéoblastique est confirmée par l’histopathologie du membre amputé dans les figures 5 et 6. Notez que l’os cortical est absent dans cet exemple et que l’os adjacent est également remplacé ou enrichi par un nouvel os tissé (exostoses) qui est orienté perpendiculairement à la tige existante du cortex. Des îlots d’ostéoïde immature (matériel extracellulaire amorphe) sont montrés dans l’exemple de la tumeur. De plus, la morphologie microscopique des métastases pulmonaires, certaines avec des os minéralisés, et des embolies vasculaires tumorales sont montrées à la figure 7.
L’amputation d’un membre avec OS augmente la survie chez les rats. Les rats peuvent mourir spontanément en raison de métastases pulmonaires logées pendant plus de 7 semaines après l’implantation. L’utilisation de l’amputation peut permettre d’approfondir l’étude du traitement standard ou ciblé du cancer dans ce modèle. L’allongement du temps entre l’implantation de la tumeur et l’amputation augmentera l’incidence des métastases.
La doxorubicine est un agent chimiothérapeutique utilisé pour traiter la SG chez l’homme. Chez le rat, la doxorubicine peut être administrée par injections jugulaires13 ou par cathéter15 comme décrit ici. L’injection jugulaire nécessite 5 à 10 minutes par rat, mais assure l’administration de la dose dans la veine exposée. Dans l’ensemble, les injections jugulaires sont beaucoup plus reproductibles que les injections de veines de la queue de rat. Si la doxorubicine fuit dans le derme lors des injections de veine caudale, une nécrose de la queue peut survenir et empêcher d’autres traitements. Dans cette étude, cinq rats ont été traités avec une dose de 2 mg / kg de doxorubicine et euthanasiés 48 h après l’injection pour étudier la mort cellulaire dans les tumeurs comme le montre la figure 5A,B.
Cinq rats témoins traités avec une solution saline ont également été évalués pour sélectionner des anticorps pouvant être utilisés pour renforcer l’immunocoloration des cellules immunitaires chez les systèmes d’exploitation de rats. Ici, deux anticorps ont été testés pour la réactivité immunitaire. Pour les études d’immunohistochimie, les tumeurs ont été fixées dans le formol pendant 48 à 72 h, puis déplacées vers l’éthanol à 70% pour réduire la réticulation des protéines qui se produit dans le formol. L’immunohistochimie a été réalisée pour les infiltrats de cellules immunitaires dans les tumeurs primaires de la SG et immunocolorée pour les macrophages (CD68) et les lymphocytes T (CD3). La figure 8 montre deux exemples d’immunotaches d’infiltrats de cellules immunitaires dans le microenvironnement tumoral.
Les cibles potentielles d’une intervention thérapeutique ont également été explorées. Après l’amputation de membres avec des tumeurs, des échantillons de SG de rat ont été congelés pour un futur isolement protéique. Dans cette étude, nous avons découvert que les cellules UMR106 expriment les protéines de la voie de la famille ErbB. Les transferts occidentaux effectués sur les lysats de protéines cellulaires UMR106 démontrent l’expression d’ErbB2, EGFR, ErbB4 et d’autres protéines qui interagissent avec ces voies (Figure 9).

Figure 1: Tibia avec aiguille d’implantation tumorale insérée. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2: Tibia pendant la procédure d’amputation avec la peau enlevée (A), l’artère fémorale et la veine exposées (B), avec muscle élevé du fémur (C), et chez un rat 3 semaines après la chirurgie d’amputation (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
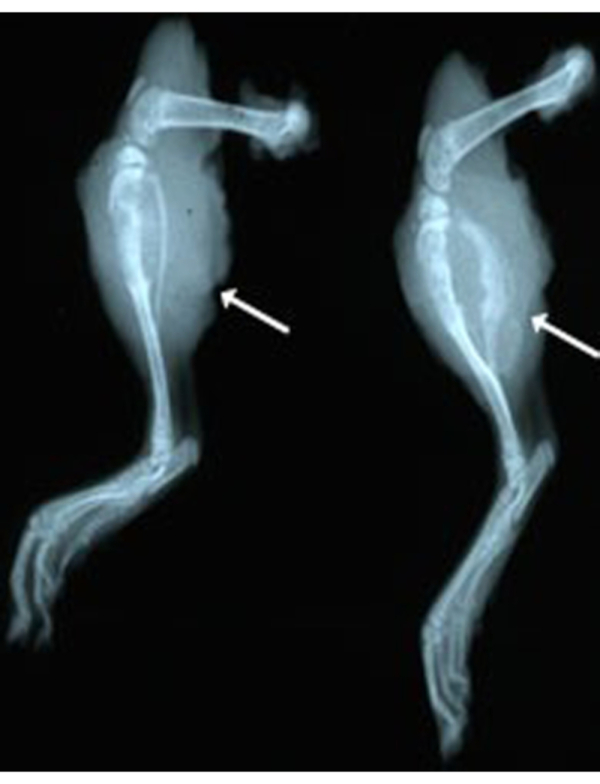
Figure 3: Radiographie aux rayons X des jambes droites après amputation (ex vivo) de deux rats atteints de SG. Notez la nature ostéolytique et ostéoblastique de la tumeur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4: Images radiographiques des poumons du rat. (A) sans métastases pulmonaires. (B) avec métastases pulmonaires de la SG. (C) corrélation avec la pathologie globale des métastases dans un poumon gonflé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5: (A) Histopathologie de la SG avec 90% des cellules présentant la mort cellulaire dans la tumeur du tibia 48 h après une dose de 2 mg/kg de doxorubicine. (B) Mort des cellules tumorales (flèche) dans la SG primaire tibiale à 48 h après une dose de 2 mg/kg de doxorubicine. Notez que les coins supérieur droit et gauche ont des cellules viables. ( C )Invasionde la SG dans l’os cortical. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6: (A) Histopathologie de la SG qui a remplacé les cellules de la moelle osseuse et s’est infiltrée dans les cortex du tibia. Remarquez la nouvelle croissance osseuse réactive accompagnée car elle est superposée à l’extérieur et perpendiculaire au cortex préexistant. (B) Examen de puissance supérieure des cellules tumorales OS adjacentes à un îlot osseux. (C) Examen de puissance supérieure des cellules OS incorporées dans la matrice extracellulaire rose à bleue (ostéoïde). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7: (A) Métastases pulmonaires multiples chez le rat avec implantation d’une tumeur du tibia. (B) Cellules tumorales OS dans une embole dans un petit vaisseau ramifié de l’artère pulmonaire adjacent à une bronchiole sous le vaisseau. (C) Certaines métastases pulmonaires contiennent des îlots osseux tandis que d’autres métastases sont plus cellulaires. (D) Puissance plus élevée des métastases avec des cellules OS mélangées avec des îlots d’os minéralisés. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8: Immunohistochimie des macrophages immunocolorants CD68 (A) et des lymphocytes T immunocolorants (B) montrant des lymphocytes CD3 positifs dans la SG du tibia. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 9: Protéines de la voie ErbB exprimées dans les cellules OS UMR106 des tumeurs du tibia. Les lysats des tumeurs primaires ont été examinés pour l’expression protéique de la voie de transduction du signal de la famille ErbB, y compris les récepteurs ErbB2, EGFR, ErbB4, AKT, ERK1/2 et β2-adrénergiques avec l’actine comme contrôle de charge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les rats porteurs d’implants tibias OS développent des tumeurs mesurables 3 semaines après l’implantation. Si les membres avec des tumeurs sont amputés 3 semaines après l’implantation, l’incidence des métastases pulmonaires est considérablement réduite. Les systèmes d’exploitation sont à la fois ostéolytiques et ostéoblastiques. Les rats sans amputation développent des métastases pulmonaires multiples et de taille variable, observées par radiographie ou lors de la nécropsie 7 semaines après l’implantation. EGFR, ErbB2 et ErbB4 sont exprimés en RAT UMR106 OS, similaire à l’OShumain 16,17,18. Les lymphocytes T CD3 et les macrophages sont facilement détectés dans la SG par des méthodes d’immunohistochimie. Les injections de veine jugulaire sont préférées à la veine de la queue pour l’administration de la chimiothérapie doxorubicine, un médicament administré aux patients atteints de SG. La méthode décrite ici est une amputation coxofémorale complète. Cette procédure est un raffinement et pourrait être envisagée pour remplacer la méthode chirurgicale d’ablation de la tumeur (ostéotomie fémorale) où l’os est coupé laissant un moignon pour le patient8. L’étude suggère une ablation complète des membres pour réduire la probabilité de douleur et de complications post-chirurgicales.
Ce protocole comporte un certain nombre d’étapes critiques. Tout d’abord, il est important de noter le passage des cellules tumorales et d’utiliser le passage inférieur des cellules pour les études afin de maintenir la cohérence du modèle d’expérience en expérience. Les cellules de passage plus âgées deviennent plus agressives avec le temps en culture. Deuxièmement, l’utilisation de l’aiguille de taille appropriée et de la seringue Hamilton aidera à injecter correctement les cellules dans le tibia à un très petit volume de 20 μL, un volume déterminé comme optimal et n’a pas causé de fuite. Troisièmement, le chirurgien doit d’abord pratiquer la désarticulation lorsqu’il fait des nécropsies sur des rats d’âge similaire pour apprendre la mécanique de la procédure. Quatrièmement, pour le succès de l’amputation, maintenez la thermorégulation et limitez le temps de chirurgie. Un chirurgien expérimenté peut compléter l’amputation en 15 min.
Il a été observé que la plantation de cellules dans le tibia s’amélioraitconsidérablement lorsqu’une aiguille de plus gros alésage était utilisée pour faire l’ouverture initiale suivie de l’insertion d’une aiguille de seringue Hamilton de plus petit calibre. Cela protège la seringue Hamilton de la casse et de l’émoussement au fil du temps. Les seringues Hamilton peuvent avoir des volumes aussi petits que 10 μL. Les seringues à tuberculine de 1 mL ne seraient pas assez précises pour l’implantation de 20 μL. La même seringue Hamilton a été utilisée pour tous les rats implantés un jour, mais ont été lavés entre les procédures chirurgicales de chaque rat. Évitez d’autoclaver les seringues Hamilton car elles sont sujettes à la casse. À la fin de la procédure, lavez-le avec une solution saline (10 fois), puis avec de l’éthanol à 100% (10 fois) et laissez-le sécher avec un piston retiré pour le stocker.
Des sutures cutanées et sous-cutanées ont d’abord été utilisées pour fermer l’incision, mais un rat a été trouvé avec une déhiscence le lendemain de la chirurgie. L’utilisation de clips de plaie et de colle chirurgicale pour fermer l’incision a amélioré la méthode. Avec ce raffinement, aucun autre rat n’a eu une telle complication post-chirurgicale. L’inclusion de la radiographie des poumons par rayons X affine ce modèle pour démontrer les métastases pulmonaires chez le rat permettant une euthanasie opportune et prévenant des décès inattendus. Les images radiographiques nous permettent de déterminer la nature ostéolytique et ostéoblastique de ces systèmes d’exploitation de rats, similaires aux systèmes d’exploitation humains.
Un niveau modéré d’expertise chirurgicale est nécessaire pour effectuer la procédure d’amputation. L’étape la plus difficile est la dissection dans la musculature pour localiser l’articulation coxofémorale. Le grossissement et un bon éclairage sont importants pendant cette étape. L’expertise chirurgicale peut être obtenue avec la pratique sur des animaux qui ont été euthanasiés. Après environ 10 rats, le chirurgien doit être sûr d’amputer un membre avec OS d’un rat vivant sous anesthésie.
Les méthodes existantes pour enlever les membres atteints de sarcomes chez la souris et le rat sont basées sur l’ablation du tibia en coupant l’os du fémur et la musculature au milieu de la tige et en laissant le moignon8. Bien que cela puisse être utile pour certaines enquêtes, dans cette étude, l’ablation complète de la jambe a été tentée. La procédure s’est avérée satisfaisante et n’a offert aucune complication post-chirurgicale. Chez les rats avec un moignon de membre postérieur, il pourrait y avoir plus de douleurs cutanées, musculaires ou nerveuses post-chirurgicales. En laissant une souche, les rats pouvaient atteindre le site de la chirurgie et y accéder. Les rats se débrouillent très bien après l’amputation et se déplacent bien dans la cage avec un membre postérieur.
Les avantages de l’amputation complète d’un membre comprennent l’ablation de la tumeur primaire avant qu’elle ne devienne trop grande et douloureuse pour le rat. Il est important de noter que l’ablation de la tumeur primaire aidera à contrôler les métastases tumorales primaires au poumon. Les rats amputés peuvent être étudiés plus avant afin de tester l’efficacité de nouveaux traitements sur les cellules tumorales circulantes dans le sang ou dans les micrométastases dans les capillaires des poumons ou d’autres os.
Il existe un besoin important de développement de nouvelles thérapies contre le cancer pour la SG et d’autres sarcomes, en particulier des thérapies qui ont une activité médicamenteuse contre la progression métastatique. Par rapport aux nouvelles thérapies développées pour d’autres cancers, les thérapies pour la SG n’ont malheureusement pas progressé depuis de nombreuses décennies. En réponse à ce problème, une réunion de dirigeants et d’experts clés en matière de SG et de métastases s’est réunie pour élaborer des lignes directrices pour améliorer le développement de médicaments contre laSG 19. Selon les suggestions du panel, des études ont été menées pour améliorer le modèle préclinique du rat, un modèle moins connu de la SG. En résumé, l’amputation et l’imagerie affinent le modèle préclinique du rat pour une utilisation ultérieure par la communauté de recherche sur le sarcome. La procédure d’amputation permettra d’améliorer la survie des patients pendant plusieurs mois, ce qui permettra d’évaluer l’efficacité de nouveaux traitements sur les micrométastases ou les tumeurs dormantes ou de tester la toxicité des traitements avec un modèle avec une meilleure longévité.
En résumé, nous offrons l’avantage de ce modèle de système d’exploitation. Les rats consanguins SD immunocompétents sont utilisés pour fournir un modèle syngénique avec une lignée cellulaire UMR106 OS implantée isolée d’une OS de rat SD. La tumeur primaire et métastatique est histologiquement similaire à la SG chez l’homme. Les rats juvéniles mâles et femelles sont utilisés pour les études d’implantation tumorale UMR106 modélisant le sarcome pédiatrique. Le placement orthotopique des cellules implantées se fait directement dans le tibia pour un microenvironnement tumoral pertinent. La tumeur primaire métastase au poumon et les métastases peuvent être surveillées par imagerie in vivo avec la méthode des rayons X. La SG du rat exprime des protéines en commun avec la SG humaine, comme ErbB2. Par rapport au système d’exploitation pour chien, le modèle de rat permet d’utiliser simultanément un plus grand nombre d’animaux. Les rats sont 10 fois plus gros que les souris pour faciliter les injections tibiales, la chirurgie, l’imagerie, les prises de sang et la biopsie. La longévité des rats est plus assurée avec l’amputation et ce modèle peut combiner un traitement néoadjuvant, une amputation et un traitement adjuvant permettant d’améliorer la survie des patients permettant d’évaluer l’efficacité des traitements sur les micrométastases ou les tumeurs dormantes. L’évaluation de la toxicité hors cible peut également être évaluée dans ce modèle où les rats peuvent être traités avec des traitements anticancéreux tels que la doxorubicine et surveillés à long terme pour la toxicité cardiaque induite par la doxorubicine ou la récurrence de la SG. Cela permettrait de tester des agents de cardio-protection dans un modèle avec OS.
Déclarations de divulgation
Aucune divulgation à déclarer.
Remerciements
Financement des NIH par le National Cancer Institute, subvention # CA228582. Shun Ishiyama reçoit actuellement une subvention de Toray Medical Co., Ltd.
matériels
| Name | Company | Catalog Number | Comments |
| AKT | Cell Signaling TECHNOLOGY | 4685S | |
| absorbable suture | Ethicon | J214H | |
| β-actin | SANTA CRUZ BIOTECHNOLOGY | sc-47778 | |
| β2-AR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-569 | replaced by β2-AR (E-3): sc-271322 |
| Bis–Tris gels | Thermo Fisher | NP0321PK2 | |
| Buprenorphine SR Lab | ZooPharm | IZ-70000-201908 | |
| CD3 antibody | Dako | #A0452 | |
| CD68 antibody | eBioscience | #14-0688-82 | |
| Chemiluminescent substrate | cytiva | RPN2232 | |
| CL-Xposure film | Thermo Fisher | 34089 | |
| Complete Anesthesia System | EVETEQUIP | 922120 | |
| diaminobenzidine | VECTOR LABORATORIES | SK-4100 | |
| Doxorubicin | Actavis | NDC 45963-733-60 | |
| EGFR antibody | SANTA CRUZ BIOTECHNOLOGY | sc-03 | replaced by EGFR (A-10): sc-373746 |
| ERBB2 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-284 | replaced by Neu (3B5): sc-33684 |
| ERBB4 antibody | SANTA CRUZ BIOTECHNOLOGY | sc-283 | replaced by ErbB4 (C-7): sc-8050 |
| ERK antibody | SANTA CRUZ BIOTECHNOLOGY | sc-514302 | |
| eye lubricant | PHARMADERM | NDC 0462-0211-38 | |
| Hamilton syringe (100 µL) | Hamilton | Model 1710 SN SYR | |
| horseradish peroxidase-linked secondary antibody | cytiva | NA934 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7401 | |
| HRP polymer detection kit | VECTOR LABORATORIES | MP-7402 | |
| isoflurane | BUTLER SCHEIN | NDC 11695-6776-2 | |
| isoflurane vaporizer | EVETEQUIP | 911103 | |
| UMR-106 cell | ATCC | CRL-1661 | |
| X-ray | Faxitron | UltraFocus | |
| X-ray processor | Hope X-Ray Peoducts Inc | MicroMax X-ray Processor | Hope Processors are not available in USA anymore |
| wound clips | BECTON DICKINSON | 427631 |
Références
- Link, M. P., et al. The effect of adjuvant chemotherapy on relapse-free survival in patients with osteosarcoma of the extremity. New England Journal of Medicine. 314 (25), 1600-1606 (1986).
- Bielack, S. S., et al. Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. Journal of Clinical Oncology. 20 (3), 776-790 (2002).
- Botter, S. M., Neri, D., Fuchs, B. Recent advances in osteosarcoma. Current Opinion in Pharmacology. 16, 15-23 (2014).
- Ek, E. T. H., Dass, C. R., Choong, P. F. M. Commonly used mouse models of osteosarcoma. Critical Reviews in Oncology Hematology. 60 (1), 1-8 (2006).
- Guijarro, M. V., Ghivizzani, S. C., Gibbs, C. P. Animal models in osteosarcoma. Frontiers Oncology. 4, 189(2014).
- Janeway, K. A., Walkley, C. R. Modeling human osteosarcoma in the mouse: From bedside to bench. Bone. 47 (5), 859-865 (2010).
- Mohseny, A. B., Hogendoorn, P. C., Cleton-Jansen, A. M. Osteosarcoma models: from cell lines to zebrafish. Sarcoma. 2012, 417271(2012).
- Khanna, C., et al. An orthotopic model of murine osteosarcoma with clonally related variants differing in pulmonary metastatic potential. Clinical & Experimental Metastasis. 18 (3), 261-271 (2000).
- Martin, T. J., et al. Parathyroid hormone-responsive adenylate cyclase in induced transplantable osteogenic rat sarcoma. Nature. 260 (5550), 436-438 (1976).
- Fisher, J. L., Mackie, P. S., Howard, M. L., Zhou, H., Choong, P. F. The expression of the urokinase plasminogen activator system in metastatic murine osteosarcoma: an in vivo mouse model. Clinical Cancer Research. 7 (6), 1654-1660 (2001).
- Yu, Z., et al. Establishment of reproducible osteosarcoma rat model using orthotopic implantation technique. Oncology Reports. 21 (5), 1175-1180 (2009).
- Zhang, P., et al. Homologous mesenchymal stem cells promote the emergence and growth of pulmonary metastases of the rat osteosarcoma cell line UMR-106. Oncology Letters. 8 (1), 127-132 (2014).
- Gabrielson, K., et al. Heat shock protein 90 and ErbB2 in the cardiac response to doxorubicin injury. Cancer Research. 67 (4), 1436-1441 (2007).
- Sysa-Shah, P., et al. Bidirectional cross-regulation between ErbB2 and β-adrenergic signalling pathways. Cardiovascular Research. 109 (3), 358-373 (2016).
- Wachtman, L. M., Browning, M. D., Bedja, D., Pin, S., Gabrielson, K. L. Validation of the use of long-term indwelling jugular catheters in a rat model of cardiotoxicity. Journal of American Association Laboratory Animal Science. 45, 55-64 (2006).
- Abdou, A. G., et al. The Prognostic role of Ezrin and HER2/neu expression in osteosarcoma. Applied Immunohistochemistry & Molecular Morphology. 24 (5), 355-363 (2016).
- Hughes, D. P., Thomas, D. G., Giordano, T. J., McDonagh, K. T., Baker, L. H. Essential erbB family phosphorylation in osteosarcoma as a target for CI-1033 inhibition. Pediatric Blood & Cancer. 46 (5), 614-623 (2006).
- Wen, Y. H., et al. Epidermal growth factor receptor in osteosarcoma: expression and mutational analysis. Human Pathology. 38 (8), 1184-1191 (2007).
- Khanna, C., et al. Toward a drug development path that targets metastatic progression in osteosarcoma. Clinical Cancer Research. 20 (16), 4200-4209 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon