Method Article
Xenopus laevis Подготовка экстракта яйцеклеток и методы визуализации в реальном времени для визуализации динамической цитоплазматической организации
В этой статье
Резюме
Описан способ получения и живой визуализации неразбавленных цитоплазматических экстрактов из яиц Xenopus laevis .
Аннотация
Традиционно используемые для объемных биохимических анализов, экстракты яиц Xenopus laevis стали мощным инструментом на основе визуализации для изучения цитоплазматических явлений, таких как цитокинез, формирование митотического веретена и сборка ядра. Основываясь на ранних методах, которые изображали фиксированные экстракты, отобранные в редкие временные точки, последние подходы изображают живые экстракты с использованием покадровой микроскопии, выявляя более динамические особенности с улучшенным временным разрешением. Эти методы обычно требуют сложной обработки поверхности сосуда визуализации. Здесь мы представляем альтернативный метод живой визуализации экстрактов яиц, которые не требуют химической обработки поверхности. Он прост в реализации и использует серийные лабораторные расходные материалы для визуализации. Описана система, которая может быть использована как для широкоугольной, так и для конфокальной микроскопии. Он предназначен для визуализации экстрактов в 2-мерном (2D) поле, но может быть легко расширен до визуализации в 3D. Он хорошо подходит для изучения формирования пространственного рисунка в цитоплазме. С репрезентативными данными мы демонстрируем типичную динамическую организацию микротрубочек, ядер и митохондрий в интерфазных экстрактах, приготовленных с использованием этого метода. Эти данные изображения могут предоставить количественную информацию о цитоплазматической динамике и пространственной организации.
Введение
Цитоплазма составляет основной объем клетки и имеет четкую организацию. Ингредиенты эукариотической цитоплазмы могут самособираться в широкий спектр пространственных структур, таких как микротрубочки и аппарат Гольджи, которые, в свою очередь, динамически располагаются и переворачиваются в зависимости от идентичности клетки и физиологического состояния. Таким образом, понимание пространственной организации цитоплазмы и ее связи с клеточными функциями важно для понимания того, как работает клетка. Экстракты яиц Xenopus laevis традиционно использовались для объемных биохимических анализов 1,2,3,4,5,6,7,8, но недавняя работа устанавливает их как мощную живую систему визуализации для механистических исследований цитоплазматических структур и их клеточных функций 9,10,11, 12,13,14,15,16,17,18. Эти неразбавленные экстракты сохраняют многие структуры и функции цитоплазмы, позволяя при этом прямые манипуляции с цитоплазматическим содержимым, недостижимые в обычных клеточных моделях19,20. Это делает их идеальными для характеристики цитоплазматических явлений и препарирования их механистических основ.
Существующие методы визуализации экстрактов требуют химической модификации поверхности или изготовления микрофлюидных устройств. Один метод на основе чехла требует пассивации полиэтиленгликолем (ПЭГ) стеклянных покровных пластин21. Метод, основанный на микроэмульсии, требует осаждения из пара трихлор(1H,1H,2H,2H-перфтороктил)силана на стеклянных поверхностях22,23. Системы на основе микрофлюидов позволяют точно контролировать объем, геометрию и состав капель экстракта, но требуют специализированных средств микропроизводства 11,12,24.
Здесь мы представляем альтернативный метод визуализации экстрактов яиц, который прост в реализации и использует легкодоступные, недорогие материалы. Это включает в себя подготовку камеры визуализации с затвором и крышкой, покрытой фторированной этиленпропиленовой лентой (FEP). Камера может быть использована для визуализации экстрактов с различными системами микроскопии, включая стереоскопы и вертикальные и инвертированные микроскопы. Этот метод не требует химической обработки поверхностей при достижении аналогичной оптической чистоты, полученной с помощью существующих методов на основе стекла, рассмотренных выше. Он предназначен для изображения слоя экстрактов с равномерной толщиной в 2D-поле и может быть легко расширен для изображения 3D-объема экстрактов. Он хорошо подходит для покадровой визуализации коллективного цитоплазматического поведения в большом поле зрения.
Мы использовали экстракты яиц с межфазным арестом, чтобы продемонстрировать наш метод визуализации. Подготовка экстракта осуществляется в соответствии с протоколом Деминга и Корнблута19. Короче говоря, яйца, естественно остановленные в метафазе мейоза II, измельчаются низкоскоростным вращением. Этот спин освобождает цитоплазму от мейотического ареста и позволяет экстракту переходить в интерфазу. Обычно цитохалазин B добавляют перед дробильным спином для ингибирования образования F-актина. Тем не менее, он может быть опущен, если требуется F-актин. Циклогексимид также добавляют перед дробильным спином, чтобы предотвратить попадание межфазного экстракта в следующий митоз. Экстракты впоследствии помещают в вышеупомянутые камеры визуализации и помещают на микроскоп. Наконец, изображения записываются с течением времени через определенные промежутки времени камерой, подключенной к микроскопу, создавая покадровые серии изображений, которые фиксируют динамическое поведение экстракта в 2D-поле.
протокол
Все методы, описанные здесь, были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Стэнфордского университета.
1. Подготовка слайдов и обложек
- Нанесите слой фторированной этиленпропиленовой (FEP) клейкой ленты на стеклянную горку с помощью роликового аппликатора. Отрежьте лишнюю ленту по краям чистым лезвием бритвы. Таким же образом подготовьте чехлы с покрытием из ленты FEP (рисунок 1А).
- Нанесите двустороннюю липкую прокладку для изображения на сторону слайда, покрытую лентой FEP. Оставьте защитный вкладыш сверху неочищенным (рисунок 1А).
ПРИМЕЧАНИЕ: Слайды и крышки должны быть подготовлены перед экспериментом. Их можно использовать немедленно или хранить в ящиках для предотвращения накопления пыли на поверхностях. Скважина в распорке для визуализации имеет глубину 120 мкм и диаметр 9 мм.
2. Подготовка и живая визуализация межфазно-остановленных экстрактов яиц
ПРИМЕЧАНИЕ: Следующий протокол адаптирован из Деминга и Корнблута19, Мюррея20 и Смайта и Ньюпорта25 с изменениями. Все этапы должны выполняться при комнатной температуре, если не указано иное.
- За три-десять дней до забора яйцеклеток вводят зрелую самку лягушек Xenopus laevis подкожно в дорсальный лимфатический мешок со 100 МЕ беременной кобыльей сывороточного гонадотропина (ПМСГ).
- За шестнадцать-восемнадцать часов до запланированного сбора яиц вводят лягушкам с шага 2.1 500 МЕ хорионического гонадотропина человека (ХГЧ). Оставьте лягушек при 18 °C в буфере для яйцекладки (100 мМ NaCl, 2 мМ KCl, 1 мМ MgSO4·7H2O, 2,5 мМ CaCl2·2H2O, 0,5 мМ HEPES, 0,1 мМ ЭДТА, готовят в виде 20-кратного запасного раствора при рН 7,4 и разбавляют чистой лягушачьей водой до 1 раза перед использованием) до сбора яиц.
- В день эксперимента соберите яйца в большую стеклянную чашку Петри и оцените качество яиц. Отбросьте яйца, которые выглядят как белые пухлые шарики или появляются в цепочке (рисунок 1B). Изучите яйца под стереоскопом, сохраните яйца с нормальным внешним видом (рисунок 1C) и выбросьте яйца с неправильным или пятнистым пигментом (рисунок 1D).
ПРИМЕЧАНИЕ: Этот протокол работает с яйцами, собранными из одной лягушки, которая обычно откладывает 25 мл яиц через 16 часов после инъекции ХГЧ. Обычно ХГЧ индуцирует в общей сложности от 3 до 6 лягушек, и для эксперимента по приготовлению экстракта выбирается лягушка с самым высоким качеством яйца. - Перенесите яйца в стеклянный стакан объемом 400 мл и удалите как можно больше буфера для яйцекладки путем декантирования.
- Инкубировать яйца в 100 мл свежеприготовленного раствора для обезжелезивания (2% мас./об. L-цистеина в воде, довести до рН 8,0 с NaOH) и осторожно периодически закручивать их. Примерно через 3 минуты раствор высыпать, и добавить 100 мл свежего раствора для обезжелезивания. Продолжайте инкубацию до тех пор, пока яйца не будут плотно упакованы (между яйцами нет места), но не оставляйте яйца в растворе для обезжелезивания более 5 минут.
- Удалите как можно больше раствора для обезжелезивания путем декантирования и промыть яйца в буфере MMR 0,25x (25 мМ NaCl, 0,5 мМ KCl, 0,25 мМ MgCl2, 0,5 мМ CaCl2, 0,025 мМ ЭДТА, 1,25 мМ HEPES, приготовленный в виде 10-кратного запасного раствора, скорректированный до рН 7,8 с NaOH и разбавленный в воде Milli-Q перед использованием) путем добавления буфера, закручивая яйца, а затем выливая из буфера. Повторите несколько раз, пока для стирки не будет использовано в общей сложности 1 л буфера.
- Вымойте яйца несколько раз, имея в общей сложности 400 мл буфера лизиса яиц (250 мМ сахарозы, 10 мМ HEPES, 50 мМ KCl, 2,5 мМ MgCl2, 1 мМ DTT, сделанный свежим и скорректированный до рН 7,7 с KOH). Удалите яйца с ненормальным внешним видом с помощью пипетки Пастера между стирками.
ПРИМЕЧАНИЕ: Яйца с аномальным внешним видом относятся к тем, которые выглядят как белые пухлые шарики (рисунок 1B), имеют пятнистую пигментацию (рисунок 1D), ухудшаются с растущей белой областью (рисунок 1E) или показывают затемненную и сокращенную пигментированную область в полушарии животного (рисунок 1F). - Используя передаточную пипетку с широко открытым наконечником, перенесите яйца в центрифужную трубку круглого дна объемом 17 мл, содержащую 1 мл буфера лизиса яиц. Вращайте трубку в клинической центрифуге при 400 х г в течение 15 секунд, чтобы упаковать яйца.
- Удалите как можно больше буфера лизиса яиц с верхней части упакованных яиц с помощью пипетки Пастера.
ПРИМЕЧАНИЕ: Важно удалить как можно больше буфера из упакованных яиц, чтобы свести к минимуму разбавление экстракта яйца. Иногда для этого необходимо удалить некоторые рыхлые яйца вместе с остаточным буфером. - Определяют приблизительный объем упакованных яиц, а затем добавляют 5 мкг/мл апротинина, 5 мкг/мл лейпептина, 5 мкг/мл цитохалазина В и 50 мкг/мл циклогексимида непосредственно поверх упакованных яиц.
ПРИМЕЧАНИЕ: Апротинин и лейпептин являются ингибиторами протеазы. Цитохалазин B ингибирует полимеризацию актина, предотвращая сокращение и желирование экстракта26. Циклогексимид ингибирует синтез белка, тем самым удерживая экстракт в интерфазе клеточного цикла. - Раздавите яйца центрифугированием трубки при 12 000 х г, 4 °C, в течение 15 минут, в качающемся роторе ведра.
ПРИМЕЧАНИЕ: В конце центрифугирования яйца должны были разорваться, и лизат разделился на три основных слоя: желтый липидный слой сверху, цитоплазматический экстракт (также называемый сырым экстрактом) в середине и темный плотный слой, содержащий гранулы пигмента внизу (рисунок 1G). - Прикрепите иглу 18-го калибра к шприцу. Кончиком иглы, обращенным вверх, проколите трубку со стороны на дне цитоплазматического слоя и восстановите экстракт, медленно рисуя.
ПРИМЕЧАНИЕ: Рисуйте цитоплазматический экстракт медленно, чтобы избежать включения загрязняющего содержимого из желтого липидного слоя. - Перенесите восстановленный цитоплазматический экстракт в новую микроцентрифужную трубку и подержите его на льду. Используйте экстракт в течение 1 часа.
- Когда вы будете готовы к изображению, дополните экстракт желаемыми реагентами и флуоресцентными зондами.
ПРИМЕЧАНИЕ: Флуоресцентные зонды для визуализации маркируют конкретные цитоплазматические структуры, чтобы их можно было визуализировать с помощью флуоресцентного микроскопа. - Снимите верхнюю защитную прокладку с распорки для визуализации на слайде, подготовленном на этапе 1.2, и нанесите приблизительно 7 мкл экстракта в центр скважины. Немедленно нанесите покрытую лентой FEP крышку со стороной FEP, обращенную к экстракту, чтобы герметизировать скважину. Быстро переходите к визуализации (рисунок 1H,I).
- Установите затвор на перевернутый или вертикальный микроскоп с моторизованной сценой и цифровой камерой. Визуализируйте извлечения в требуемых пространственных положениях и временных интервалах как в каналах яркого поля, так и во флуоресцентных каналах.
ПРИМЕЧАНИЕ: Как правило, для визуализации используется объектив 5x. Моторизованная ступень позволяет автоматически получать изображения в нескольких определенных пространственных положениях. Ярко-полевая микроскопия визуализирует цитоплазматические структуры с разной степенью прозрачности. Флуоресцентная микроскопия визуализирует цитоплазматические структуры, специально помеченные флуоресцентными зондами, добавленными на этапе 2.14. Камера записывает покадровые снимки этих структур, тем самым захватывая динамику цитоплазматической организации.
Результаты
Экстракты яиц Xenopus laevis можно использовать для изучения самоорганизации цитоплазмы во время интерфазы. На рисунке 2А показаны результаты успешного эксперимента. Мы дополнили интерфазно-арестованные экстракты демембранированными ядрами сперматозоидов Xenopus laevis 19 в концентрации 27 ядер/мкл и 0,38 мкМ очищенного GST-GFP-NLS 27,28,29,30 (слитый белок, состоящий из глутатион-S-трансферазы, зеленого флуоресцентного белка и последовательности ядерной локализации), чтобы обеспечить восстановление и визуализацию межфазных ядер. Мы также добавили 1 мкМ флуоресцентно меченого тубулина для визуализации микротрубочек и 500 нМ MitoTracker Red CMXRos для визуализации митохондрий. Через несколько мгновений после того, как экстракт был помещен в камеру визуализации, цитоплазма казалась дезорганизованной. В течение следующих 30 минут при комнатной температуре цитоплазма начала самоорганизовываться в клеточные компартменты. Микротрубочки астры росли из центросом, введенных с ядрами сперматозоидов, и образовывали истощенные микротрубочками пограничные зоны при встрече с микротрубочками из соседних астр. Белок GST-GFP-NLS, транслоцированный в круглые межфазные ядра, самособранные из добавленных демембранированных ядер сперматозоидов. Области, истощенные светорассеивающими цитоплазматическими компонентами, были видны как в каналах яркого поля, так и в каналах митохондрий (рисунок 2А, 20 мин и 35 мин). Митохондрии также истощились от границ, установленных микротрубочками, и обогатились изолированными компартментами, которые выровнялись с отсеками микротрубочек. К 60 мин при комнатной температуре должна быть хорошо установлена пространственная картина, состоящая из клеточных отсеков, с микротрубочками, образующими полую венокообразную структуру, и митохондриями, четко разделенными на каждый отсек (рисунок 2А, 53 мин).
На рисунке 2B сравниваются характеристики извлечения в камерах визуализации с лентами FEP на стекле и без них. Мы дополнили интерфазно-арестованные экстракты демембранированными ядрами сперматозоидов Xenopus laevis 19 в концентрации 27 ядер/мкл и 0,35 мкМ GST-mCherry-NLS 27,28,29,30 (термоядерный белок, состоящий из глутатиона-S-трансферазы, флуоресцентного белка mCherry и последовательности ядерной локализации), чтобы обеспечить восстановление и визуализацию межфазных ядер. Мы также добавили 1 мкМ флуоресцентно меченого тубулина для визуализации микротрубочек. Различия в динамике стали очевидными примерно через 20 мин при комнатной температуре. В камере, изготовленной из FEP-заклеенного стекла, экстракт самоорганизовывался в нормальные клеточные узоры (рисунок 2B, изображения в строках 1 и 3). Однако в камере, где стеклянные поверхности не были покрыты лентой FEP (непассивированной), экстракт показал аномальные узоры яркого поля и микротрубочек, которые со временем все больше нарушались (рисунок 2B, изображения в рядах 2 и 4). Существенных различий в ядерном импорте белка GST-mCherry-NLS не наблюдалось (рисунок 2B, изображения в строках 5 и 6).

Рисунок 1: Схемы и фотографии, относящиеся к экспериментальной процедуре. (A) Принципиальная схема для подготовки стеклянных обложек и слайдов с покрытием FEP. (B) Яйца Xenopus laevis , отложенные в буфере яйцекладки, с примерами некачественных яиц, обозначенных стрелками. Желтые стрелки, примеры яиц, которые выглядят как белые пухлые шарики. Красные стрелки, примеры яиц, которые появляются в строке. (C) Примеры яиц Xenopus laevis с нормальным внешним видом. D) Примеры некачественных яиц с нерегулярным или пятнистым пигментом. (E) Ухудшающееся яйцо с растущим белым регионом. (F) Яйцеклетка, которая показывает потемневшую и сжатую пигментированную область, возможно, из-за партеногенетической активации. (G) Слои, образованные разорванными яйцами Xenopus laevis после центрифугирования 12 000 х г на этапе 2.11. H) Схемы подготовки камеры для извлечения на этапе 2.15. (I) Фотография подготовленной камеры визуализации с экстрактом яйца внутри. (C) и (D) имеют одну и ту же шкалу в нижней части (D). (E) и (F) имеют одну и ту же шкалу в нижней части (F). Шкалы в (B) (C) (D) (E) (F) и (I) являются приблизительными. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
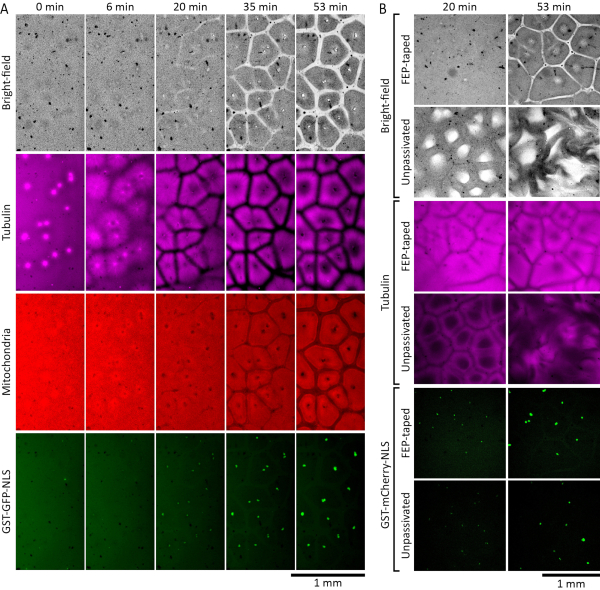
Рисунок 2: Межфазно-остановленные экстракты яиц самоорганизуются в клеточные компартменты. (A)Покадровый монтаж самоорганизованного формирования паттерна в тонком слое (120 мкм) межфазного экстракта яиц Xenopus laevis . Экстракт был дополнен 27 ядрами / мкл демембранированных ядер сперматозоидов Xenopus laevis , чтобы обеспечить восстановление межфазных ядер. Микротрубочки были визуализированы меченым HiLyte 647 тубулином (показан пурпурным цветом), митохондриями MitoTracker Red CMXRos (показаны красным цветом) и ядрами GST-GFP-NLS (показаны зеленым цветом). (B) Самоорганизующееся формирование рисунка в экстрактах яиц Xenopus laevis с межфазным арестом, помещенных в камеры со стеклянными поверхностями, покрытыми FEP-лентой, и без них. Экстракты были дополнены 27 ядрами / мкл демембранированных ядер сперматозоидов Xenopus laevis , чтобы обеспечить восстановление межфазных ядер. Микротрубочки были визуализированы hiLyte 488-меченым тубулином (показан в пурпурном цвете), а ядра GST-mCherry-NLS (показаны зеленым цветом). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
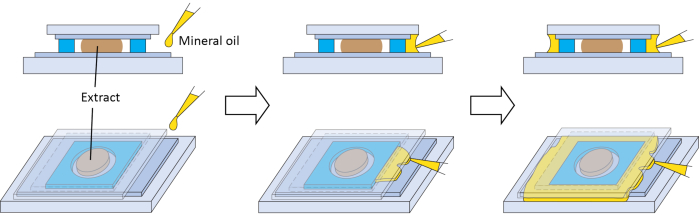
Рисунок 3: Дополнительное вторичное уплотнение для камеры визуализации. Схемы приготовления дополнительного вторичного уплотнения с минеральным маслом для предотвращения длительного контакта экстракта с воздухом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Экстракты яиц Xenopus laevis стали мощной модельной системой для визуализационных исследований различных субклеточных структур 10,14,15,16,17,18,21,31,32,33,34,35,36 и цитоплазматической организации в целом клеточная шкала9. Здесь мы описали метод визуализации в реальном времени, подходящий для визуализации динамической цитоплазматической организации в 2D. Эффективность метода демонстрируется репрезентативными результатами.
Несколько шагов имеют решающее значение для успеха метода. Качество яиц важно для экстрактов, поэтому шаги 2.3 и 2.7 имеют решающее значение. По нашему опыту, животное полушарие высококачественных яиц имеет равномерную пигментацию, отчетливую белую точку в центре (указывающую на распад зародышевого пузырька, GVBD) и четкую границу с растительным полушарием (рисунок 1C). Экстракты, изготовленные из высококачественных яиц, имеют лучшую производительность в наших условиях визуализации. Если более 5% яиц имеют пятнистый пигмент (рисунок 1D), имеют потемневшую и суженную пигментированную область (рисунок 1F), выглядят как белые пухлые шарики (рисунок 1B), появляются в цепочке (рисунок 1B) или показывают признаки ухудшения после промывки на этапах 2.6 и 2.7 (рисунок 1E), то вся партия яиц должна быть выброшена. Экстракты сохраняют замечательную биологическую активность, потому что они по существу являются неразбавленной цитоплазмой. Поэтому этап, направленный на минимизацию разбавления экстракта (этап 2.9), важен для успеха эксперимента. Для визуализации экстракты обрабатываются в очень небольших объемах и будут быстро испаряться при длительном контакте с воздухом. Это негативно скажется на их активности. Поэтому на этапе 2.15, после нанесения экстракта, он должен быть как можно скорее запечатан стороной крышки, покрытой лентой FEP. Герметизация может быть визуально подтверждена изменением текстуры в месте контакта между клеем на распорке и крышкой. Распорка должна быть в состоянии создать полную пломбу при правильном нанесении. Однако, если требуется дополнительное уплотнение, минеральное масло можно дозировать между свесом крышки и стеклянной горкой. Масло может образовывать дополнительное уплотнение вокруг распорки путем капиллярного действия (рисунок 3). Пассивация стеклянных поверхностей позволяет уменьшить неспецифическую адсорбцию молекул, и это важно для межфазных микротрубочек астр в экстрактах21,37. Нанесение ленты FEP на стеклянную поверхность, описанное здесь, по-видимому, обеспечивает аналогичные преимущества, как предполагает сборка нормальных межфазных астр микротрубочек (рисунок 2, 6 мин). Поэтому шаг 1.1 также имеет решающее значение.
Мы продемонстрировали применение метода визуализации с использованием экстрактов яиц с межфазным арестом в соответствии с протоколом Деминга и Корнблута19. По умолчанию протокол дополняет экстракты ингибитором полимеризации актина цитохалазином В для предотвращения гелеобразования-сокращения в экстрактах после длительной инкубации при комнатной температуре26. Чтобы обеспечить полимеризацию актина и наблюдать динамику актина, можно исключить цитохалазин В на этапе 2.10 протокола9. Модификация, которую мы внесли в протокол Деминга и Корнблута, заключается в том, что мы не дополняем экстракты энергетическим балансом для регенерацииАТФ-19. Это связано с тем, что в наших руках, в экстрактах, дополненных этой АТФ-регенерирующей смесью19 и ядрами сперматозоидов, микротрубочки иногда образуют сшитую решетку, которая препятствует формированию цитоплазматического рисунка. Поэтому протокол не включает этап, который добавляет энергетический баланс к экстрактам19.
Протокол межфазного экстракта основан на дроблении яиц в буфере без EGTA, чтобы освободить их от мейотического ареста (CSF-арест)37. Экстракты впоследствии переходят в интерфазу и удерживаются в интерфазе циклогексимидом. Существуют и другие устоявшиеся методы приготовления межфазных экстрактов. Некоторые методы сначала готовят экстракты, которые поддерживают мейотический арест путем дробления яиц в буфере лизиса с EGTA38, а затем освобождают арест путем добавления кальция, приводя экстракт в интерфазу 21,37,39. Экстракты могут впоследствии удерживаться в интерфазе путем добавления ингибиторов синтеза белка, таких как циклогексимид37,39. Другие методы партеногенетически активируют яйца ионофором кальция (A23187) или электрическим током, чтобы освободить их от мейотического ареста, перед дроблением яиц в отсутствие EGTA20,28 (рассмотрено в Field et al.37). Эти экстракты могут входить в интерфазу, но, как правило, не остаются там, поскольку они способны проходить несколько клеточных циклов. Кроме того, были разработаны хорошо зарекомендовавшие себя методы, оптимизированные для получения экстрактов с интактным актиновым цитоскелетом 10,37,39. Метод визуализации может быть подходящим для этих типов экстрактов, но мы не тестировали его с ними.
С целью визуализации внутренней организации цитоплазмы представленные здесь системы визуализации относительно просты в настройке, требуя только нанесения ленты FEP на стеклянные поверхности. Он позволяет собирать цитоскелетные структуры в экстрактах9, о которых сообщается в более сложных системах визуализации, где стеклянные поверхности пассивируются поли-L-лизин-g-полиэтиленгликолем (PLL-g-PEG) или покрываются поддерживаемыми липидными бислоями10,21. Метод позволяет формировать экстракционный слой с определенной толщиной (определяемой глубиной распорки, которая составляет 120 мкм для системы, показанной на фиг.1A, 1H, 1I и фиг.2). Мы можем регулировать толщину, укладывая дополнительные прокладки. Мы сложили до 6 таких распорок (толщиной 720 мкм) и отсеки сформировались нормально. Эта гибкость позволяет использовать будущие приложения, такие как визуализация экстрактов в 3D с использованием конфокальной или световой микроскопии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим J. Kamenz, Y. Chen и W. Y. C. Huang за комментарии к рукописи. Эта работа была поддержана грантами Национальных институтов здравоохранения (R01 GM110564, P50 GM107615 и R35 GM131792), присужденными Джеймсу Э. Ферреллу-младшему.
Материалы
| Name | Company | Catalog Number | Comments |
| 17 ml centrifuge tube | Beckman Coulter | 337986 | |
| 22x22 mm square #1 cover glass | Corning | 284522 | |
| Aprotinin | MilliporeSigma | 10236624001 | Protease inhibitor |
| Cycloheximide | MilliporeSigma | 01810 | Protein synthesis inhibitor |
| Cytochalasin B | MilliporeSigma | C6762 | Actin polymerization inhibitor |
| Female Xenopus laevis frogs | Nasco | LM00535MX | |
| Fluorescent HiLyte 488 labeled tubulin protein | Cytoskeleton, Inc. | TL488M-A | For visualizing the microtubule cytoskeleton |
| Fluorescent HiLyte 647 labeled tubulin protein | Cytoskeleton, Inc. | TL670M-A | For visualizing the microtubule cytoskeleton |
| Fluorinated ethylene propylene (FEP) optically clear tape | CS Hyde company | 23-FEP-2-5 | |
| Glass Pasteur pipette | Fisher Scientific | 13-678-20C | |
| Human chorionic gonadotropin (hCG) | MilliporeSigma | CG10 | |
| Imaging spacer | Electron Microscopy Sciences | 70327-8S | |
| Leupeptin | MilliporeSigma | 11017101001 | Protease inhibitor |
| Microscope slides | Fisher Scientific | 12-518-100B | |
| Mineral oil | MilliporeSigma | 330760 | |
| MitoTracker Red CMXRos | Thermo Fisher Scientific | M7512 | For visualizing mitochondria |
| Pregnant mare serum gonadotropin (PMSG) | BioVendor | RP1782725000 | |
| Roller applicator | Amazon | B07HMBJSP8 | For applying the FEP tape to the glass slides and coverslips |
| Single-edged razor blades | Fisher Scientific | 12-640 | For removing excessive FEP tape |
| Transfer pipette | Fisher Scientific | 13-711-7M |
Ссылки
- Murray, A. W., Kirschner, M. W. Cyclin synthesis drives the early embryonic cell cycle. Nature. 339 (6222), 275-280 (1989).
- Dunphy, W. G., Brizuela, L., Beach, D., Newport, J. The Xenopus cdc2 protein is a component of MPF, a cytoplasmic regulator of mitosis. Cell. 54 (3), 423-431 (1988).
- Minshull, J., Golsteyn, R., Hill, C. S., Hunt, T. The A- and B-type cyclin associated cdc2 kinases in Xenopus turn on and off at different times in the cell cycle. EMBO J. 9 (9), 2865-2875 (1990).
- Wu, J. Q., et al. PP1-mediated dephosphorylation of phosphoproteins at mitotic exit is controlled by inhibitor-1 and PP1 phosphorylation. Nature Cell Biology. 11 (5), 644-651 (2009).
- Pomerening, J. R., Sontag, E. D., Ferrell, J. E. Building a cell cycle oscillator: hysteresis and bistability in the activation of Cdc2. Nature Cell Biology. 5 (4), 346-351 (2003).
- Mochida, S., Maslen, S. L., Skehel, M., Hunt, T. Greatwall phosphorylates an inhibitor of protein phosphatase 2A that is essential for mitosis. Science. 330 (6011), 1670-1673 (2010).
- Blow, J. J., Laskey, R. A. Initiation of DNA replication in nuclei and purified DNA by a cell-free extract of Xenopus eggs. Cell. 47 (4), 577-587 (1986).
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cheng, X., Ferrell, J. E. Spontaneous emergence of cell-like organization in Xenopus egg extracts. Science. 366 (6465), 631-637 (2019).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Good, M. C., Vahey, M. D., Skandarajah, A., Fletcher, D. A., Heald, R. Cytoplasmic volume modulates spindle size during embryogenesis. Science. 342 (6160), 856-860 (2013).
- Hazel, J., et al. Changes in cytoplasmic volume are sufficient to drive spindle scaling. Science. 342 (6160), 853-856 (2013).
- Brownlee, C., Heald, R. Importin alpha Partitioning to the Plasma Membrane Regulates Intracellular Scaling. Cell. 176 (4), 805-815 (2019).
- Nguyen, P. A., Field, C. M., Mitchison, T. J. Prc1E and Kif4A control microtubule organization within and between large Xenopus egg asters. Molecular Biology of the Cell. 29 (3), 304-316 (2018).
- Desai, A., Maddox, P. S., Mitchison, T. J., Salmon, E. D. Anaphase A chromosome movement and poleward spindle microtubule flux occur At similar rates in Xenopus extract spindles. Journal of Cell Biology. 141 (3), 703-713 (1998).
- Mitchison, T. J., et al. Roles of polymerization dynamics, opposed motors, and a tensile element in governing the length of Xenopus extract meiotic spindles. Molecular Biology of the Cell. 16 (6), 3064-3076 (2005).
- Mitchison, T. J., et al. Bipolarization and poleward flux correlate during Xenopus extract spindle assembly. Molecular Biology of the Cell. 15 (12), 5603-5615 (2004).
- Murray, A. W., Desai, A. B., Salmon, E. D. Real time observation of anaphase in vitro. Proceedings of the National Academy of Sciences of the United States of America. 93 (22), 12327-12332 (1996).
- Deming, P., Kornbluth, S. Study of apoptosis in vitro using the Xenopus egg extract reconstitution system. Methods in Molecular Biology. 322, 379-393 (2006).
- Murray, A. W. Cell cycle extracts. Methods in Cell Biology. 36, 581-605 (1991).
- Field, C. M., Mitchison, T. J. Assembly of Spindles and Asters in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Guan, Y., et al. A robust and tunable mitotic oscillator in artificial cells. Elife. 7, (2018).
- Guan, Y., Wang, S., Jin, M., Xu, H., Yang, Q. Reconstitution of Cell-cycle Oscillations in Microemulsions of Cell-free Xenopus Egg Extracts. Journal of Visualized Experiments. (139), e58240(2018).
- Oakey, J., Gatlin, J. C. Microfluidic Encapsulation of Demembranated Sperm Nuclei in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Smythe, C., Newport, J. W. Systems for the study of nuclear assembly, DNA replication, and nuclear breakdown in Xenopus laevis egg extracts. Methods in Cell Biology. 35, 449-468 (1991).
- Field, C. M., et al. Actin behavior in bulk cytoplasm is cell cycle regulated in early vertebrate embryos. Journal of Cell Science. 124, Pt 12 2086-2095 (2011).
- Chang, J. B., Ferrell, J. E. Mitotic trigger waves and the spatial coordination of the Xenopus cell cycle. Nature. 500 (7464), 603-607 (2013).
- Chang, J. B., Ferrell, J. E. Robustly Cycling Xenopus laevis Cell-Free Extracts in Teflon Chambers. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Chatterjee, S., Javier, M., Stochaj, U. In vivo analysis of nuclear protein traffic in mammalian cells. Experimental Cell Research. 236 (1), 346-350 (1997).
- Mochida, S., Hunt, T. Calcineurin is required to release Xenopus egg extracts from meiotic M phase. Nature. 449 (7160), 336-340 (2007).
- Heald, R., et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature. 382 (6590), 420-425 (1996).
- Helmke, K. J., Heald, R. TPX2 levels modulate meiotic spindle size and architecture in Xenopus egg extracts. Journal of Cell Biology. 206 (3), 385-393 (2014).
- Sawin, K. E., Mitchison, T. J. Mitotic spindle assembly by two different pathways in vitro. Journal of Cell Biology. 112 (5), 925-940 (1991).
- Belmont, L. D., Hyman, A. A., Sawin, K. E., Mitchison, T. J. Real-time visualization of cell cycle-dependent changes in microtubule dynamics in cytoplasmic extracts. Cell. 62 (3), 579-589 (1990).
- Krauss, S. W., Lee, G., Chasis, J. A., Mohandas, N., Heald, R. Two protein 4.1 domains essential for mitotic spindle and aster microtubule dynamics and organization in vitro. Journal of Biological Chemistry. 279 (26), 27591-27598 (2004).
- Wang, S., Romano, F. B., Field, C. M., Mitchison, T. J., Rapoport, T. A. Multiple mechanisms determine ER network morphology during the cell cycle in Xenopus egg extracts. Journal of Cell Biology. 203 (5), 801-814 (2013).
- Field, C. M., Nguyen, P. A., Ishihara, K., Groen, A. C., Mitchison, T. J. Xenopus egg cytoplasm with intact actin. Methods in Enzymology. 540, 399-415 (2014).
- Good, M. C., Heald, R. Preparation of Cellular Extracts from Xenopus Eggs and Embryos. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Field, C. M., Pelletier, J. F., Mitchison, T. J. Xenopus extract approaches to studying microtubule organization and signaling in cytokinesis. Methods in Cell Biology. 137, 395-435 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены