Method Article
Xenopus laevis Préparation d’extrait d’oeuf et méthodes d’imagerie en direct pour visualiser l’organisation cytoplasmique dynamique
Dans cet article
Résumé
Nous décrivons une méthode de préparation et d’imagerie en direct d’extraits cytoplasmiques non dilués d’œufs de Xenopus laevis .
Résumé
Traditionnellement utilisés pour les essais biochimiques en vrac, les extraits d’œufs de Xenopus laevis sont devenus un puissant outil basé sur l’imagerie pour étudier les phénomènes cytoplasmiques, tels que la cytokinèse, la formation de fuseau mitotique et l’assemblage du noyau. S’appuyant sur les premières méthodes qui ont imagé des extraits fixes échantillonnés à des points temporels clairsemés, les approches récentes imagent des extraits vivants en utilisant la microscopie accélérée, révélant des caractéristiques plus dynamiques avec une résolution temporelle améliorée. Ces méthodes nécessitent généralement des traitements de surface sophistiqués du vaisseau d’imagerie. Nous présentons ici une méthode alternative pour l’imagerie en direct d’extraits d’œufs qui ne nécessitent aucun traitement de surface chimique. Il est simple à mettre en œuvre et utilise des consommables de laboratoire produits en série pour l’imagerie. Nous décrivons un système qui peut être utilisé à la fois pour la microscopie à grand champ et la microscopie confocale. Il est conçu pour l’imagerie d’extraits dans un champ 2 dimensions (2D), mais peut être facilement étendu à l’imagerie en 3D. Il est bien adapté pour étudier la formation de motifs spatiaux dans le cytoplasme. Avec des données représentatives, nous démontrons l’organisation dynamique typique des microtubules, noyaux et mitochondries dans des extraits interphasiques préparés à l’aide de cette méthode. Ces données d’images peuvent fournir des informations quantitatives sur la dynamique cytoplasmique et l’organisation spatiale.
Introduction
Le cytoplasme constitue le volume principal d’une cellule et a une organisation distincte. Les ingrédients du cytoplasme eucaryote peuvent s’auto-assembler en un large éventail de structures spatiales, telles que les asters de microtubules et l’appareil de Golgi, qui à leur tour sont disposés dynamiquement et retournés en fonction de l’identité et de l’état physiologique de la cellule. Comprendre l’organisation spatiale du cytoplasme et son lien avec les fonctions cellulaires est donc important pour comprendre le fonctionnement de la cellule. Les extraits d’œufs de Xenopus laevis ont traditionnellement été utilisés pour des essais biochimiques en vrac 1,2,3,4,5,6,7,8, mais des travaux récents les établissent comme un puissant système d’imagerie en direct pour les études mécanistes des structures cytoplasmiques et de leurs fonctions cellulaires 9,10,11, 12,13,14,15,16,17,18. Ces extraits non dilués préservent de nombreuses structures et fonctions du cytoplasme, tout en permettant des manipulations directes du contenu cytoplasmique non réalisables dans les modèles cellulaires conventionnels19,20. Cela les rend idéales pour caractériser les phénomènes cytoplasmiques et disséquer leurs fondements mécanistes.
Les méthodes existantes d’imagerie des extraits nécessitent des modifications chimiques de surface ou la fabrication de dispositifs microfluidiques. Une méthode basée sur les lamelles de couverture nécessite une passivation en polyéthylène glycol (PEG) des lamelles de verre21. Une méthode basée sur la microémulsion nécessite un dépôt en phase vapeur de trichloro(1H,1H,2H,2H-perfluorooctyl)silane sur des surfaces vitrées22,23. Les systèmes microfluidiques permettent un contrôle précis du volume, de la géométrie et de la composition des gouttelettes d’extrait, mais nécessitent des installations de microfabrication spécialisées11,12,24.
Ici, nous introduisons une méthode alternative d’imagerie des extraits d’œufs qui est facile à mettre en œuvre et utilise des matériaux facilement disponibles et peu coûteux. Cela comprend la préparation d’une chambre d’imagerie avec une lame et une lamelle de couverture recouverte de ruban d’éthylène propylène fluoré (FEP). La chambre peut être utilisée pour des extraits d’imagerie avec une variété de systèmes de microscopie, y compris des stéréoscopes et des microscopes droits et inversés. Cette méthode ne nécessite aucun traitement chimique des surfaces tout en obtenant une clarté optique similaire obtenue avec les méthodes à base de verre existantes décrites ci-dessus. Il est conçu pour imager une couche d’extraits avec une épaisseur uniforme sur un champ 2D, et peut être facilement étendu pour imager un volume 3D d’extraits. Il est bien adapté à l’imagerie accélérée du comportement cytoplasmique collectif sur un large champ de vision.
Nous avons utilisé des extraits d’œufs arrêtés par interphase pour démontrer notre méthode d’imagerie. La préparation de l’extrait suit le protocole de Deming et Kornbluth19. En bref, les œufs naturellement arrêtés en métaphase de méiose II sont écrasés par une rotation à basse vitesse. Ce spin libère le cytoplasme de l’arrêt méiotique et permet à l’extrait de passer en interphase. Normalement, la cytochalasine B est ajoutée avant le spin d’écrasement pour inhiber la formation de F-actine. Cependant, il peut être omis si la F-actine est souhaitée. Le cycloheximide est également ajouté avant l’essorage de broyage pour empêcher l’extrait interphase d’entrer dans la mitose suivante. Les extraits sont ensuite placés dans les chambres d’imagerie susmentionnées et placés au microscope. Enfin, les images sont enregistrées au fil du temps à des intervalles définis par une caméra connectée au microscope, produisant des séries d’images accélérées qui capturent le comportement dynamique de l’extrait dans un champ 2D.
Protocole
Toutes les méthodes décrites ici ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) de l’Université de Stanford.
1. Préparation des diapositives et des feuillets de couverture
- Appliquez une couche de ruban adhésif d’éthylène propylène fluoré (FEP) sur une lame de verre à l’aide d’un applicateur à rouleaux. Coupez le ruban adhésif excessif sur les bords avec une lame de rasoir propre. Préparez les feuillets de couverture recouverts de ruban FEP de la même manière (Figure 1A).
- Appliquez une entretoise d’imagerie collante double face sur le côté de la lame recouvert de ruban adhésif FEP. Laissez la doublure protectrice sur le dessus non pelée (Figure 1A).
NOTE: Les lames et les feuillets de couverture doivent être préparés avant l’expérience. Ils peuvent être utilisés immédiatement ou stockés dans des boîtes pour éviter l’accumulation de poussière sur les surfaces. Le puits dans l’espaceur d’imagerie a une profondeur de 120 μm et un diamètre de 9 mm.
2. Préparation et imagerie en direct d’extraits d’œufs arrêtés par interphase
NOTE: Le protocole suivant est adapté de Deming et Kornbluth19, Murray20, et Smythe et Newport25 avec des modifications. Toutes les étapes doivent être effectuées à température ambiante, sauf indication contraire.
- Trois à dix jours avant le prélèvement des œufs, injectez des grenouilles Xenopus laevis femelles matures par voie sous-cutanée dans le sac lymphatique dorsal avec 100 UI de gonadotrophine sérique de jument gravide (PMSG).
- Seize à dix-huit heures avant la collecte prévue des œufs, injectez aux grenouilles de l’étape 2.1 500 UI de gonadotrophine chorionique humaine (hCG). Laisser les grenouilles à 18 °C dans un tampon de ponte (100 mM NaCl, 2 mM KCl, 1 mM MgSO 4·7H2O, 2,5 mM CaCl2·2H2O, 0,5 mM HEPES, 0,1 mM EDTA, préparer sous forme de solution mère 20x à pH7,4 et diluer avec de l’eau propre du réservoir de grenouille à 1x avant utilisation) jusqu’à la collecte des œufs.
- Le jour de l’expérience, collectez les œufs dans une grande boîte de Petri en verre et évaluez la qualité des œufs. Jetez tous les œufs qui ressemblent à des boules gonflées blanches ou qui apparaissent dans une ficelle (Figure 1B). Examinez les œufs sous un stéréoscope, conservez-les avec une apparence normale (figure 1C) et jetez ceux qui ont un pigment irrégulier ou tacheté (figure 1D).
REMARQUE: Ce protocole fonctionne avec des œufs prélevés sur une seule grenouille, qui pond généralement 25 ml d’œufs 16 heures après l’injection d’hCG. Habituellement, un total de 3 à 6 grenouilles sont induites par hCG, et la grenouille avec la meilleure qualité d’oeuf est choisie pour l’expérience de préparation de l’extrait. - Transférer les œufs dans un bécher en verre de 400 ml et retirer autant de tampon de ponte que possible en les décantant.
- Incuber les œufs dans 100 mL de solution dégelante fraîchement préparée (2 % p/v de L-cystéine dans l’eau, ajuster à pH 8,0 avec NaOH) et les agiter doucement périodiquement. Après environ 3 minutes, verser la solution et ajouter 100 mL de solution de déjeltion fraîche. Continuez l’incubation jusqu’à ce que les œufs soient bien emballés (pas d’espace entre les œufs), mais évitez de laisser les œufs dans la solution de déjeltion pendant plus de 5 minutes au total.
- Retirer autant de solution dégelante que possible par décantation et laver les œufs dans un tampon MMR 0,25x (NaCl 25 mM, 0,5 mM KCl, 0,25 mM MgCl 2, 0,5 mM CaCl2, 0,025 mM EDTA,1,25 mM HEPES, préparé sous forme de solution mère 10x, ajusté à pH 7,8 avec NaOH et dilué dans de l’eau Milli-Q avant utilisation) en ajoutant le tampon, faire tourbillonner les œufs, puis verser le tampon. Répétez plusieurs fois jusqu’à ce qu’un total de 1 L du tampon soit utilisé pour les lavages.
- Lavez les œufs plusieurs fois avec un total de 400 mL de tampon de lyse des œufs (250 mM de saccharose, 10 mM HEPES, 50 mM KCl, 2,5 mM MgCl2, 1 mM de DTT, frais et ajusté à pH 7,7 avec KOH). Retirer les œufs d’apparence anormale à l’aide d’une pipette Pasteur entre les lavages.
REMARQUE : Les œufs d’apparence anormale font référence à ceux qui ressemblent à des boules gonflées blanches (figure 1B), qui ont une pigmentation tachetée (figure 1D), qui se détériorent avec une région blanche en croissance (figure 1E) ou qui présentent une zone pigmentée foncée et contractée dans l’hémisphère animal (figure 1F). - À l’aide d’une pipette de transfert dont l’extrémité est grande ouverte, transférer les œufs dans un tube centrifuge à fond rond de 17 ml contenant 1 mL de tampon de lyse des œufs. Faites tourner le tube dans une centrifugeuse clinique à 400 x g pendant 15 secondes pour emballer les œufs.
- Retirez autant de tampon de lyse des œufs que possible du dessus des œufs emballés à l’aide d’une pipette Pasteur.
NOTE: Il est important d’enlever autant de tampon des œufs emballés que possible, afin de minimiser la dilution de l’extrait d’œuf. Parfois, il est nécessaire d’enlever quelques œufs en vrac avec le tampon résiduel pour y parvenir. - Déterminer le volume approximatif des œufs emballés, puis ajouter 5 μg/mL d’aprotinine, 5 μg/mL de leupeptine, 5 μg/mL de cytochalasine B et 50 μg/mL de cycloheximide directement sur les œufs emballés.
REMARQUE: L’aprotinine et la leupeptine sont des inhibiteurs de la protéase. La cytochalasine B inhibe la polymérisation de l’actine, empêchant l’extrait de se contracter et de gélifier26. Le cycloheximide inhibe la synthèse des protéines, maintenant ainsi l’extrait dans l’interphase du cycle cellulaire. - Écraser les œufs en centrifugeant le tube à 12 000 x g, 4 °C, pendant 15 minutes, dans un rotor de godet oscillant.
NOTE: À la fin de la centrifugation, les œufs doivent avoir rompu et le lysat séparé en trois couches principales: une couche lipidique jaune sur le dessus, l’extrait cytoplasmique (également appelé extrait brut) au milieu et une couche dense foncée contenant les granules de pigment en bas (Figure 1G). - Fixez une aiguille de calibre 18 à une seringue. Avec le biseau de l’aiguille tourné vers le haut, percez le tube par le côté au bas de la couche cytoplasmique et récupérez l’extrait en tirant lentement.
REMARQUE: Tirez lentement l’extrait cytoplasmique pour éviter l’inclusion de contenu contaminant de la couche lipidique jaune. - Transférer l’extrait cytoplasmique récupéré dans un nouveau tube de microcentrifugation et le maintenir sur de la glace. Utilisez l’extrait dans 1 heure.
- Lorsque vous êtes prêt à imager, complétez l’extrait avec les réactifs souhaités et les sondes d’imagerie par fluorescence.
REMARQUE: Les sondes d’imagerie par fluorescence marquent des structures cytoplasmiques spécifiques afin qu’elles puissent être visualisées par un microscope à fluorescence. - Retirez le revêtement protecteur supérieur de l’espaceur d’imagerie sur la lame préparée à l’étape 1.2 et déposez environ 7 μL d’extrait au centre du puits. Appliquez immédiatement le couvercle recouvert de ruban adhésif FEP avec le côté FEP face à l’extrait pour sceller le puits. Passez rapidement à l’imagerie (Figure 1H,I).
- Placez la lame sur un microscope inversé ou droit avec une platine motorisée et un appareil photo numérique. Imagez les extraits aux positions spatiales et aux intervalles de temps souhaités dans les canaux de fond clair et de fluorescence.
Remarque : En règle générale, un objectif 5x est utilisé pour l’imagerie. L’étage motorisé permet l’acquisition automatisée d’images à plusieurs positions spatiales définies. La microscopie à fond clair visualise les structures cytoplasmiques avec différents degrés de transparence. La microscopie à fluorescence visualise les structures cytoplasmiques spécifiquement marquées par les sondes d’imagerie par fluorescence ajoutées à l’étape 2.14. La caméra enregistre des images accélérées de ces structures, capturant ainsi la dynamique de l’organisation cytoplasmique.
Résultats
Les extraits d’œufs de Xenopus laevis peuvent être utilisés pour étudier l’auto-organisation du cytoplasme pendant l’interphase. La figure 2A montre les résultats d’une expérience réussie. Nous avons complété des extraits arrêtés par interphase avec des noyaux de spermatozoïdes19 de Xenopus laevis à une concentration de 27 noyaux/μL et 0,38 μM de GST-GFP-NLS 27,28,29,30 purifiés (protéine de fusion composée de glutathion-S-transférase, de protéine fluorescente verte et d’une séquence de localisation nucléaire) pour permettre la reconstitution et la visualisation des noyaux interphasiques. Nous avons également ajouté 1 μM de tubuline marquée par fluorescence pour visualiser les microtubules et 500 nM MitoTracker Red CMXRos pour visualiser les mitochondries. Quelques instants après que l’extrait ait été placé dans la chambre d’imagerie, le cytoplasme est apparu désorganisé. Au cours des 30 minutes suivantes à température ambiante, le cytoplasme a commencé à s’auto-organiser en compartiments ressemblant à des cellules. Les asters de microtubules se sont développés à partir de centrosomes introduits avec les noyaux de spermatozoïdes et ont formé des zones frontalières appauvries en microtubules lorsqu’ils ont rencontré des microtubules d’asters voisins. Protéine GST-GFP-NLS transloquée dans les noyaux ronds interphasiques auto-assemblés à partir des noyaux de spermatozoïdes membranes ajoutés. Des zones appauvries en composants cytoplasmiques diffusant la lumière étaient visibles dans les canaux en champ clair et dans les mitochondries (Figure 2A, 20 min et 35 min). Les mitochondries se sont également épuisées à partir des frontières établies par les microtubules et se sont enrichies dans des compartiments isolés alignés sur les compartiments des microtubules. À 60 minutes à température ambiante, un schéma spatial constitué de compartiments semblables à des cellules devrait être bien établi, avec des microtubules formant une structure creuse en forme de couronne et des mitochondries clairement réparties dans chaque compartiment (Figure 2A, 53 min).
La figure 2B compare les performances des extraits dans les chambres d’imagerie avec et sans rubans FEP sur verre. Nous avons complété des extraits arrêtés par interphase avec des noyaux de spermatozoïdes 19 de Xenopus laevis à une concentration de 27 noyaux/μL et 0,35 μM GST-mCherry-NLS27,28,29,30 (protéine de fusion composée de glutathion-S-transférase, de protéine fluorescente mCherry et d’une séquence de localisation nucléaire) pour permettre la reconstitution et la visualisation des noyaux interphases. Nous avons également ajouté 1 μM de tubuline marquée par fluorescence pour visualiser les microtubules. Les différences de dynamique sont devenues évidentes au bout d’environ 20 minutes à température ambiante. Dans la chambre en verre collé au FEP, l’extrait s’est auto-organisé en motifs cellulaires normaux (Figure 2B, images dans les rangées 1 et 3). Cependant, dans la chambre où les surfaces vitrées n’étaient pas recouvertes par le ruban FEP (non passivé), l’extrait a montré des motifs anormaux de champ clair et de microtubules qui sont devenus de plus en plus perturbés au fil du temps (Figure 2B, images dans les rangées 2 et 4). Aucune différence significative n’a été observée dans l’importation nucléaire de la protéine GST-mCherry-NLS (figure 2B, images dans les rangées 5 et 6).

Figure 1 : Schémas et photos liés à la procédure expérimentale. (A) Schéma schématique pour la préparation des lames et lames de verre revêtues de ruban FEP. B) Œufs de Xenopus laevis déposés dans un tampon de ponte, avec des exemples d’œufs de mauvaise qualité indiqués par des flèches. Flèches jaunes, exemples d’œufs qui ressemblent à des boules gonflées blanches. Flèches rouges, exemples d’œufs qui apparaissent dans une chaîne. (C) Exemples d’œufs de Xenopus laevis d’apparence normale. (D) Exemples d’oeufs de mauvaise qualité avec pigment irrégulier ou tacheté. (E) Un œuf qui se détériore avec une région blanche en croissance. (F) Un œuf qui présente une zone pigmentée foncée et contractée, peut-être en raison de l’activation parthénogénétique. (G) Les couches formées par la rupture des œufs de Xenopus laevis après la centrifugation de 12 000 x g à l’étape 2.11. H) Schémas de préparation de la chambre d’imagerie d’extraction à l’étape 2.15. (I) Une photo d’une chambre d’imagerie préparée avec un extrait d’œuf à l’intérieur. (C) et (D) partagent la même barre d’échelle au bas de (D). (E) et (F) partagent la même barre d’échelle au bas de (F). Les barres d’échelle en (B) (C) (D) (E) (F) et (I) sont approximatives. Veuillez cliquer ici pour voir une version agrandie de cette figure.
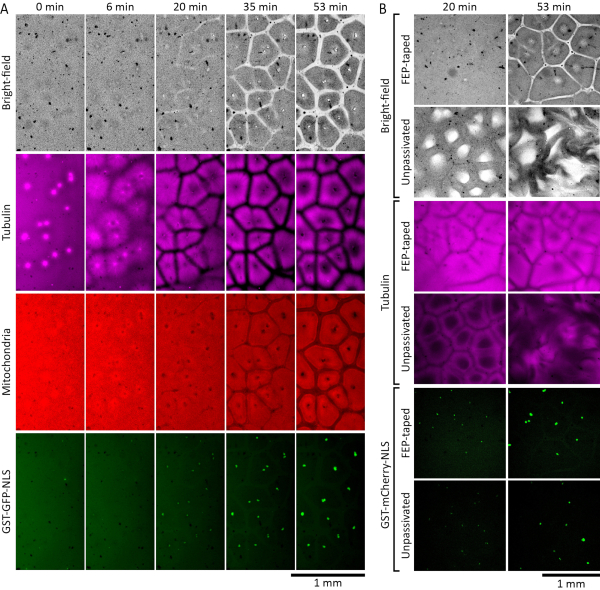
Figure 2 : Les extraits d’œufs arrêtés par interphase s’auto-organisent en compartiments ressemblant à des cellules. (A)Montage accéléré de la formation de motifs auto-organisés dans une couche mince (120 μm) d’extrait d’œuf de Xenopus laevis arrêté par interphase. L’extrait a été complété par 27 noyaux / μL de noyaux de spermatozoïdes de Xenopus laevis pour permettre la reconstitution des noyaux d’interphase. Les microtubules ont été visualisés par la tubuline marquée HiLyte 647 (en magenta), les mitochondries par MitoTracker Red CMXRos (en rouge) et les noyaux par GST-GFP-NLS (en vert). (B) Formation de motifs auto-organisés dans des extraits d’œufs de Xenopus laevis arrêtés par interphase placés dans des chambres avec et sans surfaces de verre recouvertes de ruban FEP. Les extraits ont été complétés par 27 noyaux/μL de noyaux de spermatozoïdes de Xenopus laevis pour permettre la reconstitution des noyaux d’interphase. Les microtubules ont été visualisés par la tubuline marquée HiLyte 488 (en magenta) et les noyaux par GST-mCherry-NLS (en vert). Veuillez cliquer ici pour voir une version agrandie de cette figure.
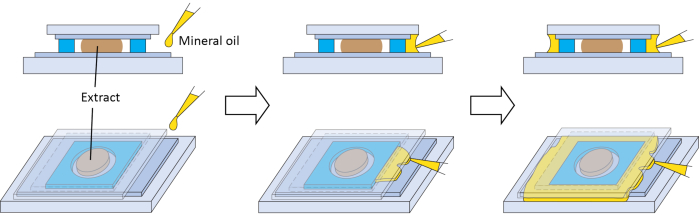
Figure 3 : Joint secondaire optionnel pour la chambre d’imagerie. Schémas pour la préparation d’un joint secondaire facultatif avec de l’huile minérale afin d’empêcher l’extrait d’un contact prolongé avec l’air. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les extraits d’œufs de Xenopus laevis sont apparus comme un puissant système modèle pour les études basées sur l’imagerie de diverses structures subcellulaires 10,14,15,16,17,18,21,31,32,33,34,35,36 et l’organisation cytoplasmique dans son ensemble. échelle cellulaire9. Nous avons décrit ici une méthode d’imagerie en direct adaptée à la visualisation de l’organisation cytoplasmique dynamique en 2D. L’efficacité de la méthode est démontrée par des résultats représentatifs.
Plusieurs étapes sont essentielles au succès de la méthode. La qualité des œufs est importante pour les extraits, c’est pourquoi les étapes 2.3 et 2.7 sont essentielles. D’après notre expérience, l’hémisphère animal des œufs de haute qualité a une pigmentation uniforme, un point blanc distinct au centre (indiquant la dégradation des vésicules germinales, GVBD) et une bordure claire avec l’hémisphère végétal (Figure 1C). Les extraits fabriqués à partir d’œufs de haute qualité ont de meilleures performances dans nos conditions d’imagerie. Si plus de 5 % des œufs ont un pigment tacheté (figure 1D), une zone pigmentée foncée et contractée (figure 1F), ressemblent à des boules gonflées blanches (figure 1B), apparaissent dans une ficelle (figure 1B) ou montrent des signes de détérioration après les lavages aux étapes 2.6 et 2.7 (figure 1E), alors tout le lot d’œufs doit être jeté. Les extraits conservent une activité biologique remarquable car il s’agit essentiellement de cytoplasme non dilué. Par conséquent, l’étape qui vise à minimiser la dilution de l’extrait (étape 2.9) est importante pour le succès de l’expérience. Pour l’imagerie, les extraits sont manipulés en très petits volumes et s’évaporent rapidement en cas de contact prolongé avec l’air. Cela affectera négativement leur activité. Par conséquent, à l’étape 2.15, après le dépôt de l’extrait, il doit être scellé dès que possible avec le côté recouvert de ruban adhésif FEP de la lamelle de couverture. L’étanchéité peut être confirmée visuellement par le changement de texture au site de contact entre l’adhésif sur l’entretoise et la lamelle de couverture. L’entretoise devrait pouvoir créer un joint complet si elle est appliquée correctement. Cependant, si un joint supplémentaire est souhaité, de l’huile minérale peut être distribuée entre le porte-à-faux de la lamelle de couverture et la lame de verre. L’huile peut former un joint supplémentaire autour de l’entretoise par capillarité (Figure 3). La passivation des surfaces vitreuses peut réduire l’adsorption non spécifique des molécules, et elle est importante pour les asters de microtubules interphasiques dans les extraits21,37. L’application de ruban FEP sur une surface vitrée décrite ici semble offrir des avantages similaires, comme le suggère l’assemblage d’asters de microtubules interphasiques normaux (figure 2, 6 min). Par conséquent, l’étape 1.1 est également critique.
Nous avons démontré l’application d’une méthode d’imagerie utilisant des extraits d’œufs arrêtés par interphase suivant le protocole de Deming et Kornbluth19. Par défaut, le protocole complète les extraits avec l’inhibiteur de polymérisation de l’actine cytochalasine B pour empêcher la gélification-contraction dans les extraits après incubation prolongée à température ambiante26. Pour permettre la polymérisation de l’actine et observer la dynamique de l’actine, on peut laisser de côté la cytochalasine B à l’étape 2.10 du protocole9. Une modification que nous avons apportée au protocole de Deming et Kornbluth est que nous ne complétons pas les extraits avec un mix énergétique pour régénérer l’ATP19. En effet, dans nos mains, dans les extraits complétés par ce mélange régénérant l’ATP19 et les noyaux de spermatozoïdes, les microtubules forment parfois un réseau réticulé qui interfère avec la formation du motif cytoplasmique. Par conséquent, le protocole n’inclut pas l’étape qui ajoute le mix énergétique aux extraits19.
Le protocole d’extraction interphase repose sur le broyage des œufs dans un tampon exempt d’EGTA pour les libérer de l’arrêt méiotique (arrêt du LCR)37. Les extraits passent ensuite en interphase, et sont maintenus en interphase par cycloheximide. Il existe d’autres méthodes établies pour préparer des extraits interphases. Certaines méthodes préparent d’abord des extraits qui maintiennent l’arrêt méiotique en écrasant les œufs dans un tampon de lyse avec EGTA38, puis libèrent l’arrêt en ajoutant du calcium, conduisant l’extrait dans l’interphase 21,37,39. Les extraits peuvent ensuite être maintenus en interphase par addition d’inhibiteurs de la synthèse des protéines tels que le cycloheximide37,39. D’autres méthodes activent parthénogénétiquement les œufs avec un ionophore de calcium (A23187) ou un choc électrique pour les libérer de l’arrêt méiotique, avant d’écraser les œufs en l’absence d’EGTA20,28 (examiné dans Field et al.37). Ces extraits peuvent entrer en interphase, mais n’y resteront généralement pas car ils sont capables de subir plusieurs cycles cellulaires. De même, des méthodes bien établies optimisées pour la préparation d’extraits avec un cytosquelette d’actine intact ont été développées 10,37,39. La méthode d’imagerie peut convenir à ces types d’extraits, mais nous ne l’avons pas testée avec eux.
Aux fins de l’imagerie de l’organisation interne du cytoplasme, le système d’imagerie présenté ici est relativement facile à mettre en place, ne nécessitant que l’application d’un ruban FEP sur des surfaces vitrées. Il permet l’assemblage de structures cytosquelettiques dans des extraits9 rapportés dans des systèmes d’imagerie plus sophistiqués où les surfaces vitrées sont passivées avec un traitement au poly-L-lysine-g-polyéthylène glycol (PLL-g-PEG) ou recouvertes de bicouches lipidiques supportées10,21. La méthode permet à la couche d’extrait de se former avec une épaisseur définie (déterminée par la profondeur de l’espaceur, qui est de 120 μm pour le système représenté sur les figures 1A, 1H, 1I et 2). Nous pouvons ajuster l’épaisseur en empilant des entretoises supplémentaires. Nous avons empilé jusqu’à 6 entretoises de ce type (720 μm d’épaisseur) et les compartiments se sont formés normalement. Cette flexibilité permet des applications futures telles que l’imagerie des extraits en 3D à l’aide de la microscopie confocale ou à feuille de lumière.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions J. Kamenz, Y. Chen et W. Y. C. Huang pour leurs commentaires sur le manuscrit. Ce travail a été soutenu par des subventions des National Institutes of Health (R01 GM110564, P50 GM107615 et R35 GM131792) accordées à James E. Ferrell, Jr.
matériels
| Name | Company | Catalog Number | Comments |
| 17 ml centrifuge tube | Beckman Coulter | 337986 | |
| 22x22 mm square #1 cover glass | Corning | 284522 | |
| Aprotinin | MilliporeSigma | 10236624001 | Protease inhibitor |
| Cycloheximide | MilliporeSigma | 01810 | Protein synthesis inhibitor |
| Cytochalasin B | MilliporeSigma | C6762 | Actin polymerization inhibitor |
| Female Xenopus laevis frogs | Nasco | LM00535MX | |
| Fluorescent HiLyte 488 labeled tubulin protein | Cytoskeleton, Inc. | TL488M-A | For visualizing the microtubule cytoskeleton |
| Fluorescent HiLyte 647 labeled tubulin protein | Cytoskeleton, Inc. | TL670M-A | For visualizing the microtubule cytoskeleton |
| Fluorinated ethylene propylene (FEP) optically clear tape | CS Hyde company | 23-FEP-2-5 | |
| Glass Pasteur pipette | Fisher Scientific | 13-678-20C | |
| Human chorionic gonadotropin (hCG) | MilliporeSigma | CG10 | |
| Imaging spacer | Electron Microscopy Sciences | 70327-8S | |
| Leupeptin | MilliporeSigma | 11017101001 | Protease inhibitor |
| Microscope slides | Fisher Scientific | 12-518-100B | |
| Mineral oil | MilliporeSigma | 330760 | |
| MitoTracker Red CMXRos | Thermo Fisher Scientific | M7512 | For visualizing mitochondria |
| Pregnant mare serum gonadotropin (PMSG) | BioVendor | RP1782725000 | |
| Roller applicator | Amazon | B07HMBJSP8 | For applying the FEP tape to the glass slides and coverslips |
| Single-edged razor blades | Fisher Scientific | 12-640 | For removing excessive FEP tape |
| Transfer pipette | Fisher Scientific | 13-711-7M |
Références
- Murray, A. W., Kirschner, M. W. Cyclin synthesis drives the early embryonic cell cycle. Nature. 339 (6222), 275-280 (1989).
- Dunphy, W. G., Brizuela, L., Beach, D., Newport, J. The Xenopus cdc2 protein is a component of MPF, a cytoplasmic regulator of mitosis. Cell. 54 (3), 423-431 (1988).
- Minshull, J., Golsteyn, R., Hill, C. S., Hunt, T. The A- and B-type cyclin associated cdc2 kinases in Xenopus turn on and off at different times in the cell cycle. EMBO J. 9 (9), 2865-2875 (1990).
- Wu, J. Q., et al. PP1-mediated dephosphorylation of phosphoproteins at mitotic exit is controlled by inhibitor-1 and PP1 phosphorylation. Nature Cell Biology. 11 (5), 644-651 (2009).
- Pomerening, J. R., Sontag, E. D., Ferrell, J. E. Building a cell cycle oscillator: hysteresis and bistability in the activation of Cdc2. Nature Cell Biology. 5 (4), 346-351 (2003).
- Mochida, S., Maslen, S. L., Skehel, M., Hunt, T. Greatwall phosphorylates an inhibitor of protein phosphatase 2A that is essential for mitosis. Science. 330 (6011), 1670-1673 (2010).
- Blow, J. J., Laskey, R. A. Initiation of DNA replication in nuclei and purified DNA by a cell-free extract of Xenopus eggs. Cell. 47 (4), 577-587 (1986).
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cheng, X., Ferrell, J. E. Spontaneous emergence of cell-like organization in Xenopus egg extracts. Science. 366 (6465), 631-637 (2019).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Good, M. C., Vahey, M. D., Skandarajah, A., Fletcher, D. A., Heald, R. Cytoplasmic volume modulates spindle size during embryogenesis. Science. 342 (6160), 856-860 (2013).
- Hazel, J., et al. Changes in cytoplasmic volume are sufficient to drive spindle scaling. Science. 342 (6160), 853-856 (2013).
- Brownlee, C., Heald, R. Importin alpha Partitioning to the Plasma Membrane Regulates Intracellular Scaling. Cell. 176 (4), 805-815 (2019).
- Nguyen, P. A., Field, C. M., Mitchison, T. J. Prc1E and Kif4A control microtubule organization within and between large Xenopus egg asters. Molecular Biology of the Cell. 29 (3), 304-316 (2018).
- Desai, A., Maddox, P. S., Mitchison, T. J., Salmon, E. D. Anaphase A chromosome movement and poleward spindle microtubule flux occur At similar rates in Xenopus extract spindles. Journal of Cell Biology. 141 (3), 703-713 (1998).
- Mitchison, T. J., et al. Roles of polymerization dynamics, opposed motors, and a tensile element in governing the length of Xenopus extract meiotic spindles. Molecular Biology of the Cell. 16 (6), 3064-3076 (2005).
- Mitchison, T. J., et al. Bipolarization and poleward flux correlate during Xenopus extract spindle assembly. Molecular Biology of the Cell. 15 (12), 5603-5615 (2004).
- Murray, A. W., Desai, A. B., Salmon, E. D. Real time observation of anaphase in vitro. Proceedings of the National Academy of Sciences of the United States of America. 93 (22), 12327-12332 (1996).
- Deming, P., Kornbluth, S. Study of apoptosis in vitro using the Xenopus egg extract reconstitution system. Methods in Molecular Biology. 322, 379-393 (2006).
- Murray, A. W. Cell cycle extracts. Methods in Cell Biology. 36, 581-605 (1991).
- Field, C. M., Mitchison, T. J. Assembly of Spindles and Asters in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Guan, Y., et al. A robust and tunable mitotic oscillator in artificial cells. Elife. 7, (2018).
- Guan, Y., Wang, S., Jin, M., Xu, H., Yang, Q. Reconstitution of Cell-cycle Oscillations in Microemulsions of Cell-free Xenopus Egg Extracts. Journal of Visualized Experiments. (139), e58240 (2018).
- Oakey, J., Gatlin, J. C. Microfluidic Encapsulation of Demembranated Sperm Nuclei in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Smythe, C., Newport, J. W. Systems for the study of nuclear assembly, DNA replication, and nuclear breakdown in Xenopus laevis egg extracts. Methods in Cell Biology. 35, 449-468 (1991).
- Field, C. M., et al. Actin behavior in bulk cytoplasm is cell cycle regulated in early vertebrate embryos. Journal of Cell Science. 124, 2086-2095 (2011).
- Chang, J. B., Ferrell, J. E. Mitotic trigger waves and the spatial coordination of the Xenopus cell cycle. Nature. 500 (7464), 603-607 (2013).
- Chang, J. B., Ferrell, J. E. Robustly Cycling Xenopus laevis Cell-Free Extracts in Teflon Chambers. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Chatterjee, S., Javier, M., Stochaj, U. In vivo analysis of nuclear protein traffic in mammalian cells. Experimental Cell Research. 236 (1), 346-350 (1997).
- Mochida, S., Hunt, T. Calcineurin is required to release Xenopus egg extracts from meiotic M phase. Nature. 449 (7160), 336-340 (2007).
- Heald, R., et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature. 382 (6590), 420-425 (1996).
- Helmke, K. J., Heald, R. TPX2 levels modulate meiotic spindle size and architecture in Xenopus egg extracts. Journal of Cell Biology. 206 (3), 385-393 (2014).
- Sawin, K. E., Mitchison, T. J. Mitotic spindle assembly by two different pathways in vitro. Journal of Cell Biology. 112 (5), 925-940 (1991).
- Belmont, L. D., Hyman, A. A., Sawin, K. E., Mitchison, T. J. Real-time visualization of cell cycle-dependent changes in microtubule dynamics in cytoplasmic extracts. Cell. 62 (3), 579-589 (1990).
- Krauss, S. W., Lee, G., Chasis, J. A., Mohandas, N., Heald, R. Two protein 4.1 domains essential for mitotic spindle and aster microtubule dynamics and organization in vitro. Journal of Biological Chemistry. 279 (26), 27591-27598 (2004).
- Wang, S., Romano, F. B., Field, C. M., Mitchison, T. J., Rapoport, T. A. Multiple mechanisms determine ER network morphology during the cell cycle in Xenopus egg extracts. Journal of Cell Biology. 203 (5), 801-814 (2013).
- Field, C. M., Nguyen, P. A., Ishihara, K., Groen, A. C., Mitchison, T. J. Xenopus egg cytoplasm with intact actin. Methods in Enzymology. 540, 399-415 (2014).
- Good, M. C., Heald, R. Preparation of Cellular Extracts from Xenopus Eggs and Embryos. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Field, C. M., Pelletier, J. F., Mitchison, T. J. Xenopus extract approaches to studying microtubule organization and signaling in cytokinesis. Methods in Cell Biology. 137, 395-435 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon