Method Article
アフリカツメガエル 動的細胞質組織を可視化するための卵抽出物調製およびライブイメージング法
要約
アフリカツメガエル卵からの希釈されていない細胞質抽出物の調製およびライブイメージングの方法を記載する。
要約
伝統的にバルク生化学的アッセイに使用されてきた アフリカツメガエル 卵抽出物は、細胞質分裂、有糸分裂紡錘体形成、核の組み立てなどの細胞質現象を研究するための強力なイメージングベースのツールとして登場しています。まばらな時点でサンプリングされた固定抽出物を画像化する初期の方法に基づいて構築され、最近のアプローチは、タイムラプス顕微鏡を使用してライブ抽出を画像化し、時間分解能を高めてより動的な特徴を明らかにします。これらの方法は、通常、イメージング容器の高度な表面処理を必要とする。ここでは、化学的表面処理を必要としない卵抽出物のライブイメージングの代替方法を紹介します。実装が簡単で、大量生産された実験用消耗品をイメージングに利用します。広視野顕微鏡と共焦点顕微鏡の両方に使用できるシステムについて説明します。2次元(2D)フィールドでの抽出物のイメージング用に設計されていますが、3Dでのイメージングに簡単に拡張できます。細胞質内の空間パターン形成の研究に適しています。代表的なデータを使用して、この方法を使用して調製された間期抽出物における微小管、核、ミトコンドリアの典型的な動的組織を示します。これらの画像データは、細胞質動態や空間構成に関する定量的な情報を提供することができます。
概要
細胞質は細胞の主要な体積を構成し、明確な組織を持っています。真核生物の細胞質の成分は、微小管アスターやゴルジ体装置などの幅広い空間構造に自己組織化することができ、細胞の同一性や生理状態に応じて動的に配置され、ひっくり返されます。したがって、細胞質の空間構成と細胞機能へのリンクを理解することは、細胞がどのように機能するかを理解するために重要です。アフリカツメガエル卵抽出物は、伝統的にバルク生化学的アッセイに使用されてきました1,2,3,4,5,6,7,8、しかし最近の研究は、細胞質構造とその細胞機能の機構研究のための強力なライブイメージングシステムとして確立されています9,10,11、 12,13,14,15,16,17,18。これらの希釈されていない抽出物は、細胞質の多くの構造と機能を保存する一方で、従来の細胞ベースのモデルでは達成できなかった細胞質内容物の直接操作を可能にします19,20。これにより、細胞質現象を特徴付け、その機構的基盤を解剖するのに理想的です。
抽出物をイメージングするための既存の方法は、化学的表面修飾、またはマイクロ流体デバイスの製造を必要とします。カバーガラスベースの方法の1つは、ガラスカバーガラス21のポリエチレングリコール(PEG)パッシベーションを必要とする。マイクロエマルジョンベースの方法では、ガラス表面22,23へのトリクロロ(1H,1H,2H,2H-パーフルオロオクチル)シランの蒸着が必要です。マイクロ流体ベースのシステムは、抽出液滴の量、形状および組成の正確な制御を可能にするが、特殊な微細加工設備を必要とする11、12、24。
ここでは、実施が容易で、容易に入手可能で低コストの材料を利用する卵抽出物のイメージングの代替方法を紹介します。これには、スライドとフッ素化エチレンプロピレン(FEP)テープでコーティングされたカバーガラスを備えたイメージングチャンバーの準備が含まれます。このチャンバーは、ステレオスコープや正立顕微鏡、倒立顕微鏡など、さまざまな顕微鏡システムで抽出物をイメージングするために使用できます。この方法は、表面の化学的処理を必要とせず、上記の既存のガラスベースの方法で得られるのと同様の光学的透明度を達成します。これは、2Dフィールド全体で均一な厚さの抽出物の層を画像化するように設計されており、3Dボリュームの抽出物を画像化するために簡単に拡張できます。広い視野にわたる集団細胞質挙動のタイムラプスイメージングに適しています。
我々は、イメージング方法を実証するために、間期停止卵抽出物を使用しました。抽出物の調製は、デミングおよびコーンブルース19のプロトコルに従います。簡単に言えば、減数分裂IIの中期に自然に停止した卵は、低速スピンによって押しつぶされます。このスピンは細胞質を減数分裂停止から解放し、抽出物が間期に進むことを可能にします。通常、サイトカラシンBは、F-アクチン形成を阻害するために、破砕スピンの前に添加される。但し、F-アクチンを希望する場合は省略することができる。シクロヘキシミドは、間期抽出物が次の有糸分裂に入るのを防ぐために、粉砕スピンの前にも添加されます。続いて、抽出物を前述のイメージングチャンバーに入れ、顕微鏡上に配置します。最後に、顕微鏡に接続されたカメラによって定義された間隔で画像が経時的に記録され、2Dフィールドでの抽出物の動的挙動をキャプチャするタイムラプス画像シリーズが生成されます。
プロトコル
ここに記載されているすべての方法は、スタンフォード大学の施設動物管理および使用委員会(IACUC)によって承認されています。
1.スライドとカバーガラスの準備
- フッ素化エチレンプロピレン(FEP)粘着テープの層をローラーアプリケーターでスライドガラスに貼り付けます。きれいなかみそりの刃で端の余分なテープを切り取ります。同じ方法でFEPテープでコーティングされたカバーガラスを準備します(図1A)。
- 両面スティッキーイメージングスペーサーをスライドのFEPテープコーティング面に塗布します。上部の保護ライナーは剥がさずに残しておきます(図1A)。
注意: スライドとカバーガラスは実験の前に準備する必要があります。すぐに使用することも、表面にほこりがたまるのを防ぐために箱に保管することもできます。イメージングスペーサー内のウェルは深さ120μm、直径9mmです。
2. 間期停止卵抽出物の調製とライブイメージング
注:次のプロトコルは、デミングとコーンブルース19、マレー20、スマイスとニューポート25 から修正を加えて適応されています。すべてのステップは、特に明記されていない限り、室温で実行する必要があります。
- 採卵の3〜10日前に、成熟した 雌のアフリカツメガエルを 100IUの妊娠中の牝馬血清ゴナドトロピン(PMSG)とともに背側リンパ嚢に皮下注射します。
- 計画された採卵の16〜18時間前に、ステップ2.1のカエルに500IUのヒト絨毛性ゴナドトロピン(hCG)を注射します。産卵バッファー(100 mM NaCl、2 mM KCl、1 mM MgSO 4·7H 2 O、2.5 mM CaCl2·2H2O、0.5 mM HEPES、0.1 mM EDTA)にカエルを18°Cで放置し、pH7.4で20倍ストック溶液として調製し、使用前にきれいなカエルタンク水で1倍に希釈してから卵を採取します。
- 実験当日、大きなガラスのペトリ皿に卵を集め、卵の品質を評価します。白いふくらんでいるボールのように見える、またはひもで現れる卵はすべて捨てます(図1B)。立体視鏡で卵を調べ、卵を通常の外観に保ち(図1C)、不規則な色素やまだらの色素を含む卵を捨てます(図1D)。
注:このプロトコルは、通常、hCG注射後16時間までに25mLの卵を産む単一のカエルから収集された卵で機能します。通常、hCGによって合計3〜6匹のカエルが誘導され、卵の品質が最も高いカエルが抽出調製実験に選ばれます。 - 卵を400 mLのガラスビーカーに移し、デカンテーションによってできるだけ多くの産卵バッファーを取り除きます。
- 卵を100 mLの新しく調製したデゼリー溶液(水中で2%w / v L-システイン、NaOHでpH 8.0に調整)でインキュベートし、定期的に穏やかに回転させます。約3分後、溶液を注ぎ、100 mLの新鮮なデゼリー溶液を加えます。卵がしっかりと詰まるまで(卵の間にスペースがなくなるまで)孵卵を続けますが、合計5分以上卵を脱ゼリー溶液に残さないでください。
- デカンテーションによりできるだけ多くの脱ゼリー溶液を除去し、0.25x MMRバッファー(25 mM NaCl、0.5 mM KCl、0.25 mM MgCl2、0.5 mM CaCl2、0.025 mM EDTA、1.25 mM HEPES、10xストック溶液として調製し、NaOHでpH 7.8に調整し、使用前にMilli-Q水で希釈)で卵を洗浄します。 卵を渦巻いてから、バッファーを注ぎます。合計1 Lのバッファーが洗浄に使用されるまで、数回繰り返します。
- 合計400 mLの卵溶解バッファー(250 mMスクロース、10 mM HEPES、50 mM KCl、2.5 mM MgCl2、1 mM DTT、新鮮にし、KOHでpH 7.7に調整)で卵を数回洗浄します。洗浄の合間にパスツールピペットを使用して異常な外観の卵を取り除きます。
注:異常な外観の卵とは、白いふくらんでいるボールのように見える卵(図1B)、まだらの色素沈着(図1D)、白い領域の成長とともに悪化している卵(図1E)、または動物半球の黒ずみと収縮した色素沈着領域を示す卵を指します(図1F)。 - 先端を大きく開いたトランスファーピペットを使用して、卵溶解バッファー17 mLが入った1 mLの丸底遠心チューブに卵を移します。チューブを400 x g の臨床遠心分離機で15秒間回転させて、卵を詰めます。
- パスツールピペットを使用して、パックされた卵の上部からできるだけ多くの卵溶解バッファーを取り除きます。
注:卵抽出物の希釈を最小限に抑えるために、パックされた卵からできるだけ多くのバッファーを除去することが重要です。これを達成するために、残留緩衝液と一緒にいくつかの緩い卵を取り除く必要がある場合があります。 - パックされた卵のおおよその容量を決定し、5 μg / mLのアプロチニン、5 μg / mLのロイペプチン、5 μg / mLのサイトカラシンB、および50 μg / mLのシクロヘキシミドをパックされた卵の上に直接加えます。
注:アプロチニンとロイペプチンはプロテアーゼ阻害剤です。サイトカラシンBはアクチン重合を阻害し、抽出物が収縮およびゲル化するのを防ぐ26。シクロヘキシミドはタンパク質合成を阻害し、それによって抽出物を細胞周期の間期に保ちます。 - チューブを12,000 x g、4°Cで15分間、スイングバケットローターで遠心分離して卵を粉砕します。
注:遠心分離の終わりに、卵は破裂し、溶解物は3つの主要な層に分離しているはずです:上部の黄色の脂質層、中央の細胞質抽出物(粗抽出物とも呼ばれます)、および下部の色素顆粒を含む暗く濃い層(図1G)。 - 18ゲージの針を注射器に取り付けます。針先ベベルを上に向けて、細胞質層の下部にある側からチューブを穿刺し、ゆっくりと描画して抽出物を回収します。
注:黄色の脂質層からの汚染含有量が含まれないように、細胞質抽出物をゆっくりと描画します。 - 回収した細胞質抽出物を新しいマイクロ遠心チューブに移し、氷上に保持します。1時間以内に抽出物を使用してください。
- イメージングの準備ができたら、抽出液に目的の試薬と蛍光イメージングプローブを補充します。
注:蛍光イメージングプローブは、特定の細胞質構造を標識して、蛍光顕微鏡で視覚化できるようにします。 - ステップ1.2で準備したスライドのイメージングスペーサーから上部保護ライナーを取り外し、ウェルの中央に約7 μLの抽出物を堆積させます。FEP側を抽出物に向けてFEPテープでコーティングされたカバーガラスをすぐに適用し、ウェルを密封します。すぐにイメージングに進みます(図1H、I)。
- 電動ステージとデジタルカメラを備えた倒立顕微鏡または正立顕微鏡にスライドをセットします。明視野チャンネルと蛍光チャンネルの両方で、目的の空間位置と時間間隔で抽出液を画像化します。
注:通常、5倍の対物レンズがイメージングに使用されます。電動ステージにより、複数の定義された空間位置での自動画像取得が可能です。明視野顕微鏡は、さまざまな透明度で細胞質構造を視覚化します。蛍光顕微鏡は、ステップ2.14で追加した蛍光イメージングプローブによって特異的に標識された細胞質構造を視覚化します。カメラはこれらの構造のタイムラプス画像を記録し、それによって細胞質組織のダイナミクスをキャプチャします。
結果
アフリカツメガエル卵抽出物は、間期中の細胞質の自己組織化を研究するために使用することができる。図2Aは、成功した実験の結果を示しています。間期間核の再構成と可視化を可能にするために、アフリカツメガエル精子核19を27核/μLの濃度で、0.38 μMの精製GST-GFP-NLS 27,28,29,30(グルタチオン-S-トランスフェラーゼ、緑色蛍光タンパク質、および核局在配列からなる融合タンパク質)を添加しました。また、微小管を可視化するために1 μM蛍光標識チューブリンを、ミトコンドリアを可視化するために500 nM MitoTracker Red CMXRosを追加しました。抽出物をイメージングチャンバーに入れた直後、細胞質は無秩序に見えました。室温で次の30分の間に、細胞質は細胞様コンパートメントに自己組織化し始めました。微小管アスターは、精子核とともに導入された中心体から成長し、隣接するアスターからの微小管と出会うと微小管枯渇境界帯を形成した。GST-GFP-NLSタンパク質は、追加された膜状の精子核から自己組織化された丸い間期核に転座した。光散乱細胞質成分が枯渇した領域は、明視野チャネルとミトコンドリアチャネルの両方で見られました(図2A、20分および35分)。ミトコンドリアはまた、微小管によって確立された境界から枯渇し、微小管コンパートメントと整列した孤立したコンパートメントで濃縮されました。室温で60分までに、微小管が中空の花輪のような構造を形成し、ミトコンドリアが各区画に明確に分割され、細胞状の区画からなる空間パターンが十分に確立されるはずです(図2A、53分)。
図2Bは、ガラス上のFEPテープの有無にかかわらず、イメージングチャンバーでの抽出性能を比較しています。間期間核の再構成と可視化を可能にするために、27核/μLおよび0.35 μM GST-mCherry-NLS27,28,29,30(グルタチオン-S-トランスフェラーゼ、mCherry蛍光タンパク質、および核局在配列からなる融合タンパク質)の濃度で、アフリカツメガエル精子核19を間期停止抽出物に添加しました。また、微小管を可視化するために、蛍光標識したチューブリンを1 μM添加しました。ダイナミクスの違いは、室温で約20分で明らかになりました。FEPテープガラスで作製したチャンバー内では、抽出物は正常な細胞様パターンに自己組織化しました(図2B、行1および3の画像)。しかし、ガラス表面がFEPテープで覆われていない(不動態化されていない)チャンバーでは、抽出物は異常な明視野および微小管パターンを示し、時間の経過とともにますます破壊されました(図2B、行2および4の画像)。GST-mCherry-NLSタンパク質の核内輸入に有意差は認められませんでした(図2B、行5および6の画像)。

図1:実験手順に関連する概略図と写真。 (A)FEPテープコーティングガラスカバーガラスカバーガラスおよびスライドを準備するための概略図。(B)産卵バッファーに沈着したアフリカツメガエルの卵、および低品質の卵の例を矢印で示した。黄色の矢印、白いふくらんでいるボールのように見える卵の例。赤い矢印、ひもに現れる卵の例。(C)通常の外観を持つアフリカツメガエルの卵の例。(D)不規則またはまだらの色素を含む質の悪い卵の例。(E)白い領域が成長している劣化した卵。(F)おそらく単為生殖の活性化により、色素沈着領域が暗くなり収縮した卵。(G)ステップ2.11で12,000 x gの遠心分離後に破裂したアフリカツメガエルの卵によって形成された層。(h)工程2.15で抽出液イメージングチャンバーを調製するための概略図。(i)卵抽出液を入れた画像チャンバーを作製した写真。(C)と(D)は、(D)の下部にある同じスケールバーを共有しています。(E)と(F)は、(F)の下部にある同じスケールバーを共有します。(B)(C)(D)(E)(F)および(I)のスケールバーは近似値です。この図の拡大版を表示するには、ここをクリックしてください。
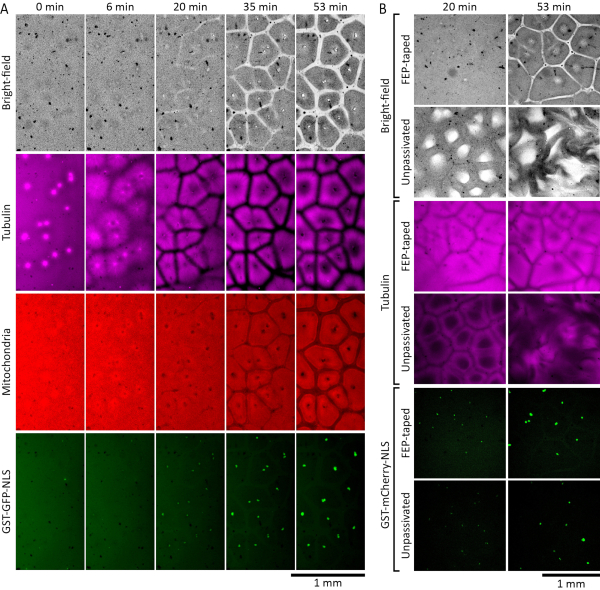
図2:間期停止卵抽出物は、細胞様コンパートメントに自己組織化 します。 (A)間期停止した アフリカツメガエル 卵抽出物の薄層(120μm)における自己組織化パターン形成のタイムラプスモンタージュ。抽出物には、間期核の再構成を可能にするために、27核/μLの膜状 アフリカツメガ エル精子核が補充されました。微小管はHiLyte 647標識チューブリン(マゼンタで表示)、ミトコンドリアはMitoTracker Red CMXRos(赤で表示)、核はGST-GFP-NLS(緑で表示)で視覚化されました。(B)FEPテープで覆われたガラス表面の有無にかかわらずチャンバーに配置された間期停止アフリカ ツメガエル 卵抽出物の自己組織化パターン形成。抽出物には、間期核の再構成を可能にするために、27核/μLの膜状 アフリカツメガ エル精子核が補充されました。微小管はHiLyte 488標識チューブリン(マゼンタで表示)によって、核はGST-mCherry-NLS(緑色で表示)によって視覚化されました。 この図の拡大版を表示するには、ここをクリックしてください。
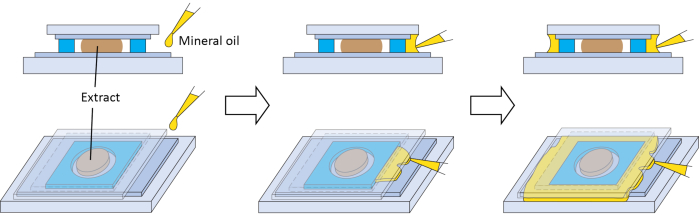
図3:イメージングチャンバーのオプションの二次シール。 抽出物が空気と長時間接触するのを防ぐために、鉱油でオプションの二次シールを調製するための回路図。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
アフリカツメガエル卵抽出物は、さまざまな細胞内構造10、14、15、16、17、18、21、31、32、33、34、35、36および細胞質組織全体のイメージングベースの研究のための強力なモデルシステムとして浮上しています。セルスケール9。ここでは、動的細胞質組織を2Dで可視化するのに適したライブイメージング法について述べました。この方法の有効性は代表的な結果によって実証されています。
メソッドの成功には、いくつかのステップが重要です。卵の品質は抽出物にとって重要であるため、ステップ2.3と2.7が重要です。私たちの経験では、高品質の卵の動物半球には、均一な色素沈着、中央に明確な白い点(胚小胞の破壊、GVBDを示す)、および植物半球との明確な境界があります(図1C)。高品質の卵から作られた抽出物は、私たちのイメージング条件下でより良い性能を発揮します。卵の5%以上がまだらの色素を持っている場合(図1D)、色素沈着領域が暗く収縮している場合(図1F)、白いふくらんでいるボールのように見える場合(図1B)、ひも状に現れる場合(図1B)、またはステップ2.6および2.7の洗浄後に劣化の兆候を示している場合(図1E)、卵のバッチ全体を廃棄する必要があります。抽出物は本質的に希釈されていない細胞質であるため、顕著な生物学的活性を保持します。したがって、抽出物の希釈を最小限に抑えることを目的としたステップ(ステップ2.9)は、実験の成功にとって重要です。イメージングの場合、抽出物は非常に少量で処理され、空気と長時間接触するとすぐに蒸発します。これは彼らの活動に悪影響を及ぼすでしょう。したがって、ステップ2.15では、抽出物が堆積した後、できるだけ早くカバーガラスのFEPテープコーティング面で密封する必要があります。シーリングは、スペーサー上の接着剤とカバーガラスとの接触部位における質感変化によって視覚的に確認することができる。スペーサーは、適切に適用されれば完全なシールを作成できるはずです。ただし、追加のシールが必要な場合は、カバーガラスの張り出しとスライドガラスの間に鉱油を分配できます。オイルは、毛細管現象によってスペーサーの周りに追加のシールを形成することができます(図3)。ガラス表面の不動態化は、分子の非特異的吸着を低減することができ、抽出物中の間相微小管アスターにとって重要である21,37。ここで説明するガラス表面にFEPテープを貼ることは、正常な間期微小管アスターの組み立てによって示唆されるように、同様の利点を提供するようです(図2、6分)。したがって、ステップ1.1も重要です。
我々は、デミングとコーンブルース19のプロトコルに従って、間期停止卵抽出物を用いたイメージング法の適用を実証した。デフォルトでは、プロトコルは、室温で長時間インキュベートした後の抽出物のゲル化収縮を防ぐために、アクチン重合阻害剤サイトカラシンBを抽出物に補充します26。アクチン重合を可能にし、アクチン動態を観察するために、プロトコル9のステップ2.10でサイトカラシンBを除外することができます。デミングとコーンブルースのプロトコルに加えた変更は、ATP19を再生するためのエネルギーミックスで抽出物を補わないことです。これは、私たちの手の中で、このATP再生ミックス19 と精子核を添加した抽出物では、微小管が細胞質パターン形成を妨げる架橋格子を形成することがあるためです。したがって、プロトコルは、抽出物19にエネルギーミックスを追加するステップを含まない。
間期抽出物プロトコルは、EGTAフリーバッファーで卵を破砕して減数分裂停止(CSF停止)から解放することに依存しています37。その後、抽出物は間相に進行し、シクロヘキシミドによって間相に保たれます。間期抽出物を調製するための他の確立された方法があります。いくつかの方法は、最初にEGTA38を含む溶解バッファーで卵を粉砕することによって減数分裂停止を維持する抽出物を調製し、次にカルシウムを添加することによって停止を解放し、抽出物を間期21、37、39に追いやる。抽出物は、続いてシクロヘキシミド37,39などのタンパク質合成阻害剤を添加することによって間期に保持することができる。他の方法は、EGTA20,28の非存在下で卵を粉砕する前に、カルシウムイオノフォア(A23187)または電気ショックで卵を単為生殖的に活性化して減数分裂停止から解放します(Field et al.37でレビュー)。これらの抽出物は間期に入ることができますが、複数の細胞周期を経ることができるため、通常はそこにとどまりません。同様に、無傷のアクチン細胞骨格を有する抽出物を調製するために最適化された十分に確立された方法が開発されている10、37、39。イメージング法はこれらのタイプの抽出物に適しているかもしれませんが、我々はそれらでそれをテストしていません。
細胞質の内部組織をイメージングする目的で、ここで紹介するイメージングシステムは比較的セットアップが簡単で、FEPテープをガラス表面に貼り付けるだけで済みます。これは、ガラス表面がポリ−L−リジン−g−ポリエチレングリコール(PLL−g−PEG)処理で不動態化されるか、または支持された脂質二重層でコーティングされるより洗練されたイメージングシステムで報告された抽出物9における細胞骨格構造の組み立てを可能にする10,21。この方法では、抽出層を定義された厚さで形成することができます(スペーサーの深さによって決定され、図1A、1H、1I、および図2に示すシステムでは120μmです)。追加のスペーサーを積み重ねることで厚さを調整できます。このようなスペーサー(厚さ720μm)を最大6つ積み重ね、コンパートメントは正常に形成されました。この柔軟性により、共焦点顕微鏡またはライトシート顕微鏡を使用した3Dでの抽出物のイメージングなどの将来のアプリケーションが可能になります。
開示事項
著者は開示するものは何もありません。
謝辞
原稿へのコメントをくださったJ. Kamenz、Y. Chen、W. Y. C. Huangに感謝します。この研究は、ジェームズE.フェレルジュニアに授与された国立衛生研究所(R01 GM110564、P50 GM107615、およびR35 GM131792)からの助成金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 17 ml centrifuge tube | Beckman Coulter | 337986 | |
| 22x22 mm square #1 cover glass | Corning | 284522 | |
| Aprotinin | MilliporeSigma | 10236624001 | Protease inhibitor |
| Cycloheximide | MilliporeSigma | 01810 | Protein synthesis inhibitor |
| Cytochalasin B | MilliporeSigma | C6762 | Actin polymerization inhibitor |
| Female Xenopus laevis frogs | Nasco | LM00535MX | |
| Fluorescent HiLyte 488 labeled tubulin protein | Cytoskeleton, Inc. | TL488M-A | For visualizing the microtubule cytoskeleton |
| Fluorescent HiLyte 647 labeled tubulin protein | Cytoskeleton, Inc. | TL670M-A | For visualizing the microtubule cytoskeleton |
| Fluorinated ethylene propylene (FEP) optically clear tape | CS Hyde company | 23-FEP-2-5 | |
| Glass Pasteur pipette | Fisher Scientific | 13-678-20C | |
| Human chorionic gonadotropin (hCG) | MilliporeSigma | CG10 | |
| Imaging spacer | Electron Microscopy Sciences | 70327-8S | |
| Leupeptin | MilliporeSigma | 11017101001 | Protease inhibitor |
| Microscope slides | Fisher Scientific | 12-518-100B | |
| Mineral oil | MilliporeSigma | 330760 | |
| MitoTracker Red CMXRos | Thermo Fisher Scientific | M7512 | For visualizing mitochondria |
| Pregnant mare serum gonadotropin (PMSG) | BioVendor | RP1782725000 | |
| Roller applicator | Amazon | B07HMBJSP8 | For applying the FEP tape to the glass slides and coverslips |
| Single-edged razor blades | Fisher Scientific | 12-640 | For removing excessive FEP tape |
| Transfer pipette | Fisher Scientific | 13-711-7M |
参考文献
- Murray, A. W., Kirschner, M. W. Cyclin synthesis drives the early embryonic cell cycle. Nature. 339 (6222), 275-280 (1989).
- Dunphy, W. G., Brizuela, L., Beach, D., Newport, J. The Xenopus cdc2 protein is a component of MPF, a cytoplasmic regulator of mitosis. Cell. 54 (3), 423-431 (1988).
- Minshull, J., Golsteyn, R., Hill, C. S., Hunt, T. The A- and B-type cyclin associated cdc2 kinases in Xenopus turn on and off at different times in the cell cycle. EMBO J. 9 (9), 2865-2875 (1990).
- Wu, J. Q., et al. PP1-mediated dephosphorylation of phosphoproteins at mitotic exit is controlled by inhibitor-1 and PP1 phosphorylation. Nature Cell Biology. 11 (5), 644-651 (2009).
- Pomerening, J. R., Sontag, E. D., Ferrell, J. E. Building a cell cycle oscillator: hysteresis and bistability in the activation of Cdc2. Nature Cell Biology. 5 (4), 346-351 (2003).
- Mochida, S., Maslen, S. L., Skehel, M., Hunt, T. Greatwall phosphorylates an inhibitor of protein phosphatase 2A that is essential for mitosis. Science. 330 (6011), 1670-1673 (2010).
- Blow, J. J., Laskey, R. A. Initiation of DNA replication in nuclei and purified DNA by a cell-free extract of Xenopus eggs. Cell. 47 (4), 577-587 (1986).
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cheng, X., Ferrell, J. E. Spontaneous emergence of cell-like organization in Xenopus egg extracts. Science. 366 (6465), 631-637 (2019).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Good, M. C., Vahey, M. D., Skandarajah, A., Fletcher, D. A., Heald, R. Cytoplasmic volume modulates spindle size during embryogenesis. Science. 342 (6160), 856-860 (2013).
- Hazel, J., et al. Changes in cytoplasmic volume are sufficient to drive spindle scaling. Science. 342 (6160), 853-856 (2013).
- Brownlee, C., Heald, R. Importin alpha Partitioning to the Plasma Membrane Regulates Intracellular Scaling. Cell. 176 (4), 805-815 (2019).
- Nguyen, P. A., Field, C. M., Mitchison, T. J. Prc1E and Kif4A control microtubule organization within and between large Xenopus egg asters. Molecular Biology of the Cell. 29 (3), 304-316 (2018).
- Desai, A., Maddox, P. S., Mitchison, T. J., Salmon, E. D. Anaphase A chromosome movement and poleward spindle microtubule flux occur At similar rates in Xenopus extract spindles. Journal of Cell Biology. 141 (3), 703-713 (1998).
- Mitchison, T. J., et al. Roles of polymerization dynamics, opposed motors, and a tensile element in governing the length of Xenopus extract meiotic spindles. Molecular Biology of the Cell. 16 (6), 3064-3076 (2005).
- Mitchison, T. J., et al. Bipolarization and poleward flux correlate during Xenopus extract spindle assembly. Molecular Biology of the Cell. 15 (12), 5603-5615 (2004).
- Murray, A. W., Desai, A. B., Salmon, E. D. Real time observation of anaphase in vitro. Proceedings of the National Academy of Sciences of the United States of America. 93 (22), 12327-12332 (1996).
- Deming, P., Kornbluth, S. Study of apoptosis in vitro using the Xenopus egg extract reconstitution system. Methods in Molecular Biology. 322, 379-393 (2006).
- Murray, A. W. Cell cycle extracts. Methods in Cell Biology. 36, 581-605 (1991).
- Field, C. M., Mitchison, T. J. Assembly of Spindles and Asters in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Guan, Y., et al. A robust and tunable mitotic oscillator in artificial cells. Elife. 7, (2018).
- Guan, Y., Wang, S., Jin, M., Xu, H., Yang, Q. Reconstitution of Cell-cycle Oscillations in Microemulsions of Cell-free Xenopus Egg Extracts. Journal of Visualized Experiments. (139), e58240(2018).
- Oakey, J., Gatlin, J. C. Microfluidic Encapsulation of Demembranated Sperm Nuclei in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Smythe, C., Newport, J. W. Systems for the study of nuclear assembly, DNA replication, and nuclear breakdown in Xenopus laevis egg extracts. Methods in Cell Biology. 35, 449-468 (1991).
- Field, C. M., et al. Actin behavior in bulk cytoplasm is cell cycle regulated in early vertebrate embryos. Journal of Cell Science. 124, Pt 12 2086-2095 (2011).
- Chang, J. B., Ferrell, J. E. Mitotic trigger waves and the spatial coordination of the Xenopus cell cycle. Nature. 500 (7464), 603-607 (2013).
- Chang, J. B., Ferrell, J. E. Robustly Cycling Xenopus laevis Cell-Free Extracts in Teflon Chambers. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Chatterjee, S., Javier, M., Stochaj, U. In vivo analysis of nuclear protein traffic in mammalian cells. Experimental Cell Research. 236 (1), 346-350 (1997).
- Mochida, S., Hunt, T. Calcineurin is required to release Xenopus egg extracts from meiotic M phase. Nature. 449 (7160), 336-340 (2007).
- Heald, R., et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature. 382 (6590), 420-425 (1996).
- Helmke, K. J., Heald, R. TPX2 levels modulate meiotic spindle size and architecture in Xenopus egg extracts. Journal of Cell Biology. 206 (3), 385-393 (2014).
- Sawin, K. E., Mitchison, T. J. Mitotic spindle assembly by two different pathways in vitro. Journal of Cell Biology. 112 (5), 925-940 (1991).
- Belmont, L. D., Hyman, A. A., Sawin, K. E., Mitchison, T. J. Real-time visualization of cell cycle-dependent changes in microtubule dynamics in cytoplasmic extracts. Cell. 62 (3), 579-589 (1990).
- Krauss, S. W., Lee, G., Chasis, J. A., Mohandas, N., Heald, R. Two protein 4.1 domains essential for mitotic spindle and aster microtubule dynamics and organization in vitro. Journal of Biological Chemistry. 279 (26), 27591-27598 (2004).
- Wang, S., Romano, F. B., Field, C. M., Mitchison, T. J., Rapoport, T. A. Multiple mechanisms determine ER network morphology during the cell cycle in Xenopus egg extracts. Journal of Cell Biology. 203 (5), 801-814 (2013).
- Field, C. M., Nguyen, P. A., Ishihara, K., Groen, A. C., Mitchison, T. J. Xenopus egg cytoplasm with intact actin. Methods in Enzymology. 540, 399-415 (2014).
- Good, M. C., Heald, R. Preparation of Cellular Extracts from Xenopus Eggs and Embryos. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Field, C. M., Pelletier, J. F., Mitchison, T. J. Xenopus extract approaches to studying microtubule organization and signaling in cytokinesis. Methods in Cell Biology. 137, 395-435 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。