Method Article
Xenopus laevis Preparación de extracto de huevo y métodos de imágenes en vivo para visualizar la organización citoplasmática dinámica
En este artículo
Resumen
Describimos un método para la preparación y obtención de imágenes en vivo de extractos citoplasmáticos sin diluir de huevos de Xenopus laevis .
Resumen
Tradicionalmente utilizados para ensayos bioquímicos a granel, los extractos de huevo de Xenopus laevis se han convertido en una poderosa herramienta basada en imágenes para estudiar fenómenos citoplasmáticos, como la citocinesis, la formación del huso mitótico y el ensamblaje del núcleo. Basándose en los primeros métodos que tomaban imágenes de extractos fijos muestreados en puntos de tiempo dispersos, los enfoques recientes de imágenes de extractos en vivo utilizando microscopía de lapso de tiempo, revelando características más dinámicas con una resolución temporal mejorada. Estos métodos generalmente requieren tratamientos superficiales sofisticados del vaso de imágenes. Aquí presentamos un método alternativo para obtener imágenes en vivo de extractos de huevo que no requieren tratamiento químico de superficie. Es fácil de implementar y utiliza consumibles de laboratorio producidos en masa para obtener imágenes. Describimos un sistema que se puede utilizar tanto para microscopía de campo amplio como para microscopía confocal. Está diseñado para extractos de imágenes en un campo de 2 dimensiones (2D), pero se puede extender fácilmente a imágenes en 3D. Es muy adecuado para estudiar la formación de patrones espaciales dentro del citoplasma. Con datos representativos, demostramos la organización dinámica típica de microtúbulos, núcleos y mitocondrias en extractos de interfase preparados utilizando este método. Estos datos de imagen pueden proporcionar información cuantitativa sobre la dinámica citoplasmática y la organización espacial.
Introducción
El citoplasma constituye el volumen principal de una célula y tiene una organización distinta. Los ingredientes del citoplasma eucariota pueden autoensamblarse en una amplia gama de estructuras espaciales, como los ásteres de microtúbulos y el aparato de Golgi, que a su vez están dispuestos dinámicamente y se voltean dependiendo de la identidad y el estado fisiológico de la célula. Por lo tanto, comprender la organización espacial del citoplasma y su vínculo con las funciones celulares es importante para comprender cómo funciona la célula. Los extractos de huevo de Xenopus laevis se han utilizado tradicionalmente para ensayos bioquímicos a granel 1,2,3,4,5,6,7,8, pero trabajos recientes los establecen como un poderoso sistema de imágenes en vivo para estudios mecanicistas de estructuras citoplasmáticas y sus funciones celulares 9,10,11, 12,13,14,15,16,17,18. Estos extractos no diluidos preservan muchas estructuras y funciones del citoplasma, al tiempo que permiten manipulaciones directas de los contenidos citoplasmáticos no alcanzables en modelos convencionales basados en células19,20. Esto los hace ideales para caracterizar fenómenos citoplasmáticos y diseccionar sus fundamentos mecanicistas.
Los métodos existentes para obtener imágenes de extractos requieren modificaciones químicas de la superficie o la fabricación de dispositivos microfluídicos. Un método basado en cubreobjetos requiere la pasivación del polietilenglicol (PEG) de los cubreobjetos de vidrio21. Un método basado en microemulsiones requiere la deposición de vapor de tricloro(1H,1H,2H,2H-perfluorooctil)silano en superficies de vidrio22,23. Los sistemas basados en microfluídicos permiten un control preciso del volumen, geometría y composición de las gotas de extracción, pero requieren instalaciones especializadas de microfabricación11,12,24.
Aquí presentamos un método alternativo para obtener imágenes de extractos de huevo que es fácil de implementar y utiliza materiales fácilmente disponibles y de bajo costo. Esto incluye la preparación de una cámara de imágenes con un portaobjetos y un cubreobjetos recubiertos con cinta de etileno propileno fluorado (FEP). La cámara se puede utilizar para extraer imágenes con una variedad de sistemas de microscopía, incluidos estereoscopios y microscopios verticales e invertidos. Este método no requiere tratamiento químico de superficies, al tiempo que logra una claridad óptica similar obtenida con los métodos existentes basados en vidrio discutidos anteriormente. Está diseñado para obtener imágenes de una capa de extractos con un grosor uniforme en un campo 2D, y se puede extender fácilmente para obtener imágenes de un volumen 3D de extractos. Es muy adecuado para imágenes de lapso de tiempo del comportamiento citoplasmático colectivo en un amplio campo de visión.
Hemos utilizado extractos de huevo detenidos entre fases para demostrar nuestro método de imagen. La preparación del extracto sigue el protocolo de Deming y Kornbluth19. Brevemente, los huevos naturalmente detenidos en la metafase de la meiosis II son aplastados por un giro de baja velocidad. Este giro libera el citoplasma del paro meiótico y permite que el extracto proceda a la interfase. Normalmente, la citocalasina B se agrega antes del giro de trituración para inhibir la formación de actina F. Sin embargo, se puede omitir si se desea F-actina. La cicloheximida también se agrega antes del centrifugado para evitar que el extracto de interfase entre en la siguiente mitosis. Los extractos se colocan posteriormente en las cámaras de imagen antes mencionadas y se colocan en un microscopio. Finalmente, las imágenes se registran a lo largo del tiempo a intervalos definidos por una cámara conectada al microscopio, produciendo series de imágenes de lapso de tiempo que capturan el comportamiento dinámico del extracto en un campo 2D.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Stanford.
1. Preparación de portaobjetos y cubreobjetos
- Aplique una capa de cinta adhesiva de etileno propileno fluorado (FEP) a un portaobjetos de vidrio con un aplicador de rodillos. Corte el exceso de cinta sobre los bordes con una cuchilla de afeitar limpia. Prepare los cubreobjetos recubiertos con cinta FEP de la misma manera (Figura 1A).
- Aplique un espaciador de imágenes adhesivas de doble cara al lado recubierto con cinta FEP de la diapositiva. Deje el forro protector en la parte superior sin pelar (Figura 1A).
NOTA: Las diapositivas y los cubreobjetos deben prepararse antes del experimento. Se pueden usar inmediatamente o almacenar en cajas para evitar la acumulación de polvo en las superficies. El pozo en el espaciador de imágenes tiene una profundidad de 120 μm y tiene un diámetro de 9 mm.
2. Preparación e imágenes en vivo de extractos de huevo detenidos entre fases
NOTA: El siguiente protocolo está adaptado de Deming y Kornbluth19, Murray20 y Smythe y Newport25 con modificaciones. Todos los pasos deben realizarse a temperatura ambiente a menos que se indique lo contrario.
- De tres a diez días antes de la recolección de huevos, inyecte ranas hembras maduras de Xenopus laevis por vía subcutánea en el saco linfático dorsal con 100 UI de gonadotropina sérica de yegua embarazada (PMSG).
- De dieciséis a dieciocho horas antes de la recolección planificada de huevos, inyecte las ranas del paso 2.1 con 500 UI de gonadotropina coriónica humana (hCG). Dejar las ranas a 18 °C en tampón de puesta de huevos (100 mM NaCl, 2 mM KCl, 1 mM MgSO 4·7H 2 O, 2.5 mM CaCl 2·2H2O, 0.5 mM HEPES, 0.1 mM EDTA, preparar como una solución madre 20x a pH 7.4 y diluir con agua limpia del tanque de rana hasta 1x antes de usar) hasta la recolección de huevos.
- El día del experimento, recolecte los huevos en una placa de Petri de vidrio grande y evalúe la calidad del huevo. Deseche cualquier huevo que parezca bolas hinchadas blancas o que aparezca en una cuerda (Figura 1B). Examine los huevos bajo un estereoscopio, mantenga los huevos con apariencia normal (Figura 1C) y deseche aquellos con pigmento irregular o moteado (Figura 1D).
NOTA: Este protocolo funciona con huevos recolectados de una sola rana, que generalmente pone 25 ml de huevos 16 horas después de la inyección de hCG. Por lo general, un total de 3 a 6 ranas son inducidas por hCG, y la rana con la más alta calidad de huevo se elige para el experimento de preparación de extractos. - Transfiera los huevos a un vaso de precipitados de vidrio de 400 ml y elimine la mayor cantidad posible de tampón de puesta de huevos por decantación.
- Incubar los huevos en 100 ml de solución desejelante recién preparada (2% p/v L-cisteína en agua, ajustar a pH 8.0 con NaOH) y agitarlos suavemente periódicamente. Después de unos 3 minutos, vierta la solución y agregue 100 ml de solución desejelante fresca. Continúe la incubación hasta que los huevos estén bien empaquetados (sin espacio entre los huevos), pero evite dejar los huevos en la solución desarticulada durante más de un total de 5 minutos.
- Eliminar la mayor cantidad posible de solución desarticulada por decantación y lavar los huevos en tampón MMR 0,25x (25 mM NaCl, 0,5 mM KCl, 0,25 mM MgCl 2, 0,5 mM CaCl2, 0,025 mM EDTA, 1,25 mM HEPES, preparado como una solución madre 10x, ajustado a pH 7,8 con NaOH, y diluido en agua Milli-Q antes de su uso) añadiendo el tampón, Agitando los huevos y luego vertiendo el amortiguador. Repita varias veces hasta que se use un total de 1 L del tampón para los lavados.
- Lave los huevos varias veces con un total de 400 ml de tampón de lisis de huevo (250 mM de sacarosa, 10 mM de HEPES, 50 mM de KCl, 2,5 mM de MgCl2, 1 mM de DTT, frescos y ajustados a pH 7,7 con KOH). Retire los huevos con apariencia anormal utilizando una pipeta Pasteur entre los lavados.
NOTA: Los huevos con apariencia anormal se refieren a aquellos que parecen bolas hinchadas blancas (Figura 1B), tienen pigmentación moteada (Figura 1D), se están deteriorando con una región blanca en crecimiento (Figura 1E) o muestran un área pigmentada oscura y contraída en el hemisferio animal (Figura 1F). - Usando una pipeta de transferencia con la punta bien abierta, transfiera los huevos a un tubo de centrífuga de fondo redondo de 17 ml que contenga 1 ml de tampón de lisis de huevo. Gire el tubo en una centrífuga clínica a 400 x g durante 15 segundos para empacar los huevos.
- Retire la mayor cantidad posible del tampón de lisis del huevo de la parte superior de los huevos envasados con una pipeta Pasteur.
NOTA: Es importante eliminar la mayor cantidad posible de tampón de los huevos empacados, con el fin de minimizar la dilución del extracto de huevo. A veces es necesario eliminar algunos huevos sueltos junto con el tampón residual para lograr esto. - Determine el volumen aproximado de los huevos empacados y luego agregue 5 μg/ml de aprotinina, 5 μg/ml de leupeptina, 5 μg/ml de citocalasina B y 50 μg/ml de cicloheximida directamente sobre los huevos empacados.
NOTA: La aprotinina y la leupeptina son inhibidores de la proteasa. La citocalasina B inhibe la polimerización de actina, evitando que el extracto se contraiga y gelifique26. La cicloheximida inhibe la síntesis de proteínas, manteniendo así el extracto en la interfase del ciclo celular. - Triturar los huevos centrifugando el tubo a 12.000 x g, 4 °C, durante 15 minutos, en un rotor de cuchara oscilante.
NOTA: Al final de la centrifugación, los huevos deben haberse roto y el lisado separado en tres capas principales: una capa lipídica amarilla en la parte superior, el extracto citoplasmático (también llamado extracto crudo) en el medio y una capa densa oscura que contiene los gránulos de pigmento en la parte inferior (Figura 1G). - Coloque una aguja de calibre 18 en una jeringa. Con el bisel de la punta de la aguja hacia arriba, perfore el tubo desde el lado en la parte inferior de la capa citoplasmática y recupere el extracto dibujando lentamente.
NOTA: Extraiga el extracto citoplasmático lentamente para evitar la inclusión de contenido contaminante de la capa lipídica amarilla. - Transfiera el extracto citoplasmático recuperado a un nuevo tubo de microcentrífuga y manténgalo en hielo. Use el extracto dentro de 1 hora.
- Cuando esté listo para obtener imágenes, complemente el extracto con los reactivos deseados y las sondas de imágenes de fluorescencia.
NOTA: Las sondas de imágenes de fluorescencia marcan estructuras citoplasmáticas específicas para que puedan ser visualizadas por un microscopio de fluorescencia. - Retire el revestimiento protector superior del espaciador de imágenes del portaobjetos preparado en el paso 1.2 y deposite aproximadamente 7 μL de extracto en el centro del pocillo. Aplique inmediatamente el cubrecubierto con cinta FEP con el lado FEP orientado hacia el extracto para sellar el pozo. Proceda rápidamente a la obtención de imágenes (Figura 1H, I).
- Coloque la diapositiva en un microscopio invertido o vertical con una platina motorizada y una cámara digital. Obtener imágenes de los extractos en las posiciones espaciales deseadas y los intervalos de tiempo tanto en canales de campo claro como de fluorescencia.
NOTA: Normalmente, se utiliza un objetivo 5x para la obtención de imágenes. La platina motorizada permite la adquisición automatizada de imágenes en múltiples posiciones espaciales definidas. La microscopía de campo claro visualiza estructuras citoplasmáticas con diferentes grados de transparencia. La microscopía de fluorescencia visualiza las estructuras citoplasmáticas específicamente marcadas por las sondas de imágenes de fluorescencia agregadas en el paso 2.14. La cámara graba imágenes de lapso de tiempo de estas estructuras, capturando así la dinámica de la organización citoplasmática.
Resultados
Los extractos de huevo de Xenopus laevis se pueden utilizar para estudiar la autoorganización del citoplasma durante la interfase. La figura 2A muestra los resultados de un experimento exitoso. Suplementamos extractos detenidos entre fases con núcleos de espermatozoides 19 de Xenopus laevis demembranados a una concentración de 27 núcleos/μL y 0,38 μM purificados GST-GFP-NLS 27,28,29,30 (proteína de fusión que consiste en glutatión-S-transferasa, proteína fluorescente verde y una secuencia de localización nuclear) para permitir la reconstitución y visualización de núcleos interfásicos. También agregamos tubulina marcada con fluorescencia de 1 μM para visualizar microtúbulos, y 500 nM MitoTracker Red CMXRos para visualizar mitocondrias. Momentos después de colocar el extracto en la cámara de imágenes, el citoplasma parecía desorganizado. En el transcurso de los siguientes 30 minutos a temperatura ambiente, el citoplasma comenzó a autoorganizarse en compartimentos similares a células. Los ásteres de microtúbulos crecieron a partir de centrosomas introducidos con los núcleos de los espermatozoides y formaron zonas fronterizas agotadas en microtúbulos cuando se encontraron con microtúbulos de ásteres vecinos. Proteína GST-GFP-NLS translocada en los núcleos redondos de interfase autoensamblados a partir de los núcleos de espermatozoides demembranados añadidos. Las áreas agotadas de componentes citoplasmáticos de dispersión de luz fueron visibles tanto en los canales de campo claro como en los de las mitocondrias (Figura 2A, 20 min y 35 min). Las mitocondrias también se agotaron de los bordes establecidos por los microtúbulos, y se enriquecieron en compartimentos aislados que se alinearon con los compartimentos de microtúbulos. A los 60 min a temperatura ambiente, un patrón espacial que consiste en compartimentos similares a células debe estar bien establecido, con microtúbulos formando una estructura hueca similar a una corona, y mitocondrias claramente divididas en cada compartimento (Figura 2A, 53 min).
La Figura 2B compara el rendimiento de extracción en cámaras de imagen con y sin cintas FEP en vidrio. Suplementamos extractos detenidos entre fases con núcleos de espermatozoides 19 de Xenopus laevis demembranados a una concentración de 27 núcleos/μL y 0,35 μM GST-mCherry-NLS27,28,29,30 (proteína de fusión que consiste en glutatión-S-transferasa, proteína fluorescente mCherry y una secuencia de localización nuclear) para permitir la reconstitución y visualización de núcleos interfásicos. También agregamos tubulina marcada con fluorescencia de 1 μM para visualizar microtúbulos. Las diferencias en la dinámica se hicieron evidentes en aproximadamente 20 minutos a temperatura ambiente. En la cámara hecha con vidrio FEP-taped, el extracto se autoorganizó en patrones normales similares a células (Figura 2B, imágenes en las filas 1 y 3). Sin embargo, en la cámara donde las superficies de vidrio no estaban cubiertas por la cinta FEP (sin pasivar), el extracto mostró patrones anormales de campo brillante y microtúbulos que se interrumpieron cada vez más con el tiempo (Figura 2B, imágenes en las filas 2 y 4). No se observaron diferencias significativas en la importación nuclear de la proteína GST-mCherry-NLS (Figura 2B, imágenes en las filas 5 y 6).

Figura 1: Esquemas y fotos relacionadas con el procedimiento experimental. (A) Diagrama esquemático para preparar cubreobjetos y portaobjetos de vidrio recubiertos con cinta FEP. (B) Huevos de Xenopus laevis depositados en tampón de puesta de huevos, con ejemplos de huevos de mala calidad indicados por flechas. Flechas amarillas, ejemplos de huevos que parecen bolas hinchadas blancas. Flechas rojas, ejemplos de huevos que aparecen en una cadena. (C) Ejemplos de huevos de Xenopus laevis con apariencia normal. (D) Ejemplos de huevos de mala calidad con pigmento irregular o moteado. (E) Un huevo deteriorado con una región blanca en crecimiento. (F) Un huevo que muestra un área pigmentada oscurecida y contraída, posiblemente debido a la activación partenogenética. (G) Las capas formadas por huevos rotos de Xenopus laevis después de la centrifugación de 12.000 x g en el paso 2.11. (H) Esquemas para preparar la cámara de imagen del extracto en el paso 2.15. (I) Una foto de una cámara de imágenes preparada con un extracto de huevo en su interior. (C) y (D) comparten la misma barra de escala en la parte inferior de (D). (E) y (F) comparten la misma barra de escala en la parte inferior de (F). Las barras de escala en (B) (C) (D) (E) (F) e (I) son aproximadas. Haga clic aquí para ver una versión más grande de esta figura.
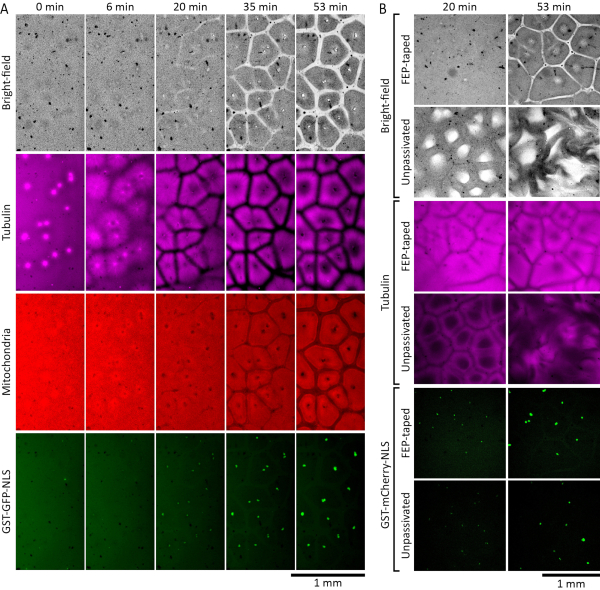
Figura 2: Los extractos de huevos detenidos por interfase se autoorganizan en compartimentos similares a células . (A) Montaje de lapso de tiempo de formación de patrones autoorganizados en una capa delgada (120 μm) de extracto de huevo de Xenopus laevis detenido entre fases . El extracto se complementó con 27 núcleos/μL de núcleos de espermatozoides de Xenopus laevis demembranados para permitir la reconstitución de los núcleos interfásicos. Los microtúbulos fueron visualizados por la tubulina marcada con HiLyte 647 (que se muestra en magenta), las mitocondrias por MitoTracker Red CMXRos (que se muestra en rojo) y los núcleos por GST-GFP-NLS (que se muestra en verde). (B) Formación de patrones autoorganizados en extractos de huevo de Xenopus laevis detenidos entre fases colocados en cámaras con y sin superficies de vidrio cubiertas con cinta FEP. Los extractos se complementaron con 27 núcleos/μL de núcleos de espermatozoides de Xenopus laevis demembranados para permitir la reconstitución de los núcleos interfásicos. Los microtúbulos fueron visualizados por tubulina marcada con HiLyte 488 (mostrada en magenta) y núcleos por GST-mCherry-NLS (mostrada en verde). Haga clic aquí para ver una versión más grande de esta figura.
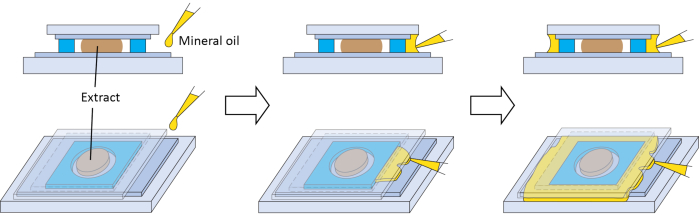
Figura 3: Sello secundario opcional para la cámara de imágenes. Esquemas para preparar un sello secundario opcional con aceite mineral para evitar que el extracto entre en contacto prolongado con el aire. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los extractos de huevos de Xenopus laevis se han convertido en un poderoso sistema modelo para estudios basados en imágenes de diversas estructuras subcelulares 10,14,15,16,17,18,21,31,32,33,34,35,36 y organización citoplasmática en su conjunto Escala celular9. Aquí hemos descrito un método de imagen en vivo adecuado para visualizar la organización citoplasmática dinámica en 2D. La eficacia del método se demuestra mediante resultados representativos.
Varios pasos son críticos para el éxito del método. La calidad del huevo es importante para los extractos, por lo que los pasos 2.3 y 2.7 son críticos. En nuestra experiencia, el hemisferio animal de huevos de alta calidad tiene una pigmentación uniforme, un punto blanco distintivo en el centro (indicativo de ruptura de vesículas germinales, GVBD) y un borde claro con el hemisferio vegetal (Figura 1C). Los extractos hechos de huevos de alta calidad tienen un mejor rendimiento en nuestras condiciones de imagen. Si más del 5% de los huevos tienen pigmento moteado (Figura 1D), tienen un área pigmentada oscurecida y contraída (Figura 1F), parecen bolas hinchadas blancas (Figura 1B), aparecen en una cuerda (Figura 1B) o muestran signos de deterioro después de los lavados en los pasos 2.6 y 2.7 (Figura 1E), entonces todo el lote de huevos debe desecharse. Los extractos conservan una notable actividad biológica porque son esencialmente citoplasma sin diluir. Por lo tanto, el paso que tiene como objetivo minimizar la dilución del extracto (paso 2.9) es importante para el éxito del experimento. Para las imágenes, los extractos se manejan en volúmenes muy pequeños y se evaporarán rápidamente si están en contacto prolongado con el aire. Esto afectará negativamente su actividad. Por lo tanto, en el paso 2.15, después de depositar el extracto, debe sellarse con el lado recubierto con cinta FEP del cubreobjetos lo antes posible. El sellado se puede confirmar visualmente mediante el cambio de textura en el sitio de contacto entre el adhesivo en el espaciador y el cubreobjetos. El espaciador debe ser capaz de crear un sello completo si se aplica correctamente. Sin embargo, si se desea un sello adicional, se puede dispensar aceite mineral entre el voladizo del cubreobjetos y la corredera de vidrio. El aceite puede formar un sello adicional alrededor del espaciador por acción capilar (Figura 3). La pasivación de las superficies de vidrio puede reducir la adsorción inespecífica de moléculas, y es importante para los ásteres de microtúbulos interfásicos en extractos21,37. La aplicación de cinta FEP sobre una superficie de vidrio descrita aquí parece ofrecer beneficios similares, como lo sugiere el ensamblaje de ásteres de microtúbulos de interfase normales (Figura 2, 6 min). Por lo tanto, el paso 1.1 también es crítico.
Demostramos la aplicación de un método de imagen utilizando extractos de huevo detenidos entre fases siguiendo el protocolo de Deming y Kornbluth19. Por defecto, el protocolo complementa los extractos con el inhibidor de la polimerización de actina citocalasina B para prevenir la gelificación-contracción en los extractos después de una incubación prolongada a temperatura ambiente26. Para permitir la polimerización de actina y observar la dinámica de la actina, se puede omitir la citocalasina B en el paso 2.10 del protocolo9. Una modificación que hemos hecho al protocolo de Deming y Kornbluth es que no complementamos los extractos con una mezcla energética para regenerar ATP19. Esto se debe a que en nuestras manos, en extractos suplementados con esta mezcla regeneradora de ATP19 y núcleos de espermatozoides, los microtúbulos ocasionalmente forman una red reticulada que interfiere con la formación de patrones citoplasmáticos. Por lo tanto, el protocolo no incluye el paso que agrega la combinación energética a los extractos19.
El protocolo de extracción interfase se basa en triturar huevos en tampón libre de EGTA para liberarlos de la detención meiótica (detención del LCR)37. Los extractos progresan posteriormente a la interfase, y se mantienen en la interfase por cicloheximida. Existen otros métodos establecidos para preparar extractos de interfase. Algunos métodos primero preparan extractos que mantienen el paro meiótico triturando huevos en tampón de lisis con EGTA38, y luego liberan el arresto agregando calcio, conduciendo el extracto a la interfase 21,37,39. Los extractos pueden mantenerse posteriormente en interfase mediante la adición de inhibidores de la síntesis de proteínas como la cicloheximida37,39. Otros métodos activan partenogenéticamente los huevos con ionóforo de calcio (A23187) o descarga eléctrica para liberarlos de la detención meiótica, antes de aplastar los huevos en ausencia de EGTA20,28 (revisado en Field et al.37). Estos extractos pueden entrar en interfase, pero por lo general no permanecerán allí, ya que son capaces de someterse a múltiples ciclos celulares. Asimismo, se han desarrollado métodos bien establecidos optimizados para preparar extractos con citoesqueleto de actina intacto 10,37,39. El método de imagen puede ser adecuado para este tipo de extractos, pero no lo hemos probado con ellos.
Con el fin de obtener imágenes de la organización interna del citoplasma, el sistema de imágenes presentado aquí es relativamente fácil de configurar, requiriendo solo la aplicación de una cinta FEP a las superficies de vidrio. Permite el ensamblaje de estructuras citoesqueléticas en extractos9 reportados en sistemas de imagen más sofisticados donde las superficies de vidrio son pasivadas con tratamiento con poli-L-lisina-g-polietilenglicol (PLL-g-PEG) o recubiertas con bicapas lipídicas soportadas10,21. El método permite que la capa de extracción se forme con un espesor definido (determinado por la profundidad del espaciador, que es de 120 μm para el sistema que se muestra en las Figuras 1A, 1H, 1I y 2). Podemos ajustar el grosor apilando espaciadores adicionales. Hemos apilado hasta 6 espaciadores de este tipo (720 μm de espesor) y los compartimentos se formaron normalmente. Esta flexibilidad permite aplicaciones futuras, como la obtención de imágenes de los extractos en 3D mediante microscopía confocal o de hoja de luz.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a J. Kamenz, Y. Chen y W. Y. C. Huang por sus comentarios sobre el manuscrito. Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud (R01 GM110564, P50 GM107615 y R35 GM131792) otorgadas a James E. Ferrell, Jr.
Materiales
| Name | Company | Catalog Number | Comments |
| 17 ml centrifuge tube | Beckman Coulter | 337986 | |
| 22x22 mm square #1 cover glass | Corning | 284522 | |
| Aprotinin | MilliporeSigma | 10236624001 | Protease inhibitor |
| Cycloheximide | MilliporeSigma | 01810 | Protein synthesis inhibitor |
| Cytochalasin B | MilliporeSigma | C6762 | Actin polymerization inhibitor |
| Female Xenopus laevis frogs | Nasco | LM00535MX | |
| Fluorescent HiLyte 488 labeled tubulin protein | Cytoskeleton, Inc. | TL488M-A | For visualizing the microtubule cytoskeleton |
| Fluorescent HiLyte 647 labeled tubulin protein | Cytoskeleton, Inc. | TL670M-A | For visualizing the microtubule cytoskeleton |
| Fluorinated ethylene propylene (FEP) optically clear tape | CS Hyde company | 23-FEP-2-5 | |
| Glass Pasteur pipette | Fisher Scientific | 13-678-20C | |
| Human chorionic gonadotropin (hCG) | MilliporeSigma | CG10 | |
| Imaging spacer | Electron Microscopy Sciences | 70327-8S | |
| Leupeptin | MilliporeSigma | 11017101001 | Protease inhibitor |
| Microscope slides | Fisher Scientific | 12-518-100B | |
| Mineral oil | MilliporeSigma | 330760 | |
| MitoTracker Red CMXRos | Thermo Fisher Scientific | M7512 | For visualizing mitochondria |
| Pregnant mare serum gonadotropin (PMSG) | BioVendor | RP1782725000 | |
| Roller applicator | Amazon | B07HMBJSP8 | For applying the FEP tape to the glass slides and coverslips |
| Single-edged razor blades | Fisher Scientific | 12-640 | For removing excessive FEP tape |
| Transfer pipette | Fisher Scientific | 13-711-7M |
Referencias
- Murray, A. W., Kirschner, M. W. Cyclin synthesis drives the early embryonic cell cycle. Nature. 339 (6222), 275-280 (1989).
- Dunphy, W. G., Brizuela, L., Beach, D., Newport, J. The Xenopus cdc2 protein is a component of MPF, a cytoplasmic regulator of mitosis. Cell. 54 (3), 423-431 (1988).
- Minshull, J., Golsteyn, R., Hill, C. S., Hunt, T. The A- and B-type cyclin associated cdc2 kinases in Xenopus turn on and off at different times in the cell cycle. EMBO J. 9 (9), 2865-2875 (1990).
- Wu, J. Q., et al. PP1-mediated dephosphorylation of phosphoproteins at mitotic exit is controlled by inhibitor-1 and PP1 phosphorylation. Nature Cell Biology. 11 (5), 644-651 (2009).
- Pomerening, J. R., Sontag, E. D., Ferrell, J. E. Building a cell cycle oscillator: hysteresis and bistability in the activation of Cdc2. Nature Cell Biology. 5 (4), 346-351 (2003).
- Mochida, S., Maslen, S. L., Skehel, M., Hunt, T. Greatwall phosphorylates an inhibitor of protein phosphatase 2A that is essential for mitosis. Science. 330 (6011), 1670-1673 (2010).
- Blow, J. J., Laskey, R. A. Initiation of DNA replication in nuclei and purified DNA by a cell-free extract of Xenopus eggs. Cell. 47 (4), 577-587 (1986).
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cheng, X., Ferrell, J. E. Spontaneous emergence of cell-like organization in Xenopus egg extracts. Science. 366 (6465), 631-637 (2019).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Good, M. C., Vahey, M. D., Skandarajah, A., Fletcher, D. A., Heald, R. Cytoplasmic volume modulates spindle size during embryogenesis. Science. 342 (6160), 856-860 (2013).
- Hazel, J., et al. Changes in cytoplasmic volume are sufficient to drive spindle scaling. Science. 342 (6160), 853-856 (2013).
- Brownlee, C., Heald, R. Importin alpha Partitioning to the Plasma Membrane Regulates Intracellular Scaling. Cell. 176 (4), 805-815 (2019).
- Nguyen, P. A., Field, C. M., Mitchison, T. J. Prc1E and Kif4A control microtubule organization within and between large Xenopus egg asters. Molecular Biology of the Cell. 29 (3), 304-316 (2018).
- Desai, A., Maddox, P. S., Mitchison, T. J., Salmon, E. D. Anaphase A chromosome movement and poleward spindle microtubule flux occur At similar rates in Xenopus extract spindles. Journal of Cell Biology. 141 (3), 703-713 (1998).
- Mitchison, T. J., et al. Roles of polymerization dynamics, opposed motors, and a tensile element in governing the length of Xenopus extract meiotic spindles. Molecular Biology of the Cell. 16 (6), 3064-3076 (2005).
- Mitchison, T. J., et al. Bipolarization and poleward flux correlate during Xenopus extract spindle assembly. Molecular Biology of the Cell. 15 (12), 5603-5615 (2004).
- Murray, A. W., Desai, A. B., Salmon, E. D. Real time observation of anaphase in vitro. Proceedings of the National Academy of Sciences of the United States of America. 93 (22), 12327-12332 (1996).
- Deming, P., Kornbluth, S. Study of apoptosis in vitro using the Xenopus egg extract reconstitution system. Methods in Molecular Biology. 322, 379-393 (2006).
- Murray, A. W. Cell cycle extracts. Methods in Cell Biology. 36, 581-605 (1991).
- Field, C. M., Mitchison, T. J. Assembly of Spindles and Asters in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Guan, Y., et al. A robust and tunable mitotic oscillator in artificial cells. Elife. 7, (2018).
- Guan, Y., Wang, S., Jin, M., Xu, H., Yang, Q. Reconstitution of Cell-cycle Oscillations in Microemulsions of Cell-free Xenopus Egg Extracts. Journal of Visualized Experiments. (139), e58240(2018).
- Oakey, J., Gatlin, J. C. Microfluidic Encapsulation of Demembranated Sperm Nuclei in Xenopus Egg Extracts. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Smythe, C., Newport, J. W. Systems for the study of nuclear assembly, DNA replication, and nuclear breakdown in Xenopus laevis egg extracts. Methods in Cell Biology. 35, 449-468 (1991).
- Field, C. M., et al. Actin behavior in bulk cytoplasm is cell cycle regulated in early vertebrate embryos. Journal of Cell Science. 124, Pt 12 2086-2095 (2011).
- Chang, J. B., Ferrell, J. E. Mitotic trigger waves and the spatial coordination of the Xenopus cell cycle. Nature. 500 (7464), 603-607 (2013).
- Chang, J. B., Ferrell, J. E. Robustly Cycling Xenopus laevis Cell-Free Extracts in Teflon Chambers. Cold Spring Harbor Protocols. 2018 (8), (2018).
- Chatterjee, S., Javier, M., Stochaj, U. In vivo analysis of nuclear protein traffic in mammalian cells. Experimental Cell Research. 236 (1), 346-350 (1997).
- Mochida, S., Hunt, T. Calcineurin is required to release Xenopus egg extracts from meiotic M phase. Nature. 449 (7160), 336-340 (2007).
- Heald, R., et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature. 382 (6590), 420-425 (1996).
- Helmke, K. J., Heald, R. TPX2 levels modulate meiotic spindle size and architecture in Xenopus egg extracts. Journal of Cell Biology. 206 (3), 385-393 (2014).
- Sawin, K. E., Mitchison, T. J. Mitotic spindle assembly by two different pathways in vitro. Journal of Cell Biology. 112 (5), 925-940 (1991).
- Belmont, L. D., Hyman, A. A., Sawin, K. E., Mitchison, T. J. Real-time visualization of cell cycle-dependent changes in microtubule dynamics in cytoplasmic extracts. Cell. 62 (3), 579-589 (1990).
- Krauss, S. W., Lee, G., Chasis, J. A., Mohandas, N., Heald, R. Two protein 4.1 domains essential for mitotic spindle and aster microtubule dynamics and organization in vitro. Journal of Biological Chemistry. 279 (26), 27591-27598 (2004).
- Wang, S., Romano, F. B., Field, C. M., Mitchison, T. J., Rapoport, T. A. Multiple mechanisms determine ER network morphology during the cell cycle in Xenopus egg extracts. Journal of Cell Biology. 203 (5), 801-814 (2013).
- Field, C. M., Nguyen, P. A., Ishihara, K., Groen, A. C., Mitchison, T. J. Xenopus egg cytoplasm with intact actin. Methods in Enzymology. 540, 399-415 (2014).
- Good, M. C., Heald, R. Preparation of Cellular Extracts from Xenopus Eggs and Embryos. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Field, C. M., Pelletier, J. F., Mitchison, T. J. Xenopus extract approaches to studying microtubule organization and signaling in cytokinesis. Methods in Cell Biology. 137, 395-435 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados