Method Article
Бесклеточная продукция протеолипосом для функционального анализа и разработки антител, нацеленных на мембранные белки
В этой статье
Резюме
Данный протокол описывает эффективный бесклеточный метод получения высококачественной протеолипосомы двухслойно-диализным методом с использованием бесклеточной системы пшеницы и липосом. Этот метод обеспечивает подходящие средства для функционального анализа мембранных белков, скрининга лекарственных мишеней и выработки антител.
Аннотация
Мембранные белки играют важную роль в различных клеточных процессах и выполняют жизненно важные функции. Мембранные белки важны с медицинской точки зрения при открытии лекарств, потому что они являются мишенями более половины всех лекарств. Препятствием для проведения биохимических, биофизических и структурных исследований мембранных белков, а также развития антител была трудность в получении большого количества высококачественного мембранного белка с правильной конформацией и активностью. Здесь мы описываем «двухслойный метод диализа» с использованием системы без клеток зародышей пшеницы, липосом и диализных чашек для эффективного синтеза мембранных белков и получения очищенных протеолипосом за короткое время с высокой успешностью. Мембранные белки могут продуцироваться столько же, сколько в нескольких миллиграммах, таких как GPCR, ионные каналы, транспортеры и тетраспанины. Этот бесклеточный метод способствует сокращению времени, затрат и усилий на приготовление высококачественных протеолипосом и обеспечивает подходящие средства для функционального анализа мембранных белков, скрининга лекарственных мишеней и разработки антител.
Введение
Мембранные белки являются одной из наиболее важных лекарственных мишеней в диагностике и терапии. Действительно, половина мелких составных лекарств-мишеней являются мембранными белками, такими как рецепторы, связанные с G-белком (GPCR) и ионные каналы1. На протяжении многих лет исследователи работали над биохимическими, биофизическими и структурными исследованиями мембранных белков, чтобы выяснить их структуру и функцию 2,3. Разработка моноклональных антител против мембранных белков также активно осуществляется с целью ускорения функциональных и структурных исследований и разработки лечебно-диагностических приложений 4,5,6,7,8,9. Все эти исследования требуют большого количества высококачественных мембранных белков10. Например, для выработки антител необходимо несколько миллиграммов очищенных мембранных белков с естественной конформацией. Для рентгеновской кристаллографии требуется гораздо большее количество высокоочищенных мембранных белков. Тем не менее, массовое производство мембранных белков остается узким местом в исследовании мембранных белков11. Мембранные белки имеют сложные структуры с одной или несколькими трансмембранными спиралями и играют важную роль в клеточном гомеостазе. Гетерологичная сверхэкспрессия мембранных белков приводит к множественным препятствиям, таким как агрегация мембранных белков, которые накапливаются при высоких локальных концентрациях или нарушении клеточных сигнальных путей. Даже если выражение лица будет успешным, последующие этапы пробоподготовки также столкнутся с трудностями. Например, приготовление протеолипосом требует высоких навыков и профессионального опыта в солюбилизации, очистке и стабилизации мембранных белков, а также требует больших усилий и времени, а также12,13.
С другой стороны, в последние десятилетия появились некоторые передовые технологии для производства белков без использования живых клеток 14,15,16,17,18. Технология бесклеточного синтеза белка воссоздает реакцию трансляции в пробирке. Поскольку нет никаких ограничений, которые имеет система клеточной экспрессии, бесклеточные системы имеют потенциал для синтеза различных белков, которые трудно экспрессировать или проявлять токсичность в клетках. Очищенный клеточный экстракт или восстановленный поступательный механизм смешивают с шаблонными мРНК, аминокислотами и источниками энергии, а рекомбинантные белки синтезируются за короткое время. Что касается синтеза мембранного белка, некоторые виды каркасов, состоящих из липидов или амфифилов, такие как липосомы, бицеллы, нанодиски или сополимеры, добавляются к бесклеточной реакции 19,20,21,22,23,24. Синтезированные мембранные белки взаимодействуют с каркасами и могут стабилизироваться в воде. Бесклеточные синтезированные мембранные белки широко используются в функциональных исследованиях и выработке антител 25,26,27,28,29,30,31.
В этом протоколе мы описываем эффективный бесклеточный метод получения протеолипосом с использованием бесклеточной системы пшеницы и липосом. Бесклеточная система синтеза белка пшеницы представляет собой мощную систему трансляции in vitro с использованием экстракта из зародышей пшеницы 15,32,33. Зародыши пшеницы содержат большое количество трансляционных механизмов и мало ингибиторов трансляции. Трансляционный механизм в пшенице, входящей в состав эукариот, подходит для трансляции эукариотических белков, и на его эффективность трансляции практически не влияет использование кодона шаблонной мРНК. Используя бесклеточную систему пшеницы, мы синтезировали различные белки, включая протеинкиназы34,35, убиквитиновые лигазы36, факторы транскрипции37 и мембранные белки с высокими показателями успеха. Для производства мембранного белка мы добавляем липидные везикулярные липосомы в трансляционную смесь в виде каркаса19,38. Гидрофобные домены мембранного белка взаимодействуют с липидным бислоем и спонтанно интегрируются с липосомами. Центрифугирование градиента плотности используется для строгого отделения протеолипосом от эндогенных белков пшеницы, хотя обычной центрифугации реакционной смеси трансляции достаточно для простой очистки протеолипосомы20. Многие виды интегральных мембранных белков были синтезированы с использованием бесклеточной системы пшеницы и применены для различных исследований и разработок 25,38,39,40,41,42,43,44. Кроме того, мы разработали «двухслойно-диализный метод» для крупносерийного производства45,46. В этом способе устройство для диализа чашечного типа погружают в буфер подачи субстрата, и в чашке образуются два слоя реакционной смеси трансляции и буфер подачи субстрата, как показано на рисунке 1. Непрерывная подача подложек и удаление побочного продукта могут эффективно проводиться как в верхней, так и в нижней части реакционной смеси в течение длительного времени, что приводит к превосходной эффективности трансляции (фиг.2А и фиг.2В)45.
протокол
1. Получение плазмиды экспрессии pEU
ПРИМЕЧАНИЕ: плазмида экспрессии pEU должна включать стартовый кодон, открытую рамку считывания белка целевой мембраны и стоп-кодон в фрагменте (см. Рисунок 1). При необходимости добавьте последовательность (последовательности) меток обнаружения/очистки в соответствующее положение. Для субклонирования применимо либо переваривание фермента рестрикции, либо бесшовное клонирование. Здесь мы опишем протокол, использующий бесшовный метод клонирования.
- Подготовьте вставку фрагмента ДНК.
- Амплифицируйте интересующий ген с помощью ПЦР с помощью шаблона кДНК, праймера 1 и праймера 2. Грунтовка 1 и грунтовка 2 содержат 15 bp перекрытий для бесшовного клонирования соответственно (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Не включайте последовательности, подлежащие обработке и удалению из зрелого белка в клетках (например, сигнальная последовательность). Переработка синтезированного белка не осуществляется в бесклеточной системе пшеницы. Не добавляйте последовательность Козака. Вектор pEU-E01-MCS имеет усилитель трансляции E01. - Добавьте 1/25 объема фермента рестрикции DpnI в продукт ПЦР для удаления шаблонной плазмидной ДНК. Инкубировать в течение 30 мин при 37 °C.
- Используйте набор для очистки ПЦР для очистки продукта ПЦР и регулировки концентрации на уровне 20–50 нг/мкл.
- Амплифицируйте интересующий ген с помощью ПЦР с помощью шаблона кДНК, праймера 1 и праймера 2. Грунтовка 1 и грунтовка 2 содержат 15 bp перекрытий для бесшовного клонирования соответственно (см. Таблицу материалов).
- Линеаризация вектора pEU-E01-MCS.
- Проводят обратную ПЦР с использованием pEU-E01-MCS, праймера 3 и праймера 4.
- Добавьте 1/25 объема фермента рестрикции DpnI к обратному продукту ПЦР. Инкубировать в течение 30 мин при 37 °C.
- Используйте набор для очистки ПЦР для очистки продукта ПЦР в соответствии с рекомендацией производителя. Отрегулируйте концентрацию на уровне 20–50 нг/мкл.
- Смешайте 2 мкл вставленного фрагмента ДНК, 2 мкл линеаризированного вектора и 4 мкл 2-кратной бесшовной смеси ферментов клонирования.
- Преобразуйте штамм Escherichia coli JM109 с помощью бесшовного продукта клонирования. С помощью разбрасывателя распределите бактериальную суспензию на пластину агарового агар lb-ампициллина.
ПРИМЕЧАНИЕ: вектор pEU имеет маркер сопротивления ампициллина. - Подтверждают последовательность экспрессии плазмиды, построенной с использованием праймера 5 и праймера 6 со стороны 5' и 3' MCS в плазмиде pEU соответственно.
- Усиливают и очищают экспрессию плазмид.
- Культивируйте плазмидно-трансформированный штамм E. coli JM109 в 150 мл LB-ампициллиновой среды при 37 °C и 125 ударов в минуту встряхивания в течение ночи.
- Извлеките и очистите плазмиды, используя коммерчески доступный набор для подготовки плазмид миди. Растворяют плазмиды в 500 мкл буфера TE.
ВНИМАНИЕ: Не используйте мини-комплект для подготовки к извлечению плазмид. Не обеспечивает достаточного качества и количества плазмиды. - Добавьте 500 мкл фенола/хлороформа/изоамилового спирта (25:24:1). Энергично перемешайте в течение 5 мин, а центрифугу в течение 5 мин при 17 800 х г и комнатной температуре. Перенесите верхний плазмидный раствор в новую трубку.
ВНИМАНИЕ: Носите одноразовые перчатки для защиты кожи от фенола и хлороформа.
ПРИМЕЧАНИЕ: Чтобы удалить загрязнение РНКазы из набора для экстракции плазмид, очистите плазмиды с помощью фенол-хлороформной очистки. - Добавьте 500 мкл хлороформа, чтобы полностью удалить фенол. Энергично перемешайте в течение 5 мин, а центрифугу в течение 5 мин при 17 800 х г и комнатной температуре. Перенесите верхний плазмидный раствор в новую трубку.
- Добавьте 2,5 объема этанола и 1/8 объема 7,5 М ацетата аммония и храните при -30 °C в течение 1 ч.
- Центрифуга при 17 800 х г при 4 °C в течение 10 мин. Промыть гранулу 500 мкл 70% этанола. Осторожно удалите супернатант и оставьте гранулу на 5 минут, чтобы она высохла.
- Полностью растворите экспрессию плазмид в 100 мкл сверхчистой воды. Измеряют концентрацию плазмид с абсорбцией при 260 нм. Отрегулируйте концентрацию до 1 мг/мл.
2. Транскрипция in vitro
ВНИМАНИЕ: Используйте пластиковые трубки и наконечники без ДНКазы и нуклеаз на этапах транскрипции и перевода. Избегайте автоклавирования пластиковых изделий, чтобы предотвратить загрязнение.
- Собирайте сверхчистую воду в новой пластиковой трубке.
ВНИМАНИЕ: Не используйте воду, обработанную DEPC, потому что остаточный DEPC сильно ингибирует реакцию. Используйте свежеочищенную сверхчистую воду для транскрипции и перевода. - Готовят реакционную смесь транскрипции, смешивая 115,2 мкл сверхчистой воды, 40 мкл транскрипционного буфера LM, 20 мкл смеси NTP, 2,4 мкл ингибитора РНказы 80 Ед/мкл, 2,4 мкл 80 Ед/мкл SP6 полимеразы и 20 мкл плазмиды экспрессии 1 мг/мл pEU. Аккуратно перемешайте реагенты путем инвертирования. Выполняйте быстрый спин.
- Инкубируют реакцию транскрипции при 37 °C в течение 6 ч.
- Осторожно перемешайте реакцию, инвертируя и быстро вращаясь вниз. Используйте его немедленно для перевода, в противном случае заморозьте и храните при -80 °C.
- Подтвердите транскрипцию продукта электрофорезом.
- Смешать 100 мл 1x TAE буфера и 1 г агарозы. Разогрейте суспензию в микроволновой печи для приготовления 1% агарозного Геля TAE.
- Взять 1 мкл реакции транскрипции и смешать с 3 мкл воды и 4 мкл 2-кратного нагрузочного красителя.
ПРИМЕЧАНИЕ: Денатурация РНК не требуется. - Нагрузка 4 мкл смеси и 2 мкл ДНК лестничного маркера на агарозный гель TAE.
- Электрофорез при 100 В в течение 20 мин.
- Окрашивают гель в бромид этидия в течение 30 мин. Проверьте рисунок лестничной полосы мРНК с помощью УФ-трансиллюминатора и гелевого тепловизора.
ПРИМЕЧАНИЕ: Когда наблюдается размазанная полоса менее 500 bp, подозревается деградация мРНК.
3. Подготовка материалов к переводу
- Подготовьте буфер трансляции.
- Смешайте 27 мл свежеприготовленной сверхчистой воды и 0,75 мл каждого 40-кратного запасного раствора для S1, S2, S3 и S4 соответственно в пробирке объемом 50 мл.
ПРИМЕЧАНИЕ: Модулируйте количество материалов в соответствии с конечным требуемым количеством 1x буфера трансляции.
ВНИМАНИЕ: Не храните и не замораживайте лишний 1-кратный буфер трансляции после использования.
- Смешайте 27 мл свежеприготовленной сверхчистой воды и 0,75 мл каждого 40-кратного запасного раствора для S1, S2, S3 и S4 соответственно в пробирке объемом 50 мл.
- Приготовьте раствор креатинкиназы. Растворяют лиофилизированную креатинкиназу в сверхчистой воде до конечной концентрации 20 мг/мл. Дозируют раствор в небольших количествах (от 10 до 50 мкл каждая) в 0,2 мл 8-полосных пробирок ПЦР. Заморозьте пробирки в жидком азоте и храните при -80 °C.
ВНИМАНИЕ: Не замораживайте раствор креатинкиназы после размораживания. - Промыть диализные чашки (размером 0,1 мл), чтобы удалить глицерин с диализной мембраны.
ПРИМЕЧАНИЕ: Существует несколько диализных чашек разного размера. Малогабаритные чашки (0,1 мл) используются для мелкомасштабных испытаний (секция 5.4), а крупногабаритные чашки (2 мл) - для крупномасштабного производства (секция 5.5), соответственно. Этапа промывки диализной мембраны крупногабаритных чашек можно избежать.- Поместите 1 мл сверхчистой воды в новую трубку объемом 1,5 мл. Вставьте в трубку небольшой диализный стаканчик (0,1 мл). Добавьте в чашку 0,5 мл сверхчистой воды.
- Инкубировать более 30 мин при комнатной температуре.
4. Получение липосом
ПРИМЕЧАНИЕ: Здесь мы описываем два протокола для получения липосом. Один использует готовые к использованию лиофилизированные липосомы (раздел 4.1), в то время как другой производит липосомы путем гидратации тонкой липидной пленки (раздел 4.2).
- Готовят липосомы, используя лиофилизированные липосомы.
ПРИМЕЧАНИЕ: Более простым способом получения протеолипосомы является использование коммерчески доступной липосомы азолектина. Азолектин является своего рода природным липидом, извлеченным из соевых бобов.- Откройте флакон, содержащий 10 мг лиофилизированных липосом азолектина (см. Таблицу материалов) и добавьте 200 мкл трансляционного буфера (раздел 3.1) на дно флакона. Запечатайте флакон и инкубируйте в течение 10 минут.
- Энергично перемешайте, положив флакон на вихрево-миксер на 1 мин.
- Вставьте флакон в пробирку объемом 50 мл. Открутите трубку центрифугированием при 500 х г в течение 1 мин.
- Используя пипетку, перенесите суспензию липосомы азолектина (50 мг липидов / мл) в новую трубку объемом 1,5 мл. Используйте липосомы немедленно для трансляции, в противном случае заморозьте в жидком азоте и храните при -80 °C.
- Приготовьте липосомы, увлажнив тонкую липидную пленку.
- Если липид продается в виде порошка, растворить в хлороформе или соответствующем органическом растворителе до концентрации 10-100 мг/мл.
ПРИМЕЧАНИЕ: Тонкая липидная пленка может быть получена с использованием очищенных и/или синтезированных амфифильных липидов. Способ очистки азолектина ранее описан38. Функционально модифицированные липиды, такие как биотинилированные липиды, флуоресцентные липиды и адъювантные липиды, могут быть добавлены к базальным липидам для получения функциональных липосом. - Переложите липидный раствор, содержащий 50 мг липида (липидов), в испарительную колбу.
- Используя вращающийся испаритель, испаряют растворитель и равномерно распределяют липид на стенку дна колбы, образуя тонкую пленку липида.
- Поместите колбу в вакуумный осушитель и оставьте под отрицательным давлением на ночь, чтобы полностью удалить растворитель.
- Добавьте 1 мл буфера трансляции в испарительную колбу. Поверните колбу, чтобы распределить буфер по тонкой липидной пленке. Инкубировать в течение 5 мин для гидратации пленки.
- Обработайте колбу ультразвуком с помощью ультразвукового гомогенизатора или ультразвукового очистителя. Время от времени меняйте угол колбы, чтобы раствор полностью коснулся пленки. Убедитесь, что тонкая липидная пленка отслаивается со дна и эмульгируется полностью и однородно.
ПРИМЕЧАНИЕ: Электронная микрофотография биотинилированных липидов, содержащих липосомы, показана на рисунке 1. - Перенесите суспензию липосом (50 мг липидов/мл) в новую трубку объемом 1,5 мл. Если он не будет использован немедленно, заморозьте липосомы в жидком азоте и храните при -80 °C.
- Если липид продается в виде порошка, растворить в хлороформе или соответствующем органическом растворителе до концентрации 10-100 мг/мл.
5. Перевод in vitro
- Быстро разморозьте экстракт зародышей пшеницы, плавая трубками на воде комнатной температуры в течение нескольких минут. После оттаивания немедленно аккуратно перемешайте, перевернув трубки, открутите вниз и охладите на льду до использования.
ПРИМЕЧАНИЕ: Заморозьте экстракт зародышей пшеницы в жидком азоте после использования и храните при -80 °C. Он выдерживает несколько циклов замораживания/оттаивания. - Разморозить 20 мг/мл раствора креатинкиназы. Смешайте 5 мкл исходного раствора и 45 мкл трансляционного буфера для приготовления рабочего раствора креатинкиназы 2 мг/мл.
ВНИМАНИЕ: Повторное замораживание креатинкиназы не рекомендуется. - При необходимости размораживайте липосомы или мРНК.
- Проводят мелкомасштабную белковую трансляцию.
- Удалите воду из трубки и диализной чашки (0,1 мл), как это было подготовлено на этапе 3.3.2.
- Вводят 1 мл и 300 мкл трансляционного буфера в трубку и диализную чашку соответственно.
ВНИМАНИЕ: В случае, если дно диализной чашки не достигает поверхности трансляционного буфера в трубке объемом 1,5 мл, введите в трубку дополнительно 50–100 мкл буфера. - Готовят реакционную смесь трансляции, смешивая 15,6 мкл трансляционного буфера, 2,4 мкл креатинкиназы 2 мг/мл, 12 мкл липосом 50 мг/мл, 15 мкл экстракта зародышей пшеницы и 15 мРНК. Аккуратно перемешайте, перевернув трубки, и открутите вниз.
- Аспират 60 мкл реакционной смеси трансляции с использованием пипетки объемом 200 мкл.
- Вставьте наконечник пипетки в нижнюю поверхность буфера трансляции в диализной чашке. Выбрасывайте реакционную смесь медленно и осторожно. Накройте диализную чашку крышкой, чтобы предотвратить испарение.
ПРИМЕЧАНИЕ: Реакционная смесь естественным образом опускается на дно чашки и образует двухслойный слой. Не мешайте бислою, смешивая или встряхивая чашку.
- Проведите масштабный перевод (рисунок 1).
- Налейте 22 мл буфера трансляции в трубку объемом 25 мл. Вставьте в трубку диализную чашку большого размера (2 мл) и добавьте в чашку 2 мл буфера трансляции.
- Готовят реакционную смесь трансляции, смешивая 130 мкл трансляционного буфера, 20 мкл 2 мг/мл креатинкиназы, 100 мкл липосомы 50 мг/мл, 125 мкл экстракта зародышей пшеницы и 125 мРНК. Аккуратно перемешайте путем пипетки.
- Аспирировать всю реакционную смесь трансляции (500 мкл) с помощью пипетки объемом 1000 мкл. Вводят реакционную смесь трансляции в диализную чашку таким же образом, как описано на этапе 5.4.5. Накройте диализную чашку крышкой, чтобы предотвратить испарение.
- Инкубируют реакции при 15 °C в течение 24 ч.
- Хорошо перемешайте реакцию в диализной чашке путем пипетки. Перенесите сырую суспензию протеолипосомы в новую трубку.
ПРИМЕЧАНИЕ: Для сбора протеолипосомы из мелкомасштабной трансляции рекомендуется плоскодонная трубка объемом 1,5 мл. После центрифугирования липосомы образуют компактные и легко видимые гранулы на нижнем углу трубки.
6. Очищение протеолипосом
- Центрифугируют трубку, содержащую сырую суспензию протеолипосомы при 17 800 х г при 4 °С в течение 10 мин.
- Удалите супернатант. Приостановить гранулу протеолипосомы в PBS (малый масштаб: 1 мл, крупный масштаб: 10 мл) путем пипетки.
- Повторите центрифугирование и промывку протеолипосом еще на два круга.
- После промывки добавляют небольшое количество ПБС и повторно суспендируют гранулы протеолипосомы путем пипетки. Измерьте объем суспензии с помощью микропипетки. Добавьте PBS, чтобы отрегулировать громкость до 60 мкл (малый масштаб) или 500 мкл (большой масштаб). Перенесите суспензию в новую трубку объемом 1,5 мл.
- Перенесите 10 мкл суспензии протеолипосомы в новую ПЦР-трубку для SDS-PAGE. Разделите остальные образцы на более мелкие порции для использования при необходимости. Заморозить в жидком азоте и хранить при -80 °C.
7. Окрашивание SDS-PAGE и CBB
- Добавьте 70 мкл воды и 40 мкл 3x буфера образцов SDS-PAGE к 10 мкл суспензии протеолипосомы.
ВНИМАНИЕ: Не кипятите образец SDS-PAGE, так как мембранные белки накапливаются и почти не проникают в акриламидный гель при электрофорезе. Кроме того, добавьте достаточное количество восстановителя в буфер образца SDS-PAGE (например, 2-меркаптоэтанол в конечной концентрации 3%), чтобы предотвратить окисление. - Установите гель SDS-PAGE с градиентом 5%-20% в камеру электрофореза. Нагрузка 3 мкл, 6 мкл, 12 мкл образцов протеолипосом, 2 мкл маркера размера белка, а также стандартная серия BSA.
- Электрофорез при 52 мА, 400 В в течение 30 мин.
- Окрашивайте гель красителем CBB в течение 1 ч. Обесцвечить в горячей воде и отсканировать изображение геля.
- Используя программное обеспечение NIH Image J (https://imagej.nih.gov/ij/), количественно оцените интенсивность полосы мембранного белка в каждой полосе. Оцените количество синтезированных мембранных белков со стандартным рядом BSA.
Результаты
Используя этот протокол, частично очищенные протеолипосомы могут быть получены за короткое время. Репрезентативные результаты показаны на рисунке 2А. Двадцать пять GPCR классов A, B и C были успешно синтезированы с использованием метода двухслойного диализа (мелкомасштабного) и частично очищены центрифугированием и буферной промывкой. Хотя количество синтезированных белков варьируется в зависимости от типа белка, от 50 до 400 мкг мембранных белков обычно могут быть синтезированы за реакцию при использовании больших диализных чашек. Несколько миллиграммов мембранных белков могут быть легко получены путем увеличения числа реакций, благодаря высокой масштабируемости пшеничной бесклеточной системы. Предварительного теста с использованием небольшой диализной чашки достаточно для определения эффективности производства белка-мишени в двухслойно-диализном методе. По полученной продуктивности можно оценить количество целевого белка, который будет получен с использованием больших диализных чашек.
Этот протокол подходит для экспрессии мембранных белков, особенно для тех, у кого есть несколько трансмембранных спиралей. В большинстве случаев мембранные белки с тремя и более трансмембранными спиралями легко включаются в протеолипосомы после синтеза (рисунок 2B), что обеспечивает хорошую продуктивность протеолипосом. Однотрансмембранно-спиральные белки обычно синтезируются плавно; однако они почти не интегрируются в липосомы из-за небольшой гидрофобной области. Что касается белков с двумя трансмембранными спиралями, то вопрос о том, закреплены ли они на липосомах или нет, зависит от того, как подвергаются воздействию их трансмембранные спирали.
Синтезированные протеолипосомы собирают простым центрифугированием, и частично очищают промывочным буфером, что значительно укорачивает процесс очистки мембранных белков. Хотя как биологические мембраны, так и мембранные белки были удалены из экстрактов зародышей пшеницы заранее, небольшие количества белков пшеницы иногда осаждаются путем связывания с липосомами или синтезированными мембранными белками (рисунок 2A). Такие белковые загрязнители трудно удалить простым центрифугированием и буферной промывкой. Когда требуется высокоочищенный мембранный белок, необходимо солюбилизировать частично очищенные протеолипосомы поверхностно-активным веществом и очистить их колоночной хроматографией.

Рисунок 1: Схема производства бесклеточных протеолипосом. SP6, SP6 промоторная последовательность; Последовательность усилителей трансляции E01, E01; Ampr, ген резистентности к ампициллину; ДТТ, дитиотрейтол. Электронная микрофотография показывает иммунозолотистую маркировку биотинилированных липидов, содержащих липосомы. Бар, 0,2 мкм. Это электронное микрографическое изображение было взято из рисунка 1D в Takeda et al., 201545. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
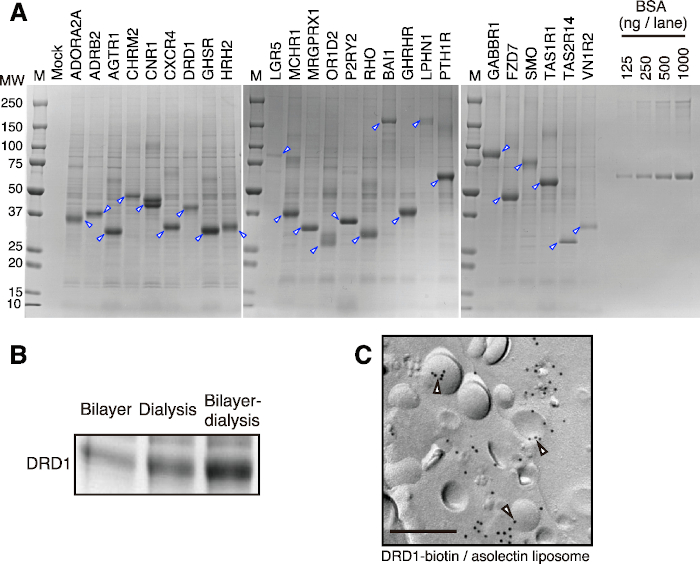
Рисунок 2: Репрезентативные результаты получения протеолипосом двухслойным методом диализа. (A) SDS-PAGE изображение бесклеточных синтезированных GPCR. Двадцать пять отобранных GPCR были синтезированы методом двухслойного диализа. Протеолипосомы частично очищали и наносили на окрашивание SDS-PAGE и CBB. Наконечники стрел указывают целевые GPCR. (B) Сравнение продукции мембранного белка между различными методами трансляции. Белок дофаминовых рецепторов D1 (DRD1) синтезировали каждым способом в одинаковом соотношении экстракта зародышей пшеницы, липосом и мРНК соответственно. Протеолипосому DRD1 частично очищали центрифугированием и подвергали окрашиванию SDS-PAGE и CBB. (C) Иммунозолотая маркировка DRD1-биотина/липосомного комплекса. DRD1 был ферментативно биотинилирован биотинлигазой BirA. Бар, 0,2 мкм. Пустые наконечники стрел указывают на DRD1-биотин на липосомах. Эта цифра была изменена по сравнению с рисунком 1 в Takeda et al., 201545. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
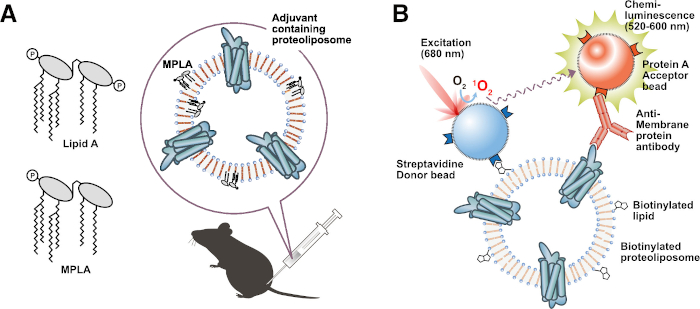
Рисунок 3: Применение функциональных протеолипосом. (A) Иммунизация адъювантных липидсодержащих протеолипосом. (B) Анализ взаимодействия на основе биотинилированных липосом (BiLIA). Взаимодействие между мембранным белком и антимембранным белковым антителом было обнаружено с помощью AlphaScreen. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Представленный протокол обеспечивает способ получения мембранных белков с высокой успешностью. Этот протокол прост, хорошо воспроизводим и легко масштабируется. Он также имеет потенциал для сокращения времени и стоимости экспериментов, которые потребляют большое количество мембранных белков. Двухслойно-диализный метод повышает производительность в 4–10 раз по сравнению с двухслойным методом или методом диализа (рис. 2В)45. В крайнем случае выход ионного канала и транспортера увеличился соответственно в 30 и 20 раз при двухслойно-диализном методе, чем при двухслойном методе (данные не показаны). Высокая производительность этого протокола является преимуществом в производстве антигена для иммунизации. Протеолипосомы часто используются в качестве иммунизирующих антигенов для выработки антимембранных белковых антител. Высококонцентрированные и очищенные мембранные белки, встроенные в протеолипосомы, эффективно стимулируют иммунный ответ и индуцируют антитела41,47. Используя этот двухслойно-диализный метод, протеолипосомы, несущие несколько миллиграммов мембранных белков для целей иммунизации, могут быть легко приготовлены за несколько дней. Действительно, наша группа синтезировала GPCR, ионные каналы и клаудины, используя этот протокол, и иммунизировала мышей продуктами для получения моноклональных антител против них 31,41,45. Некоторые из полученных моноклональных антител были проверены как функциональные антитела, такие как высокоаффинные антитела, конформационно-чувствительные антитела, применимые антитела к проточной цитометрии и ингибирующие антитела, что указывает на то, что этот протокол способен продуцировать мембранные белки с функционально правильными конформациями.
Еще одним привлекательным преимуществом этого протокола является возможность производства протеолипосом, которым назначены специфические функции с использованием модифицированных липидов, таких как биотинилированные липиды, флуоресцентные липиды или адъювантные липиды. Подготовленные протеолипосомы со специфическими функциями полезны и применимы к широкому кругу экспериментов. Например, адъювантные липидсодержащие протеолипосомы, такие как липид А48 или монофосфориллипид А (МПЛА)49, делают удобные иммунизирующие антигены, поскольку их можно вводить непосредственно для иммунизации мышей без эмульсии. Адъювантные липиды эффективно стимулируют иммунный ответ у животных-хозяев, индуцируя антитела против белков целевой мембраны (рисунок 3А). Действительно, мы успешно индуцировали применимые антитела к проточной цитометрии путем иммунизации мышей протеолипосомой31, содержащей MPLA. Кроме того, протеолипосомы, приготовленные из биотинилированных липидов, являются идеальными зондами для скрининговых анализов. Мы разработали высокопроизводительный метод скрининга для отбора антимембранных белковых антител с использованием биотинилированных протеолипосом и AlphaScreen (метод BiLIA) (рисунок 3B)45. Сэндвич-ИФА также может быть легко изготовлен с использованием биотинилированных протеолипосом и пластин, покрытых стрептавидином.
Наконец, есть два важных предостережения, которые следует учитывать при использовании этого метода. Во-первых, образование дисульфидных связей может быть недостаточным из-за высоких концентраций DTT в буфере трансляции, которые, возможно, влияют на структуру некоторых видов мембранных белков15. Хотя дисульфидные связи способны образовываться после удаления восстановителя в процессе очистки, они, возможно, образуются в другой тип, а не в естественный. Другая заключается в том, что мембранные белки не являются гликозилированными. Ферменты, необходимые для гликозилирования, теоретически отсутствуют в бесклеточной системе, поскольку в процессе производства экстракта зародышей пшеницы биомембраны, включая Гольджи и ЭР, удаляются. Поскольку отсутствие дисульфидных связей и гликозилирования может вызывать различные конформации, следует тщательно рассмотреть и оценить экспериментальный дизайн, особенно когда посттрансляционные модификации имеют решающее значение для функциональной экспрессии белков в соответствии с экспериментальными целями.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Проектом платформы для поддержки открытия лекарств и исследований в области наук о жизни (Основа для поддержки инновационных исследований в области лекарств и наук о жизни (BINDS)) от AMED под номером гранта JP20am0101077. Эта работа также была частично поддержана грантом JSPS KAKENHI No 20K05709.
Материалы
| Name | Company | Catalog Number | Comments |
| ×3 SDS-PAGE sample buffer | Containing 10% 2-mercaptoethanol | ||
| 5-20% gradient SDS-PAGE gel | ATTO | E-D520L | |
| 70% ethanol | Diluted ethanol by ultrapure water. | ||
| Agarose | Takara Bio | ||
| Ammonium acetate | Nakalai tesque | 02406-95 | As this reagent is deliquescent, dissolve all of it in water once opened and store it at -30°C. |
| Ampicillin Sodium | Nakalai tesque | 02739-74 | |
| Asolectin Liposome, lyophilized | CellFree Sciences | CFS-PLE-ASL | A vial contains 10 mg of lyophilized liposomes. |
| BSA standard | 1000 ng, 500 ng, 250 ng, 125 ng BSA / 10 µL ×1 SDS-PAGE sample buffer | ||
| CBB gel stain | |||
| cDNA clone of interest | Plasmid harboring cDNA clone or synthetic DNA fragment | ||
| Chloroform | Nakalai tesque | 08402-84 | |
| Cooled incubator | Temperature ranging from 0 to 40 °C or wider. | ||
| Creatine kinase | Roche Diagnostics | 04524977190 | |
| Dialysis cup (0.1 mL) | Thermo Fisher Scientific | 69570 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 0.1 mL |
| Dialysis cup (2 mL) | Thermo Fisher Scientific | 88404 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 2 mL |
| DNA ladder marker | Thermo Fisher Scientific | SM0311 | GeneRuler 1 kb DNA Ladder |
| DpnI | Thermo Fisher Scientific | FD1703 | FastDigest DpnI |
| E. coli strain JM109 | |||
| Electrophoresis chamber | ATTO | ||
| Ethanol (99.5%) | Nakalai tesque | 14713-95 | |
| Ethidium bromide | |||
| Evaporation flask, 100 mL | |||
| Gel imager | |||
| Gel scanner | We use document scanner and LED immuninator as a substitute. | ||
| LB broth | |||
| Lipids of interest | Avanti Polar Lipids | ||
| Micro centrifuge | TOMY | MX-307 | |
| NTP mix | CellFree Sciences | CFS-TSC-NTP | Mixture of ATP, GTP, CTP, UTP, at 25 mM each |
| Nuclease-free 25 mL tube | IWAKI | 362-025-MYP | |
| Nucrease-free plastic tubes | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| Nucrease-free tips | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| PBS buffer | |||
| PCR purification kit | MACHEREY-NAGEL | 740609 | NucleoSpin Gel and PCR Clean-up |
| pEU-E01-MCS vector | CellFree Sciences | CFS-11 | |
| Phenol/chloroform/isoamyl alcohol (25:24:1) | Nippon Gene | 311-90151 | |
| Plasmid prep Midi kit | MACHEREY-NAGEL | 740410 | NucleoBond Xtra Midi |
| Primer 1 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CCAAGATATCACTAGnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, forward. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 2 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CCATGGGACGTCGACnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, reverse. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 3 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-GTCGACGTCCCATGGTTTTGTATAGAAT-3' Forward primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 4 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CTAGTGATATCTTGGTGATGTAGATAGGTG-3' Reverse primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 5 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CAGTAAGCCAGATGCTACAC-3’ Sequencing primer, forward |
| Primer 6 | Thermo Fisher Scientific | Custom oligo synthesis | 5’- CCTGCGCTGGGAAGATAAAC-3’ Sequencing primer, reverse |
| Protein size marker | Bio-Rad | 1610394 | Precision Plus Protein Standard |
| Rotary evaporator | |||
| seamless cloning enzyme mixture | New England BioLabs | E2611L | Gibson Assembly Master Mix Other seamless cloning reagents are also avairable. |
| SP6 RNA Polymerase & RNase Inhibitor | CellFree Sciences | CFS-TSC-ENZ | |
| Submarine Electrophoresis system | |||
| TAE buffer | |||
| Transcription Buffer LM | CellFree Sciences | CFS-TSC-5TB-LM | |
| Translation buffer | CellFree Sciences | CFS-SUB-SGC | SUB-AMIX SGC (×40) stock solution (S1, S2, S3, S4). Prepare ×1 translation buffer before use by mixing stock S1, S2, S3, S4 stock and ultrapure water. |
| Ultrapure water | We recommend to prepare ultrapure water by using ultrapure water production system every time you do experiment. Do not autoclave. We preparaed ultrapure water by using Milli-Q Reference and Elix10 system. Commercially available nuclease-free water (not DEPC-treated water) can be used as a substitute. Take care of contamination after open the bottle. | ||
| Ultrasonic homogenizer | Branson | SONIFIER model 450D-Advanced | Ultrasonic cleaner can be used as a substitute. |
| UV transilluminator | |||
| Vacuum desiccator | |||
| Wheat germ extract | CellFree Sciences | CFS-WGE-7240 | WEPRO7240 |
Ссылки
- Santos, R., et al. A comprehensive map of molecular drug targets. Nature Reviews. Drug Discovery. 16 (1), 19-34 (2017).
- Gusach, A., et al. Beyond structure: emerging approaches to study GPCR dynamics. Current Opinion in Structural Biology. 63, 18-25 (2020).
- Congreve, M., de Graaf, C., Swain, N. A., Tate, C. G. Impact of GPCR Structures on Drug Discovery. Cell. 181 (1), 81-91 (2020).
- Wilkinson, T. C. I. Discovery of functional monoclonal antibodies targeting G-protein-coupled receptors and ion channels. Biochemical Society Transactions. 44 (3), 831-837 (2016).
- Hino, T., Iwata, S., Murata, T. Generation of functional antibodies for mammalian membrane protein crystallography. Current Opinion in Structural Biology. 23 (4), 563-568 (2013).
- Webb, D. R., Handel, T. M., Kretz-Rommel, A., Stevens, R. C. Opportunities for functional selectivity in GPCR antibodies. Biochemical Pharmacology. 85 (2), 147-152 (2013).
- Douthwaite, J. A., Finch, D. K., Mustelin, T., Wilkinson, T. C. I. Development of therapeutic antibodies to G-protein coupled receptors and ion channels: Opportunities, challenges and their therapeutic potential in respiratory diseases. Pharmacology and Therapeutics. 169, 113-123 (2016).
- Hashimoto, Y., Yagi, K., Kondoh, M. Current progress in a second-generation claudin binder, anti-claudin antibody, for clinical applications. Drug Discovery Today. 21 (10), 1711-1718 (2016).
- Hutchings, C. J., Colussi, P., Clark, T. G. Ion channels as therapeutic antibody targets. mAbs. 11 (2), 265-296 (2019).
- Errey, J. C., Fiez-Vandal, C. Production of membrane proteins in industry: The example of GPCRs. Protein Expression and Purification. 169, 105569 (2020).
- Pandey, A., Shin, K., Patterson, R. E., Liu, X. Q., Rainey, J. K. Current strategies for protein production and purification enabling membrane protein structural biology. Biochemistry and Cell Biology. 94 (6), 507-527 (2016).
- Wiseman, D. N., et al. Expression and purification of recombinant G protein-coupled receptors: a review. Protein Expression and Purification. 167, 105524 (2020).
- Jeffery, C. J. Expression, Solubilization, and Purification of Bacterial Membrane Proteins. Current Protocols in Protein Science. 83 (1), 1-15 (2016).
- Spirin, A. S., Baranov, V. I., Ryabova, L. A., Ovodov, S. Y., Alakhov, Y. B. A continuous cell-free translation system capable of producing polypeptides in high yield. Science. 242 (4882), 1162-1164 (1988).
- Takai, K., Sawasaki, T., Endo, Y. Practical cell-free protein synthesis system using purified wheat embryos. Nature Protocols. 5 (2), 227-238 (2010).
- Endo, Y., Sawasaki, T. Cell-free expression systems for eukaryotic protein production. Current Opinion in Biotechnology. 17 (4), 373-380 (2006).
- Shimizu, Y., Kuruma, Y., Ying, B. W., Umekage, S., Ueda, T. Cell-free translation systems for protein engineering. The FEBS Journal. 273 (18), 4133-4140 (2006).
- Klammt, C., et al. Cell-free expression as an emerging technique for the large scale production of integral membrane protein. The FEBS Journal. 273 (18), 4141-4153 (2006).
- Nozawa, A., et al. A cell-free translation and proteoliposome reconstitution system for functional analysis of plant solute transporters. Plant and Cell Physiology. 48 (12), 1815-1820 (2007).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35-45 (2011).
- Henrich, E., Hein, C., Dotsch, V., Bernhard, F. Membrane protein production in Escherichia coli cell-free lysates. FEBS Letters. 589 (15), 1713-1722 (2015).
- Henrich, E., Peetz, O., et al. Analyzing native membrane protein assembly in nanodiscs by combined non-covalent mass spectrometry and synthetic biology. eLife. 6, 243 (2017).
- Shelby, M. L., He, W., Dang, A. T., Kuhl, T. L., Coleman, M. A. cell-free co-translational approaches for producing mammalian receptors: expanding the cell-free expression toolbox using nanolipoproteins. Frontiers in Pharmacology. 10, 744 (2019).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the United States of America. 116 (10), 4031-4036 (2019).
- Sackin, H., Nanazashvili, M., Makino, S. I. Direct injection of cell-free Kir1.1 protein into Xenopus oocytes replicates single-channel currents derived from Kir1.1 mRNA. Channels. 9 (4), 196-199 (2015).
- Zemella, A., Richter, T., Thoring, L., Kubick, S. A combined cell-free protein synthesis and fluorescence-based approach to investigate GPCR binding properties. Methods in Molecular Biology. 1947 (10), 57-77 (2019).
- Vaish, A., Guo, S., Murray, R. M., Grandsard, P. J., Chen, Q. On-chip membrane protein cell-free expression enables development of a direct binding assay: A curious case of potassium channel KcsA-Kv1.3. Analytical Biochemistry. 556, 70-77 (2018).
- Suzuki, Y., et al. Functional G-Protein-Coupled Receptor (GPCR) synthesis: the pharmacological analysis of Human Histamine H1 Receptor (HRH1) synthesized by a wheat germ cell-free protein synthesis system combined with asolectin glycerosomes. Frontiers in Pharmacology. 9, 38 (2018).
- Cortes, S., Barette, C., Beroud, R., De Waard, M., Schaack, B. Functional characterization of cell-free expressed Kv1.3 channel using a voltage-sensitive fluorescent dye. Protein Expression and Purification. 145, 94-99 (2018).
- Woznicka-Misaila, A., Juillan-Binard, C., Baud, D., Pebay-Peyroula, E., Ravaud, S. Cell-free production, purification and characterization of human mitochondrial ADP/ATP carriers. Protein Expression and Purification. 144, 46-54 (2018).
- Hashimoto, Y., et al. Engineered membrane protein antigens successfully induce antibodies against extracellular regions of claudin-5. Scientific Reports. 8 (1), 8383 (2018).
- Sawasaki, T., et al. A bilayer cell-free protein synthesis system for high-throughput screening of gene products. FEBS Letters. 514 (1), 102-105 (2002).
- Goshima, N., et al. Human protein factory for converting the transcriptome into an in vitro-expressed proteome. Nature Methods. 5 (12), 1011-1017 (2008).
- Nemoto, K., Takemori, N., Seki, M., Shinozaki, K., Sawasaki, T. Members of the plant CRK superfamily are capable of trans- and autophosphorylation of tyrosine residues. The Journal of Biological Chemistry. 290 (27), 16665-16677 (2015).
- Takeda, H., et al. Comparative analysis of human src-family kinase substrate specificity in vitro. Journal of Proteome Research. 9 (11), 5982-5993 (2010).
- Takahashi, H., et al. Establishment of a wheat cell-free synthesized protein array containing 250 human and mouse E3 ubiquitin ligases to identify novel interaction between E3 ligases and substrate proteins. PLoS One. 11 (6), 0156718 (2016).
- Nozawa, A., et al. Construction of a protein library of Arabidopsis transcription factors using a wheat cell-free protein production system and its application for DNA binding analysis. Bioscience, Biotechnology, and Biochemistry. 73 (7), 1661-1664 (2009).
- Goren, M. A., Nozawa, A., Makino, S. I., Wrobel, R. L., Fox, B. G. Cell-free translation of integral membrane proteins into unilamelar liposomes. Methods in Enzymology. 463, 647-673 (2009).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35 (2011).
- Renauld, S., et al. Functional reconstitution of cell-free synthesized purified Kv channels. Biochimica Et Biophysica Acta. Biomembranes. 1859 (12), 2373-2380 (2017).
- Liu, S., et al. Efficiency and Safety of CRAC Inhibitors in Human Rheumatoid Arthritis Xenograft Models. Journal of Immunology. 199 (5), 1584-1595 (2017).
- Jarecki, B. W., Makino, S. I., Beebe, E. T., Fox, B. G., Chanda, B. Function of shaker potassium channels produced by cell-free translation upon injection into xenopus oocytes. Scientific Reports. 3, 1-7 (2013).
- David, G., et al. Phosphorylation and alternative translation on wheat germ cell-free protein synthesis of the DHBV large envelope protein. Frontiers in Molecular Biosciences. 6, 138 (2019).
- Jirasko, V., et al. Proton-detected solid-state NMR of the cell-free synthesized α-helical transmembrane protein NS4B from hepatitis C virus. Chembiochem: A European Journal of Chemical Biology. 21 (10), 1453-1460 (2020).
- Takeda, H., et al. Production of monoclonal antibodies against GPCR using cell-free synthesized GPCR antigen and biotinylated liposome-based interaction assay. Scientific Reports. 5, 11333 (2015).
- Zhou, W., Takeda, H. Production of immunizing antigen proteoliposome using cell-free protein synthesis system. Methods in Molecular Biology. 1868, 49-67 (2018).
- Hutchings, C. J., Koglin, M., Marshall, F. H. Therapeutic antibodies directed at G protein-coupled receptors. mAbs. 2 (6), 594-606 (2010).
- Raetz, C. R. H., et al. Discovery of new biosynthetic pathways: the lipid A story. Journal of Lipid Research. 50, 103-108 (2009).
- Baldridge, J. R., Crane, R. T. Monophosphoryl lipid A (MPL) formulations for the next generation of vaccines. Methods. 19 (1), 103-107 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены