Method Article
막 단백질을 표적으로 하는 기능 분석 및 항체 개발을 위한 프로테올리포좀의 무세포 생산
요약
이 프로토콜은 밀 무세포 시스템 및 리포좀을 사용하는 이중층 투석 방법에 의한 고품질 프로테올리포좀의 생산을 위한 효율적인 무세포 방법을 설명합니다. 이 방법은 막 단백질의 기능 분석, 약물 표적 스크리닝 및 항체 개발에 적합한 수단을 제공합니다.
초록
막 단백질은 다양한 세포 과정에서 필수적인 역할을 하며 중요한 기능을 수행합니다. 막 단백질은 모든 약물의 절반 이상을 표적으로 삼기 때문에 약물 발견에서 의학적으로 중요합니다. 막 단백질의 생화학적, 생물물리학적, 구조적 연구와 항체 개발의 걸림돌은 정확한 형태와 활성을 가진 고품질 막 단백질을 대량으로 생산하는 데 어려움이 있다는 것입니다. 여기에서는 밀 배아 무세포 시스템, 리포좀 및 투석 컵을 사용하여 막 단백질을 효율적으로 합성하고 높은 성공률로 단시간에 정제된 프로테올리포좀을 제조하는 "이중층 투석 방법"에 대해 설명합니다. 막 단백질은 GPCR, 이온 채널, 수송체 및 테트라스파닌과 같은 수 밀리그램만큼 생산될 수 있습니다. 이 무세포 분석법은 고품질 프로테올리포좀을 제조하는 데 드는 시간, 비용 및 노력을 줄이는 데 기여하며 막 단백질의 기능 분석, 약물 표적 스크리닝 및 항체 개발에 적합한 수단을 제공합니다.
서문
막 단백질은 진단 및 치료에서 가장 중요한 약물 표적 중 하나입니다. 실제로, 작은 복합 약물 표적의 절반은 막 단백질, 예를 들어 G- 단백질 결합 수용체 (GPCR) 및 이온 채널1입니다. 수년에 걸쳐 연구자들은 막 단백질의구조와 기능을 밝히기 위해 생화학적, 생물물리학적, 구조적 연구를 수행해 왔습니다2,3. 막 단백질에 대한 단일 클론 항체의 개발은 기능적 및 구조적 연구를 가속화하고 치료 및 진단 응용 프로그램 4,5,6,7,8,9를 개발하기 위해 적극적으로 수행됩니다. 이러한 모든 연구는 다량의 고품질 막 단백질을 필요로합니다10. 예를 들어, 항체 발달을 위해서는 자연적인 형태를 가진 수 밀리그램의 정제 된 막 단백질이 필요합니다. X선 결정학에는 훨씬 더 많은 양의 고도로 정제된 막 단백질이 필요합니다. 그러나 막 단백질의 대량 생산은 막 단백질 연구11에서 병목 현상으로 남아 있습니다. 막 단백질은 하나 이상의 막 횡단 나선과 복잡한 구조를 가지며 세포 항상성에서 중요한 역할을합니다. 막 단백질의 이종 과발현은 높은 국소 농도로 축적되는 막 단백질의 응집 또는 세포 신호 경로의 교란과 같은 여러 장애물을 유발합니다. 발현이 성공적이더라도 샘플 준비의 후속 단계도 어려움에 직면합니다. 예를 들어, 프로테올리포좀의 제조에는 막 단백질의 가용화, 정제 및 안정화에 대한 높은 수준의 기술과 전문적인 경험이 필요하며 많은 노력과 시간이 소요됩니다12,13.
다른 한편으로, 최근 수십 년 동안 살아있는 세포14,15,16,17,18을 사용하지 않고 단백질을 생산하기 위해 일부 첨단 기술이 등장했습니다. 무세포 단백질 합성 기술은 시험관에서 번역 반응을 재구성합니다. 세포 발현 시스템이 갖는 제한이 없기 때문에, 무세포 시스템은 발현하기 어렵거나 세포에서 독성을 나타내기 어려운 다양한 단백질을 합성할 가능성이 있다. 정제된 세포 추출물 또는 재구성된 번역 기계는 주형 mRNA, 아미노산 및 에너지원과 혼합되고 재조합 단백질은 짧은 시간 내에 합성됩니다. 막 단백질 합성과 관련하여, 리포좀, 비셀, 나노디스크, 또는 공중합체와 같은 지질 또는 양친매성으로 구성된 일부 종류의 스캐폴드가 무세포 반응에 첨가된다 19,20,21,22,23,24. 합성된 막 단백질은 스캐폴드와 상호작용하고 물에서 안정화될 수 있다. 무세포 합성 막 단백질은 기능 연구 및 항체 생산 25,26,27,28,29,30,31에 널리 사용된다.
이 프로토콜에서, 우리는 밀 무세포 시스템 및 리포좀을 사용하는 프로테올리포좀 생산의 효율적인 무세포 방법을 설명한다. 밀 무세포 단백질 합성 시스템은 밀 배아15,32,33에서 추출한 추출물을 사용하는 강력한 시험관 내 번역 시스템입니다. 밀 배아는 많은 양의 번역 기계와 번역 억제제를 거의 포함하지 않습니다. 진핵생물의 구성원인 밀의 번역 기계는 진핵 단백질을 번역하는 데 적합하며, 그 번역 효율은 주형 mRNA의 코돈 사용에 거의 영향을 받지 않습니다. 밀 무 세포 시스템을 사용하여 단백질 키나아제 34,35, 유비퀴틴 리가 아제36, 전사 인자37 및 성공률이 높은 막 단백질을 포함한 다양한 단백질을 합성했습니다. 막 단백질 생산을 위해, 우리는 스캐폴드19,38로서 번역 혼합물에 지질 소포 리포좀을 첨가한다. 막 단백질의 소수성 도메인은 지질 이중층과 상호 작용하며 리포솜과 자발적으로 통합됩니다. 밀도 구배 원심분리는 번역 반응 혼합물의 일반적인 원심분리가 프로테올리포솜(20)의 단순 정제에 충분함에도 불구하고 내인성 밀 단백질로부터 프로테올리포좀을 엄격하게 분리하는 데 사용됩니다. 많은 종류의 일체형 막 단백질이 밀 무 세포 시스템을 사용하여 합성되었으며 다양한 연구 및 개발 25,38,39,40,41,42,43,44에 적용되었습니다. 또한, 우리는 대규모 생산45,46을위한 "이중층 투석 방법"을 개발했습니다. 이 방법에서는 컵형 투석 장치를 기질 공급 완충액에 침지하고, 그림 1과 같이 컵에 2층의 번역 반응 혼합물과 기질 공급 완충액을 형성한다. 기질의 지속적인 공급 및 부산물 제거는 반응 혼합물의 상단과 하단 모두에서 장시간 효율적으로 수행될 수 있어 우수한 번역 효능을 제공합니다(그림 2A 및 그림 2B)45.
프로토콜
1. pEU 발현 플라스미드의 제조
참고: pEU 발현 플라스미드는 단편에서 시작 코돈, 표적 막 단백질의 개방 판독 프레임 및 정지 코돈을 포함해야 합니다( 그림 1 참조). 필요한 경우 적절한 위치에 검출/정제 태그 시퀀스를 추가합니다. 제한 효소 소화 또는 원활한 클로닝은 서브클로닝에 적용할 수 있습니다. 여기서는 원활한 복제 방법을 사용하는 프로토콜에 대해 설명합니다.
- 삽입 DNA 단편을 준비하십시오.
- cDNA 주형, 프라이머 1 및 프라이머 2를 사용하여 PCR에 의해 관심 유전자를 증폭한다. 프라이머 1 및 프라이머 2는 원활한 클로닝을 위해 각각 15bp 중첩을 포함합니다( 재료 표 참조).
참고: 세포의 성숙 단백질에서 처리 및 제거될 서열(예: 신호 서열)을 포함하지 마십시오. 합성된 단백질의 처리는 밀 무세포 시스템에서는 수행되지 않는다. Kozak 시퀀스를 추가하지 마십시오. pEU-E01-MCS 벡터에는 E01 번역 증강제가 있습니다. - 1/25 부피의 DpnI 제한 효소를 PCR 산물에 추가하여 주형 플라스미드 DNA를 제거합니다. 37°C에서 30분 동안 배양합니다.
- PCR 정제 키트를 사용하여 PCR 산물을 정제하고 농도를 20–50 ng/μL로 조정합니다.
- cDNA 주형, 프라이머 1 및 프라이머 2를 사용하여 PCR에 의해 관심 유전자를 증폭한다. 프라이머 1 및 프라이머 2는 원활한 클로닝을 위해 각각 15bp 중첩을 포함합니다( 재료 표 참조).
- pEU-E01-MCS 벡터를 선형화합니다.
- pEU-E01-MCS, 프라이머 3 및 프라이머 4를 사용하여 역 PCR을 수행합니다.
- 1/25 부피의 DpnI 제한 효소를 역 PCR 산물에 추가합니다. 37°C에서 30분 동안 배양합니다.
- PCR 정제 키트를 사용하여 제조업체의 권장 사항에 따라 PCR 제품을 정제합니다. 농도를 20–50 ng/μL로 조정합니다.
- 2μL의 삽입 DNA 단편, 2μL의 선형화된 벡터 및 4μL의 2x 이음매 없는 클로닝 효소 혼합물을 혼합합니다.
- 원활한 클로닝 제품으로 대장균 균주 JM109를 변형시킵니다. 스프레더를 사용하여 LB- 암피실린 한천 플레이트에 박테리아 현탁액을 펼칩니다.
참고: pEU 벡터에는 암피실린 내성 마커가 있습니다. - pEU 플라스미드에서 MCS의 5' 및 3' 측으로부터 프라이머 5 및 프라이머 6을 사용하여 구축된 발현 플라스미드의 서열을 각각 확인하였다.
- 발현 플라스미드를 증폭하고 정제한다.
- 플라스미드-형질전환 된 대장균 균주 JM109를 LB-암피실린 배지 150mL에서 37°C에서 밤새 분당 125회 진탕하여 배양하였다.
- 시판되는 플라스미드 프렙미디 키트를 사용하여 플라스미드를 추출하고 정제한다. 플라스미드를 500μL의 TE 완충액에 용해시킨다.
주의: 플라스미드 추출을 위해 미니 준비 키트를 사용하지 마십시오. 그것은 플라스미드의 충분한 품질과 양을 제공하지 않습니다. - 500μL의 페놀/클로로포름/이소아밀 알코올을 추가합니다(25:24:1). 5분 동안 격렬하게 혼합하고 17,800 x g 및 실온에서 5분 동안 원심분리합니다. 상부 플라스미드 용액을 새 튜브로 옮깁니다.
주의 : 페놀과 클로로포름으로부터 피부를 보호하기 위해 일회용 장갑을 착용하십시오.
참고: 플라스미드 추출 키트에서 RNase의 오염을 제거하려면 페놀-클로로포름 정제를 사용하여 플라스미드를 정제하십시오. - 클로로포름 500μL를 첨가하여 페놀을 완전히 제거합니다. 5분 동안 격렬하게 혼합하고 17,800 x g 및 실온에서 5분 동안 원심분리합니다. 상부 플라스미드 용액을 새 튜브로 옮깁니다.
- 2.5 부피의 에탄올과 1/8 부피의 7.5 M 암모늄 아세테이트를 추가하고 -30 °C에서 1 시간 동안 보관하십시오.
- 4°C에서 17,800 x g 로 10분 동안 원심분리합니다. 펠릿을 500 μL의 70 % 에탄올로 세척하십시오. 상청액을 조심스럽게 제거하고 펠릿을 5분 동안 그대로 두어 건조시킵니다.
- 발현 플라스미드를 100μL의 초순수에 완전히 용해시킨다. 260 nm에서 흡광도로 플라스미드의 농도를 측정한다. 농도를 1 mg / mL로 조정하십시오.
2. 시험관 내 전사
주의: 전사 및 번역 단계에서 DNase 및 뉴클레아제가 없는 플라스틱 튜브와 팁을 사용하십시오. 오염을 방지하기 위해 플라스틱 제품을 고압 멸균하지 마십시오.
- 새 플라스틱 튜브에서 초순수를 수확하십시오.
주의 : 잔류 DEPC는 반응을 강력하게 억제하므로 DEPC 처리 된 물을 사용하지 마십시오. 전사 및 번역을 위해 신선하게 정제된 초순수를 사용하십시오. - 115.2μL의 초순수, 40μL의 전사 버퍼 LM, 20μL의 NTP 혼합물, 2.4μL의 80U/μL RNase 억제제, 2.4μL의 80U/μL SP6 중합효소 및 20μL의 1mg/mL pEU 발현 플라스미드를 혼합하여 전사 반응 혼합물을 준비합니다. 시약을 뒤집어 부드럽게 혼합하십시오. 빠른 회전을 수행하십시오.
- 전사 반응을 37°C에서 6시간 동안 배양합니다.
- 반전하여 반응을 부드럽게 혼합하고 빠르게 회전시킵니다. 번역을 위해 즉시 사용하고, 그렇지 않으면 -80 °C에서 동결 및 보관하십시오.
- 전기 영동으로 전사 생성물을 확인하십시오.
- 1x TAE 완충액 100mL와 아가로스 1g을 혼합합니다. 이 현탁액을 전자레인지에서 가열하여 1% 아가로스 TAE 겔을 제조하였다.
- 1μL의 전사 반응을 취하여 3μL의 물과 4μL의 2x 로딩 염료와 혼합합니다.
참고: RNA의 변성은 필요하지 않습니다. - 4 μL의 혼합물 및 2 μL의 DNA 래더 마커를 아가로스 TAE 겔에 로딩한다.
- 100V에서 20 분 동안 전기 영동.
- 에티듐 브로마이드에 젤을 30분 동안 염색합니다. UV 투과 조명기와 젤 이미저를 사용하여 mRNA의 사다리 밴드 패턴을 확인합니다.
참고: 500bp 미만의 번진 밴드가 관찰되면 mRNA 분해가 의심됩니다.
3. 번역 자료 준비
- 번역 버퍼를 준비합니다.
- 50mL 튜브에 새로 준비된 초순수 27mL와 S1, S2, S3 및 S4용 각 40x 원액 0.75mL를 혼합합니다.
참고: 1x 변환 버퍼의 최종 필요한 양에 따라 재료의 양을 조절합니다.
주의 : 사용 후 여분의 1x 변환 버퍼를 보관하거나 다시 얼리지 마십시오.
- 50mL 튜브에 새로 준비된 초순수 27mL와 S1, S2, S3 및 S4용 각 40x 원액 0.75mL를 혼합합니다.
- 크레아틴 키나아제 원액을 준비하십시오. 동결건조된 크레아틴 키나아제를 초순수에 최종 농도 20mg/mL까지 용해시킵니다. 0.2mL 8-스트립 PCR 튜브에 소량(각각 10 - 50μL)의 용액을 분주합니다. 튜브를 액체 질소로 동결시키고 -80 °C에서 보관하십시오.
주의 : 해동 후 크레아틴 키나아제 용액을 다시 얼리지 마십시오. - 투석 컵(0.1mL 크기)을 세척하여 투석막에서 글리세롤을 제거합니다.
참고: 여러 가지 크기의 투석 컵이 있습니다. 소형 컵(0.1mL)은 소규모 테스트(섹션 5.4)에 사용되고 대형 컵(2mL)은 대규모 생산(섹션 5.5)에 각각 사용됩니다. 대형 컵의 투석막의 세척 단계는 피할 수 있습니다.- 1mL의 초순수를 새 1.5mL 튜브에 넣습니다. 작은 크기의 투석 컵(0.1mL)을 튜브에 삽입합니다. 컵에 초순수 0.5mL를 넣습니다.
- 실온에서 30분 이상 배양합니다.
4. 리포좀의 제조
참고: 여기에서는 리포좀 준비를 위한 두 가지 프로토콜을 설명합니다. 하나는 바로 사용할 수있는 동결 건조 된 리포좀 (섹션 4.1)을 사용하는 반면, 다른 하나는 얇은 지질 필름을 수화 (섹션 4.2)하여 리포좀을 생성합니다.
- 동결건조된 리포좀을 사용하여 리포좀을 제조한다.
참고: 프로테올리포좀을 생산하는 더 쉬운 방법은 시중에서 판매되는 아솔렉틴 리포좀을 사용하는 것입니다. 아솔렉틴은 콩에서 추출한 천연 지질의 일종입니다.- 동결건조된 아솔렉틴 리포좀 10mg이 들어 있는 바이알( 재료 표 참조)을 열고 200μL의 번역 완충액(섹션 3.1)을 바이알 바닥에 추가합니다. 바이알을 밀봉하고 10분 동안 배양합니다.
- 바이알을 와류 믹서에 1 분 동안 올려 놓고 격렬하게 혼합합니다.
- 바이알을 50mL 튜브에 삽입합니다. 500 x g 에서 1분 동안 원심분리하여 튜브를 회전시킵니다.
- 피펫을 사용하여 아솔렉틴 리포좀 현탁액(50mg 지질/mL)을 새 1.5mL 튜브로 옮깁니다. 번역을 위해 즉시 리포좀을 사용하고, 그렇지 않으면 액체 질소에서 동결하고 -80 °C에서 보관하십시오.
- 얇은 지질 필름에 수분을 공급하여 리포좀을 준비합니다.
- 지질이 분말 형태로 판매되는 경우 클로로포름 또는 적절한 유기 용매에 10-100 mg / mL 농도로 녹입니다.
참고: 얇은 지질 필름은 정제 및/또는 합성된 양친매성 지질을 사용하여 제조할 수 있습니다. 아솔렉틴의 정제 방법은 앞서 설명하였다38. 기능적으로 변형된 지질, 예컨대 비오티닐화 지질, 형광 지질 및 보조 지질은 기능성 리포좀을 생성하기 위해 기저 지질에 첨가될 수 있다. - 50mg의 지질을 함유한 지질 용액을 증발 플라스크로 옮깁니다.
- 회전 증발기를 사용하여 용매를 증발시키고 플라스크 바닥의 벽에 지질을 고르게 펴서 지질 박막을 형성합니다.
- 플라스크를 진공 데시케이터에 넣고 밤새 음압 하에 두어 용매를 완전히 제거합니다.
- 증발 플라스크에 1mL의 번역 버퍼를 추가합니다. 플라스크를 회전시켜 얇은 지질 필름 위에 완충액을 퍼뜨립니다. 필름에 수분을 공급하기 위해 5분 동안 배양합니다.
- 초음파 균질화 기 또는 초음파 세척기로 플라스크를 초음파 처리하십시오. 용액이 필름에 완전히 닿을 수 있도록 때때로 플라스크의 각도를 변경하십시오. 얇은 지질 필름이 바닥에서 벗겨지고 완전하고 균질하게 유화되었는지 확인하십시오.
참고: 리포좀을 포함하는 비오틴화 지질의 전자 현미경 사진은 그림 1에 나와 있습니다. - 리포좀 현탁액(50mg 지질/mL)을 새 1.5mL 튜브로 옮깁니다. 즉시 사용하지 않을 경우에는 리포좀을 액체 질소에 동결시키고 -80°C에서 보관한다.
- 지질이 분말 형태로 판매되는 경우 클로로포름 또는 적절한 유기 용매에 10-100 mg / mL 농도로 녹입니다.
5. 시험관 내 번역
- 밀 배아 추출물을 실온에서 몇 분 동안 물에 떠서 빠르게 해동하십시오. 해동 후 즉시 튜브를 뒤집어 부드럽게 혼합하고 스핀 다운하고 사용할 때까지 얼음에서 식히십시오.
알림: 사용 후 밀 배아 추출물을 액체 질소에 동결하고 -80 ° C에서 보관하십시오. 여러 번의 동결/해동 주기를 견뎌냅니다. - 20 mg / mL 크레아틴 키나아제 원액을 해동. 5 μL의 원액과 45 μL의 번역 완충액을 혼합하여 2 mg / mL 크레아틴 키나아제 작업 용액을 준비합니다.
주의 : 크레아틴 키나아제 재 냉동은 권장하지 않습니다. - 필요한 경우 리포좀 또는 mRNA를 해동합니다.
- 소규모 단백질 번역을 수행하십시오.
- 단계 3.3.2에서 준비한 대로 튜브와 투석 컵(0.1mL) 모두에서 물을 제거합니다.
- 튜브와 투석 컵에 각각 1mL 및 300μL의 번역 버퍼를 주입합니다.
주의: 투석 컵의 바닥이 1.5mL 튜브의 번역 버퍼 표면에 닿지 않는 경우 튜브에 50–100μL의 버퍼를 추가로 주입합니다. - 15.6μL의 번역 완충액, 2.4μL의 2mg/mL 크레아틴 키나제, 12μL의 50mg/mL 리포좀, 15μL의 밀 배아 추출물 및 15μL의 mRNA를 혼합하여 번역 반응 혼합물을 준비합니다. 튜브를 뒤집어 부드럽게 혼합하고 스핀 다운합니다.
- 200 μL 피펫을 사용하여 번역 반응 혼합물 60 μL를 흡인한다.
- 피펫 팁을 투석 컵의 번역 버퍼 아래쪽에 삽입합니다. 반응 혼합물을 천천히 부드럽게 피펫팅합니다. 증발을 방지하기 위해 투석 컵을 뚜껑으로 덮으십시오.
알림: 반응 혼합물은 컵 바닥으로 자연스럽게 가라앉고 이중층을 형성합니다. 컵을 혼합하거나 흔들어 이중층을 방해하지 마십시오.
- 대규모 번역을 수행합니다(그림 1).
- 25mL 튜브에 번역 버퍼 22mL를 붓습니다. 대형 투석 컵(2mL)을 튜브에 넣고 컵에 번역 버퍼 2mL를 추가합니다.
- 130 μL의 번역 완충액, 2 mg/mL 크레아틴 키나아제 20 μL, 50 mg/mL 리포좀 100 μL, 125 μL의 밀 배아 추출물 및 125 μL의 mRNA를 혼합하여 번역 반응 혼합물을 준비합니다. 피펫팅으로 부드럽게 섞습니다.
- 모든 번역 반응 혼합물(500 μL)을 1,000 μL 피펫을 사용하여 흡인한다. 번역 반응 혼합물을 단계 5.4.5에 기재된 것과 동일한 방법으로 투석 컵에 주입한다. 증발을 방지하기 위해 투석 컵을 뚜껑으로 덮으십시오.
- 반응물을 15°C에서 24시간 동안 배양합니다.
- 피펫팅으로 투석 컵에서 반응을 잘 혼합합니다. 조잡한 프로테올리포좀 현탁액을 새 튜브로 옮깁니다.
참고: 바닥이 평평한 1.5mL 튜브를 사용하여 소규모 번역에서 프로테올리포좀을 수집하는 것이 좋습니다. 원심분리 후, 리포좀은 튜브의 바닥 모서리에 작고 쉽게 볼 수 있는 펠릿을 형성합니다.
6. 프로테올리포좀의 정제
- 조 프로테올리포좀 현탁액이 들어 있는 튜브를 4°C에서 17,800 x g 에서 10분 동안 원심분리합니다.
- 상청액을 제거하십시오. 프로테올리포좀 펠렛을 피펫팅에 의해 PBS(소규모: 1mL, 대규모: 10mL)에 현탁시킨다.
- 다른 두 개의 원에 대해 프로테올리포좀의 원심분리 및 세척을 반복합니다.
- 세척 후 소량의 PBS를 넣고 피펫팅으로 프로테올리포좀 펠릿을 잘 재현탁합니다. 마이크로 피펫을 사용하여 현탁액의 부피를 측정합니다. PBS를 추가하여 부피를 60μL(소규모) 또는 500μL(대규모)로 조정합니다. 현탁액을 새 1.5mL 튜브로 옮깁니다.
- 10μL의 프로테오리포좀 현탁액을 SDS-PAGE용 새 PCR 튜브로 옮깁니다. 필요할 때 사용할 수 있도록 나머지 샘플을 더 작은 부분으로 나눕니다. 액체 질소에서 동결하고 -80 °C에서 보관하십시오.
7. SDS-PAGE 및 CBB 염색
- 70μL의 물과 40μL의 3x SDS-PAGE 샘플 버퍼를 10μL의 프로테올리포좀 현탁액에 추가합니다.
주의 : 막 단백질이 응집되므로 SDS-PAGE 샘플을 끓이지 말고 전기 영동에서 아크릴 아미드 겔에 거의 침투하지 마십시오. 또한 산화를 방지하기 위해 SDS-PAGE 샘플 버퍼(예: 3% 최종 농도의 2-메르캅토에탄올)에 충분한 환원제를 첨가합니다. - 전기영동 챔버에서 5%-20% 그래디언트 SDS-PAGE 겔을 설정합니다. 3 μL, 6 μL, 12 μL의 프로테올리포좀 샘플, 2 μL의 단백질 크기 마커 및 BSA 표준 시리즈도 로드합니다.
- 52 mA, 400 V에서 30 분 동안 전기 영동.
- CBB 염료로 젤을 1 시간 동안 염색하십시오. 뜨거운 물에서 탈색하고 젤 이미지를 스캔합니다.
- NIH Image J 소프트웨어(https://imagej.nih.gov/ij/)를 사용하여 각 레인에서 막 단백질의 밴드 강도를 정량화합니다. BSA 표준 시리즈로 합성된 막 단백질의 양을 추정합니다.
결과
이 프로토콜을 사용하면 부분적으로 정제 된 프로테올리포좀을 짧은 시간 내에 얻을 수 있습니다. 대표적인 결과를 도 2A에 나타내었다. 클래스 A, B 및 C의 25 개의 GPCR을 이중층 투석 방법 (소규모)을 사용하여 성공적으로 합성하고 원심 분리 및 완충액 세척에 의해 부분적으로 정제했습니다. 합성된 단백질의 양은 단백질의 종류에 따라 다르지만, 일반적으로 대형 투석 컵을 사용할 때 반응당 50-400μg의 막 단백질을 합성할 수 있습니다. 밀 세포가없는 시스템의 높은 확장 성으로 인해 반응 수를 증가시켜 수 밀리그램의 막 단백질을 쉽게 생산할 수 있습니다. 작은 투석 컵을 사용한 사전 테스트는 이중층 투석 방법에서 표적 단백질의 생산 효능을 결정하기에 충분합니다. 얻어진 생산성에 따라, 대형 투석 컵을 사용하여 제조되는 타겟 단백질의 양을 추정할 수 있다.
이 프로토콜은 막 단백질의 발현, 특히 여러 개의 막 횡단 나선을 가진 단백질에 적합합니다. 대부분의 경우, 3개 이상의 막횡단 나선을 갖는 막 단백질은 합성 후 프로테올리포좀에 쉽게 통합되며(그림 2B), 이는 프로테올리포좀의 생산성을 좋게 만든다. 단일 막 횡단 나선 단백질은 일반적으로 원활하게 합성됩니다. 그러나 작은 소수성 영역으로 인해 리포좀에 거의 통합되지 않습니다. 두 개의 막 횡단 나선을 가진 단백질과 관련하여 리포솜에 고정되어 있는지 여부는 막 횡단 나선이 노출되는 방식에 따라 다릅니다.
합성 된 프로테올리포좀은 간단한 원심 분리에 의해 수집되고 세척 완충액으로 부분적으로 정제되어 막 단백질의 정제 과정을 크게 단축시킵니다. 생물학적 막과 막 단백질이 밀 배아 추출물에서 미리 제거되었지만, 소량의 밀 단백질은 때때로 리포좀 또는 합성 된 막 단백질에 결합하여 공동 침전됩니다 (그림 2A). 이러한 단백질 오염물질은 단순한 원심분리 및 완충액 세척으로 제거하기 어렵다. 고도로 정제된 막 단백질이 필요한 경우, 부분적으로 정제된 프로테오리포좀을 계면활성제로 가용화하고 컬럼 크로마토그래피로 정제해야 합니다.

그림 1: 무세포 프로테올리포좀 생산 계획. SP6, SP6 프로모터 서열; E01, E01 번역 증강제 서열; Ampr, 암피실린 내성 유전자; DTT, 디티오트레이톨. 전자 현미경 사진은 리포좀을 함유하는 비오티닐화 지질의 면역금 표지를 보여준다. 바, 0.2 μm. 이 전자 현미경 사진 이미지는 도 1D 의 Takeda et al., 201545에서 가져온 것이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
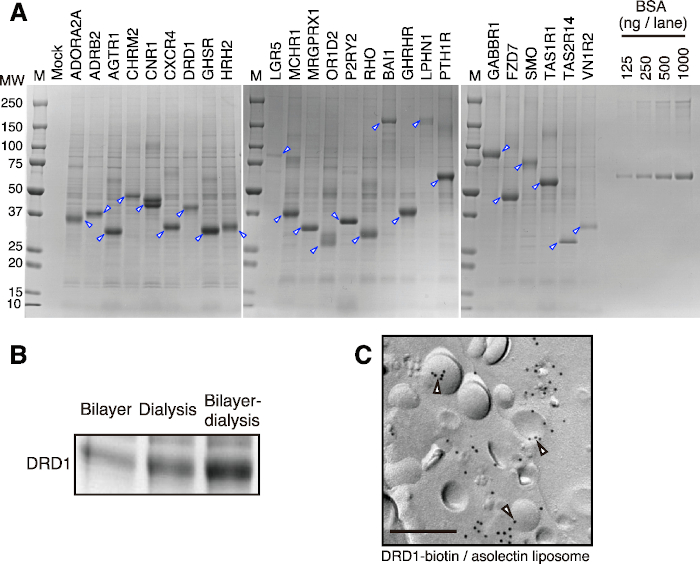
그림 2: 이중층 투석법에 의한 프로테올리포좀 생산의 대표적인 결과. (A) 무세포 합성 GPCR의 SDS-PAGE 이미지. 25개의 선택된 GPCR을 이중층-투석 방법에 의해 합성하였다. 프로테올리포좀을 부분적으로 정제하여 SDS-PAGE 및 CBB 염색에 적용하였다. 화살촉은 표적 GPCR을 나타냅니다. (B) 서로 다른 번역 방법 간의 막 단백질 생산 비교. 도파민 수용체 D1(DRD1) 단백질은 각각 밀배아 추출물, 리포좀 및 mRNA를 동일한 비율로 각각의 방법으로 합성하였다. DRD1 프로테올리포좀을 원심분리에 의해 부분적으로 정제하고, SDS-PAGE 및 CBB 염색을 실시하였다. (C) DRD1- 비오틴 / 리포좀 복합체의 면역 금 표지. DRD1은 BirA 비오틴 리가아제에 의해 효소적으로 비오티닐화되었다. 바, 0.2 μm. 빈 화살촉은 리포좀의 DRD1-비오틴을 나타냅니다. 이 수치는 Takeda et al., 201545의 그림 1에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
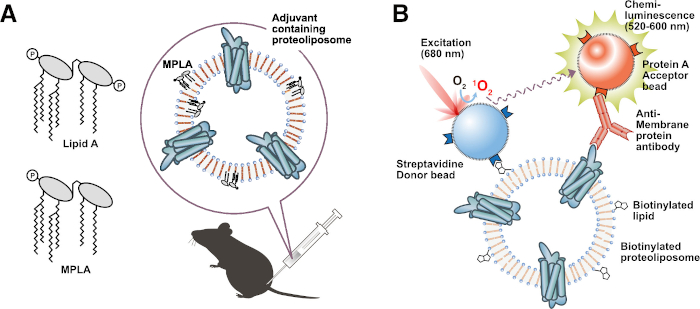
그림 3: 기능성 프로테올리포좀의 적용. (a) 보조제 지질 함유 프로테올리포좀의 면역화. (B) 비오틴화 리포좀 기반 상호작용 분석(BiLIA). 막 단백질과 항막 단백질 항체 사이의 상호작용은 알파스크린에 의해 검출되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
제시된 프로토콜은 높은 성공률로 막 단백질을 생산하는 방법을 제공한다. 이 프로토콜은 간단하고 재현성이 높으며 확장하기 쉽습니다. 또한 많은 양의 막 단백질을 소비하는 실험의 시간과 비용을 줄일 수 있는 잠재력이 있습니다. 이중층 투석 방법은 이중층 방법 또는 투석 방법에 비해 생산성을 4-10배 향상시킵니다(그림 2B)45. 극단적 인 경우, 이온 채널 및 수송 체의 수율은 이중층 방법보다 이중층 투석 방법으로 각각 30 배 및 20 배 증가했다 (데이터는 표시되지 않음). 이 프로토콜의 높은 생산성은 면역화를위한 항원 생산에 유리합니다. 프로테올리포좀은 종종 항막 단백질 항체의 개발을 위한 면역화 항원으로 사용됩니다. 프로테올리포좀에 내장된 고농축 및 정제된 막 단백질은 면역 반응을 효과적으로 자극하고 항체를 유도합니다41,47. 이 이중층 투석 방법을 사용하면 면역 목적으로 수 밀리그램의 막 단백질을 운반하는 프로테올리포좀을 며칠 만에 쉽게 제조할 수 있습니다. 실제로, 우리 그룹은이 프로토콜을 사용하여 GPCR, 이온 채널 및 클로딘을 합성하고 마우스에 제품을 면역화하여 31,41,45에 대한 단일 클론 항체를 얻었습니다. 수득된 단클론 항체 중 일부는 고친화성 항체, 형태감응 항체, 유세포분석 적용 항체 및 억제 항체와 같은 기능성 항체로 검증되었으며, 이는 이 프로토콜이 기능적으로 정확한 형태를 갖는 막 단백질을 생산할 수 있음을 나타냅니다.
이 프로토콜의 또 다른 매력적인 이점은 비오티닐화 지질, 형광 지질 또는 보조 지질과 같은 변형된 지질을 사용하여 특정 기능이 할당된 프로테올리포좀의 생산을 허용하는 것입니다. 특정 기능을 가진 준비된 프로테오리포좀은 유용하며 광범위한 실험에 적용 할 수 있습니다. 예를 들어, 지질A48 또는 모노포스포릴 지질 A(MPLA)49와 같은 보조 지질 함유 프로테올리포좀은 에멀젼 없이 마우스를 면역화하기 위해 직접 투여될 수 있기 때문에 편리한 면역화 항원을 만듭니다. 보조 지질은 숙주 동물의 면역 반응을 효과적으로 자극하여 표적 막 단백질에 대한 항체를 유도합니다(그림 3A). 실제로, 우리는 MPLA 함유 프로테올리포좀31로 마우스를 면역화함으로써 유세포분석 적용 가능한 항체를 성공적으로 유도하였다. 또한, 비오틴화 지질로부터 제조된 프로테오리포좀은 스크리닝 분석에 이상적인 프로브이다. 우리는 비오티닐화 프로테올리포좀과 AlphaScreen(BiLIA 방법)을 사용하여 항막 단백질 항체를 선택하기 위한 고처리량 스크리닝 방법을 개발했습니다(그림 3B)45. 샌드위치 ELISA는 또한 비오티닐화 프로테올리포좀과 스트렙타비딘 코팅 플레이트를 사용하여 쉽게 구성할 수 있습니다.
마지막으로, 이 방법을 사용할 때 해결해야 할 두 가지 중요한 주의 사항이 있습니다. 첫째, 이황화 결합의 형성은 번역 완충액 내의 DTT의 높은 농도로 인해 불충분 할 수 있으며, 이는 일부 종류의 막 단백질(15)의 구조에 영향을 미칠 수있다. 이황화 결합은 정제 과정에서 환원제가 제거 된 후에 형성 될 수 있지만 천연 결합이 아닌 다른 유형으로 형성 될 수 있습니다. 다른 하나는 막 단백질이 당화되지 않는다는 것입니다. 글리코 실화에 필요한 효소는 밀 배아 추출물이 생성되는 과정에서 골지체와 ER을 포함한 생물막이 제거되기 때문에 이론적으로 무 세포 시스템에는 없습니다. 이황화 결합의 부족과 글리코실화는 다른 형태를 유발할 수 있으므로, 특히 번역 후 변형이 실험 목적에 따라 단백질의 기능적 발현에 중요한 경우 실험 설계에 신중한 고려와 평가가 제공되어야 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 보조금 번호 JP20am0101077에 따라 AMED의 약물 발견 및 생명 과학 연구 지원을 위한 플랫폼 프로젝트(혁신적인 약물 발견 및 생명 과학 연구(BINDS) 지원을 위한 기반)의 지원을 받았습니다. 이 작업은 JSPS KAKENHI 보조금 번호 20K05709에 의해 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| ×3 SDS-PAGE sample buffer | Containing 10% 2-mercaptoethanol | ||
| 5-20% gradient SDS-PAGE gel | ATTO | E-D520L | |
| 70% ethanol | Diluted ethanol by ultrapure water. | ||
| Agarose | Takara Bio | ||
| Ammonium acetate | Nakalai tesque | 02406-95 | As this reagent is deliquescent, dissolve all of it in water once opened and store it at -30°C. |
| Ampicillin Sodium | Nakalai tesque | 02739-74 | |
| Asolectin Liposome, lyophilized | CellFree Sciences | CFS-PLE-ASL | A vial contains 10 mg of lyophilized liposomes. |
| BSA standard | 1000 ng, 500 ng, 250 ng, 125 ng BSA / 10 µL ×1 SDS-PAGE sample buffer | ||
| CBB gel stain | |||
| cDNA clone of interest | Plasmid harboring cDNA clone or synthetic DNA fragment | ||
| Chloroform | Nakalai tesque | 08402-84 | |
| Cooled incubator | Temperature ranging from 0 to 40 °C or wider. | ||
| Creatine kinase | Roche Diagnostics | 04524977190 | |
| Dialysis cup (0.1 mL) | Thermo Fisher Scientific | 69570 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 0.1 mL |
| Dialysis cup (2 mL) | Thermo Fisher Scientific | 88404 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 2 mL |
| DNA ladder marker | Thermo Fisher Scientific | SM0311 | GeneRuler 1 kb DNA Ladder |
| DpnI | Thermo Fisher Scientific | FD1703 | FastDigest DpnI |
| E. coli strain JM109 | |||
| Electrophoresis chamber | ATTO | ||
| Ethanol (99.5%) | Nakalai tesque | 14713-95 | |
| Ethidium bromide | |||
| Evaporation flask, 100 mL | |||
| Gel imager | |||
| Gel scanner | We use document scanner and LED immuninator as a substitute. | ||
| LB broth | |||
| Lipids of interest | Avanti Polar Lipids | ||
| Micro centrifuge | TOMY | MX-307 | |
| NTP mix | CellFree Sciences | CFS-TSC-NTP | Mixture of ATP, GTP, CTP, UTP, at 25 mM each |
| Nuclease-free 25 mL tube | IWAKI | 362-025-MYP | |
| Nucrease-free plastic tubes | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| Nucrease-free tips | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| PBS buffer | |||
| PCR purification kit | MACHEREY-NAGEL | 740609 | NucleoSpin Gel and PCR Clean-up |
| pEU-E01-MCS vector | CellFree Sciences | CFS-11 | |
| Phenol/chloroform/isoamyl alcohol (25:24:1) | Nippon Gene | 311-90151 | |
| Plasmid prep Midi kit | MACHEREY-NAGEL | 740410 | NucleoBond Xtra Midi |
| Primer 1 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CCAAGATATCACTAGnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, forward. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 2 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CCATGGGACGTCGACnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, reverse. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 3 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-GTCGACGTCCCATGGTTTTGTATAGAAT-3' Forward primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 4 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CTAGTGATATCTTGGTGATGTAGATAGGTG-3' Reverse primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 5 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CAGTAAGCCAGATGCTACAC-3’ Sequencing primer, forward |
| Primer 6 | Thermo Fisher Scientific | Custom oligo synthesis | 5’- CCTGCGCTGGGAAGATAAAC-3’ Sequencing primer, reverse |
| Protein size marker | Bio-Rad | 1610394 | Precision Plus Protein Standard |
| Rotary evaporator | |||
| seamless cloning enzyme mixture | New England BioLabs | E2611L | Gibson Assembly Master Mix Other seamless cloning reagents are also avairable. |
| SP6 RNA Polymerase & RNase Inhibitor | CellFree Sciences | CFS-TSC-ENZ | |
| Submarine Electrophoresis system | |||
| TAE buffer | |||
| Transcription Buffer LM | CellFree Sciences | CFS-TSC-5TB-LM | |
| Translation buffer | CellFree Sciences | CFS-SUB-SGC | SUB-AMIX SGC (×40) stock solution (S1, S2, S3, S4). Prepare ×1 translation buffer before use by mixing stock S1, S2, S3, S4 stock and ultrapure water. |
| Ultrapure water | We recommend to prepare ultrapure water by using ultrapure water production system every time you do experiment. Do not autoclave. We preparaed ultrapure water by using Milli-Q Reference and Elix10 system. Commercially available nuclease-free water (not DEPC-treated water) can be used as a substitute. Take care of contamination after open the bottle. | ||
| Ultrasonic homogenizer | Branson | SONIFIER model 450D-Advanced | Ultrasonic cleaner can be used as a substitute. |
| UV transilluminator | |||
| Vacuum desiccator | |||
| Wheat germ extract | CellFree Sciences | CFS-WGE-7240 | WEPRO7240 |
참고문헌
- Santos, R., et al. A comprehensive map of molecular drug targets. Nature Reviews. Drug Discovery. 16 (1), 19-34 (2017).
- Gusach, A., et al. Beyond structure: emerging approaches to study GPCR dynamics. Current Opinion in Structural Biology. 63, 18-25 (2020).
- Congreve, M., de Graaf, C., Swain, N. A., Tate, C. G. Impact of GPCR Structures on Drug Discovery. Cell. 181 (1), 81-91 (2020).
- Wilkinson, T. C. I. Discovery of functional monoclonal antibodies targeting G-protein-coupled receptors and ion channels. Biochemical Society Transactions. 44 (3), 831-837 (2016).
- Hino, T., Iwata, S., Murata, T. Generation of functional antibodies for mammalian membrane protein crystallography. Current Opinion in Structural Biology. 23 (4), 563-568 (2013).
- Webb, D. R., Handel, T. M., Kretz-Rommel, A., Stevens, R. C. Opportunities for functional selectivity in GPCR antibodies. Biochemical Pharmacology. 85 (2), 147-152 (2013).
- Douthwaite, J. A., Finch, D. K., Mustelin, T., Wilkinson, T. C. I. Development of therapeutic antibodies to G-protein coupled receptors and ion channels: Opportunities, challenges and their therapeutic potential in respiratory diseases. Pharmacology and Therapeutics. 169, 113-123 (2016).
- Hashimoto, Y., Yagi, K., Kondoh, M. Current progress in a second-generation claudin binder, anti-claudin antibody, for clinical applications. Drug Discovery Today. 21 (10), 1711-1718 (2016).
- Hutchings, C. J., Colussi, P., Clark, T. G. Ion channels as therapeutic antibody targets. mAbs. 11 (2), 265-296 (2019).
- Errey, J. C., Fiez-Vandal, C. Production of membrane proteins in industry: The example of GPCRs. Protein Expression and Purification. 169, 105569 (2020).
- Pandey, A., Shin, K., Patterson, R. E., Liu, X. Q., Rainey, J. K. Current strategies for protein production and purification enabling membrane protein structural biology. Biochemistry and Cell Biology. 94 (6), 507-527 (2016).
- Wiseman, D. N., et al. Expression and purification of recombinant G protein-coupled receptors: a review. Protein Expression and Purification. 167, 105524 (2020).
- Jeffery, C. J. Expression, Solubilization, and Purification of Bacterial Membrane Proteins. Current Protocols in Protein Science. 83 (1), 1-15 (2016).
- Spirin, A. S., Baranov, V. I., Ryabova, L. A., Ovodov, S. Y., Alakhov, Y. B. A continuous cell-free translation system capable of producing polypeptides in high yield. Science. 242 (4882), 1162-1164 (1988).
- Takai, K., Sawasaki, T., Endo, Y. Practical cell-free protein synthesis system using purified wheat embryos. Nature Protocols. 5 (2), 227-238 (2010).
- Endo, Y., Sawasaki, T. Cell-free expression systems for eukaryotic protein production. Current Opinion in Biotechnology. 17 (4), 373-380 (2006).
- Shimizu, Y., Kuruma, Y., Ying, B. W., Umekage, S., Ueda, T. Cell-free translation systems for protein engineering. The FEBS Journal. 273 (18), 4133-4140 (2006).
- Klammt, C., et al. Cell-free expression as an emerging technique for the large scale production of integral membrane protein. The FEBS Journal. 273 (18), 4141-4153 (2006).
- Nozawa, A., et al. A cell-free translation and proteoliposome reconstitution system for functional analysis of plant solute transporters. Plant and Cell Physiology. 48 (12), 1815-1820 (2007).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35-45 (2011).
- Henrich, E., Hein, C., Dotsch, V., Bernhard, F. Membrane protein production in Escherichia coli cell-free lysates. FEBS Letters. 589 (15), 1713-1722 (2015).
- Henrich, E., Peetz, O., et al. Analyzing native membrane protein assembly in nanodiscs by combined non-covalent mass spectrometry and synthetic biology. eLife. 6, 243 (2017).
- Shelby, M. L., He, W., Dang, A. T., Kuhl, T. L., Coleman, M. A. cell-free co-translational approaches for producing mammalian receptors: expanding the cell-free expression toolbox using nanolipoproteins. Frontiers in Pharmacology. 10, 744 (2019).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the United States of America. 116 (10), 4031-4036 (2019).
- Sackin, H., Nanazashvili, M., Makino, S. I. Direct injection of cell-free Kir1.1 protein into Xenopus oocytes replicates single-channel currents derived from Kir1.1 mRNA. Channels. 9 (4), 196-199 (2015).
- Zemella, A., Richter, T., Thoring, L., Kubick, S. A combined cell-free protein synthesis and fluorescence-based approach to investigate GPCR binding properties. Methods in Molecular Biology. 1947 (10), 57-77 (2019).
- Vaish, A., Guo, S., Murray, R. M., Grandsard, P. J., Chen, Q. On-chip membrane protein cell-free expression enables development of a direct binding assay: A curious case of potassium channel KcsA-Kv1.3. Analytical Biochemistry. 556, 70-77 (2018).
- Suzuki, Y., et al. Functional G-Protein-Coupled Receptor (GPCR) synthesis: the pharmacological analysis of Human Histamine H1 Receptor (HRH1) synthesized by a wheat germ cell-free protein synthesis system combined with asolectin glycerosomes. Frontiers in Pharmacology. 9, 38 (2018).
- Cortes, S., Barette, C., Beroud, R., De Waard, M., Schaack, B. Functional characterization of cell-free expressed Kv1.3 channel using a voltage-sensitive fluorescent dye. Protein Expression and Purification. 145, 94-99 (2018).
- Woznicka-Misaila, A., Juillan-Binard, C., Baud, D., Pebay-Peyroula, E., Ravaud, S. Cell-free production, purification and characterization of human mitochondrial ADP/ATP carriers. Protein Expression and Purification. 144, 46-54 (2018).
- Hashimoto, Y., et al. Engineered membrane protein antigens successfully induce antibodies against extracellular regions of claudin-5. Scientific Reports. 8 (1), 8383 (2018).
- Sawasaki, T., et al. A bilayer cell-free protein synthesis system for high-throughput screening of gene products. FEBS Letters. 514 (1), 102-105 (2002).
- Goshima, N., et al. Human protein factory for converting the transcriptome into an in vitro-expressed proteome. Nature Methods. 5 (12), 1011-1017 (2008).
- Nemoto, K., Takemori, N., Seki, M., Shinozaki, K., Sawasaki, T. Members of the plant CRK superfamily are capable of trans- and autophosphorylation of tyrosine residues. The Journal of Biological Chemistry. 290 (27), 16665-16677 (2015).
- Takeda, H., et al. Comparative analysis of human src-family kinase substrate specificity in vitro. Journal of Proteome Research. 9 (11), 5982-5993 (2010).
- Takahashi, H., et al. Establishment of a wheat cell-free synthesized protein array containing 250 human and mouse E3 ubiquitin ligases to identify novel interaction between E3 ligases and substrate proteins. PLoS One. 11 (6), 0156718 (2016).
- Nozawa, A., et al. Construction of a protein library of Arabidopsis transcription factors using a wheat cell-free protein production system and its application for DNA binding analysis. Bioscience, Biotechnology, and Biochemistry. 73 (7), 1661-1664 (2009).
- Goren, M. A., Nozawa, A., Makino, S. I., Wrobel, R. L., Fox, B. G. Cell-free translation of integral membrane proteins into unilamelar liposomes. Methods in Enzymology. 463, 647-673 (2009).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35 (2011).
- Renauld, S., et al. Functional reconstitution of cell-free synthesized purified Kv channels. Biochimica Et Biophysica Acta. Biomembranes. 1859 (12), 2373-2380 (2017).
- Liu, S., et al. Efficiency and Safety of CRAC Inhibitors in Human Rheumatoid Arthritis Xenograft Models. Journal of Immunology. 199 (5), 1584-1595 (2017).
- Jarecki, B. W., Makino, S. I., Beebe, E. T., Fox, B. G., Chanda, B. Function of shaker potassium channels produced by cell-free translation upon injection into xenopus oocytes. Scientific Reports. 3, 1-7 (2013).
- David, G., et al. Phosphorylation and alternative translation on wheat germ cell-free protein synthesis of the DHBV large envelope protein. Frontiers in Molecular Biosciences. 6, 138 (2019).
- Jirasko, V., et al. Proton-detected solid-state NMR of the cell-free synthesized α-helical transmembrane protein NS4B from hepatitis C virus. Chembiochem: A European Journal of Chemical Biology. 21 (10), 1453-1460 (2020).
- Takeda, H., et al. Production of monoclonal antibodies against GPCR using cell-free synthesized GPCR antigen and biotinylated liposome-based interaction assay. Scientific Reports. 5, 11333 (2015).
- Zhou, W., Takeda, H. Production of immunizing antigen proteoliposome using cell-free protein synthesis system. Methods in Molecular Biology. 1868, 49-67 (2018).
- Hutchings, C. J., Koglin, M., Marshall, F. H. Therapeutic antibodies directed at G protein-coupled receptors. mAbs. 2 (6), 594-606 (2010).
- Raetz, C. R. H., et al. Discovery of new biosynthetic pathways: the lipid A story. Journal of Lipid Research. 50, 103-108 (2009).
- Baldridge, J. R., Crane, R. T. Monophosphoryl lipid A (MPL) formulations for the next generation of vaccines. Methods. 19 (1), 103-107 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유