Method Article
膜タンパク質を標的とした機能解析と抗体開発のためのプロテオリポソームの無細胞生産
要約
このプロトコルは、小麦無細胞系およびリポソームを用いた二重層透析法による高品質のプロテオリポソームの効率的な無細胞生産法を記載する。この方法は、膜タンパク質の機能解析、創薬標的のスクリーニング、および抗体開発に適した手段を提供します。
要約
膜タンパク質は、さまざまな細胞プロセスにおいて重要な役割を果たし、重要な機能を果たします。膜タンパク質は、すべての薬剤の半分以上の標的であるため、創薬において医学的に重要です。膜タンパク質の生化学的、生物物理学的、構造的研究、および抗体開発を行う上での障害は、正しい立体構造と活性を有する高品質の膜タンパク質を大量に生産することの難しさでした。ここでは、小麦胚芽無細胞系、リポソーム、透析カップを用いて、膜タンパク質を効率よく合成し、精製プロテオリポソームを短時間で高成功率で調製する「二重層透析法」について述べる。膜タンパク質は、GPCR、イオンチャネル、トランスポーター、テトラスパニンなど、数ミリグラム単位で産生することができます。この無細胞法は、高品質なプロテオリポソームを調製するための時間、コスト、労力の削減に貢献し、膜タンパク質の機能解析、創薬ターゲットスクリーニング、抗体開発に適した手段を提供します。
概要
膜タンパク質は、診断および治療において最も重要な薬物標的の1つです。実際、標的とする低分子化合物の半分は、Gタンパク質共役型受容体(GPCR)やイオンチャネル1などの膜タンパク質です。長年にわたり、研究者は膜タンパク質の構造と機能を解明するために、膜タンパク質の生化学的、生物物理学的、および構造的研究に取り組んできました2,3。膜タンパク質に対するモノクローナル抗体の開発も、機能的および構造的研究を加速し、治療および診断アプリケーションを開発するために積極的に行われています4,5,6,7,8,9。これらの研究はすべて、大量の高品質の膜タンパク質を必要とします10。例えば、抗体開発には、天然の立体配座を有する数ミリグラムの精製膜タンパク質が必要です。X線結晶学には、はるかに大量の高度に精製された膜タンパク質が必要です。しかし、膜タンパク質の大量生産は、膜タンパク質研究のボトルネックとして残っています11。膜タンパク質は、1つまたは複数の膜貫通ヘリックスを有する複雑な構造を有し、細胞の恒常性において重要な役割を果たします。膜タンパク質の異種過剰発現は、高局所濃度で蓄積する膜タンパク質の凝集や細胞シグナル経路の乱れなど、複数の障害を引き起こします。発現が成功したとしても、サンプル調製の後続のステップも困難に直面します。例えば、プロテオリポソームの調製には、膜タンパク質の可溶化、精製、安定化における高度なスキルと専門的な経験が必要であり、同様に多くの労力と時間が必要です12,13。
一方、生細胞を使用せずにタンパク質を生産するために、ここ数十年でいくつかの高度な技術が出現しました14、15、16、17、18。無細胞タンパク質合成技術は、試験管内で翻訳反応を再構成します。細胞発現系には制限がないため、無細胞系は、細胞内で発現が困難な、または毒性を示す様々なタンパク質を合成できる可能性がある。精製された細胞抽出物または再構成された翻訳機構は、鋳型mRNA、アミノ酸、およびエネルギー源と混合され、組換えタンパク質が短時間で合成されます。膜タンパク質合成に関しては、無細胞反応にリポソーム、バイセル、ナノディスク、コポリマーなどの脂質または両親媒性物質からなるある種の足場が付加される19、20、21、22、23、24。合成された膜タンパク質は足場と相互作用し、水中で安定化することができます。無細胞合成膜タンパク質は、機能研究および抗体産生において広く使用されている25、26、27、28、29、30、31。
このプロトコールでは、小麦無細胞系とリポソームを用いた効率的なプロテオリポソーム生産法を記載する。小麦無細胞タンパク質合成系は、小麦胚芽15,32,33からの抽出物を用いた強力なin vitro翻訳系である。小麦胚芽には大量の翻訳機構が含まれており、翻訳阻害剤はほとんどありません。真核生物の一員であるコムギの翻訳機構は真核生物タンパク質の翻訳に適しており、その翻訳効率は鋳型mRNAのコドン使用にほとんど影響されない。コムギ無細胞系を用いて、プロテインキナーゼ34,35、ユビキチンリガーゼ36、転写因子37、膜タンパク質など様々なタンパク質を高い成功率で合成しています。膜タンパク質の生産のために、脂質小胞リポソームを足場として翻訳混合物に加えます19,38。膜タンパク質の疎水性ドメインは脂質二重層と相互作用し、リポソームと自発的に統合されます。密度勾配遠心分離は、プロテオリポソーム20の単純な精製には翻訳反応混合物の一般的な遠心分離で十分であるにもかかわらず、内因性小麦タンパク質からプロテオリポソームを厳密に分離するために使用されます。コムギ無細胞系を用いて多くの種類の内在性膜タンパク質が合成され、様々な研究開発に応用されている25,38,39,40,41,42,43,44。さらに、大規模生産のための「二重層透析法」を開発しました45,46。この方法では、カップ型透析装置を基板供給バッファーに浸漬し、図1に示すようにカップ内に翻訳反応混合物と基質供給バッファーの2層を形成する。基質の連続供給と副生成物の除去は、反応混合物の上部と下部の両方で長時間効率的に行うことができ、優れた翻訳効率につながります(図2Aおよび図2B)45。
プロトコル
1. pEU発現プラスミドの調製
注:pEU発現プラスミドには、開始コドン、標的膜タンパク質のオープンリーディングフレーム、およびフラグメント内の終止コドンを含める必要があります( 図1を参照)。必要に応じて、検出/精製タグ配列を適切な位置に追加します。制限酵素消化またはシームレスクローニングのいずれかがサブクローニングに適用できます。ここでは、シームレスクローニング法を用いたプロトコルについて説明する。
- インサートDNA断片を準備します。
- cDNA鋳型、プライマー1およびプライマー2を用いたPCRにより目的の遺伝子を増幅する。プライマー1とプライマー2には、シームレスなクローニングのためにそれぞれ15 bpのオーバーラップが含まれています( 材料表を参照)。
注:細胞内の成熟タンパク質から処理および除去される配列(シグナル配列など)は含めないでください。合成されたタンパク質のプロセシングは、小麦無細胞系では行われない。コザックシーケンスを追加しないでください。pEU-E01-MCSベクターはE01翻訳エンハンサーを有する。 - 1/25容量の DpnI制限酵素をPCR産物に加え、鋳型プラスミドDNAを除去します。37°Cで30分間インキュベートします。
- PCR精製キットを使用してPCR産物を精製し、濃度を20〜50 ng / μLに調整します。
- cDNA鋳型、プライマー1およびプライマー2を用いたPCRにより目的の遺伝子を増幅する。プライマー1とプライマー2には、シームレスなクローニングのためにそれぞれ15 bpのオーバーラップが含まれています( 材料表を参照)。
- pEU-E01-MCSベクトルを線形化します。
- pEU-E01-MCS、プライマー3、プライマー4を用いてインバースPCRを実施します。
- 1/25容量の DpnI制限酵素をインバースPCR産物に加えます。37°Cで30分間インキュベートします。
- PCR精製キットを使用して、メーカーの推奨に従ってPCR産物を精製します。濃度を20〜50 ng / μLに調整します。
- 2 μLのインサートDNAフラグメント、2 μLの直鎖化ベクター、および4 μLの2xシームレスクローニング酵素混合物を混合します。
- 大腸菌JM109株をシームレスクローニング産物で形質転換する。スプレッダーを使用して、LB-アンピシリン寒天プレート上に細菌懸濁液を広げる。
注:pEUベクターはアンピシリン耐性マーカーを有する。 - pEUプラスミドにおけるMCSの5'側および3'側からそれぞれプライマー5およびプライマー6を用いて構築した発現プラスミドの配列を確認する。
- 発現プラスミドを増幅および精製する。
- プラスミド形質転換 大腸菌 JM109株を150 mLのLB-アンピシリン培地中で37°C、毎分125ストロークで一晩振とう培養した。
- 市販のプラスミド調製MIDIキットを用いてプラスミドを抽出・精製します。プラスミドを 500 μL の TE バッファーに溶解します。
注意: プラスミド抽出にミニプレップキットを使用しないでください。それはプラスミドの十分な質と量を提供しません。 - 500 μLのフェノール/クロロホルム/イソアミルアルコール(25:24:1)を加えます。5分間激しく混合し、17,800 x g 、室温で5分間遠心分離します。上部プラスミド溶液を新しいチューブに移します。
注意: フェノールやクロロホルムから皮膚を保護するために、使い捨て手袋を着用してください。
注:プラスミド抽出キットからRNaseの汚染を除去するには、フェノール-クロロホルム精製を使用してプラスミドを精製します。 - 500μLのクロロホルムを加えてフェノールを完全に除去します。5分間激しく混合し、17,800 x g 、室温で5分間遠心分離します。上部プラスミド溶液を新しいチューブに移します。
- 2.5容量のエタノールと1/8容量の7.5 M酢酸アンモニウムを加え、-30°Cで1時間保存します。
- 17,800 x g 、4°C、10分間遠心分離します。ペレットを500μLの70%エタノールで洗浄します。上清を注意深く取り除き、ペレットを5分間放置して乾かします。
- 発現プラスミドを100 μLの超純水に完全に溶解します。260 nmの吸光度でプラスミドの濃度を測定します。濃度を1 mg/mLに調整してください。
2.インビトロ転写
注意: 転写および翻訳のステップでは、DNaseおよびヌクレアーゼフリーのプラスチックチューブとチップを使用してください。汚染を防ぐために、プラスチック製品のオートクレーブは避けてください。
- 新しいプラスチックチューブで超純水を収穫します。
注意: DEPC処理水は残留すると反応が強く阻害されるため、使用しないでください。転写と翻訳には、新たに精製された超純水を使用してください。 - 115.2 μLの超純水、40 μLの転写バッファーLM、20 μLのNTPミックス、2.4 μLの80 U/μL RNase阻害剤、2.4 μLの80 U/μL SP6ポリメラーゼ、および20 μLの1 mg/mL pEU発現プラスミドを混合して、転写反応ミックスを調製します。反転させて試薬を穏やかに混合します。クイックスピンを実行します。
- 転写反応を37°Cで6時間インキュベートします。
- 反転して反応を穏やかに混ぜ合わせ、すばやく回転させます。翻訳には直ちに使用し、それ以外の場合は凍結して-80°Cで保存してください。
- 電気泳動により転写産物を確認する。
- 100 mLの1x TAEバッファーと1 gのアガロースを混合します。懸濁液を電子レンジで加熱し、1%アガロースTAEゲルを調製した。
- 1 μLの転写反応を取り、3 μLの水および4 μLの2xローディング色素と混合します。
注:RNAの変性は必要ありません。 - 混合物4 μLとDNAラダーマーカー2 μLをアガロースTAEゲルにロードします。
- 100 Vで20分間電気泳動します。
- ゲルを臭化エチジウムで30分間染色する。UVトランスイルミネーターとゲルイメージャーを使用してmRNAのラダーバンドパターンを確認します。
注:500 bp未満の塗抹バンドが観察された場合、mRNAの分解が疑われます。
3. 翻訳資料の作成
- 翻訳バッファを準備します。
- 調製したての超純水27 mLと、S1、S2、S3、S4の40xストック溶液0.75 mLをそれぞれ50 mLチューブに混合します。
注: 1x 変換バッファの最終必要量に応じて、材料の量を調整してください。
注意: 使用後に余分な 1x 翻訳バッファを保存または再フリーズしないでください。
- 調製したての超純水27 mLと、S1、S2、S3、S4の40xストック溶液0.75 mLをそれぞれ50 mLチューブに混合します。
- クレアチンキナーゼストック溶液を調製します。凍結乾燥クレアチンキナーゼを超純水に溶解し、最終濃度20 mg/mLにします。溶液を少量(各10〜50 μL)で0.2 mL 8ストリップPCRチューブに分注します。チューブを液体窒素で凍結し、-80°Cで保存します。
注意: 解凍後にクレアチンキナーゼ溶液を再凍結しないでください。 - 透析カップ(0.1mLサイズ)を洗浄し、透析膜からグリセロールを除去します。
注意: いくつかの異なるサイズの透析カップがあります。小規模テストには小型カップ(0.1 mL)が使用され(セクション5.4)、大規模生産には大型カップ(2 mL)がそれぞれ使用されます(セクション5.5)。大型カップの透析膜の洗浄工程は回避可能である。- 1mLの超純水を新しい1.5mLチューブに入れます。小型の透析カップ(0.1 mL)をチューブに挿入します。カップに超純水0.5mLを加えます。
- 室温で30分以上インキュベートします。
4.リポソームの調製
注:ここでは、リポソームの調製のための2つのプロトコルについて説明します。1つはすぐに使用できる凍結乾燥リポソームを使用し(セクション4.1)、もう1つは薄い脂質膜を水和することによってリポソームを生成します(セクション4.2)。
- 凍結乾燥リポソームを用いてリポソームを調製する。
注:プロテオリポソームを製造するより簡単な方法は、市販のアソレクチンリポソームを使用することです。アソレクチンは大豆から抽出された天然脂質の一種です。- 10 mgの凍結乾燥アソレクチンリポソーム( 材料表を参照)を含むバイアルを開き、200 μLの翻訳バッファー(セクション3.1)をバイアルの底に追加します。バイアルを密封し、10分間インキュベートします。
- バイアルをボルテックスミキサーに1分間置き、激しく混合します。
- バイアルを50 mLチューブに挿入します。500 x g で1分間遠心分離してチューブをスピンダウンします。
- ピペットを使用して、アソレクチンリポソーム懸濁液(50 mg脂質/ mL)を新しい1.5 mLチューブに移します。翻訳のためにすぐにリポソームを使用し、それ以外の場合は液体窒素で凍結し、-80°Cで保存します。
- 薄い脂質膜を水和してリポソームを調製する。
- 脂質が粉末状で販売されている場合は、クロロホルムまたは適切な有機溶媒に10〜100 mg / mLの濃度に溶解します。
注:薄い脂質膜は、精製および/または合成された両親媒性脂質を使用して調製できます。アソレクチンの精製方法は、先に説明した38。ビオチン化脂質、蛍光脂質、アジュバント脂質などの機能修飾脂質を基底脂質に添加して、機能性リポソームを製造することができる。 - 50 mgの脂質を含む脂質溶液を蒸発フラスコに移します。
- ロータリーエバポレーターを使用して、溶媒を蒸発させ、フラスコ底の壁に脂質を均一に広げて、脂質の薄膜を形成します。
- フラスコを真空デシケーターに入れ、負圧下で一晩放置して溶媒を完全に除去します。
- 1 mLの翻訳バッファーを蒸発フラスコに加えます。フラスコを回転させて、薄い脂質膜上にバッファーを広げます。5分間インキュベートしてフィルムを水和させます。
- 超音波ホモジナイザーまたは超音波洗浄機でフラスコを超音波処理します。フラスコの角度を時々変更して、溶液がフィルムに完全に触れるようにします。薄い脂質フィルムが底から剥がされ、完全かつ均質に乳化されていることを確認してください。
注:ビオチン化脂質含有リポソームの電子顕微鏡写真を 図1に示す。 - リポソーム懸濁液(50 mg脂質/ mL)を新しい1.5 mLチューブに移します。すぐに使用しない場合は、リポソームを液体窒素で凍結し、-80°Cで保存してください。
- 脂質が粉末状で販売されている場合は、クロロホルムまたは適切な有機溶媒に10〜100 mg / mLの濃度に溶解します。
5. インビトロ翻訳
- チューブを室温の水に数分間浮かべて、小麦胚芽抽出物をすばやく解凍します。解凍後、すぐにチューブを反転させて穏やかに混合し、回転させ、使用するまで氷の上で冷やします。
注:使用後は小麦胚芽抽出物を液体窒素で凍結し、-80°Cで保存してください。 いくつかの凍結/解凍サイクルに耐えます。 - 20 mg/mLのクレアチンキナーゼストック溶液を解凍します。5 μLのストック溶液と45 μLの翻訳バッファーを混合して、2 mg/mLのクレアチンキナーゼ作業溶液を調製します。
注意: クレアチンキナーゼの再凍結はお勧めしません。 - 必要に応じてリポソームまたはmRNAを解凍します。
- 小規模なタンパク質翻訳を実施します。
- ステップ3.3.2で準備したように、チューブと透析カップ(0.1 mL)の両方から水を取り除きます。
- 1 mL および 300 μL の翻訳バッファーをチューブと透析カップにそれぞれ注入します。
注意: 透析カップの底部が1.5 mLチューブの翻訳バッファーの表面に届かない場合は、さらに50〜100 μLのバッファーをチューブに注入します。 - 翻訳バッファー15.6 μL、2 mg/mLクレアチンキナーゼ2.4 μL、50 mg/mLリポソーム12 μL、小麦胚芽抽出物15 μL、およびmRNA15 μLを混合して、翻訳反応混合物を調製します。チューブを反転させて穏やかに混合し、スピンダウンします。
- 200 μLのピペットを用いて60 μLの翻訳反応混合物を吸引します。
- ピペットチップを透析カップの翻訳バッファーの下面に挿入します。反応混合物をゆっくりと穏やかにピペットで取り出します。蒸発を防ぐために、透析カップを蓋で覆います。
注意: 反応混合物はカップの底に自然に沈み、二重層を形成します。カップを混ぜたり振ったりして二重層を邪魔しないでください。
- 大規模な翻訳を行います(図1)。
- 22 mLの翻訳バッファーを25 mLチューブに注ぎます。大型の透析カップ(2 mL)をチューブに挿入し、カップに2 mLの翻訳バッファーを追加します。
- 翻訳バッファー130 μL、2 mg/mLクレアチンキナーゼ20 μL、50 mg/mLリポソーム100 μL、小麦胚芽抽出物125 μL、およびmRNA125 μLを混合して、翻訳反応混合物を調製します。ピペッティングで穏やかに混ぜます。
- すべての翻訳反応混合物(500 μL)を1,000 μLピペットで吸引します。ステップ5.4.5で説明されているのと同じ方法で、翻訳反応混合物を透析カップに注入します。蒸発を防ぐために、透析カップを蓋で覆います。
- 反応物を15°Cで24時間インキュベートします。
- ピペッティングにより透析カップ内で反応をよく混合する。粗プロテオリポソーム懸濁液を新しいチューブに移します。
注:小規模翻訳からプロテオリポソームを採取するには、平底の1.5 mLチューブをお勧めします。遠心分離後、リポソームはチューブの下隅にコンパクトで見やすいペレットを形成します。
6. プロテオリポソームの精製
- 粗プロテオリポソーム懸濁液を含むチューブを17,800 x g で4°Cで10分間遠心分離します。
- 上清を取り除きます。プロテオリポソームペレットをピペッティングによりPBS(小スケール:1mL、大スケール:10mL)に懸濁する。
- プロテオリポソームの遠心分離と洗浄をさらに2つの円で繰り返します。
- 洗浄後、少量のPBSを加え、ピペッティングでプロテオリポソームペレットをよく再懸濁します。マイクロピペットを使用して懸濁液の量を測定します。PBSを加えて、容量を60 μL(小規模)または500 μL(大規模)に調整します。懸濁液を新しい1.5 mLチューブに移します。
- 10 μLのプロテオリポソーム懸濁液をSDS-PAGE用の新しいPCRチューブに移します。残りのサンプルを小さな部分に分割して、必要に応じて使用します。液体窒素中で凍結し、-80°Cで保存する。
7. SDS-PAGEおよびCBB染色
- 70 μLの水と40 μLの3x SDS-PAGEサンプルバッファーを10 μLのプロテオリポソーム懸濁液に加えます。
注意:膜タンパク質が凝集し、電気泳動でアクリルアミドゲルに浸透しにくいため、SDS-PAGEサンプルを沸騰させないでください。また、酸化を防ぐために、SDS-PAGEサンプルバッファーに十分な還元剤(例えば、最終濃度3%の2-メルカプトエタノール)を加えます。 - 電気泳動チャンバーに5%〜20%のグラジエントSDS-PAGEゲルをセットします。3 μL、6 μL、12 μLのプロテオリポソームサンプル、2 μLのタンパク質サイズマーカー、およびBSA標準シリーズもロードします。
- 52 mA、400 Vで30分間電気泳動します。
- ゲルをCBB染料で1時間染色します。お湯で脱色し、ゲル画像をスキャンします。
- NIH Image Jソフトウェア(https://imagej.nih.gov/ij/)を用いて、各レーンにおける膜タンパク質のバンド強度を定量化する。BSA標準系列で合成した膜タンパク質の量を推定します。
結果
このプロトコールを用いて、部分的に精製されたプロテオリポソームを短時間で得ることができる。代表的な結果を 図2Aに示す。クラスA、B、Cの25個のGPCRを二層透析法(小規模)で合成し、遠心分離とバッファー洗浄によって部分的に精製することに成功しました。タンパク質の種類によって合成されるタンパク質の量は異なりますが、大型の透析カップを使用すると、通常、反応ごとに50〜400μgの膜タンパク質を合成できます。小麦無細胞系の高いスケーラビリティにより、反応回数を増やすことで数ミリグラムの膜タンパク質を簡単に生成できます。二重層透析法における標的タンパク質の産生効果を判断するには、小型の透析カップを使用した事前試験で十分です。得られた生産性に応じて、大型の透析カップを用いて産生される標的タンパク質の量を推定することができる。
このプロトコルは、膜タンパク質の発現、特に複数の膜貫通ヘリックスを持つタンパク質に適しています。ほとんどの場合、3つ以上の膜貫通ヘリックスを有する膜タンパク質は、合成後にプロテオリポソームに容易に取り込まれ(図2B)、プロテオリポソームの生産性が良好になります。単一膜貫通らせんタンパク質は通常、スムーズに合成されます。しかし、疎水性領域が小さいため、リポソームにはほとんど組み込まれません。2つの膜貫通ヘリックスを持つタンパク質に関して、それらがリポソームに固定されているかどうかは、それらの膜貫通ヘリックスが露出する方法に依存します。
合成されたプロテオリポソームは、単純な遠心分離によって回収され、洗浄バッファーで部分的に精製されるため、膜タンパク質の精製プロセスが大幅に短縮されます。小麦胚芽抽出物からは生体膜と膜タンパク質の両方が事前に除去されていますが、少量の小麦タンパク質がリポソームまたは合成された膜タンパク質に結合して共沈することがあります(図2A)。このようなタンパク質汚染物質は、単純な遠心分離および緩衝液洗浄では除去が困難である。高度に精製された膜タンパク質が必要な場合は、部分的に精製されたプロテオリポソームを界面活性剤で可溶化し、カラムクロマトグラフィーで精製する必要があります。

図1:無細胞プロテオリポソーム生産のスキーム。 SP6、SP6プロモーター配列;E01、E01翻訳エンハンサー配列;Ampr、アンピシリン耐性遺伝子;DTT、ジチオスレイトール。電子顕微鏡写真は、ビオチン化脂質含有リポソームのイムノゴールド標識を示す。バー、0.2μm。この電子顕微鏡写真像は、武田ら、2015年45月の図1Dからのものであった。この図の拡大版を表示するには、ここをクリックしてください。
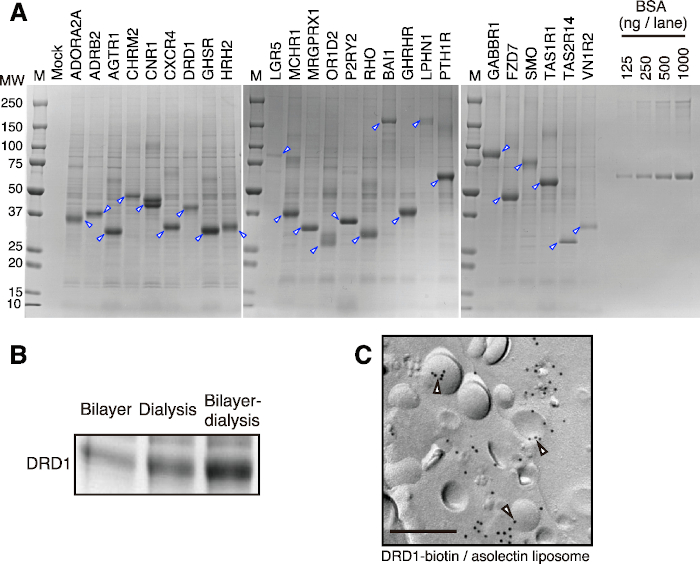
図2:二重膜透析法によるプロテオリポソーム生産の代表的な結果。 (A)無細胞合成GPCRのSDS-PAGE画像。 25個の選択されたGPCRを二重層透析法で合成した。プロテオリポソームを部分的に精製し、SDS-PAGEおよびCBB染色に適用した。矢印はターゲットGPCRを示す。 (B)異なる翻訳法間の膜タンパク質生産の比較。ドーパミン受容体D1(DRD1)タンパク質は、小麦胚芽抽出物、リポソーム、およびmRNAのそれぞれ同じ比率でそれぞれの方法で合成されました。DRD1プロテオリポソームを遠心分離により部分的に精製し、SDS-PAGEおよびCBB染色を行った。(C)DRD1-ビオチン/リポソーム複合体のイムノゴールド標識。DRD1は、BirAビオチンリガーゼによって酵素的にビオチン化されました。バー、0.2μm。空白の矢印はリポソーム上のDRD1-ビオチンを示す。この図は、武田ら, 201545の図1から修正された。この図の拡大版を表示するには、ここをクリックしてください。
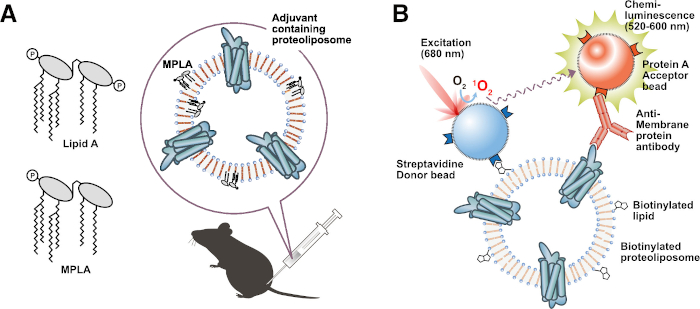
図3:機能性プロテオリポソームの応用。 (a)アジュバント脂質含有プロテオリポソームの免疫。(B)ビオチン化リポソームベースの相互作用アッセイ(BiLIA)。膜蛋白質と抗膜蛋白質抗体との相互作用は、AlphaScreenにより検出した。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
提示されたプロトコルは、高い成功率で膜タンパク質を生産する方法を提供する。このプロトコルはシンプルで再現性が高く、スケールアップも簡単です。また、膜タンパク質を大量に消費する実験の時間とコストを削減できる可能性もあります。二重層透析法は、二分子膜法または透析法と比較して生産性を4〜10倍向上させます(図2B)45。極端な場合、イオンチャネルとトランスポーターの収率は、二層透析法の場合よりも二重層透析法でそれぞれ30倍と20倍増加しました(データ示さず)。このプロトコールの高い生産性は、免疫化のための抗原産生における利点である。プロテオリポソームは、抗膜タンパク質抗体開発のための免疫抗原としてよく使用されます。プロテオリポソームに埋め込まれた高濃度および精製された膜タンパク質は、免疫応答を効果的に刺激し、抗体を誘導する41,47。この二重層透析法を用いると、免疫目的で数ミリグラムの膜タンパク質を担持したプロテオリポソームを数日で容易に調製することができる。実際、私たちのグループは、このプロトコルを使用してGPCR、イオンチャネル、およびクローディンを合成し、マウスに製品で免疫して、それらに対するモノクローナル抗体を取得しました31、41、45。得られたモノクローナル抗体の一部は、高親和性抗体、コンフォメーション感受性抗体、フローサイトメトリー適用抗体、阻害抗体などの機能的抗体として検証されており、このプロトコルが機能的に正しい立体構造を持つ膜タンパク質を産生できることを示しています。
このプロトコルの別の魅力的な利点は、ビオチン化脂質、蛍光脂質、またはアジュバント脂質などの修飾脂質を使用して特定の機能を割り当てられたプロテオリポソームの産生を可能にすることです。特定の機能を有する調製されたプロテオリポソームは有用であり、幅広い実験に適用可能である。例えば、リピドA48 またはモノホスホリルリピドA(MPLA)49などのアジュバント脂質含有プロテオリポソームは、エマルジョンなしでマウスを免疫するために直接投与することができるので、便利な免疫抗原を作る。アジュバント脂質は、宿主動物における免疫応答を効果的に刺激し、標的膜タンパク質に対する抗体を誘導します(図3A)。実際に、我々は、MPLA含有プロテオリポソーム31でマウスを免疫することにより、フローサイトメトリー適用可能な抗体を誘導することに成功した。また、ビオチン化脂質から調製されたプロテオリポソームは、スクリーニングアッセイに理想的なプローブです。我々は、ビオチン化プロテオリポソームとAlphaScreen(BiLIA法)を用いて、抗膜タンパク質抗体を選択するハイスループットスクリーニング法を開発しました(図3B)45。サンドイッチELISAは、ビオチン化プロテオリポソームとストレプトアビジンコーティングプレートを使用して簡単に構築することもできます。
最後に、この方法を使用する際に対処する必要がある2つの重要な注意事項があります。第一に、翻訳バッファー中の高濃度のDTTのためにジスルフィド結合の形成が不十分である可能性があり、これはある種の膜タンパク質の構造に影響を与える可能性がある15。ジスルフィド結合は、精製プロセス中に還元剤が除去された後に形成することができますが、天然のものとは異なるタイプに形成される可能性があります。もう1つは、膜タンパク質がグリコシル化されていないことです。グリコシル化に必要な酵素は、小麦胚芽抽出物が生産される過程でゴルジ体やERなどの生体膜が除去されているため、理論的には無細胞系には存在しません。ジスルフィド結合とグリコシル化の欠如は異なる立体配座を引き起こす可能性があるため、特に翻訳後修飾が実験目的に応じたタンパク質の機能発現にとって重要である場合は、実験デザインを慎重に検討および評価する必要があります。
開示事項
著者は開示するものは何もありません。
謝辞
本研究は、AMEDの創薬・ライフサイエンス研究支援プラットフォームプロジェクト(革新的創薬・ライフサイエンス研究支援基盤(BINDS))の支援を受けて、JP20am0101077の支援を受けて行われました。本研究の一部は、JSPS科研費20K05709の支援も受けました。
資料
| Name | Company | Catalog Number | Comments |
| ×3 SDS-PAGE sample buffer | Containing 10% 2-mercaptoethanol | ||
| 5-20% gradient SDS-PAGE gel | ATTO | E-D520L | |
| 70% ethanol | Diluted ethanol by ultrapure water. | ||
| Agarose | Takara Bio | ||
| Ammonium acetate | Nakalai tesque | 02406-95 | As this reagent is deliquescent, dissolve all of it in water once opened and store it at -30°C. |
| Ampicillin Sodium | Nakalai tesque | 02739-74 | |
| Asolectin Liposome, lyophilized | CellFree Sciences | CFS-PLE-ASL | A vial contains 10 mg of lyophilized liposomes. |
| BSA standard | 1000 ng, 500 ng, 250 ng, 125 ng BSA / 10 µL ×1 SDS-PAGE sample buffer | ||
| CBB gel stain | |||
| cDNA clone of interest | Plasmid harboring cDNA clone or synthetic DNA fragment | ||
| Chloroform | Nakalai tesque | 08402-84 | |
| Cooled incubator | Temperature ranging from 0 to 40 °C or wider. | ||
| Creatine kinase | Roche Diagnostics | 04524977190 | |
| Dialysis cup (0.1 mL) | Thermo Fisher Scientific | 69570 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 0.1 mL |
| Dialysis cup (2 mL) | Thermo Fisher Scientific | 88404 | Slide-A-Lyzer MINI Dialysis Device, 10K MWCO, 2 mL |
| DNA ladder marker | Thermo Fisher Scientific | SM0311 | GeneRuler 1 kb DNA Ladder |
| DpnI | Thermo Fisher Scientific | FD1703 | FastDigest DpnI |
| E. coli strain JM109 | |||
| Electrophoresis chamber | ATTO | ||
| Ethanol (99.5%) | Nakalai tesque | 14713-95 | |
| Ethidium bromide | |||
| Evaporation flask, 100 mL | |||
| Gel imager | |||
| Gel scanner | We use document scanner and LED immuninator as a substitute. | ||
| LB broth | |||
| Lipids of interest | Avanti Polar Lipids | ||
| Micro centrifuge | TOMY | MX-307 | |
| NTP mix | CellFree Sciences | CFS-TSC-NTP | Mixture of ATP, GTP, CTP, UTP, at 25 mM each |
| Nuclease-free 25 mL tube | IWAKI | 362-025-MYP | |
| Nucrease-free plastic tubes | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| Nucrease-free tips | Watson bio labs | Do not autoclave. Use them separately from other experiments. | |
| PBS buffer | |||
| PCR purification kit | MACHEREY-NAGEL | 740609 | NucleoSpin Gel and PCR Clean-up |
| pEU-E01-MCS vector | CellFree Sciences | CFS-11 | |
| Phenol/chloroform/isoamyl alcohol (25:24:1) | Nippon Gene | 311-90151 | |
| Plasmid prep Midi kit | MACHEREY-NAGEL | 740410 | NucleoBond Xtra Midi |
| Primer 1 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CCAAGATATCACTAGnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, forward. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 2 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CCATGGGACGTCGACnnnnnnnnnnnnnnnnnnnnnnnn-3’ Gene specific primer, reverse. Upper case shows overlap sequence to be added for seamless cloning. Lower case nnnn…. (20-30 bp) shows gene specific sequence. |
| Primer 3 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-GTCGACGTCCCATGGTTTTGTATAGAAT-3' Forward primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 4 | Thermo Fisher Scientific | Custom oligo synthesis | 5'-CTAGTGATATCTTGGTGATGTAGATAGGTG-3' Reverse primer for vector linearization. Underline works as overlap in seamless cloning. |
| Primer 5 | Thermo Fisher Scientific | Custom oligo synthesis | 5’-CAGTAAGCCAGATGCTACAC-3’ Sequencing primer, forward |
| Primer 6 | Thermo Fisher Scientific | Custom oligo synthesis | 5’- CCTGCGCTGGGAAGATAAAC-3’ Sequencing primer, reverse |
| Protein size marker | Bio-Rad | 1610394 | Precision Plus Protein Standard |
| Rotary evaporator | |||
| seamless cloning enzyme mixture | New England BioLabs | E2611L | Gibson Assembly Master Mix Other seamless cloning reagents are also avairable. |
| SP6 RNA Polymerase & RNase Inhibitor | CellFree Sciences | CFS-TSC-ENZ | |
| Submarine Electrophoresis system | |||
| TAE buffer | |||
| Transcription Buffer LM | CellFree Sciences | CFS-TSC-5TB-LM | |
| Translation buffer | CellFree Sciences | CFS-SUB-SGC | SUB-AMIX SGC (×40) stock solution (S1, S2, S3, S4). Prepare ×1 translation buffer before use by mixing stock S1, S2, S3, S4 stock and ultrapure water. |
| Ultrapure water | We recommend to prepare ultrapure water by using ultrapure water production system every time you do experiment. Do not autoclave. We preparaed ultrapure water by using Milli-Q Reference and Elix10 system. Commercially available nuclease-free water (not DEPC-treated water) can be used as a substitute. Take care of contamination after open the bottle. | ||
| Ultrasonic homogenizer | Branson | SONIFIER model 450D-Advanced | Ultrasonic cleaner can be used as a substitute. |
| UV transilluminator | |||
| Vacuum desiccator | |||
| Wheat germ extract | CellFree Sciences | CFS-WGE-7240 | WEPRO7240 |
参考文献
- Santos, R., et al. A comprehensive map of molecular drug targets. Nature Reviews. Drug Discovery. 16 (1), 19-34 (2017).
- Gusach, A., et al. Beyond structure: emerging approaches to study GPCR dynamics. Current Opinion in Structural Biology. 63, 18-25 (2020).
- Congreve, M., de Graaf, C., Swain, N. A., Tate, C. G. Impact of GPCR Structures on Drug Discovery. Cell. 181 (1), 81-91 (2020).
- Wilkinson, T. C. I. Discovery of functional monoclonal antibodies targeting G-protein-coupled receptors and ion channels. Biochemical Society Transactions. 44 (3), 831-837 (2016).
- Hino, T., Iwata, S., Murata, T. Generation of functional antibodies for mammalian membrane protein crystallography. Current Opinion in Structural Biology. 23 (4), 563-568 (2013).
- Webb, D. R., Handel, T. M., Kretz-Rommel, A., Stevens, R. C. Opportunities for functional selectivity in GPCR antibodies. Biochemical Pharmacology. 85 (2), 147-152 (2013).
- Douthwaite, J. A., Finch, D. K., Mustelin, T., Wilkinson, T. C. I. Development of therapeutic antibodies to G-protein coupled receptors and ion channels: Opportunities, challenges and their therapeutic potential in respiratory diseases. Pharmacology and Therapeutics. 169, 113-123 (2016).
- Hashimoto, Y., Yagi, K., Kondoh, M. Current progress in a second-generation claudin binder, anti-claudin antibody, for clinical applications. Drug Discovery Today. 21 (10), 1711-1718 (2016).
- Hutchings, C. J., Colussi, P., Clark, T. G. Ion channels as therapeutic antibody targets. mAbs. 11 (2), 265-296 (2019).
- Errey, J. C., Fiez-Vandal, C. Production of membrane proteins in industry: The example of GPCRs. Protein Expression and Purification. 169, 105569 (2020).
- Pandey, A., Shin, K., Patterson, R. E., Liu, X. Q., Rainey, J. K. Current strategies for protein production and purification enabling membrane protein structural biology. Biochemistry and Cell Biology. 94 (6), 507-527 (2016).
- Wiseman, D. N., et al. Expression and purification of recombinant G protein-coupled receptors: a review. Protein Expression and Purification. 167, 105524 (2020).
- Jeffery, C. J. Expression, Solubilization, and Purification of Bacterial Membrane Proteins. Current Protocols in Protein Science. 83 (1), 1-15 (2016).
- Spirin, A. S., Baranov, V. I., Ryabova, L. A., Ovodov, S. Y., Alakhov, Y. B. A continuous cell-free translation system capable of producing polypeptides in high yield. Science. 242 (4882), 1162-1164 (1988).
- Takai, K., Sawasaki, T., Endo, Y. Practical cell-free protein synthesis system using purified wheat embryos. Nature Protocols. 5 (2), 227-238 (2010).
- Endo, Y., Sawasaki, T. Cell-free expression systems for eukaryotic protein production. Current Opinion in Biotechnology. 17 (4), 373-380 (2006).
- Shimizu, Y., Kuruma, Y., Ying, B. W., Umekage, S., Ueda, T. Cell-free translation systems for protein engineering. The FEBS Journal. 273 (18), 4133-4140 (2006).
- Klammt, C., et al. Cell-free expression as an emerging technique for the large scale production of integral membrane protein. The FEBS Journal. 273 (18), 4141-4153 (2006).
- Nozawa, A., et al. A cell-free translation and proteoliposome reconstitution system for functional analysis of plant solute transporters. Plant and Cell Physiology. 48 (12), 1815-1820 (2007).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35-45 (2011).
- Henrich, E., Hein, C., Dotsch, V., Bernhard, F. Membrane protein production in Escherichia coli cell-free lysates. FEBS Letters. 589 (15), 1713-1722 (2015).
- Henrich, E., Peetz, O., et al. Analyzing native membrane protein assembly in nanodiscs by combined non-covalent mass spectrometry and synthetic biology. eLife. 6, 243 (2017).
- Shelby, M. L., He, W., Dang, A. T., Kuhl, T. L., Coleman, M. A. cell-free co-translational approaches for producing mammalian receptors: expanding the cell-free expression toolbox using nanolipoproteins. Frontiers in Pharmacology. 10, 744 (2019).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. Proceedings of the National Academy of Sciences of the United States of America. 116 (10), 4031-4036 (2019).
- Sackin, H., Nanazashvili, M., Makino, S. I. Direct injection of cell-free Kir1.1 protein into Xenopus oocytes replicates single-channel currents derived from Kir1.1 mRNA. Channels. 9 (4), 196-199 (2015).
- Zemella, A., Richter, T., Thoring, L., Kubick, S. A combined cell-free protein synthesis and fluorescence-based approach to investigate GPCR binding properties. Methods in Molecular Biology. 1947 (10), 57-77 (2019).
- Vaish, A., Guo, S., Murray, R. M., Grandsard, P. J., Chen, Q. On-chip membrane protein cell-free expression enables development of a direct binding assay: A curious case of potassium channel KcsA-Kv1.3. Analytical Biochemistry. 556, 70-77 (2018).
- Suzuki, Y., et al. Functional G-Protein-Coupled Receptor (GPCR) synthesis: the pharmacological analysis of Human Histamine H1 Receptor (HRH1) synthesized by a wheat germ cell-free protein synthesis system combined with asolectin glycerosomes. Frontiers in Pharmacology. 9, 38 (2018).
- Cortes, S., Barette, C., Beroud, R., De Waard, M., Schaack, B. Functional characterization of cell-free expressed Kv1.3 channel using a voltage-sensitive fluorescent dye. Protein Expression and Purification. 145, 94-99 (2018).
- Woznicka-Misaila, A., Juillan-Binard, C., Baud, D., Pebay-Peyroula, E., Ravaud, S. Cell-free production, purification and characterization of human mitochondrial ADP/ATP carriers. Protein Expression and Purification. 144, 46-54 (2018).
- Hashimoto, Y., et al. Engineered membrane protein antigens successfully induce antibodies against extracellular regions of claudin-5. Scientific Reports. 8 (1), 8383 (2018).
- Sawasaki, T., et al. A bilayer cell-free protein synthesis system for high-throughput screening of gene products. FEBS Letters. 514 (1), 102-105 (2002).
- Goshima, N., et al. Human protein factory for converting the transcriptome into an in vitro-expressed proteome. Nature Methods. 5 (12), 1011-1017 (2008).
- Nemoto, K., Takemori, N., Seki, M., Shinozaki, K., Sawasaki, T. Members of the plant CRK superfamily are capable of trans- and autophosphorylation of tyrosine residues. The Journal of Biological Chemistry. 290 (27), 16665-16677 (2015).
- Takeda, H., et al. Comparative analysis of human src-family kinase substrate specificity in vitro. Journal of Proteome Research. 9 (11), 5982-5993 (2010).
- Takahashi, H., et al. Establishment of a wheat cell-free synthesized protein array containing 250 human and mouse E3 ubiquitin ligases to identify novel interaction between E3 ligases and substrate proteins. PLoS One. 11 (6), 0156718 (2016).
- Nozawa, A., et al. Construction of a protein library of Arabidopsis transcription factors using a wheat cell-free protein production system and its application for DNA binding analysis. Bioscience, Biotechnology, and Biochemistry. 73 (7), 1661-1664 (2009).
- Goren, M. A., Nozawa, A., Makino, S. I., Wrobel, R. L., Fox, B. G. Cell-free translation of integral membrane proteins into unilamelar liposomes. Methods in Enzymology. 463, 647-673 (2009).
- Nozawa, A., et al. Production and partial purification of membrane proteins using a liposome-supplemented wheat cell-free translation system. BMC Biotechnology. 11 (1), 35 (2011).
- Renauld, S., et al. Functional reconstitution of cell-free synthesized purified Kv channels. Biochimica Et Biophysica Acta. Biomembranes. 1859 (12), 2373-2380 (2017).
- Liu, S., et al. Efficiency and Safety of CRAC Inhibitors in Human Rheumatoid Arthritis Xenograft Models. Journal of Immunology. 199 (5), 1584-1595 (2017).
- Jarecki, B. W., Makino, S. I., Beebe, E. T., Fox, B. G., Chanda, B. Function of shaker potassium channels produced by cell-free translation upon injection into xenopus oocytes. Scientific Reports. 3, 1-7 (2013).
- David, G., et al. Phosphorylation and alternative translation on wheat germ cell-free protein synthesis of the DHBV large envelope protein. Frontiers in Molecular Biosciences. 6, 138 (2019).
- Jirasko, V., et al. Proton-detected solid-state NMR of the cell-free synthesized α-helical transmembrane protein NS4B from hepatitis C virus. Chembiochem: A European Journal of Chemical Biology. 21 (10), 1453-1460 (2020).
- Takeda, H., et al. Production of monoclonal antibodies against GPCR using cell-free synthesized GPCR antigen and biotinylated liposome-based interaction assay. Scientific Reports. 5, 11333 (2015).
- Zhou, W., Takeda, H. Production of immunizing antigen proteoliposome using cell-free protein synthesis system. Methods in Molecular Biology. 1868, 49-67 (2018).
- Hutchings, C. J., Koglin, M., Marshall, F. H. Therapeutic antibodies directed at G protein-coupled receptors. mAbs. 2 (6), 594-606 (2010).
- Raetz, C. R. H., et al. Discovery of new biosynthetic pathways: the lipid A story. Journal of Lipid Research. 50, 103-108 (2009).
- Baldridge, J. R., Crane, R. T. Monophosphoryl lipid A (MPL) formulations for the next generation of vaccines. Methods. 19 (1), 103-107 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved