Method Article
Выделение и функциональная оценка стволовых клеток рака молочной железы человека из образцов клеток и тканей
В этой статье
Резюме
Этот экспериментальный протокол описывает выделение BCSC из образцов клеток и тканей рака молочной железы, а также анализы in vitro и in vivo , которые могут быть использованы для оценки фенотипа и функции BCSC.
Аннотация
Стволовые клетки рака молочной железы (BCSC) являются раковыми клетками с унаследованными или приобретенными характеристиками, подобными стволовым клеткам. Несмотря на их низкую частоту, они являются основными факторами, способствующими возникновению рака молочной железы, рецидивам, метастазированию и резистентности к терапии. Крайне важно понять биологию стволовых клеток рака молочной железы, чтобы определить новые терапевтические мишени для лечения рака молочной железы. Стволовые клетки рака молочной железы выделяются и характеризуются на основе экспрессии уникальных маркеров клеточной поверхности, таких как CD44, CD24 и ферментативная активность альдегиддегидрогеназы (ALDH). Эти ALDHс высоким содержаниемCD44 + CD24-клеток составляют популяцию BCSC и могут быть выделены путем флуоресцентно-активированной сортировки клеток (FACS) для последующих функциональных исследований. В зависимости от научного вопроса для оценки функциональных характеристик БЦСК могут использоваться различные методы in vitro и in vivo. Здесь мы предоставляем подробный экспериментальный протокол для выделения БЦСК человека как из гетерогенных популяций клеток рака молочной железы, так и из первичной опухолевой ткани, полученной от пациентов с раком молочной железы. Кроме того, мы выделяем функциональные анализы in vitro и in vivo, включая колониеобразующие анализы, анализы маммосферы, 3D-модели культур и анализы опухолевых ксенотрансплантатов, которые могут быть использованы для оценки функции BCSC.
Введение
Понимание клеточных и молекулярных механизмов стволовых клеток рака молочной железы человека (BCSC) имеет решающее значение для решения проблем, возникающих при лечении рака молочной железы. Появление концепции BCSC восходит к началу21-го века, когда было обнаружено, что небольшая популяция CD44 + CD24- / низких клеток рака молочной железы способна генерировать гетерогенные опухоли у мышей 1,2. Впоследствии было замечено, что клетки рака молочной железы человека с высокой ферментативной активностью альдегиддегидрогеназы (ALDHhigh) также проявляли аналогичные стволовые клеткоподобные свойства3. Эти БЦСК представляют собой небольшую популяцию клеток, способных к самообновлению и дифференцировке, способствуя гетерогенному характеру объемных опухолей 1,2,3. Накапливающиеся данные свидетельствуют о том, что изменения в эволюционно сохраненных сигнальных путях приводят к выживанию и поддержанию BCSC 4,5,6,7,8,9,10,11,12,13,14 . Кроме того, было показано, что внешнее микроокружение клеток играет ключевую роль в диктовке различных функций BCSC 15,16,17. Эти молекулярные пути и внешние факторы, регулирующие функцию BCSC, способствуют рецидиву рака молочной железы, метастазированию18 и развитию резистентности к терапии 19,20,21, при этом остаточное существование BCSC после лечения представляет собой серьезную проблему для общей выживаемости пациентов с раком молочной железы 22,23 . Поэтому доклиническая оценка этих факторов очень важна для выявления методов лечения, нацеленных на BCSC, которые могут быть полезны для достижения лучших результатов лечения и улучшения общей выживаемости у пациентов с раком молочной железы.
Несколько моделей клеточных линий рака молочной железы человека in vitro и моделей ксенотрансплантата человека in vivo были использованы для характеристики BCSC 24,25,26,27,28,29. Способность клеточных линий непрерывно заселяться после каждого последующего прохождения делает их идеальной модельной системой для проведения омических и фармакогеномных исследований. Однако клеточные линии часто не могут повторить гетерогенность, наблюдаемую в образцах пациентов. Следовательно, важно дополнять данные клеточной линии образцами, полученными от пациента. Выделение БЦСК в чистом виде важно для обеспечения детальной характеристики БЦСК. Достижение этой чистоты зависит от выбора фенотипических маркеров, специфичных для БЦСК. В настоящее время фенотип клеток ALDHс высоким cd44 + CD24 чаще всего используется для различения и изоляции БЦСК человека из массовых популяций клеток рака молочной железы с использованием флуоресцентной активированной клеточной сортировки (FACS) для максимальной чистоты1, 3,26. Кроме того, свойства изолированных БЦСК, такие как самообновление, пролиферация и дифференциация, могут быть оценены с использованием методов in vitro и in vivo.
Например, in vitro колониеобразующие анализы могут быть использованы для оценки способности одной клетки к самообновлению с образованием колонии из 50 клеток или более при наличии различных условийлечения 30. Анализы маммосферы также могут быть использованы для оценки потенциала самообновления клеток рака молочной железы в условиях, не зависящих от анкориджа. Этот анализ измеряет способность отдельных клеток генерировать и расти в виде сфер (смесь BCSC и non-BCSC) при каждом последующем прохождении в условиях 31 неадгезивной культуры безсыворотки. Кроме того, 3-мерные (3D) модели культур могут быть использованы для оценки функции BCSC, включая взаимодействия клетка-клетка и клетка-матрица, которые близко повторяют микросреду in vivo и позволяют исследовать активность потенциальных BCSC-таргетных терапий32. Несмотря на разнообразие применений моделей in vitro, трудно смоделировать сложность условий in vivo , используя только анализы in vitro. Эта проблема может быть преодолена с помощью мышиных моделей ксенотрансплантата для оценки поведения BCSC in vivo. В частности, такие модели служат идеальной системой для оценки метастазирования рака молочной железы33, исследования взаимодействий с микросредой во время прогрессирования заболевания34, визуализации in vivo 35 и для прогнозирования специфической для пациента токсичности и эффективности противоопухолевых средств34.
Этот протокол предоставляет подробное описание выделения ALDH человекас высоким содержаниемCD44 + CD24-BCSC при максимальной чистоте из объемных популяций гетерогенных клеток рака молочной железы. Мы также предоставляем подробное описание трех методов in vitro (колониеобразующий анализ, анализ маммосферы и 3D-модель культуры) и анализ ксенотрансплантата опухоли in vivo, который может быть использован для оценки различных функций BCSC. Эти методы будут подходящими для использования исследователями, заинтересованными в выделении и характеристике BCSC из клеточных линий рака молочной железы человека или первичных клеток рака молочной железы и опухолевой ткани для целей понимания биологии BCSC и / или исследования новых BCSC-таргетных терапий.
протокол
Сбор хирургических или биопсийных образцов, полученных от пациентов, непосредственно у пациентов с раком молочной железы, полученных по согласию, осуществлялся в соответствии с утвержденным протоколом человеческой этики, утвержденным институциональным этическим советом. Все мыши, используемые для создания моделей ксенотрансплантатов, полученных от пациентов, поддерживались и размещались в одобренном учреждением животном учреждении. Опухолевая ткань из моделей ксенотрансплантатов, полученных от пациента с использованием мышей, была сгенерирована в соответствии с утвержденным этическим протоколом, одобренным институциональным комитетом по уходу за животными.
1. Подготовка клеточных линий
- Выполните все процедуры культивирования и окрашивания клеток в стерильных условиях в шкафу биобезопасности. Используйте стерильные клеточные культуры для посуды/колб и реагентов.
- Поддерживать клетки рака молочной железы человека при 37 ° C с 5% CO2 в определенных средах, дополненных фетальной бычьей сывороткой (FBS) и необходимыми факторами роста, специфичными для каждой клеточной линии.
- Поддерживать культуры клеток фибробластов NIH3T3 (для использования в колониеобразующих анализах) при 37 °C с 5% CO2 в модифицированной среде Орла (DMEM) Dulbecco, дополненной 10% FBS.
- Для всех культур пополняйте старые медиа каждые 2-3 дня свежими медиа. Как только культуры достигают 75-80% сливания, субкультура превращается в несколько стерильных колб для культивирования клеток.
2. Подготовка опухолевой ткани рака молочной железы
- Соберите полученные от пациента хирургические образцы или образцы биопсии непосредственно у пациентов с раком молочной железы в соответствии с протоколом человеческой этики, утвержденным советом по этике учреждения.
- Впоследствии, соберите и сгенерируйте опухолевую ткань из моделей ксенотрансплантатов, полученных от пациента, с использованием мышей в соответствии с протоколом этики животных, одобренным институциональным комитетом по уходу за животными.
- Соберите все опухолевые ткани в стерильных условиях в стерильную коническую трубку объемом 50 мл, содержащую 30 мл сред DMEM: F12, храните на льду и обрабатывайте образцы, как описано ниже, в течение 2 часов после сбора.
3. Генерация одноклеточных суспензий клеток рака молочной железы
- Аспиратные среды из колбы, содержащей монослой клеток рака молочной железы, который на 60-80% состоит из слива (клеточные линии выбора). Промыть клетки 1x фосфатно-буферным физиологическим раствором (PBS). Аспирировать PBS и добавить соответствующий раствор для диссоциации клеток (например, Трипсин: ЭДТА; достаточно, чтобы покрыть монослой клеток) и инкубировать в течение 5 мин при комнатной температуре (рекомендуется) или при 37 °C.
- Добавляют 5 мл культуральной среды для нейтрализации активности раствора диссоциации клеток.
- Переложите полученный диссоциированный клеточный раствор в коническую трубку объемом 50 мл и центрифугу при 1000 х г в течение 5 мин.
- Откажитесь от супернатанта и повторно суспендируйте ячейку гранулы в 5 мл 1x PBS. Подсчитайте клетки с помощью гемоцитометра и микроскопа.
ПРИМЕЧАНИЕ: Наблюдайте за слипанием клеток в гемоцитометре. Повторите стадию диссоциации клеток, если одноклеточная суспензия не сформировалась. - После подсчета клеток повторно центрифугируют клеточную суспензию при 1000 х г в течение 5 мин, отбрасывают супернатант и повторно суспендируют клеточную гранулу в буфере субстрата ALDH в концентрации 1 х 106 клеток/мл.
4. Генерация одноклеточной суспензии из образцов тканей
- Измельчите опухолевую ткань хирургическими лезвиями, используя технику крест-накрест, чтобы получить более мелкие кусочки размером около 1 мм. Перенесите кусочки ткани в свежую коническую трубку объемом 50 мл, содержащую буфер диссоциации 10 мл (1X коллагеназа в DMEM:F12). Запечатайте коническую трубку парапленкой и инкубируйте при 37 °C в шейкерном инкубаторе в течение 40 мин.
ПРИМЕЧАНИЕ: Если нет шейкерного инкубатора, поместите трубку в водяную баню с температурой 37 °C и перемешайте трубку, вихря каждые 5-10 минут. - Гранулируют переваренную ткань путем центрифугирования образца при 530 х г в течение 5 мин. Откажитесь от надосадочного вещества и добавьте 5 мл трипсина. Пипетка вверх и вниз с использованием пипетки 1 мл (установленная на отметку 750 мкл) для разрушения гранулы и инкубации на водяной бане 37 °C в течение 5 минут. После инкубации пипетку вверх и вниз энергично высвобождают одиночные клетки.
- Доливайте общий объем в пробирке до 25 мл средой DMEM:F12 и центрифугой при 1000 х г в течение 5 мин. Выбросьте супернатант и повторно суспендируйте гранулу в 1 мл раствора диспазы-ДНКазы. Инкубировать на водяной бане при температуре 37 °C в течение 5 мин.
- Доливайте общий объем в пробирке до 10 мл с помощью PBS. Перемешайте путем пипетки вверх и вниз, пропустите полученную клеточную суспензию через 40-мкм клеточный сетчатый фильтр, прикрепленный к свежей конической трубке объемом 50 мл. Центрифуга при 1000 х г в течение 5 мин.
- Откажитесь от супернатанта и повторно суспендируйте гранулу ячейки в 5 мл 1x PBS. Подсчет клеток и полная подготовка клеточной суспензии, как описано на этапах 3.4 и 3.5.
5. Выделение стволовых клеток рака молочной железы (БЦСК)
- Этикетировочные проточные трубки для незапятнанного контроля, одноклеточные элементы управления окрашиванием (DEAB control, ALDH, CD44-PE, CD24-PE-Cy7, 7AAD), отрицательная контрольная трубка (окрашенная DEAB, CD44-PE, CD24-PE-Cy7 и 7AAD), флуоресцентная система управления минус один (FMO) и трубка «сортировки» (окрашенная ALDH, CD44, CD24 и 7AAD).
- Перенос 500 мкл (0,5 х 106 клеток) клеточных суспензий со стадии 3,5 или стадии 4,5 в каждую трубку, которая помечена только клетками, CD44, CD24 и 7AAD. Поместите тюбики на лед до использования.
- Перенесите 2 мл образца (2 x 106 ячеек) в соответствующую пробирку ALDH. Добавьте 5 мкл DEAB в пробирки «DEAB control» и «negative control» и плотно закрывайте его крышкой. Добавьте 10 мкл субстрата ALDH в трубку 'ALDH', хорошо перемешайте путем вихря и немедленно передайте 500 мкл в соответствующую трубку 'DEAB control' и 'negative control'. Повторите «контроль DEAB», «отрицательный контроль» и «ALDH трубки» и инкубируйте при 37 °C в течение 30-60 мин (не превышайте 60 мин).
ПРИМЕЧАНИЕ: Оптимальное время инкубации может потребовать оптимизации в зависимости от клеточной линии. Всегда защищайте субстрат ALDH и трубки, содержащие окрашенные клетки, от света. - После инкубации центрифугируйте все образцы в течение 5 мин при 250 х г. Повторное суспендирование клеток в 500 мкл буфера субстрата ALDH. Добавьте рекомендованную производителем или оптимизированную для пользователя концентрацию коктейля антител против CD44-PE и против CD24-PE-Cy7 и инкубируйте при 4 °C в течение 30 мин. Добавьте антитела против CD44-PE и CD24-PE-Cy7 в соответствующие пробирки, меченые «CD44» и «CD24».
- После инкубации центрифугируйте все образцы по 250 х г в течение 5 мин. Повторное суспендирование клеток в 500 мкл буфера субстрата ALDH. Инкубируйте «отрицательную контрольную» трубку, «Сортировочную трубку» и трубку «7ADD» с 7AAD (рекомендуемая концентрация: 0,25 мкг / 1 х 106 клеток) в течение 10 минут на льду.
ПРИМЕЧАНИЕ: Активность ALDH обнаруживается в зеленом флуоресцентном канале, поэтому следует использовать фторхром с другим совместимым спектром излучения. Там, где спектральное перекрытие наблюдается во время многопараметрической проточной цитометрии, в качестве руководства следует использовать одноцветные элементы управления и управление FMO, чтобы обеспечить компенсацию между фторхромами для минимизации распространения флуоресцентного сигнала в другие каналы. - Создание протокола анализа на приборе СУИМ в рамках подготовки к анализу проб. Создание точечных диаграмм (прямое и боковое рассеяние, прямое рассеяние против флуоресцентных каналов).
- Используя незапятнанный контроль, отрегулируйте фотоумножитель для отделения мусора от всей популяции клеток и отрегулируйте флуоресцентное напряжение, чтобы переместить всю популяцию клеток вокруг первой логарифмической шкалы (101). Используя элемент управления DEAB, переместите всю популяцию клеток в пределах второй логарифмической шкалы (102), регулируя зеленый флуоресцентный канал напряжения.
- Сначала проанализируйте все элементы управления одиночным окрашиванием (ALDH, CD44-PE, CD24-PE-Cy7) и 7AAD и FMO, регулируя напряжение, чтобы отделить окрашенные от неокрашенных клеток и свести к минимуму разлив флуоресцентных сигналов в другие каналы.
- Ворота на положительную популяцию для каждого отдельного окрашенного образца клеток. Использование отрицательной контрольной трубки, затвора для жизнеспособности (7AAD отрицательный), ALDHнизкий и ALDHвысокий клеточные популяции (репрезентативная стратегия гатинга показана на рисунке 1B).
- Анализ многопараметрических окрашенных образцов, представляющих интерес, для выделения BCSC. Используя жизнеспособныенизкие ивысокие вентильные элементы ALDH, выберите популяцию клеток CD44 + CD24 ( BCSC) и CD44-CD24 + (не BCSC) соответственно (рисунок 1B).
- Собирайте жизнеспособные BCSC и не-BCSC в средах сбора в стерильных коллекторных трубках (популяции из двух репрезентативных клеточных линий, показанных на рисунке 2A & B). Используйте отсортированные клетки для последующих анализов in vitro и in vivo , как описано ниже.
ПРИМЕЧАНИЕ: В дополнение к анализам in vitro и in vivo , описанным ниже, BCSC могут быть проверены путем измерения экспрессии плюрипотентных маркеров, таких как SOX2, OCT4 и NANOG, с помощью стандартных методов иммуноблоттинга.
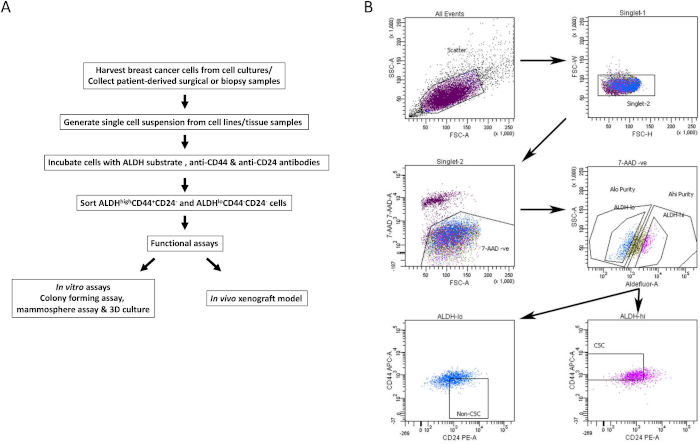
Рисунок 1: Стратегия facS по выделению BCSC из клеточных линий рака молочной железы и образцов тканей. (A) Блок-схема, описывающая процедуру изоляции BCSC. (B) Репрезентативные графики FACS, показывающие стратегию сортировки, используемую для изоляции жизнеспособных BCSC и non-BCSC из гетерогенного пула клеток. Клетки рака молочной железы человека MDA-MB-231 одновременно маркируются 7-AAD, CD44-APC, CD24-PE и субстратом ALDH. Подмножества ячеек были изолированы с использованием четырехцветного протокола на машине FACS. Клетки отбираются на основе ожидаемого рассеяния света, затем для синглетов и жизнеспособности на основе исключения 7-AAD. Затем клетки анализируются на активность ALDH, и верхние 20% наиболее положительных выбираются какпопуляция с высоким содержанием ALDH, в то время как нижние 20% клеток с самой низкой активностью ALDH считаютсянизкими ALDH. Наконец, 50%клеток с низким содержанием ALDH дополнительно отбираются на основе фенотипа CD44low/-CD24+ , а 50%клеток с высоким содержанием ALDH выбираются на основе фенотипа CD44+CD24- . Эта цифра была адаптирована из Chu et al.17. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Пропорции BCSC варьируются в различных клеточных линиях рака молочной железы. Репрезентативное изображение, показывающее дифференциальную пропорцию BCSC и non-BCSC в (A) SUM159 и (B) MDA-MD-468 тройных отрицательных клеточных линиях рака молочной железы после маркировки и сортировки, как описано на рисунке 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Колониеобразующий анализ
- Повторное суспендирование интересующих ячеек (отсортированных ячеек из шага 5.11 или несортированных ячеек из шагов 3.5 или 4.5) в полных средах.
- Маркировка трех проточных трубок для 1 x 102, 2 x 102 и 5 x 102 ячеек. Добавьте 2 мл полной среды и передайте соответствующий номер ячейки (отсортированный из шага 5.11 или несортированных ячеек из шагов 3.5 или 4.5) в соответствующие пробирки. Тщательно перемешайте клеточные растворы, пипетируя их вверх и вниз 5 раз.
- Обложите ячейки 6-луночной пластиной и распределите клеточную суспензию, осторожно закручивая пластины для получения равномерного распределения ячеек.
- Инкубируйте пластины в инкубаторе с температурой 37 °C, 5% CO2 до появления колоний (где колонии = ≥50 клеток на колонию). Тщательно пополняйте запасы два раза в неделю, не нарушая формирования колоний.
- Аспирировать средства и промыть один раз 1 мл PBS. Добавьте 0,5 мл 0,05% кристаллического фиолетового раствора в каждую лунку и инкубируйте пластину в течение 30 минут. Удалите излишки кристаллического фиолетового пятна, промыв 2 мл воды. Повторяйте этап стирки до тех пор, пока фоновое окрашивание не будет удалено.
- Используя микроскоп с 4-кратным и 10-кратным увеличением, подсчитайте и запишите общее количество сгенерированных колоний (репрезентативные изображения показаны на рисунке 3A).
- Рассчитайте частоту образования колоний следующим образом: Частота (%) = (количество сформированных колоний/количество засеянных клеток) x 100. Например, если 25 колоний генерируются из 1 х 102 клеток, то Частота образования колоний равна частоте = (25/100) x100 = 25%.
- В качестве альтернативы замените этапы 6.1-6.4 альтернативным методом, включающим совместную культивирование с фибробластами, которые обеспечивают микроокружную поддержку БЦСК за счет производства необходимых факторов роста и выживания.
- Предварительно покрытая клетка 60 мм культуральной посуды с бычьим коллагеном I типа (1 из 30 разведения 3 мг/мл коллагена). Дайте коллагену полимеризоваться в течение 30 минут в инкубаторе при температуре 37 °C. Аспирируйте неполимеризованный коллаген и дважды вымойте пластину 1x PBS. Накройте пластину с коллагеновым покрытием 1 мл PBS и отложите ее при комнатной температуре до использования.
- Маркировка трех проточных трубок для 1 x 103, 5 x 103 и 1 x 104 ячеек. Добавьте 4 мл колониеобразующей среды для анализа и перенесите соответствующее количество клеток (отсортированных со стадии 5.11 или несортированных клеток из стадий 3.5 или 4.5) в соответствующие пробирки. Добавьте облученные мышиные фибробласты NIH3T3 (4 x 104 клеток/мл среды). Тщательно перемешайте клеточные растворы, пипетируя их вверх и вниз 5 раз.
- Аспирируйте PBS из чашки для культивирования, покрытой коллагеном, со стадии 6.1 и нанесите клеточную смесь на каждую из пластин клеточной культуры, как описано на этапе 6.3.
- Инкубируют пластины в инкубаторе 37 °C, 5% CO2 и оставляют их нетронутыми в течение 7-10 дней или до образования колоний, без пополнения среды. Подсчитайте и запишите общее количество созданных колоний, как описано в шагах 6.6 и 6.7.
7. Анализ маммосферы
- Повторное суспендирование интересующих клеток (отсортированных клеток со стадии 5.11 или несортированных клеток со стадии 3.5 или 4.5) в полной среде маммосферы и пластинчатых клетках при плотности посева 5 х 102 клеток/см2 в 96 лунок со сверхнизким прикреплением клеточной культуральной пластины.
ПРИМЕЧАНИЕ: Плотность посева клеток должна быть оптимизирована для различных клеточных линий. - Инкубируйте культуральные пластины в течение 5-10 дней в инкубаторе с температурой 37 °C с 5% CO2. Тщательно пополняйте среды два раза в неделю, не нарушая формирования маммосферы.
- После инкубации подсчитайте количество маммосфер, образующихся в каждой скважине, с помощью микроскопа; где маммосферы определяются как кластеры клеток рака молочной железы диаметром более 100 мкм (репрезентативные изображения показаны на рисунке 3B).
- Рассчитайте эффективность формирования маммосферы (MFE) следующим образом: MFE (%) = (количество маммосфер на скважину)/ (количество клеток, засеянных на скважину) x 100 (т.е. если 5 маммосфер генерируются 1 x 102 ячейками в скважине, то MFE = (5/100) x 100 = 5%).
- Для субкультуры маммосфер осторожно переносят среды, содержащие содержимое маммосфер, в свежую коническую трубку объемом 50 мл и центрифужную среду при 1000 х г в течение 5 мин. Осторожно удаляют надосадочный материал, повторно суспендируют ячейку гранулы в 500 мкл трипсина и инкубируют в течение 5 мин при комнатной температуре.
- Выбросьте надосадочный материал и повторно суспендируйте гранулу в 1 мл полной маммосферной среды. Подсчитайте клетки с помощью гемоцитометра и повторно обложите клетки в ультранизкой пластине культивирования клеток, как описано в шаге 7.1.
ПРИМЕЧАНИЕ: В дополнение к субкультурированию, клетки, полученные из маммосферы, могут быть также дополнительно проанализированы FACS для оценки фенотипа BCSC и / или получения чистых популяций BCSC для других последующих анализов. - Чтобы определить количество клеток, инициирующих маммосферу, содержащихся в ваших клеточных популяциях, используйте альтернативный метод, включающий анализ сфероограничивающего разбавления (SLDA). Пластинчатые ячейки в последовательных разведениях с высоким и низким количеством клеток в 96 лунок со сверхнизким прикреплением клеточной культуральной пластины, причем самое высокое разбавление приводит к менее чем одной клетке на лунку.
- Инкубируйте культуральную пластину в течение 10-14 дней в инкубаторе с температурой 37 °C с 5% CO2 и оставляйте их нетронутыми, чтобы избежать агрегации клеток.
- После инкубации подсчитайте количество маммосфер, образующихся в каждой скважине, с помощью микроскопа; где маммосферы определяются как кластеры клеток рака молочной железы диаметром более 100 мкм. Рассчитайте частоту и значимость инициирования сферы с помощью онлайн-программного обеспечения (http://bioinf.wehi.edu.au/software/elda/) Extreme Limit Dilution Analysis (ELDA).
8.3D культурная модель
- В зависимости от экспериментального вопроса используют экстракт базальной мембраны (BME) с факторами роста или без них (сниженные). Для того чтобы оценить влияние индивидуального фактора роста на раковые клетки, используют фактор роста, сниженный ИМЭ. Это также помогает свести к минимуму неспецифические эффекты эндогенных факторов роста, присутствующих в BME.
ПРИМЕЧАНИЕ: BME затвердевает при температуре выше 10 °C. Всегда держите BME на льду даже во время стадии оттаивания. - Осторожно добавьте 50 мкл BME на скважину в 96-луночную пластину без образования пузырьков воздуха и дайте ей полимеризоваться при 37 °C в течение 1 ч. После 10 мин инкубации добавьте 100 мкл PBS, чтобы избежать высыхания гелевого слоя.
- Повторно суспендируют отсортированные клетки со стадии 5.11 или несортированные клетки со стадии 3.5 или 4.5 в концентрации от 5 х 103 до 5 х 104/200 мкл в 3D-культуральной среде.
- Как только BME полимеризуется, удалите PBS, добавьте 200 мкл клеточной суспензии в каждую лунку и инкубируйте в инкубаторе с температурой 37 °C с 5% CO2. Добавьте PBS в окружающие скважины, чтобы избежать испарения среды.
ПРИМЕЧАНИЕ: Оптимальное количество ячеек для обшивки должно быть определено до постановки эксперимента. В зависимости от экспериментального вопроса, BCSC можно культивировать отдельно или с другими типами клеток (фибробласты / эндотелиальные / иммунные клетки и т. Д.). - Два раза в неделю добавляйте свежие носители в тарелки культуры. Поддерживать культуры в течение 10-14 дней до анализа образования органоидов (репрезентативные изображения показаны на рисунке 3С).
- Для субкультурирования тщательно аспирируйте среду и добавляйте 200 мкл диспазы к каждой лунке, содержащей клетки. Инкубировать пластину в инкубаторе при температуре 37 °C в течение 1 ч. В середине инкубационного периода (30 мин) выньте пластину, аккуратно выложите раствор диспазы вверх и вниз 5 раз и поместите обратно в инкубатор еще на 30 минут.
- Через 1 ч переложить диссоциированный клеточный раствор в проточную трубку. Промыть скважину 1x PBS, содержащим 2% FBS (fPBS) и перенести его в проточную трубку. Центрифугируйте трубку при 1000 х г в течение 5 мин. Осторожно аспирировать супернатант и добавить 500 мкл трипсина, инкубировать при 37 °C в течение 5 мин. Инактивировать трипсин путем добавления равного количества фПБС и центрифуги при 1000 х г в течение 5 мин.
- Выбросьте супернатант и повторно суспендируйте гранулу в 1 мл 3D-культуральной среды. Подсчитайте ячейки и повторно обложите необходимое количество ячеек в BME, как на шагах с 8.2 по 8.4.
ПРИМЕЧАНИЕ: Несколько скважин могут быть объединены для дальнейшего анализа или сортировки интересующей популяции клеток.

Рисунок 3: Анализы in vitro для оценки функции клеток BCSC. Анализы in vitro проводили, как описано в разделах протокола 6.1-6.5 (A), 7.1-7.4 (B) или 81. до 8,4 + 8,6 (С). (A) Репрезентативное изображение, показывающее колонии, генерируемые клетками рака молочной железы человека MDA-MB-231; (B) Репрезентативные изображения, показывающие формирование маммосферы клеточными линиями человека MCF7, SUM159 или MDA-MB-468, а также полученными от пациента клетками рака молочной железы LRCP17. (C) Репрезентативные изображения, показывающие 3D-структуры, образованные клетками рака молочной железы MCF7 и MDA-MB-231 в моделях 3D-культур. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Проводить эксперименты на животных в соответствии с протоколом этики животных, утвержденным институциональным комитетом по уходу за животными.
9. Модель ксенотрансплантата in vivo
- Чтобы определить способность стволовых клеток рака молочной железы к инициации опухоли, подготовьте клетки (отсортированную популяцию из стадии 5,7 или несортированные популяции из шагов 3,5 или 4,5) с использованием подхода ограничения разведения. Последовательно разбавляйте клетки в PBS, используя от 1 до 5 различных групп разведения, с дозами от 0,01-0,2 х 102 клеток / 100 мкл и до 1 х 106 клеток / 100 мкл.
ПРИМЕЧАНИЕ: В качестве элемента управления можно использовать несортированные/целые популяционные клетки. Количество используемых групп разведения будет зависеть от желаемого научного результата (например, если только тестирование опухолегенности, то может быть использована 1 группа с более высоким числом клеток, тогда как при расчете опухолевой иницирующей способности оптимально протестировать 5 предельных доз разбавления). - Для генерации моделей ксенотрансплантатов из клеток рака молочной железы человека используйте иммунокомпрометированные самки мышей (атипичные обнаженные [nu/nu], необезболенные диабетические/тяжелые комбинированные иммунодефицитные [NOD/SCID] или NOD/SCID IL2γ [NGS]).
ПРИМЕЧАНИЕ: Хотя можно использовать минимум 4 животных в группе, рекомендуется 8-12 животных в группе для получения надежных результатов, особенно для анализа ограничения разбавления. - Выполняйте стандартные инъекции прокладки для молочного жира (МФУ) с использованием 100 мкл / мышь каждого клеточного препарата в стерильных условиях в шкафу биобезопасности.
ПРИМЕЧАНИЕ: Для оптимального роста опухоли молочной железы и спонтанного метастазирования в отдаленные органы рекомендуется грудной МФП. В качестве альтернативы можно также использовать паховое МФУ. - После инъекции ежедневно контролируйте мышей на предмет общего состояния здоровья и роста опухоли в месте инъекции. При обнаружении пальпируемой опухоли начинают измерение размера опухоли суппортами в двух перпендикулярных размерах и записывают еженедельно до конечной точки.
ПРИМЕЧАНИЕ: Экспериментальная конечная точка определяется на основе правил, изложенных в институциональном протоколе по этике животных; Как правило, конечная точка путем эвтаназии обычно требуется, когда объемы опухоли достигают 1500мм3. Для популяций BCSC и/или более высоких клеточных доз (например, >1 x 104 клеток) эта конечная точка, вероятно, будет достигнута в течение 4-8 недель после инъекции МФУ. Для очень низких доз клеток и / или клеточных популяций, не относящихся к BCSC, рост опухоли должен прогрессировать в течение 8 месяцев после инъекции. - Из этих измерений рассчитайте объем опухоли по следующей формуле: Объем в мм3 = 0,52 х (ширина)2 х длина. При использовании подхода к ограничению разведения рассчитайте способность и значимость опухоли, инициирующие опухоль, с помощью онлайн-программного обеспечения ELDA (http://bioinf.wehi.edu.au/software/elda/).
- В качестве альтернативы, чтобы гуманно расширить конечную точку, хирургически удалить первичные опухоли и продолжить наблюдение за мышами на предмет здоровья и / или развития спонтанного метастазирования в отдаленных органах. Используют резецированную опухолевую ткань для генерации серийных ксенотрансплантатов.
- В конечной точке собирают ткань из первичных опухолей и отдаленных органов (лимфатических узлов, легких, печени, мозга, костей) и проводят гистопатологический и/или иммуногистохимический анализ или диссоциированную опухолевую ткань и используют в in vitro анализы, описанные в разделах 6-8.
Результаты
Описанный протокол позволяет выделить БЦСК человека из гетерогенной популяции клеток рака молочной железы, либо из клеточных линий, либо из диссоциированной опухолевой ткани. Для любой данной клеточной линии или образца ткани крайне важно генерировать однородную одноклеточную суспензию для выделения BCSC максимальной чистоты, поскольку загрязнение популяций, не относящихся к BCSC, может привести к переменным клеточным ответам, особенно если целью исследования является оценка эффективности терапевтических агентов, нацеленных на BCSC. Применение строгой стратегии сортировки минимизирует присутствие загрязняющих не BCSCC и приведет к способности собирать долю клеток рака молочной железы. со стволовыми клетками, которые отображают клеточный фенотип, который отличает их от массовой популяции раковых клеток. Клетки рака молочной железы человека, которые проявляют повышенную ферментативную активность ALDH, экспрессируют высокие уровни маркера клеточной поверхности CD44 и низкую / отрицательную экспрессию CD24, имеютвысокийфенотип ALDH CD44 + CD24- и могут быть классифицированы как BCSC. Доля БЦСК в основной популяции может варьироваться между клеточными линиями или пациентами (рисунок 2) и часто зависит от стадии заболевания, причем более агрессивный рак молочной железы обычно демонстрирует более высокую долю БЦСК 26,36,37.
Изолированные BCSC могут быть использованы для выполнения различных анализов in vitro и in vivo , где их поведение и функцию можно сравнить с поведением и функцией массовых и/или не-BCSC популяций. Например, способность одной клетки рака молочной железы самообновляться и генерировать колонии из 50 клеток может быть оценена с помощью колониеобразующих анализов (рисунок 3А). Способность БЦСК к самообновлению в независимых от анкориджа экспериментальных условиях может быть оценена с помощью анализов маммосферы, где переменное число сфер, размер и инициирующая сфера емкость могут быть проанализированы и коррелированы с наличием и функцией БЦСК (рисунок 3В). Важно определить плотность посевных клеток для различных клеточных линий рака молочной железы или образцов опухоли молочной железы для получения оптимальных результатов. Это особенно важно при выполнении SLDA, так как более высокая плотность клеток может привести к агрегации клеток, что приведет к неправильной интерпретации клеточной активности.
Культивирование клеток рака молочной железы в BME позволяет BCSC формировать 3D-структуры, которые рекапитулируют условия in vivo (рисунок 3C). 3D-культура клеток рака молочной железы в присутствии других типов микроокружающих клеток, таких как фибробласты, эндотелиальные клетки и / или иммунные клетки, обладает дополнительной способностью исследовать роль микросреды в 3D-росте BCSC38,39. Конкретные количества клеток, необходимые для генерации 3D-органоидов, могут варьироваться в зависимости от клеточной линии или источника опухоли пациента, и поэтому важно оптимизировать условия культивирования и количество клеток перед любыми крупномасштабными экспериментами.
Наконец, модели ксенотрансплантатов мышей in vivo могут быть использованы для понимания различий в росте (рисунок 4) самообновления, дифференцировки и/или опухолевой способности БЦСК in vivo по сравнению с не-БЦСК или объемными клеточными популяциями. Часто клеточные реакции in vitro, наблюдаемые в присутствии экзогенных факторов или терапевтических агентов, не являются репрезентативными для установки in vivo, предполагая, что наблюдение in vitro должно дополняться исследованиями in vivo, когда это возможно. Используя модели ксенотрансплантата in vivo, клеточная гетерогенность и архитектура опухоли сохраняются, и, таким образом, эти модели могут служить системой, которая близко имитирует микросреду у пациентов с человеческими заболеваниями. In vivo LDA может быть выполнен для определения доли опухолеобразующих клеток в данной смешанной популяции раковых клеток (BCSC или non-BCSC)40,41. Диапазон используемых клеточных разведений должен быть оптимизирован и будет зависеть от частоты инициирующих клеток в интересующей клеточной популяции. В идеале эти разведения должны включать дозы, которые приводят к 100% образованию опухоли, вплоть до доз клеток без образования опухоли и разумного диапазона между ними. Частота опухолевых клеток в первичных образцах может быть переменной, и в случаях, когда опухоли молочной железы имеют очень низкое количество или гетерогенные популяции опухолевых клеток, выполнение LDA может быть особенно сложным42. В этих случаях инъекция большего количества клеток была бы более подходящей для понимания биологии рака молочной железы.

Рисунок 4: Анализы ксенотрансплантата in vivo для оценки функции BCSC. Клетки рака молочной железы MDA-MB-231 были выделены FACS, как описано на рисунке 1, и введены в правую грудную жировую прокладку молочной железы самок мышей NSG, как описано в разделах протокола 9.1-9.8 (5 x 105 клеток / мышь; 4 мыши / клеточная популяция). Первичная кинетика роста опухоли молочной железы показана для ALDHhiCD44 + CD24- (■) по сравнению с ALDHс низким CD44с низким / -CD24 + (□) популяций. Данные, представленные в виде среднего ± S.E.M. * = значительно отличающийся размер опухоли, чем соответствующие ALDHlowCD44low/- подмножества в то же время (P < 0,05). Эта цифра была адаптирована из Croker et al.26. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Метастазы рака молочной железы и устойчивость к терапии стали основной причиной смертности среди женщин во всем мире. Существование субпопуляции стволовых клеток рака молочной железы (БЦСК) способствует усилению метастазирования 26,43,44,45,46 и резистентности к терапии 21,47,48. Поэтому основное внимание в будущих методах лечения должно быть направлено на искоренение БЦСК для достижения лучших результатов лечения, а для этого требуются точные методы выделения и характеристики функциональных характеристик БЦСК с использованием методов in vitro и in vivo.
Увековеченные клеточные линии, полученные из различных подтипов рака молочной железы, оказались возможными моделями для изучения биологии рака молочной железы, включая выделение и характеристику BCSC 26,49,50. Высокая пролиферативная способность и неограниченная способность к расширению клеточных линий обеспечивают идеальную модельную систему для выполнения исследований, которые являются высоковоспроизводимыми и технически простыми. Однако из-за клонального происхождения клеточных линий они могут не воспроизводить гетерогенность, проявляемую различными пациентами и / или раковыми клетками в опухолевой ткани. Кроме того, генетические изменения могут быть приобретены во время последовательного прохождения клеточных линий и могут вызывать генотипические или фенотипические изменения, которые могут сбивать с толку экспериментальные результаты51. Напротив, первичные клетки, полученные от пациента, несмотря на их ограниченную пролиферативную и экспансионистскую способность, могут обеспечить более точную модель, наблюдаемую in vivo. Однако такие образцы могут быть более трудными для получения и более технически сложными для работы. Все эти факторы следует учитывать при выборе исходной модельной системы, с помощью которой можно изолировать и охарактеризовать БЦСК.
FACS является широко используемым методом для выделения клеток, представляющих интерес, на основе экспрессии маркера клеточной поверхности52,53. Основываясь на антигенах клеточной поверхности (CD44 и CD24) и ферментативной активности ALDH, БЦСК человека могут быть выделены с высокой чистотой как из клеточных линий рака молочной железы, так и из опухолевых тканей 1,2. Эффективность сортировки определяет чистоту отсортированного образца, и пользователям рекомендуется проанализировать небольшую часть отсортированного образца, инкубированного с красителем жизнеспособности, чтобы проверить эффективность сортировки53,54. Эффективность сортировки может быть затруднена многими факторами, включая наличие клеточных скоплений, большое количество мертвых или умирающих клеток, неправильную компенсацию фторхромов и / или повреждение антигенов клеточной поверхности из-за чувствительности к трипсину или коллагеназе во время этапов диссоциации предварительной сортировки 53,54,55,56 . Таким образом, генерация правильной одноклеточной суспензии и использование соответствующих методов диссоциации клеток повысит эффективность сортировки. При выполнении многопараметрической сортировки ячеек важно выбирать фторхромы, которые минимизируют спектральное перекрытие. В некоторых случаях, когда спектрального перекрытия не избежать, для минимизации распространения флуоресцентных сигналов в другие каналы54 следует использовать элемент управления, содержащий все флуорохромы, кроме одного (флуоресценция минус один, FMO). Альтернативно, спектральное перекрытие может быть уменьшено путем иммуномагнитного выделения клеточных популяций до окончательной изоляции FACS клеток, представляющих интерес56.
Анализы in vitro, такие как колониеобразующие и маммосферные анализы, описанные в этом протоколе, широко использовались для изучения самообновления и пролиферативной способности BCSC 57,58,59,60,61,62. Кроме того, эти анализы могут быть использованы для оценки активности различных терапевтических препаратов на функцию BCSC. Несколько эволюционно сохраненных сигнальных путей были реализованы в поддержании BCSC63, и как колониеобразующие 64,65,66, так и анализы маммосферы 64,67 были использованы для оценки ценности терапевтического нарушения этих путей в качестве вмешательства для блокирования внутренней сигнализации BCSC и снижения активности BCSC и прогрессирования заболевания. Колониеобразующий анализ с использованием первичных клеток может быть сложным из-за низкой плотности клеток, вариаций между образцами и отсутствия его адаптивности к изолированным условиям in vitro. Эти проблемы могут быть преодолены путем культивирования BCSC на мягком агаровом слое или путем их кокультурирования с фибробластами на чашке клеточной культуры, покрытой коллагеном, 68,69,70. Кроме того, добавление факторов роста в питательные среды (такие как FGF771) также может улучшить колониеобразующую способность клеток, выделенных из образцов тканей. Кроме того, чрезмерное переваривание тканей с использованием коллагеназы или трипсина на этапе генерации одноклеточной суспензии может привести к низкой или нулевой колониеобразующей способности и снижению эффективности формирования маммосферы31. В обоих анализах следует позаботиться о том, чтобы инкубировать пробирные пластины нетронутыми, чтобы избежать разрушения колониальных или сферных структур по мере их формирования. Пользователям также рекомендуется продлить инкубационный период для первичных клеток (относительно клеточных линий), поскольку этим клеткам может потребоваться больше времени для формирования колоний или сфер.
Многочисленные линии доказательств продемонстрировали решающую роль внеклеточного матрикса (ECM)15,17,72 и стромальных компонентов, таких как фибробласты, иммунные клетки, эндотелиальные клетки и адипоциты, во влиянии на функции BCSC 15. Таким образом, модель 3D-культуры, которую мы описываем в этом протоколе, может обеспечить полезную экспериментальную систему, помогающую рекапитулировать микроокружение опухоли in vivo в условиях in vitro. Хотя система 3D-культуры очень напоминает микроокружение опухоли у больных раком, долгосрочное поддержание клеток в качестве органоидов может быть затруднено. Кроме того, оптимизация условий 3D-культуры и возможность точно исследовать способность к самообновлению и дифференциации BCSC является сложной задачей73. Эффективность органоидов, образующихся в системе 3D культуры, зависит от факторов роста, добавляемых в культуральную среду74. Отсутствие ключевых компонентов (например, ингибитора ROCK) может привести к снижению или отсутствию органоидного образования74. Среды следует пополнять каждые 3-4 дня для поддержания оптимальной клеточной функции и устойчивости культуры. Чтобы повторить условия in vivo и реакцию, всегда важно позволить клеткам образовывать органоиды до любого вида экзогенного лечения75. Клетки, полученные из образцов пациентов, должны давать достаточно времени для формирования органоидов, особенно если целью является оценка лекарственного ответа75.
Хотя эти методы in vitro являются привлекательными и доступными экспериментальными инструментами для характеристики функции BCSC, гетерогенность опухоли и влияние микроокружения опухоли на поведение BCSC не могут быть изучены с полной эффективностью. Поэтому эти анализы in vitro должны быть дополнены моделями ксенотрансплантата in vivo, когда это возможно, чтобы дополнительно подтвердить экспериментальные результаты, связанные с биологией BSCS и / или ответом на новые терапевтические средства. Были использованы различные модели in vivo для изучения опухолеобразности и метастазирования BCSC. Эктопические (подкожное приживление) и ортотопические (приживление МФУ) мышиные модели были использованы для генерации опухолей молочной железы и оценки продольных изменений в росте опухоли с течением времени50. Хотя оба подхода к инъекциям in vivo могут быть использованы для изучения биологии BCSC, нативные стромальные и связанные с сосудами компоненты МФУ позволяют более точно повторять первичную прогрессию опухоли молочной железы, наблюдаемую у пациентов, и, таким образом, инъекция МФП предпочтительна 76,77,78. Наконец, использование мышей с ослабленным иммунитетом необходимо для приживления БЦСК человека и роста опухоли, и это препятствует включению роли иммунных клеток в исследования опухолевого генеза и метастазирования79. Совсем недавно это ограничение было устранено путем использования гуманизированных мышей, у которых иммунная система человека восстанавливается с помощью трансплантации костного мозга до начала исследований ксенотрансплантатов 80,81,82. Тем не менее, эти модели являются дорогими и технически сложными, и, таким образом, все еще не часто используются83.
Таким образом, здесь мы предоставили протокол для выделения БЦСК человека как из клеточных линий рака молочной железы, так и из образцов опухолевой ткани, полученных от пациента. Мы также описали протоколы in vitro и in vivo для последующих анализов, которые могут быть использованы для изучения функции BCSC, с возможностью оптимизации для различных источников клеток рака молочной железы и гибкостью для выполнения в различных экспериментальных условиях. Эти протоколы будут полезны для исследователей, заинтересованных в раковых стволовых клетках, биологии рака молочной железы и терапевтической разработке, с конечной целью улучшения результатов лечения пациентов в будущем.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим сотрудников нашей лаборатории за их полезные обсуждения и поддержку. Наши исследования стволовых клеток рака молочной железы и микроокружения опухоли финансируются за счет грантов Научно-исследовательского института Канадского общества исследований рака и Программы по борьбе с раком молочной железы Министерства обороны США (грант No BC160912). V.B. поддерживается Западной постдокторской стипендией (Западный университет), а A.L.A. и V.B. поддерживаются Обществом рака молочной железы Канады. C.L. поддерживается стипендией Vanier Canada Graduate Scholarship от правительства Канады.
Материалы
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
Ссылки
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены