Method Article
Isolamento e Avaliação Funcional de Células-Tronco de Câncer de Mama Humano de Amostras de Células e Tecidos
Neste Artigo
Resumo
Este protocolo experimental descreve o isolamento de CBSCs de amostras de células e tecidos de câncer de mama, bem como os ensaios in vitro e in vivo que podem ser usados para avaliar o fenótipo e a função do CBSC.
Resumo
As células-tronco do câncer de mama (CBSCs) são células cancerígenas com características hereditárias ou adquiridas semelhantes a células-tronco. Apesar de sua baixa frequência, eles são os principais contribuintes para o início do câncer de mama, recaída, metástase e resistência à terapia. É imperativo entender a biologia das células-tronco do câncer de mama, a fim de identificar novos alvos terapêuticos para tratar o câncer de mama. As células-tronco do câncer de mama são isoladas e caracterizadas com base na expressão de marcadores únicos da superfície celular, como CD44, CD24 e atividade enzimática da aldeído desidrogenase (ALDH). Essas células CD44+CD24-altasde ALDH constituem a população de CBSC e podem ser isoladas por classificação celular ativada por fluorescência (FACS) para estudos funcionais a jusante. Dependendo da questão científica, diferentes métodos in vitro e in vivo podem ser usados para avaliar as características funcionais dos CBSC. Aqui, fornecemos um protocolo experimental detalhado para o isolamento de BCSCs humanos de populações heterogêneas de células de câncer de mama, bem como tecido tumoral primário obtido de pacientes com câncer de mama. Além disso, destacamos ensaios funcionais in vitro e in vivo a jusante, incluindo ensaios de formação de colônias, ensaios de mamosfera, modelos de cultura 3D e ensaios de xenoenxerto tumoral que podem ser usados para avaliar a função do CBSC.
Introdução
Compreender os mecanismos celulares e moleculares das células-tronco do câncer de mama humano (CBSCs) é crucial para enfrentar os desafios encontrados no tratamento do câncer de mama. O surgimento do conceito de CBSC remonta ao início doséculo 21, onde uma pequena população de células CD44+CD24-/baixo câncer de mama foi capaz de gerar tumores heterogêneos em camundongos 1,2. Posteriormente, observou-se que as células de câncer de mama humano com alta atividade enzimática da aldeído desidrogenase (ALDHalta) também apresentaram propriedades semelhantes às células-tronco3. Esses CBSCs representam uma pequena população de células capazes de auto-renovação e diferenciação, contribuindo para a natureza heterogênea dos tumores em massa 1,2,3. Evidências acumuladas sugerem que alterações nas vias de sinalização evolutivamente conservadas impulsionam a sobrevivência e a manutenção do CBSC 4,5,6,7,8,9,10,11,12,13,14 . Além disso, o microambiente extrínseco celular demonstrou desempenhar um papel fundamental na ditadura de diferentes funções do CBSC15,16,17. Essas vias moleculares e os fatores externos que regulam a função do CBSC contribuem para a recidiva do câncer de mama, metástase18 e desenvolvimento de resistência às terapias 19,20,21, sendo que a existência residual de CBSCs pós-tratamento representa um grande desafio para a sobrevida global de pacientes com câncer de mama 22,23 . A avaliação pré-clínica desses fatores é, portanto, muito importante para identificar terapias direcionadas ao BCSC que possam ser benéficas para alcançar melhores resultados de tratamento e melhorar a sobrevida global em pacientes com câncer de mama.
Vários modelos de linhagem celular de câncer de mama humano in vitro e modelos de xenoenxerto humano in vivo têm sido utilizados para caracterizar BCSCs24,25,26,27,28,29. A capacidade das linhagens celulares de repovoar continuamente após cada passagem sucessiva faz delas um sistema modelo ideal para realizar estudos farmacogenômicos e baseados em ômica. No entanto, as linhagens celulares muitas vezes não conseguem recapitular a heterogeneidade observada em amostras de pacientes. Por isso, é importante complementar os dados da linhagem celular com amostras derivadas do paciente. O isolamento de BCSCs em sua forma mais pura é importante para permitir a caracterização detalhada de BCSCs. Alcançar essa pureza depende da seleção de marcadores fenotípicos que são específicos para BCSCs. Atualmente, o fenótipo de células CD44 + CD24- de alta ALDH é mais comumente usado para distinguir e isolar BCSCs humanos de populações de células de câncer de mama em massa usando a classificaçãode células ativadas por fluorescência (FACS) para máxima pureza1, 3,26. Além disso, as propriedades de CBSCs isolados, como auto-renovação, proliferação e diferenciação, podem ser avaliadas usando técnicas in vitro e in vivo.
Por exemplo, ensaios de formação de colônias in vitro podem ser usados para avaliar a capacidade de uma única célula de se auto-renovar para formar uma colônia de 50 células ou mais na presença de diferentes condições de tratamento30. Os ensaios da mamosfera também podem ser usados para avaliar o potencial de auto-renovação das células de câncer de mama sob condições independentes de ancoragem. Este ensaio mede a capacidade de células individuais de gerar e crescer como esferas (mistura de BCSCs e não-BCSCs) a cada passagem sucessiva em condições de cultura não aderente livre de soro31. Além disso, modelos de cultura 3-Dimensional (3D) podem ser usados para avaliar a função do CBSC, incluindo interações célula-célula e célula-matriz que recapitulam de perto o microambiente in vivo e permitem a investigação da atividade de potenciais terapias direcionadas ao BCSC32. Apesar das diversas aplicações de modelos in vitro, é difícil modelar a complexidade de condições in vivo usando apenas ensaios in vitro. Esse desafio pode ser superado pelo uso de modelos de xenoenxerto de camundongos para avaliar o comportamento do CBSC in vivo. Em particular, tais modelos servem como um sistema ideal para avaliar a metástase do câncer de mama33, investigar as interações com o microambiente durante a progressão da doença 34, imagens in vivo 35 e para prever a toxicidade específica do paciente e a eficácia dos agentes antitumorais34.
Este protocolo fornece uma descrição detalhada para o isolamento de ALDH humanos CD44 + CD24-BCSCselevadosna pureza máxima de populações em massa de células heterogêneas de câncer de mama. Também fornecemos uma descrição detalhada de três técnicas in vitro (ensaio de formação de colônias, ensaio de mamosfera e modelo de cultura 3D) e um ensaio de xenoenxerto tumoral in vivo que pode ser usado para avaliar diferentes funções de CBSCs. Esses métodos seriam apropriados para uso por pesquisadores interessados em isolar e caracterizar BCSCs de linhagens celulares de câncer de mama humano ou células de câncer de mama derivadas de pacientes primários e tecido tumoral para fins de compreensão da biologia do BCSC e / ou investigação de novas terapias direcionadas ao BCSC.
Protocolo
A coleta de amostras cirúrgicas ou de biópsia derivadas de pacientes diretamente de pacientes com câncer de mama consentidas foi realizada sob protocolo de ética humana aprovado pelo conselho de ética institucional. Todos os camundongos usados para gerar modelos de xenoenxerto derivados do paciente foram mantidos e alojados em uma instalação animal aprovada pela instituição. O tecido tumoral de modelos de xenoenxerto derivados de pacientes usando camundongos foi gerado de acordo com o protocolo de ética aprovado pelo comitê institucional de cuidados com animais.
1. Preparação de linhagens celulares
- Realizar todos os procedimentos de cultura e coloração de células em condições estéreis em um gabinete de biossegurança. Use pratos/frascos e reagentes de cultura de células estéreis.
- Manter as células do câncer de mama humano a 37 °C com 5% de CO2 em meio definido suplementado com soro fetal bovino (FBS) e fatores de crescimento necessários específicos para cada linhagem celular.
- Manter culturas de células de fibroblastos NIH3T3 de camundongos (para uso em ensaios de formação de colônias) a 37 °C com 5% de CO2 no meio de águia modificado (DMEM) de Dulbecco suplementado com 10% de FBS.
- Para todas as culturas, reabasteça a velha mídia a cada 2-3 dias com novas mídias. Uma vez que as culturas atinjam 75-80% de confluência, subcultura em múltiplos frascos de cultura de células estéreis.
2. Preparação do tecido tumoral do câncer de mama
- Coletar as amostras cirúrgicas ou de biópsia derivadas do paciente diretamente de pacientes com câncer de mama consentidas sob um protocolo de ética humana aprovado pelo conselho de ética institucional.
- Posteriormente, coletar e gerar tecido tumoral a partir de modelos de xenoenxertos derivados de pacientes usando camundongos sob um protocolo de ética animal aprovado pelo comitê institucional de cuidados com animais.
- Coletar todos os tecidos tumorais em condições estéreis em um tubo cônico estéril de 50 mL contendo 30 mL de meio DMEM:F12, manter no gelo e processar as amostras conforme descrito abaixo dentro de 2 h após a coleta.
3. Geração de suspensões unicelulares de células de câncer de mama
- Aspirar o meio do balão contendo uma monocamada de células de câncer de mama que é 60-80% confluente (linhagens celulares de escolha). Lave as células com 1x solução salina tamponada com fosfato (PBS). Aspirar PBS e adicionar solução de dissociação celular apropriada (por exemplo, tripsina:EDTA; apenas o suficiente para cobrir a monocamada de células) e incubar por 5 min à temperatura ambiente (recomendado) ou a 37 °C.
- Adicionar 5 mL de meio de cultura para neutralizar a atividade da solução de dissociação celular.
- Transfira a solução de células dissociadas resultante para um tubo cônico de 50 mL e centrífuga a 1000 x g por 5 min.
- Descarte o sobrenadante e ressuscite o pellet celular em 5 mL de 1x PBS. Conte as células usando um hemocitômetro e um microscópio.
NOTA: Observe a aglomeração celular no hemocitômetro. Repita a etapa de dissociação celular se a suspensão de uma única célula não tiver se formado. - Após a contagem de células, recentrifugar a suspensão celular a 1000 x g por 5 min, descartar o sobrenadante e ressuspender o pellet celular em tampão de substrato ALDH a uma concentração de 1 x 106 células/mL.
4. Geração de suspensão unicelular a partir de amostras de tecido
- Pice o tecido tumoral com lâminas cirúrgicas usando uma técnica de cruzamento para obter pedaços menores de aproximadamente 1 mm de tamanho. Transfira os pedaços de tecido para um tubo cônico fresco de 50 mL contendo 10 mL de tampão de dissociação (1X colagenase em DMEM:F12). Selar o tubo cónico com parafilme e incubar a 37 °C numa incubadora agitadora durante 40 minutos.
NOTA: Se não houver uma incubadora agitadora, coloque o tubo em banho-maria de 37 °C e misture o tubo por vórtice a cada 5-10 min. - Pellet o tecido digerido por centrifugação da amostra a 530 x g durante 5 min. Descarte o sobrenadante e adicione 5 mL de tripsina. Pipetar para cima e para baixo utilizando uma pipeta de 1 ml (ajustada para a marca de 750 μL) para interromper o pellet e incubar em banho-maria de 37 °C durante 5 min. Após a incubação, pipete para cima e para baixo vigorosamente para liberar células únicas.
- Aumente o volume total no tubo para 25 mL com meio DMEM:F12 e centrífuga a 1000 x g por 5 min. Descarte o sobrenadante e ressuspenda o pellet em 1 mL de solução de dispase-DNase. Incubar em banho-maria a 37 °C durante 5 min.
- Aumente o volume total no tubo para 10 mL com PBS. Misture pipetando para cima e para baixo, passe a suspensão celular resultante através de um filtro celular de 40 μm ligado a um tubo cônico fresco de 50 mL. Centrífuga a 1000 x g durante 5 min.
- Descarte o sobrenadante e ressuspenda o pellet celular em 5 mL de 1x PBS. Contar as células e preparar completamente a suspensão celular, conforme descrito nos passos 3.4 e 3.5.
5. Isolamento de células-tronco de câncer de mama (CBSCs)
- Tubos de fluxo de etiqueta para o controle não corado, controles de coloração de célula única (controle DEAB, ALDH, CD44-PE, CD24-PE-Cy7, 7AAD), o tubo de controle negativo (corado com DEAB, CD44-PE, CD24-PE-Cy7 e 7AAD), controle fluorescente menos um (FMO) e o tubo 'sort' (corado com ALDH, CD44, CD24 e 7AAD).
- Transfira 500 μL (0,5 x 106 células) das suspensões celulares da etapa 3.5 ou da etapa 4.5 para cada tubo que é rotulado apenas com células, CD44, CD24 e 7AAD. Coloque os tubos no gelo até o uso.
- Transferir 2 ml de amostra (2 x 106 células) para o respetivo tubo 'ALDH'. Adicionar 5 μL de DEAB aos tubos de «controlo DEAB» e «controlo negativo» e tampar-o firmemente. Adicionar 10 μL de substrato ALDH ao tubo «ALDH», misturar bem por vórtice e transferir imediatamente 500 μL para o tubo correspondente de «controlo DEAB» e «controlo negativo». Recapitular os tubos «controlo DEAB», «controlo negativo» e «tubos ALDH» e incubar a 37 °C durante 30-60 min (não exceda 60 min).
NOTA: O tempo de incubação ideal pode exigir otimização, dependendo da linhagem celular. Proteja sempre o substrato ALDH e os tubos que contêm células coradas da luz. - Após a incubação, centrifugar todas as amostras por 5 min a 250 x g. Ressuspender as células em 500 μL de tampão substrato ALDH. Adicione a concentração recomendada pelo fabricante ou otimizada pelo usuário de coquetéis de anticorpos anti-CD44-PE e anti-CD24-PE-Cy7 e incube a 4 °C por 30 min. Adicione anticorpos anti-CD44-PE e anti-CD24-PE-Cy7 aos respectivos tubos marcados com 'CD44' e 'CD24'.
- Após a incubação, centrifugar todas as amostras a 250 x g durante 5 min. Ressuspender as células em 500 μL de tampão substrato ALDH. Incubar o tubo de "controlo negativo", o tubo de classificação e o tubo de "7ADD" com 7AAD (concentração sugerida: 0,25 μg/1 x 106 células) durante 10 min sobre gelo.
NOTA: A atividade ALDH é detectada no canal fluorescente verde, portanto, um fluorocromo com um espectro de emissão compatível diferente deve ser usado. Quando a sobreposição espectral é observada durante a citometria de fluxo multiparâmetro, os controles de cor única e o controle FMO devem ser usados como um guia para permitir a compensação entre fluorocromos para minimizar o transbordamento do sinal fluorescente para outros canais. - Configurar o protocolo de análise no instrumento FACS em preparação para a análise da amostra. Crie gráficos de dispersão (dispersão para a frente vs dispersão lateral, dispersão para a frente vs canais fluorescentes).
- Usando o controle não corado, ajuste o fotomultiplicador para separar os detritos da população de células inteiras e ajuste a tensão fluorescente para mover toda a população de células em torno da primeira escala logarítmica (101). Usando o controle DEAB, mova toda a população de células dentro da segunda escala de log (102) ajustando o canal de tensão fluorescente verde.
- Analise primeiro todos os controles de coloração única (ALDH, CD44-PE, CD24-PE-Cy7) e 7AAD e controle FMO, ajustando a tensão para separar as células coradas das não coradas e minimizar o derramamento de sinais fluorescentes em outros canais.
- Limite da população positiva para cada amostra de célula corada. Utilizando o tubo de controle negativo, porta para viabilidade (7AAD negativo), ALDHbaixa e ALDHalta populações celulares (estratégia de gating representativa mostrada na Figura 1B).
- Analisar amostras coradas multiparâmetros de interesse para isolar BCSCs. Usando as portas ALDH baixas viáveis eALDH altas, selecione a população de células CD44+CD24- (BCSC) e CD44-CD24+ (não-BCSC), respectivamente (Figura 1B).
- Coletar BCSCs viáveis e não-BCSCs em meios de coleta em tubos de coleta estéreis (populações de duas linhagens celulares representativas mostradas na Figura 2A & B). Use células classificadas para ensaios in vitro e in vivo a jusante, conforme descrito abaixo.
NOTA: Além dos ensaios in vitro e in vivo descritos abaixo, os BCSCs podem ser validados medindo a expressão de marcadores pluripotentes como SOX2, OCT4 e NANOG por meio de técnicas padrão de immunoblotting.
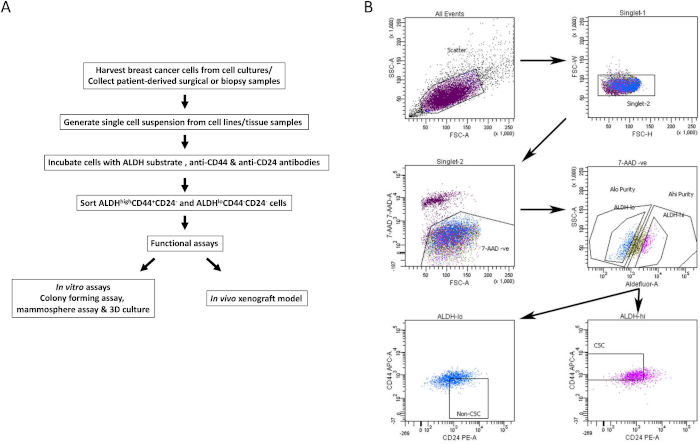
Figura 1: Estratégia de bloqueio FACS para isolamento de BCSCs de linhagens celulares de câncer de mama e amostras de tecido. (A) Fluxograma descrevendo o procedimento de isolamento BCSC. (B) Gráficos FACS representativos mostrando a estratégia de classificação usada para isolar BCSCs viáveis e não-BCSCs de um pool heterogêneo de células. As células de câncer de mama humano MDA-MB-231 são marcadas simultaneamente com 7-AAD, CD44-APC, CD24-PE e o substrato ALDH. Os subconjuntos celulares foram isolados usando um protocolo de quatro cores em uma máquina FACS. As células são selecionadas com base na dispersão de luz esperada, depois para singletos e na viabilidade com base na exclusão de 7-AAD. As células são então analisadas quanto à atividade da ALDH e os 20% mais positivos são selecionados como a população ALDH alta, enquanto os 20% inferiores das células com a menor atividade da ALDH foram consideradosALDH baixos. Finalmente, 50% das célulasbaixas de ALDH são selecionadas com base em um fenótipo CD44baixo/-CD24+ , e 50% das célulasaltas de ALDH são selecionadas com base no fenótipo CD44+CD24- . Essa figura foi adaptada de Chu et al.17. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: As proporções de CBSCs são variáveis em diferentes linhagens celulares de câncer de mama. Imagem representativa mostrando a proporção diferencial de CBSCs e não-BCSCs em (A) SUM159 e (B) MDA-MD-468 linhas celulares de câncer de mama triplo negativo após rotulagem e classificação, conforme descrito na Figura 1. Por favor, clique aqui para ver uma versão maior desta figura.
6. Ensaio de formação de colônia
- Ressuspenda as células de interesse (células classificadas da etapa 5.11 ou células não classificadas das etapas 3.5 ou 4.5) em uma mídia completa.
- Rotule três tubos de fluxo para 1 x 10 2, 2 x 10 2 e 5 x 102 células. Adicione 2 mL de meio completo e transfira o número de célula apropriado (classificado a partir da etapa 5.11 ou as células não classificadas das etapas 3.5 ou 4.5) nos respectivos tubos. Misture bem as soluções celulares, pipetando-as para cima e para baixo 5 vezes.
- Chapear as células em uma placa de 6 poços e distribuir a suspensão celular girando suavemente as placas para obter uma distribuição uniforme das células.
- Incubar as placas em uma incubadora de 37 °C, 5% de CO2 até que as colônias apareçam (onde colônias = ≥50 células por colônia). Reabasteça cuidadosamente o meio duas vezes por semana sem perturbar a formação da colônia.
- Aspirar meio e lavar uma vez com 1 mL de PBS. Adicionar 0,5 mL de solução violeta cristalina a 0,05% em cada poço e incubar a placa por 30 minutos. Remova o excesso de mancha violeta cristalina lavando com 2 mL de água. Repita a etapa de lavagem até que a coloração de fundo tenha sido removida.
- Usando um microscópio de ampliação de 4x e 10x, conte e registre o número total de colônias geradas (imagens representativas mostradas na Figura 3A).
- Calcule a frequência de formação de colônias da seguinte forma: Frequência (%) = (número de colônias formadas/número de células semeadas) x 100. Por exemplo, se 25 colônias são geradas a partir de 1 x 102 células, então a Frequência de formação de colônias é, Frequência = (25/100) x100 = 25%.
- Alternativamente, substitua as etapas 6.1 a 6.4 por um método alternativo envolvendo co-cultura com fibroblastos, que fornecem um suporte microambiental para BCSCs através da produção de fatores de crescimento e sobrevivência necessários.
- Placas de cultura de células pré-revestimento de 60 mm com colágeno bovino tipo I (diluição de 1 em 30 de colágeno de 3 mg/mL). Deixe o colágeno polimerizar por 30 min em uma incubadora de 37 °C. Aspirar o colagénio não polimerizado e lavar a placa duas vezes com 1x PBS. Cubra a placa revestida de colagénio com 1 ml de PBS e reserve-a à temperatura ambiente até à sua utilização.
- Rotule três tubos de fluxo para 1 x 10 3, 5 x 103 e 1 x 104 células. Adicionar 4 mL de meio de ensaio formador de colônias e transferir o número apropriado de células (classificadas a partir da etapa 5.11 ou células não classificadas das etapas 3.5 ou 4.5) para os respectivos tubos. Adicionar fibroblastos NIH3T3 irradiados de camundongos (4 x 104 células/mL de meio). Misture bem as soluções celulares, pipetando-as para cima e para baixo 5 vezes.
- Aspirar o PBS da placa de cultura revestida de colagénio a partir do passo 6.1 e colocar a mistura celular em cada uma das placas de cultura celular, conforme descrito no passo 6.3.
- Incubar as placas em uma incubadora de CO2 a 37 °C e deixá-las intactas por 7-10 dias ou até que as colônias se formem, sem reabastecer o meio. Conte e registre o número total de colônias geradas conforme descrito nas etapas 6.6 e 6.7.
7. Ensaio da mamosfera
- Ressuspender as células de interesse (células classificadas da etapa 5.11 ou células não classificadas das etapas 3.5 ou 4.5) em meios completos da mamosfera e células de placa a uma densidade de semeadura de 5 x 10 2 células/cm2 de área em uma placa de cultura celular de fixação ultrabaixa de 96 poços.
NOTA: A densidade de semeadura de células deve ser otimizada para diferentes linhagens celulares. - Incubar as placas de cultura por 5-10 dias em uma incubadora de 37 °C com 5% de CO2. Reabasteça cuidadosamente o meio duas vezes por semana sem perturbar a formação da mamosfera.
- Após a incubação, conte o número de mamosferas geradas em cada poço usando um microscópio; onde as mamosferas são definidas como aglomerados de células de câncer de mama maiores que 100 μm de diâmetro (imagens representativas mostradas na Figura 3B).
- Calcule a eficiência de formação da mamosfera (MFE) da seguinte forma: MFE (%) = (número de mamosferas por poço)/ (número de células semeadas por poço) x 100 (ou seja, se 5 mamosferas são geradas por 1 x 102 células em um poço, então MFE = (5/100) x 100 = 5%).
- Para subcultivar mamosferas, transfira cuidadosamente o meio contendo o conteúdo das mamosferas para um tubo cônico fresco de 50 mL e meio de centrífuga a 1000 x g por 5 min. Remova cuidadosamente o sobrenadante, ressuspenda o pellet celular em 500 μL de tripsina e incube por 5 min à temperatura ambiente.
- Descarte o sobrenadante e ressuspenda o pellet em 1 mL de meio mamósfera completo. Conte as células usando um hemocitômetro e recoloque as células em uma placa de cultura de células de fixação ultrabaixa, conforme descrito na etapa 7.1.
NOTA: Além da subcultura, as células derivadas da mamosfera também podem ser analisadas mais adiante pelo FACS para avaliar o fenótipo de CBSC e/ou obter populações puras de BCSCs para outros ensaios a jusante. - Para determinar o número de células iniciadoras da mamosfera contidas em suas populações celulares, use um método alternativo envolvendo a análise de diluição limitante da esfera (SLDA). Células de placa em diluições seriadas de alto a baixo número de células em uma placa de cultura de células de fixação ultrabaixa de 96 poços, com a maior diluição resultando em menos de uma célula por poço.
- Incubar a placa de cultura por 10-14 dias em uma incubadora de 37 °C com 5% de CO2 e deixá-los intactos para evitar a agregação celular.
- Após a incubação, conte o número de mamosferas geradas em cada poço usando um microscópio; onde as mamosferas são definidas como aglomerados de células de câncer de mama maiores que 100 μm de diâmetro. Calcule a frequência e a significância de início da esfera usando o software on-line ELDA (http://bioinf.wehi.edu.au/software/elda/) Extreme Limiting Dilution Analysis).
8.3D modelo de cultura
- Dependendo da questão experimental, utilizar extrato de membrana basal (BME) com ou sem fatores de crescimento (reduzidos). A fim de avaliar o efeito do fator de crescimento individual sobre as células cancerosas, use o fator de crescimento reduzido BME. Também ajuda a minimizar os efeitos inespecíficos dos fatores de crescimento endógenos presentes na EMB.
NOTA: BME solidifica acima de 10 °C. Mantenha sempre a BME no gelo, mesmo durante a etapa de descongelamento. - Adicionar cuidadosamente 50 μL de BME por poço numa placa de 96 poços sem criar bolhas de ar e deixar polimerizar a 37 °C durante 1 h. Após 10 min de incubação, adicione 100 μL PBS para evitar a secagem da camada de gel.
- Ressuspender as células classificadas da etapa 5.11 ou as células não classificadas das etapas 3.5 ou 4.5 a uma concentração de 5 x 103 a 5 x 104/200 μL em meios de cultura 3D.
- Uma vez que o BME tenha polimerizado, remova o PBS, adicione 200 μL de suspensão celular a cada poço e incube em incubadora a 37 °C com 5% de CO2. Adicione PBS aos poços circundantes para evitar a evaporação do meio.
NOTA: O número óptimo de células para chapeamento deve ser determinado antes da fixação da experiência. Dependendo da questão experimental, os BCSCs podem ser cultivados sozinhos ou com outros tipos de células (fibroblastos/células endoteliais/imunes, etc.). - Adicione meios frescos às placas de cultura duas vezes por semana. Manter as culturas por 10-14 dias antes de analisar a formação de organoides (imagens representativas mostradas na Figura 3C).
- Para a subcultura, aspirar cuidadosamente o meio e adicionar 200 μL de dispase a cada bem contendo células. Incubar a placa numa incubadora a 37 °C durante 1 h. A meio do período de incubação (30 min), retire a placa, pipete suavemente a solução de dispase para cima e para baixo 5 vezes e coloque de volta na incubadora por mais 30 min.
- Após 1 h, transferir a solução de célula dissociada para um tubo de fluxo. Lave o poço com 1x PBS contendo 2% de FBS (fPBS) e transfira-o para o tubo de fluxo. Centrifugar o tubo a 1000 x g durante 5 minutos. Aspirar cuidadosamente o sobrenadante e adicionar 500 μL de tripsina, incubar a 37 °C durante 5 min. Ative a tripsina adicionando quantidade igual de fPBS e centrífuga a 1000 x g por 5 min.
- Descarte o sobrenadante e ressuspenda o pellet em 1 mL de meio de cultura 3D. Conte as células e re-placa o número necessário de células no BME como nas etapas 8.2 a 8.4.
NOTA: Vários poços podem ser agrupados para analisar ou classificar melhor a população de células de interesse.

Figura 3: Ensaios in vitro para avaliar a função celular do CBSC. Os ensaios in vitro foram realizados conforme descrito nas seções 6.1 a 6.5 (A), 7.1 a 7.4 (B) ou 81. para 8,4 + 8,6 (C). (A) Imagem representativa mostrando as colônias geradas por células de câncer de mama humano MDA-MB-231; (B) Imagens representativas mostrando a formação da mamosfera por MCF7, SUM159 ou MDA-MB-468 linhagens celulares humanas, bem como células de câncer de mama LRCP17 derivadas do paciente. (C) Imagens representativas mostrando as estruturas 3D formadas por células de câncer de mama MCF7 e MDA-MB-231 em modelos de culturas 3D. Por favor, clique aqui para ver uma versão maior desta figura.
NOTA: Realizar experimentos com animais sob um protocolo de ética animal aprovado pelo comitê institucional de cuidados com animais.
9. Modelo de xenoenxerto in vivo
- Para determinar a capacidade de iniciação tumoral das células-tronco do câncer de mama, prepare as células (população classificada da etapa 5.7 ou populações não classificadas das etapas 3.5 ou 4.5) usando uma abordagem de diluição limitante. Diluir serialmente as células em PBS usando entre 1 e 5 grupos de diluição diferentes, com doses tão baixas quanto 0,01-0,2 x 102 células/100 μL e tão altas quanto 1 x 106 células/100 μL.
NOTA: Células de população não classificadas/inteiras podem ser usadas como um controle. O número de grupos de diluição utilizados dependerá do resultado científico desejado (por exemplo, se apenas testar a tumorgenicidade, então 1 grupo com um número de células mais elevado pode ser usado, ao passo que, ao calcular a capacidade de início do tumor, é ideal testar 5 doses limitantes de diluição). - Para gerar modelos de xenoenxerto a partir de células de câncer de mama humano, use camundongos fêmeas imunocomprometidos (nus atímicos [nu / nu], diabéticos não obesos/imunodeficientes combinados graves [NOD / SCID] ou cepas NOD / SCID IL2γ [NGS]).
NOTA: Embora um mínimo de 4 animais por grupo possa ser usado, recomenda-se 8-12 animais por grupo para obter resultados robustos, particularmente para limitar a análise de diluição. - Realizar injeções padrão de almofada de gordura mamária (MFP) usando 100 μL/rato de cada preparação celular, em condições estéreis em um gabinete de biossegurança.
NOTA: Para o crescimento ideal do tumor de mama e metástase espontânea para órgãos distantes, recomenda-se a MFP torácica. Alternativamente, a MFP inguinal também pode ser usada. - Após a injeção, monitore os ratos diariamente para a saúde geral e o crescimento do tumor no local da injeção. Após a detecção de um tumor palpável, comece a medir o tamanho do tumor por paquímetros em duas dimensões perpendiculares e registre semanalmente até o desfecho.
NOTA: O ponto final experimental é determinado com base nos regulamentos estabelecidos no protocolo institucional de ética animal; normalmente, o desfecho por eutanásia é geralmente necessário quando os volumes tumorais atingem 1500 mm3. Para populações de CBSC e/ou doses celulares mais elevadas (por exemplo, >1 x 104 células), este objetivo será provavelmente atingido dentro de 4-8 semanas após a injeção de MFP. Para doses celulares muito baixas e/ou populações de células não-CBSC, deve-se permitir que o crescimento do tumor progrida por até 8 meses após a injeção. - A partir dessas medidas, calcule-se o volume tumoral utilizando a seguinte fórmula: Volume em mm3 = 0,52 x (largura)2 x comprimento. Se estiver usando uma abordagem de diluição limitante, calcule a capacidade e a significância de início do tumor usando o software on-line ELDA (http://bioinf.wehi.edu.au/software/elda/).
- Alternativamente, estender humanamente o desfecho, remover cirurgicamente tumores primários e continuar a monitorar camundongos quanto à saúde e / ou desenvolvimento de metástases espontâneas em órgãos distantes. Use tecido tumoral ressecado para a geração de xenotransplantes seriados.
- No desfecho, colher tecido de tumores primários e órgãos distantes (linfonodos, pulmão, fígado, cérebro, osso) e realizar análises histopatológicas e/ou imuno-histoquímicas ou dissociar o tecido tumoral e utilizar nos ensaios in vitro descritos nas seções 6-8.
Resultados
O protocolo descrito permite o isolamento de BCSCs humanos de uma população heterogênea de células de câncer de mama, seja de linhagens celulares ou de tecido tumoral dissociado. Para qualquer linhagem celular ou amostra de tecido, é crucial gerar uma suspensão celular única uniforme para isolar BCSCs na pureza máxima, pois a contaminação de populações não-BCSC pode resultar em respostas celulares variáveis, especialmente se o objetivo do estudo for avaliar a eficácia de agentes terapêuticos direcionados aos BCSCs. A aplicação de uma estratégia de classificação rigorosa minimizará a presença de não-BCSCs contaminantes e resultará na capacidade de coletar a proporção de células de câncer de mama. com características semelhantes a células-tronco que exibem um fenótipo celular que os distingue da população em massa de células cancerígenas. As células de câncer de mama humano que exibem atividade enzimática de ALDH aumentada, expressam altos níveis do marcador de superfície celular CD44 e expressão baixa/negativa de CD24 têm um fenótipo CD44 + CD24- altode ALDH e podem ser classificadas como BCSCs. A proporção de CBSCs dentro da população em massa pode variar entre linhagens celulares ou pacientes (Figura 2), e muitas vezes depende do estágio da doença, com o câncer de mama mais agressivo geralmente apresentando uma proporção maior de BCSCs26,36,37.
BCSCs isolados podem ser usados para realizar diferentes ensaios in vitro e in vivo , onde seu comportamento e função podem ser comparados com os das populações a granel e/ou não-CBSC. Por exemplo, a capacidade de uma única célula de câncer de mama de se auto-renovar e gerar colônias de 50 células pode ser avaliada por ensaios formadores de colônias (Figura 3A). A capacidade dos BCSCs de se auto-renovarem em condições experimentais independentes de ancoragem pode ser avaliada por ensaios de mamosfera, onde o número variável da esfera, o tamanho e a capacidade de iniciação da esfera podem ser analisados e correlacionados com a presença e a função dos BCSCs (Figura 3B). É importante determinar as densidades celulares de semeadura para diferentes linhagens celulares de câncer de mama ou amostras de tumor de mama para obter resultados ótimos. Isso é particularmente importante ao realizar SLDA, pois densidades celulares mais altas podem levar à agregação celular, resultando em má interpretação da atividade celular.
A cultura de células de câncer de mama em BME permite que os BCSCs formem estruturas 3D que recapitulam em condições in vivo (Figura 3C). A cultura 3D de células de câncer de mama na presença de outros tipos de células microambientais, como fibroblastos, células endoteliais e/ou células imunes, tem a capacidade adicional de investigar o papel do microambiente no crescimento 3D de CBSCs38,39. Os números de células específicas necessários para gerar organoides 3D podem variar dependendo da linhagem celular ou da fonte do tumor do paciente e, portanto, é importante otimizar as condições de cultura e o número de células antes de qualquer experimento em larga escala.
Finalmente, modelos de xenoenxerto in vivo de camundongos podem ser usados para entender as diferenças no crescimento (Figura 4) de auto-renovação, diferenciação e / ou capacidade de início de tumor de BCSCs in vivo em comparação com não-BCSCs ou populações de células a granel. Muitas vezes, as respostas celulares in vitro observadas na presença de fatores exógenos ou agentes terapêuticos não são representativas do cenário in vivo, sugerindo que a observação in vitro deve ser complementada com estudos in vivo sempre que possível. Usando modelos de xenoenxerto in vivo, a heterogeneidade celular e a arquitetura tumoral são preservadas e, portanto, esses modelos podem servir como um sistema que imita de perto o microambiente em pacientes humanos. In vivo A LDA pode ser realizada para determinar a proporção de células iniciadoras de tumores em uma determinada população mista de células cancerígenas (BCSCs ou não-BCSCs)40,41. A gama de diluições celulares utilizadas deve ser otimizada e dependerá da frequência de células iniciadas na população celular de interesse. Idealmente, essas diluições devem incluir doses que resultem em 100% de formação de tumor, até doses celulares sem formação de tumor e uma faixa razoável entre elas. A frequência de células iniciadoras de tumores em amostras primárias pode ser variável e, nos casos em que os tumores de mama têm números muito baixos ou populações heterogêneas de células iniciadoras de tumores, a realização de LDA pode ser particularmentedesafiadora 42. Nesses casos, injetar um número maior de células seria mais apropriado para entender a biologia do câncer de mama.

Figura 4: Ensaios de xenoenxerto in vivo para avaliar a função do CBSC. As células de câncer de mama MDA-MB-231 foram isoladas por FACS, conforme descrito na Figura 1, e injetadas na almofada de gordura mamária torácica direita de camundongos NSG fêmeas, conforme descrito nas seções do protocolo 9.1 a 9.8 (5 x 105 células/camundongo; 4 camundongos/população celular). A cinética de crescimento do tumor primário de mama é mostrada para populações ALDHhiCD44+CD24- (■) versus ALDH low CD44low/-CD24+ (□). Os dados representados como a média ± S.E.M. * = tamanho do tumor significativamente diferente dos respectivos subconjuntos deALDH baixo CD44baixo/- no mesmo ponto de tempo (P < 0,05). Essa figura foi adaptada de Croker et al.26. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
A metástase do câncer de mama e a resistência à terapia tornaram-se a principal causa de mortalidade em mulheres em todo o mundo. A existência de uma subpopulação de células-tronco do câncer de mama (CBSCs) contribui para o aumento da metástase 26,43,44,45,46 e da resistência à terapia 21,47,48. Portanto, o foco de tratamentos futuros deve ter como objetivo erradicar os BCSCs para alcançar melhores resultados de tratamento, e isso requer métodos precisos para isolar e caracterizar as características funcionais dos BCSCs usando métodos in vitro e in vivo.
Linhagens celulares imortalizadas derivadas de diferentes subtipos de câncer de mama têm se mostrado modelos viáveis para estudar a biologia do câncer de mama, incluindo o isolamento e caracterização de CBSCs 26,49,50. A alta capacidade proliferativa e a capacidade de expansão ilimitada das linhagens celulares fornecem um sistema modelo ideal para a realização de estudos altamente reprodutíveis e tecnicamente simples. No entanto, devido à origem clonal das linhagens celulares, elas podem não recapitular a heterogeneidade exibida por diferentes pacientes e/ou por células cancerígenas dentro do tecido tumoral. Além disso, alterações genéticas podem ser adquiridas durante a passagem seriada de linhagens celulares e podem induzir alterações genotípicas ou fenotípicas que podem confundir os resultados experimentais51. Em contraste, as células primárias derivadas de pacientes, apesar de sua limitada capacidade proliferativa e de expansão, podem fornecer um modelo mais preciso do que o observado in vivo. No entanto, essas amostras podem ser mais difíceis de adquirir e ser mais tecnicamente desafiadoras de se trabalhar. Todos esses fatores devem ser considerados na escolha de um sistema de modelo inicial com o qual isolar e caracterizar os BCSCs.
A FACS é uma técnica comumente utilizada para isolar células de interesse com base na expressão do marcador de superfície celular52,53. Com base em antígenos de superfície celular (CD44 e CD24) e na atividade enzimática da ALDH, os CBSCs humanos podem ser isolados em alta pureza de linhagens celulares de câncer de mama e tecidos tumorais 1,2. A eficiência de triagem determina a pureza da amostra classificada, e recomenda-se que os usuários analisem uma pequena porção de amostra classificada incubada com corante de viabilidade para verificar a eficiência da classificação53,54. A eficiência de classificação pode ser confundida por muitos fatores, incluindo a presença de aglomerados celulares, um alto número de células mortas ou moribundas, compensação inadequada dos fluorocromos e/ou danos aos antígenos da superfície celular devido à sensibilidade à tripsina ou colagenase durante as etapas de dissociação pré-classificação53,54,55,56 . Portanto, a geração de uma suspensão adequada de uma única célula e o uso de técnicas apropriadas de dissociação celular aumentarão a eficiência da classificação. Ao executar a classificação de células multiparâmetros, é importante escolher fluorocromos que minimizem a sobreposição espectral. Em alguns casos, onde a sobreposição espectral não pode ser evitada, um controle que contenha todos os fluorocromos, exceto um (fluorescência menos um, FMO) deve ser usado para minimizar o transbordamento de sinais fluorescentes para outros canais54. Alternativamente, a sobreposição espectral pode ser reduzida pelo isolamento imunológico de populações celulares antes do isolamento final da FACS de células de interesse56.
Ensaios in vitro, como os ensaios de formação de colônias e mamosfera descritos neste protocolo, têm sido amplamente utilizados para estudar a auto-renovação e a capacidade proliferativa de CBSCs 57,58,59,60,61,62. Além disso, esses ensaios podem ser usados para avaliar a atividade de diferentes drogas terapêuticas na função do CBSC. Várias vias de sinalização evolutivamente conservadas foram implementadas na manutenção do CBSC 63, e tanto os ensaios formadores de colônias 64,65,66 quanto os ensaios da mamosfera64,67 têm sido usados para avaliar o valor da ruptura terapêutica dessas vias como uma intervenção para bloquear a sinalização intrínseca do CBSC e reduzir a atividade do CBSC e a progressão da doença. O ensaio de formação de colônias usando células primárias pode ser desafiador devido à baixa densidade celular, variação entre amostras e falta de sua adaptabilidade a condições isoladas in vitro. Esses desafios podem ser superados pela cultura de BCSCs em uma camada macia de ágar ou pela cocultura com fibroblastos em um prato de cultura celular revestido de colágeno68,69,70. Além disso, a suplementação de fatores de crescimento nos meios de cultura (como o FGF771) também poderia melhorar a capacidade de formação de colônias de células isoladas de amostras de tecido. Além disso, a digestão excessiva de tecidos usando colagenase ou tripsina durante a etapa de geração de suspensão unicelular pode resultar em baixa a zero capacidade de formação de colônias e reduzir a eficiência de formação de mamosferas31. Em ambos os ensaios, deve-se tomar cuidado para incubar as placas de ensaio sem serem perturbadas para evitar a ruptura das estruturas da colônia ou esfera à medida que elas estão se formando. Recomenda-se também que os usuários estendam o período de incubação para células primárias (em relação às linhas celulares), pois pode levar mais tempo para que essas células formem colônias ou esferas.
Múltiplas linhas de evidência têm demonstrado o papel crítico da matriz extracelular (MEC)15,17,72 e dos componentes estromais, como fibroblastos, células imunes, células endoteliais e adipócitos, na influência das funções do CBSC 15. Assim, o modelo de cultura 3D que descrevemos neste protocolo pode fornecer um sistema experimental útil para ajudar a recapitular o microambiente tumoral in vivo em um ambiente in vitro. Embora o sistema de cultura 3D se assemelhe muito ao microambiente tumoral em pacientes com câncer, a manutenção a longo prazo das células como organoides pode ser difícil. Além disso, a otimização das condições da cultura 3D e a capacidade de investigar com precisão a capacidade de auto-renovação e diferenciação dos BCSCs é um desafio73. A eficiência dos organoides formados no sistema de cultura 3D depende dos fatores de crescimento suplementados nos meios de cultura74. A ausência de componentes-chave (por exemplo, inibidor de ROCK) pode levar à redução ou ausência de formação de organoides74. A mídia deve ser reabastecida a cada 3-4 dias para manter a função celular ideal e a sustentabilidade da cultura. Para recapitular as condições e a resposta in vivo, é sempre importante permitir que as células formem organoides antes de qualquer tipo de tratamento exógeno75. Células derivadas de amostras de pacientes devem estar dando tempo suficiente para formar organoides, particularmente se o objetivo for avaliar a resposta medicamentosa75.
Embora esses métodos in vitro sejam ferramentas experimentais atraentes e acessíveis para caracterizar a função do CBSC, a heterogeneidade tumoral e o efeito do microambiente tumoral no comportamento do CBSC não podem ser estudados com eficácia completa. Estes ensaios in vitro devem, por conseguinte, ser complementados com modelos de xenoenxertos in vivo, sempre que possível, a fim de validar ainda mais os resultados experimentais relacionados com a biologia do BSCS e/ou a resposta a novas terapêuticas. Diferentes modelos in vivo têm sido utilizados estudo de tumorigenicidade e metástase BCSC. Modelos de camundongos ectópicos (enxerto subcutâneo) e ortotópicos (enxerto de MFP) têm sido utilizados para gerar tumores de mama e avaliar alterações longitudinais no crescimento tumoral ao longo do tempo50. Embora ambas as abordagens de injeção in vivo possam ser usadas para estudar a biologia do CBSC, os componentes nativos relacionados ao estroma e à vasculatura da MFP permitem uma recapitulação mais precisa da progressão do tumor primário de mama, como observado em pacientes, e, portanto, a injeção de MFP é preferida76,77,78. Finalmente, o uso de camundongos imunocomprometidos é necessário para o enxerto de CBSCs humanos e crescimento tumoral, o que impede a incorporação do papel das células imunes em estudos de tumorigênese e metástase79. Mais recentemente, essa limitação tem sido abordada por meio do uso de camundongos humanizados, nos quais um sistema imunológico humano é reconstituído via transplante de medula óssea antes do início dos estudos de xenoenxerto80,81,82. No entanto, esses modelos são caros e tecnicamente desafiadores e, portanto, ainda não são comumente usados83.
Em resumo, aqui fornecemos um protocolo para o isolamento de BCSCs humanos de ambas as linhagens celulares de câncer de mama e amostras de tecido tumoral derivadas de pacientes. Também descrevemos protocolos in vitro e in vivo para ensaios a jusante que podem ser usados para estudar a função do CBSC, com a capacidade de serem otimizados para diferentes fontes de células de câncer de mama e a flexibilidade a ser realizada sob diferentes condições experimentais. Esses protocolos serão úteis para pesquisadores interessados em células-tronco cancerígenas, biologia do câncer de mama e desenvolvimento terapêutico, com o objetivo final de melhorar os resultados dos pacientes no futuro.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos aos membros do nosso laboratório por suas discussões úteis e apoio. Nossa pesquisa sobre células-tronco de câncer de mama e o microambiente tumoral é financiada por doações do Instituto de Pesquisa da Sociedade Canadense de Pesquisa do Câncer e do Programa de Câncer de Mama do Departamento de Defesa do Exército dos EUA (Grant # BC160912). V.B. é apoiado por uma Western Postdoctoral Fellowship (Western University), e tanto a A.L.A. quanto a V.B. são apoiadas pela Breast Cancer Society of Canada. C.L. é apoiado por uma Bolsa de Pós-Graduação Vanier Canada do Governo do Canadá.
Materiais
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
Referências
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados