Method Article
从细胞和组织样本中分离和功能评估人类乳腺癌干细胞
摘要
该实验方案描述了从乳腺癌细胞和组织样品中分离BCSC以及可用于评估BCSC表型和功能的 体外 和 体内 测定。
摘要
乳腺癌干细胞(BCSC)是具有遗传或获得性干细胞样特征的癌细胞。尽管它们的频率很低,但它们是乳腺癌发生、复发、转移和治疗耐药性的主要贡献者。了解乳腺癌干细胞的生物学必须确定治疗乳腺癌的新治疗靶点。乳腺癌干细胞是根据独特的细胞表面标志物(如CD44、CD24)和醛脱氢酶(ALDH)的酶活性)的表达进行分离和表征的。这些 ALDH高CD44+CD24- 细胞构成了 BCSC 群体,可通过荧光激活细胞分选 (FACS) 进行下游功能研究。根据科学问题,可以使用不同的 体外 和 体内 方法来评估BCSC的功能特征。在这里,我们提供了一个详细的实验方案,用于从乳腺癌细胞的异质群体以及从乳腺癌患者获得的原发性肿瘤组织中分离人类BCSC。此外,我们还重点介绍了下游体 外 和 体内 功能测定,包括集落形成测定、乳腺球测定、3D 培养模型和可用于评估 BCSC 功能的肿瘤异种移植测定。
引言
了解人类乳腺癌干细胞(BCSC)的细胞和分子机制对于解决乳腺癌治疗中遇到的挑战至关重要。BCSC概念的出现可以追溯到21世纪初,当时发现少量CD44 + CD24-/低乳腺癌细胞能够在小鼠中产生异质肿瘤1,2。随后,观察到具有高酶活性的醛脱氢酶(ALDH高)的人乳腺癌细胞也表现出类似的干细胞样性质3。这些BCSC代表能够自我更新和分化的细胞群,有助于本体肿瘤的异质性1,2,3。越来越多的证据表明,进化保守信号通路的改变推动了BCSC的存活和维持4,5,6,7,8,9,10,11,12,13,14.此外,细胞外在微环境已被证明在决定不同的BCSC功能中起着关键作用15,16,17。这些分子途径和调节BCSC功能的外部因素有助于乳腺癌复发,转移18和对治疗耐药性的发展19,20,21,治疗后BCSC的残留存在对乳腺癌患者的总体生存构成重大挑战22,23.因此,这些因素的临床前评估对于确定BCSC靶向疗法非常重要,这些疗法可能有利于实现更好的治疗结果和提高乳腺癌患者的总生存期。
几种体外人乳腺癌细胞系模型和体内人异种移植模型已被用于表征BCSCs24,25,26,27,28,29。细胞系在每次连续传代后不断重新填充的能力使其成为进行基于组学和药物基因组学研究的理想模型系统。然而,细胞系通常无法概括在患者样本中观察到的异质性。因此,用患者来源的样本补充细胞系数据非常重要。以最纯净的形式分离BCSC对于实现BCSC的详细表征非常重要。 实现这种纯度取决于BCSC特有的表型标记的选择。 目前,ALDH高CD44+CD24- 细胞表型最常用于使用荧光活化细胞分选 (FACS) 从大量乳腺癌细胞群中区分和分离人 BCSC,以获得最大纯度1,3,26.此外,可以使用体外和体内技术评估分离的BCSCs的特性,例如自我更新,增殖和分化。
例如,体外集落形成测定可用于评估单个细胞在不同治疗条件下自我更新以形成50个或更多细胞集落的能力30。乳腺球测定也可用于评估乳腺癌细胞在锚定非依赖条件下的自我更新潜力。该测定法测量单细胞在无血清非贴壁培养条件下每次连续传代时以球体(BCSC 和非 BCSC 的混合物)生成和生长的能力31。此外,三维(3D)培养模型可用于评估BCSC功能,包括细胞-细胞和细胞-基质相互作用,这些相互作用密切概括了体内微环境,并允许研究潜在的BCSC靶向疗法的活性32。尽管体外模型的应用多种多样,但仅使用体外测定很难模拟体内条件的复杂性。这一挑战可以通过使用小鼠异种移植模型来评估体内BCSC行为来克服。特别是,这些模型可作为评估乳腺癌转移33,研究疾病进展期间与微环境的相互作用34,体内成像35以及预测患者特异性毒性和抗肿瘤药物功效的理想系统34。
该协议详细描述了从大量异质乳腺癌细胞群中以最大纯度分离人ALDH高CD44 + CD24-BCSC。我们还详细介绍了三种体外技术(集落形成测定、乳腺球测定和 3D 培养模型)和可用于评估 BCSC 不同功能的体内肿瘤异种移植测定。这些方法适合于有兴趣从人类乳腺癌细胞系或原发性患者来源的乳腺癌细胞和肿瘤组织中分离和表征BCSC的研究人员使用,以了解BCSC生物学和/或研究新的BCSC靶向疗法。
研究方案
直接从同意的乳腺癌患者那里收集患者来源的手术或活检样本是根据机构伦理委员会批准的批准的人类伦理协议进行的。所有用于生成患者来源的异种移植模型的小鼠均被维持并饲养在机构批准的动物设施中。使用小鼠的患者来源的异种移植模型的肿瘤组织是根据机构动物护理委员会批准的批准的伦理方案生成的。
1. 细胞系的制备
- 在生物安全柜的无菌条件下执行所有细胞培养和染色程序。使用无菌细胞培养皿/烧瓶和试剂。
- 在补充有胎牛血清(FBS)和每个细胞系特异性的必要生长因子的定义培养基中用5%CO2 将人乳腺癌细胞维持在37°C。
- 将小鼠NIH3T3成纤维细胞培养物(用于集落形成测定)保持在37°C,在补充有10%FBS的Dulbecco改良鹰培养基(DMEM)中含有5%CO2 。
- 对于所有培养物,每 2-3 天用新培养基补充旧培养基。一旦培养物达到75-80%汇合度,传代培养到多个无菌细胞培养瓶中。
2.乳腺癌肿瘤组织的制备
- 根据机构伦理委员会批准的人类伦理协议,直接从同意的乳腺癌患者中收集患者来源的手术或活检样本。
- 随后,根据机构动物护理委员会批准的动物伦理协议,使用小鼠从患者来源的异种移植模型中收集和生成肿瘤组织。
- 在无菌条件下将所有肿瘤组织收集到含有 50 mL DMEM:F12 培养基的 30 mL 无菌锥形管中,保持在冰上,并在收集后 2 小时内按下述方式处理样品。
3. 乳腺癌细胞单细胞悬液的产生
- 从含有60-80%汇合的单层乳腺癌细胞(选择细胞系)的烧瓶中吸出培养基。用1x磷酸盐缓冲盐水(PBS)洗涤细胞。吸出PBS并加入适当的细胞解离溶液(例如,胰蛋白酶:EDTA;刚好足以覆盖单层细胞),并在室温(推荐)或37°C下孵育5分钟。
- 加入 5 mL 培养基以中和细胞解离溶液的活性。
- 将所得解离的细胞溶液转移到50 mL锥形管中,并以1000 x g 离心5分钟。
- 弃去上清液并将细胞沉淀重悬于 5 mL 的 1x PBS 中。使用血细胞计数器和显微镜计数细胞。
注意:观察血细胞计数器中的细胞聚集。如果未形成单细胞悬液,则重复细胞解离步骤。 - 细胞计数后,以 1000 x g 重新离心细胞悬液 5 分钟,弃去上清液,并将细胞沉淀重悬于 ALDH 底物缓冲液中,浓度为 1 x 106 个细胞/mL。
4. 从组织样本中产生单细胞悬液
- 使用纵横交错技术用手术刀片切碎肿瘤组织,以获得约 1 毫米大小的较小碎片。将组织碎片转移到含有 10 mL 解离缓冲液(DMEM:F12 中的 1X 胶原酶)的新鲜 50 mL 锥形管中。用封口膜密封锥形管,并在37°C下在摇床培养箱中孵育40分钟。
注意:如果没有摇床培养箱,请将管放入37°C水浴中,每5-10分钟涡旋一次管。 - 通过将样品以530 x g 离心5分钟来沉淀消化的组织。弃去上清液并加入5mL胰蛋白酶。使用 1 mL 移液器(设置为 750 μL 标记)上下移液以破坏沉淀并在 37 °C 水浴中孵育 5 分钟。孵育后,剧烈上下移液以释放单个细胞。
- 用 DMEM:F12 培养基将管中的总体积加满至 25 mL,并以 1000 x g 离心 5 分钟。弃去上清液并将沉淀重悬于 1 mL 分散酶-DNase 溶液中。在37°C水浴中孵育5分钟。
- 用 PBS 将管中的总体积加满至 10 mL。通过上下移液混合,将所得细胞悬液通过连接到新鲜 50 mL 锥形管的 40 μm 细胞过滤器。以1000× g 离心5分钟。
- 弃去上清液并将细胞沉淀重悬于 5 mL 的 1x PBS 中。计数细胞并按照步骤3.4和3.5中所述完成细胞悬液的制备。
5. 乳腺癌干细胞的分离
- 标记用于未染色对照、单细胞染色对照(DEAB 对照、ALDH、CD44-PE、CD24-PE-Cy7、7AAD)、阴性对照管(用 DEAB、CD44-PE、CD24-PE-Cy7 和 7AAD 染色)、荧光减一 (FMO) 对照和"分选"管(用 ALDH、CD44、CD24 和 7AAD 染色)的流管。
- 将步骤3.5或步骤4.5的500μL(0.5 x 106 个细胞)的细胞悬液转移到仅标记细胞CD44,CD24和7AAD的每个管中。将试管放在冰上直至使用。
- 将 2 mL 样品(2 x 106 个细胞)转移到相应的"ALDH"试管中。将 5 μL DEAB 加入"DEAB 对照"和"阴性对照"管中,并盖紧。将 10 μL ALDH 底物加入"ALDH"试管中,通过涡旋充分混合,并立即将 500 μL 转移到相应的"DEAB 对照"和"阴性对照"试管中。回顾"DEAB对照","阴性对照"和"ALDH管",并在37°C孵育30-60分钟(不要超过60分钟)。
注意:最佳孵育时间可能需要优化,具体取决于细胞系。始终保护 ALDH 活性基材和含有染色细胞的试管免受光照。 - 孵育后,将所有样品以250× g离心5分钟。将细胞重悬于 500 μL ALDH 底物缓冲液中。加入制造商推荐或用户优化浓度的抗CD44-PE和抗CD24-PE-Cy7抗体混合物,并在4°C孵育30分钟。将抗 CD44-PE 和抗 CD24-PE-Cy7 抗体添加到相应的"CD44"和"CD24"标记的试管中。
- 孵育后,将所有样品以250 x g 离心5分钟。将细胞重悬于 500 μL ALDH 底物缓冲液中。将"阴性对照"管,"分选管"和"7ADD"管与7AAD(建议浓度:0.25μg/ 1 x 106 个细胞)在冰上孵育10分钟。
注意:在绿色荧光通道中检测到 ALDH 活性,因此应使用具有不同兼容发射光谱的荧光染料。如果在多参数流式细胞术中观察到光谱重叠,则应使用单色对照和FMO对照作为指导,以允许荧光染料之间进行补偿,以最大程度地减少荧光信号溢出到其他通道。 - 在FACS仪器上设置分析协议,为样品分析做准备。创建散点图(前向散射与侧向散射、前向散射与荧光通道)。
- 使用未染色的对照,调整光电倍增管以从整个细胞群中分离碎片,并调整荧光电压以将整个细胞群移动到第一个对数刻度(101)。使用DEAB对照,通过调整绿色荧光电压通道,在第二个对数刻度(102)内移动整个细胞群。
- 首先分析所有单染色对照(ALDH、CD44-PE、CD24-PE-Cy7)和7AAD和FMO对照,调整电压以将染色细胞与未染色细胞分离,并最大限度地减少荧光信号溢出到其他通道。
- 对每个染色细胞样品的阳性群体进行门控。使用阴性对照管,对活性(7AAD阴性)、ALDH低 细胞群和ALDH高 细胞群进行门控(代表性门控策略如图 1B所示)。
- 分析感兴趣的多参数染色样品以分离BCSC。 使用活的ALDH低门和ALDH高门,分别选择CD44 + CD24-(BCSC)和CD44-CD24 +(非BCSC)细胞群(图1B)。
- 在无菌收集管中的收集培养基中收集活的BCSC和非BCSC(来自 图2A&B所示的两个代表性细胞系的群体)。如下所述,使用分选的细胞进行下游 体外 和 体内 测定。
注意:除了下面描述的 体外 和 体内 测定外,还可以通过标准免疫印迹技术测量多能标志物(如SOX2,OCT4和NANOG)的表达来验证BCSC。
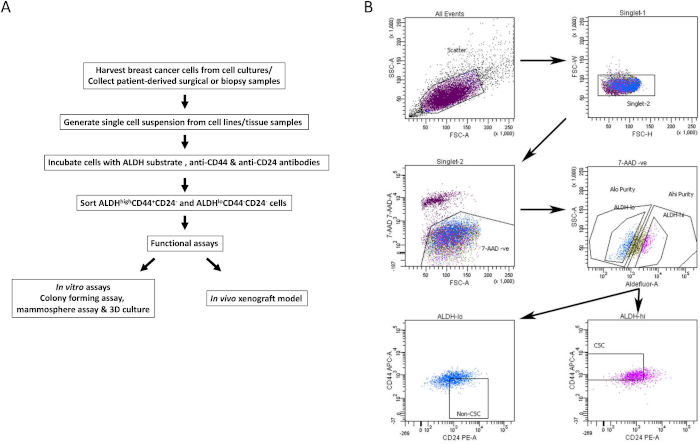
图 1:用于从乳腺癌细胞系和组织样本中分离 BCSC 的 FACS 门控策略。 (A)描述BCSC隔离程序的流程图。(B)代表性FACS图,显示了用于从异质细胞池中分离活的BCSC和非BCSC的分类策略。MDA-MB-231人乳腺癌细胞同时与7-AAD,CD44-APC,CD24-PE和ALDH底物标记。在FACS机器上使用四色方案分离细胞亚群。根据预期的光散射选择细胞,然后选择单线细胞,并根据7-AAD排除选择活力。然后分析细胞的 ALDH 活性,并选择前 20% 最阳性的细胞作为 ALDH高群体,而底部 20% 具有最低 ALDH 活性的细胞被认为是低 ALDH。最后,根据CD44低/-CD24+表型进一步选择50%的ALDH低细胞,根据CD44+CD24-表型选择50%的ALDH高细胞。该图改编自Chu等人17。请点击此处查看此图的大图。

图2:BCSCs的比例在不同的乳腺癌细胞系中是可变的。 代表性图像显示了(A)SUM159和(B)MDA-MD-468三阴性乳腺癌细胞系中BCSC和非BCSC的差异比例,如图 1所示进行标记和分类。 请点击此处查看此图的大图。
6. 菌落形成测定
- 将感兴趣的细胞(步骤5.11中的分选细胞或步骤3.5或4.5中的未分选细胞)重悬于完整的培养基中。
- 标记三个流管,分别用于 1 x 10 2、2 x 10 2 和 5 x 102 细胞。加入 2 mL 完整培养基,并在相应的管中转移适当的细胞数(从步骤 5.11 分选或从步骤 3.5 或 4.5 分选的未分选细胞)。通过上下移液5次彻底混合细胞溶液。
- 将细胞接种在6孔板中,并通过轻轻旋转板来分配细胞悬液以获得均匀的细胞分布。
- 将板在37°C,5%CO2 培养箱中孵育直至出现菌落(其中菌落= ≥每个菌落50个细胞)。每周两次仔细补充培养基,不要干扰菌落形成。
- 吸出培养基并用 1 mL PBS 洗涤一次。向每个孔中加入 0.5 mL 的 0.05% 结晶紫溶液,并将板孵育 30 分钟。用 2 mL 水洗涤去除多余的结晶紫污渍。重复洗涤步骤,直到去除背景染色。
- 使用4倍和10倍放大倍率的显微镜,计数并记录产生的菌落总数(代表性图像如图 3A所示)。
- 计算集落形成的频率如下:频率(%)=(#形成的菌落/接种的细胞数)x 100。例如,如果从 1 x 102 个细胞产生 25 个菌落,则菌落形成的频率为 Frequency = (25/100) x100 = 25%。
- 或者,将步骤6.1至6.4替换为涉及与成纤维细胞共培养的替代方法,该方法通过产生必要的生长和存活因子为BCSC提供微环境支持。
- 预涂细胞 60 mm 培养皿,含有 I 型牛胶原蛋白(3 mg/mL 胶原蛋白稀释度为 1/30)。让胶原蛋白在37°C培养箱中聚合30分钟。吸出未聚合的胶原蛋白,并用1x PBS洗涤板两次。用 1 mL PBS 覆盖胶原蛋白包被的板,并在室温下放在一边直至使用。
- 标记 1 x 10 3、5 x 103 和 1 x 104 细胞的三个流管。加入 4 mL 菌落形成测定培养基,并将适当数量的细胞(从步骤 5.11 分选或从步骤 3.5 或 4.5 分选的未分选细胞)转移到相应的管中。加入照射的小鼠NIH3T3成纤维细胞(4 x 104细胞/ mL培养基)。通过上下移液 5 次彻底混合细胞溶液。
- 从步骤6.1中的胶原蛋白包被的培养皿中吸出PBS,并按照步骤6.3中所述将细胞混合物接种到每个细胞培养板上。
- 将板在37°C,5%CO2 培养箱中孵育,并使其不受干扰7-10天或直到菌落形成,而不补充培养基。计数并记录如步骤6.6和6.7中所述产生的菌落总数。
7. 乳腺球测定
- 将感兴趣的细胞(步骤5.11中的分选细胞或步骤3.5或4.5中的未分选细胞)重悬于完整的乳腺培养基中,并以5 x 102 细胞/ cm2 面积的接种密度将细胞板重悬在96孔超低附着细胞培养板中。
注意:细胞接种密度应针对不同的细胞系进行优化。 - 将培养板在含有5%CO2的37°C培养箱中孵育5-10天。每周两次仔细补充培养基,不要干扰乳腺球的形成。
- 孵育后,使用显微镜计算每个孔中产生的乳腺球的数量;其中乳腺球定义为直径大于100μm的乳腺癌细胞簇(代表性图像如图 3B所示)。
- 计算乳腺球形成效率(MFE)如下:MFE(%)=(每孔乳腺球数)/(每孔接种的细胞数)x 100(即,如果孔中的1 x 102 个细胞产生5个乳腺球,则MFE = (5/100) x 100 = 5%)。
- 为了传代培养乳腺球,小心地将含有乳腺球内容物的培养基转移到新鲜的50mL锥形管中,并以1000× g 离心培养基5分钟。小心地除去上清液,将细胞沉淀重悬于500μL胰蛋白酶中,并在室温下孵育5分钟。
- 弃去上清液并将沉淀重悬于 1 mL 完全乳腺球培养基中。使用血细胞计数器计数细胞,并按照步骤7.1所述将细胞重新铺在超低附着细胞培养板中。
注意:除了亚培养外,FACS还可以进一步分析乳腺球来源的细胞,以评估BCSC表型和/或获得纯BCSC群体以进行其他下游测定。 - 要确定细胞群中包含的乳腺球起始细胞的数量,请使用涉及球体限制稀释分析 (SLDA) 的替代方法。在 96 孔超低附着细胞培养板中连续稀释高到低细胞数的细胞,最高稀释度导致每孔少于一个细胞。
- 将培养板在含有5%CO2 的37°C培养箱中孵育10-14天,并使其不受干扰以避免细胞聚集。
- 孵育后,使用显微镜计算每个孔中产生的乳腺球的数量;其中乳腺球被定义为直径大于100μm的乳腺癌细胞簇。使用极限稀释分析 (ELDA) 在线软件 (http://bioinf.wehi.edu.au/software/elda/) 计算球体起始频率和显著性。
8.3D培养模型
- 根据实验问题,使用基底膜提取物(BME)有或没有生长因子(减少)。为了评估个体生长因子对癌细胞的影响,使用生长因子降低BME。它还有助于最大限度地减少BME中存在的内源性生长因子的非特异性影响。
注意:BME在10°C以上固化。 即使在解冻步骤中,也始终将BME保持在冰上。 - 在96孔板中小心地每孔加入50μL的BME,而不会产生气泡,并使其在37°C下聚合1小时。孵育 10 分钟后,加入 100 μL PBS 以避免凝胶层干燥。
- 将步骤5.11中的分选细胞或步骤3.5或4.5的未分选细胞以5 x 103至 5 x 104/200μL的浓度重悬于3D培养基中。
- 一旦BME聚合,除去PBS,向每个孔中加入200μL细胞悬液,并在含有5%CO2的37°C培养箱中孵育。将PBS添加到周围的孔中以避免介质蒸发。
注意:应在设置实验之前确定用于接种的最佳细胞数。根据实验问题,BCSC可以单独培养,也可以与其他细胞类型(成纤维细胞/内皮细胞/免疫细胞等)一起培养。 - 每周两次向培养板中加入新鲜培养基。在分析类器官的形成之前,将培养物维持10-14天( 图3C所示的代表性图像)。
- 对于亚培养,小心吸出培养基并向每个含有细胞的孔中加入 200 μL 分散酶。将板在37°C培养箱中孵育1小时。孵育期(30分钟)进行到一半时,取出板,轻轻上下移液5次,然后放回培养箱中再放置30分钟。
- 1小时后,将解离的细胞溶液转移到流管中。用含有2%FBS(fPBS)的1x PBS清洗孔,并将其转移到流管中。将管以1000× g 离心5分钟。小心吸出上清液并加入500μL胰蛋白酶,在37°C孵育5分钟。通过加入等量的fPBS灭活胰蛋白酶,并以1000× g 离心5分钟。
- 弃去上清液并将沉淀重悬于 1 mL 3D 培养基中。计数细胞并重新铺板BME中所需数量的细胞,如步骤8.2至8.4所示。
注意:可以汇集多个孔以进一步分析或分类感兴趣的细胞群。

图 3:评估 BCSC 细胞功能的 体外 测定。体外 测定按照方案第6.1至6.5(A)、7.1至7.4(B)或81节所述进行。至 8.4 + 8.6 (C)。(A)显示MDA-MB-231人乳腺癌细胞产生的菌落的代表性图像;(B)代表性图像显示MCF7,SUM159或MDA-MB-468人类细胞系以及患者来源的LRCP17乳腺癌细胞形成的乳腺球。(C)代表性图像显示MCF7和MDA-MB-231乳腺癌细胞在3D培养模型中形成的3D结构。 请点击此处查看此图的大图。
注意:根据机构动物护理委员会批准的动物伦理协议进行动物实验。
9. 体内 异种移植模型
- 为了确定乳腺癌干细胞的肿瘤起始能力,使用限制稀释方法制备细胞(步骤5.7中的分类群体或步骤3.5或4.5中的未分类群体)。使用 1 到 5 个不同的稀释组连续稀释 PBS 中的细胞,剂量低至 0.01-0.2 x 102 个细胞/100 μL,高至 1 x 106 个细胞/100 μL。
注意:未排序/整个总体单元格可用作对照。使用的稀释组的数量将取决于所需的科学结果(例如,如果仅测试肿瘤原性,则可以使用1个细胞数较高的组,而在计算肿瘤起始容量时,最好测试5个限制稀释剂量)。 - 要从人类乳腺癌细胞生成异种移植模型,请使用免疫功能低下的雌性小鼠(无胸腺裸鼠[nu / nu],非肥胖糖尿病/严重联合免疫缺陷[NOD / SCID]或NOD / SCID IL2γ[NGS]菌株)。
注意:虽然每组至少可以使用4只动物,但建议每组8-12只动物以获得可靠的结果,特别是对于限制稀释分析。 - 在生物安全柜中的无菌条件下,使用每种细胞制剂的100μL /小鼠进行标准乳腺脂肪垫(MFP)注射。
注意:为了获得最佳的乳腺肿瘤生长和自发转移到远处器官,建议使用胸部多功能一体机。或者,也可以使用腹股沟多功能一体机。 - 注射后,每天监测小鼠的一般健康状况和注射部位的肿瘤生长。检测到可触及的肿瘤后,开始用卡尺在两个垂直维度上测量肿瘤大小,并每周记录直到终点。
注意:实验终点是根据机构动物伦理协议规定的法规确定的;通常,一旦肿瘤体积达到1500mm3,通常需要安乐死结束。对于BCSC群体和/或更高剂量的细胞(例如>1 x 104个细胞),该终点可能会在MFP注射后4-8周内达到。对于非常低的细胞剂量和/或非BCSC细胞群,应允许肿瘤生长在注射后长达8个月。 - 从这些测量中,使用以下公式计算肿瘤体积:mm3 = 0.52 x (宽度)2 x 长度。如果使用限制稀释方法,请使用ELDA在线软件(http://bioinf.wehi.edu.au/software/elda/)计算肿瘤起始容量和意义。
- 或者,为了人道地延长终点,手术切除原发性肿瘤并继续监测小鼠的健康和/或远处器官自发转移的发展。使用切除的肿瘤组织生成连续异种移植。
- 在终点,从原发肿瘤和远处器官(淋巴结,肺,肝,脑,骨)中收获组织并进行组织病理学和/或免疫组织化学分析或解离肿瘤组织并用于第6-8节所述的体外测定。
结果
所描述的方案允许从异质的乳腺癌细胞群中分离人BCSC,无论是来自细胞系还是从解离的肿瘤组织中。对于任何给定的细胞系或组织样品,产生均匀的单细胞悬液以最大纯度分离BCSC至关重要,因为污染的非BCSC群体可能导致不同的细胞反应,特别是如果研究目的是评估靶向BCSC的治疗剂的功效。 应用严格的分选策略将最大限度地减少污染非BCSC的存在,并导致收集乳腺癌细胞比例的能力具有干细胞样特征,显示出将它们与大量癌细胞区分开来的细胞表型。表现出增强的 ALDH 酶活性、表达高水平的细胞表面标志物 CD44 和低/阴性表达的 CD24 的人乳腺癌细胞具有 ALDH高CD44+CD24- 表型,可归类为 BCSC。散装群体中BCSC的比例可能因细胞系或患者而异(图2),并且通常取决于疾病阶段,更具侵袭性的乳腺癌通常显示更高比例的BCSCs26,36,37。
分离的BCSC可用于进行不同的 体外 和 体内 测定,其中其行为和功能可以与大量和/或非BCSC群体的行为和功能进行比较。例如,单个乳腺癌细胞自我更新和产生50个细胞集落的能力可以通过集落形成测定来评估(图3A)。BCSC在锚地无关的实验条件下自我更新的能力可以通过乳球测定进行评估,其中可以分析可变球体数量,大小和球起始能力,并与BCSC的存在和功能相关联(图3B)。确定不同乳腺癌细胞系或乳腺肿瘤样本的接种细胞密度以获得最佳结果非常重要。这在进行SLDA时尤其重要,因为较高的细胞密度可能导致细胞聚集,从而导致对细胞活动的误解。
在BME中培养乳腺癌细胞允许BCSC形成3D结构,概括 体内 条件(图3C)。在其他微环境细胞类型(如成纤维细胞、内皮细胞和/或免疫细胞)存在下对乳腺癌细胞进行 3D 培养,具有研究微环境在 BCSC 3D 生长中的作用的额外能力38,39。生成3D类器官所需的特定细胞数量可能因细胞系或患者肿瘤来源而异,因此在任何大规模实验之前优化培养条件和细胞数量非常重要。
最后,体内小鼠异种移植模型可用于了解与非BCSC或大细胞群相比,BCSC在体内的生长(图4)自我更新,分化和/或肿瘤起始能力的差异。通常,在存在外源性因子或治疗剂的情况下观察到的体外细胞反应不代表体内环境,这表明体外观察应尽可能与体内研究相辅相成。使用体内异种移植模型,保留了细胞异质性和肿瘤结构,因此这些模型可以作为密切模拟人类患者微环境的系统。体内可以进行LDA以确定给定混合癌细胞群(BCSC或非BCSC)中肿瘤起始细胞的比例40,41。应优化使用的细胞稀释范围,并将取决于目标细胞群中启动细胞的频率。理想情况下,这些稀释液应包括导致100%肿瘤形成的剂量,低至没有肿瘤形成的细胞剂量,并且在两者之间有一个合理的范围。原发样本中肿瘤起始细胞的频率可能是可变的,并且在乳腺肿瘤具有非常少的数量或肿瘤起始细胞群异质的情况下,进行LDA可能特别具有挑战性42。在这些情况下,注射大量细胞更适合理解乳腺癌生物学。

图 4:用于评估 BCSC 功能的体内异种移植测定。如图1所示,通过FACS分离MDA-MB-231乳腺癌细胞,并按照方案第9.1至9.8节(5 x 105细胞/小鼠;4只小鼠/细胞群)所述注射到雌性NSG小鼠的右胸乳脂垫中。显示原发性乳腺肿瘤生长动力学适用于 ALDHhi CD44+CD24- (■) 人群与 ALDH 低 CD44低/-CD24+ (□) 人群。数据表示为±平均值 S.E.M. * = 肿瘤大小与同一时间点各自的 ALDH 低 CD44低/-亚群显著不同(P < 0.05)。这个数字改编自克罗克等人26。请点击此处查看此图的大图。
讨论
乳腺癌转移和对治疗的抵抗已成为全世界妇女死亡的主要原因。乳腺癌干细胞(BCSC)亚群的存在有助于增强转移26,43,44,45,46和治疗耐药性21,47,48。因此,未来治疗的重点应旨在根除BCSC以达到更好的治疗效果,这需要使用体外和体内方法分离和表征BCSC功能特征的准确方法。
源自不同亚型乳腺癌的永生化细胞系已被证明是研究乳腺癌生物学的可行模型,包括BCSCs的分离和表征26,49,50。细胞系的高增殖能力和无限扩增能力为进行高度可重复且技术简单的研究提供了理想的模型系统。然而,由于细胞系的克隆起源,它们可能无法概括不同患者和/或肿瘤组织内癌细胞所表现出的异质性。此外,遗传改变可以在细胞系的连续传代过程中获得,并可能诱导基因型或表型变化,从而混淆实验结果51。相比之下,原代患者来源的细胞尽管增殖和扩增能力有限,但可以提供比体内观察到的更准确的模型。然而,这些样品可能更难获得,并且在技术上更具挑战性。在选择用于分离和表征BCSC的起始模型系统时,应考虑所有这些因素。
FACS是一种常用的技术,用于基于细胞表面标志物表达52,53分离感兴趣的细胞。基于细胞表面抗原(CD44 和 CD24)和 ALDH 酶活性,可以从乳腺癌细胞系和肿瘤组织中分离出高纯度的人 BCSC1,2。分选效率决定了分选样品的纯度,建议用户分析一小部分用活性染料孵育的分选样品,以检查分选效率53,54。分选效率可能受到许多因素的影响,包括细胞团块的存在、大量死亡或垂死的细胞、荧光染料补偿不当和/或在预分选解离步骤中由于对胰蛋白酶或胶原酶的敏感性而导致细胞表面抗原受损53,54,55,56.因此,产生适当的单细胞悬液并使用适当的细胞解离技术将提高分选效率。在进行多参数细胞分选时,选择能够最大限度地减少光谱重叠的荧光染料非常重要。在某些情况下,在无法避免光谱重叠的情况下,应使用包含除一种(荧光减一,FMO)以外的所有荧光染料的对照,以尽量减少荧光信号溢出到其他通道54。或者,可以通过在最终FACS分离感兴趣的细胞56之前免疫磁分离细胞群来减少光谱重叠。
体外测定,例如本协议中描述的集落形成和乳腺球测定已被广泛用于研究BCSCs的自我更新和增殖能力57,58,59,60,61,62。此外,这些测定可用于评估不同治疗药物对BCSC功能的活性。在BCSC维持63中已经实施了几种进化保守的信号通路,并且集落形成64,65,66和乳腺球测定64,67都用于评估这些途径的治疗破坏作为阻断BCSC内在信号传导和减少BCSC活性和疾病进展的干预措施的价值。由于细胞密度低、样品之间的差异以及缺乏对分离体外条件的适应性,使用原代细胞进行集落形成测定可能具有挑战性。这些挑战可以通过在软琼脂层上培养BCSC或在胶原包被的细胞培养皿上与成纤维细胞共培养来克服68,69,70。此外,在培养基中补充生长因子(如FGF771)也可以提高从组织样品中分离的细胞的集落形成能力。此外,在单细胞悬液生成步骤中使用胶原酶或胰蛋白酶过度消化组织会导致集落形成能力低至零,并降低乳腺球形成效率31。在这两种测定中,应注意孵育检测板不受干扰,以避免在形成时破坏菌落或球体结构。还建议用户延长原代细胞的孵育期(相对于细胞系),因为这些细胞形成集落或球体可能需要更长的时间。
多条证据线已经证明了细胞外基质(ECM)15,17,72和基质成分(如成纤维细胞,免疫细胞,内皮细胞和脂肪细胞)在影响BCSC功能方面的关键作用15。因此,我们在本协议中描述的3D培养模型可以提供有用的实验系统,以帮助在体外环境中概括体内肿瘤微环境。尽管3D培养系统与癌症患者的肿瘤微环境非常相似,但长期维持细胞作为类器官可能很困难。此外,优化3D培养条件以及准确研究BCSC的自我更新和分化能力的能力具有挑战性73。在3D培养系统中形成的类器官的效率取决于培养基中补充的生长因子74。缺乏关键成分(例如ROCK抑制剂)可能导致类器官形成减少或没有74。培养基应每 3-4 天补充一次,以维持最佳细胞功能和培养的可持续性。为了概括体内条件和反应,在任何类型的外源性处理之前让细胞形成类器官始终很重要75。来自患者样本的细胞应给予足够的时间来形成类器官,特别是如果目标是评估药物反应75。
虽然这些体外方法是表征BCSC功能的有吸引力且易于访问的实验工具,但肿瘤异质性和肿瘤微环境对BCSC行为的影响无法完全有效地研究。因此,在可行的情况下,这些体外测定应与体内异种移植模型相辅相成,以进一步验证与BSCS生物学和/或对新疗法的反应相关的实验结果。不同的体内模型已经用于研究BCSC的致瘤性和转移性。异位(皮下植入)和原位(MFP植入)小鼠模型已被用于产生乳腺肿瘤并评估肿瘤生长随时间的纵向变化50。尽管两种体内注射方法都可用于研究BCSC生物学,但MFP的天然基质和脉管系统相关成分允许更准确地概括在患者中观察到的原发性乳腺肿瘤进展,因此MFP注射是优选的76,77,78。最后,需要使用免疫功能低下的小鼠来植入人类BCSC和肿瘤生长,这阻止了免疫细胞在肿瘤发生和转移研究中的作用79。最近,这一限制已通过使用人源化小鼠得到解决,其中在异种移植研究开始之前通过骨髓移植重建人类免疫系统80,81,82。然而,这些模型价格昂贵且技术上具有挑战性,因此仍然不常用83。
总之,这里我们提供了一种从乳腺癌细胞系和患者来源的肿瘤组织样本中分离人类BCSC的方案。我们还描述了可用于研究BCSC功能的下游测定的 体外 和 体内 方案,能够针对不同的乳腺癌细胞来源进行优化,并且可以灵活地在不同的实验条件下进行。这些方案将对癌症干细胞,乳腺癌生物学和治疗开发感兴趣的研究人员有用,最终目标是改善未来的患者预后。
披露声明
作者没有什么可透露的。
致谢
我们感谢实验室成员的有益讨论和支持。我们对乳腺癌干细胞和肿瘤微环境的研究由加拿大癌症研究学会研究所和美国陆军国防部乳腺癌计划(赠款#BC160912)资助。V.B.由西部博士后奖学金(西部大学)支持,A.L.A.和V.B.都得到加拿腺癌协会的支持。C.L.得到了加拿大政府颁发的Vanier加拿大研究生奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 7-Aminoactinomycin D (7AAD) | BD | 51-68981E | suggested: 0.25 µg/1x106 cells |
| Acetone | Fisher | A18-1 | |
| Aldehyde dehydrogenase (ALDH) substrate | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions for ALDH substrate preparation |
| Basement membrane extract (BME) | Corning | 354234 | Sold under the commercial name Matrigel |
| Cell culture plates: 6 well | Corning | 877218 | |
| Cell culture plates: 60mm | Corning | 353002 | |
| Cell culture plates: 96-well ultra low attachment | Corning | 3474 | |
| Cell strainer: 40 micron | BD | 352340 | |
| Collagen | Stemcell Technologies | 7001 | Prepare 1:30 dilution of 3 mg/mL collagen in PBS |
| Collagenase | Sigma | 11088807001 | 1x |
| Conical tubes: 50 mL | Fisher scientific | 05-539-7 | |
| Crystal violet | Sigma | C6158 | Use 0.05% crystal violet solution in water for staining |
| Dispase | Stemcell Technologies | 7913 | 5U/mL |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| DNAse | Sigma | D5052 | 0.1 mg/mL final concentration |
| FBS | Avantor Seradigm Lifescience | 97068-085 | |
| Flow tubes: 5ml | BD | 352063 | Polypropylene round-bottom tubes |
| Methanol | Fisher | 84124 | |
| mouse anti-Human CD24 antibody | BD | 561646 | R-phycoerythrin and Cyanine dye conjugated Clone: ML5 |
| mouse anti-Human CD44 antibody | BD | 555479 | R-phycoerythrin conjugated, Clone: G44-26 |
| N,N-diethylaminobenzaldehyde (DEAB) | Stemcell Technologies | 1700 | Sold commerically as part of the ALDEFLOUR Assay kit; follow manufacturer's instructions DEAB preparation |
| PBS | Wisent Inc | 311-425-CL | 1x, Without calcium and magnesium |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Mammosphere Media Composition | |||
| B27 | Gibco | 17504-44 | 1x |
| bFGF | Sigma | F2006 | 10 ng/mL |
| BSA | Bioshop | ALB003 | 04% |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 20 ng/mL |
| Insulin | Sigma | 16634 | 5 µg/mL |
| 3D Organoid Media Composition | |||
| A8301 | Tocris | 2939 | 500 nM |
| B27 | Gibco | 17504-44 | 1x |
| DMEM:F12 | Gibco | 11330-032 | 1x, With L-glutamine and 15 mM HEPES |
| EGF | Sigma | E9644 | 5 ng/mL |
| FGF10 | Peprotech | 100-26 | 20 ng/mL |
| FGF7 | Peprotech | 100-19 | 5 ng/mL |
| GlutaMax | Invitrogen | 35050-061 | 1x |
| HEPES | Gibco | 15630-080 | 10 mM |
| N-acetylcysteine | Sigma | A9165 | 1.25 mM |
| Neuregulin β1 | Peprotech | 100-03 | 5 nM |
| Nicotinamide | Sigma | N0636 | 5 mM |
| Noggin | Peprotech | 120-10C | 100 ng/mL |
| R-spondin3 | R&D | 3500 | 250 ng/mL |
| SB202190 | Sigma | S7067 | 500 nM |
| Y-27632 | Tocris | 1254 | 5 µM |
参考文献
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proceedings of the National Academy of Sciences of the United States of America. 100 (7), 3983-3988 (2003).
- Shipitsin, M., et al. Molecular definition of breast tumor heterogeneity. Cancer Cell. 11 (3), 259-273 (2007).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Sulaiman, A., et al. Dual inhibition of Wnt and Yes-associated protein signaling retards the growth of triple-negative breast cancer in both mesenchymal and epithelial states. Molecular Oncology. 12 (4), 423-440 (2018).
- Debeb, B. G., et al. Histone deacetylase inhibitors stimulate dedifferentiation of human breast cancer cells through WNT/β-catenin signaling. Stem Cells. 30 (11), 2366-2377 (2012).
- Klutzny, S., et al. PDE5 inhibition eliminates cancer stem cells via induction of PKA signaling. Cell Death & Disease. 9 (2), 192 (2018).
- DiMeo, T. A., et al. A novel lung metastasis signature links Wnt signaling with cancer cell self-renewal and epithelial-mesenchymal transition in basal-like breast cancer. Cancer Research. 69 (13), 5364-5373 (2009).
- Liu, C. C., Prior, J., Piwnica-Worms, D., Bu, G. LRP6 overexpression defines a class of breast cancer subtype and is a target for therapy. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5136-5141 (2010).
- Miller-Kleinhenz, J., et al. Dual-targeting Wnt and uPA receptors using peptide conjugated ultra-small nanoparticle drug carriers inhibited cancer stem-cell phenotype in chemo-resistant breast cancer. Biomaterials. 152, 47-62 (2018).
- Mamaeva, V., et al. Inhibiting Notch Activity in Breast Cancer Stem Cells by Glucose Functionalized Nanoparticles Carrying γ-secretase Inhibitors. Molecular Therapy. 24 (5), 926-936 (2016).
- Ithimakin, S., et al. HER2 drives luminal breast cancer stem cells in the absence of HER2 amplification: implications for efficacy of adjuvant trastuzumab. Cancer Research. 73 (5), 1635-1646 (2013).
- Koike, Y., et al. Anti-cell growth and anti-cancer stem cell activities of the non-canonical hedgehog inhibitor GANT61 in triple-negative breast cancer cells. Breast Cancer. 24 (5), 683-693 (2017).
- Sun, Y., et al. Estrogen promotes stemness and invasiveness of ER-positive breast cancer cells through Gli1 activation. Molecular Cancer. 13, 137 (2014).
- Colavito, S. A., Zou, M. R., Yan, Q., Nguyen, D. X., Stern, D. F. Significance of glioma-associated oncogene homolog 1 (GLI1) expression in claudin-low breast cancer and crosstalk with the nuclear factor kappa-light-chain-enhancer of activated B cells (NFκB) pathway. Breast Cancer Research. 16 (5), 444 (2014).
- Bhat, V., Allan, A. L., Raouf, A. Role of the Microenvironment in Regulating Normal and Cancer Stem Cell Activity: Implications for Breast Cancer Progression and Therapy Response. Cancers. 11 (9), (2019).
- Pio, G. M., Xia, Y., Piaseczny, M. M., Chu, J. E., Allan, A. L. Soluble bone-derived osteopontin promotes migration and stem-like behavior of breast cancer cells. PloS One. 12 (5), 0177640 (2017).
- Chu, J. E., et al. Lung-derived factors mediate breast cancer cell migration through CD44 receptor-ligand interactions in a novel ex vivo system for analysis of organ-specific soluble proteins. Neoplasia. 16 (2), 180-191 (2014).
- McGowan, P. M., et al. Notch1 inhibition alters the CD44hi/CD24lo population and reduces the formation of brain metastases from breast cancer. Molecular Cancer Research. 9 (7), 834-844 (2011).
- Mao, J., et al. ShRNA targeting Notch1 sensitizes breast cancer stem cell to paclitaxel. International Journal of Biochemistry and Cell Biology. 45 (6), 1064-1073 (2013).
- Duru, N., et al. HER2-associated radioresistance of breast cancer stem cells isolated from HER2-negative breast cancer cells. Clinical Cancer Research. 18 (24), 6634-6647 (2012).
- Croker, A. K., Allan, A. L. Inhibition of aldehyde dehydrogenase (ALDH) activity reduces chemotherapy and radiation resistance of stem-like ALDHhiCD44+ human breast cancer cells. Breast Cancer Research and Treatment. 133 (1), 75-87 (2012).
- Creighton, C. J., et al. Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13820-13825 (2009).
- Calcagno, A. M., et al. Prolonged drug selection of breast cancer cells and enrichment of cancer stem cell characteristics. Journal of the National Cancer Institute. 102 (21), 1637-1652 (2010).
- Feng, Y., et al. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 5 (2), 77-106 (2018).
- Samanta, D., Gilkes, D. M., Chaturvedi, P., Xiang, L., Semenza, G. L. Hypoxia-inducible factors are required for chemotherapy resistance of breast cancer stem cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 5429-5438 (2014).
- Croker, A. K., et al. High aldehyde dehydrogenase and expression of cancer stem cell markers selects for breast cancer cells with enhanced malignant and metastatic ability. Journal of Cellular and Molecular Medicine. 13 (8), 2236-2252 (2009).
- Morel, A. P., et al. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PloS One. 3 (8), 2888 (2008).
- Muntimadugu, E., Kumar, R., Saladi, S., Rafeeqi, T. A., Khan, W. CD44 targeted chemotherapy for co-eradication of breast cancer stem cells and cancer cells using polymeric nanoparticles of salinomycin and paclitaxel. Colloids Surf B Biointerfaces. 143, 532-546 (2016).
- Liu, S., et al. Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts. Stem Cell Reports. 2 (1), 78-91 (2014).
- Munshi, A., Hobbs, M., Meyn, R. E. Clonogenic cell survival assay. Methods in Molecular Medicine. 110, 21-28 (2005).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Shin, C. S., Kwak, B., Han, B., Park, K. Development of an in vitro 3D tumor model to study therapeutic efficiency of an anticancer drug. Molecular Pharmaceutics. 10 (6), 2167-2175 (2013).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Cheon, D. J., Orsulic, S. Mouse models of cancer. Annual Review of Pathology. 6, 95-119 (2011).
- Lyons, S. K. Advances in imaging mouse tumour models in vivo. Journal of Pathology. 205 (2), 194-205 (2005).
- Margaryan, N. V., et al. The Stem Cell Phenotype of Aggressive Breast Cancer Cells. Cancers. 11 (3), (2019).
- Ma, F., et al. Enriched CD44(+)/CD24(-) population drives the aggressive phenotypes presented in triple-negative breast cancer (TNBC). Cancer Letters. 353 (2), 153-159 (2014).
- Chatterjee, S., et al. Paracrine Crosstalk between Fibroblasts and ER(+) Breast Cancer Cells Creates an IL1β-Enriched Niche that Promotes Tumor Growth. iScience. 19, 388-401 (2019).
- Phan-Lai, V., et al. Three-dimensional scaffolds to evaluate tumor associated fibroblast-mediated suppression of breast tumor specific T cells. Biomacromolecules. 14 (5), 1330-1337 (2013).
- O'Brien, C. A., Kreso, A., Jamieson, C. H. Cancer stem cells and self-renewal. Clinical Cancer Research. 16 (12), 3113-3120 (2010).
- Hu, Y., Smyth, G. K. ELDA: extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunological Methods. 347 (1-2), 70-78 (2009).
- Stewart, J. M., et al. Phenotypic heterogeneity and instability of human ovarian tumor-initiating cells. Proceedings of the National Academy of Sciences of the United States of America. 108 (16), 6468-6473 (2011).
- Abraham, B. K., et al. Prevalence of CD44+/CD24-/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clinical Cancer Research. 11 (3), 1154-1159 (2005).
- Balic, M., et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clinical Cancer Research. 12 (19), 5615-5621 (2006).
- Charafe-Jauffret, E., et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer. Clinical Cancer Research. 16 (1), 45-55 (2010).
- Marcato, P., et al. Aldehyde dehydrogenase activity of breast cancer stem cells is primarily due to isoform ALDH1A3 and its expression is predictive of metastasis. Stem Cells. 29 (1), 32-45 (2011).
- Lacerda, L., Pusztai, L., Woodward, W. A. The role of tumor initiating cells in drug resistance of breast cancer: Implications for future therapeutic approaches. Drug Resist Updat. 13 (4-5), 99-108 (2010).
- Liu, S., Wicha, M. S. Targeting breast cancer stem cells. Journal of Clinical Oncology. 28 (25), 4006-4012 (2010).
- D'Angelo, R. C., et al. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity. Molecular Cancer Therapeutics. 14 (3), 779-787 (2015).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Forozan, F., et al. Comparative genomic hybridization analysis of 38 breast cancer cell lines: a basis for interpreting complementary DNA microarray data. Cancer Research. 60 (16), 4519-4525 (2000).
- Lanier, L. L. Just the FACS. Journal of Immunology. 193 (5), 2043-2044 (2014).
- Ibrahim, S. F., van den Engh, G. Flow cytometry and cell sorting. Advances in Biochemical Engineering/Biotechnology. 106, 19-39 (2007).
- Shapiro, H. M. Flow Cytometry: The Glass Is Half Full. Methods in Molecular Biology. 1678, 1-10 (2018).
- Tsuji, K., et al. Effects of Different Cell-Detaching Methods on the Viability and Cell Surface Antigen Expression of Synovial Mesenchymal Stem Cells. Cell Transplantation. 26 (6), 1089-1102 (2017).
- Sun, C., et al. Immunomagnetic separation of tumor initiating cells by screening two surface markers. Scientific Reports. 7, 40632 (2017).
- Rodríguez, C. E., et al. Breast cancer stem cells are involved in Trastuzumab resistance through the HER2 modulation in 3D culture. Journal of Cellular Biochemistry. 119 (2), 1381-1391 (2018).
- Kim, D. W., Cho, J. Y. NQO1 is Required for β-Lapachone-Mediated Downregulation of Breast-Cancer Stem-Cell Activity. International Journal of Molecular Sciences. 19 (12), (2018).
- Xu, L. Z., et al. p62/SQSTM1 enhances breast cancer stem-like properties by stabilizing MYC mRNA. Oncogene. 36 (3), 304-317 (2017).
- Huang, X., et al. Breast cancer stem cell selectivity of synthetic nanomolar-active salinomycin analogs. BMC Cancer. 16, 145 (2016).
- Liu, T. J., et al. CD133+ cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer. Oncogene. 32 (5), 544-553 (2013).
- Ponti, D., et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Research. 65 (13), 5506-5511 (2005).
- Velasco-Velázquez, M. A., Popov, V. M., Lisanti, M. P., Pestell, R. G. The role of breast cancer stem cells in metastasis and therapeutic implications. American Journal of Pathology. 179 (1), 2-11 (2011).
- Palomeras, S., Ruiz-Martínez, S., Puig, T. Targeting Breast Cancer Stem Cells to Overcome Treatment Resistance. Molecules. 23 (9), (2018).
- McClements, L., et al. Targeting treatment-resistant breast cancer stem cells with FKBPL and its peptide derivative, AD-01, via the CD44 pathway. Clinical Cancer Research. 19 (14), 3881-3893 (2013).
- Berger, D. P., Henss, H., Winterhalter, B. R., Fiebig, H. H. The clonogenic assay with human tumor xenografts: evaluation, predictive value and application for drug screening. Annals of Oncology. 1 (5), 333-341 (1990).
- Tian, J., et al. Dasatinib sensitises triple negative breast cancer cells to chemotherapy by targeting breast cancer stem cells. British Journal of Cancer. 119 (12), 1495-1507 (2018).
- Samoszuk, M., Tan, J., Chorn, G. Clonogenic growth of human breast cancer cells co-cultured in direct contact with serum-activated fibroblasts. Breast Cancer Research. 7 (3), 274-283 (2005).
- Linnemann, J. R., et al. Quantification of regenerative potential in primary human mammary epithelial cells. Development. 142 (18), 3239-3251 (2015).
- Xu, Y., Hu, Y. D., Zhou, J., Zhang, M. H. Establishing a lung cancer stem cell culture using autologous intratumoral fibroblasts as feeder cells. Cell Biology International. 35 (5), 509-517 (2011).
- Palmieri, C., et al. Fibroblast growth factor 7, secreted by breast fibroblasts, is an interleukin-1beta-induced paracrine growth factor for human breast cells. Journal of Endocrinology. 177 (1), 65-81 (2003).
- Bourguignon, L. Y., Peyrollier, K., Xia, W., Gilad, E. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells. Journal of Biological Chemistry. 283 (25), 17635-17651 (2008).
- Yin, X., et al. Engineering Stem Cell Organoids. Cell Stem Cell. 18 (1), 25-38 (2016).
- Sachs, N., et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communications. 10 (1), 3991 (2019).
- Okano, M., et al. Orthotopic Implantation Achieves Better Engraftment and Faster Growth Than Subcutaneous Implantation in Breast Cancer Patient-Derived Xenografts. Journal of Mammary Gland Biology and Neoplasia. 25 (1), 27-36 (2020).
- Zhang, Y., et al. Establishment of a murine breast tumor model by subcutaneous or orthotopic implantation. Oncology Letters. 15 (5), 6233-6240 (2018).
- Zhang, W., et al. Comparative Study of Subcutaneous and Orthotopic Mouse Models of Prostate Cancer: Vascular Perfusion, Vasculature Density, Hypoxic Burden and BB2r-Targeting Efficacy. Scientific Reports. 9 (1), 11117 (2019).
- Kim, R., Emi, M., Tanabe, K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 121 (1), 1-14 (2007).
- Rosato, R. R., et al. Evaluation of anti-PD-1-based therapy against triple-negative breast cancer patient-derived xenograft tumors engrafted in humanized mouse models. Breast Cancer Research. 20 (1), 108 (2018).
- Choi, Y., et al. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice. Experimental and Molecular Medicine. 50 (8), 99 (2018).
- Meraz, I. M., et al. An Improved Patient-Derived Xenograft Humanized Mouse Model for Evaluation of Lung Cancer Immune Responses. Cancer Immunol Res. 7 (8), 1267-1279 (2019).
- Wege, A. K. Humanized Mouse Models for the Preclinical Assessment of Cancer Immunotherapy. Biodrugs. 32 (3), 245-266 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。